Психиатрия Психические расстройства в общей медицине
№04 2008
Психосоматические соотношения при нервной анорексии №04 2008
Введение
Достижения нейронаук последних десятилетий позволяют под новым углом зрения взглянуть на некоторые нерешенные проблемы нервной анорексии (НА). Как известно, этиология этого заболевания остается неустановленной. Попытки отстоять ее генетически детерминированную природу все еще не увенчались успехом. От эндокринной гипотезы происхождения НА отказались еще в первой половине прошлого столетия, когда удалось отграничить ее от болезни Симмондса (гипофизарная кахексия). Множественную соматоэндокринную патологию, занимающую столь значительное место в картине НА, большинство исследователей признают вторичной, обусловленной потерей массы тела. Нет достаточно обоснованных данных и для включения НА в рамки эндогенных болезней, в частности шизофренического или аффективного спектра, хотя формирование аноректического синдрома при этих заболеваниях не является редкостью. Так, G.Patton и соавт. считают, что риск развития НА у лиц, страдающих психической патологией, в том числе и шизофренией, в 7 раз выше, чем в населении [65]. В свою очередь, памятуя об эстрогенной теории шизофрении, можно предположить, что и НА, сопровождающаяся нарушением овариальной функции вследствие дефицита эстрогенов, является фактором, облегчающим развитие шизофренического процесса. Возможно, ближе других к истине находятся те, кто признает родство НА с обсессивно-фобическими нарушениями, расстройством личности или психосоматической патологией.
При всей нозологической неопределенности синдромальная самостоятельность НА общепризнана. Этот синдром относится к числу психопатологически наиболее устойчивых, сохранивших свою структуру, клиническое оформление и стереотип развития практически с момента его выделения на протяжении многих десятилетий. Клиническая картина НА в основных своих чертах и в настоящее время вполне может быть соотнесена с ее описаниями столетней давности, несмотря на некоторые изменения показателей болезни. Так, расширилась география НА, которая к настоящему времени диагностируется по всему миру и уже не считается (как это было несколько десятилетий тому назад) преимущественно культурально обусловленной [14, 46]. Наблюдается рост показателей распространенности НА и, в частности, относительное увеличение частоты ее встречаемости у мужчин. Произошло “омоложение” болезни. Практически все исследователи отмечают в последние годы пик заболеваемости НА в возрасте 12–14 лет и относят ее к детско-подростковой патологии [3, 4, 6, 16, 26, 32, 58, 70]. Проявлением патоморфоза болезни, видимо, является и нарастание в клинической картине НА доли булимической симптоматики, ее более раннее присоединение к рестриктивным расстройствам.
Однако нельзя умолчать о работе P.Hewitt и соавт. (2001 г.), описавших поздний вариант НА с началом во второй половине жизни, при котором, несмотря на тот факт, что соотношение мужчин и женщин остается по-прежнему в пользу последних, их доля становится значимо выше, чем в более молодом контингенте [39]. При выделении наряду с классической НА так называемой пресбианорексии (presbyanorexia nervosa) с поздним началом – после 50 лет, авторы рассматривают стрессогенные события, значимые для развития НА во второй половине жизни: утрата объекта любви, выход на пенсию, изменения жизненного уклада (можно полагать, в нежелательную сторону) и т.д. У пожилых эти воздействия оказались выраженными в большей степени, чем у молодых. Сама же клиническая картина НА практически идентична, за исключением аменореи, которая может быть обусловлена менопаузой. Механизм развития НА в позднем возрасте имеет существенный невротический компонент: утрата прежнего социального статуса, женской привлекательности, привычной ролевой функции лежит в основе стремления изменить свою внешность, “помолодеть” с целью самоутверждения и в надежде начать новую жизнь. Этот возраст, как и пубертатный, характеризуется гормональной перестройкой, только как бы в обратную сторону, с угасанием репродуктивной функции, т.е. также налицо нарушенный по сравнению с предшествующим периодом гормональный фон. Мы не располагаем данными об исходах поздней НА, за исключением указаний тех же авторов на более высокие показатели смертности вследствие НА среди этого контингента, неуклонно возрастающие с увеличением возраста.
Среди женщин показатели распространенности НА в зависимости от обследованных контингентов колеблются от 0,3 до 1%, а легкие, так называемые атипичные формы, не полностью отвечающие всем диагностическим критериям этого заболевания, достигают 10% и более. Следует иметь в виду, что приводимые в литературе данные условны в силу несовершенства диагностических критериев, включающих в себя не только психопатологические характеристики, но и соматоэндокринные показатели (практически не используемые при квалификации иных психических состояний, помимо нарушений пищевого поведения). Поскольку больные, имеющие индекс массы тела (ИМТ) 17,5 кг/м2 и более, как и больные с еще сохранной менструальной функцией, данному диагнозу не отвечают, к рубрике “Расстройства приема пищи” могут быть отнесены лишь развернутые стадии НА.
Зарубежные исследователи практически не рассматривают НА в контексте шизофренической патологии, в отечественной же психиатрии традиционно выделяют две возможности формирования синдрома НА: как пограничной патологии и как этапа в течении эндогенного заболевания. Сосуществование этих двух контингентов в любом исследовании накладывает отпечаток на особенности семейного отягощения, преморбидный личностный склад и клинико-динамические параметры болезни. В свете сказанного нам представилось целесообразным рассмотреть предпосылки развития НА вне рамок шизофренического процесса, ее клинические проявления и формирующиеся психосоматические корреляции.
Материалы и методы
Проанализированы все случаи НА, зарегистрированные в Подростковом медико-психолого-лечебно-реабилитационном центре при ГКПБ №15 г. Москвы (главный врач – канд. мед. наук Н.П.Герасимов) в период с 1991 по 2005 г. Обращаемость в официальное психиатрическое учреждение, даже не связанное с последующим наблюдением в психоневрологическом диспансере (ПНД), оказалось намного ниже показателей распространенности НА в населении. Мальчики, больные НА, в связи с их малочисленностью (единичные случаи) в последующий анализ не вошли. Многократное преобладание среди больных НА лиц женского пола (в соотношении от 15:1 до 6:1) общеизвестно, но причина этого явления не совсем понятна. Недавнее близнецовое исследование M.Proporcio и P.Marriot [68] позволило предположить, что во время беременности плодом женского пола продуцируется некоторая, возможно, гормональная субстанция (наиболее вероятный кандидат – половые стероидные гормоны), которая повышает риск развития НА.
После исключения больных с подозрением на текущий эндогенный процесс, а также недостаточно информативных случаев в анализируемой группе осталось 115 подростков. Поскольку больные НА крайне негативно относятся к контакту с психиатрами, оттягивая его до последнего момента, при первичном обращении большинство из них находились в уже развернутой стадии болезни, обнаруживая не только присущие этой патологии психопатологические расстройства, но и множественные соматоэндокринные последствия потери массы тела.
Длительность периода от начала НА до обращения к психиатру составляла от 7–9 мес до 3–4 лет (в среднем 1,9 года). Минимальная потеря массы тела ограничивалась 6–7 кг, а максимальная достигала 40 кг (средняя – 16,5±7 кг). Наиболее часто имела место потеря массы тела в пределах 10–20 кг. Самая низкая масса тела за время болезни зарегистрирована на уровне 24 кг, а самая высокая – 60 кг. ИМТ, определяемый отношением массы тела в кг к росту в м2 (показатель, наиболее широко используемый для суждения о массе тела и ее динамике), при презентации у большинства оказался ниже 17,5 кг/м2 (в среднем 15,3±2,3 кг/м2), а в отдельных случаях опускался до 10,2 кг/м2. Почти у 2/3 подростков НА протекала по рестриктивному варианту и менее чем у 1/3 – с присоединением булимических эпизодов. Такое соотношение вполне ожидаемо и согласуется с мнением многих исследователей о появлении булимических расстройств на более поздних этапах НА [4, 24, 31, 47].
Семейное отягощение, особенности ранней патологии и перенесенных заболеваний. Обращало на себя внимание в целом невысокое отягощение психической патологией (преимущественно пограничные расстройства и алкоголизм). Верифицированные случаи НА в первой линии родства наблюдали лишь у 5 больных, а острые психозы – у 8. Что же касается суицидов (не являющихся редкостью у больных НА), среди родственников они были единичны и выявлялись в отдаленном родстве. В целом в структуре семейного отягощения не прослеживалось каких-либо нозологически специфических особенностей, что мало согласуется с представлениями о НА как наследственно-конституционально обусловленной патологии или заболевании эндогенного спектра, при котором картина семейного отягощения несколько иная. C.Bulik и соавт. [26], основываясь на близнецовых исследованиях, пишут о НА как об “умеренно наследуемом” психическом расстройстве, к развитию которого может предрасполагать наличие “раннего невротизма”, допуская при этом, что “невротизм” является неспецифическим предиктором развития психической патологии вообще.
В последние годы оживился интерес к роли перинатальных факторов в формировании расстройств пищевого поведения. К числу наиболее значимых независимых предикторов развития НА относят патологию во время беременности у матери: анемию, диабет, преэклампсию, отслойку плаценты, а также неонатальные проблемы у ребенка (кардиальные нарушения, гипореактивность). Риск развития НА увеличивается пропорционально массивности акушерских осложнений – повышение числа последних значимо снижает возраст, в котором начинается НА [13, 28, 30].
В обследованном нами контингенте пренатальные и перинатальные вредности были выявлены более чем у половины больных. Их перечень отражает весь спектр такого рода патологии, наблюдаемой в населении, и не имеет явных предпочтений. Хорошее умственное развитие больных в последующем, их академическая успешность и жизненная активность не позволяли говорить о наличии у большинства из них какого-либо резидуально-органического фона, предрасполагающего к развитию НА. В структуре перенесенных в детстве заболеваний на долю патологии со стороны желудочно-кишечного тракта, которую принято считать облегчающей формирование расстройств приема пищи (гастродуодениты, хронический гастрит, гепатит, диспепсия, дисбактериоз, дизентерия), приходилось не более 10%. В единичных случаях в раннем анамнезе выявлялись хронический пиелонефрит, ферментопатия, желудочно-кишечный рефлюкс.
Частота оперативных вмешательств не отличалась от популяционной, но у 7 больных они проводились под общим наркозом, негативно влияющим на структуры головного мозга. В том же контексте могут быть рассмотрены перенесенные инфекционные болезни, обладающие нейротоксическим действием. Более половины подростков в дошкольном возрасте переболели ветряной оспой, более 1/3 – корью и коревой краснухой, 10% – скарлатиной. На долю других инфекций (инфекционный паротит, коклюш, инфекционный мононуклеоз) в общей сложности приходилось не более 10%. Около 1/3 подростков в детстве были подвержены простудам и острым респираторным вирусным инфекциям, за давностью этих состояний невозможно уточнить, какая доля из них приходилась на грипп и гриппоподобные инфекции. Таким образом, большинство обследованных подростков, заболевших в последующем НА, перенесли в раннем возрасте инфекции с потенциальным нейротропным эффектом.
Заслуживают внимания показатели массы тела включенных в исследование больных. При рождении они, как правило, не были отклонены от нормы (лишь у 2 больных масса тела превышала 4 кг, а еще у 1 была меньше 2,5 кг). Однако ко времени начала НА более чем у половины подростков масса тела превышала нормативную для их возраста и роста. Такую ситуацию традиционно пытаются объяснить особенностями пищевых пристрастий в родительской семье. Однако данные последних лет об эндокринной функции жировой ткани и роли в организме ее основного гормона лептина [19] не позволяют исключить в этих случаях врожденные или рано приобретенные вследствие воздействия нейротоксических факторов отклонения в лептиновой системе, облегчающие возникновение соматоэндокринной дисфункции и отклонений в соотношении насыщение/голод у больных НА.
Лептин принадлежит к числу недавно открытых гормонов жировой ткани, на примере которого можно продемонстрировать всю сложность нейрогормональных соотношений при НА. По мнению большинства исследователей, лептин причинно не связан с НА, но играет важную роль в развитии нейроэндокринной дисфункции при этом заболевании [35]. У больных НА уровень лептина в сыворотке крови (чаще всего определяемый радиоиммунным методом) снижен и напрямую коррелирует с потерей массы тела. При этом показатели лептина в большей степени соотносятся с редукцией жировой ткани, чем со снижением ИМТ.
Лептин не только “информирует” головной мозг об энергетических запасах в жировых депо, но и участвует в различных физиологических процессах в организме человека [сошлемся на соответствующие публикации и обзоры: 8, 10, 36, 38, 50, 54]. У здоровых женщин уровень лептина в сыворотке крови колеблется от 19,1 до 8,1 мг/мл. У больных НА содержание лептина снижается до 5,6±3,7 мг/мл и ниже. Падение лептина, вызванное ограничением калорий и последующей потерей жировой массы, влечет за собой выключение гипоталамо-питуитарной оси и наступление аменореи. Падение лептина ниже критического уровня (пороговый диапазон) приводит к редукции секреции гипоталамического гонатропин-рилизинг-гормона и фолликулостимулирующего гормона, секретируемого гипофизом, а затем к сокращению овариальной продукции эстрогенов. К пороговым относят уровни лептина в сыворотке крови 1,85–2 мг/мл. У женщин в менопаузе он также снижается до 2–3 мг/мл. У преморбидно худых женщин, больных НА, может наблюдаться падение концентрации циркулирующего лептина, опережающее уменьшение массы тела и уже способное вызывать аменорею.
Лептин способствует субъективному ощущению сытости, подавляя экспрессию нейропептида Y и других гормонов и понижая потребление пищи. У больных с ожирением предполагается наличие лептиновой резистентности, при которой, несмотря на высокое содержание лептина в крови, его действие снижено. Абсолютно гипотетически можно соотнести повышенную преморбидную массу тела больных с нарушением чувствительности к лептину. У девочек при рождении и в пубертате, а затем и в последующих возрастах уровень лептина значительно выше, чем у лиц мужского пола. Но инициация пубертатного сдвига имеет место лишь при достижении определенной массы тела, что позволило некоторым исследователям выдвинуть предположение о вероятной резистентности к лептину у девочек, благодаря которой начало пубертата откладывается до момента достижения нужной массы тела и, соответственно, энергетического запаса в организме. Отсюда понятно, что любые сбои в лептиновой системе могут опосредованно или напрямую влиять на другие гормональные оси, отвечающие за формирование репродуктивной функции и обменные процессы в организме.
Среди факторов, предрасполагающих к развитию НА, важное место отводится структуре личности больных. В исследованиях по проблеме НА наиболее часто указывают на перфекционизм, стремление к совершенству [18, 25, 37, 52]. K.Halmi и соавт. [37] не только считают перфекционизм характерным личностным свойством больных НА, но и видят в нем одно из проявлений, составляющих совокупность фенотипических признаков, связанных с генетической предрасположенностью к НА. Т.Nagata и соавт. [59] на основе изучения японской популяционной выборки пришли к выводу, что темперамент и черты характера у больных рестриктивным типом НА одинаковы даже в культурах, существенно отличающихся от западной, и отмечают в качестве типичных личностных особенностей ригидность, стоицизм и сдержанность. Отечественные психиатры также склонны рассматривать высокий уровень притязаний, свойственный больным НА и их родственникам, как один из ведущих этиопатогенетических механизмов НА [5].
У больных НА и их незаболевших сестер J.Holliday и соавт. [41], C.Bulik и соавт. [26] при исследовании исполнительских функций выявили трудности выполнения тестов, связанных с быстрой сменой заданий, необходимостью переключения от одного к другому, и отнесли эту особенность нейропсихологической функции, ассоциирующуюся с чертами ригидности, к эндофенотипу, характерному для НА. Таким образом, сниженная когнитивная и перцептуальная гибкость как семейная черта соотносится с большим риском развития НА, чем ее последствия или картина болезни. Выявленные паттерны нейропсихологического функционирования могут представлять собой биологический маркер или врожденный эндофенотип при НА. Одно из возможных объяснений – стойкие отклонения серотониновой системы, наблюдаемые при НА, включая повышенный уровень 5-НТ2А-метаболитов серотонина в мозговом кровотоке и изменения в связывании 5-НТ2А-рецепторов [21, 32, 45]. W.Kaye и соавт. [45] допускают, что высокий уровень серотониновой активности в головном мозге, определяемый у больных НА, ведет к симптомам тревоги, которые облегчаются диетой, снижающей продукцию серотонина.
У изученных нами больных наиболее выраженными и часто встречающимися в преморбиде чертами характера оказались именно перфекционизм, настойчивость в достижении цели, стремление к усовершенствованию, активность (более 2/3 больных). Малая общительность, чрезмерная тревожность, повышенная ранимость наблюдались значительно реже, но и этим подросткам были присущи такие качества, как исполнительность, пунктуальность, упорство в достижении высоких результатов в учебе. Подавляющее большинство больных обнаруживали хорошие интеллектуальные способности. Явный шизоидный радикал редко определял преморбидный склад личности, в лучшем случае речь шла о легкой шизоидной акцентуации. При этом чем более выраженными оказывались шизоидные свойства (особенно в присутствии аксессорной психопатологической симптоматики или неспособности адекватно приспосабливаться в коллективе), тем больше подозрений возникало в отношении подспудной динамики эндогенного (шизофренического) процесса.
В широкий круг факторов, предрасполагающих или провоцирующих развитие НА, традиционно включают культурально-средовые, семейные и разнообразные стрессорные воздействия. Любопытные данные интервьюирования больных НА спустя 8 и 10 лет после их первичного обращения в детско-подростковом возрасте опубликовали K.Nillson и соавт. [62]. Отвечая на вопрос: “Что вы думаете о причинах, приведших вас к заболеванию НА?”, больные наиболее часто указывали собственные амбициозные требования и перфекционизм, неудовлетворенность собственным телом и состоянием питания, низкую самооценку; а затем (уже в 2 раза реже) – трудности в семейном взаимодействии, стрессорные события и еще реже – социокультуральные проблемы и отношения со сверстниками, плохую ситуацию в школе, переезд, необходимость коррекции фигуры в спортивных целях.
Начальные этапы болезни. Во всех исследованных нами случаях подростки жили в крупных городах, нередко в преуспевающих и материально благополучных семьях и с раннего возраста были осведомлены о современных канонах “идеальной” фигуры. Благодаря широкому освещению в средствах массовой информации гламурного образа жизни “звезд” эстрады и кино, фотомоделей и других VIP-персон у будущих больных НА очень рано “шикарная” жизнь начинала ассоциироваться именно с определенными культивируемыми в социуме стандартами внешности. Значительная часть девочек так или иначе оказывалась вовлеченной в публичные виды деятельности, требующие стройности фигуры (танцы, эстетические виды спорта, верховая езда и др.).
Вначале у подростков формировалось сверхценное отношение к своей внешности со стремлением добиться подобной известным женщинам или более преуспевающим родственницам изящной комплекции, но не просто в подражание, а с тем чтобы в последующем использовать улучшенные внешние данные для достижения социального и карьерного благополучия. Некоторые подростки были убеждены, что у обладательниц стройной фигуры совсем другая, “лучшая” жизнь и большие перспективы, и этим мотивировали свое стремление к худобе. Нередко стремление похудеть, стать стройной преследовало цель достичь особого положения в среде сверстников, поразить их своей силой воли и, таким образом, завоевать желаемый авторитет, которого подростки не могли добиться другим способом. Некоторые подростки, худея, надеялись вернуть себе расположение и внимание отвернувшегося от них молодого человека, стать привлекательнее соперницы. Даже когда подростки начинали ограничивать себя в еде заодно с членами семьи, они считали, что уменьшение массы тела принесет им определенные преимущества. Однако такие мотивы нарушенного пищевого поведения тщательно скрывались от окружающих.
Зачастую подростки усматривали в мнимых недостатках фигуры препятствие к удовлетворению своих амбиций. И.Ю.Борисов [2] пишет об “операциональном кризисе”, переживании фрустрации, когда подросток не может удовлетворить свои важнейшие потребности в самоутверждении и общении и пытается устранить препятствие, изменив собственное тело. Формирующийся психологический внутриличностный конфликт между личной пищевой потребностью и комплексом потребностей, питающих стремление похудеть, приобретает затяжной невротический характер. Преодолеть его удается лишь спустя многие годы за счет постепенного развития “взрослых” потребностей и интересов (учебных, профессиональных, семейных).
Именно благодаря своим преморбидным особенностям больные НА оказывались последовательными, упорными и несгибаемыми в достижении желаемой худобы. Воздержание от приема пищи, по-видимому, облегчается и рядом других факторов. Так, R.Wojciak и соавт. [74] обнаружили у молодых женщин, больных НА, быстрое снижение некоторых микронутриентов во время голодания, в частности содержания цинка, играющего важную роль в синтезе таких протеинов, как нейрогормоны, а низкий уровень этого элемента может усилить недостаточность аппетита. Не случайно некоторые исследователи, в том числе М.Растам [11], считают, что включение в нутриционную терапию препаратов цинка способствует более быстрому возврату массы тела у больных НА. Фиксация на своей внешности и ее несоответствии идеалу через какое-то время осложнялось убежденностью в ущербности своей фигуры, искажением восприятия “образа тела”, т.е нарушением самовосприятия. В западной литературе этому феномену, известному под названием “телесное дисморфическое расстройство” (body dismorphic disorder), придают большое значение как в плане оценки тяжести состояния больного, так и его исхода, отмечая его устойчивость и малую податливость терапии [63, 66, 69].
О.А.Скугаревский [12] на основании скрининговых исследований указывает, что от 30 до 70% лиц в населении стремятся к снижению массы тела (сходные показатели приводят и другие исследователи), при нормальной массе тела у большей части из них. Высокую распространенность в среде девушек установок на похудание и достижение “идеальной” формы тела автор, в подтверждение вышесказанному, предположительно также связывает с психологическими характеристиками, в частности с искажениями в когнитивной оценке массы тела как составной части образа собственного тела.
С момента утраты реального восприятия своей внешности больные испытывают постоянный страх поправиться. Достигающая степени одержимости идея похудания начинает занимать лидирующее место в сознании и структуре жизненных ценностей, хотя еще долгие месяцы вплоть до появления выраженной астении вследствие физического истощения больные способны поддерживать некоторые другие привычные виды активности. Практически никогда одержимость похудением у больных НА не сопровождается попытками вовлечь в этот процесс окружающих, найти сторонников, как это бывает у здоровых людей, стремящихся уменьшить массу тела.
Больные НА быстро утрачивают критические способности, вследствие чего не могут адекватно оценивать реально складывающуюся ситуацию, антивитальный характер своего поведения и возможность летального исхода. При этом они не осознают катастрофические последствия болезни и тот урон, который она наносит их последующей жизни. Формируется анозогнозическое отношение к болезни [7].
Снижение критики и выявляемые при психологическом тестировании отклонения со стороны когнитивной деятельности становятся понятными в свете данных компьютерно-томографических (КТ) исследований головного мозга больных НА, которые были получены уже какое-то время тому назад и оказались легко воспроизводимыми во многих более поздних работах. Речь идет о так называемой псевдоатрофии белого и серого вещества головного мозга, которая большинством исследователей расценивается как следствие длительного голодания [11, 72]. Сопровождающиеся вторичным расширением и визуализацией в норме невидимых борозд, а также расширением желудочков и цистерн мозга, эти изменения при рутинном КТ-исследовании создают впечатление гидроцефалии и клинически в повседневной практике обычно трактуются как проявления ранней резидуально-мозговой недостаточности, что искажает причинно-следственные отношения.
Увеличение внутренних и наружных внутримозговых пространств и расширение мозговых борозд наиболее выражено у тяжело и длительно болеющих. Тем не менее сходные изменения некоторые исследователи находят уже при презентации, правда, последняя имеет место в большинстве случаев в продвинутых стадиях НА (спустя месяцы и годы после ее начала), когда налицо значительная потеря массы тела и соматоэндокринные нарушения. Так, I.Cvitanovic-Sojat и соавт. [29] выявили при ЭЭГ-исследовании 52 девочек с НА (средний возраст 15,5 года) в первую неделю после поступления в клинику снижение вольтажа в 74% случаев, а при КТ-сканировании – признаки атрофии головного мозга в 76%. После восстановления массы тела у большинства больных указанные изменения оказались обратимыми. Признаки атрофии обнаруживаются как в коре головного мозга, так и в мозжечке. При отсутствии раннего терапевтического вмешательства возможен переход функциональных изменений в морфологические.
М.Husain и соавт. [цит. по 72] нашли, что размеры гипоталамуса и среднего мозга у больных НА изначально меньше, чем у здоровых, или же они недостаточно развиты, что может играть причинную роль в развитии НА. Позднее МРТ-исследования гипофиза выявили уменьшение его размеров или недостаточное его увеличение в сравнении с ожидаемой для пубертатной нормы гипертрофией. Вне зависимости от того, первично или вторично уменьшение гипофиза у больных НА, эта находка представляется важной для понимания механизма возникновения гипоталамо-гипофизарной дисфункции, наблюдаемой при НА. Изменения в объеме белого вещества мозга по мере восстановления массы тела исчезают, а значительный дефицит серого вещества и расширение церебральных пространств с внутримозговой жидкостью остаются выраженными в сравнении со здоровыми сверстниками. Указанные отклонения соотносятся с худшим выполнением некоторых тестов [41, 64], как и со снижением визуально-пространственных способностей, памяти и внимания, успешностью выполнения теста на общий интеллект.
Хроническое голодание и потеря массы тела значительно нарушают метаболические процессы в головном мозге, чаще всего это носит обратимый характер. Однако снижение связывания рецепторов 5–НТ2А, остающееся у больных НА после восстановления массы тела и при отсутствии голодания, предполагает, что нарушение серотонинергической трансмиссии может быть фундаментальным проявлением патофизиологии НА.
Функциональные исследования выявляют у больных НА также снижение мозгового кровотока с усилением разницы сторон. S.Boettger и соавт. [20] представили данные о снижении порога болевой чувствительности у больных НА, которое, по их мнению, в значительной степени объясняются повышением тонуса парасимпатической нервной системы. J.Nandrino и соавт. установили, что эмоциональные расстройства при НА выражаются в нарушении автобиографического воспоминания [60]. Такие больные характеризуются трудностями интеграции как негативного, так и позитивного эмоционального опыта, испытывают затруднения при идентификации и описании своих эмоций [15]. Указанные морфологические и функциональные изменения в головном мозге с учетом их неполной обратимости могут приводить к изменению личности больных с заострением прежних и появлением новых качеств, нарушением критических способностей, некоторым оскудением. Этот “мягкий когнитивный дефицит” [9] создает у клинициста впечатление формирующегося дефекта и в отсутствие четких дифференциально-диагностических критериев служит поводом для необоснованной его оценки как шизофренического.
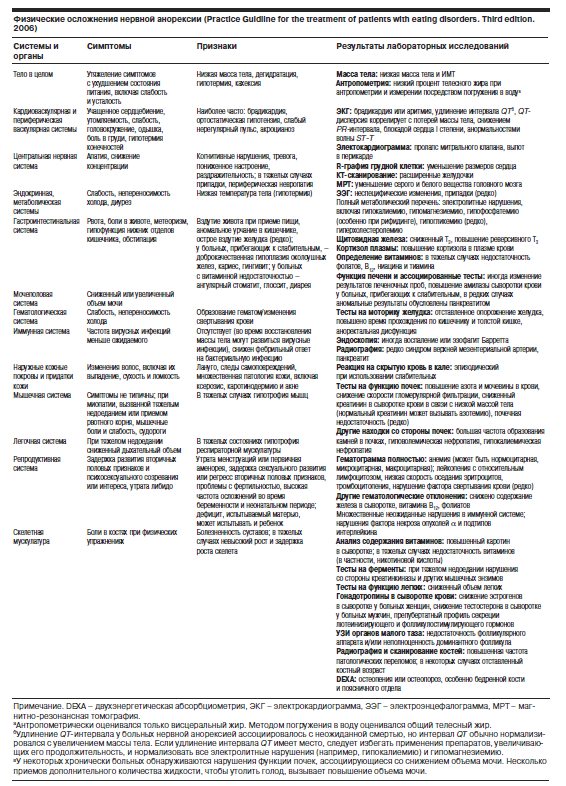
Развернутые стадии болезни. При потере массы тела значительное похудание ведет к тяжелым отклонениям в функции практически всех органов и систем (см. таблицу, приведенную в 3-м издании американского “Практического руководства по лечению больных с расстройствами приема пищи”, 2006). Считается, что у больных подросткового возраста они не столь катастрофичны и даже при резком уменьшение массы тела могут ограничиваться минимальными [14]. Хотя у подростков вероятность выздоровления при раннем начале терапии более высока, чем у взрослых (исключение составляют больные с манифестацией НА в допубертатном периоде, когда болезнь протекает особенно тяжело), осложнения этого заболевания, как краткосрочные, так и долговременные, могут быть угрожающими для жизни. В острой стадии НА нередкой причиной смерти является остановка сердца, вызванная электролитным дисбалансом и нарушениями сердечной проводимости. Чревата опасностями и нутриционная терапия в связи с возможностью развития рифидинг-синдрома (англ. refeeding – возобновление кормления). Все это диктует необходимость строгого наблюдения за больными НА, регулярного мониторинга функции внутренних органов, комплексного лечения, которое должно включать восстановление питания, психосоциальные вмешательства и медикацию.
В отечественной психиатрии более или менее последовательная помощь оказывается больным НА только в психиатрических стационарах. После выписки лишь единицы из их числа обращаются в ПНД, другие же учреждения, адаптированные к длительному амбулаторному ведению больных НА, в России практически отсутствуют. Почти у 50% больных, восстановивших свою массу тела, в ближайший год отмечаются рецидивы [67].
Более четверти века назад была доказана зависимость динамики соматоэндокринных нарушений при НА от особенностей соматоэндокринного состояния больных до ее начала, а также наличие корреляций между соматоэндокринной и психической патологией в ходе течения болезни [1]. При этом основной соматоэндокринной характеристикой у больных НА наряду с массой тела считается менструальная функция.
Нарушения репродуктивной функции. В зарубежных работах этот аспект всегда занимал важное место, поскольку прекращение менструаций не только говорит о нарушении репродуктивной функции и дефиците эстрогенов, но и о серьезных отклонениях во всех основных гормональных системах. Почти у всех обследованных нами больных отмечена вторичная и лишь в единичных случаях – первичная аменорея. Как известно, наступление менархе возможно лишь при достижении так называемого весового порога, который размещается в интервале 47–48 кг. Необходимо также, чтобы не менее 17% массы тела приходилось на долю жировой ткани, преимущественно представленной подкожной жировой клетчаткой, которая у больных НА при голодании редуцируется в первую очередь. Считается, что прекращение менструальной функции наступает при падении массы тела на 15% и более от нормативного. При изначально невысокой массе тела к аменорее может привести и незначительное ее уменьшение (в пределах нескольких килограммов). При этом играют роль не только абсолютные показатели потери массы тела, но скорость.
Приводимый в разных исследованиях ИМТ больных в острой стадии НА составляет 11–17 кг/м2. Падение ИМТ<13 кг/м2 соотносится с опасностью для жизни больного. В отдельных работах фигурируют и более низкие показатели ИМТ, что говорит о возможности индивидуальных отклонений. В обследованном нами подростковом контингенте абсолютная масса тела к моменту прекращения менструаций колебалась в широком диапазоне, от 28 до 65 кг (в среднем 47,4±5,5 кг), а ИМТ – от 12,6 до 23,3 кг/м2 (в среднем 17,3±1,7 кг/м2). На пике похудения при минимальной массе тела больных ИМТ понижался в среднем до 14,8 кг/м2.
При НА эндокринные и метаболические изменения отражают (как следствие потери массы тела) выраженную гипоталамическую дисфункцию и потенциально обратимы. НА характеризуется множественными отклонениями со стороны нейропептидов и нейротрансмиттеров, таких как гонадотропин-рилизинг-гормон, лептин, грелин, b-эндорфины, серотонин и дофамин. Изменения их концентраций в крови и спинно-мозговой жидкости находятся в сложной взаимозависимости и, кроме того, частично определяются нарушениями суточной ритмики, объемом и составом потребляемой пищи, приемом различных фармакологических агентов и многими другими факторами.
У подростков, больных НА, после прекращения менструаций прогрессируют уменьшение массы тела и проявления нейроэндокринной дисфункции. Если же НА начинается в препубертатном возрасте, она обусловливает отставленное наступление пубертата и менархе, более низкий рост в сравнении с нормативным для этого возраста. В некоторых случаях недоразвитие матки и придатков приводят к тому, что репродуктивная функция так и остается несформированной.
Не менее тяжелым и не полностью обратимым последствием НА является остеопения/остеопороз [14, 16, 58]. По данным некоторых авторов, снижение минеральной плотности кости (МПК) выявляется у 50% больных НА (как мужчин, так и женщин) уже при первом обращении. Остеопорозу особенно подвержены подростки, поскольку НА нарушает формирование МПК, пик которого приходится именно на пубертатный возраст. Причиной остеопороза при НА (по аналогии с тем, что происходит у женщин в менопаузе) принято считать длительный дефицит эстрогенов с диспропорциональным преобладанием резорбции кости над ее формированием, недостаточность витаминов и микроэлементов, гиперкортизолемию, также повышающую резорбцию кости, и прямое угнетающее действие пониженного питания на образование кости и остеобластическую функцию. Гиполептинемия в свою очередь оказывает негативный эффект на МПК посредством включения в гипоталамо-питуитарно-адреналовую ось. И хотя воздействие лептина на костный метаболизм не до конца понятен, наличие у этого гормона выраженного остеогенного эффекта не подвергается сомнению (лептиновые рецепторы были обнаружены в первичных остеобластах).
Согласно В.Biller и соавт. [17] у женщин со средней продолжительностью НА 5,8 года показатель частоты клинических переломов в 7 раз выше, чем в сопоставимой выборке здоровых. E.Brooks и соавт. [22] обнаружили дефицит МПК у 85% выздоровевших от НА женщин с восстановившимся менструальным циклом спустя 11 лет после постановки диагноза. Можно полагать, что повышенный риск костных переломов сопровождает больных НА на протяжении всей жизни.
Об отдаленных неблагоприятных последствиях свидетельствуют и повышенные показатели смертности при НА. H.Caci и соавт. [27] пишут о 5,6% ежегодной смертности среди больных НА, что в 12 раз превышает таковую у женщин 15–24 лет в населении. Показатели смертности при НА наряду с токсико- и наркоманиями остаются самыми высокими в кругу всей психической патологии (достигая 20%), и лишь при хорошо налаженной системе терапевтической и реабилитационной помощи этим больным в отдельных странах в последние годы удалось добиться положительных сдвигов [40, 53]. Меньшая продолжительность жизни обусловлена не только частотой суицидов (более 15% женщин больных НА сообщают об имевшихся у них за период болезни суицидальных мыслях) [33] или тяжестью кахексии в острой стадии болезни. Индивидуумы с НА в анамнезе, уже миновавшие активную стадию болезни, могут иметь повышенный уровень смертности в связи с коморбидными состояниями, даже когда непосредственно проблемы питания перестают отражаться на их долговечности [33]. Последствия негативного влияния НА на состояние различных органов и систем также поддерживают повышенные показатели смертности от прочих соматических причин среди больных НА спустя годы после излечения в сравнении со здоровыми сверстниками [44]. Учитывая тяжесть как кратковременных, так и протрагированных неблагоприятных последствий НА, оказание своевременной и адекватной помощи таким больным на ранних этапах до наступления необратимых морфологических изменений представляется жизненно важным.
Обязательным условием выздоровления считается восстановление массы тела и нормализация гормональной функции [34]. Повышение уровня лептина в сыворотке крови вследствие набора массы тела сопровождается ростом концентраций лютеинизирующего и фолликулостимулирующего гормонов, что подтверждает участие лептина в активации гипоталамо-питуитарно-гонадной оси и регуляции репродуктивной функции [57]. Однако, поскольку возврат массы тела не у всех больных ведет к восстановлению менструальной функции даже при сопоставимых уровнях лептина у больных НА женщин с аменореей и без нее, очевидно, что возобновление репродуктивной функции требует нормализации и других эндокринных осей, в частности, включающих инсулиноподобный фактор роста.
Если в остром периоде НА уровень лептина низок и соотносится с потерей массы тела, то в стадии набора массы тела строгие корреляции между уровнем лептина, ИМТ и процентным содержанием жировой ткани нарушаются. Лептин вырабатывается преимущественно подкожной жировой клетчаткой, в то время как нормализация массы тела у больных НА ассоциируется с аномальным перераспределением жировых запасов с предпочтительным их накоплением в висцеральных депо [55]. При возврате массы тела у больных НА масса подкожного жира становится меньше, а висцерального больше, чем у здоровых женщин, что может создавать повышенный риск развития метаболического синдрома и кардиоваскулярной патологии.
Важную роль жировой ткани в поддержании репродуктивной функции можно видеть и на примере здоровых женщин, профессионально занимающихся атлетическими видами спорта, у которых синдром аменореи – нередкое явление, входящее в так называемую атлетическую триаду. У этих женщин нормальная масса тела поддерживается за счет мышечной ткани при недостаточности подкожной жировой клетчатки и, соответственно, сниженном уровне лептина, что и приводит к прекращению менструальной функции. По такому же механизму аменорея может развиваться и у придерживающихся жесткой диеты худощавых женщин при незначительной потере массы тела (2–3 кг) за счет уменьшения жировой ткани.
Бесплодие вследствие дефицита лептина разной этиологии отчасти отражает нарушение его непосредственного влияния на репродуктивные процессы или неспособность гонадотропинов стимулировать их в отсутствие лептина и его рецепторов. Лептин влияет на продукцию эстрадиола и вмешивается в процесс развития доминантного фолликула и созревания яйцеклетки. У больных НА даже при наличии циклических кровотечений возможность забеременеть снижена. При низких концентрациях лептина нарушаются поминутные колебания в пульсации гонадотропинов, уровни эстрадиола и лютеинизирующего и фолликулостимулирующего гормонов, снижается продукция эстрогенов яичниками. Половозрастной тип секреции лютеинизирующего гормона регистрируется у больных с массой тела не менее 80% нормативной. Аменорея при НА имеет адаптивное значение, предохраняя организм женщины в условиях физического истощения от требующей повышенных энергетических затрат беременности.
Лептин уменьшает энергетические расходы организма, влияя на терморегуляцию путем подавления тиреоидной функции, в частности за счет снижения образования тиреотропин-рилизинг-гормона. У больных НА могут наблюдаться клинические проявления гипотиреоза, в том числе эпизоды неукротимого голода, купирующиеся потреблением чрезмерных объемов пищи в силу нарушения формирования чувства сытости, и довольно характерные как для больных гипотиреозом, так и для отклонений в гормональной функции поджелудочной железы. Поэтому вряд ли обоснованно объяснять присоединение булимической симптоматики при НА исключительно динамикой психического заболевания, не принимая во внимание возможность патогенетического участия в этом процессе вторичных эндокринных нарушений, которые с определенных стадий болезни могут выступать в качестве самостоятельных механизмов, участвующих в видоизменении ее проявлений. Не случайно булимические расстройства присоединяются позднее, в период значительной выраженности соматоэндокринной патологии, и крайне редко выявляются в дебюте НА.
Однозначное отнесение булимических эпизодов с последующими мероприятиями по очищению организма (вызывание рвоты) к проявлениям патологии влечений также представляется несколько упрощенным. Действительно, рвота, освобождающая больную от съеденной пищи и тягостных ощущений в желудке при его чрезмерном переполнении ставшими непривычными объемами пищи, приносит ей не только физическое, но и психологическое облегчение, уменьшая чувство страха перед увеличением массы тела. И хотя переедание носит компульсивный характер, вряд ли больные НА (по крайней мере формирующейся вне рамок патологии шизофренического спектра) прибегают к нему специально, чтобы потом испытать удовольствие от рвоты. Осложнение фобического синдрома патологией влечений у больных НА со сниженными влечениями и редуцированными основными инстинктами по меньшей мере проблематично, поскольку наступление булимического этапа должно было бы в таком случае отражать прогредиентную динамику заболевания, но именно с этой стадии у больных нередко появляются элементы критического осмысления своего состояния с осознанием невозможности самостоятельно прервать патологический цикл переедания/очищения, что зачастую сопровождается возникновением вторичных депрессивных расстройств и суицидальных тенденций. Таким образом, булимическое поведение, феноменологически трудно определяемое, приходится дифференцировать с патологическим привычным поведенческим стереотипом, сформировавшимся у больных с навязчивым страхом поправиться и одержимых идеей коррекции фигуры на фоне присоединившейся соматоэндокринной патологии с нарушением соотношения чувства сытости/голода.
Выраженная тиреоидная недостаточность, сопровождающаяся муковисцидозом, может также наряду с нарушениями электролитного баланса отчасти обусловливать повышенную отечность больных НА в продвинутых стадиях болезни.
Процесс выздоровления. Считается, что стабилизация психического состояния коррелирует с улучшением соматоэндокринного статуса и следует за моментом восстановления менструальной функции [1, 6]. Активная стадия болезни в случаях, заканчивающихся выздоровлением, длится несколько лет. A.Keski-Rahkonen и соавт. [49] указывают 5-летний период, M.Lamoureux и J.Bottorff [51] – 7–10 лет. За это время больные переносят несколько рецидивов с повторной потерей и восстановлением массы тела и как следствие нарушением обменных процессов, ухудшением состояния общего физического здоровья. Остается дискутабельным, какие именно параметры прогностически значимы, хотя чаще всего пишут о плохом прогнозе при низкой массе жировой ткани [56], но существует мнение и о недостаточной информативности показателей динамики массы тела.
Создается впечатление, что излишний набор массы тела чаще имеют больные, подвергшиеся слишком интенсивной нутриционной реабилитации в сочетании с активным лечением психотропными препаратами. Еще С.Г.Жислин на заре психофармакотерапевтической эры писал о нестабильности психического состояния больных с тенденцией к учащению рецидивов как возможного проявления лекарственного патоморфоза. Период восстановления у больных НА, по-видимому, должен занимать несколько месяцев, при этом следует избегать любых методов терапии, приводящих к висцеральному ожирению или увеличению тощей массы тела, так как последние не играют решающей роли в достижении полного выздоровления (психического, репродуктивного и общесоматического).
Выздоровление при НА может наступить и в случаях значительной продолжительности болезни. В исследованиях с длительным катамнестическим прослеживанием представляет интерес анализ факторов, влияющих на этот процесс. Karin Nilsson и Bruno Hagglof [61] в 2006 г. проинтервьюировали 68 больных НА в среднем 10 лет спустя после их первичного обращения в психиатрическую клинику. Выздоровевшие женщины (58 человек) смогли четко указать поворотные моменты, с которых началось их выздоровление. Наиболее часто ими послужили неожиданные комментарии или события, приводившие к осознанию того, что дальнейшее голодание чревато смертельным исходом. Болезнь или смерть друга могли пробудить у больной желание жить. В других случаях неприятные телесные сенсации (слабость, тяжесть в желудке, нарушения сердцебиения), отечность ног вызывали испуг и заставляли больных переосмыслить свою ситуацию. Положительному сдвигу у 18% больных способствовала перемена места жительства, а еще у 14% – учебного заведения или же поступление в высшую школу. Также полезным оказалось вовлечение в новые формы активности: приобретение домашних любимцев, путешествия, увлечение танцами, сочинительством, рисованием или ваянием. В числе лиц, повлиявших на принятие решения прекратить голодание, прежде всего указывались друзья, бойфренды. Так, например, неожиданное замечание, сделанное девочке отцом ее бойфренда по поводу неправильного отношения к питанию, произвело на нее сильное впечатление и заставило отказаться от голодания. Благотворно сказывалась и поддержка друзей (у 45% больных), которые демонстрировали больным пример альтернативного стиля жизни. У больных происходила переориентация жизненных ценностей с восприятием себя как активного действующего лица. Именно формирование собственной активной позиции 62% больных считали важным фактором для произошедшего выздоровления. Причем более активную позицию обнаруживали больные с большей продолжительностью процесса выздоровления (более 10 лет).
Исследованные M.Lamoureux и J.Bottorff [51] женщины, выздоровевшие от НА, объясняли, что в период болезни они испытывали тягостное отсутствие ощущения того, кто они есть (sense of no sense who they were), и выздоровление описывали как процесс обретения себя настоящей (becomes the real me). Этот процесс включал в себя: осознание привносимой болезнью опасности, очень постепенное отделение себя от НА, попытки существования без анорексии, приобретение перспективы путем изменения аноректического мышления, открытия и презентации себя как “достаточно хорошей”. Причем в этом процессе продвижение вперед перемежалось с отступлениями назад. При низкой самооценке больных и их плохой социальной приспособляемости отход от НА представлялся для них отказом от того единственного, что они могли контролировать в жизни, а именно собственную массу тела. Реальный прогресс часто зависел от наличия людей, воодушевляющих их в этом и пользующихся их доверием.
Женщины также вспоминали, что в период болезни они утрачивали границы себя как личности, будучи как бы в тени (overshadowed) своих родителей и бойфрендов. Идентификация собственной значимости, верований, целей, желаний и выбора оказывалась очень важной на пути к выздоровлению и открывала возможность для самовыражения и обсуждения своих проблем. Обрести умение противостоять своим страхам, относящимся к массе тела, переносить фокус своего интереса с массы тела на другие аспекты больные также считали важным стратегическим моментом в избавлении от аноректической направленности мышления. Социальная поддержка, то, что другие видели в них ценность, способствовало выстраиванию чувства уверенности в себе и осознанию независимости собственной значимости исключительно от их внешности.
Авторы отмечают уникальный характер выздоровления от НА в сравнении с другими психическими болезнями (шизофрения, большая депрессия, тревожное расстройство). В последних случаях процесс нового открытия себя (rediscovery) включает понимание болезни как части своей сущности, тогда как при НА больные ощущали себя выздоровевшими лишь после того, как переставали идентифицировать НА как часть себя. В цитируемом исследовании женщины считали выздоровление прежде всего результатом собственных усилий, поддержки друзей и родственников, которым они доверяли. В контексте описанного понятна эффективность психотерапии в лечении больных НА (если только она не приводит к зависимости больной от психотерапевта) и малая результативность применения психофармакологических средств.
Заключение
Результаты современных нейропсихологических, нейробиохимических, томографических и морфологических исследований заставляют несколько иначе, чем это общепринято, взглянуть на патогенетические механизмы при НА.
1. При НА не выявляется какое-либо специфическое семейное отягощение психическими расстройствами, хотя выделение характерных личностных структур и эндофенотипов, создающих определенный личностно-конституциональный фон, по-видимому, вполне обосновано и перспективно в плане дальнейшего изучения.
2. В качестве предрасполагающих факторов с убежденностью можно говорить о личностных свойствах ананкастного круга, повышенной в преморбиде массе тела и (предположительно) наличии в анамнезе инфекций с нейротоксическим действием. Можно также предполагать некоторый изначальный дефект в лептиновой и других гормональных системах.
3. Заболевание развивается в период кардинальной гормональной перестройки и эндокринологического дисбаланса (пубертат, климакс) по невротическому механизму, в основе которого лежит неразрешимый конфликт между желаемым и реально доступным. При этом потеря массы тела преследует своей первоначальной целью изменение формы тела для достижения определенных задач и перемен имеющейся ситуации в лучшую сторону, т.е. похудение становится средством достижения цели и самоутверждения.
4. Особенностью НА является быстрое присоединение вследствие потери массы тела соматоэндокринных нарушений и формирование нейроэндокринной дисфункции, которые при сохранении более или менее однотипного психического состояния с психопатологическими расстройствами, ограничивающимися легкими регистрами, начинают играть важную патогенетическую роль в последующей динамике болезни и в какой-то мере определять возможности и сроки наступления выздоровления.
5. Активный период болезни длится несколько лет. Со временем наступает относительная стабилизация, облегчающая процесс выздоровления, в котором решающую роль играют социально-средовые факторы, повышающие мотивацию больных на нормализацию пищевого поведения.
Стоит задуматься и над тем, какие же психические расстройства могут так неожиданно в отсутствие терапии исчезать под влиянием событий, меняющих структуру ценностей больной и приводящих к формированию новых увлечений. Во всяком случае, к их числу вряд ли может быть отнесена симптоматика тяжелых регистров и расстройства шизофренического спектра. Сомнительно, чтобы смена увлечений, появление нового объекта привязанности были способны привести к нивелированию столь трудно курабельных синдромов, как дисморфофобия и дисморфомания.
Список исп. литературыСкрыть список1. Баринов А.М. Диагностические и прогностические критерии динамики синдрома нервной анорексии (коррекции соматоэндокринных и психических расстройств). Автореф. дис. … канд. мед. наук. М., 1982.
2. Борисов И.Ю. Два основных вида нервной анорексии как варианты аномального развития личности в рамках психической нормы. К психологической постановке проблемы. Мир психологии. 2000; 1: 154–65.
3. Брюхин А.Е. Особенности аффективной патологии у больных нервной анорексией. Материалы Конгресса по детской психиатрии. Москва, 25–28 сентября 2001. М.: Росинэкс, 2001; 169–70.
4. Кислова Е.К. Булимические расстройства при нервной анорексии. Автореф. дис. … канд. мед. наук. М., 2004.
5. Коркина М.В., Цивилько М.А., Кареева М.А. и др. Клинико-психопатологические корреляции психической ригидности при нервной анорексии. Журн. невропатол. психиатр. 1990; 10: 86–8.
6. Коркина М.В., Цивилько М.А., Карева М.А., Брюхин А.Е. Этапы реабилитации больных нервной анорексией. Соц. и клин. психиат. 1993; 1: 84–96.
7. Крылов В.И. Клинико-психопатологический анализ синдромов нервной анорексии и нервной булимии при пограничных нервно-психических заболеваниях. Обозрение психиатр. мед. психологии им. В.М.Бехтерева. 1993; 2: 87–88.
8. Мазаева Н.А. Жировая ткань, лептин и нервная анорексия. Психиат. и психофармакотер. 2008; 2: 18–27.
9. Марилов В.В., Крисп А.Х., Бен-Товим. Особенности личностного реагирования и психического состояния при нервной анорексии. Журн. неврол. психиатр. 2000; 2: 19–22.
10. Панков Ю.А. Роль лептина и его медиаторов в нейрофизиологии. Вестн. РАМН. 2005; 2: 44–7.
11. Растам М. Нервно-психическая анорексия. В кн.: Психиатрия детского и подросткового возраста. Под ред. К.Гиллберга и Л.Халегрена. М.: ГЭОТАР-Мед, 2004; 222–30.
12. Скугаревский О.А. Классификационные критерии нарушений пищевого поведения и сопряженные поведенческие проявления. Психотер. и клин. психол. 2003; 2 (7): 25–9.
13. Сулейманов Р.А. Особенности доманифестного периода нервной анорексии. Автореф. дис. … канд. мед. наук. М., 2004.
14. Attia E, Walsh BT. Anorexia nervosa. Am J Psychiat 2007; 164 (12): 1805–10.
15. Bechetoille B, Nezelof S, Millot JL, Bizouard P. Comparison of electrodermal reaction on odours used as emotional stimulus between an adolescent with anorexia nervosa group and control group. Posters. Eur Psychiat 2006; 21: S79.
16. Becker AE, Greenspoon SK, Klibanski A, Herzog DS. Eating Disorders. New Engl J Med 1999; 14 (340): 1092–8.
17. Biller BM, Saxe V, Herzog DB et al. Mechanisms of osteoporosis in adult and adolescent women with anorexia nervosa. J Clin Endocrinol Metabol 1995; 68: 548–54.
18. Bizeul C, Sadowsky N, Rigaud D. The prognostic value of EDI scores in anorexia nervosa patients: a prospective follow-up study of 5–10 years. Eur Psychiat 2001; 16: 232–8.
19. Bluher S, Mantzoros Chr S. The role of leptin in regulating neuroendocrine function in humans. J Nutrition 2004; 134: 2469S–74S.
20. Boettger S, Wagner G, Greiner W et al. Changes of pain perception, autonomic function and endocrine parameters during treatment of anorexia nervosa. Posters. Eur Psychiat 2006; 21: S79–S80.
21. Bosanac P, Norman T, Burrows G, Beumont P. Serotonergic and dopaminergic systems in anorexia nervosa: a role for atypical antipsychotics? Austral New Zealand J Psychiat 2005; 39: 146–53.
22. Brooks ER, Ogden BW, Cavalier DS. Compromised bone denmsity 11,4 years after diagnosis of anorexia nervosa. J Women Health 1998; 7: 567–74.
23. Bruch H. Perceptual and conceptual disturbances in anorexia nervosa. Psychosomatic Med 1962; 24: 187–94.
24. Bulik CM, Sullivan PF, Fear J, Pickering A. Predictors of the development of bulimia nervosa in women with anorexia nervosa. J Nerv Ment Dis 1997; 185: 704–7.
25. Bulik CM, Sullivan PF, Tozzi F et al. Prevalence heritability and prospective risk factors for anorexia nervosa. Arch Gen Psychiat 2006; 63: 305–12.
26. Bulik C, Hebebrand J, Keski-Rahkonen A et al. Genetic epidemiology, endophenotypes and eating disorder classification. Int J Eat Disorders 2007; 40: S52–S60.
27. Caci HM, Dossios C. Amisulpride enhances weight gain in anorexia nervosa: a case report. Posters. Eur Psychiat 2006; 21: S80.
28. Cnattingius S, Hultman C, Dahl M, Sparen P. Very preterm birth, birth trauma and the risk of anorexia nervosa among girls. Arch Gen Psychiat 1999; 56: 634–8.
29. Cvitanovic-Sojat IJ, Bedek D, Mucic-Pucic B et al. EEG findinds and structural brain changes in girls with anorexia nervosa – experience with 52 cases. Paediat Croat 1997; 41 (2): 124.
30. Favaro A, Tenconi E, Santonastaso P. Perinatal factors and risk of developing anorexia nervosa and bulimia nervosa. Arch Gen Psychiat 2006; 63: 82–8.
31. Fichter MM, Quadflieg N. Long-term study of eating disorders diagnoses. Int J Eating Disorders 2007; 40: S61–S66.
32. Frank GK, Kaye WH, Meltzer CC et al. Reduced 5-HT2A receptor binding after recovery from anorexia nervosa. Biol Psychiat 2002; 52: 896–906.
33. Franko DL, Herzog DB, Dorer DJ, Keel PK. Suicidal behavior in women with anorexia nervosa and bulimia nervosa: report from longitudinal study. Abstracts for oral sessions. Eur Psychiat 2006; 21: S46.
34. Gendall KA, Kaye WH, Altemus M et al. Leptin, neuropeptide Y and peptide YY in long- term recovered eating disorder patients. Biol Psychiat 1999; 46: 292–9.
35. Grinspoon S, Gulick T, Askari H et al. Serum leptin levels in women with anorexia nervosa. J Clin Endocrinol Metab 1996; 81: 11. Downloaded from jcem.endojournals.org by on May 31, 2007.
36. Haas V, Onur S, Paul Th et al. Leptin and body weight regulation in patients with anorexia nervosa before and during weight recovery. Am J Clin Nutrition 2005; 81 (4): 889–96.
37. Halmi KA, Sundday SR, Strober M еt al. Perfectionism in anorexia nervosa: variation by clinical subtipe, obsessionality and pathological eating behavior. Am J Psychiat 2000; 157: 1799–805.
38. Hebebrand J, Muller TD, Holtkamp K, Herpertz-Dahlmann B. The role of leptin in anorexia nervosa: clinical implications. Mol Psychiat 2007; 12: 23–35.
39. Hewitt PL, Coren S, Steel GD. Death from anorexia nervosa: age span and sex differences. Aging and mental health 2001; 5 (1): 41–6.
40. Hjern A, Lindberg L, Lindblad F. Outcome and prognostic factors for adolescent female in-patients with anorexia nervosa: 9- to 14-years follow-up. Brit J Psychiatry 2006; 189: 428–32.
41. Holliday J, Tchanturia K, Landau S et al. Is impaired set-shifting an endophenotype of anorexia nervosa? Am J Psychiat 2005; 162: 2269–75.
42. Holtkamp K, Hebebrand J, Mika C et al. The effect of therapeutically induced weight gain on plasma leptin levels in patients with anorexia nervosa. J Psychiatr Res 2003; 37 (2): 165–9.
43. Holtkamp K, Hebebrand J, Mika C et al. High serum leptin levels subseguent to weight gain predict renewed weight loss in patients with anorexia nervosa. Psychoneuroendocrinology 2004; 29 (6): 791–7.
44. Johnson JG, Cohen P, Kasen St, Brook JS. Early disorders during adolescence and the risk for physical and mental disorders during early adulthood. Arch Gen Psychiat 2002; 59: 545–52.
45. Kaye WH, Frank GK, Bailer UF, Henry SE. Neurobiology of anorexia nervosa: clinical implications of alterations of the function of serotonin and other neuronal systems. Int J Eat Disorders 2005; 37 (Suppl.): S15–S19.
46. Keel PK, Klump KL. Are eating disorders culture- bound syndromes? Implications for conceptualizing their etiology. Psychol Bull 2003; 129: 747–69.
47. Keel PK, Dorer DJ, Franko DL et al. Postremission predictors of relapse in women with eating disorders. Am J Psychiat 2005; 162 (12): 2263–8.
48. Kellett J, Trimble M, Thorley A. Anorexia nervosa after the menopause. Brit J Psychiat 1976; 128: 555–8.
49. Keski-Rahkonen A, Hoek HV, Susser ES et al. Epidemiology and course of anorexia nervosa in the community. Am J Psychiat 2007; 164: 1259–65.
50. Krisova J, Papezova H, Haluzikova D et al. Soluble leptin receptor levels in patients with anoreхia nervosa. Endocrine Research 2002; 28 (3): 199–205.
51. Lamoureux MMH, Bottorff JL. “Becoming the real me”: recovering from anorexia nervosa. Health Care for Women International 2005; 26: 170–88.
52. Lilenfeld LRR, Wonderlich S, Riso LP et al. Eating disorders and personality: A methodological and empirical review. Clin Psychol Rev 2006; 26: 299–320.
53. Lindblad F, Lindberg L, Hjern A. Improved survival in an adolescent patients with anorexia nervosa: a comparison of two Swedish national cohorts of female inpatients. Am J Psychiat 2006a; 163: 1433–5.
54. Mantzoros CS. The role of leptin in human obesity and desease: a review of current evidence. Ann Intern Med 1999; 130: 671–80.
55. Mayer L, Walsh BT, Pierson RN et al. Body fat redistribution after weight gain in women with anorexia nervosa. Am J Clin Nutr 2005; 81: 1286–91.
56. Mayer LES, Roberto ChrA, Glasofer DR et al. Does percent body fat predict outcome in anorexia nervosa? Am J Psychiat 2007; 164: 970–2.
57. Moschos S, Chan JL, Mantzoros ChrS. Leptin and reproduction. Fertil Steril 2002; 77 (3): 433–44.
58. Munoz TM, Argente J. Anorexia nervosa in female adolescents: endocrine and bone mineral density disturbances. Eur J Endocrinol 2002; 147: 275–86.
59. Nagata T, Oshima J, Wada A et al. Temperament and character of Japanese eating disorder patients. Compr Psychiat 2003; 44 (2): 142–45.
60. Nandrino JL, Doba K, Pezard L, Christophe V. Autobiographical memory deficit in anorexia nervosa: effect of duration of illness on emotion regulation. Posters. Eur Psychiat 2006; 21: S82.
61. Nilsson K, Hagglof B. Patients perspectives of recovery in adolescent onset anorexia nervosa. Eating Disord 2006; 14: 305–11.
62. Nilsson K, Abrahamsson E, Torbiornsson А, Hagglof B. Causes of adolescent onset anorexia nervosa: patient perspectives. Eating Disord 2007; 15: 125–33.
63. Otto MW, Wilhelm S, Cohen LS, Harlow BL. Prevalence of body dysmorphic disorder in a community sample of women. Am J Psychiat 2001; 158: 2061–3.
64. Palazidou E, Robinson P, Lishman WA. Neuroradiolocical and neuropsychological assessment in anorexia nervosa. Psycholog Med 1990; 36: 521–7.
65. Patton GC, Selzer R, Coffey C et al. Onset of adolescent eating disorders: population based cohort study over 3 years. Brit Med J 1999; 318: 765–8.
66. Phillips KA, Grant JE, Siniscalchi JM et al. A retrospective follow-up study of body dysmorphic disorder. Compr Psychiat 2005; 46: 315–21.
67. Pike KM. Lond-term course of anorexia nervosa: response, relapse, remission and recovery. Clin Psychol Rev 1998; 18: 447–75.
68. Procopio M, Marriott P. Intrauterine hormonal environment and risk of developing anorexia nervosa. Arch Gen Psychiat 2007; 64 (12): 1402–7.
69. Rabe-Jablonska J, Sobow M. The links between body dysmorphic disorder and eating disorders. Eur Psychiat 2000; 15: 302–5.
70. Rastam M, Gillberg Chr, Garton M. Anorexia nervosa in Swedish urban region: a population based study. Brit J Psychiat 1989; 155: 642–6.
71. Russel JFM, Treasure J, Eisler I. Mothers with anorexia nervosa who underfeet their children: their recognition and management. Psycholog Med 1998; 28: 93–108.
72. Stamatakis EA, Hetherington MM. Neuroimaging in eating disorders. Nutritional Neuroscience 2003; 6 (6): 325–34.
73. Strober M. Pathologic fear conditioning and anorexia nervosa: on search of novel paradigms. Int J Eat Disord 2004; 35: 504–8.
74. Wojciak RW, Krejcpio Z, Oleinik D. The assesment of hair trace elements level in early onset of anorexia. Abstract for poster session. Eur Psychiat 2007; 22: S182.


