Психиатрия Психические расстройства в общей медицине
№04 2008
К вопросу о безопасности применения антидепрессантов в кардиологической практике(обзор зарубежной литературы) №04 2008
Введение
Депрессия – частое аффективное расстройство, истинная распространенность которого в населении окончательно неизвестна. Так, А.Б.Смулевич, А.Л.Сыркин и соавт. (2005 г.) опубликовали данные о том, что заболеваемость депрессиями на сегодняшний день составляет 3%, а риск заболеть депрессией в течение всей жизни – 20% [1]. В 1994 г. в эпидемиологическом исследовании National Comorbidity Survey, изучавшем распространенность и факторы риска “большой” депрессии per se и “большой” коморбидной депрессии, было показано, что приблизительно 17% американцев испытывали в течение жизни “тяжелую” депрессию, а около 10% населения США – в течение последних 12 мес [2, 3].
Термин “депрессивный эпизод” объединяет три понятия: “большая” депрессия, униполярная (монополярная) депрессия и автономная депрессия. Отечественные и зарубежные психиатры характеризуют “большое” депрессивное расстройство как состояние, когда в течение по меньшей мере 2 нед имеются пять следующих симптомов или более: сниженное настроение большую часть дня, значительное снижение интереса и/или чувства удовольствия от всех или практически всех видов повседневной активности, изменения аппетита (как снижение, так и повышение) с изменением массы тела или без такового, инсомния/гиперсомния, психомоторная ажитация/заторможенность, чувство опустошенности/потери энергии, чувство бесцельности существования/крайне выраженное чувство собственной вины, снижение умственной активности и снижение возможности концентрировать внимание, принимать решение, суицидальные мысли или мысли о смерти [1, 4].
Патофизиология.
Патофизиологические механизмы, лежащие в основе депрессивных расстройств, являются многофакторными и малоизученными. Было предложено несколько гипотез. Наибольшее признание получила “моноаминовая” гипотеза, “отправной точкой” которой послужил эмпирический факт, что депрессия выявляется у гипертоников, получавших резерпин в составе антигипертензивных препаратов. Резерпин способствует опустошению пула катехоламинов в постганглионарных симпатических нервных окончаниях и мозгового слоя надпочечников. Кроме того, резерпин также опустошает и запасы катехоламинов и серотонина в головном мозге [5]. Таким образом, моноаминовая гипотеза рассматривает истощение катехоламинового и серотонинового пулов как причину развития депрессии [6, 7]. Второй общепринятой патогенетической теорией является гипотеза о дисфункции рецепторов нейромедиаторов (нейротрансмиттеры), предполагающая, что источником депрессии является не столько опустошение запасов нейромедиаторов, сколько дисфункция их рецепторного аппарата. В 2000 г. была предложена моноаминовая гипотеза генной экспрессии. Она основывается на псевдоаминовом дефиците, т.е. сигнал блокируется из-за дефицита мозгового нейротрофического фактора (МНТФ) при нормальном уровне нейротрансмиттеров и нормальном состоянии рецепторного аппарата. В нормальных условиях МНТФ обеспечивает нормальную передачу сигнала. Однако в стрессорных ситуациях ген, кодирующий продукцию МНТФ, подавляется, что и приводит к развитию рефрактерной депрессии [7].
Развитие депрессии может быть спровоцировано множеством факторов, в том числе тяжелыми соматическими заболеваниями и определенными видами лекарственной терапии. У больных с инвалидизирующими заболеваниями депрессия встречается с частотой 20–60% [8]. Депрессии ассоциированы с заболеваниями сердечно-сосудистой системы, синдромом приобретенного иммунодефицита человека и другими состояниями, влияние которых из-за многофакторности в полной мере невозможно оценить. В кардиологической практике депрессии встречаются с частотой 15–38% [9–15, 97].
В настоящее время доказано, что депрессия является независимым предиктором развития ишемической болезни сердца (ИБС) [16–25]. С этой точки зрения особо интересными представляются результаты исследования John Hopkins Precursors Study, впервые доказавшие, что депрессия является независимым фактором риска ИБС, повышающим риск развития острого инфаркта миокарда (ИМ) в 2,12 раза [22]. В масштабном популяционном исследовании INTERHEART (участвовало 52 страны) было показано, что различные факторы (и в их числе депрессия) повышают риск развития острого ИМ более чем в 2,5 раза [26, 27].
В настоящее время установлено, что риск развития депрессии повышен у больных ИБС, кардиомиопатиями, недавно перенесших острый ИМ [9–12, 28–33]. Приблизительно у каждого четвертого больного, перенесшего острый ИМ, в течение 18–24 мес от момента коронарной катастрофы разовьется “большая” депрессия [10]. Патофизиологические механизмы, лежащие в основе высокой частоты депрессии у коронарных больных, до сих пор остаются неизвестными. Предполагается, что у таких больных за развитие значительной доли депрессий ответственна терапия b-адреноблокаторами. Однако депрессивное расстройство, вызываемое приемом этих препаратов, не настолько клинически выражено, чтобы соответствовать современным критериям тяжелой депрессии [34]. Ведущие позиции в возникновении и развитии депрессии после острого ИМ отводятся анамнезу заболевания или такому событию, как аортокоронарное шунтирование (АКШ) [13, 35, 36]. Факторами риска развития депрессии после острого ИМ являются другие сопутствующие инвалидизирующие заболевания, предшествовавшая этому заболеванию стертая или тяжелая депрессия, тип личности А [12].
Депрессия, развивающаяся после острого ИМ, является причиной повышенной заболеваемости и смертности [10]. В многочисленных перекрестных [14, 29, 31, 32, 37] и проспективных [30, 33] исследованиях показано, что у больных, страдающих сердечной недостаточностью, “большие” и стертые депрессии развиваются чаще, чем у пациентов, не имеющих признаков недостаточности кровообращения. Высказывалось предположение, что у больных, страдающих сердечной недостаточности в сочетании с депрессией, регистрируются более высокие показатели смертности по сравнению с больными, имеющими симптомы только сердечной недостаточности [9, 32].
R.Carney и соавт. (1993 г.) предположили, что психологический стресс, включая депрессию, может усилить эктопическую активность желудочков сердца и, следовательно, повысить риск развития фибрилляции последних [38]. Кроме того, у пациентов с депрессией имеет место уменьшение высокочастотного компонента вариабельности ритма сердца (ВРС) за счет снижения тонуса парасимпатической нервной системы. Снижение активности парасимпатического отдела вегетативной нервной системы понижает порог возникновения желудочковых нарушений ритма и фибрилляции желудочков, что ведет к повышению риска внезапной сердечной смерти (ВСС) [40–47].
Нашим коллективом было доказано, что депрессия влияет и на течение стабильной ИБС в виде усугубления проявлений миокардиальной ишемии, в основном за счет ее безболевого компонента, нарушений диастолической и систолической функции левого желудочка (ЛЖ) [39].
Вследствие широкой распространенности депрессии среди кардиологических больных, а также в связи с ростом заболеваемости и смертности, причиной которой является депрессия, лечение данных аффективных расстройств у пациентов с сердечно-сосудистыми заболеваниями (ССЗ) нам представляется обязательным. До настоящего времени актуален вопрос, применение какого антидепрессанта у этого контингента наиболее безопасно. В многочисленных клинических исследованиях была продемонстрирована относительная безопасность антидепрессантов в лечении больных без ССЗ. Следует заметить, что применение препаратов этих групп у кардиологических пациентов тщательно изучены в очень малом количестве исследований.
Терапия антидепрессантами
В настоящее время для лечения депрессии используются препараты нескольких групп: тимоаналептики I поколения – трициклические антидепрессанты (ТЦА) и ингибиторы моноаминоксидазы (ИМАО) II поколения (амоксапин, мапротилин, тразодон, бупропион) и III поколения. Представителями последней группы являются селективные ингибиторы обратного захвата серотонина (СИОЗС), ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН). Кроме того, в современной практике применяются антидепрессанты с недостаточно изученными механизмами действия (тианептин, нефазодон). Препараты последних групп обладают способностью менять плотность рецепторов как на пре-, так и на постсинаптическом уровнях. Более того, в настоящее время постулируется, что все они действуют за счет повышения концентрации биогенных аминов в синапсе (норадреналин, серотонин, дофамин как изолированно, так и в их комбинации).
Для антидепрессантов описан ряд побочных сердечно-сосудистых эффектов – ортостатическая гипотензия, артериальная гипертензия, нарушение проводимости (табл. 1).
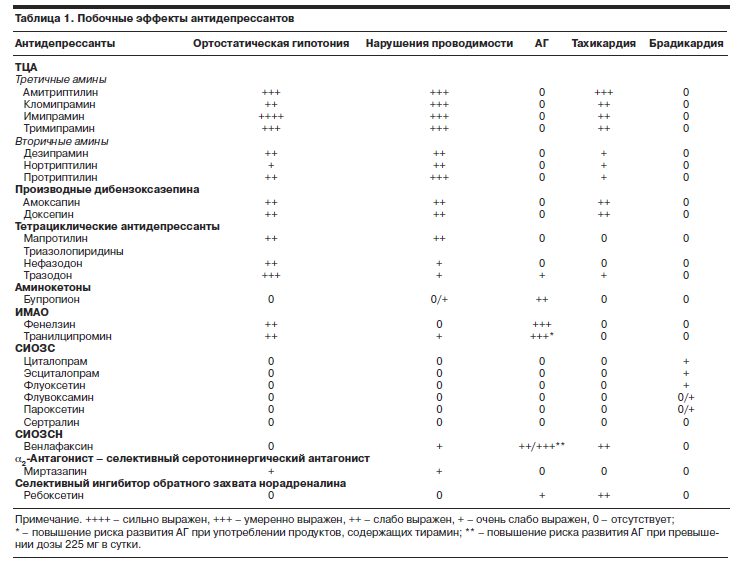
Поскольку антидепрессанты повышают доступность и активность нейромедиаторов норадреналина, дофамина и серотонина, то у больных ССЗ связанные с их приемом побочные реакции могут развиваться чаще.
Норадреналин способен через центральные механизмы влиять на тревогу, на периферии он связывается с a- и b-рецепторами сосудистого русла и миокарда, что приводит к развитию побочных сердечно-сосудистых эффектов. К ним относятся повышение исходных уровней артериального давления (АД) и частоты сердечных сокращений (ЧСС), ускорение проводимости и усиление сократимости. У больных с заболеваниями сердца это может привести к возникновению или усугублению ишемии миокарда, развитию стенокардии, артериальной гипертензии (АГ), различных нарушений ритма.
Дофамин действует на уровне центральной нервной системы (ЦНС) и влияет на мотивацию поведения, чувство удовольствия и психомоторную активность. На периферии дофамин превращается в норадреналин за счет действия b-гидроксилазы, что приводит к развитию побочных эффектов, сходных с норадреналином.
Серотонин влияет на сон, психомоторную активность, настроение, чувство удовольствия и другие аспекты поведения. На периферии он связывается с 5-гидрокситриптаминовыми рецепторами четырех типов: 5-НТ1, 5-НТ2, 5-НТ3 и 5-НТ4. В ответ на активацию рецепторов каждого типа со стороны сердечно-сосудистой системы развивается определенный эффект. Эти эффекты не ограничиваются только возможным незначительным повышением АД. Серотонин способен вызывать вазоконстрикцию у больных с атеросклеротическим поражением коронарного русла, усиливать агрегацию тромбоцитов [48, 49]. И хотя тромбоциты самостоятельно секретируют серотонин, что находит отражение в прогрессировании ИБС и развитии коронарных событий, возможное влияние СИОЗС на эти звенья патогенеза коронарной болезни сердца остается малоизученным.
ТЦА. Из всех тимоаналептиков ТЦА наиболее широко исследованы у больных с ССЗ. Однако в данных исследованиях участвовали мало пациентов. При депрессии ТЦА осуществляют свое действие за счет блокады обратного захвата нервными окончаниями норадреналина и серотонина, что ведет к повышению концентрации последних в синаптической щели. Для реализации антидепрессивной активности ТЦА также необходимо воздействие на рецепторы дофамина1.
Влияние ТЦА на сердце подобно воздействию антиаритмических препаратов I класса (хинидин, прокаинамид, дизопирамид, энкаинид, флекаинид, пропафенон и морицизин). ТЦА способны удлинять время внутрижелудочкового проведения за счет блокады натриевых каналов. В случае передозировки ТЦА и при отсутствии своевременного и агрессивного лечения данный феномен может привести к смерти [50]. Увеличение проводимости приводит к уменьшению числа желудочковых экстрасистол, что расценивается как антиаритмический эффект [51–53]. Кроме того, ТЦА эффективно ингибируют деятельность IKr, быстро инактивируемых калиевых каналов миоцитов [54, 55]. Инактивация последних ведет к удлинению интервала QT ЭКГ. Следует заметить, что случаи развития torsade de pointes описаны у очень небольшого числа больных, получавших ТЦА. Как правило, значительное удлинение интервала QT и увеличение риска возникновения пируэтной тахикардии наблюдается у больных, у которых использование ТЦА комбинируется с назначением препаратов других групп, также удлиняющих интервал QT. Концентрируясь в миокарде, ТЦА приводят к значительным изменениям проводимости и сократимости. ТЦА способны вызывать развитие атриовентрикулярной (АВ) блокады I и II степени, асистолию и ВСС [56].
У большинства больных, принимающих ТЦА, регистрируется синусовая тахикардия вследствие повышения базальной концентрации норадреналина в сыворотке крови [57]; у 20% может отмечаться постуральная гипотония из-за комбинации антиадренергического эффекта, подавления сократимости миокарда и a-адреноблокирующего действия на ЦНС [58]. Более того, постуральная гипотония ответственна за травмы у пациентов старших возрастных групп и способна индуцировать развитие и/или усугубление ишемии миокарда в случае рефлекторной тахикардии. Среди больных, получающих ТЦА, постуральная гипотония более выражена у пациентов, у которых перед началом лечения ортостатическое снижение систолического АД (САД) составляет более 10 мм рт.ст.
Для оценки влияния ТЦА на желудочковую экстрасистолию (ЖЭ) было выполнено несколько исследований. Желудочковая эктопическая активность (ЖЭА) являлась предметом исследований в связи с тем фактом, что у пациентов, перенесшими острый ИМ, развитие которого осложнялось частой желудочковой экстрасистолией (ЖЭ более 10 в 1 ч), повышен риск ВСС по сравнению с больными, также перенесших острый ИМ, но течение которого осложнялось развитием более редкой ЖЭ [59]. Было показано, что ТЦА достоверно уменьшают количество ЖЭ у больных с поражением сердца и не имеющих признаков депрессии [51–53] и подавление ЖЭ на фоне использования ТЦА идет параллельно с уменьшением выживаемости в течение длительного периода наблюдения [60–64].
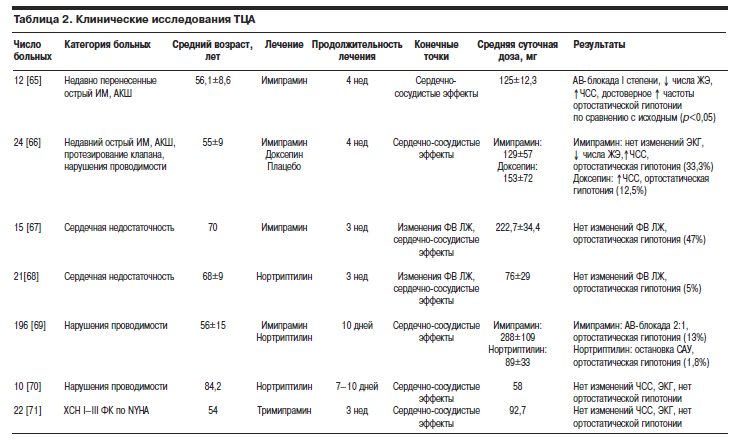
M.Raskind и соавт. обследовали 12 мужчин (средний возраст 56,1±8,6 года), страдающих ИБС, которые отвечали диагностическим критериям вторичной большой депрессии [65]. Все больные перенесли острый ИМ и имели признаки стенокардии напряжения высоких функциональных классов, что послужило причиной выполнения АКШ. В качестве первичных конечных точек этого исследования выступали нарушения проводимости и ритма сердца, частота развития ортостатической гипотонии, а также антидепрессивная активность ТЦА имипрамина.
Стартовая дозировка этого ТЦА составляла 50 мг/сут перед сном с постепенным повышением до достижения максимальной (175 мг/сут). В максимальной дозе имипрамин назначали в течение 4 нед. Симптомы депрессии оценивали при включении в исследование и еженедельно с использованием шкал Гамильтона для оценки депрессии (Hamilton Psychiatric Rating Scale for Depression), общей (глобальной) клинической оценки (Clinical Global Impression Scale), Цунга для самооценки депрессии (Zung Self-Rating Scale). На момент окончания исследования среднесуточная дозировка препарата составила 125±12,3 мг, средняя плазменная концентрация имипрамина+десметилимипрамина – 194±63 нг/мл (от 32 до 770 нг/мл). В процессе лечения у 2 (17%) из 12 больных развилась АВ-блокада I степени (интервал PQ≥240 мс). Не отмечено изменений продолжительности комплекса QRS на ЭКГ. Однако среднее значение корригированного интервала QT (QTc) через 21 день лечения было значительно выше сравнительно с исходным (441 и 420 мс соответственно; p<0,05). Среднее постуральное снижение САД, определявшееся как разница между систолическим АД в положении лежа и систолическим АД в положении стоя, составило 4,3±8,5 мм рт. ст. при исходном обследовании, что значимо отличалось от аналогичного показателя на 4-й неделе лечения (среднее постуральное снижение САД 12,6±10,7 мм рт. ст.; p<0,05).
В течение 1-й недели 1 пациент был исключен из исследования в связи с развитием клинически выраженной ортостатической гипотонии. В отношении улучшения симптомов депрессии следует отметить, что в показателях шкалы Гамильтона не было существенных изменений между исходными и полученными в конце 4-й недели лечения. Можно предположить, что при достижении терапевтической концентрации препарата в плазме крови происходит “запаздывание” развития антидепрессивного эффекта по сравнению с кардиотропным. Авторы пришли к заключению, что применение имипрамина безопасно у больных со стабильно протекающей ИБС и сопровождается минимально выраженными изменениями проводимости.
Эффекты имипрамина и доксепина сравнивали в рандомизированном двойном слепом плацебо-контролируемом исследовании у 24 больных (средний возраст 55±9 лет) [66], 23 из которых в недавнем прошлом перенесли острый ИМ, 8 – подверглись АКШ, 1 был установлен желудочковый водитель ритма, а еще у 1 был механический протез сердечного клапана. Исходная фракция выброса левого желудочка (ФВ ЛЖ) составила 45±17% (11–73%). Целью этого исследования являлось изучение влияний имипрамина и доксепина на проводимость и сравнение антидепрессивной активности этих препаратов у коронарных больных, страдающих депрессией. Пациенты были рандомизированы для приема 50 мг имипрамина в сутки перед сном, 50 мг доксепина в сутки перед сном или плацебо. Курс лечения препаратом составлял 4 нед. На 4-й неделе средняя конечная доза препарата составила: 129±57 мг/сут имипрамина и 153±72 мг/сут доксепина. У пациентов, получавших имипрамин, на 4-й неделе отмечено достоверное уменьшение количества ЖЭ по сравнению с исходным (28±44 и 8±13 соответственно, p<0,01). У больных, получавших доксепин или плацебо, число желудочковых нарушений ритма существенно не изменилось. Артериальная гипотензия ни в одной из групп не наблюдалась. Однако в обеих группах отмечено достоверное повышение ЧСС на 4-й неделе (имипрамин 81±8 уд/мин исходно и 85±13 уд/мин на 4-й неделе, p<0,001; доксепин 77±13 уд/мин исходно и 79±11 уд/мин на 4-й неделе, p<0,005). При анализе исходной ЭКГ у 2 больных регистрировали АВ-блокаду I степени, у 3 пациентов отмечено удлинение интервала QT, у 1 имела место фибрилляция предсердий, у 13 регистрировались признаки перенесенного ИМ. Эти аномалии были равномерно распределены между группами. В ходе лечения не отмечено значительных изменений в продолжительности интервалов PQ (PR), QRS, QTс, изменений сегмента ST зафиксировано не было или они были выражены минимально. Симптоматическую ортостатическую гипотонию наблюдали у 1 из 8 больных, получавших имипрамин (12,5%), и у 3 из 9 пациентов, получавших доксепин (33%). На 4-й неделе исследования в обеих группах отмечена достоверная редукция симптомов депрессии по сравнению с исходным состоянием. Несмотря на то что число больных, включенных в исследование, было недостаточным для обоснованных выводов, авторы пришли к заключению, что у пациентов, перенесших ИМ со значительными нарушениями функции ЛЖ или без таковых, назначение имипрамина или доксепина безопасно. Тем не менее пациентам, имеющим высокий риск развития ортостатической гипотонии, следует назначать альтернативное лечение.
Применение ТЦА у больных с нарушенной функцией ЛЖ и страдающих депрессией изучалось в двух проспективных исследованиях. В первом эффекты имипрамина у 15 больных в возрасте 70 лет оценивали с использованием радионуклидной ангиографии [67]. Исходная величина ФВ ЛЖ составила 37,6±14,2% (22–64%). Впоследствии пациентам назначали имипрамин (стартовая доза не указана). Дозу препарата постепенно увеличивали до достижения максимальной, равной 3,5 мг/кг/сут. В ходе исследования была достигнута средняя дозировка имипрамина, составившая 227± 34,4 мг/сут или 3,37 мг/кг/сут. Целевые плазменные концентрации авторы не указывают. Спустя 1 нед от начала лечения средняя концентрация препарата в сыворотке крови через 12 ч после последнего приема составила 388±19 нг/мл. Радионуклидную ангиографию повторяли при достижении терапевтического уровня препарата в плазме крови. По замыслу исследователей, целевой терапевтический уровень препарата в плазме крови должен был достигнут спустя 3 нед от начала приема имипрамина. Повторная ангиография была проведена только у 11 из 15 больных. И хотя плазменная концентрация имипрамина была выше рекомендуемой, авторы не наблюдали достоверных изменений в показателях ФВ ЛЖ (38±14 и 39±15%). Кроме того, у 7 (47%) из 15 пациентов развилась выраженная ортостатическая гипотония, что послужило причиной отмены препарата. Авторами был сделан вывод о том, что имипрамин не влияет на функцию ЛЖ, а пациенты, его получающие, нуждаются в тщательном наблюдении из-за риска развития ортостатической гипотонии.
В исследовании S.Roose и соавт. (1987 г.) у 196 больных, имеющих нарушения проводимости и признаки депрессии, сравнивали эффекты применения 3,5 мг/кг/сут имипрамина (достигнутая плазменная концентрация 200 нг/мл и более) и 1,4 мг/кг/сут нортриптилина (достигнутые плазменные концентрации 50–150 нг/мл) [69]. Средний возраст больных составил 56±15 лет. Пациентов включали в исследование в течение 10 лет. Следует отметить, что в течение первых 5 лет наблюдения плазменные концентрации препаратов не мониторировали. У 41 пациента регистрировали изменения на исходной ЭКГ: в 11 случаях выявлена АВ-блокада I степени, в 30 случаях – блокады ножек пучка Гиса. У оставшихся 155 больных регистрировали нормальную ЭКГ: интервал PQ (PR) по длительности не превышал 200 мс, а продолжительность комплекса QRS была менее 110 мс. Первичной целью исследования было сравнение частоты развития нарушений проводимости и ортостатической гипотонии между двумя группами больных через 10 дней от начала лечения. Средняя суточная доза имипрамина в конце исследования составила 288±109 мг, нортриптилина – 89±33 мг. Авторы обнаружили, что в ряде случаев использование имипрамина и нортриптилина связано с развитием АВ-блокады 2:1 у больных, ранее имевших признаки блокады ножек пучка Гиса [69]. Так, у 3 (12,5%) из 24 больных с этим нарушением, зарегистрированным до начала исследования (и у которых удалось достичь терапевтических концентраций имипрамина или нортриптилина), во время приема исследуемых препаратов развились серьезные нарушения проводимости. В то же время блокада ножек пучка Гиса развилась как осложнение только у 1 (0,7%) из 150 больных с исходно нормальной ЭКГ (p<0,05). После прекращения лечения нарушения проводимости купировались.
Как указывалось выше, в этом исследовании оценивали также частоту развития ортостатической гипотонии [69]. Среди пациентов с исходно нормальной ЭКГ у 9 (7%) из 122 больных группы имипрамина развился данный побочный эффект, тогда как в группе нортриптилина подобных случаев не зарегистрировано. Ортостатическая гипотония чаще развивалась у пациентов, получавших имипрамин и имевших нарушения проводимости сердца (с признаками сердечной недостаточности или без таковых). В этой группе ортостатическая гипотония отмечена у 12 (32%) из 38 больных. Среди больных, получавших нортриптилин и имевших нарушения проводимости, данное осложнение развилось только у 1(5%) из 20 пациентов (p<0,05). У 5 из 12 больных с нарушениями проводимости, у которых ортостатическая гипотония развилась на фоне приема имипрамина, регистрировали признаки сердечной недостаточности. Был сделан вывод о том, что у пациентов с нарушениями проводимости и признаками сердечной недостаточности (или без таковых) использование нортриптилина является более предпочтительным по сравнению с имипрамином.
Другая группа исследователей изучала эффекты нортриптилина у 10 больных старшей возрастной группы (средний возраст 84,3 года), имевших нарушения проводимости и признаки депрессии [70]. Целью данного исследования являлась оценка изменений ЭКГ на фоне терапии нортриптилином. При исходной регистрации ЭКГ у 4 больных выявлена АВ-блокада I степени, у 5 – блокада передней ветви левой ножки пучка Гиса, у 3 – блокада правой ножки пучка Гиса, у 2 – блокада левой ножки пучка Гиса, у 1 – синусовая брадикардия. У нескольких пациентов имелись множественные нарушения проводимости сердца. Лечение начинали с приема 10 мг нортриптилина перед сном с повышением дозировки препарата до 20 мг/сут через 1 нед. Далее дозировку нортриптилина увеличивали каждые 5 дней до достижения целевой, составлявшей 40 мг/сут. Если не удавалось достичь терапевтической концентрации препарата в крови или развивался приемлемый терапевтический эффект, доза нортриптилина могла составлять менее 40 мг/сут. У всех пациентов была достигнута минимальная терапевтическая концентрация препарата в плазме крови (50–150 нг/мл). В процессе 7–10-дневного лечения побочных эффектов не выявлено. Последнюю регистрацию ЭКГ проводили между 7 и
10-м днями лечения. При сравнении с исходной ЭКГ не зарегистрировано изменений ЧСС, длительности интервалов PQ (PR), QRS или QTc. Авторы утверждают, что применение нортриптилина у больных с исходными нарушениями проводимости сопровождается минимальным риском их усугубления.
Влияние тримипрамина изучено в 28-дневном исследовании у 22 больных с “легкой” и “умеренной” депрессиями, оцененных по шкале Гамильтона, и проявлениями сердечной недостаточности: по классификации NYHA у 11 (50%), 10 (45%) и 1 (5%) пациента эти нарушения отнесены к I, II и III функциональному классу соответственно [71]. У каждого больного регистрировали одно из следующих состояний или более: нарушения проводимости (5 больных), ИБС (15 больных), патологические шумы в сердце и клапанные стенозы различной локализации (8 больных), АГ (4 больных). Первичной целью этого исследования явилась оценка влияния тримипрамина на проводимость, функции миокарда, ЧСС и АД. После 7-дневного “безлекарственного” периода всем больным назначали тримипрамин (50 мг/сут перед сном в течение 4 дней). При необходимости дозировку препарата повышали на 25 мг/сут каждые 4 дня до достижения максимальной (200 мг/сут). Оценку антидепрессивной активности препарата и его влияния на сердечно-сосудистую систему проводили еженедельно. Среднесуточная дозировка тримипрамина в конце исследования составляла 92,7 мг. Включение в исследование группы плацебо не предусматривалось. Отмечена тенденция к снижению выраженности депрессии. При этом, по данным авторов, средние значения интервалов PQ (PR) и QTc, а также АД в положении лежа, ЧСС были одинаковыми на 5 и 13-й дни лечения по сравнению с первым днем от момента начала терапии. Однако на 5-й день лечения тримипрамином отмечено достоверное удлинение (пролонгация) комплекса QRS по сравнению с исходным значением (0,095 и 0,087 с соответственно, р=0,013). Случаев развития ортостатической гипотонии не зарегистрировано. Был сделан вывод о том, что использование тримипрамина в обычных дозировках эффективно для лечения депрессии у больных с заболеваниями сердца и не вызывает серьезных побочных эффектов со стороны сердечно-сосудистой системы.
Как указано выше, ТЦА применяли для лечения депрессии при различных ССЗ. Из результатов приведенных исследований следует, что основным побочным действием ТЦА является ортостатическая гипотония. При кратковременном использовании препараты этой группы не подавляют функцию ЛЖ и не вызывают тяжелых нарушений проводимости. Кроме того, судя по результатам этих исследований, нортриптилин оказывает наименьшее влияние на уровень АД по сравнению с другими представителями ТЦА. Следует также отметить, что применение имипрамина или доксепина допустимо у больных без дисфункции ЛЖ при стабильно протекающей ИБС. При тяжелой сократительной дисфункции ЛЖ ишемического генеза (ФВ ЛЖ<40%) кратковременное использование имипрамина и нортриптилина не сопровождается ее усугублением. Однако применение имипрамина часто приводит к развитию ортостатической гипотонии, а соответственно, у данной категории больных предпочтительно использование нортриптилина. При этом для окончательных выводов необходимо проведение долгосрочных и крупномасштабных исследований, посвященных исследованию влияния нортриптилина на функцию ЛЖ. Несмотря на то что ТЦА эффективны в отношении подавления желудочковой эктопической активности, их нельзя считать безопасными препаратами для рутинного применения у больных, имеющих нарушения проводимости, тем более что появление новых антидепрессантов обеспечивает альтернативные подходы к терапии.
В табл. 2 представлено сравнение клинических исследований ТЦА.
Тразодон.
Тразодон (триазолопиридин) по структуре и свойствам отличается от ТЦА. Препарат селективно блокирует обратный захват серотонина, но по выраженности этого эффекта значительно уступает представителям группы СИОЗС, не влияет на уровень норадреналина и не ингибирует активность МАО. Поскольку тразодон лишен свойств стимулировать выработку катехоламинов, его использование у пациентов с ССЗ более предпочтительно, чем применение ТЦА.
Эффекты тразодона изучены в 6-недельном проспективном исследовании у 46 больных с депрессией (средний возраст 57,6 года) [72]. У пациентов регистрировали следующие заболевания или аномалии сердца: ИБС (21 пациент), АГ (11 пациентов), ревматическая болезнь сердца (3 пациента), нарушения проводимости (3 пациента), нарушения проводимости сердца, индуцированные приемом ТЦА (2 пациента), легочное сердце (1 пациент), пролапс митрального клапана (2 пациента), вторичная недостаточность коронарного кровообращения из-за серповидно-клеточной анемии (1 пациент), алкогольная кардиомиопатия (1 пациент). Целью исследования являлась оценка частоты развития и выраженности сердечно-сосудистых эффектов препарата. В другом исследовании оценивали ЖЭА, связанную с приемом тразодона [73]. По значениям шкалы Гамильтона все пациенты соответствовали критериям “большой” депрессии. Больным назначали 50 мг тразодона 2 раза в сутки. Каждые 3 дня дозу увеличивали на 50 мг/сут до тех пор, пока не развивались непереносимые побочные действия или не была достигнута максимальная дозировка 600 мг/сут. В ходе лечения тразодоном только у 3 (8,6%) из 35 больных развилась ортостатическая гипотония de novo и еще 1 пациент самостоятельно прекратил прием препарата. При анализе 24-часовой записи ЭКГ по Holter было показано, что тразодон обладает выраженной способностью урежать ЧСС. У 35 больных, завершивших исследование, по данным холтеровского мониторирования, средняя ЧСС исходно составляла 76,53±12,32 уд/мин и 71,32±10,42 уд/мин в конце 6-й недели (р=0,002). В течение 6-недельного лечения тразодоном не отмечено развития новых нарушений проводимости, изменений в длительности интервалов PQ (PR), комплекса 1 или 2 QRS или QTc. Основным побочным эффектом являлась выраженная седация (10 больных, в 2 случаях проведена отмена препарата).
Результаты исследований приведены в табл. 3.
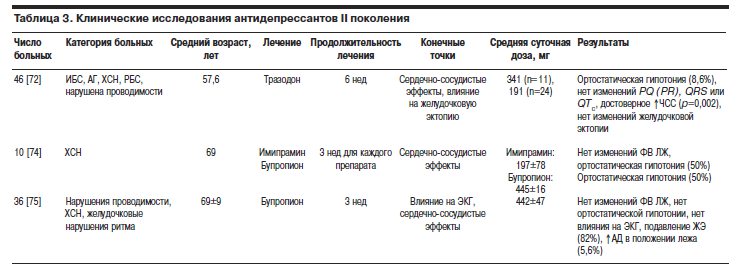
Во второй части этого исследования изучали частоту желудочковых нарушений ритма сердца у больных, получавших тразодон [72]. Авторы разработали следующие критерии для характеристики значимых изменений желудочковой эктопии: 5-кратное увеличение или уменьшение числа ЖЭ или аллоритмических форм, возникновение их впервые. Из 26 больных, у которых отмечено некоторое увеличение или уменьшение числа ЖЭ, у 8 (31%) пациентов регистрировали ухудшение, у 3 (11%) больных – улучшение, у 15 (58%) больных изменений не зарегистрировано. Из 8 больных с ухудшением у 4 (50%) пациентов регистрировали либо увеличение числа ЖЭ на фоне исходно малого их количества, появление эпизодов групповой ЖЭ, либо ЖЭ развивалась в результате отмены b-адреноблокаторов. У оставшихся 4 больных, имевших критерии ухудшения, наличие связи между приемом тразодона и увеличением числа ЖЭ доказать не удалась. У некоторых больных этой группы ЖЭ могла развиться и вследствие других причин: отмены имипрамина (обладающего способностью подавлять ЖЭ), некомплаентностью по отношению к препаратам других групп, способных подавлять ЖЭА. Только у 1 пациента произошло необъяснимое увеличение числа ЖЭ. Авторы пришли к заключению, что у страдающих депрессией больных с нарушениями проводимости и хронической сердечной недостаточностью (ХСН) тразодон является безопасной и эффективной альтернативой антидепрессантов других групп, особенно ТЦА.
Таким образом, несмотря на изучение эффектов тразодона у весьма небольшого числа тщательно отобранных больных, полученные результаты позволяют говорить об отсутствии серьезных побочных эффектов со стороны сердечно-сосудистой системы при приеме данного препарата. В крайне редких случаях тразодон способен увеличить число ЖЭ. Препарату присущ седативный эффект, который при назначении в дневное время может оказаться неприемлемым.
Бупропион является слабым ингибитором обратного захвата норадреналина и дофамина, механизм действия которого до конца неизвестен. Предполагают, что свои антидепрессивные свойства бупропион реализует через стимуляцию выработки катехоламинов. Повышение концентрации норадреналина, как и в случае использования ТЦА, может вызвать повышение АД и увеличение ЧСС. В современной кардиологической практике бупропион не нашел широкого применения.
Проведено двойное слепое перекрестное сравнение бупропиона и имипрамина у 10 больных, имеющих признаки ХСН и депрессии (средний возраст 69 лет) [74]. Авторы оценивали изменения функции ЛЖ и уровня АД. Пациентов рандомизировали для лечения имипрамином при постепенном увеличении дозировки до достижения целевой 3,5 мг/кг/сут на 12-й день приема или для лечения бупропионом, дозировка которого также титровали до достижения 8 мг/кг/сут или максимальной дозировки 450 мг/сут. “Безлекарственный” период перед началом приема каждого из препаратов составил 5 дней. Определяли плазменные концентрации препаратов. На 10-й день исследования авторы установили, что 200 нг/мл является минимальной целевой плазменной концентрацией имипрамина и его метаболита, десметилимипрамина. Также исследовали плазменные концентрации бупропиона и его метаболитов. Однако установить целевые концентрации препарата в плазме крови авторам не удалось. Среднесуточная доза имипрамина составила 197±78 мг (3 мг/кг), бупропиона – 445±16 мг (8,8 мг/кг). Радионуклидную ангиографию выполняли всем больным перед включением в исследование, а также после 3-недельного периода назначения каждого из исследуемых препаратов. Исходная ФВ ЛЖ у 9 из 10 больных составила 31% (19–54%). После назначения каждого из препаратов по данному показателю не было получено различий по сравнению с исходным. У половины больных (5 из 10), получавших имипрамин (средняя суточная дозировка препарата составила 165±74 мг – 2,3 мг/кг, а средняя концентрация в плазме крови – 106±46 нг/мл), развилась тяжелая ортостатическая гипотония, что послужило причиной отмены препарата. Авторы указывают, что у больных, имеющих признаки ХСН и депрессии, использование бупропиона более безопасно по сравнению с имипрамином из-за сравнительно более низкой частоты развития ортостатической гипотонии и отсутствия влияния на функцию ЛЖ.
С использованием бупропиона проведено также 3-недельное исследование у 36 больных, имевших признаки поражения сердца и “большой” депрессии по DSM-III (средний возраст 69±9 лет) [75]. К поражению сердца авторы отнесли: предсуществующую дисфункцию ЛЖ (15 больных), желудочковые нарушения ритма сердца (15 больных), нарушения проводимости (21 больной). Начальная дозировка бупропиона составила 150 мг/сут и постепенно повышалась до 450 мг/сут к 7-му дню исследования. Обследование сердечно-сосудистой системы (АД 3 раза в день, радионуклидная ангиография, регистрация ЭКГ) проводилось исходно и на 7–10-й день лечения бупропионом. У 34 больных, завершивших исследование, не выявлено различий между показателями средней ЧСС за сутки до начала лечения и на фоне приема бупропиона. На терапии бупропионом у больных с исходно тяжелой дисфункцией ЛЖ не наблюдали также изменений его диастолической и систолической функций. Ортостатические колебания АД в течение исследования были незначительными. У больных, имевших нарушения проводимости до включения в исследование, не зарегистрировано их усугубления. Изменения средних величин длительности интервалов PQ (PR) и комплексов QRS также были незначительными. Однако бупропион приводил к достоверному повышению САД и диастолического АД (ДАД) в положении лежа по сравнению с исходными значениями этих показателей (145/ 79±20/9 мм рт.ст. и 140/76±16/7 мм рт. ст. соответственно, р<0,01 для САД и р<0,005 для ДАД). Следует подчеркнуть, что у больных, имевших более 10 ЖЭ в 1 ч исходно, бупропион вызывал достоверное уменьшение их количества (32±40 ЖЭ в 1 ч на фоне лечения бупропионом и 172±134 ЖЭ в 1 ч исходно, р<0,005). Один пациент был исключен из исследования из-за увеличения числа ЖЭ на фоне приема исследуемого препарата. Авторы пришли к заключению о том, что бупропион является безопасным антидепрессантом, использование которого возможно у больных с признаками поражения сердечно-сосудистой системы, но пациентам, страдающим АГ, его следует назначать с осторожностью.
Эффекты бупропиона у больных с ССЗ изучены в минимальном числе исследований с малым объемом выборок. Тем не менее доступные данные позволяют предположить, что использование бупропиона у больных с дисфункцией ЛЖ предпочтительнее, чем применение имипрамина. С особой осторожностью бупропион следует назначать лицам с АГ из-за способности препарата повышать АД. Следует подчеркнуть и тот факт, что исследований этого препарата у больных, страдающих ИБС, не проводили.
Антидепрессанты III поколения
СИОЗС.
СИОЗС подавляют обратный захват серотонина пресинаптическими нервными окончаниями, что приводит к повышению серотонинергической активности в синаптической щели. Серотонин оказывает множество воздействий на сосуды, тромбоциты, проводящую систему сердца. Большинство сердечно-сосудистых побочных эффектов СИОЗС развивается из-за их способности взаимодействовать с другими препаратами, метаболизирующимися в системе цитохрома Р-450 (CYP). Ингибирование CYP может привести к повышению концентрации отдельных антиаритмических препаратов, b-адреноблокаторов, антигистаминных препаратов и антагонистов кальция.
Было установлено, что частота побочных эффектов со стороны сердечно-сосудистой системы при использовании СИОЗС менее 0,0003% [76]. Этот показатель основывается на данных, представленных фармацевтическими компаниями. Однако были описаны и такие побочные сердечно-сосудистые эффекты, как бради- и тахикардия, АВ-блокады и даже летальные исходы при передозировке препаратов этой группы [77–82]. Многочисленные исследования продемонстрировали высокую эффективность СИОЗС у больных без ССЗ. У данной категории больных зарегистрированы минимальные побочные эффекты со стороны сердечно-сосудистой системы. В доступной нам литературе опубликованы результаты нескольких исследований, изучавших применение препаратов данной группы у больных с заболеваниями сердечно-сосудистой системы.
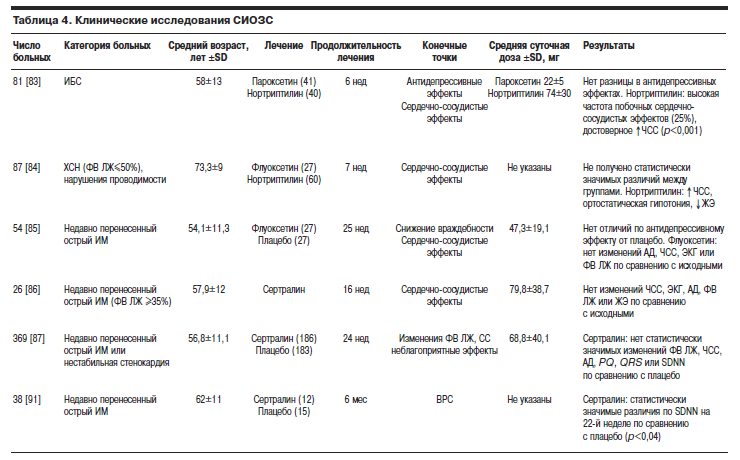
Было проведено двойное слепое рандомизированное 6-недельное исследование, сравнивавшее эффекты СИОЗС пароксетина и нортриптилина у 81 больного, страдавшего ИБС и депрессией (средний возраст 58±13 лет) [83]. Первичной целью данного исследования являлось изучение эффективности и безопасности двух препаратов. Исходные показатели, характеризовавшие степень тяжести депрессии, были одинаковы в обеих группах больных. У 41 пациента применяли пароксетин в дозе 20–30 мг/сут, 40 больных получали нортриптилин (начиная с 25–50 мг/сут с попыткой достичь целевой терапевтической концентрации в плазме крови 50–150 нг/мл). Конечные среднесуточные дозы составили для пароксетина 22±5 мг, для нортриптилина 74±30 мг. В конце 6-й недели исследования различий по антидепрессивной активности между препаратами не выявлено. Прервали лечение 10 (25%) из 40 больных, получавших нортриптилин. У 7 из них развились следующие осложнения: синусовая тахикардия, определяемая как ЧСС 120 уд/мин и более (4 больных), приступы стенокардии и связанные с этим изменения сегмента ST на ЭКГ (1 больной), проаритмия (2 больных). В группе пароксетина 1 пациент прервал лечение из-за развития нестабильной стенокардии. Более того, использование нортриптилина привело к достоверному увеличению ЧСС по сравнению с исходными показателями (83 уд/мин на 6-й неделе и 75 уд/мин исходно, р<0,001). По мнению авторов, оба препарата эффективны как антидепрессанты у больных, страдающих ИБС и депрессией. Они также подчеркнули, что использование пароксетина связано со сравнительно меньшей частотой развития серьезных сердечно-сосудистых событий, чем терапия нортриптилином.
В другом исследовании сравнивали сердечно-сосудистые эффекты флуоксетина и нортриптилина [84]. Флуоксетин назначали 27 больным (средний возраст 73,7±9 лет), в то время как нортриптилин применялся у 60 больных (средний возраст 69,5±9,2 года). У пациентов, принимавших участие в этом исследовании, имела место следующая патология сердца: ХСН (45 больных), нарушения проводимости (62 больных), желудочковые нарушения ритма (49 больных), перенесенный ИМ (47 больных). Начальная дозировка флуоксетина составила 20 мг/сут. Через 2 нед дозировку увеличивали, а на 4-й неделе лечения достигли максимальной – 60 мг/сут. В группе нортриптилина стартовая доза препарата составляла 1 мг/кг/сут, ее титровали до достижения плазменной терапевтической концентрации от 50 до 150 нг/мл (конечные среднесуточные дозировки препаратов авторы не приводят).
Первичными конечными точками исследования являлись изменения ЧСС и ритма сердца, ФВ ЛЖ, интервалов ЭКГ и уровней АД [84]. Достоверных различий в изменениях указанных параметров между группами зарегистрировано не было, но большее число побочных явлений отмечено в группе нортриптилина. На 2-й неделе приема флуоксетина отмечено достоверное урежение ЧСС (78±14 уд/мин исходно и 73±12 уд/мин в конце 2-й недели, р=0,0002) наряду с ростом уровня САД в горизонтальном положении (128±13 мм рт.ст. исходно и 131±14 мм рт.ст. в конце 2-й недели, р=0,02). В конце 2-й недели в группе пациентов, принимавших флуоксетин, отмечено также увеличение ФВ ЛЖ у больных, у которых данный показатель исходно составлял 50% и менее (35±11,1% исходно и 37,4±11,8% в конце 2-й недели, р=0,05). Достоверных различий в длительности интервалов ЭКГ и проявлениях ЖЭА получено не было.
У больных, принимавших нортриптилин, напротив, на 2-й неделе отмечено достоверное увеличение ЧСС и уровня ДАД в положении лежа [84]. ЧСС, исходно составлявшая 75±9 уд/мин, возросла до 82±9 уд/мин (p<0,0001), а ДАД в горизонтальном положении возросло с исходно составлявшего 74±8 мм рт. ст. до 77±8 мм рт. ст. (р=0,0002). В группе нортриптилина также отмечено статистически достоверное снижение САД в положении стоя (127±10 и 120±10 мм рт.ст., р=0,02). Вероятно, это явилось причиной того, что ортостатическое падение АД в группе нортриптилина регистрировали значительно чаще. Ортостатическое падение АД определяли как разницу между уровнями САД в горизонтальном и вертикальном положении. Исходно данный показатель составил 3±10 мм рт.ст. и 11±13 мм рт.ст. в конце 2-й недели (р<0,0001). У больных с исходной ФВ ЛЖ, равной 50% и менее, прием нортриптилина приводил к статистически значимому уменьшению данного показателя (33,1±9,4% исходно и 30,9±10,7% в конце 2-й недели, р=0,04), но при этом ассоциировался с достоверным уменьшением числа ЖЭ за 1 ч (118±105 исходно и 62±63 в конце 2-й недели, р=0,01).
Из 8 пациентов, принимавших флуоксетин и выбывших из исследования, только у 1 развился серьезный побочный эффект – у данного больного произошло достоверное усугубление исходно имевшихся желудочковых нарушений ритма сердца. При этом после прекращения приема препарата нарушения ритма продолжали усугубляться в течение 4 нед.
В группе нортриптилина 15 (25%) больных из 60 не завершили своего участия в исследовании. У 12 из 15 пациентов развились серьезные побочные эффекты: у 4 – ортостатическая гипотония, у 3 – проаритмический эффект, у 2 – острый ИМ, у 2 – АВ-блокада 2:1, у 1 – тяжелая сердечная недостаточность.
Эффекты флуоксетина изучали также в двойном слепом плацебо-контролируемом исследовании у 54 больных, недавно перенесших ИМ и страдающих депрессией (средний возраст 54,1±11,3 года) [85]. В этом 25-недельном исследовании пациенты были рандомизированы для приема 20 мг флуоксетина в сутки или плацебо. Дозировка флуоксетина в зависимости от ответа на проводимую терапию могла быть повышена до 40 мг/сут на 3-й и до 60 мг/сут на 6-й неделях исследования. Антидепрессивный эффект определяли как уменьшение интегрального показателя шкалы Гамильтона на 50% и более. АД измеряли исходно, затем в конце 6, 9 и 25-й недели. Первичной конечной точкой исследования являлось определение изменений показателя шкалы Гамильтона, SCL-90, АД, ЧСС, интервала PQ (PR), комплекса QRS, интервала QTc и ФВ ЛЖ. Достигнутая среднесуточная дозировка флуоксетина составила 47,3±19,1 мг. Антидепрессивный ответ во всех временных точках между группами пациентов, получавших флуоксетин или плацебо, не различался. Достоверное снижение показателей SCL-90 у больных, получавших флуоксетин, отмечают на 25-й неделе исследования. Не получено также статистически значимых различий между значениями ФВ ЛЖ, ЧСС, интервалов PQ (PR), комплекса QRS, QTc, регистрировавшимися как исходно, так и в любой временной точке данного исследования. Частота развития побочных эффектов между группами также не различалась. Авторы пришли к заключению, что применение флуоксетина у больных, недавно перенесших ИМ, в качестве антидепрессанта безопасно.
Эффекты сертралина изучали в многоцентровом открытом пилотном исследовании Sertraline Anti-Depressant Heart Attack Trial (SADHAT) [86]. Сертралин назначали 26 пациентам (средний возраст 57,9±12 лет) по поводу тяжелой депрессии, диагностированной в течение 5–30 дней от момента госпитализации по поводу развития острого ИМ.
В начале исследования сертралин назначали в дозе 50 мг/сут. Спустя 4 нед дозировка препарата могла быть увеличена до 100 мг/сут. Затем с 2-недельными интервалами дозировка препарата могла повышаться на 50 мг/сут до достижения максимальной (200 мг/сут). Однако только у 2 пациентов удалось превысить дозировку сертралина до суточной более 100 мг в конце исследования. Большой депрессивный эпизод диагностировали с использованием структурированного диагностического интервью (Diagnostic Interview Schedule, DIS), модифицированных критериев DSM-IV и опросника Бека для оценки депрессии (Beck Depression Inventory, BDI). Первичными конечными точками исследования являлись оценка эффективности препарата и изменения ЧСС, ЭКГ, АД в горизонтальном и вертикальном положении, ФВ ЛЖ и ЖЭА. Антидепрессивный эффект оценивали с использованием госпитальной шкалы Гамильтона для оценки депрессии, BDI и шкалы общей клинической оценки. Сертралин показал себя эффективным антидепрессантом с хорошей переносимостью больными, перенесшими острый ИМ.
Изучение сертралина было продолжено в рандомизированном двойном слепом плацебо-контролируемом исследовании Sertraline Antidepressant Heart Randomized Trial (SADHART) [87]. Были включены 369 больных (средний возраст 57,1 года) с тяжелой депрессией и коморбидными острым ИМ (294 пациента) или нестабильной стенокардией (75 пациентов). Больным случайным образом назначали сертралин или плацебо. Средняя ФВ ЛЖ в группе сертралина составила 54±10% и в группе плацебо – 52±13%. Первичной конечной точкой исследования явилась оценка изменений ФВ ЛЖ в ходе лечения по сравнению с исходными. Вторичными конечными точками являлись изменения ЧСС, АД, интервалов ЭКГ, частота развития желудочковой тахикардии и сердечно-сосудистых событий (острый ИМ, инсульт, стенокардия высоких функциональных классов, выраженная ХСН, смерть). ВРС оценивали по показателю SDNN (стандартное отклонение в продолжительности интервалов RR между последовательными комплексами синусового ритма) [88]. Этот метод используется для оценки симпатической гиперстимуляции, которая приводит к уменьшению ВРС. В течение первых 2 нед исследования всем пациентам назначали плацебо. Пациентам, рандомизированным к приему сертралина, препарат назначали в дозировке 50 мг/сут. В конце 12-й недели у каждого пациента могла быть достигнута дозировка 200 мг сертралина в сутки (в зависимости от клинического эффекта и переносимости). В случае развития побочных эффектов дозировку на время могли уменьшать на 50 мг/сут. Тем самым достигали приема по крайней мере 50 мг сертралина в сутки. Исследование продолжалось в течение 24 нед. Исходные демографические и клинические характеристики исследуемых групп пациентов были сопоставимы.
В конце 24-недельного периода исследования межу группами больных, получавших сертралин или плацебо, не зарегистрировано достоверных различий в значениях ФВ ЛЖ [87]. Кроме того, также не было получено существенных различий в значениях вторичных конечных точек – ЧСС, АД, длительность интервалов PQ (PR), комплекса QRS, QTc или SDNN. Хотя частота сердечно-сосудистых событий в группе больных, получавших сертралин, по сравнению с группой пациентов, получавших плацебо, была ниже, это различие не носило характер значимого (14,5 и 22,4% соответственно). Авторы приходят к выводу, что использование сертралина не только эффективно в отношении воздействия на депрессию, но и безопасно у больных с острым ИМ или нестабильной стенокардией. Очевидно, что в будущем для оценки влияния сертралина на летальность у больных данных категорий требуется проведение более масштабных исследований.
Доказано, что в течение года после острого ИМ сниженная ВРС является независимым предиктором смертности [89]. Доказан тот факт, что больные с депрессией, развившейся вслед за острым ИМ, имеют более выраженную дисфункцию автономной нервной системы. Это подтверждается более низкими значениями ВРС по сравнению с таковыми больных без депрессии [90]. Исследователи рандомизировали 38 пациентов с депрессией и недавно перенесенным острым ИМ (средний возраст 62±11 лет) для приема 50 мг сертралина в сутки или плацебо в течение 6 мес [91]. Считалось, что у пациентов имелась депрессия, если показатель стандартизованного опросника для диагностики депрессии (standardized Inventory to Diagnose Depression, sIDD) составлял более 15 баллов. Опрос проводили за 2 нед до выписки или в течение 2 нед от момента развития острого ИМ. Критериями исключения являлись: мерцательная аритмия, ЖЭ (более 100 в 1 ч), тяжелая сердечная недостаточность, жизнеугрожающие сопутствующие заболевания, неспособность заполнить опросник и использование антидепрессантов перед включением в исследование. Группой сравнения были 11 пациентов соответствующего возраста в стабильном состоянии после острого ИМ, показатель sIDD которых был ниже 15, что расценивалось как “нормальная” частота восстановления автономной функции сердца. Первичной целью исследования являлось определение влияния сертралина на темпы восстановления автономной функции сердца у больных, перенесших острый ИМ в недавнем прошлом (о вегетативной функции судили по показателю SDNN). Значения sIDD в группе больных, получавших сертралин и плацебо, были сопоставимы (21±6,7 и 23±6,4 соответственно). Не отмечено различий в исходных показателях SDNN между указанными группами пациентов (111±10 и 102±7 мс). Для сравнения следует отметить, что показатель SDNN в группе больных без признаков депрессии составлял 107±9 мс. Однако на 22-й неделе лечения в группе больных, получавших сертралин, отмечено увеличение значения SDNN со 111±10 мс до 115,4±11 мс, тогда как в группе получавших плацебо, напротив, отмечалось уменьшение этого показателя со 102±7 мс до 86,1±10 мс. Различие в значениях SDNN между группами было статистически достоверным (р<0,04). Более того, различия в частоте восстановления автономной функции сердца между двумя группами также оказались достоверными (p<0,05). Авторы пришли к заключению, что применение сертралина ускоряет восстановление SDNN у больных, недавно перенесших острый ИМ. Они также предположили, что препарат способен оказывать влияние на отдаленные результаты.
В доступной литературе опубликованы сведения о том, что у больных, страдающих депрессией, повышена активность тромбоцитов по сравнению с таковой у больных без признаков депрессии [92, 93]. Также опубликованы данные о способности СИОЗС влиять на функцию тромбоцитов [94]. Однако до сих пор нет ответа на вопрос, какие именно воздействия оказывают препараты этой группы на активность тромбоцитов, тромбоз и прогредиентное течение ИБС [95, 96].
Таким образом, результаты клинических исследований СИОЗС показали, что они более безопасны, чем ТЦА, у больных с различными заболеваниями сердечно-сосудистой системы: ИБС, нарушениями проводимости и дисфункцией ЛЖ. В этих же исследованиях было также продемонстрировано, что использование СИОЗС не сопровождается развитием ортостатической гипотонии, что препараты этой группы обладают минимальным влиянием на проводимость сердца и практически не влияют на сократительную функцию ЛЖ. По сравнению с плацебо сертралин зарекомендовал себя как безопасный и эффективный препарат для лечения депрессии у больных с острым ИМ или нестабильной стенокардией.
В табл. 4 представлено сравнение клинических исследований СИОЗС.
Значительный интерес представляют результаты первого российского многоцентрового проспективного исследования КООРДИНАТА (Клинико-эпидемиолОгическая прОграмма изучения депРессии в карДиологической практИке: у больНых Артериальной гиперТонией и ишемической болезнью сердцА), целью которого являлось изучение частоты тревожной и депрессивной симптоматики у больных АГ и ИБС, а также ее влияния на кардиоваскулярный прогноз [15, 97]. Исследование было начато в 2004 г. В исследовании приняли участие более 3000 больных ИБС и более 1500 больных АГ; 99% больных ИБС страдали АГ. Согласно полученным результатам частота тревожной и депрессивной симптоматики составила 30 и 38% у больных АГ и ИБС соответственно. Терапевтическая часть исследования была посвящена применению селективного стимулятора обратного захвата серотонина (ССОЗС) – тианептина – у описанной категории больных. Из числа больных, прошедших первичное обследование, каждому врачу предлагалось включить в терапевтическую часть программы 2 пациентов с АГ и/или ИБС. При этом первому пациенту тианептин назначали в дополнение к стандартной терапии ССЗ, а второй пациент продолжал получать только соматотропную терапию (контрольная группа). По клинико-социодемографическим показателям группы были сопоставимы. Тианептин назначали в дозе 25–37,5 мг/сут в зависимости от возраста пациента. Шестинедельная терапия тианептином сопровождалась снижением интегрального показателя по шкале депрессии HADS на 36% (с 13,1±2,75 до 8,43±3,64, р<0,0001). В контрольной группе также произошло снижение среднего суммарного значения данного показателя (с 13,15±2,65 до 11,79±3,31), но менее выраженное, чем в группе тианептина (р<0,001).
Кроме того, назначение тианептина обеспечивало лучший контроль САД. Так, к концу периода лечения уровень САД в основной группе был достоверно ниже, чем в контрольной группе (140,6±15,3 и 146,0±16,7 мм рт. ст. соответственно, р<0,01).
В исследовании также оценивали переносимость назначенного лечения. Так, переносимость терапии оценили как “отличную” и “хорошую” 71,4% больных основной и только 45,6% больных контрольной группы (p<0,001) как “удовлетворительную” – 27 и 49,7% (р<0,001) и “неудовлетворительную” – 1,6 и 4,7% (р=0,12) соответственно. Следует заметить, что отмена тианептина потребовалась только в 2 случаях, а корректировка его дозы – в 6. В группе соматотропной терапии лечение было отменено в 10 случаях, а корректировку доз препаратов проводили в 4 случаях. Более подробно результаты терапевтической части исследования представлены в работе Е.И.Чазова и соавт. (2005 г.) [97].
Обсуждение и выводы
У больных, страдающих депрессией в сочетании с ХСН, ИБС, недавно перенесших острый ИМ, повышен риск ВСС. В настоящее время оценка признанных факторов риска и лечение депрессии у данной категории пациентов постепенно становится обязательными условиями подхода к терапии. Группу риска по развитию осложнений антидепрессивной терапии составляют больные с подтвержденной ИБС, ХСН, нарушениями проводимости, недавно перенесенным острый ИМ и постуральной гипотонией. Перед назначением любого антидепрессанта следует тщательно взвешивать соотношение “риск:польза”. При выборе антидепрессанта клиницистам следует тщательно оценивать вид и тяжесть поражения сердца, вид и тяжесть депрессивного расстройства, знать профиль побочных эффектов каждого препарата и, самое главное – владеть результатами клинических исследований по данному препарату.
В настоящее время доказано, что лечение депрессии с помощью ТЦА у больных ИБС, ХСН, перенесших острый ИМ, относительно безопасно в течение короткого периода времени. Однако длительное применение препаратов этой группы полностью не изучено. Как известно, ортостатическая гипотония является серьезным побочным эффектом ТЦА. Ее развитие чаще связано с назначением третичного амина (имипрамин), нежели с назначением вторичного амина (нортриптилин). У пациентов с предсуществующим постуральным снижением САД на 10–15 мм рт. ст. частота развития ортостатической гипотонии выше, а следовательно, в этих случаях ТЦА необходимо применять крайне осторожно или не использовать вовсе. Больные, получающие постоянную антигипертензивную терапию, также составляют группу риска по развитию ортостатической гипотонии.
Антидепрессанты II поколения тразодон и бупропион изучены в небольших клинических исследованиях. Тразодон продемонстрировал низкую частоту развития ортостатической гипотонии и практически полное отсутствие влияния на электрическую активность сердца. Основным лимитирующим фактором его приема является выраженная седация в течение дня. У больных с нарушениями проводимости сердца, систолической дисфункцией ЛЖ в качестве безопасной альтернативы может служить бупропион. Однако если у больного исходно имеется АГ, предпочтение следует отдавать препаратам других групп. Для оценки влияния бупропиона на заболеваемость и смертность у больных ИБС необходимо проведение дальнейших исследований и сравнение его с вновь синтезируемыми лекарственными средствами.
В настоящее время СИОЗС считают самыми безопасными антидепрессантами. В отличие от ТЦА СИОЗС развитие ортостатической гипотонии не свойственно. При назначении СИОЗС не наблюдается также появления нарушений проводимости сердца, как это регистрируется при использовании ТЦА и препаратов других групп. Сравнение СИОЗС с антидепрессантами других групп позволит выяснить безопасность этих препаратов у больных с ССЗ. Кроме того, проведение дальнейших исследований необходимо для выяснения влияний СИОЗС на функцию тромбоцитов.
Несмотря на ограниченность имеющихся данных, представляется возможным дать некоторые рекомендации по выбору антидепрессантов для пациентов с заболеваниями сердечно-сосудистой системы. В целом больным ИБС без ИМ в анамнезе назначение пароксетина или сертралина представляется безопасным. У пациентов, перенесших острый ИМ, предпочтение следует отдавать флуоксетину или сертралину. Назначение сертралина даже более предпочтительно за счет лучшего профиля побочных эффектов. Для изучения влияния этих препаратов на уровень летальности у данной категории больных необходимо проведение дальнейших исследований. Пациентам с ХСН могут быть назначены флуоксетин или сертралин. Однако и у этой категории больных назначение сертралина предпочтительнее из-за отсутствия влияния на ФВ ЛЖ.
Сертралин повышает ВРС, но не доказано, что этот эффект приводит к снижению смертности больных, недавно перенесших острый ИМ. Учитывая профили побочных эффектов и возможные взаимодействия с другими лекарственными препаратами, можно сделать заключение, что пароксетин, флуоксетин и сертралин могут считаться самыми безопасными антидепрессантами с точки зрения их использования у пациентов с заболеваниями сердечно-сосудистой системы.
Применение тианептина в дополнение к стандартной терапии АГ и ИБС позволяет корректировать тревожно-депрессивный статус пациентов, обеспечивает улучшение переносимости кардиотропной терапии, улучшение контроля САД и безопасно. Однако, по всей вероятности, для более всестороннего изучения эффектов единственного представителя группы ССОЗС – тианептина – потребуется проведение многоцентровых двойных слепых исследований, в том числе и для сравнения его эффектов с “эталонными” препаратами.
Результаты приведенных исследований наглядно продемонстрировали, что депрессивные расстройства per se являются независимым фактором риска развития ИБС и острого ИМ в частности, а вторичные депрессии утяжеляют течение соматического заболевания, неизбежно приводя к росту уровня смертности. Следовательно, как можно более раннее начало терапии депрессий может способствовать снижению частоты развития ССЗ, включая ИБС и связанных с ней событий.
Список исп. литературыСкрыть список1. Смулевич А.Б., Сыркин А.Л., Дробижев М.Ю., Иванов С.В. Психокардиология. М.: Медицинское информационное агентство, 2005.
2. Kessler RC, McGonagle KA, Zhao S et al. Lifetime and 12-month prevalence of DSM-III-R psychiatric disorders in the United States: results from the National Comorbidity Survey. Arch Gen Psychiat 1994; 51: 8–19.
3. Blazer DG, Kessler RC, McGonagle KA, Swartz MS. The prevalence and distribution of major depression in a national community sample: the National Comorbidity Survey. Am J Psychiat 1994; 151: 979–86.
4. The American Psychiatric Association. Mood disorders. The diagnostic and statistical manual of mental disorders, 4th ed, Washington, DC: American Psychiatric Association. 1994; 317–91.
5. Benowitz NL. Antihypertensive agents. Basic and clinical Pharmacology, 8th ed. B.G.Katzung, ed. New York: Lange Medical Books/McGraw-Hill, 2001; 155–80.
6. Akiskal HS. Mood disorders: introduction and overview. Kaplan&Sadock’s comprehensive textbook of psychiatry, 7th ed. B.J. Sadock and V.A., eds. Philadelphia: Lipincott Williams & Wilkins, 2000; 1284–440.
7. Stahl SM. Depression and bipolar disorders. Neuroscientific basis and practical application, 2nd ed. Cambridge: Cambridge University Press, 2000; 135–97.
8. Krishnan KR, Delong M, Kraemer H et al Comorbidity of depression with other medical diseases in elderly. Biol. Psychiatry. 2002; 52: 559–88.
9. Jiang W, Alexander J, Christopher E et al. Relationship of depression to increased risk of mortality and rehospitalization in patients with congestive heart failure. Arch Intern Med 2001; 161: 1849–56.
10. Ariyo A, Haan M, Tangen C et al. Depressive symptoms and risks of coronary heart disease and mortality in elderly Americans. Afor the Cardiovascular Health Study Collaborative Research Group. Circulation 2000; 102: 1773–9.
11. Frasure-Smith N, Lesperance F, Talajic M. Depression and 18-month prognosis after myocardial infarction. Circulation 1995; 91: 999–1005.
12. Schleifer S, Macari-Hinson M, Coyle D et al. The nature and course of depression following myocardial infarction. Arch Intern Med 1989; 149: 1785–9.
13. Carney R, Rich M, teVelde A et al. Prevalence of major depressive disorder in patients receiving b-blocker therapy versus other medications Am J Med 1987; 83: 223–6.
14. Zuccala G, Cocchi A, Carbonin P. The impact of depression on self-perceived health status J Am Geriatr Soc 1995; 43: 198–9.
15. Чазов Е.И., Оганов Р.Г., Погосова Г.В. и др. Клинико-эпидемиологическая программа изучения депрессии в кардиологической практике: у больных артериальной гипертонией и ишемической болезнью сердца (КООРДИНАТА): результаты многоцентрового исследования. Кардиология. 2007; 3: 28–37.
16. van den Brink R, van Melle J, Honig A et al.Treatment of depression after myocardial infarction and the effects on cardiac prognosis and quality of life: rationale and outline of the myocardial infarction and depression-intervention trial (MIND-IT) Am Heart J 2002; 144: 219–25.
17. Rozanski A, Blumenthal J, Kaplan J. Impact of psychological factors on the pathogenesis of cardiovascular disease and implications for therapy. Circulation 1999; 99: 2192–217.
18. Sesso H, Kawachi I, Vokonas P, Sparrow D. Depression and the risk of coronary heart disease in the normative aging study. Am J Cardiol 1998; 82: 851–6.
19. Ferketich A, Schwartzbaum J, Frid D, Moeschberger M. Depression as an antecedent to heart disease among women and men in the NHANES I study Arch Intern Med 2000; 160: 1261–8.
20. Roose S, Dalack G, Woodring S. Death, depression, and heart disease J Clin Psychiatr 1991; 52 (suppl.): 34–9.
21. Sullivan M, LaCroix A, Russo J et al. Depression in coronary heart disease: what is the appropriate diagnostic threshold? Psychosomatics 1999; 40: 286–92.
22. Ford D, Meal L, Chang P et al. Depression as a risk factor for coronary artery disease in men: the precursors study. Arch Intern Med 1998; 158: 1422–6.
23. Creed F. The importance of depression following myocardial infarction. Heart 1999; 82: 406–8.
24. Cohen H, Gibson G, Alderman M. Excess risk of myocardial infarction in patients treated with antidepressant medications: association with use of tricyclic agents. Am J Med 2000; 108: 2–8.
25. Lapane K, Zierler S, Lasater T et al. Is the use of psychotropic drugs associated with increased risk of ischemic heart disease? Epidemiology 1995; 6: 376–81.
26. Yusuf S. Howken S, Ounpuu S, on behalf of the INTERHEART Study Investigators Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet 2004; 364: 937–52.
27. Association of psychosocial risk factors with risk of acute myocardial infarction in 11119 cases and 13648 controls from 52 countries (the INTERHEART study): case-control study. A. Rosengren, S. Hawken, S. Ounpuu et al. Lancet 2004; 364: 953–62.
28. Ballenger J, Davidson J, Lecrubier Y et al. and the International Consensus Group on Depression and Anxiety. Consensus statement on depression, anxiety, and cardiovascular disease. J Clin Psychiatry 2001;62 (suppl. 8): 24–7.
29. Havranek E, Ware M, Lowes B. Prevalence of depression in congestive heart failure. Am J Cardiol 1999; 84: 348–50.
30. Murberg T, Bru E, Aarsland T, Svebak S. Functional status and depression among men and women with congestive heart failure. Int J Psychiatry Med 1998; 28: 273–91.
31. Koenig H. Depression in hospitalized older patients with congestive heart failure. Gen Hosp Psychiatry 1998; 20: 29–43.
32. Fraticelli A. Congestive heart failure in the elderly requiring hospital admission. Arch Gerontol. Geriatr 1996; 23: 225–38.
33. Krumholz H, Butler J, Miller J et al. Prognostic importance of emotional support for elderly patients hospitalized with heart failure. Circulation 1998; 97: 958–64.
34. Frasure-Smith N, Lesperance F. Depression following myocardial infarction: impact on 6-month survival. JAMA 1993; 270 (15): 1819–25.
35. Carney R, Rich M, teVelde A et al. Major depressive disorder in coronary artery disease. Am J Cardiol 1987; 60: 1273–5.
36. McKhann G, Borowicz L, Goldborough M et al. Depression and cognitive decline after coronary artery bypass grafting. Lancet 1997; 349: 1282–4.
37. Con A, Linden W, Thompson J, Ignaszewski A. The psychology of men and women recovering from coronary artery bypass surgery. J Cardiopulmonary Rehabil 1999; 19: 152–61.
38. Carney R, Freedland K, Rich M et al. Ventricular tachycardia and psychiatric depression in patients with coronary artery disease. Am J Med 1993; 95: 23–8.
39. Скворцов К.Ю., Головачева Т.В. Эффективность тофизопама (грандаксина) в лечении ИБС: клинико-инструментальное подтверждение. Клиническая фармакология и терапия 2001; 1: 52–5.
40. Panina G, Knot U, Nunziata E et al. Assessment of autonomic tone over a 24-hour period in patients with congestive heart failure. Am Heart J 1995; 129: 748–53.
41. Klingenheben T, Rapp U, Hohnloser S. Circadian variation of heart rate variability in postinfarction patients with and without life-threatening ventricular tachyarrhythmias. J Cardiovasc Electrophysiol 1995; 6: 357–64.
42. Shusterman V, Aysin B, Weiss R et al. Dynamics of low-frequency R-R interval oscillations preceding spontaneous ventricular tachycardia. Am Heart J 2000; 139: 126–33.
43. Lown B., Verrier R, Rabinowitz S. Neural and psychological mechanisms and the problem of sudden cardiac death. Am J Cardiol 1977; 39: 890–2.
44. Reich P, DeSilva R, Lown B, Murawski B. Acute psychological disturbances preceding life-threatening ventricular arrhythmias. JAMA 1981; 246: 233–5.
45. Brodsy M, Sato D, Iseri L et al. Ventricular tachycardia associated with psychological stress: the role of sympathetic nervous system. JAMA 1987; 257: 2064–7.
46. Peters R, McQuillan S, Resnik S, Gold M. Increased Monday incidence of life-threatening ventricular arrhythmias: experience with a third-generation implantable defibrillator. Circulation 1996; 94: 1346–9.
47. Lehofer M, Moser M, Hoehn-Saric R et al. Major depression and cardiac autonomic control. Biol Psychiatry 1997; 42: 914–9.
48. Golino P, Piscione F, Willerson J. Divergent effects of serotonin on coronary-artery dimensions and blood flow in patients with coronary atherosclerosis and control patients. N Engl J Med 1991; 324:641–8.
49. Vikenes K, Farstad M, Nordrehaug J. Serotonin is associated with coronary artery disease and cardiac events. Circulation 1999; 100: 483–9.
50. Harrigan R, Brady W. ECG abnormalities in tricyclic antidepressant ingestion. Am J Med 2000; 108: 2–8.
51. Giardina E, Johnson L, Vita J et al. Effect of imipramine and notriptyline on left ventricular function and blood pressure in patients treated for arrhythmias. Am Heart J 1985; 109: 992–8.
52. Giardina E, Barnard T, Johnson L et al. The antiarrhythmic effect of nortriptyline in cardiac patients with ventricular premature depolarizations. J Am Coll Cardiol 1986; 7: 1363–9.
53. Giardina E, Cooper T, Suckow R, Saroff A. Cardiovascular effects of doxepine in cardiac patients with ventricular arrhythmias. Clin Pharmacol Ther 1987; 42: 20–7.
54. Jo S, Youm J, Lee C et al. Blockade of the HERG human cardiac K(+) channel by the antidepressant drug amitriptyl. Br J Pharmacol 2000; 129: 1474–80.
55. Teschemacher A, Seward E, Hancox J, Witchel H. Inhibition of the current of heterologously expressed HERG potassium channels by imipramine and amitriptyline. Br J Pharmacol 1999; 128: 479–85.
56. Feenstra J, Grobbee D, Remme W, Stricker B. Drug-induced heart failure. J Am Coll Cardiol 1999; 33: 1152–62.
57. Veith R, Raskind M, Barnes R et al. Tricyclic antidepressants and supine, standing, and exercise plasma norepinephrine. Clin Pharmacol Ther 1983; 33: 763–9.
58. Glassman A, Bigger J Jr, Giardina E et al.Clinical characteristics of imipramine-induced orthostatic hypotension. Lancet 1979; 1 (8114): 468–72.
59. Ruberman W, Weinblatt E, Goldberg J et al. Ventricular premature beats and mortality after myocardial infarction. N Engl J Med 1977; 297: 750–7.
60. Effects of encainide, flecainide, imipramine and moricizine on ventricular arrhythmias during the year after acute myocardial infarction: the CAPS. The Cardiac Arrhythmia Pilot Study (CAPS) Investigators. Am J Cardiol 1988; 61: 501–9.
61. Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. The Cardiac Arrhythmia Suppression Trial (CAST) Investigators. N Engl J Med 1989; 321: 406–12.
62. Mortality and morbidity in patients receiving encainide, flecainide, or placebo. The CAST Investigators. N Engl J Med 1991; 324: 781–8.
63. Effects of the antiarrythmic agent moricizine on survival after myocardial infarction. The CAST II Investigators. N Engl J Med 1992; 327: 227–33.
64. Roose S, Glassman A. Antidepressant choice in the patient with cardiac disease: lessons from the cardiac arrhythmias suppression trial (CAST) studies. J Clin Psychiatry 1994; 55 (suppl. A): 83–7.
65. Raskind M, Veith R, Barnes R, Gumbrecht G. Cardiovascular and antidepressant effects of imipramine in the treatment of secondary depression in patients with ischemic heart disease. Am J Psychiatry 1982; 139: 1114–7.
66. Veith R, Raskind M, Caidwell J et al. Cardiovascular effects of tricyclic antidepressants in depressed patients with chronic heart disease. N Engl J Med 1982; 306: 954–9.
67. Glassman A, Johnson L, Giardina E et al. The use of imipramine in depressed patients with congestive heart failure. JAMA 1983; 250: 1997–2001.
68. Roose S, Glassman A, Giardina E et al. Nortriptyline in depressed patients with left ventricular impairment. JAMA 1986; 256: 3253–7.
69. Roose S, Glassman A, Giardina E et al. Tricyclic antidepressants in depressed patients with cardiac conduction disease. Arch Gen Psychiatry 1987; 44: 273–5.
70. Dietch J, Fine M. The effect of nortriptyline in elderly patients with cardiac conduction disease. J Clin Psychiatry 1990; 51: 57–5.
71. Cohn J, Wilcox C, Goodman L. Antidepressant efficacy and safety of trimipramine in patients with mild heart disease. Clin. Ther 1993; 15: 114–26.
72. Himmelhoch J, Schechtman K, Auchenbach R. The role of trazodone in the treatment of depressed cardiac patients. Psychopathology 1984; 17 (suppl. 2): 51–63.
73. Janowsky D, Curtis G, Zissook S et al. Ventricular arrhythmias possibly aggravated by trazodone. Am J Psychiatry 1983; 140: 796–7.
74. Roose S, Glassman A, Giardina E et al. Cardiovascular effects of imipramine and bupropion in depressed patients with congestive heart failure. J Clin Psychopharmacology 1987; 7: 247–51.
75. Roose S, Dallack G, Glassman A et al. Cardiovascular effects of bupropion in depressed patients with heart disease. Am J Psychiatry 1991; 148: 512–6.
76. Sheline Y, Freedland K, Carney R. How safe are serotonin reuptake inhibitors for depression in patients with coronary heart disease? Am J Med 1997; 102: 54–9.
77. Isbister G, Prior F, Foy A. Citalopram-induced bradycardia and presyncope. Ann Pharmacother 2001; 35: 1552–5.
78. Catalano G, Catalano M, Epstein M, Tsambiras P. QTc interval prolongation associated with citalopram overdose: a case report and literature review. Clin. Neuropharacol 2001; 24: 158–62.
79. Neely J. Tonic clonic seizures and tachycardia induced by fluoxetine overdose. W V Med J 1998; 94: 283–5.
80. Gaudins A, Vossler C, Wang R. Fluoxetine-induced cardiotoxicity with response to bicarbonate therapy. Am J Emerg Med 1997; 15: 501–3.
81. McAnally L. Threlkeld K, Dreyling C. Case report of a syncopal episode associated with fluoxetine. Ann Pharmacother 1992; 26: 1090–1.
82. Spier S, Frontera M. Unexpected deaths in depressed medical inpatients treated with fluoxetine. J Clin Psychiatry 1991; 52: 377–82.
83. Roose S, Laghrissi-Thode F, Kennedy J et al. Comparison of paroxetine and nortriptyline in depressed patients with ischemic heart disease. JAMA 1998; 279: 287–91.
84. Roose S, Glassman A, Attia E et al. Cardiovascular effects of fluoxetine in depressed patients with heart disease. Am J Psychiatry 1998; 155: 660–5.
85. Strik J, Honig A, Lousberg R et al.Efficacy and safety of fluoxetine in the treatment of patients with major depression after first myocardial infarction: findings from a double-blind, placebo-controlled trial. Psycosom Med 2000; 62: 783–9.
86. Shapiro A, Lesperance F, Frasure-Smith N et al. An open-label preliminary trial of sertraline for treatment of major depression after acute myocardial infarction (the SADHAT trial). Am Heart J 1999; 137: 1100–6.
87. Glassman A, O\'Connor C, Califf R et al. Sertraline treatment of major depression in patients with acute MI or unstable angina (the SADHART trial). JAMA 2002; 288: 701–9.
88. Stys A, Stys T. Current clinical application of heart rate variability. Clin Cardiol 1998; 21: 719–24.
89. Kleiger R, Miller J, Bigger J Jr., Moss A. Decreased heart rate variability and its association with mortality after myocardial infarction. Am J Cardiol 1987; 59: 256–62.
90. Carney R, Blumenthal J, Stein P et al. Depression, heart rate variability, and acute myocardial infarction. Circulation 2001; 104: 2024–8.
91. McFariane A, Kamath K, Fallen E et al. Effect of sertraline on recovery rate of cardiac autonomic function in depressed patients after acute myocardial infarction. Am Heart J 2001; 142: 617–23.
92. Laghrissi-Thode F, Wagner W, Pollock B et al. Elevated platelet factor 4 and b-thromboglobulin plasma levels in depressed ischemic heart disease. Biol. Psychiatry 1997; 42: 290–5.
93. Musselman D, Tomer A, Manatunga A et al.Exaggerated platelet reactivity in major depression. Am J Psychiatry 1996; 153: 1313–17.
94. Pollock B, Laghrissi-Thode F, Wagner W. Evaluation of platelet activation in depressed patients with ischemic heart disease after paroxetine or nortriptyline treatment. J Clin Psychopharmacol 2000; 20: 137–40.
95. Nair G, Gurbel P, O\'Connor C et al. Depression, coronary events, platelet inhibition, and serotonin reuptake inhibitors. Am J Cardiol 1999; 84: 321–3.
96. Pratt L, Ford D, Crum R et al. Depression, psychotropic medication, and risk of myocardial infarction. Circulation 1996; 94: 3123–9.
97. Чазов Е.И., Оганов Р.Г., Погосова Г.В. и др. Клинико-эпидемиологическая программа изучения депрессии в кардиологической практике: у больных артериальной гипертонией и ишемической болезнью сердца (КООРДИНАТА): первые результаты многоцентрового исследования. Кардиология. 2005; 11: 4–11.


