Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№03 2013
Психические расстройства в практике невролога (обзор) №03 2013
Номера страниц в выпуске:27-35
Современные клинические и эпидемиологические исследования, проведенные с использованием информативных баз данных и экспертных систем, показали актуальность изучения соотношения неврологических заболеваний и психических расстройств на основе интегративного подхода. Всестороннее взаимодействие – принципиальное требование современной нейропсихиатрии, обеспечивающее надежность диагностики, прогноза и терапии психопатологических расстройств, наблюдающихся в неврологической практике.
Резюме. В обзоре литературы приведены данные о бремени психических расстройств в неврологической практике, общей распространенности и распределении психических расстройств среди неврологических пациентов. Рассмотрены сложности классификации и диагностики психических расстройств в неврологической практике и возможные пути их решения. В качестве серьезной медицинской проблемы выделены неврологические заболевания (эпилепсия, болезнь Паркинсона, рассеянный склероз, инсульт головного мозга, болезнь Гентингтона), при которых коморбидные психические расстройства оказывают наиболее значимое негативное влияние на течение основного заболевания.
Ключевые слова: эпилепсия, болезнь Паркинсона, рассеянный склероз, инсульт головного мозга, болезнь Гентингтона.
Psychiatric disorders in neurological setting: a review
A.V.Andryushchenko, D.F.Pushkarev
I.M.Sechenov First Moscow State Medical University
Summary. The paper reviews the data on the burden of psychiatric disorders in neurological setting, their prevalence and ratio. The differences of neurological and psychiatric approaches to brain disorders are considered along with ensuing conceptual and diagnostical difficulties. Finally the authors examine the clinical features and prevalence of psychiatric disorders comorbid to some important neurological diseases: epilepsy, Parkinson disease, multiple sclerosis, stroke, and Huntington disease. The data reviewed suggests necessity of the dialogue intensification between psychiatry and neurology, which are detached out of date.
Key words: epilepsy, Parkinson disease, multiple sclerosis, stroke, and Huntington disease.
Введение
Современные клинические и эпидемиологические исследования, проведенные с использованием информативных баз данных и экспертных систем, показали актуальность изучения соотношения неврологических заболеваний и психических расстройств на основе интегративного подхода. Всестороннее взаимодействие – принципиальное требование современной нейропсихиатрии, обеспечивающее надежность диагностики, прогноза и терапии психопатологических расстройств, наблюдающихся в неврологической практике.
В России стратегия развития психиатрии и неврологии (наука, образование, клиническая практика) заявлена на 2 из 14 основных научных платформ, разработанных до 2025 г. ведущими специалистами и рекомендованных Минздравом России и Минобром России. Соответственно, создаются условия для поиска оптимального междисциплинарного взаимодействия психиатрии и неврологии между собой, а также с другими базисными для развития медицины направлениями.
Бремя психических заболеваний
По мировым прогнозам, тяжесть бремени аффективной патологии, занимающая одну из первых позиций по целому ряду показателей, продолжает расти (L.Kessing, 1999; van den Weg, 1999; M.Tarrants, 2011). К этим показателям приближены общие затраты здравоохранения стран Евросоюза на заболевания головного мозга, связанные с деменцией, психозами, тревожными расстройствами. Существенными следует считать и более низкие расходы, связанные с сочетанием неврологической патологии (черепно-мозговая травма, рассеянный склероз, болезнь Паркинсона, эпилепсия) с психической (хронические боли, расстройства сна, расстройства личности). Немаловажно отметить, что у пациентов с функциональными неврологическими симптомами отмечаются относительно высокий уровень бремени болезни и низкое качество жизни, ассоциированные с инвалидизацией и усилением болезненных проявлений дистресса по мере хронификации состояния (A.Carson, 2000).
Изучение коморбидных неврологической патологии психических расстройств выявило много факторов, негативно влияющих на показатели бремени болезни, среди которых особое место в плане последствий для больного и общества отводится депрессии. В частности, коморбидность депрессии и рассеянного склероза ухудшает нейропсихическое функционирование по целому ряду параметров: сравнительно с больными без коморбидной депрессии у этого контингента выявляются значимое снижение когнитивного функционирования, нарушения работоспособности и социальных связей (семья, органы социальной поддержки), а также снижение комплаентности и приверженности неврологическому лечению. В результате снижается сравнительная интегральная оценка качества жизни и долгосрочного прогноза неврологического заболевания (Goldman consensus group, 2005).
Коморбидные болезни Паркинсона широко распространенные депрессии, как показали современные исследования (D.Weintraub и соавт., 2004; M.Visser и соавт., 2008), являются инвалидизирующим фактором, снижающим качество жизни даже в большей степени, чем собственно двигательные нарушения. Выполненное в Шотландии (Эдинбург) сравнительное исследование A.Carson (2000 г.) пациентов с психической патологией и без нее показало, что такие показатели качества жизни, как физическое, социальное, ролевое функционирование и телесная боль, статистически достоверно (p<0,0005) ниже среди неврологических пациентов с психическими (тревожными и аффективными) нарушениями.
Одним из важных показателей, отражающих тяжесть бремени болезни, является суицидальный риск; наиболее высокие значения этого показателя, по данным литературы, регистрируются при рассеянном склерозе, хорее Гентингтона, травмах головного и спинного мозга, височной эпилепсии, упорном болевом синдроме (E.Stenager и соавт., 1992; E.Harris и соавт., B.Barraclough, 1994; H.Chochinov и соавт., 1995; D.Fishbain и соавт., 1991, 1999; Y.Conwell и соавт., 1995, 2000; L.Nilsson и соавт., 2002; V.Rafnsson и соавт., 2001; T.Fukuchi и соавт., 2002; D.Arciniegas, C.Anderson, 2002; M.Waern и соавт., 2002).
При оценке непрямых затрат, учитывающих показатели своевременности диагностики и рациональности лечения психических расстройств, коморбидных неврологическим заболеваниям, показано, что даже легко распознаваемая психометрически депрессия часто остается недиагностированной, а применяемая терапия – неадекватной (D.Mohr и соавт., 2006). Так, К.Bridges и D.Goldberg (1984 г.) установили, что при обследовании неврологами психическая патология у 72% больных не выявляется.
По данным обзора P.Fink и соавт. (2003 г.), неврологи распознают лишь 14–40% случаев психических расстройств, верифицированных затем психиатрами, причем уже на момент консультации невролога 16,9% получают психофармакотерапию, а 4,6% имеют направление на консультацию к психиатру. По мнению автора, неврологи достаточно редко направляют пациентов к психиатру и даже доля тех, у которых они выявляют «клинически значимые психические нарушения», составляет всего 1,5%. Врачи общей практики и неврологи более склонны рекомендовать консультацию психиатра только в случае, если жалобы пациента имеют характер соматически необъяснимых или констатируется острый психоз с психомоторным возбуждением (A.Carson, 2000). Соответственно, редко назначается и адекватное лечение психотропными средствами.
Данные о желании пациентов получить консультацию психиатра выявляют следующую тенденцию: 58% пациентов неврологической клиники с диагностированным позднее психическим расстройством намеревались обсудить с врачом отклонения своего настроения, тогда как среди пациентов без психических расстройств их оказалось 50% (K.Bridges, D.Goldberg, 1984). В условиях дефицита информации пациенты редко спонтанно высказывают желание психокоррекционного вмешательства. P.Fink и соавт. (2003 г.) отмечают, что в выборке A.Carson и соавт. (2000 г.) зарегистрированы лишь 11% страдающих аффективными расстройствами пациентов неврологической клиники, подтверждающих, что они возможно нуждаются в помощи специалистов, практикующих в области психического здоровья.
Эпидемиология психических нарушений (соматоформные расстройства, хронические головные боли, ятрогении) в первичной сети и неврологической практике (эпилепсия, инсульт, болезнь Паркинсона, рассеянный склероз, хорея Гентингтона)
Уже через 10 лет от начала первых исследований, посвященных психическим расстройствам в неврологической практике (1970-е годы), стала очевидной необходимость применения статистически верифицированных диагностических критериев. Соответственно, если в ранних работах зарубежных авторов (C.Kirk, 1977, 1979) для обозначения патологии, не обнаруживавшей органической природы, использовался термин «психическое заболевание» (распространенность этой патологии среди амбулаторных неврологических больных оценивалась в пределах 13–30%), то использование первых психометрических опросников позволило выявить существенные расхождения статистических показателей (C.Kirk, 1979; J. De Paulo, 1980; K.Bridges, 1984).
При совместном неврологическом и психиатрическом обследовании 93 женщин неврологического стационара в 34% наблюдений были обнаружены клинически очерченные психические расстройства, причем наиболее частым диагнозом была депрессия, а общая распространенность психических расстройств среди пациентов неврологического стационара в изученной выборке оказалась сопоставимой с показателем, рассчитанным для пациентов клиник иного соматического профиля (C.Kirk, 1977; Metcalfe, 1988). T.Lempert и соавт. (1990 г.) в результате изучения репрезентативной выборки (4470 пациентов, госпитализированных в неврологический стационар) показали, что в 9% случаев госпитализация была связана с психическими расстройствами.
В РФ в 1997 и 2003 гг. проведены два широкомасштабных эпидемиологических исследования «Один день многопрофильной больницы» и КОМПАС, в рамках которых обследовались (осмотрены неврологами 23,2% пациентов) стационарные и амбулаторные больные. По данным первого из цитированных исследований, частота психических нарушений в неврологическом отделении по расчетам психиатров-экспертов составила в совокупности 30%, а второго – только для расстройств аффективного спектра (депрессии, смешанные тревожно-депрессивные расстройства, расстройства адаптации, дистимии, расстройства сна) этот показатель составил 47,4%.
Наиболее высокие значения показателя распространенности депрессий зарегистрированы при паркинсонизме, последствиях острого нарушения мозгового кровообращения, рассеянном склерозе, болезни Альцгеймера, что соответствует данным литературы. Экспертами отмечено, что при квалификации соматизированной симптоматики, связанной с депрессиями, часто устанавливаются ошибочные неврологические диагнозы (дисциркуляторная энцефалопатия, вертебро-базилярная недостаточность, остеохондроз позвоночника, мигрень, нейроциркуляторная дистония). При экспертной психиатрической оценке установлено, что у пациентов с диагнозом «нейроциркуляторная дистония» достоверно чаще, чем при диагностике неврологами, встречаются невротические/соматоформные (44% vs 8%; p=0,00001) и аффективные расстройства (19% vs 6%; p=0,00001), а также психопатологические нарушения шизофренического спектра (11% vs 5%; p=0,005).
Кроме того, у этих пациентов экспертами были чаще диагностированы расстройства адаптации (27% vs 16%) и синдром зависимости от психоактивных веществ (8% vs 3%). Оценка потребности в психотропных средствах в городской многопрофильной больнице позволила выявить, что, если в среднем на 1 пациента требуется 0,8 условных единиц психотропного препарата, то в отделениях неврологического профиля этот показатель был наиболее высоким по сравнению с другими профильными отделениями (кардиологическим, пульмонологическим, ревматологическим, нефрологическим, отоларингологическим и др.) – 1,5.
В исследование P.Fink и соавт. (2003 г.) были включены 198 пациентов (63,5% женщин, 46,4% мужчин), впервые обратившихся к неврологу. Диагноз по Международной классификации болезней 10-го пересмотра (МКБ-10) устанавливался посредством интервью SCAN (Schedules for Clinical Assessment in Neuropsychiatry). Общая распространенность психических расстройств на момент обследования составила 55,1% (95% доверительный интервал – ДИ 46,2–63,8), что превышает значения, приводимые в более ранних публикациях (34–47%)1; распространенность в течение жизни – 65,0% (95% ДИ 56,1–73,0). Наиболее частыми диагнозами в цитируемой работе оказались (по мере убывания) соматоформные (33,8%; 95% ДИ 25,9–42,7), фобические (21,8%; 95% ДИ 15,3–30,0), аддиктивные (13,3%; 95% ДИ 8,3–20,6) расстройства, а также депрессия и дистимия (14,4%; 95% ДИ 9,1–21,8). По данным Hansen и соавт. (2001 г.), полученным в исследовании с аналогичным дизайном, распространенность психических расстройств в контингенте обращающихся к неврологу ниже (39%), что, по мнению P.Fink (2003 г.), связано с гендерными и возрастными различиями.
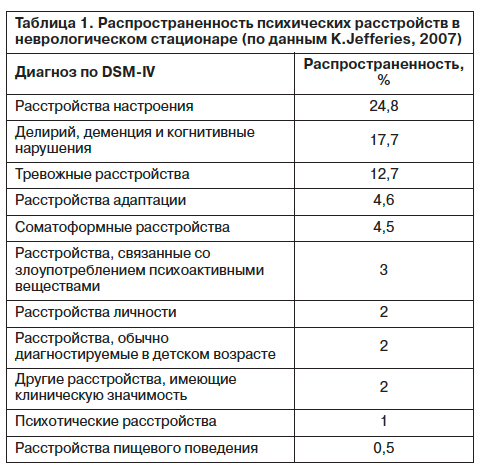
В более позднем исследовании K.Jefferies и соавт. (2007 г.) выборку составили поступившие в неврологический стационар 265 больных (57,4% женщин, 42,6% мужчин; возрастной диапазон 18–91 год, средний возраст 54,5 года), из них в окончательный анализ включены 197 (74%), полностью обследованных экспертами (табл. 1). Установлено, что 44% пациентов обратились к неврологу с целью диагностики, а 56% уже имели верифицированный неврологический диагноз. Клинически завершенные психические расстройства, диагностированные по критериям DSM-IV, выявлялись с такой же частотой, что и в работе Р.Fink (2003 г.), – у 51,3% (ДИ 44–58%), при этом у 18,7% сосуществовали два, а у 5,1% – три синдромальных диагноза. Корреляций, связанных с полом, возрастом и установленным ранее неврологическим диагнозом, не обнаружено.
В настоящее время особую актуальность приобретает проблема соматизированных психических расстройств, протекающих с неврологическими «масками». Последние, с точки зрения неврологов, относятся к так называемым необъяснимым симптомам, выявляемым у 5% вновь поступивших в клинику двигательных неврологических расстройств пациентов (M.Thomas, 2004). Причем симптоматика, обозначаемая этим термином, примерно у 1/2 пациентов подвержена спонтанным ремиссиям (A.Carson и соавт., 2003). В цитированном исследовании A.Carson и соавт. (2000 г.) из 300 вновь обратившихся амбулаторно к неврологу пациентов у 47% выявлены тревожные или депрессивные расстройства, диагностированные по критериям DSM-IV; «большая депрессия» оказалась наиболее распространенной (27%). При анализе соотношения неврологической патологии с психической установлено, что у 11% пациентов клинические проявления «ни в коей степени не объясняются неврологической патологией», а у 19% «объясняются в некоторой степени»; у 70% выявлена неврологическая патология, при которой у большинства (43%) психопатологическая симптоматика «полностью объясняется неврологической».
Следует отметить, что в литературе представлены данные о сравнительно высокой распространенности так называемой функциональной слабости: 4–5 случаев на 100 тыс. населения в год (M.Binzer и соавт., 1997; M.Binzer, G.Kullgren, 1998), этот показатель среди вновь обратившихся за неврологической помощью пациентов приближается к 1,5% (M.Binzer и соавт., 1997; J.Stone и соавт., 2009), а среди пациентов неврологического стационара – к 2% (I.Parry и соавт., 2006).
При развитии неврологической патологии (черепно-мозговая травма, болезни Альцгеймера, Гентингтона, Коновалова–Вильсона, нейроонкопатология, инсульт, рассеянный склероз, сложные парциальные припадки, нейросифилис) могут усугубляться характерологические расстройства, в частности истерические (конверсионные и диссоциативные) и одноименные изменения личности.
Одной из серьезных проблем до сих пор являются трудности сопоставления результатов клинико-эпидемиологических исследований, проводимых неврологами и психиатрами раздельно. Эта ситуация мало чем отличается от положения в психосоматической медицине в целом, когда классификационные подходы не столько отражают реальную ситуацию, сколько позицию разработчиков. Неврологи часто рассматривают отдельные психопатологические симптомы и синдромы (апатия, хроническая усталость, хронические боли, когнитивные нарушения, эмоциональная лабильность и др.) вне контекста клинических единиц, принятых в психиатрии. Результатом классификационных, терминологических и семантических разногласий при взгляде на одну и ту же проблему оказывается размывание границ нозологических категорий, когда симптоматика болезни трудно поддается определению и верификации.
Эпилепсия
Несмотря на многолетние исследования эпилепсии, многие вопросы, связанные с распространенностью психических и поведенческих нарушений (включая когнитивные и патохарактерологические) и их соотношением с пароксизмальными расстройствами и знаками органического поражения головного мозга, остаются спорными. Психические расстройства, развивающиеся при эпилепсии без четкой зависимости от частоты пароксизмов, могут длительно (у 60% больных в течение года) не распознаваться (A.Kanner, 2008).
По А.И.Болдыреву (1984 г.), среди психических расстройств, выявляемых в начальной стадии эпилепсии (из 600 наблюдений без психических нарушений – 14%), регистрируются: нарушения сна (54%), астенические расстройства (44%), заторможенность (19%), патохарактерологические изменения (6%), навязчивости (3%), депрессии (2%), истерические расстройства (2,3%), психозы – делириозные, параноидные, сумеречные, онейроидные, маниакальные с галлюцинациями (1,7%). По данным C.Cullum и M.Weiner (2011 г.), частота психотических нарушений при эпилепсии может достигать 50%, при этом их условно разделяют на первичные и вторичные (лекарственные/фармакогенные).
Как социально стигматизирующее заболевание, эпилепсия сопровождается тревожно-депрессивными реакциями, но наиболее частой формой аффективной патологии является рекуррентная депрессия, выявляемая примерно у 25% пациентов (A.Kanner, 2003). В более поздней работе A.Kanner (2005 г.) отмечает некоторые общие механизмы эпилепсии и депрессии, связывая их с постепенно нарастающими атрофическими процессами и ухудшением серотонинергической трансмиссии рецепторов височных и лобных отделов.
Депрессии, проявляющиеся в продромальном (преиктальном) периоде пароксизмальной активности, могут приближаться по длительности (свыше 2 нед) к депрессивному эпизоду и включать витальные симптомы (степень витализации аффекта коррелирует с локализацией патологического очага). При этом многие авторы констатируют высокую частоту психических расстройств при эпилепсии в связи с локализацией очага в височной области и гиппокампе. Для височной эпилепсии характерна аура – приступы иктальной тревожной депрессии или соматизированного страха, отличные от эндогенных и непосредственно связанные с активностью эпилептогенного очага. Постприступная (постиктальная) депрессия вариабельна по проявлениям (при этом преобладает астеническая симптоматика) и длительности. Выявляются также эндоморфные типы с тоскливо-дисфорическим или дисфорическим аффектом (угрюмость, вспышки агрессии, застревание на обидах, конфликтах и пр.), сопоставимые по длительности (до нескольких лет) с дистимией (D.Blumer, 1995; W.Lishman, 2001). В приступе, а также продромальном и межприступном периодах могут отмечаться кратковременные (несколько ч/сут) эпизоды эйфории/гипомании. Тревожные расстройства при эпилепсии могут иметь форму панических атак с агорафобией.
Отмечая личностные особенности у больных эпилепсией, одни эксперты выявляют у них конституциональные эпилептоидные черты (подчеркнутая аккуратность, экономность, раболепность, угодливость, слащавость), а также шизоидные (склонность к мечтательности, резонерству) и психастенические (повышенная мнительность, неуверенность в себе), другие склоняются к высокой вероятности патологического развития личности (эксплозивность, импульсивность, раздражительность, аффективная лабильность, вязкость, склонность к навязчивым идеям, патологическая религиозность), обусловленного неврологической патологией.
Обсуждаемые ниже формы психической патологии предпочтительны, как известно, для пожилого возраста. Эпидемиологической характеристике этой патологии уместно предпослать информацию, полученную в результате впервые проведенного в РФ сотрудниками отдела по изучению геронтологической психиатрии ФГБУ НЦПЗ РАМН (Я.Б.Калын, 2001; С.И.Гаврилова, Я.Б.Калын, 2002). Показатели болезненности определены посредством сплошного клинико-эпидемиологического населения пожилого и старческого возраста, проживающего на ограниченной территории Москвы.
Явные психические нарушения разного уровня и нозологической принадлежности (без учета условно патологических состояний) выявлены у 36,6% обследованных, в том числе у 6,1% – психозы и состояния органического слабоумия. Психическая патология непсихотического уровня, включающая инициальные проявления собственно возрастных церебральных процессов, латентные и мягкие формы эндогенных заболеваний
(а также длительные ремиссии при этой патологии), диагностирована у 30,5% обследованных.
Болезнь Паркинсона
Распространенное (17 случаев на 100 тыс. населения) неврологическое расстройство, сопровождающееся широким спектром когнитивных, психотических и аффективных нарушений.
Распространенность депрессий при этой нозологии составляет 40–50% (А.М.Вейн и соавт., 2002), а по данным зарубежных авторов (S.Starkstein и соавт., 2008; J.Slaughter и соавт., 2001; V.Tumas и соавт., 2008), может достигать 90%. Многие авторы считают депрессию почти постоянным спутником заболевания наряду с характерными психомоторными и постепенно проявляющимися когнитивными нарушениями. Высокую частоту депрессии на нейробиологическом уровне связывают с вторичной дисфункцией передних отделов мозга, ассоциированной с поражением дофаминергических нейронов экстрапирамидной системы в области базальных ганглиев.
Необходимо отметить, что клиническую и психометрическую диагностику депрессии существенно затрудняет то обстоятельство, что целый ряд депрессивных симптомов перекрывается с основными проявлениями паркинсонизма (моторное торможение, дефицит внимания, нарушения сна, снижение массы тела, эректильная дисфункция, бедность мимики, снижение громкости голоса, утомляемость, тревога за здоровье).
В качестве значимого негативно воздействующего фактора выделяется нозогенное воздействие неврологической болезни, сопряженной с психосоциальными трудностями, в частности утратой подвижности в трудоспособном возрасте и прогрессированием когнитивных нарушений при частичной критике к ним. Нозогенные депрессии представлены сравнительно равномерно: «большая» (по критериям DSM-IV-TR) – 17–31% пациентов, «малая» – у 25–40% (E.Tandberg и соавт., 1996; L.Marsh и соавт., 2006; S.Starkstein и соавт., 2008; J.Reijinders и соавт., 2008; Zahodne и соавт., 2012). Отмечается атипия клинической картины: преобладание симптомов, реализующихся в соматической сфере, и когнитивных нарушений над сравнительно незначительной выраженностью собственно аффективных феноменов, включая идеи вины и суицидальные мысли (U.Ehrt и соавт., 2006; A.Gotham и соавт., 1986).
Особой характеристикой таких депрессий является брадифрения (замедление темпа мышления, скорости реакций, снижение произвольной и общей активности), определяющаяся соотношением присущей паркинсонизму психомоторной заторможенности и заторможенности собственно депрессивной. Колебания аффективного фона могут быть также связаны с изменением состояния в ответ на прием антипаркинсонического препарата леводопы.
В исследовании L.Zahodne и соавт. (2012 г.), выполненном на выборке 95 пациентов с болезнью Паркинсона, депрессия выявлена у 27 (28,4%) пациентов.
В структуре гипотимии наблюдались следующие проявления: ангедония – 12 (44%) наблюдений, снижение аппетита (59%), нарушения сна (81%), психомоторное возбуждение/торможение (4%), утомляемость (93%), чувство вины или собственной малоценности (56%), нарушения концентрации внимания или нерешительность (85%), суицидальные мысли (19%). Отмечена также высокая частота апатии, выявляемой как у пациентов с коморбидной болезни Паркинсона депрессией (85%), так и при отсутствии аффективной патологии (31%).
Этот результат соотносится с данными других исследований, согласно которым распространенность апатии при болезни Паркинсона достигает 70% и прежде всего при наличии коморбидной депрессии (A.Leentjens и соавт., 2008).
В исследовании Oguru и соавт. (2010 г.) представлена попытка установить статистические соотношения между депрессией, апатией и деменцией в выборке 150 пациентов с болезнью Паркинсона. По результатам данной работы апатия выявляется у 60%, а депрессия – в 56% случаев. При этом апатия в отсутствие депрессии регистрируется в 17% наблюдений, а депрессия в отсутствие апатии – в 13%. У 12 (8%) пациентов диагностирована деменция. Апатия без коморбидных психических нарушений зарегистрирована у 23 (15%) больных, депрессия –
у 18 (12%) больных. Деменция во всех наблюдениях сопровождалась коморбидными расстройствами.
Отмечается два «пика» возникновения депрессии: в дебюте – 12–20% всех случаев болезни Паркинсона (Н.Н.Яхно, 2010) и на поздних стадиях болезни (А.М.Вейн и соавт., 2002; Н.Н.Яхно, 2010; G.Fenelon, 2008). Считается, что депрессия ускоряет или усугубляет течение двигательной и когнитивной патологии. Следует также отметить, что на фоне стандартного для паркинсонизма лечения, уменьшающего двигательные нарушения, клинически развернутая депрессия может сохраняться.
Несмотря на сравнительно небольшую тяжесть депрессивной симптоматики по сравнению с психиатрической клиникой, в ряде исследований с высокой степенью статистической достоверности показано, что депрессия – важнейший фактор, определяющий качество жизни пациентов с болезнью Паркинсона, более значимый, чем собственно двигательные нарушения (A.Schrag и соавт., 2000; D.Gallagher и соавт., 2010; S.Naismith и соавт., 2010).
Сложности при оценке психопатологических нарушений при паркинсонизме привносит также тревога (В.Н.Краснов, 2011), возникающая, как правило, на более поздних этапах течения болезни и отчасти связанная с тяжестью моторных симптомов. Психотические расстройства, возникающие, как правило, либо в рамках побочных эффектов дофаминомиметических препаратов, либо в структуре делирия, у пациентов с болезнью Паркинсона без деменции отмечаются в 7–14% наблюдений и в 29–54% – при наличии коморбидной деменции (A.Carson и соавт., 2007).
Рассеянный склероз
По данным специальных исследований и систематических обзоров среди больных рассеянным склерозом наиболее широко распространены непсихотические психические нарушения, в частности депрессивные и тревожные, а также хроническая усталость (астения) и когнитивные расстройства (K.Jefferies, 2006). Оценки распространенности этих расстройств варьируют, что может быть связано с различиями в дизайне исследований, используемых оценочных инструментов и неоднозначности классификационных границ между этими нарушениями (L.Chwastiak и соавт., 2002; A.Janssens и соавт., 2006; Y.Suh и соавт., 2010; Wood и соавт., 2012).
Депрессия рассматривается как наиболее распространенное психическое расстройство, выявляемое у 40–50% больных на разных этапах развития болезни (S.Minden и соавт., 1987; R.Schiffer, H.Babigian, 1984; M.Wallin и соавт., 2006). В проспективном исследовании B.Wood и соавт. (2012 г.) показано, что распространенность депрессивной патологии при рассеянном склерозе постепенно возрастает и с каждым годом болезни соответствующий показатель повышается в среднем на 7,3%. Оценки риска расстройств депрессивного спектра в течение жизни также довольно высоки и уступают лишь показателям, рассчитанным для паркинсонизма, – 42–60% (R.Joffe и соавт., 1987; S.Minden и соавт., 1990; D.Schubert, R.Foliart, 1993; S.Patten, L.Metz, 1997; A.Sadovnick и соавт., 1991; A.Sadovnick и соавт., 1996; A.Feinstein, K.Feinstein, 2001; A.Feinstein, 2004).
В более ранних исследованиях отмечалось, что депрессии при рассеянном склерозе формируются не только при тяжелых, но и при мягких формах неврологического заболевания (M.Sullivan и соавт., 1995a; M.Sullivan и соавт., 1995b). В работах последнего десятилетия высказывается предположение, что высокая частота депрессий объясняется включением в изучаемые выборки пациентов, получающих неврологическое лечение, а соответственно, нельзя исключить, что с учетом тех больных, у которых заболевание протекает благоприятно и не требует обращения за помощью, этот показатель оказался бы существенно ниже (R.Siegert, D.Abernethy, 2005).
Так, по результатам популяционного исследования (выборка из 115 071 пациента), S.Patten и соавт. (2003 г.) оценивают годичную (12-месячную) распространенность большой депрессии среди больных рассеянным склерозом в возрасте 18–45 лет на уровне 25,7% (в населении – 8,9%). В других работах (L.Chwastiak и соавт., 2001; Y.Suh и соавт., 2010; B.Wood и соавт., 2012) приводится более низкий показатель распространенности этой формы (10–18,5%), хотя отдельные «клинически значимые депрессивные симптомы» выявляются у 42% больных.
Проводятся исследования, учитывающие корреляции депрессивной симптоматики с тяжестью неврологических нарушений (A.Moller и соавт., 1994), а также характер течения аффективной патологии. Отмечена тенденция депрессий при рассеянном склерозе к безремиссионному (или с малым числом спонтанных ремиссий) течению и хронификации (D.Mohr, D.Goodkin, 1999).
Изучение ятрогенных воздействий показало, что неврологическая терапия может являться фактором, провоцирующим развитие аффективной патологии. Длительное применение кортикостероидов, используемых для лечения рассеянного склероза, ассоциируется с возникновением или усугублением депрессивной симптоматики (S.Patten и соавт., 1996). В литературе представлены также данные о манифестации депрессивных проявлений и повышении суицидального риска при проведении терапии интерфероном b, 1b (J.Avasarala и соавт., 2003; J.Aikens, 1999).
Депрессия, коморбидная рассеянному склерозу, – один из важнейших факторов, влияющих на качество жизни пациентов (V.Janardhan, R.Bakshi, 2002; A.Janssens и соавт., 2003; I.Lobentanz и соавт., 2004; S.D’Alisa и соавт., 2006), усугубляющий связанные с неврологической патологией когнитивные нарушения (P.Arnett, 1999), ухудшающий социальные взаимоотношения (C.Maybury, 1984), снижающий комплаентность (D.Mohr и соавт., 1997). В числе психологических детерминант развития депрессии исследователи отмечают неопределенность прогноза рассеянного склероза, неадекватные стратегии совладания, беспомощность (отсутствие контроля над течением болезни) (A.Feinstein, 2007). В целом роль психосоциальных факторов в возникновении депрессии оценивается на уровне 40%, несколько уступая значению регистрируемых параметров демиелинизации (A.Feinstein, 2011).
Самостоятельный аспект проблемы депрессий при рассеянном склерозе – связь с суицидальным риском, по эпидемиологическим данным (A.Sadovnick и соавт., 1991), в 7 раз превышающим популяционные значения. По наблюдениям A.Feinstein (1997, 2002 гг.), около 1/4 больных в течение жизни обдумывают суицид, а частота завершенных суицидов расценивается как «чрезвычайно высокая» (E.Stenager и соавт., 1992, 1996). Результаты «психологической аутопсии» свидетельствует, что суицид может быть причиной смерти для 15% пациентов клиник рассеянного склероза. Чаще всего суицид совершают молодые мужчины с катамнезом заболевания до 5 лет (E.Stenager и соавт., 1992). В качестве наиболее важного фактора суицидального риска рассматриваются умеренная и тяжелая депрессии, социальная изоляция и злоупотребление алкоголем (A.Feinstein, 1997, 2002). Завершенному суициду может предшествовать серия суицидальных попыток, ассоциированных с резким ухудшением/экзацербацией демиелинизирующего процесса (E.Stenager и соавт., 1996), хотя большинство суицидальных попыток с фатальным исходом совершается пациентами с патологией умеренной тяжести (Goldman consensus group, 2005).
Не менее значимый фактор суицидального риска – коморбидная депрессии тревога, повышающая соответствующий показатель до 46,0% против 18,9% при «чистой» депрессии, формирующейся у больных рассеянным склерозом (A.Feinstein, P.O’Connor и соавт., 1999; M.Korostil, A.Feinstein, 2007).
По данным S.Donnchadha и соавт. (2013 г.), полученным при помощи модифицированного опросника тревоги Бека (modified Beck Anxiety Inventory – mBAI), тревожные симптомы (более 7 баллов) выявляются у 51,2%, а выраженная тревожная симптоматика (более 15 баллов) – у 24,3% пациентов с рассеянным склерозом. Распространенность тревожных расстройств в течение жизни при рассеянном склерозе оценивается в пределах 36–40% (популяционный показатель – 25%) (R.Kessler и соавт., 1994; M.Korostil, A.Feinstein, 2007; G.Galeazzi и соавт., 2005). На момент обследования тревожные расстройства диагностируются у 14% пациентов (M.Korostil, A.Feinstein, 2007). Приведенные данные соотносятся с представлениями о распространенности расстройств тревожного спектра среди пациентов с хронической соматической патологией (K.Wells и соавт., 1988). В отношении других неврологических заболеваний указанные значения распространенности тревожных расстройств превышают таковые для эпилепсии (A.Jacoby и соавт., 1996), но несколько уступают 40%, приводимым для пациентов с болезнью Паркинсона (S.Starkstein и соавт., 1993).
Представленность расстройств тревожного спектра при рассеянном склерозе в течение жизни и на момент обследования распределяется следующим образом: генерализованное тревожное расстройство (ГТР) – 18,6 и 10,0%, изолированные фобии – 10,8 и 2,8%, паническое расстройство – 10,0 и 2,1%, обсессивно-компульсивное расстройство – 8,6 и 5,7%, социальная фобия – 7,8 и 2,1% соответственно (M.Korostil, A.Feinstein, 2007).
S. Di Legge и соавт. (2003 г.) в рамках проспективного исследования отмечают наибольшую выраженность тревожной симптоматики непосредственно после установления диагноза рассеянного склероза, с постепенной редукцией тревоги с течением времени. В проспективных исследованиях A.Giordano и соавт. (2011 г.) и Wood и соавт. (2012 г.) также регистрируется снижение выраженности тревожной симптоматики по мере течения заболевания, особенно среди женщин. В свете этого факта авторы высказывают предположение, что тревожные нарушения, развивающиеся, как правило, в ответ на информацию о тяжелой инвалидизирующей болезни с неясным прогнозом, имеют преимущественно нозогенный характер.
Согласно представленным в литературе данным 60–92% больных рассеянным склерозом жалуются на повышенную утомляемость (fatigue), а 30–55% пациентов называют хроническую усталость наиболее значимым симптомом своей болезни (J.Iriarte и соавт., 2000; B.Wood и соавт., 2012).
При формализованной оценке (шкала тяжести утомляемости – Fatigue severity scale, FSS) распространенность умеренной астенической симптоматики (свыше граничного значения в 4 балла) оценивается в 70,8%, а клинически выраженной (свыше 5 баллов) – в 53,7% больных (B.Wood и соавт., 2012). При этом значимо чаще (отношение шансов 1,29; p<0,001) утомляемость возникает у мужчин.
Опубликованные исследования не позволяют выявить жестких связей между утомляемостью и депрессией при рассеянном склерозе (L.Krupp, 1988, 1989).
Не коррелировала астения и с неврологически обусловленными нарушениями функционирования (в оценке по Expanded Disability Status Scale). При изучении выборки (139 пациентов с рассеянным склерозом) (C.Schwartz и соавт., 1996) обнаружили достоверную, но слабую (r=0,17) корреляцию между выраженностью астении и средним баллом по шкале депрессии. Группа голландских авторов также рассматривает утомляемость как распространенный и значимый симптом, который, однако, не ассоциирован с выраженностью депрессии или нарушениями функционирования (J.Vercoulen и соавт., 1996). В ряде исследований указывается на необходимость дальнейшего научного поиска в этом направлении (J.Vercoulen и соавт., 1996; K.Schreurs и соавт., 2002; R.Bakshi и соавт., 2000; S. van der Werf и соавт., 2003; W.Woss и соавт., 2002). По наблюдениям H.Ford и соавт. (1998 г.), депрессия более значимо коррелирует с психической утомляемостью (r=0,54; p<0,0001), чем с физической (r=0,31; p<0,01).
Вопросы коморбидности тревоги, депрессии и астении у больных рассеянным склерозом подробно рассмотрены в проспективном исследовании B.Wood и соавт. (2012 г.), выполненном на выборке из 198 пациентов. Тревожные и астенические проявления представляют собой самостоятельные категории и могут возникать в том числе и вне контекста депрессии, депрессия в 88,9% наблюдений (а при нетяжелых функциональных неврологических нарушениях – балл EDSS<3,0 во всех случаях) сопровождается тревогой и/или патологической утомляемостью. При этом представленность психопатологических проявлений меняется с течением времени: редуцируется тревожная симптоматика и нарастает выраженность депрессивных нарушений.
Среди пациентов с рассеянным склерозом выявляются (J.Fischer и соавт., 1994) когнитивные нарушения, хотя менее выраженные, чем при других ослабоумливающих заболеваниях (например, болезни Альцгеймера).
Психотические расстройства при рассеянном склерозе представлены отдельными казуистическими случаями (Davison, Bagley, 1969; Mathews, 1979; Awad, 1983). В частности, по данным A.Feinstein (1992 г.), за 6 лет работы специализированной клиники рассеянного склероза было зарегистрировано всего 10 случаев психоза. В клинической картине преобладают психотические расстройства с персекуторным бредом, сопровождающиеся ажитацией или дисфорией, тогда как галлюцинаторные/псевдогаллюцинаторные расстройства, а также нарушения сознания встречаются реже (A.Feinstein и соавт., 1992).
Инсульт
Распространенность инсульта, по данным Oxford Community Stroke Project (Bamford и соавт., 1988), составляет 2 на 1 тыс. населения (для первого инсульта).
В РФ ежегодно регистрируется более 1 млн жителей, перенесших инсульт, 15–30% признаются ограниченно трудоспособными, а 40% – инвалидами I или II группы (В.И.Скворцова и соавт., 2009). В числе неблагоприятных последствий инсульта рассматривается возникновение широкого спектра психических расстройств (от делирия и деменции до импульсивных расстройств и навязчивостей).
Делирий развивается у 30–40% пациентов в течение недели после инсульта, что связывают с ухудшением прогноза, повышением длительности госпитализаций и риска развития деменции (A.Carson и соавт., 2007).
Другие психотические расстройства, в частности психотическая мания, также выявляемые в постинсультном периоде (S.Starkstein и соавт., 1987), рассматриваются в ассоциации с правосторонним поражением головного мозга (J.Cummings, M.Mendez, 1984). В качестве факторов риска выделяются пожилой возраст и наличие дегенеративного заболевания центральной нервной системы (S.Starkstein, 1998). При этом распространенность этой патологии остается неизученной (А.Carson и соавт., 2007).
Постинсультная деменция выявляется обычно через
3 мес после сосудистой катастрофы приблизительно у 1/4 больных; анозогнозия с частичным или полным непониманием неврологического дефицита может сопровождаться депрессивной симптоматикой (S.Starkstein и соавт., 1990).
Апатия у больных, перенесших инсульт, на современном уровне знаний рассматривается как самостоятельный клинический синдром и ассоциируется со снижением активности во фронтальной и переднетемпоральной областях мозга (S.Starkstein и соавт., 1993).
Постинсультная депрессия2 развивается примерно у 1/3 пациентов (показатели частоты расстройства варьируют в диапазоне 17–52% в зависимости от периода проведения эпидемиологического среза) и чаще манифестирует спустя 6 мес – 2 года после инсульта (H.Rickards, 2005). Так, по данным проспективного исследования М.А.Савиной (2006 г.), выполненного в отделе по изучению геронтологической психиатрии ФГБУ НЦПЗ РАМН под руководством профессора В.А.Концевого, на протяжении 12 мес после перенесенного инсульта депрессивные расстройства выявляются у 34% больных. К факторам риска развития депрессии относят сравнительно молодой возраст (по данным М.А.Савиной, в среднем 65 лет – нижняя граница пожилого возраста по МКБ-10; Квинн, 2000), наличие когнитивных нарушений, расстройства сна, социального функционирования, депрессии в анамнезе, женский пол
(у мужчин выявлена корреляция с уровнем образования и степенью утраты социально-профессиональной активности), отсутствие социальной поддержки. В течение 2 лет после инсульта риск депрессии повышается в 6 раз, а в условиях такой коморбидности за 3 года на 10% возрастают показатели риска смерти вследствие повторного инсульта, инфаркта миокарда, осложнений сахарного диабета, атеросклероза, агрегации тромбоцитов и пр. (L.Williams и соавт., 2004).
Большинство эпидемиологических исследований свидетельствуют о связи между значительным нарушением функционирования после инсульта (Herrmann и соавт., 1995; Pohjasvaara и соавт., 2001) и высокой частотой возникновения депрессии.
Оценки распространенности тревожных расстройств среди больных, перенесших инсульт, варьируют в пределах 4–28% в зависимости от их оценки в качестве самостоятельной категории либо – симптомов депрессивного расстройства (Astrom, 1996). По данным P.Burvill и соавт. (1995 г.), катамнестически обследовавших выборку (294 наблюдения) выживших после инсульта пациентов (длительность катамнеза – 12 мес), распространенность тревожных расстройств составила 12% для мужчин и 28% для женщин. Агорафобия выявлена у 9% мужчин и у 26% женщин, ГТР – по 2% соответственно.
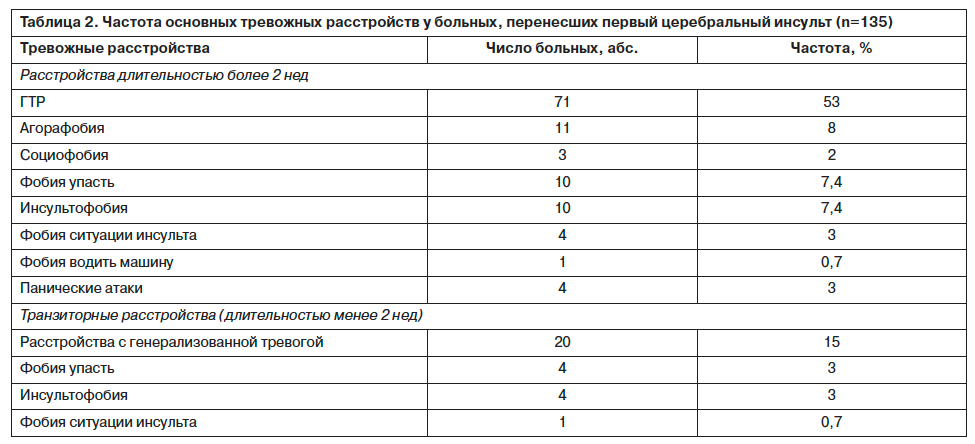
Долевое распределение отдельных типов тревожных расстройств (как развернутых, так и субсиндромальных) у больных, перенесших первый церебральный инсульт за 6 мес до момента обследования, приведена в работе М.А.Савиной и И.А.Серпуховитиной (2009 г.); табл. 2.
Эмоциональная лабильность часто наблюдается в острой фазе инсульта, но может иметь и отставленный дебют (Berthier и соавт., 1996). Выражаемые пациентом эмоции при этом нарушении не соответствуют его общему психическому состоянию. В настоящее время точно не установлено, существует ли связь между депрессией и эмоциональной лабильностью, но оба расстройства могут возникать как одновременно, так и каждое в отдельности (House и соавт., 1989; Robinson и соавт., 1993). Нарушения функционирования лобных долей головного мозга вследствие инсульта могут быть причиной снижения эмпатии, бестактности, снижения инициативности и спонтанности, ребяческого поведения, сексуальной расторможенности и бедности эмоциональной экспрессии (Carota и соавт., 2002).
Хорея Гентингтона
Депрессия, распространенность которой составляет на момент обследования 30–40%, а в течение жизни до 60% (A.Rosenblatt и соавт., 2007), – одно из облигатных коморбидных расстройств этого наследственного прогрессирующего нейродегенеративного заболевания. Аффективные расстройства (депрессии мрачно-угрюмые, дисфорически раздражительные, ипохондрические, вялоапатические) впервые проявляются в продромальном периоде и на ранних этапах заболевания, иногда за несколько лет опережая манифестацию хореотических гиперкинезов (С.Гаврилова, 2011). Такие депрессии в 4–6 раз повышают риск суицидов сравнительно со средне-популяционными показателями.
Как правило, хореотический гиперкинез предшествует интеллектуальному снижению (общее оскудение психической деятельности, психической и речевой активности, эмоциональное притупление, расстройства памяти и ориентировки) и психотическим расстройствам. По данным Э.Я.Штернберга (1967 г.), психозы выявляются у 60% больных хореей Гентингтона и представлены на инициальных этапах бредовыми расстройствами, включая малоразработанные, паранойяльные идеи ревности, преследования или отравления, а на более поздних – галлюцинаторно-параноидными синдромами или нелепым бредом величия.
Примечания
1Этот факт может отчасти объясняться тем обстоятельством, что категория «Соматоформные расстройства» впервые выделена в МКБ-10, действующей в качестве диагностического инструмента с 1994 г.
2Следует отметить, что психометрические шкалы, разработанные для оценки депрессии у больных соматической клиники (в частности, Госпитальная шкала тревоги и депрессии), при обследовании этого контингента не позволяют получить достоверные результаты в связи с топически обусловленной неврологической симптоматикой (афазия, анозогнозия, когнитивные расстройства и др.).
Сведения об авторах
Андрющенко Алиса Владимировна – д-р мед. наук, зав. научно-исследовательским отд. психосоматической медицины НИЦ Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: alissia.va@gmail.com
Пушкарев Дмитрий Федорович – канд. мед. наук, мл. науч. сотр. научно-исследовательского отд. психосоматической медицины НИЦ Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: d.f.pushkarev@gmail.com
Ключевые слова: эпилепсия, болезнь Паркинсона, рассеянный склероз, инсульт головного мозга, болезнь Гентингтона.
Psychiatric disorders in neurological setting: a review
A.V.Andryushchenko, D.F.Pushkarev
I.M.Sechenov First Moscow State Medical University
Summary. The paper reviews the data on the burden of psychiatric disorders in neurological setting, their prevalence and ratio. The differences of neurological and psychiatric approaches to brain disorders are considered along with ensuing conceptual and diagnostical difficulties. Finally the authors examine the clinical features and prevalence of psychiatric disorders comorbid to some important neurological diseases: epilepsy, Parkinson disease, multiple sclerosis, stroke, and Huntington disease. The data reviewed suggests necessity of the dialogue intensification between psychiatry and neurology, which are detached out of date.
Key words: epilepsy, Parkinson disease, multiple sclerosis, stroke, and Huntington disease.
Введение
Современные клинические и эпидемиологические исследования, проведенные с использованием информативных баз данных и экспертных систем, показали актуальность изучения соотношения неврологических заболеваний и психических расстройств на основе интегративного подхода. Всестороннее взаимодействие – принципиальное требование современной нейропсихиатрии, обеспечивающее надежность диагностики, прогноза и терапии психопатологических расстройств, наблюдающихся в неврологической практике.
В России стратегия развития психиатрии и неврологии (наука, образование, клиническая практика) заявлена на 2 из 14 основных научных платформ, разработанных до 2025 г. ведущими специалистами и рекомендованных Минздравом России и Минобром России. Соответственно, создаются условия для поиска оптимального междисциплинарного взаимодействия психиатрии и неврологии между собой, а также с другими базисными для развития медицины направлениями.
Бремя психических заболеваний
По мировым прогнозам, тяжесть бремени аффективной патологии, занимающая одну из первых позиций по целому ряду показателей, продолжает расти (L.Kessing, 1999; van den Weg, 1999; M.Tarrants, 2011). К этим показателям приближены общие затраты здравоохранения стран Евросоюза на заболевания головного мозга, связанные с деменцией, психозами, тревожными расстройствами. Существенными следует считать и более низкие расходы, связанные с сочетанием неврологической патологии (черепно-мозговая травма, рассеянный склероз, болезнь Паркинсона, эпилепсия) с психической (хронические боли, расстройства сна, расстройства личности). Немаловажно отметить, что у пациентов с функциональными неврологическими симптомами отмечаются относительно высокий уровень бремени болезни и низкое качество жизни, ассоциированные с инвалидизацией и усилением болезненных проявлений дистресса по мере хронификации состояния (A.Carson, 2000).
Изучение коморбидных неврологической патологии психических расстройств выявило много факторов, негативно влияющих на показатели бремени болезни, среди которых особое место в плане последствий для больного и общества отводится депрессии. В частности, коморбидность депрессии и рассеянного склероза ухудшает нейропсихическое функционирование по целому ряду параметров: сравнительно с больными без коморбидной депрессии у этого контингента выявляются значимое снижение когнитивного функционирования, нарушения работоспособности и социальных связей (семья, органы социальной поддержки), а также снижение комплаентности и приверженности неврологическому лечению. В результате снижается сравнительная интегральная оценка качества жизни и долгосрочного прогноза неврологического заболевания (Goldman consensus group, 2005).
Коморбидные болезни Паркинсона широко распространенные депрессии, как показали современные исследования (D.Weintraub и соавт., 2004; M.Visser и соавт., 2008), являются инвалидизирующим фактором, снижающим качество жизни даже в большей степени, чем собственно двигательные нарушения. Выполненное в Шотландии (Эдинбург) сравнительное исследование A.Carson (2000 г.) пациентов с психической патологией и без нее показало, что такие показатели качества жизни, как физическое, социальное, ролевое функционирование и телесная боль, статистически достоверно (p<0,0005) ниже среди неврологических пациентов с психическими (тревожными и аффективными) нарушениями.
Одним из важных показателей, отражающих тяжесть бремени болезни, является суицидальный риск; наиболее высокие значения этого показателя, по данным литературы, регистрируются при рассеянном склерозе, хорее Гентингтона, травмах головного и спинного мозга, височной эпилепсии, упорном болевом синдроме (E.Stenager и соавт., 1992; E.Harris и соавт., B.Barraclough, 1994; H.Chochinov и соавт., 1995; D.Fishbain и соавт., 1991, 1999; Y.Conwell и соавт., 1995, 2000; L.Nilsson и соавт., 2002; V.Rafnsson и соавт., 2001; T.Fukuchi и соавт., 2002; D.Arciniegas, C.Anderson, 2002; M.Waern и соавт., 2002).
При оценке непрямых затрат, учитывающих показатели своевременности диагностики и рациональности лечения психических расстройств, коморбидных неврологическим заболеваниям, показано, что даже легко распознаваемая психометрически депрессия часто остается недиагностированной, а применяемая терапия – неадекватной (D.Mohr и соавт., 2006). Так, К.Bridges и D.Goldberg (1984 г.) установили, что при обследовании неврологами психическая патология у 72% больных не выявляется.
По данным обзора P.Fink и соавт. (2003 г.), неврологи распознают лишь 14–40% случаев психических расстройств, верифицированных затем психиатрами, причем уже на момент консультации невролога 16,9% получают психофармакотерапию, а 4,6% имеют направление на консультацию к психиатру. По мнению автора, неврологи достаточно редко направляют пациентов к психиатру и даже доля тех, у которых они выявляют «клинически значимые психические нарушения», составляет всего 1,5%. Врачи общей практики и неврологи более склонны рекомендовать консультацию психиатра только в случае, если жалобы пациента имеют характер соматически необъяснимых или констатируется острый психоз с психомоторным возбуждением (A.Carson, 2000). Соответственно, редко назначается и адекватное лечение психотропными средствами.
Данные о желании пациентов получить консультацию психиатра выявляют следующую тенденцию: 58% пациентов неврологической клиники с диагностированным позднее психическим расстройством намеревались обсудить с врачом отклонения своего настроения, тогда как среди пациентов без психических расстройств их оказалось 50% (K.Bridges, D.Goldberg, 1984). В условиях дефицита информации пациенты редко спонтанно высказывают желание психокоррекционного вмешательства. P.Fink и соавт. (2003 г.) отмечают, что в выборке A.Carson и соавт. (2000 г.) зарегистрированы лишь 11% страдающих аффективными расстройствами пациентов неврологической клиники, подтверждающих, что они возможно нуждаются в помощи специалистов, практикующих в области психического здоровья.
Эпидемиология психических нарушений (соматоформные расстройства, хронические головные боли, ятрогении) в первичной сети и неврологической практике (эпилепсия, инсульт, болезнь Паркинсона, рассеянный склероз, хорея Гентингтона)
Уже через 10 лет от начала первых исследований, посвященных психическим расстройствам в неврологической практике (1970-е годы), стала очевидной необходимость применения статистически верифицированных диагностических критериев. Соответственно, если в ранних работах зарубежных авторов (C.Kirk, 1977, 1979) для обозначения патологии, не обнаруживавшей органической природы, использовался термин «психическое заболевание» (распространенность этой патологии среди амбулаторных неврологических больных оценивалась в пределах 13–30%), то использование первых психометрических опросников позволило выявить существенные расхождения статистических показателей (C.Kirk, 1979; J. De Paulo, 1980; K.Bridges, 1984).
При совместном неврологическом и психиатрическом обследовании 93 женщин неврологического стационара в 34% наблюдений были обнаружены клинически очерченные психические расстройства, причем наиболее частым диагнозом была депрессия, а общая распространенность психических расстройств среди пациентов неврологического стационара в изученной выборке оказалась сопоставимой с показателем, рассчитанным для пациентов клиник иного соматического профиля (C.Kirk, 1977; Metcalfe, 1988). T.Lempert и соавт. (1990 г.) в результате изучения репрезентативной выборки (4470 пациентов, госпитализированных в неврологический стационар) показали, что в 9% случаев госпитализация была связана с психическими расстройствами.
В РФ в 1997 и 2003 гг. проведены два широкомасштабных эпидемиологических исследования «Один день многопрофильной больницы» и КОМПАС, в рамках которых обследовались (осмотрены неврологами 23,2% пациентов) стационарные и амбулаторные больные. По данным первого из цитированных исследований, частота психических нарушений в неврологическом отделении по расчетам психиатров-экспертов составила в совокупности 30%, а второго – только для расстройств аффективного спектра (депрессии, смешанные тревожно-депрессивные расстройства, расстройства адаптации, дистимии, расстройства сна) этот показатель составил 47,4%.
Наиболее высокие значения показателя распространенности депрессий зарегистрированы при паркинсонизме, последствиях острого нарушения мозгового кровообращения, рассеянном склерозе, болезни Альцгеймера, что соответствует данным литературы. Экспертами отмечено, что при квалификации соматизированной симптоматики, связанной с депрессиями, часто устанавливаются ошибочные неврологические диагнозы (дисциркуляторная энцефалопатия, вертебро-базилярная недостаточность, остеохондроз позвоночника, мигрень, нейроциркуляторная дистония). При экспертной психиатрической оценке установлено, что у пациентов с диагнозом «нейроциркуляторная дистония» достоверно чаще, чем при диагностике неврологами, встречаются невротические/соматоформные (44% vs 8%; p=0,00001) и аффективные расстройства (19% vs 6%; p=0,00001), а также психопатологические нарушения шизофренического спектра (11% vs 5%; p=0,005).
Кроме того, у этих пациентов экспертами были чаще диагностированы расстройства адаптации (27% vs 16%) и синдром зависимости от психоактивных веществ (8% vs 3%). Оценка потребности в психотропных средствах в городской многопрофильной больнице позволила выявить, что, если в среднем на 1 пациента требуется 0,8 условных единиц психотропного препарата, то в отделениях неврологического профиля этот показатель был наиболее высоким по сравнению с другими профильными отделениями (кардиологическим, пульмонологическим, ревматологическим, нефрологическим, отоларингологическим и др.) – 1,5.
В исследование P.Fink и соавт. (2003 г.) были включены 198 пациентов (63,5% женщин, 46,4% мужчин), впервые обратившихся к неврологу. Диагноз по Международной классификации болезней 10-го пересмотра (МКБ-10) устанавливался посредством интервью SCAN (Schedules for Clinical Assessment in Neuropsychiatry). Общая распространенность психических расстройств на момент обследования составила 55,1% (95% доверительный интервал – ДИ 46,2–63,8), что превышает значения, приводимые в более ранних публикациях (34–47%)1; распространенность в течение жизни – 65,0% (95% ДИ 56,1–73,0). Наиболее частыми диагнозами в цитируемой работе оказались (по мере убывания) соматоформные (33,8%; 95% ДИ 25,9–42,7), фобические (21,8%; 95% ДИ 15,3–30,0), аддиктивные (13,3%; 95% ДИ 8,3–20,6) расстройства, а также депрессия и дистимия (14,4%; 95% ДИ 9,1–21,8). По данным Hansen и соавт. (2001 г.), полученным в исследовании с аналогичным дизайном, распространенность психических расстройств в контингенте обращающихся к неврологу ниже (39%), что, по мнению P.Fink (2003 г.), связано с гендерными и возрастными различиями.
В более позднем исследовании K.Jefferies и соавт. (2007 г.) выборку составили поступившие в неврологический стационар 265 больных (57,4% женщин, 42,6% мужчин; возрастной диапазон 18–91 год, средний возраст 54,5 года), из них в окончательный анализ включены 197 (74%), полностью обследованных экспертами (табл. 1). Установлено, что 44% пациентов обратились к неврологу с целью диагностики, а 56% уже имели верифицированный неврологический диагноз. Клинически завершенные психические расстройства, диагностированные по критериям DSM-IV, выявлялись с такой же частотой, что и в работе Р.Fink (2003 г.), – у 51,3% (ДИ 44–58%), при этом у 18,7% сосуществовали два, а у 5,1% – три синдромальных диагноза. Корреляций, связанных с полом, возрастом и установленным ранее неврологическим диагнозом, не обнаружено.

В настоящее время особую актуальность приобретает проблема соматизированных психических расстройств, протекающих с неврологическими «масками». Последние, с точки зрения неврологов, относятся к так называемым необъяснимым симптомам, выявляемым у 5% вновь поступивших в клинику двигательных неврологических расстройств пациентов (M.Thomas, 2004). Причем симптоматика, обозначаемая этим термином, примерно у 1/2 пациентов подвержена спонтанным ремиссиям (A.Carson и соавт., 2003). В цитированном исследовании A.Carson и соавт. (2000 г.) из 300 вновь обратившихся амбулаторно к неврологу пациентов у 47% выявлены тревожные или депрессивные расстройства, диагностированные по критериям DSM-IV; «большая депрессия» оказалась наиболее распространенной (27%). При анализе соотношения неврологической патологии с психической установлено, что у 11% пациентов клинические проявления «ни в коей степени не объясняются неврологической патологией», а у 19% «объясняются в некоторой степени»; у 70% выявлена неврологическая патология, при которой у большинства (43%) психопатологическая симптоматика «полностью объясняется неврологической».
Следует отметить, что в литературе представлены данные о сравнительно высокой распространенности так называемой функциональной слабости: 4–5 случаев на 100 тыс. населения в год (M.Binzer и соавт., 1997; M.Binzer, G.Kullgren, 1998), этот показатель среди вновь обратившихся за неврологической помощью пациентов приближается к 1,5% (M.Binzer и соавт., 1997; J.Stone и соавт., 2009), а среди пациентов неврологического стационара – к 2% (I.Parry и соавт., 2006).
При развитии неврологической патологии (черепно-мозговая травма, болезни Альцгеймера, Гентингтона, Коновалова–Вильсона, нейроонкопатология, инсульт, рассеянный склероз, сложные парциальные припадки, нейросифилис) могут усугубляться характерологические расстройства, в частности истерические (конверсионные и диссоциативные) и одноименные изменения личности.
Одной из серьезных проблем до сих пор являются трудности сопоставления результатов клинико-эпидемиологических исследований, проводимых неврологами и психиатрами раздельно. Эта ситуация мало чем отличается от положения в психосоматической медицине в целом, когда классификационные подходы не столько отражают реальную ситуацию, сколько позицию разработчиков. Неврологи часто рассматривают отдельные психопатологические симптомы и синдромы (апатия, хроническая усталость, хронические боли, когнитивные нарушения, эмоциональная лабильность и др.) вне контекста клинических единиц, принятых в психиатрии. Результатом классификационных, терминологических и семантических разногласий при взгляде на одну и ту же проблему оказывается размывание границ нозологических категорий, когда симптоматика болезни трудно поддается определению и верификации.
Эпилепсия
Несмотря на многолетние исследования эпилепсии, многие вопросы, связанные с распространенностью психических и поведенческих нарушений (включая когнитивные и патохарактерологические) и их соотношением с пароксизмальными расстройствами и знаками органического поражения головного мозга, остаются спорными. Психические расстройства, развивающиеся при эпилепсии без четкой зависимости от частоты пароксизмов, могут длительно (у 60% больных в течение года) не распознаваться (A.Kanner, 2008).
По А.И.Болдыреву (1984 г.), среди психических расстройств, выявляемых в начальной стадии эпилепсии (из 600 наблюдений без психических нарушений – 14%), регистрируются: нарушения сна (54%), астенические расстройства (44%), заторможенность (19%), патохарактерологические изменения (6%), навязчивости (3%), депрессии (2%), истерические расстройства (2,3%), психозы – делириозные, параноидные, сумеречные, онейроидные, маниакальные с галлюцинациями (1,7%). По данным C.Cullum и M.Weiner (2011 г.), частота психотических нарушений при эпилепсии может достигать 50%, при этом их условно разделяют на первичные и вторичные (лекарственные/фармакогенные).
Как социально стигматизирующее заболевание, эпилепсия сопровождается тревожно-депрессивными реакциями, но наиболее частой формой аффективной патологии является рекуррентная депрессия, выявляемая примерно у 25% пациентов (A.Kanner, 2003). В более поздней работе A.Kanner (2005 г.) отмечает некоторые общие механизмы эпилепсии и депрессии, связывая их с постепенно нарастающими атрофическими процессами и ухудшением серотонинергической трансмиссии рецепторов височных и лобных отделов.
Депрессии, проявляющиеся в продромальном (преиктальном) периоде пароксизмальной активности, могут приближаться по длительности (свыше 2 нед) к депрессивному эпизоду и включать витальные симптомы (степень витализации аффекта коррелирует с локализацией патологического очага). При этом многие авторы констатируют высокую частоту психических расстройств при эпилепсии в связи с локализацией очага в височной области и гиппокампе. Для височной эпилепсии характерна аура – приступы иктальной тревожной депрессии или соматизированного страха, отличные от эндогенных и непосредственно связанные с активностью эпилептогенного очага. Постприступная (постиктальная) депрессия вариабельна по проявлениям (при этом преобладает астеническая симптоматика) и длительности. Выявляются также эндоморфные типы с тоскливо-дисфорическим или дисфорическим аффектом (угрюмость, вспышки агрессии, застревание на обидах, конфликтах и пр.), сопоставимые по длительности (до нескольких лет) с дистимией (D.Blumer, 1995; W.Lishman, 2001). В приступе, а также продромальном и межприступном периодах могут отмечаться кратковременные (несколько ч/сут) эпизоды эйфории/гипомании. Тревожные расстройства при эпилепсии могут иметь форму панических атак с агорафобией.
Отмечая личностные особенности у больных эпилепсией, одни эксперты выявляют у них конституциональные эпилептоидные черты (подчеркнутая аккуратность, экономность, раболепность, угодливость, слащавость), а также шизоидные (склонность к мечтательности, резонерству) и психастенические (повышенная мнительность, неуверенность в себе), другие склоняются к высокой вероятности патологического развития личности (эксплозивность, импульсивность, раздражительность, аффективная лабильность, вязкость, склонность к навязчивым идеям, патологическая религиозность), обусловленного неврологической патологией.
Обсуждаемые ниже формы психической патологии предпочтительны, как известно, для пожилого возраста. Эпидемиологической характеристике этой патологии уместно предпослать информацию, полученную в результате впервые проведенного в РФ сотрудниками отдела по изучению геронтологической психиатрии ФГБУ НЦПЗ РАМН (Я.Б.Калын, 2001; С.И.Гаврилова, Я.Б.Калын, 2002). Показатели болезненности определены посредством сплошного клинико-эпидемиологического населения пожилого и старческого возраста, проживающего на ограниченной территории Москвы.
Явные психические нарушения разного уровня и нозологической принадлежности (без учета условно патологических состояний) выявлены у 36,6% обследованных, в том числе у 6,1% – психозы и состояния органического слабоумия. Психическая патология непсихотического уровня, включающая инициальные проявления собственно возрастных церебральных процессов, латентные и мягкие формы эндогенных заболеваний
(а также длительные ремиссии при этой патологии), диагностирована у 30,5% обследованных.
Болезнь Паркинсона
Распространенное (17 случаев на 100 тыс. населения) неврологическое расстройство, сопровождающееся широким спектром когнитивных, психотических и аффективных нарушений.
Распространенность депрессий при этой нозологии составляет 40–50% (А.М.Вейн и соавт., 2002), а по данным зарубежных авторов (S.Starkstein и соавт., 2008; J.Slaughter и соавт., 2001; V.Tumas и соавт., 2008), может достигать 90%. Многие авторы считают депрессию почти постоянным спутником заболевания наряду с характерными психомоторными и постепенно проявляющимися когнитивными нарушениями. Высокую частоту депрессии на нейробиологическом уровне связывают с вторичной дисфункцией передних отделов мозга, ассоциированной с поражением дофаминергических нейронов экстрапирамидной системы в области базальных ганглиев.
Необходимо отметить, что клиническую и психометрическую диагностику депрессии существенно затрудняет то обстоятельство, что целый ряд депрессивных симптомов перекрывается с основными проявлениями паркинсонизма (моторное торможение, дефицит внимания, нарушения сна, снижение массы тела, эректильная дисфункция, бедность мимики, снижение громкости голоса, утомляемость, тревога за здоровье).
В качестве значимого негативно воздействующего фактора выделяется нозогенное воздействие неврологической болезни, сопряженной с психосоциальными трудностями, в частности утратой подвижности в трудоспособном возрасте и прогрессированием когнитивных нарушений при частичной критике к ним. Нозогенные депрессии представлены сравнительно равномерно: «большая» (по критериям DSM-IV-TR) – 17–31% пациентов, «малая» – у 25–40% (E.Tandberg и соавт., 1996; L.Marsh и соавт., 2006; S.Starkstein и соавт., 2008; J.Reijinders и соавт., 2008; Zahodne и соавт., 2012). Отмечается атипия клинической картины: преобладание симптомов, реализующихся в соматической сфере, и когнитивных нарушений над сравнительно незначительной выраженностью собственно аффективных феноменов, включая идеи вины и суицидальные мысли (U.Ehrt и соавт., 2006; A.Gotham и соавт., 1986).
Особой характеристикой таких депрессий является брадифрения (замедление темпа мышления, скорости реакций, снижение произвольной и общей активности), определяющаяся соотношением присущей паркинсонизму психомоторной заторможенности и заторможенности собственно депрессивной. Колебания аффективного фона могут быть также связаны с изменением состояния в ответ на прием антипаркинсонического препарата леводопы.
В исследовании L.Zahodne и соавт. (2012 г.), выполненном на выборке 95 пациентов с болезнью Паркинсона, депрессия выявлена у 27 (28,4%) пациентов.
В структуре гипотимии наблюдались следующие проявления: ангедония – 12 (44%) наблюдений, снижение аппетита (59%), нарушения сна (81%), психомоторное возбуждение/торможение (4%), утомляемость (93%), чувство вины или собственной малоценности (56%), нарушения концентрации внимания или нерешительность (85%), суицидальные мысли (19%). Отмечена также высокая частота апатии, выявляемой как у пациентов с коморбидной болезни Паркинсона депрессией (85%), так и при отсутствии аффективной патологии (31%).
Этот результат соотносится с данными других исследований, согласно которым распространенность апатии при болезни Паркинсона достигает 70% и прежде всего при наличии коморбидной депрессии (A.Leentjens и соавт., 2008).
В исследовании Oguru и соавт. (2010 г.) представлена попытка установить статистические соотношения между депрессией, апатией и деменцией в выборке 150 пациентов с болезнью Паркинсона. По результатам данной работы апатия выявляется у 60%, а депрессия – в 56% случаев. При этом апатия в отсутствие депрессии регистрируется в 17% наблюдений, а депрессия в отсутствие апатии – в 13%. У 12 (8%) пациентов диагностирована деменция. Апатия без коморбидных психических нарушений зарегистрирована у 23 (15%) больных, депрессия –
у 18 (12%) больных. Деменция во всех наблюдениях сопровождалась коморбидными расстройствами.
Отмечается два «пика» возникновения депрессии: в дебюте – 12–20% всех случаев болезни Паркинсона (Н.Н.Яхно, 2010) и на поздних стадиях болезни (А.М.Вейн и соавт., 2002; Н.Н.Яхно, 2010; G.Fenelon, 2008). Считается, что депрессия ускоряет или усугубляет течение двигательной и когнитивной патологии. Следует также отметить, что на фоне стандартного для паркинсонизма лечения, уменьшающего двигательные нарушения, клинически развернутая депрессия может сохраняться.
Несмотря на сравнительно небольшую тяжесть депрессивной симптоматики по сравнению с психиатрической клиникой, в ряде исследований с высокой степенью статистической достоверности показано, что депрессия – важнейший фактор, определяющий качество жизни пациентов с болезнью Паркинсона, более значимый, чем собственно двигательные нарушения (A.Schrag и соавт., 2000; D.Gallagher и соавт., 2010; S.Naismith и соавт., 2010).
Сложности при оценке психопатологических нарушений при паркинсонизме привносит также тревога (В.Н.Краснов, 2011), возникающая, как правило, на более поздних этапах течения болезни и отчасти связанная с тяжестью моторных симптомов. Психотические расстройства, возникающие, как правило, либо в рамках побочных эффектов дофаминомиметических препаратов, либо в структуре делирия, у пациентов с болезнью Паркинсона без деменции отмечаются в 7–14% наблюдений и в 29–54% – при наличии коморбидной деменции (A.Carson и соавт., 2007).
Рассеянный склероз
По данным специальных исследований и систематических обзоров среди больных рассеянным склерозом наиболее широко распространены непсихотические психические нарушения, в частности депрессивные и тревожные, а также хроническая усталость (астения) и когнитивные расстройства (K.Jefferies, 2006). Оценки распространенности этих расстройств варьируют, что может быть связано с различиями в дизайне исследований, используемых оценочных инструментов и неоднозначности классификационных границ между этими нарушениями (L.Chwastiak и соавт., 2002; A.Janssens и соавт., 2006; Y.Suh и соавт., 2010; Wood и соавт., 2012).
Депрессия рассматривается как наиболее распространенное психическое расстройство, выявляемое у 40–50% больных на разных этапах развития болезни (S.Minden и соавт., 1987; R.Schiffer, H.Babigian, 1984; M.Wallin и соавт., 2006). В проспективном исследовании B.Wood и соавт. (2012 г.) показано, что распространенность депрессивной патологии при рассеянном склерозе постепенно возрастает и с каждым годом болезни соответствующий показатель повышается в среднем на 7,3%. Оценки риска расстройств депрессивного спектра в течение жизни также довольно высоки и уступают лишь показателям, рассчитанным для паркинсонизма, – 42–60% (R.Joffe и соавт., 1987; S.Minden и соавт., 1990; D.Schubert, R.Foliart, 1993; S.Patten, L.Metz, 1997; A.Sadovnick и соавт., 1991; A.Sadovnick и соавт., 1996; A.Feinstein, K.Feinstein, 2001; A.Feinstein, 2004).
В более ранних исследованиях отмечалось, что депрессии при рассеянном склерозе формируются не только при тяжелых, но и при мягких формах неврологического заболевания (M.Sullivan и соавт., 1995a; M.Sullivan и соавт., 1995b). В работах последнего десятилетия высказывается предположение, что высокая частота депрессий объясняется включением в изучаемые выборки пациентов, получающих неврологическое лечение, а соответственно, нельзя исключить, что с учетом тех больных, у которых заболевание протекает благоприятно и не требует обращения за помощью, этот показатель оказался бы существенно ниже (R.Siegert, D.Abernethy, 2005).
Так, по результатам популяционного исследования (выборка из 115 071 пациента), S.Patten и соавт. (2003 г.) оценивают годичную (12-месячную) распространенность большой депрессии среди больных рассеянным склерозом в возрасте 18–45 лет на уровне 25,7% (в населении – 8,9%). В других работах (L.Chwastiak и соавт., 2001; Y.Suh и соавт., 2010; B.Wood и соавт., 2012) приводится более низкий показатель распространенности этой формы (10–18,5%), хотя отдельные «клинически значимые депрессивные симптомы» выявляются у 42% больных.
Проводятся исследования, учитывающие корреляции депрессивной симптоматики с тяжестью неврологических нарушений (A.Moller и соавт., 1994), а также характер течения аффективной патологии. Отмечена тенденция депрессий при рассеянном склерозе к безремиссионному (или с малым числом спонтанных ремиссий) течению и хронификации (D.Mohr, D.Goodkin, 1999).
Изучение ятрогенных воздействий показало, что неврологическая терапия может являться фактором, провоцирующим развитие аффективной патологии. Длительное применение кортикостероидов, используемых для лечения рассеянного склероза, ассоциируется с возникновением или усугублением депрессивной симптоматики (S.Patten и соавт., 1996). В литературе представлены также данные о манифестации депрессивных проявлений и повышении суицидального риска при проведении терапии интерфероном b, 1b (J.Avasarala и соавт., 2003; J.Aikens, 1999).
Депрессия, коморбидная рассеянному склерозу, – один из важнейших факторов, влияющих на качество жизни пациентов (V.Janardhan, R.Bakshi, 2002; A.Janssens и соавт., 2003; I.Lobentanz и соавт., 2004; S.D’Alisa и соавт., 2006), усугубляющий связанные с неврологической патологией когнитивные нарушения (P.Arnett, 1999), ухудшающий социальные взаимоотношения (C.Maybury, 1984), снижающий комплаентность (D.Mohr и соавт., 1997). В числе психологических детерминант развития депрессии исследователи отмечают неопределенность прогноза рассеянного склероза, неадекватные стратегии совладания, беспомощность (отсутствие контроля над течением болезни) (A.Feinstein, 2007). В целом роль психосоциальных факторов в возникновении депрессии оценивается на уровне 40%, несколько уступая значению регистрируемых параметров демиелинизации (A.Feinstein, 2011).
Самостоятельный аспект проблемы депрессий при рассеянном склерозе – связь с суицидальным риском, по эпидемиологическим данным (A.Sadovnick и соавт., 1991), в 7 раз превышающим популяционные значения. По наблюдениям A.Feinstein (1997, 2002 гг.), около 1/4 больных в течение жизни обдумывают суицид, а частота завершенных суицидов расценивается как «чрезвычайно высокая» (E.Stenager и соавт., 1992, 1996). Результаты «психологической аутопсии» свидетельствует, что суицид может быть причиной смерти для 15% пациентов клиник рассеянного склероза. Чаще всего суицид совершают молодые мужчины с катамнезом заболевания до 5 лет (E.Stenager и соавт., 1992). В качестве наиболее важного фактора суицидального риска рассматриваются умеренная и тяжелая депрессии, социальная изоляция и злоупотребление алкоголем (A.Feinstein, 1997, 2002). Завершенному суициду может предшествовать серия суицидальных попыток, ассоциированных с резким ухудшением/экзацербацией демиелинизирующего процесса (E.Stenager и соавт., 1996), хотя большинство суицидальных попыток с фатальным исходом совершается пациентами с патологией умеренной тяжести (Goldman consensus group, 2005).
Не менее значимый фактор суицидального риска – коморбидная депрессии тревога, повышающая соответствующий показатель до 46,0% против 18,9% при «чистой» депрессии, формирующейся у больных рассеянным склерозом (A.Feinstein, P.O’Connor и соавт., 1999; M.Korostil, A.Feinstein, 2007).
По данным S.Donnchadha и соавт. (2013 г.), полученным при помощи модифицированного опросника тревоги Бека (modified Beck Anxiety Inventory – mBAI), тревожные симптомы (более 7 баллов) выявляются у 51,2%, а выраженная тревожная симптоматика (более 15 баллов) – у 24,3% пациентов с рассеянным склерозом. Распространенность тревожных расстройств в течение жизни при рассеянном склерозе оценивается в пределах 36–40% (популяционный показатель – 25%) (R.Kessler и соавт., 1994; M.Korostil, A.Feinstein, 2007; G.Galeazzi и соавт., 2005). На момент обследования тревожные расстройства диагностируются у 14% пациентов (M.Korostil, A.Feinstein, 2007). Приведенные данные соотносятся с представлениями о распространенности расстройств тревожного спектра среди пациентов с хронической соматической патологией (K.Wells и соавт., 1988). В отношении других неврологических заболеваний указанные значения распространенности тревожных расстройств превышают таковые для эпилепсии (A.Jacoby и соавт., 1996), но несколько уступают 40%, приводимым для пациентов с болезнью Паркинсона (S.Starkstein и соавт., 1993).
Представленность расстройств тревожного спектра при рассеянном склерозе в течение жизни и на момент обследования распределяется следующим образом: генерализованное тревожное расстройство (ГТР) – 18,6 и 10,0%, изолированные фобии – 10,8 и 2,8%, паническое расстройство – 10,0 и 2,1%, обсессивно-компульсивное расстройство – 8,6 и 5,7%, социальная фобия – 7,8 и 2,1% соответственно (M.Korostil, A.Feinstein, 2007).
S. Di Legge и соавт. (2003 г.) в рамках проспективного исследования отмечают наибольшую выраженность тревожной симптоматики непосредственно после установления диагноза рассеянного склероза, с постепенной редукцией тревоги с течением времени. В проспективных исследованиях A.Giordano и соавт. (2011 г.) и Wood и соавт. (2012 г.) также регистрируется снижение выраженности тревожной симптоматики по мере течения заболевания, особенно среди женщин. В свете этого факта авторы высказывают предположение, что тревожные нарушения, развивающиеся, как правило, в ответ на информацию о тяжелой инвалидизирующей болезни с неясным прогнозом, имеют преимущественно нозогенный характер.
Согласно представленным в литературе данным 60–92% больных рассеянным склерозом жалуются на повышенную утомляемость (fatigue), а 30–55% пациентов называют хроническую усталость наиболее значимым симптомом своей болезни (J.Iriarte и соавт., 2000; B.Wood и соавт., 2012).
При формализованной оценке (шкала тяжести утомляемости – Fatigue severity scale, FSS) распространенность умеренной астенической симптоматики (свыше граничного значения в 4 балла) оценивается в 70,8%, а клинически выраженной (свыше 5 баллов) – в 53,7% больных (B.Wood и соавт., 2012). При этом значимо чаще (отношение шансов 1,29; p<0,001) утомляемость возникает у мужчин.
Опубликованные исследования не позволяют выявить жестких связей между утомляемостью и депрессией при рассеянном склерозе (L.Krupp, 1988, 1989).
Не коррелировала астения и с неврологически обусловленными нарушениями функционирования (в оценке по Expanded Disability Status Scale). При изучении выборки (139 пациентов с рассеянным склерозом) (C.Schwartz и соавт., 1996) обнаружили достоверную, но слабую (r=0,17) корреляцию между выраженностью астении и средним баллом по шкале депрессии. Группа голландских авторов также рассматривает утомляемость как распространенный и значимый симптом, который, однако, не ассоциирован с выраженностью депрессии или нарушениями функционирования (J.Vercoulen и соавт., 1996). В ряде исследований указывается на необходимость дальнейшего научного поиска в этом направлении (J.Vercoulen и соавт., 1996; K.Schreurs и соавт., 2002; R.Bakshi и соавт., 2000; S. van der Werf и соавт., 2003; W.Woss и соавт., 2002). По наблюдениям H.Ford и соавт. (1998 г.), депрессия более значимо коррелирует с психической утомляемостью (r=0,54; p<0,0001), чем с физической (r=0,31; p<0,01).
Вопросы коморбидности тревоги, депрессии и астении у больных рассеянным склерозом подробно рассмотрены в проспективном исследовании B.Wood и соавт. (2012 г.), выполненном на выборке из 198 пациентов. Тревожные и астенические проявления представляют собой самостоятельные категории и могут возникать в том числе и вне контекста депрессии, депрессия в 88,9% наблюдений (а при нетяжелых функциональных неврологических нарушениях – балл EDSS<3,0 во всех случаях) сопровождается тревогой и/или патологической утомляемостью. При этом представленность психопатологических проявлений меняется с течением времени: редуцируется тревожная симптоматика и нарастает выраженность депрессивных нарушений.
Среди пациентов с рассеянным склерозом выявляются (J.Fischer и соавт., 1994) когнитивные нарушения, хотя менее выраженные, чем при других ослабоумливающих заболеваниях (например, болезни Альцгеймера).
Психотические расстройства при рассеянном склерозе представлены отдельными казуистическими случаями (Davison, Bagley, 1969; Mathews, 1979; Awad, 1983). В частности, по данным A.Feinstein (1992 г.), за 6 лет работы специализированной клиники рассеянного склероза было зарегистрировано всего 10 случаев психоза. В клинической картине преобладают психотические расстройства с персекуторным бредом, сопровождающиеся ажитацией или дисфорией, тогда как галлюцинаторные/псевдогаллюцинаторные расстройства, а также нарушения сознания встречаются реже (A.Feinstein и соавт., 1992).
Инсульт
Распространенность инсульта, по данным Oxford Community Stroke Project (Bamford и соавт., 1988), составляет 2 на 1 тыс. населения (для первого инсульта).
В РФ ежегодно регистрируется более 1 млн жителей, перенесших инсульт, 15–30% признаются ограниченно трудоспособными, а 40% – инвалидами I или II группы (В.И.Скворцова и соавт., 2009). В числе неблагоприятных последствий инсульта рассматривается возникновение широкого спектра психических расстройств (от делирия и деменции до импульсивных расстройств и навязчивостей).
Делирий развивается у 30–40% пациентов в течение недели после инсульта, что связывают с ухудшением прогноза, повышением длительности госпитализаций и риска развития деменции (A.Carson и соавт., 2007).
Другие психотические расстройства, в частности психотическая мания, также выявляемые в постинсультном периоде (S.Starkstein и соавт., 1987), рассматриваются в ассоциации с правосторонним поражением головного мозга (J.Cummings, M.Mendez, 1984). В качестве факторов риска выделяются пожилой возраст и наличие дегенеративного заболевания центральной нервной системы (S.Starkstein, 1998). При этом распространенность этой патологии остается неизученной (А.Carson и соавт., 2007).
Постинсультная деменция выявляется обычно через
3 мес после сосудистой катастрофы приблизительно у 1/4 больных; анозогнозия с частичным или полным непониманием неврологического дефицита может сопровождаться депрессивной симптоматикой (S.Starkstein и соавт., 1990).
Апатия у больных, перенесших инсульт, на современном уровне знаний рассматривается как самостоятельный клинический синдром и ассоциируется со снижением активности во фронтальной и переднетемпоральной областях мозга (S.Starkstein и соавт., 1993).
Постинсультная депрессия2 развивается примерно у 1/3 пациентов (показатели частоты расстройства варьируют в диапазоне 17–52% в зависимости от периода проведения эпидемиологического среза) и чаще манифестирует спустя 6 мес – 2 года после инсульта (H.Rickards, 2005). Так, по данным проспективного исследования М.А.Савиной (2006 г.), выполненного в отделе по изучению геронтологической психиатрии ФГБУ НЦПЗ РАМН под руководством профессора В.А.Концевого, на протяжении 12 мес после перенесенного инсульта депрессивные расстройства выявляются у 34% больных. К факторам риска развития депрессии относят сравнительно молодой возраст (по данным М.А.Савиной, в среднем 65 лет – нижняя граница пожилого возраста по МКБ-10; Квинн, 2000), наличие когнитивных нарушений, расстройства сна, социального функционирования, депрессии в анамнезе, женский пол
(у мужчин выявлена корреляция с уровнем образования и степенью утраты социально-профессиональной активности), отсутствие социальной поддержки. В течение 2 лет после инсульта риск депрессии повышается в 6 раз, а в условиях такой коморбидности за 3 года на 10% возрастают показатели риска смерти вследствие повторного инсульта, инфаркта миокарда, осложнений сахарного диабета, атеросклероза, агрегации тромбоцитов и пр. (L.Williams и соавт., 2004).
Большинство эпидемиологических исследований свидетельствуют о связи между значительным нарушением функционирования после инсульта (Herrmann и соавт., 1995; Pohjasvaara и соавт., 2001) и высокой частотой возникновения депрессии.
Оценки распространенности тревожных расстройств среди больных, перенесших инсульт, варьируют в пределах 4–28% в зависимости от их оценки в качестве самостоятельной категории либо – симптомов депрессивного расстройства (Astrom, 1996). По данным P.Burvill и соавт. (1995 г.), катамнестически обследовавших выборку (294 наблюдения) выживших после инсульта пациентов (длительность катамнеза – 12 мес), распространенность тревожных расстройств составила 12% для мужчин и 28% для женщин. Агорафобия выявлена у 9% мужчин и у 26% женщин, ГТР – по 2% соответственно.
Долевое распределение отдельных типов тревожных расстройств (как развернутых, так и субсиндромальных) у больных, перенесших первый церебральный инсульт за 6 мес до момента обследования, приведена в работе М.А.Савиной и И.А.Серпуховитиной (2009 г.); табл. 2.

Эмоциональная лабильность часто наблюдается в острой фазе инсульта, но может иметь и отставленный дебют (Berthier и соавт., 1996). Выражаемые пациентом эмоции при этом нарушении не соответствуют его общему психическому состоянию. В настоящее время точно не установлено, существует ли связь между депрессией и эмоциональной лабильностью, но оба расстройства могут возникать как одновременно, так и каждое в отдельности (House и соавт., 1989; Robinson и соавт., 1993). Нарушения функционирования лобных долей головного мозга вследствие инсульта могут быть причиной снижения эмпатии, бестактности, снижения инициативности и спонтанности, ребяческого поведения, сексуальной расторможенности и бедности эмоциональной экспрессии (Carota и соавт., 2002).
Хорея Гентингтона
Депрессия, распространенность которой составляет на момент обследования 30–40%, а в течение жизни до 60% (A.Rosenblatt и соавт., 2007), – одно из облигатных коморбидных расстройств этого наследственного прогрессирующего нейродегенеративного заболевания. Аффективные расстройства (депрессии мрачно-угрюмые, дисфорически раздражительные, ипохондрические, вялоапатические) впервые проявляются в продромальном периоде и на ранних этапах заболевания, иногда за несколько лет опережая манифестацию хореотических гиперкинезов (С.Гаврилова, 2011). Такие депрессии в 4–6 раз повышают риск суицидов сравнительно со средне-популяционными показателями.
Как правило, хореотический гиперкинез предшествует интеллектуальному снижению (общее оскудение психической деятельности, психической и речевой активности, эмоциональное притупление, расстройства памяти и ориентировки) и психотическим расстройствам. По данным Э.Я.Штернберга (1967 г.), психозы выявляются у 60% больных хореей Гентингтона и представлены на инициальных этапах бредовыми расстройствами, включая малоразработанные, паранойяльные идеи ревности, преследования или отравления, а на более поздних – галлюцинаторно-параноидными синдромами или нелепым бредом величия.
Примечания
1Этот факт может отчасти объясняться тем обстоятельством, что категория «Соматоформные расстройства» впервые выделена в МКБ-10, действующей в качестве диагностического инструмента с 1994 г.
2Следует отметить, что психометрические шкалы, разработанные для оценки депрессии у больных соматической клиники (в частности, Госпитальная шкала тревоги и депрессии), при обследовании этого контингента не позволяют получить достоверные результаты в связи с топически обусловленной неврологической симптоматикой (афазия, анозогнозия, когнитивные расстройства и др.).
Сведения об авторах
Андрющенко Алиса Владимировна – д-р мед. наук, зав. научно-исследовательским отд. психосоматической медицины НИЦ Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: alissia.va@gmail.com
Пушкарев Дмитрий Федорович – канд. мед. наук, мл. науч. сотр. научно-исследовательского отд. психосоматической медицины НИЦ Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: d.f.pushkarev@gmail.com
Список исп. литературыСкрыть список1. Вейн А.М. и др. Болевые синдромы в неврологической практике. М.: МЕДпресс-информ, 2001.
2. Вейн А.М., Вознесенская Т.Г., Голубев В.Л., Дюкова Г.М. Депрессия в неврологической практике. М., 2002.
3. Вейн А.М., Дюкова Г.М., Воробьева О.В., Данилов А.В. Панические атаки. Руководство для врачей. М., 2004.
4. Дамиулин И.В. Сосудистые когнитивные нарушения: клинические и терапевтические аспекты. РМЖ. Неврология. Психиатрия. 2006; 14 (9): 658–64.
5. Штернберг Э.Я. Клиника деменций пресенильного возраста. М., 1967.
6. Яхно Н.Н., Захаров В.В., Нодель М.Р. Когнитивные и другие нервно-психические расстройства при болезни Паркинсона. Болезни движений: медицинские и социальные аспекты. Под ред. Е.И.Гусева, А.Б.Гехт. М., 2010; с. 95–102.
7. Bakshi R, Shaikh ZA, Miletich RS et al. Fatigue in multiple sclerosis and its relationship to depression and neurologic disability. Mult Scler 2000; 6: 181–5.
8. Bridges K, Goldberg DP. Psychiatric illness in in-patients with neurological disorders: patients' views on discussion of emotional problems with neurologists. Br Med J 1984; 289: 656–8.
9. Burvill PW, Johnson GA, Jamrozik KD et al. Anxiety disorders after stroke: results from the perth community stroke study. Brit J Psychiat 1995; 166: 328–32.
10. Carson AJ, Postma K, Stone J et al. The outcome of depressive disorders in neurology patients: a prospective cohort study. J Neurol Neurosurg Psychiat 2003; 74: 893–6.
11. Carson AJ, Ringbauer B, Stone J et al. Do medically unexplained symptoms matter? A prospective cohort study of 300 new referrals to neurology outpatient clinics. J Neurol Neurosurg Psychiat 2000; 68: 207–10.
12. Di Legge S, Piattella MC, Pozzilli C et al. Longitudinal evaluation of depression and anxiety in patients with clinically isolated syndrome at high risk of developing early multiple sclerosis. Mult Scler 2003; 9: 302–6.
13. Ehrt U, Bronnick K, Leentjens AF et al. Depressive symptom profile in Parkinson’s disease: a comparison with depression in elderly patients without Parkinson’s disease. Int J Geriat Psychiat 2006; 21 (3): 252–8.
14. Feinstein A, Feinstein K. Depression associated with multiple sclerosis. Looking beyond diagnosis to symptom expression. J Affect Dis 2001; 66: 193–8.
15. Feinstein A. The neuropsychiatry of multiple sclerosis. Can J Psychiat 2004; 49: 157–63.
16. Fink P, Hansen MS, Søndergaard L, Frydenberg M. Mental illness in new neurological patients. J Neurol Neurosurg Psychiat 2003; 74: 817–9.
17. Fink P, Steen Hansen M, Søndergaard L. Somatoform disorders among first-time referrals to a neurology service. Psychosom 2005; 46 (6): 540–8.
18. Fitzgerald P, Herlihy D, Sweeney B et al. Neurology referrals to a liaison psychiatry service. Ir Med J 2008; 101 (9): 271–3.
19. Gallagher DA, Lees AJ, Schrag A. What are the most important nonmotor symptoms in patients with Parkinson’s disease and are we missing them? Mov Dis 2010; 25 (15): 2493–500.
20. Giordano A, Granella F, Lugaresi A et al. Anxiety and depression in multiple sclerosis patients around diagnosis. J Neurol Sci 2011; 307: 86–91.
21. Goldman consensus group. The Goldman Consensus statement on depression in multiple sclerosis. Multiple Sclerosis 2005; 11: 328–37.
22. Harden CL. The co-morbidity of depression and epilepsy: epidemiology, etiology and treatment. Neurology 2002; 59 (Suppl. 4): s48–55.
23. Janssens AC JW, van Doorn PA, de Boer JB et al. Impact of recently diagnosed multiple sclerosis on quality of life, anxiety, depression and distress of patients and partners. Acta Neurol Scand 2003; 108: 389–95.
24. Jefferies K, Owino A, Rickards H, Agrawal N. Psychiatric disorders in inpatients on a neurology ward: estimate of prevalence and usefulness of screening questionnaires J Neurol Neurosurg Psychiat 2007; 78: 414–6.
25. Kanner AM. Mood disorders and epilepsy: a neurobiologic perspective of their relationship. Dialogues Clin Neuroscience 2008; 10 (1): 39–47.
26. Kirk C, Saunders M. Primary psychiatric illness in a neurological out-patients department in North-East England. An analysis of symptomatology. Acta Psychiat Scand 1977; 56: 294–302.
27. Kirk C, Saunders M. Psychiatric illness in a neurological out-patients department in North-East England. Use of the General Health Questionnaire in the prospective study of neurological out-patients. Acta Psychiat Scand 1979; 60: 427–37.
28. Korostil M, Feinstein A. Anxiety disorders and their clinical correlates in multiple sclerosis patients. Mult Scler 2007; 13: 67–72.
29. Kurtzke JF. The current neurological burden of illness and injury in the United States. Neurology 1982; 32: 1207–14.
30. Leentjens AF, Dujardin K, Marsh L et al. Apathy and anhedonia rating scales in Parkinson’s disease: critique and recommendations. Mov Dis 2008; 23 (14): 2004–14.
31. Lyketsos C et al. Psychiatric aspects of neurologic diseases. NY, 2008.
32. Mohr DC, Hart SL, Fonareva I, Tasch ES. Treatment of depression for patients with multiple sclerosis in neurology clinics. Mult Scler 2006; 12: 204–8.
33. Moller A, Wiedemann G, Rohde U et al. Correlates of Cognitive Impairment and Depressive Mood Disorder in Multiple Sclerosis. Acta Psychiat Scand 1994; 89: 117–21.
34. Naismith SL, Hickie IB, Lewis SJ. The role of mild depression in sleep disturbance and quality of life in Parkinson’s disease. J Neuropsychiat Clin Neurosci 2010; 22 (4): 384–9.
35. Donnchadha S, Burke T, Bramham J et al. Symptom overlap in anxiety and multiple sclerosis. Multiple Sclerosis J 2013; 19 (10): 1349–54.
36. Oguru M, Tachibana H, Toda K et al. Apathy and Depression in Parkinson Disease Journal of Geriatric Psychiatry and Neurolog 2010; 23 (1): 35–41.
37. Patten SB, Beck CA, Williams JV et al. Major depression in multiple sclerosis: a population-based perspective. Neurology 2003; 61: 1524–7.
38. Patten SB, Metz LM. Depression in multiple sclerosis. Psychother Psychosom 1997; 66: 286–92.
39. Patten SB, Williams JV, Wang J. Mental disorders in a population sample with musculoskeletal disorders. BMC Musculoskelet Dis 2006; 7: 37.
40. Reijnders JS, Ehrt U, Weber WE et al. A systematic review of prevalence studies of depression in Parkinson’s disease. Mov Dis 2008; 23 (2): 183–9.
41. Rosenblatt A. Neuropsychiatry in Huntington’s disease. Dialogues Clin Neurosci 2007; 9: 191–7.
42. Sadovnik AD, Remick RA, Allen J et al. Depression and multiple sclerosis. Neurology 1996; 46: 628–32.
43. Schieffer RB, Rao SM, Fogel BS. Neuropsychiatry. 2nd ed. Philadelphia etc., 2003.
44. Schreurs KM, de Ridder DT, Bensing JM. Fatigue in multiple sclerosis: reciprocal relationships with physical disabilities and depression. J Psychosom Res 2002; 53: 775–81.
45. Siegert R, Abernethy D. Depression in multiple sclerosis: a review.
J Neurol Neurosurg Psychiat 2005; 76: 469–75.
46. Slaughter JR, Slaughter KA, Nichols D et al. Prevalence, clinical manifestations, etiology, and treatment of depression in Parkinson’s disease. J Neuropsychiat Clin Neurosci 2001; 13 (2): 187–96.
47. Smith SJ, Young CA. The role of affect on the perception of disability in multiple sclerosis. Clin Rehabil 2000; 14: 50–4.
48. Starkstein SE, Merello M, Jorge R et al. A validation study of depressive syndromes in Parkinson’s disease. Mov Dis 2008; 23 (4): 538–46.
49. Stone J, Carson A, Duncan R et al. Symptoms’ unexplained by organic disease’ in 1144 new neurology out-patients: how often does the diagnosis change at follow up? Brain 2009; 132: 2878–88.
50. Suh Y, Motl RW, Mohr DC. Physical activity, disability, and mood in the early stage of multiple sclerosis. Disabil Health J 2010; 3: 93–8.
51. Tarrants M, Oleen-Burkey M, Castelli-Haley J, Lage MJ. The Impact of Comorbid Depression on Adherence to Therapy for Multiple Sclerosis Multiple Sclerosis International 2011. ID271321.
52. Taylor MA. The Fundamentals of clinical neuropsychiatry. NY, Oxford 1999.
53. Tumas V, Rodrigues GG, Farias TL, Crippa JA. The accuracy of diagnosis of major depression in patients with Parkinson’s disease: a comparative study among the UPDRS, the geriatric depression scale and the Beck depression inventory. Arq Neuropsiquiat 2008; 66 (2A): 152–6.
54. Werf SP, Evers A, Jongen PJ et al. The role of helplessness as mediator between neurological disability, emotional instability, experienced fatigue and depression in patients with multiple sclerosis. Mult Scler 2003; 9: 89–94.
55. Visser M, Rooden SM, Verbaan D et al. A comprehensive model of health-related quality of life in Parkinson’s disease. J Neurol 2008; 255 (10): 1580–7.
56. Wallin MT, Wilken JA, Turner AP et al. Depression and multiple sclerosis. Review of a lethal combination. J Rehabil Res Dev 2006; 43: 45–62.
57. Williams LS, Jones WJ, Shen J et al. Prevalence and impact of depression and pain in neurology outpatients J Neurol Neurosurg Psychiat 2003; 74: 1587–9.
58. Wood B, Mei IA, Ponsonby A-L et al. Prevalence and concurrence of anxiety, depression and fatigue over time in multiple sclerosis. Multiple Sclerosis J 2012; 19 (2): 217–24.
59. Zahodne LB, Marsiske M, Okun MS, Bowers D. Components of depression in Parkinson disease. J Geriat Psychiat Neurol 2012; 25 (3): 131–7.


