Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№04 2013
Взаимодействие основных групп противоопухолевых и психотропных препаратов, применяющихся у пациенток со злокачественными опухолями женской репродуктивной системы №04 2013
Номера страниц в выпуске:16-22
При выборе средств психофармакотерапии для лечения психопатологических расстройств у пациенток со злокачественными новообразованиями органов женской репродуктивной системы (ЖРС) необходимо учитывать вероятность интеракции этой группы препаратов со средствами химиотерапии и гормонотерапии. В настоящей работе проведен анализ интеракции основных групп противоопухолевых средств, активно используемых в схемах адъювантной и неоадъювантной терапии злокачественных новообразований органов ЖРС, а также вспомогательных медикаментов со средствами психофармакотерапии.
Резюме. В целях совершенствования психофармакотерапевтической помощи пациенткам, страдающим онкологическими заболеваниями органов женской репродуктивной системы, уточнен целый ряд интеракций основных групп противоопухолевых средств, используемых в схемах адъювантной и неоадъювантной терапии этих больных, со средствами психофармакотерапии. Выделены три уровня риска нежелательного взаимодействия – высокий, средний, низкий. Даны подробные рекомендации, позволяющие оптимизировать лечебный процесс с учетом политерапевтического воздействия.
Ключевые слова: интеракция, риск нежелательного взаимодействия, психофармакотерапия, противоопухолевая терапия, злокачественные новообразования органов женской репродуктивной системы.
Interaction of main groups of antineoplastic and psychotropic drugs used in patients with malignant tumors of the female reproductive system
M.A.Samushiya
First Moscow State Medical University I.M.Sechenov
Summary. For the purposes of the development of psychopharmacotherapeutical assistance for the patients, having oncology diseases of the female reproductive system organs, a large variety of interactions of the main groups of antineoplastic drugs, used in adjuvant and neoajuvant therapy schemes along with psychopharmacotherapy drugs, is specified. Three risk levels of adverse interaction (high, medium, low) are distinguished. Detailed recommendations, enabling to optimize medical treatment with account of polytherapeutic intervention, are given.
Key words: interaction, adverse interaction risk, psychopharmacotherapy, anticancer therapy, cancer of the female reproductive system organs.
При выборе средств психофармакотерапии для лечения психопатологических расстройств у пациенток со злокачественными новообразованиями органов женской репродуктивной системы (ЖРС) необходимо учитывать вероятность интеракции этой группы препаратов со средствами химиотерапии и гормонотерапии. В настоящей работе проведен анализ интеракции основных групп противоопухолевых средств1, активно используемых в схемах адъювантной и неоадъювантной терапии злокачественных новообразований органов ЖРС, а также вспомогательных медикаментов2 со средствами психофармакотерапии.
Полученные результаты, содержащие информацию по потенциальному лекарственному взаимодействию лекарственных средств, построены по принципу прогнозирования риска развития неблагоприятных последствий для пациента в результате сочетания конкретных пар – противоопухолевого препарата и средства психофармакотерапии. В работе использовались электронные ресурсы (http://www.drugs.com/interactions-check.php.drug_list и http://www.uptodate.com), представляющие собой регулярно обновляемые рецензируемые и редактируемые медицинские англоязычные электронные порталы, содержащие достоверную информацию, полученную в соответствии с требованиями доказательной медицины, касающуюся лекарственных препаратов.
К числу наиболее серьезных осложнений с высоким уровнем риска нежелательного взаимодействия химиотерапевтических/гормональных препаратов со средствами психофармакотерапии относятся:
1. Кардиотоксические эффекты, связанные с развитием дозозависимого удлинения интервала Q–T и возникновением опасных желудочковых аритмий, включая желудочковую тахикардию (ЖТ) и torsade de pointes3, вплоть до внезапной сердечной смерти при совместном назначении ингибиторов ароматазы (метрозола) и торемифена из группы антиэстрогеновых агентов с антидепрессантами из ряда селективных ингибиторов обратного захвата серотонина – СИОЗС (циталопрам, эсциталопрам). Механизм подобного нежелательного взаимодействия связан со значительным увеличением концентрации циталопрама и эсциталопрама в крови путем ингибирования изофермента CYP-450 2C19 указанными средствами гормонотерапии злокачественных новообразований органов ЖРС. Риск аналогичных осложнений имеется при совместном назначении торемифена с трициклическими антидепрессантами – ТЦА (имелипрамин, кломипрамин, амитриптилин, венлафаксин), мапротилином, циталопрамом и эсциталопрамом (F.Huyse, R. van Schijndel, 1988; J.O'Brien и соавт., 1999; A.Glassman, J.Bigger, 2001). Крайне нежелательно в плане развития кардиотоксического эффекта назначение антипсихотиков (за исключением арипипразола и оланзапина) пациенткам, принимающим в качестве гормонотерапии препарат антиэстрогенового ряда – торемифен (H.Witchel, J.Hancox, D.Nutt, 2003), а также назначение бутерофенонов и бициклических нейролептиков (зипразидон) при наличии в схеме терапии тамоксифена и цитостатика доксорубицина (A.Glassman, J.Bigger, 2001); табл. 1.
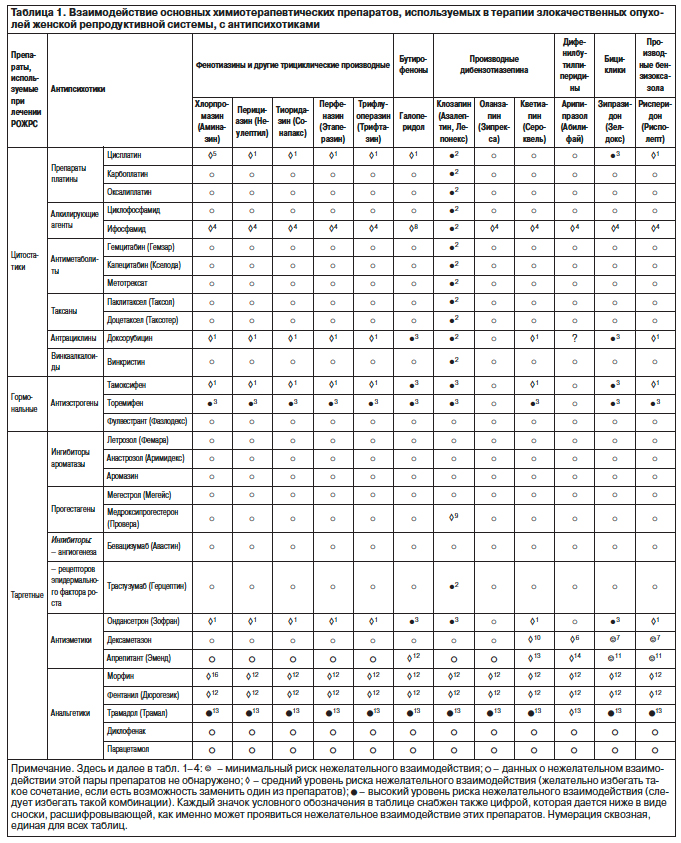
2. Гематотоксические эффекты в виде риска развития агранулоцитоза, относящиеся к нежелательным лекарственным взаимодействиям высокого уровня риска, развиваются при совместном назначении клозапина со всеми группами цитостатиков и ингибитора рецепторов эпидермального фактора роста трастузумаба (табл. 1).
3. Нарушение метаболизма тамоксифена также относится к нежелательным лекарственным взаимодействиям высокого уровня риска, что связано с ухудшением прогноза онкологического заболевания. Учитывая тот факт, что ряд антидепрессантов из группы СИОЗС являются ингибиторами изофермента CYP-450 2D6, процесс превращения тамоксифена в его активный метаболит эндоксифен замедляется или полностью прекращается. Результаты множества клинических исследований подтверждают ухудшение прогноза онкологического заболевания при назначении некоторых антидепрессантов из группы СИОЗС (флуоксетин, пароксетин, сертралин), а также тимоаналептика двойного действия – дулоксетина – пациенткам, принимающим тамоксифен, что связано с увеличением рецидивов рака молочной железы, укорочением периодов ремиссий, а также с более низкими показателями выживаемости. Так, двухлетняя частота рецидивов рака молочной железы (353 наблюдения) у пациенток, получавших тамоксифен совместно с СИОЗС, составила 13,9% по сравнению с 7,5% у пациенток, получавших только тамоксифен при средней продолжительности приема препаратов 340 дней. В то же время в группе сравнения (137 пациенток, получавших с тамоксифеном циталопрам, эсциталопрам или флувоксамин) частота рецидивов рака молочной железы статистически не отличалась от показателя у пациенток основной выборки (только тамоксифен) и составила 8,8%.
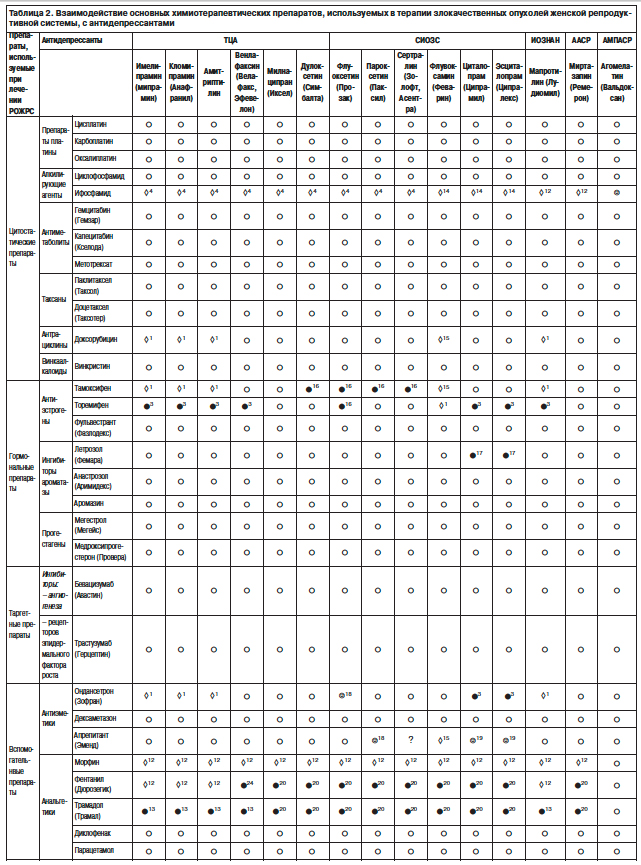
4. Риск развития серотонинового синдрома – потенциально летального осложнения фармакотерапии, которое связано с гиперстимуляцией рецепторов
5-HT1A- и HT2А-, располагающихся в стволе головного мозга. Клиническими проявлениями этого состояния могут быть: раздражительность, измененное состояние сознания, спутанность, галлюцинации и кома, также могут развиваться тахикардия, гипертермия, неустойчивость артериального давления, мидриаз, гиперрефлексия, миоклонус, атаксия, абдоминальные судороги, тошнота, рвота и диарея. Высокий уровень риска подобного осложнения наблюдается при совместном назначении часто используемых в онкологической практике аналгетиков, в частности морфина и фентанила, с целым рядом антидепрессантов: вся группа СИОЗС, некоторые ТЦА, а также тимоаналептики двойного действия (венлафаксин, милнаципран, дулоксетин, миртазапин); табл. 2.
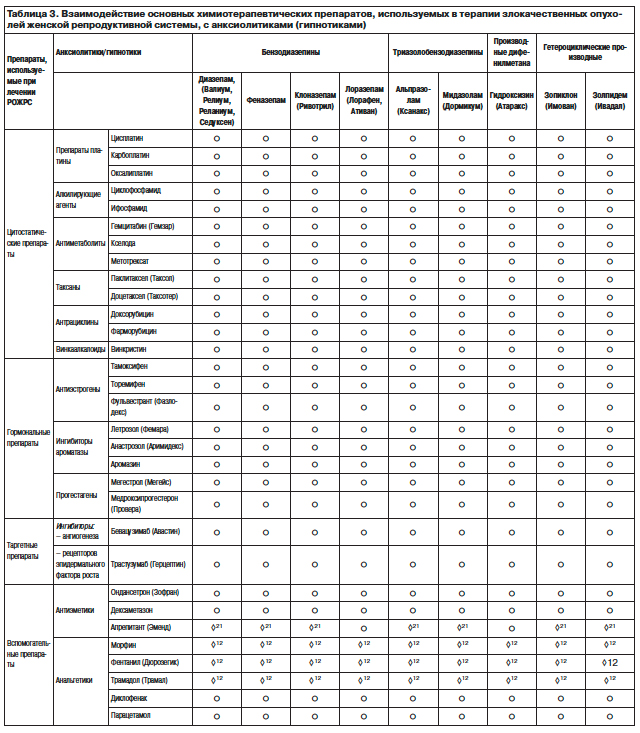
5. Высокая вероятность развития судорог и угнетения дыхательного центра, особенно у пожилых больных, пациентов с черепно-мозговой травмой или алкоголизмом в анамнезе, метаболическими, инфекционными расстройствами, а также при опухолях головного мозга наблюдается при интеракции наркотического аналгетика трамадола с ТЦА (имипрамин, кломипрамин, амитриптилин) и антидепрессантами двойного действия – венлафаксином, мапротилином (F.Pisani и соавт., 1999; J.Gardiner и соавт., 2000).
Выявлены также интеракции со средним уровнем риска нежелательного взаимодействия. При назначении психотропных средств совместно с препаратами, используемыми в схеме лечения злокачественных новообразований органов ЖРС, желательно избегать такое сочетание, если есть возможность заменить один из препаратов. Так, при совместном назначении антипсихотиков из группы фенотиазинов, бутирофенонов (галоперидола), а также кветиапина и рисперидона с препаратом платины – цисплатином и антрациклином – доксорубицином повышается риск развития желудочковых аритмий за счет удлинения интервала Q–T.
Аналогичный уровень риска нежелательного взаимодействия указанных антипсихотиков, ТЦА и мапротилина отмечается в результате интеракции с тамоксифеном и ондансетроном (используется в качестве антиэметика)4. В случае необходимости такого сочетания препаратов требуется регулярный контроль уровня электролитов крови во избежание нарастания гипокалиемии или гипомагниемии. Следует опасаться возникновения головокружения, предобморочных или синкопальных состояний, ортостатических явлений или тахикардии. Указанные явления могут быть минимизированы при назначении более низких стартовых доз и более медленной титрации, особенно у пожилых пациентов (A.Glassman и соавт., 2001; H.Witchel и соавт., 2003).
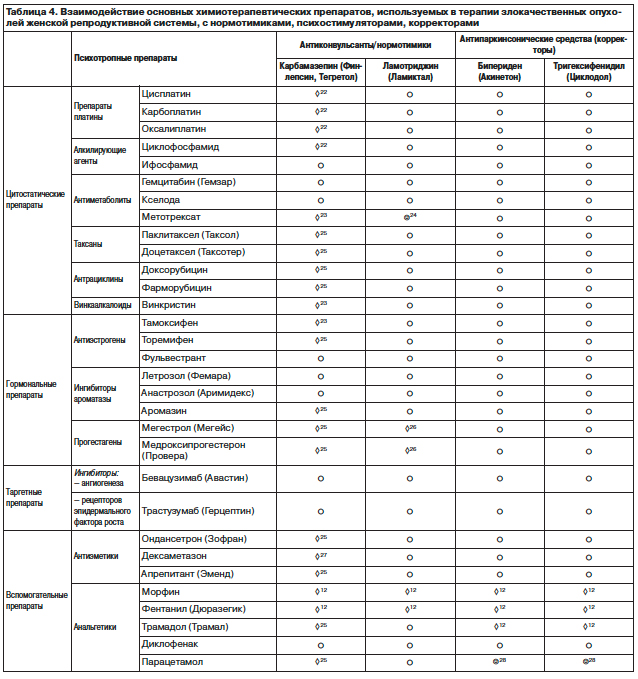
Данные ряда исследований интеракции карбамазепина с антиметаболитами (метотрексат), винкаалкалоидами (винкристин) и антиэстрогенами (тамоксифен) подтверждают повышение риска гепатотоксичности (включая острый гепатит, хронический фиброз, некроз, цирроз и повышение активности ферментов печени).
Комбинация алкилирующего агента ифосфамида со всеми группами антипсихотиков и антидепрессантами (исключение составляют в группе СИОЗС циталопрам, эсциталопрам, флувоксамин, а также миртазапин и агомелатин) может усиливать нейротоксические эффекты изофосфамида, проявляющиеся сонливостью, спутанностью, галлюцинациями, психотическим возбуждением, экстрапирамидной симптоматикой, недержанием мочи, судорогами, в некоторых случаях развитием комы. Приводятся также отдельные сообщения о периферической нейропатии. Указанные явления могут развиться от нескольких часов до нескольких суток, что, как правило, приводит к отмене препаратов через 48–72 ч после назначения. Однако возникшие симптомы могут сохраниться в течение более длительных промежутков времени, причем восстановление иногда может быть неполным (N.Simonian и соавт., 1993).
Множество нежелательных эффектов интеракции препаратов, использующихся для лечения злокачественных новообразований органов ЖРС с психофармакологическими средствами, связаны с нарушением обмена одного из агентов. В ходе многочисленных исследований установлен риск лекарственных взаимодействий, объясняющийся особенностями метаболизма психотропных препаратов основных классов и использующихся при лечении рака органов ЖРС противоопухолевых медикаментов. Основные из них представлены в табл. 1–4, к которым прилагаются пояснения для удобства использования.
Признано, что онкология – одна из областей медицины, наиболее широко использующая самые разнообразные методы лечения. Кроме широкого арсенала соматотропных средств, применяются методы физического воздействия (радиотерапевтические технологии), хирургическое лечение. Онкологические заболевания являются причиной декомпенсации или возникновения заболеваний других систем органов, психических нарушений, что приводит к необходимости назначения дополнительных соматотропных и психотропных средств.
Несмотря на уже имеющиеся данные, информация о транзакции препаратов требует постоянного обновления и дополнения.
Примечания
1В группу противоопухолевых средств, применяемых для лечения злокачественных новообразований органов ЖРС, были включены основные классы цитостатиков, таргетные средства, препараты гормонотерапии.
2В группу вспомогательных препаратов, широко применяемых при лечении злокачественных новообразований органов ЖРС, вошли аналгетики (в том числе наркотические) и антиэметики.
3Особая форма пароксизмальной ЖТ, так называемая полиморфная (двунаправленная) веретенообразная ЖТ («пируэт», torsade de pointes), которая характеризуется нестабильной, постоянно меняющейся формой комплекса QRS и развивается на фоне удлиненного интервала Q–T. Полагают, что в основе двунаправленной веретенообразной ЖТ лежит значительное удлинение интервала Q–T, которое сопровождается замедлением и асинхронизмом процесса реполяризации в миокарде желудочков, что и создает условия для возникновения повторного входа волны возбуждения (re-entry) или появления очагов триггерной активности.
Сноски к табл. 1–4.
◊1 Кардиотоксический эффект, связанный с риском развития желудочковых аритмий за счет удлинения интервала Q–T. В случае необходимости такого сочетания препаратов необходим регулярный контроль уровня электролитов крови во избежание нарастания гипокалиемии или гипомагниемии.
●2 Высокий риск гематологической токсичности, особенно агранулоцитоза.
●3 При сочетании этих препаратов высок риск развития дозозависимого удлинения интервала Q–T и возникновения опасных желудочковых аритмий, включая желудочковую тахикардию и torsade de pointes, вплоть до внезапной сердечной смерти (F.Huyse, R. van Schijndel, 1988; J.O'Brien и соавт., 1999; A.Glassman, J.Bigger, 2001).
◊4 Усиление нейротоксических эффектов изофосфамида.
◊5 Увеличение концентрации клозапина в крови. Точный механизм взаимодействия неизвестен, но, вероятно, связан со снижением метаболизма клозапина, осуществляющегося через CYP-450 1A2, 2C19 и/или 3A4 (V.Gabbay и соавт., 2002). Для предотвращения этих эффектов следует начинать с очень низких доз клозапина, если все же избежать такой комбинации лекарственных средств не удается.
◊6 За счет выраженной индукции изофермента CYP-450 3A4 может снижаться концентрация антипсихотиков в крови. Во избежание снижения эффекта антипсихотиков необходимо более тщательно мониторировать психический статус пациента, что позволит своевременно увеличить дозу антипсихотика при необходимости (Y.Wong, C.Yeh, 2001).
☺7 Умеренная индукция изофермента CYP-450 3A4, что незначительно повышает дозу антипсихотиков в крови. В доступной печати не сообщается о каких-либо серьезных последствиях такой комбинации препаратов (J.Miceli и соавт., 2000; C.Prakash и соавт., 2000).
◊8 Увеличение концентрации антипсихотиков в крови за счет изофермента CYP-450 3A4. Сочетание этих лекарственных средств возможно, однако влечет за собой необходимость более тщательной титрации доз антипсихотиков (следует учитывать, что апрепитант не назначается на длительное время).
◊9 Сочетание кветиапина с мощным ингибитором изофермента CYP-450 3A4 может приводить к накоплению препарата в крови и проявляться, в частности, угнетением дыхания и потерей сознания (C.DeVane, C.Nemeroff, 2001). Кроме этого, имеются единичные публикации, описывающие существенное увеличение аппетита и глюкозы сыворотки (прибавка в массе тела более чем на
22 кг за 6 мес – вес пациента вернулся к прежнему спустя 5 мес после отмены обоих препаратов) (E.Spina, J de Leon, 2007).
◊10 Увеличение концентрации арипипразола в крови за счет ингибиторования изоферментов CYP-450 3A4 и/или 2D6, однако к серьезным нежелательным последствиям, это, как правило, не ведет.
☺11 Незначительное повышение концентрации антипсихотиков в крови за счет ингибиторования изофермента CYP-450 3A4 (J.Miceli
и соавт., 2000).
◊12 Риск угнетения центральной нервной системы и дыхательного центра, особенно у пожилых или истощенных пациентов. Рекомендуется избегать управления транспортными средствами и механизмами во время приема комбинации указанных препаратов (M.Divoll и соавт., 1981; L.Lemberger и соавт., 1988).
●13 Высокий риск развития судорог и угнетения дыхательного центра, особенно у пожилых больных, пациентов с черепно-мозговой травмой или алкоголизмом в анамнезе, метаболическими, инфекционными расстройствами или при опухоли головного мозга (F.Pisani и соавт., 1999; J.Gardiner и соавт., 2000).
◊14 Увеличение концентрации в крови препаратов, метаболизм которых осуществляется изоферментом CYP-450 3A4 за счет ингибирования этого фермента антидепрессантами, что требует дополнительной коррекции дозы противоопухолевых препаратов каждый раз, когда антидепрессант был добавлен в схему лечения или отменен.
◊15 За счет выраженной индукции изофермента CYP-450 3A4 может снижаться концентрация антидепрессанта в крови. Во избежание снижения эффекта антидепрессантов необходимо более тщательно мониторировать психический статус пациента, что позволит своевременно увеличить дозу антидепрессанта при необходимости (P.Damkier и соавт., 1999).
●16 Представленный ряд препаратов из группы СИОЗС является ингибитором изофермента CYP-450 2D6, процесс превращения тамоксифена в его активный метаболит эндоксифен замедляется или даже прекращается, что ухудшает клинический прогноз онкологического заболевания.
●17 Значительное увеличение концентрации циталопрама и эсциталопрама в крови за счет ингибирования изофермента CYP-450 2C19, что клинически может проявляться удлинением интервала Q–T с увеличением риска развития опасных аритмий, в частности torsade de pointes (риск возрастает при заболеваниях сердечно-сосудистой системы и нарушениях электролитного баланса, например гипокалиемии, гипомагниемии).
☺18 Опубликованы единичные клинические случаи, сообщающие об успешном применении флуоксетина при депрессивно-дисфорической симптоматике, развившейся на фоне приема ондансетрона (D.Oren, 1995).
☺19 Такое сочетание препаратов относительно безопасно, если не превышается дозировка: 40 мг/сут для циталопрама и 20 мг/сут для эсциталопрама. Несмотря на то что происходит ингибирование изофермента CYP-450 3A4, это значительно не затрагивает фармакокинетику антидепрессантов, поскольку они частично перерабатываются другими изоферментами (CYP-450 2C19, 3A4 и 2D6).
●20 Высокий риск развития серотонинового синдрома.
◊21 Увеличение концентрации бензодиазепинов в крови за счет угнетения изофремента CYP-450 3A4 апрепитантом. Клиническими проявлениями могут стать угнетение дыхательного центра и центральной нервной системы (G.Dresser и соавт., 2000; J.Hardman
и соавт., 2001).
◊22 Ограниченные данные клинических наблюдений свидетельствуют о том, что параллельное применение этих препаратов может уменьшить концентрации карбамазепина в крови и его и фармакологические эффекты. Точный механизм взаимодействия неизвестен. В одном клиническом случае у молодой женщины с эпилепсией в анамнезе развился тонико-клонический припадок на фоне приема карбамазепина и противоопухолевой терапии цисплатином и доксорубицином. Рекомендованы тщательное наблюдение и своевременная коррекция доз противосудорожных препаратов в случае необходимости такого сочетания лекарственных средств (C.Neef и соавт., 1988).
◊23 Увеличение гепатотоксичности.
☺24 Ламотриджин является слабым ингибитором дигидрофолатредуктазы. Теоретически одновременное назначение с другими ингибиторами этого же фремента может иметь негативные последствия для костного мозга, возможно, увеличивая риск мегалобластной анемии и других гематологических заболеваний.
◊25 Теоретически параллельное назначение этих препаратов может приводить к снижению концентрации противоопухолевых средств в крови за счет того, что карбамазепин является индуктором изоферментов CYP-450 3A4 и/или 2C8. Если все же такая комбинация необходима, рекомендован тщательный контроль содержания противоопухолевых средств в крови и увеличение дозы при необходимости (C.Jamis-Dow и соавт., 1993; C.Spencer и соавт., 1994; S.Baker, 1997).
◊26 Снижение концентрации ламотриджина в крови и его фармакологических эффектов, что может потребовать коррекции дозы ламотриджина (I.Ohman и соавт., 2000; T.Holdich и соавт., 1991).
◊27 Карбамазепин может приводить к снижению концентрации в крови кортикостероидов за счет индукции изофремента CYP-450 3A4, поэтому доза дексаметазона должна контролироваться каждый раз, когда карбамазепин был добавлен в схему лечения или отменен (M.Privitera и соавт., 1982; R.Levy, 1995; G.Keitner и соавт., 1989).
☺28 Такое сочетание препаратов теоретически может привести к снижению подвижности желудка и задержке его освобождения, однако вероятность этого слишком мала (J.Nimmo и соавт., 1973; J.Clark и соавт., 1983).
Сведения об авторе
Самушия Марина Антиповна – канд. мед. наук, доц. каф. психиатрии и психосоматики ФППОВ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: sma-psychiatry@mail.ru
Ключевые слова: интеракция, риск нежелательного взаимодействия, психофармакотерапия, противоопухолевая терапия, злокачественные новообразования органов женской репродуктивной системы.
Interaction of main groups of antineoplastic and psychotropic drugs used in patients with malignant tumors of the female reproductive system
M.A.Samushiya
First Moscow State Medical University I.M.Sechenov
Summary. For the purposes of the development of psychopharmacotherapeutical assistance for the patients, having oncology diseases of the female reproductive system organs, a large variety of interactions of the main groups of antineoplastic drugs, used in adjuvant and neoajuvant therapy schemes along with psychopharmacotherapy drugs, is specified. Three risk levels of adverse interaction (high, medium, low) are distinguished. Detailed recommendations, enabling to optimize medical treatment with account of polytherapeutic intervention, are given.
Key words: interaction, adverse interaction risk, psychopharmacotherapy, anticancer therapy, cancer of the female reproductive system organs.
При выборе средств психофармакотерапии для лечения психопатологических расстройств у пациенток со злокачественными новообразованиями органов женской репродуктивной системы (ЖРС) необходимо учитывать вероятность интеракции этой группы препаратов со средствами химиотерапии и гормонотерапии. В настоящей работе проведен анализ интеракции основных групп противоопухолевых средств1, активно используемых в схемах адъювантной и неоадъювантной терапии злокачественных новообразований органов ЖРС, а также вспомогательных медикаментов2 со средствами психофармакотерапии.
Полученные результаты, содержащие информацию по потенциальному лекарственному взаимодействию лекарственных средств, построены по принципу прогнозирования риска развития неблагоприятных последствий для пациента в результате сочетания конкретных пар – противоопухолевого препарата и средства психофармакотерапии. В работе использовались электронные ресурсы (http://www.drugs.com/interactions-check.php.drug_list и http://www.uptodate.com), представляющие собой регулярно обновляемые рецензируемые и редактируемые медицинские англоязычные электронные порталы, содержащие достоверную информацию, полученную в соответствии с требованиями доказательной медицины, касающуюся лекарственных препаратов.
К числу наиболее серьезных осложнений с высоким уровнем риска нежелательного взаимодействия химиотерапевтических/гормональных препаратов со средствами психофармакотерапии относятся:
1. Кардиотоксические эффекты, связанные с развитием дозозависимого удлинения интервала Q–T и возникновением опасных желудочковых аритмий, включая желудочковую тахикардию (ЖТ) и torsade de pointes3, вплоть до внезапной сердечной смерти при совместном назначении ингибиторов ароматазы (метрозола) и торемифена из группы антиэстрогеновых агентов с антидепрессантами из ряда селективных ингибиторов обратного захвата серотонина – СИОЗС (циталопрам, эсциталопрам). Механизм подобного нежелательного взаимодействия связан со значительным увеличением концентрации циталопрама и эсциталопрама в крови путем ингибирования изофермента CYP-450 2C19 указанными средствами гормонотерапии злокачественных новообразований органов ЖРС. Риск аналогичных осложнений имеется при совместном назначении торемифена с трициклическими антидепрессантами – ТЦА (имелипрамин, кломипрамин, амитриптилин, венлафаксин), мапротилином, циталопрамом и эсциталопрамом (F.Huyse, R. van Schijndel, 1988; J.O'Brien и соавт., 1999; A.Glassman, J.Bigger, 2001). Крайне нежелательно в плане развития кардиотоксического эффекта назначение антипсихотиков (за исключением арипипразола и оланзапина) пациенткам, принимающим в качестве гормонотерапии препарат антиэстрогенового ряда – торемифен (H.Witchel, J.Hancox, D.Nutt, 2003), а также назначение бутерофенонов и бициклических нейролептиков (зипразидон) при наличии в схеме терапии тамоксифена и цитостатика доксорубицина (A.Glassman, J.Bigger, 2001); табл. 1.

2. Гематотоксические эффекты в виде риска развития агранулоцитоза, относящиеся к нежелательным лекарственным взаимодействиям высокого уровня риска, развиваются при совместном назначении клозапина со всеми группами цитостатиков и ингибитора рецепторов эпидермального фактора роста трастузумаба (табл. 1).
3. Нарушение метаболизма тамоксифена также относится к нежелательным лекарственным взаимодействиям высокого уровня риска, что связано с ухудшением прогноза онкологического заболевания. Учитывая тот факт, что ряд антидепрессантов из группы СИОЗС являются ингибиторами изофермента CYP-450 2D6, процесс превращения тамоксифена в его активный метаболит эндоксифен замедляется или полностью прекращается. Результаты множества клинических исследований подтверждают ухудшение прогноза онкологического заболевания при назначении некоторых антидепрессантов из группы СИОЗС (флуоксетин, пароксетин, сертралин), а также тимоаналептика двойного действия – дулоксетина – пациенткам, принимающим тамоксифен, что связано с увеличением рецидивов рака молочной железы, укорочением периодов ремиссий, а также с более низкими показателями выживаемости. Так, двухлетняя частота рецидивов рака молочной железы (353 наблюдения) у пациенток, получавших тамоксифен совместно с СИОЗС, составила 13,9% по сравнению с 7,5% у пациенток, получавших только тамоксифен при средней продолжительности приема препаратов 340 дней. В то же время в группе сравнения (137 пациенток, получавших с тамоксифеном циталопрам, эсциталопрам или флувоксамин) частота рецидивов рака молочной железы статистически не отличалась от показателя у пациенток основной выборки (только тамоксифен) и составила 8,8%.

4. Риск развития серотонинового синдрома – потенциально летального осложнения фармакотерапии, которое связано с гиперстимуляцией рецепторов
5-HT1A- и HT2А-, располагающихся в стволе головного мозга. Клиническими проявлениями этого состояния могут быть: раздражительность, измененное состояние сознания, спутанность, галлюцинации и кома, также могут развиваться тахикардия, гипертермия, неустойчивость артериального давления, мидриаз, гиперрефлексия, миоклонус, атаксия, абдоминальные судороги, тошнота, рвота и диарея. Высокий уровень риска подобного осложнения наблюдается при совместном назначении часто используемых в онкологической практике аналгетиков, в частности морфина и фентанила, с целым рядом антидепрессантов: вся группа СИОЗС, некоторые ТЦА, а также тимоаналептики двойного действия (венлафаксин, милнаципран, дулоксетин, миртазапин); табл. 2.
5. Высокая вероятность развития судорог и угнетения дыхательного центра, особенно у пожилых больных, пациентов с черепно-мозговой травмой или алкоголизмом в анамнезе, метаболическими, инфекционными расстройствами, а также при опухолях головного мозга наблюдается при интеракции наркотического аналгетика трамадола с ТЦА (имипрамин, кломипрамин, амитриптилин) и антидепрессантами двойного действия – венлафаксином, мапротилином (F.Pisani и соавт., 1999; J.Gardiner и соавт., 2000).
Выявлены также интеракции со средним уровнем риска нежелательного взаимодействия. При назначении психотропных средств совместно с препаратами, используемыми в схеме лечения злокачественных новообразований органов ЖРС, желательно избегать такое сочетание, если есть возможность заменить один из препаратов. Так, при совместном назначении антипсихотиков из группы фенотиазинов, бутирофенонов (галоперидола), а также кветиапина и рисперидона с препаратом платины – цисплатином и антрациклином – доксорубицином повышается риск развития желудочковых аритмий за счет удлинения интервала Q–T.
Аналогичный уровень риска нежелательного взаимодействия указанных антипсихотиков, ТЦА и мапротилина отмечается в результате интеракции с тамоксифеном и ондансетроном (используется в качестве антиэметика)4. В случае необходимости такого сочетания препаратов требуется регулярный контроль уровня электролитов крови во избежание нарастания гипокалиемии или гипомагниемии. Следует опасаться возникновения головокружения, предобморочных или синкопальных состояний, ортостатических явлений или тахикардии. Указанные явления могут быть минимизированы при назначении более низких стартовых доз и более медленной титрации, особенно у пожилых пациентов (A.Glassman и соавт., 2001; H.Witchel и соавт., 2003).
Данные ряда исследований интеракции карбамазепина с антиметаболитами (метотрексат), винкаалкалоидами (винкристин) и антиэстрогенами (тамоксифен) подтверждают повышение риска гепатотоксичности (включая острый гепатит, хронический фиброз, некроз, цирроз и повышение активности ферментов печени).
Комбинация алкилирующего агента ифосфамида со всеми группами антипсихотиков и антидепрессантами (исключение составляют в группе СИОЗС циталопрам, эсциталопрам, флувоксамин, а также миртазапин и агомелатин) может усиливать нейротоксические эффекты изофосфамида, проявляющиеся сонливостью, спутанностью, галлюцинациями, психотическим возбуждением, экстрапирамидной симптоматикой, недержанием мочи, судорогами, в некоторых случаях развитием комы. Приводятся также отдельные сообщения о периферической нейропатии. Указанные явления могут развиться от нескольких часов до нескольких суток, что, как правило, приводит к отмене препаратов через 48–72 ч после назначения. Однако возникшие симптомы могут сохраниться в течение более длительных промежутков времени, причем восстановление иногда может быть неполным (N.Simonian и соавт., 1993).
Множество нежелательных эффектов интеракции препаратов, использующихся для лечения злокачественных новообразований органов ЖРС с психофармакологическими средствами, связаны с нарушением обмена одного из агентов. В ходе многочисленных исследований установлен риск лекарственных взаимодействий, объясняющийся особенностями метаболизма психотропных препаратов основных классов и использующихся при лечении рака органов ЖРС противоопухолевых медикаментов. Основные из них представлены в табл. 1–4, к которым прилагаются пояснения для удобства использования.

Признано, что онкология – одна из областей медицины, наиболее широко использующая самые разнообразные методы лечения. Кроме широкого арсенала соматотропных средств, применяются методы физического воздействия (радиотерапевтические технологии), хирургическое лечение. Онкологические заболевания являются причиной декомпенсации или возникновения заболеваний других систем органов, психических нарушений, что приводит к необходимости назначения дополнительных соматотропных и психотропных средств.

Несмотря на уже имеющиеся данные, информация о транзакции препаратов требует постоянного обновления и дополнения.
Примечания
1В группу противоопухолевых средств, применяемых для лечения злокачественных новообразований органов ЖРС, были включены основные классы цитостатиков, таргетные средства, препараты гормонотерапии.
2В группу вспомогательных препаратов, широко применяемых при лечении злокачественных новообразований органов ЖРС, вошли аналгетики (в том числе наркотические) и антиэметики.
3Особая форма пароксизмальной ЖТ, так называемая полиморфная (двунаправленная) веретенообразная ЖТ («пируэт», torsade de pointes), которая характеризуется нестабильной, постоянно меняющейся формой комплекса QRS и развивается на фоне удлиненного интервала Q–T. Полагают, что в основе двунаправленной веретенообразной ЖТ лежит значительное удлинение интервала Q–T, которое сопровождается замедлением и асинхронизмом процесса реполяризации в миокарде желудочков, что и создает условия для возникновения повторного входа волны возбуждения (re-entry) или появления очагов триггерной активности.
Сноски к табл. 1–4.
◊1 Кардиотоксический эффект, связанный с риском развития желудочковых аритмий за счет удлинения интервала Q–T. В случае необходимости такого сочетания препаратов необходим регулярный контроль уровня электролитов крови во избежание нарастания гипокалиемии или гипомагниемии.
●2 Высокий риск гематологической токсичности, особенно агранулоцитоза.
●3 При сочетании этих препаратов высок риск развития дозозависимого удлинения интервала Q–T и возникновения опасных желудочковых аритмий, включая желудочковую тахикардию и torsade de pointes, вплоть до внезапной сердечной смерти (F.Huyse, R. van Schijndel, 1988; J.O'Brien и соавт., 1999; A.Glassman, J.Bigger, 2001).
◊4 Усиление нейротоксических эффектов изофосфамида.
◊5 Увеличение концентрации клозапина в крови. Точный механизм взаимодействия неизвестен, но, вероятно, связан со снижением метаболизма клозапина, осуществляющегося через CYP-450 1A2, 2C19 и/или 3A4 (V.Gabbay и соавт., 2002). Для предотвращения этих эффектов следует начинать с очень низких доз клозапина, если все же избежать такой комбинации лекарственных средств не удается.
◊6 За счет выраженной индукции изофермента CYP-450 3A4 может снижаться концентрация антипсихотиков в крови. Во избежание снижения эффекта антипсихотиков необходимо более тщательно мониторировать психический статус пациента, что позволит своевременно увеличить дозу антипсихотика при необходимости (Y.Wong, C.Yeh, 2001).
☺7 Умеренная индукция изофермента CYP-450 3A4, что незначительно повышает дозу антипсихотиков в крови. В доступной печати не сообщается о каких-либо серьезных последствиях такой комбинации препаратов (J.Miceli и соавт., 2000; C.Prakash и соавт., 2000).
◊8 Увеличение концентрации антипсихотиков в крови за счет изофермента CYP-450 3A4. Сочетание этих лекарственных средств возможно, однако влечет за собой необходимость более тщательной титрации доз антипсихотиков (следует учитывать, что апрепитант не назначается на длительное время).
◊9 Сочетание кветиапина с мощным ингибитором изофермента CYP-450 3A4 может приводить к накоплению препарата в крови и проявляться, в частности, угнетением дыхания и потерей сознания (C.DeVane, C.Nemeroff, 2001). Кроме этого, имеются единичные публикации, описывающие существенное увеличение аппетита и глюкозы сыворотки (прибавка в массе тела более чем на
22 кг за 6 мес – вес пациента вернулся к прежнему спустя 5 мес после отмены обоих препаратов) (E.Spina, J de Leon, 2007).
◊10 Увеличение концентрации арипипразола в крови за счет ингибиторования изоферментов CYP-450 3A4 и/или 2D6, однако к серьезным нежелательным последствиям, это, как правило, не ведет.
☺11 Незначительное повышение концентрации антипсихотиков в крови за счет ингибиторования изофермента CYP-450 3A4 (J.Miceli
и соавт., 2000).
◊12 Риск угнетения центральной нервной системы и дыхательного центра, особенно у пожилых или истощенных пациентов. Рекомендуется избегать управления транспортными средствами и механизмами во время приема комбинации указанных препаратов (M.Divoll и соавт., 1981; L.Lemberger и соавт., 1988).
●13 Высокий риск развития судорог и угнетения дыхательного центра, особенно у пожилых больных, пациентов с черепно-мозговой травмой или алкоголизмом в анамнезе, метаболическими, инфекционными расстройствами или при опухоли головного мозга (F.Pisani и соавт., 1999; J.Gardiner и соавт., 2000).
◊14 Увеличение концентрации в крови препаратов, метаболизм которых осуществляется изоферментом CYP-450 3A4 за счет ингибирования этого фермента антидепрессантами, что требует дополнительной коррекции дозы противоопухолевых препаратов каждый раз, когда антидепрессант был добавлен в схему лечения или отменен.
◊15 За счет выраженной индукции изофермента CYP-450 3A4 может снижаться концентрация антидепрессанта в крови. Во избежание снижения эффекта антидепрессантов необходимо более тщательно мониторировать психический статус пациента, что позволит своевременно увеличить дозу антидепрессанта при необходимости (P.Damkier и соавт., 1999).
●16 Представленный ряд препаратов из группы СИОЗС является ингибитором изофермента CYP-450 2D6, процесс превращения тамоксифена в его активный метаболит эндоксифен замедляется или даже прекращается, что ухудшает клинический прогноз онкологического заболевания.
●17 Значительное увеличение концентрации циталопрама и эсциталопрама в крови за счет ингибирования изофермента CYP-450 2C19, что клинически может проявляться удлинением интервала Q–T с увеличением риска развития опасных аритмий, в частности torsade de pointes (риск возрастает при заболеваниях сердечно-сосудистой системы и нарушениях электролитного баланса, например гипокалиемии, гипомагниемии).
☺18 Опубликованы единичные клинические случаи, сообщающие об успешном применении флуоксетина при депрессивно-дисфорической симптоматике, развившейся на фоне приема ондансетрона (D.Oren, 1995).
☺19 Такое сочетание препаратов относительно безопасно, если не превышается дозировка: 40 мг/сут для циталопрама и 20 мг/сут для эсциталопрама. Несмотря на то что происходит ингибирование изофермента CYP-450 3A4, это значительно не затрагивает фармакокинетику антидепрессантов, поскольку они частично перерабатываются другими изоферментами (CYP-450 2C19, 3A4 и 2D6).
●20 Высокий риск развития серотонинового синдрома.
◊21 Увеличение концентрации бензодиазепинов в крови за счет угнетения изофремента CYP-450 3A4 апрепитантом. Клиническими проявлениями могут стать угнетение дыхательного центра и центральной нервной системы (G.Dresser и соавт., 2000; J.Hardman
и соавт., 2001).
◊22 Ограниченные данные клинических наблюдений свидетельствуют о том, что параллельное применение этих препаратов может уменьшить концентрации карбамазепина в крови и его и фармакологические эффекты. Точный механизм взаимодействия неизвестен. В одном клиническом случае у молодой женщины с эпилепсией в анамнезе развился тонико-клонический припадок на фоне приема карбамазепина и противоопухолевой терапии цисплатином и доксорубицином. Рекомендованы тщательное наблюдение и своевременная коррекция доз противосудорожных препаратов в случае необходимости такого сочетания лекарственных средств (C.Neef и соавт., 1988).
◊23 Увеличение гепатотоксичности.
☺24 Ламотриджин является слабым ингибитором дигидрофолатредуктазы. Теоретически одновременное назначение с другими ингибиторами этого же фремента может иметь негативные последствия для костного мозга, возможно, увеличивая риск мегалобластной анемии и других гематологических заболеваний.
◊25 Теоретически параллельное назначение этих препаратов может приводить к снижению концентрации противоопухолевых средств в крови за счет того, что карбамазепин является индуктором изоферментов CYP-450 3A4 и/или 2C8. Если все же такая комбинация необходима, рекомендован тщательный контроль содержания противоопухолевых средств в крови и увеличение дозы при необходимости (C.Jamis-Dow и соавт., 1993; C.Spencer и соавт., 1994; S.Baker, 1997).
◊26 Снижение концентрации ламотриджина в крови и его фармакологических эффектов, что может потребовать коррекции дозы ламотриджина (I.Ohman и соавт., 2000; T.Holdich и соавт., 1991).
◊27 Карбамазепин может приводить к снижению концентрации в крови кортикостероидов за счет индукции изофремента CYP-450 3A4, поэтому доза дексаметазона должна контролироваться каждый раз, когда карбамазепин был добавлен в схему лечения или отменен (M.Privitera и соавт., 1982; R.Levy, 1995; G.Keitner и соавт., 1989).
☺28 Такое сочетание препаратов теоретически может привести к снижению подвижности желудка и задержке его освобождения, однако вероятность этого слишком мала (J.Nimmo и соавт., 1973; J.Clark и соавт., 1983).
Сведения об авторе
Самушия Марина Антиповна – канд. мед. наук, доц. каф. психиатрии и психосоматики ФППОВ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: sma-psychiatry@mail.ru
Список исп. литературыСкрыть список1. Baker SD. Drug interactions with the taxanes. Pharmacotherapy 1997; 17 (5 Pt. 2): s126–32.
2. Clark JM, Seager SJ. Gastric emptying following premedication with glycopyrrolate or atropine. Br J Anaesth 1983; 55: 1195–9.
3. Crewe HK, Notley LM, Wunsch RM et al. Metabolism of tamoxifen by recombinant human cytochrome P-450 enzymes: formation of the 4-hydroxy, 4'-hydroxy and N-desmethyl metabolites and isomerization of trans-4-hydroxytamoxifen. Drug Metab Dis 2002; 30: 869–74.
4. Damkier P, Hansen LL, Brosen K. Effect of fluvoxamine on the pharmacokinetics of quinidine. Eur J Clin Pharmacol 1999; 55: 451–6.
5. DeVane CL, Nemeroff CB. Clinical pharmacokinetics of quetiapine – An atypical antipsychotic. Clin Pharmacokinet 2001; 40: 509–22.
6. Divoll M, Greenblatt DJ, Lacasse Y, Shader RI. Benzodiazepine overdosage: plasma concentrations and clinical outcome. Psychopharmacol Berl 1981; 73: 381–3.
7. Dresser GK, Spence JD, Bailey DG. Pharmacokinetic-pharmacodynamic consequences and clinical relevance of cytochrome P-450 3A4 inhibition. Clin Pharmacokinet 2000; 38: 41–57.
8. Gabbay V, O'Dowd MA, Mamamtavrishvili M, Asnis GM. Clozapine and oral contraceptives: A possible drug interaction. J Clin Psychopharmacol 2002; 22: 621–2.
9. Gardiner JS, Blough D, Drinkard CR et al. Tramadol and seizures: a surveillance study in a managed care population. Pharmacotherapy 2000; 20: 1423–31.
10. Glassman AH, Bigger JT Jr. Antipsychotic drugs: prolonged Q–Tc interval, torsade de pointes, and sudden death. Am J Psychiat 2001; 158: 1774–82.
11. Goetz MP, Rae JM, Suman VJ et al. Pharmacogenetics of tamoxifen biotransformation is associated with clinical outcomes of efficacy and hot flashes. J Clin Oncol 2005; 23: 9312–8.
12. Hardman JG, Limbird LE, Gilman AG (eds). Goodman and Gilman's the Pharmacological Basis of Therapeutics. 10th ed. NY: McGraw-Hill 2001.
13. Holdich T, Whiteman P, Orme M et al. Effect of lamotrigine on the pharmacology of the combined oral contraceptive pill. Epilepsia 32 (Suppl.) 1991; 96.
14. Huyse F, van Schijndel RS. Haloperidol and cardiac arrest. Lancet 1988; 2: 568–9.
15. Iannini PB. Cardiotoxicity of macrolides, ketolides and fluoroquinolones that prolong the Q–Tc interval. Exp Opin Drug Saf 2002; 1: 121–8.
16. Jamis-Dow CA, Klecker RW, Katki AG, Collins JM. Metabolism of Taxol by human liver microsomes and effect of inhibitors (Meeting abstract). Proc Ann Meet Am Assoc Cancer Res 1993; 34: a21981993.
17. Keitner GI, Fruzzetti AE, Miller IW et al. The effect of anticonvulsants on the dexamethasone suppression test. Can J Psychiat 1989; 34: 441–3.
18. Lemberger L, Rowe H, Bosomworth JC et al. The effect of fluoxetine on the pharmacokinetics and psychomotor responses of diazepam. Clin Pharmacol Ther 1988; 43: 412–9.
19. Levy RH. Cytochrome P-450 isozymes and antiepileptic drug interactions. Epilepsia 1995; 36 (Suppl.) 5: s8–13.
20. Miceli JJ, Anziano RJ, Robarge L et al. The effect of carbamazepine on the steady-state pharmacokinetics of ziprasidone in healthy volunteers. Br J Clin Pharmacol 2000; 49 (Suppl. 1): s65–70.
21. Miceli JJ, Smith M, Robarge L et al. The effects of ketoconazole on ziprasidone pharmacokinetics – a placebo-controlled crossover study in healthy volunteers. Br J Clin Pharmacol 2000; 49 (Suppl. 1): s71–6.
22. Neef C, de Voogd-van der Straaten. An interaction between cytostatic and anticonvulsant drugs. Clin Pharmacol Ther 1988; 43: 372–5.
23. Nimmo J, Heading RC, Tothill P, Prescott LF. Pharmacological modification of gastric emptying: effects of propantheline and metoclopramide on paracetamol absorption. Br Med J 1973; 1: 587–9.
24. O'Brien JM, Rockwood RP, Suh KI. Haloperidol-induced torsade de pointes. Ann Pharmacother 1999; 33: 1046–9.
25. Ohman I, Vitols S, Tomson T. Lamotrigine in pregnancy: pharmacokinetics during delivery, in the neonate, and during lactation. Epilepsia 2000; 41: 706–13.
26. Oren DA. Dysphoria after treatment with ondansetron. Am J Psychiat 1995; 152: 1101.
27. Pisani F, Spina E, Oteri G. Antidepressant drugs and seizure susceptibility: from in vitro data to clinical practice. Epilepsia 1999; 40 (Suppl. 10): s48–56.
28. Plushner SL. Valerian: valeriana officinalis. Am J Health Syst Pharm 2000; 57: 328–35.
29. Prakash C, Kamel A, Cui D et al. Identification of the major human liver cytochrome P-450 isoform(s) responsible for the formation of the primary metabolites of ziprasidone and prediction of possible drug interactions. Br J Clin Pharmacol 2000; 49 (Suppl. 1): s35–42.
30. Privitera MR, Greden JF, Gardner RW et al. Interference by carbamazepine with the dexamethasone suppresion test. Biol Psychiat 1982; 17: 611–20.
31. Schroth W, Antoniadou L, Fritz P et al. Breast cancer treatment outcome with adjuvant tamoxifen relative to patient CYP2D6 and CYP2C19 genotypes. J Clin Oncol 2007; 25: 5187–93.
32. Simonian NA, Gilliam FG, Chiappa KH. Ifosfamide causes a diazepam-sensitive encephalopathy. Neurol 1993; 43: 2700–2.
33. Spencer CM, Faulds D. Paclitaxel. A review of its pharmacodynamic and pharmacokinetic properties and therapeutic potential in the treatment of cancer. Drugs 1994; 48: 794–847.
34. Spina E, de Leon J. Metabolic drug interactions with newer antipsychotics: a comparative review. Basic Clin Pharmacol Toxicol 2007; 100: 4–22.
35. Vieweg WV. New generation antipsychotic drugs and Q–Tc interval prolongation. Prim Care Companion J Clin Psychiat 2003; 5: 205–15.
36. Vieweg WV, Schneider RK, Wood MA. Torsade de pointes in a patient with complex medical and psychiatric conditions receiving low-dose quetiapine. Acta Psychiat Scand 2005; 112: 318–22.
37. Wilner KD, Hansen RA, Folger CJ, Geoffroy P. The pharmacokinetics of ziprasidone in healthy volunteers treated with cimetidine or antacid. Br J Clin Pharmacol 2000; 49 (Suppl. 1): s57–60.
38. Witchel HJ, Hancox JC, Nutt DJ. Psychotropic drugs, cardiac arrhythmia, and sudden death. J Clin Psychopharmacol 2003; 23: 58–77.
39. Wong YWJ, Yeh C, Thyrum PT. The effects of concomitant phenytoin administration on the steady-state pharmacokinetics of quetiapine. J Clin Psychopharmacol 2001; 21: 89–93.


