Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№01 2014
Флувоксамин как антидепрессант и кардиопротектор: роль s1-рецепторов как общего патогенетического звена депрессий и сердечно-сосудистых заболеваний №01 2014
Номера страниц в выпуске:46-51
Депрессии и сердечно-сосудистые заболевания находятся в тесных коморбидных взаимоотношениях, подразумевающих наличие общего патогенетического звена. Хотя механизмы этих соотношений на сегодняшний день не ясны, исследования последних лет выявили, что процессы, связанные с экспрессией и функциями s1-рецепторов, частично способны объяснить патогенез обоих типов расстройств. В частности, экспрессия s1-рецепторов осуществляется не только в тканях головного мозга, но и кардиомиоцитах левого и правого желудочков сердца.
Резюме. Депрессии и сердечно-сосудистые заболевания находятся в тесных коморбидных взаимоотношениях, подразумевающих наличие общего патогенетического звена. Хотя механизмы этих соотношений на сегодняшний день не ясны, исследования последних лет выявили, что процессы, связанные с экспрессией и функциями s1-рецепторов, частично способны объяснить патогенез обоих типов расстройств. В частности, экспрессия s1-рецепторов осуществляется не только в тканях головного мозга, но и кардиомиоцитах левого и правого желудочков сердца. Согласно экспериментальным работам агонисты s1-рецепторов (дегидроэпиандростерон и флувоксамин) обладают и антидепрессивным, и кардиопротективным действием. Их благоприятное действие на миокард представляется комплексным и состоит из снижения симпатической активности через центральные механизмы, через непосредственную активацию внутриклеточных каскадов трансдукции и через повышение выработки нейротрофного фактора мозга благодаря шаперонной активности рецепторов. Данная публикация представляет собой обзор этих исследований.
Ключевые слова: флувоксамин, кардиопротектор, s1-рецепторы.
Fluvoxamine as an antidepressant and cardioprotector:
the role of s1-receptors as the common pathological pathway
in depression and cardiovascular diseases
T.S.Syunyakov
FSBI Zakusov Institute of Pharmacology RAMS, Moscow
Summary. Depression and cardiovascular diseases often co-occur meaning the possibility of existence of common pathological pathway. While causes of this relationships are still not clear the recent studies show that processes linked to s1-receptors expression and functions may partially be causative for both disorders. Thus s1-receptor expression occur not only in the brain tissues but also in the cells of cardiac left and right ventricles. According to experimental studies s1-receptor agonists
(i.e. dehydroepiandrosterone and fluvoxamine) provide both antidepressant action and cardioprotection. The cardioprotective action seems to be complex in nature and consists of sympathetic activity reduction via central mechanisms, direct downstream effects of cardiac s1-receptors activation, and conversion of pro-BDNF into mature BDNF via chaperone activity of s-receptors. This publication is the over view of the sestudies.
Key words: fluvoxamine, cardioprotector, s1-receptors.
Высокая коморбидность депрессивных расстройств и сердечно-сосудистых заболеваний (ССЗ) является предметом активного изучения. У пациентов с ишемической болезнью сердца (ИБС) синдромально завершенные депрессивные расстройства встречаются в 20%, а клинически незавершенные проявления гипотимии – в 27% [1]. Вместе с тем в недавно опубликованном обзоре, посвященном данной проблеме, указывается на то, что масштаб проблемы может быть даже выше и затрагивать не менее 1/2 больных данного контингента [2]. При этом указывается на серьезное взаимное влияние аффективных и сердечно-сосудистых расстройств.
Так, сердечно-сосудистые нарушения могут провоцировать возникновение депрессивных, тогда как последние повышают вероятность возникновения ИБС, инфаркта миокарда (ИМ), артериальной гипертензии (АГ) и отягощают прогноз уже имеющихся за счет расширения и усиления тяжести симптоматики и ассоциируются с повышением вероятности неблагоприятных исходов ССЗ (смертности и повторных сердечно-сосудистых катастроф) вне зависимости от наличия традиционных факторов риска [3]. У лиц с сочетанной патологией депрессивные расстройства обнаруживают взаимосвязь с функциональным классом (ФК) сердечной недостаточности [4]. По данным New York Heart Association (NYHA), распространенность депрессивных нарушений обнаруживает взаимосвязь с ФК сердечной недостаточности, повышаясь с 11 до 20%, 38 и 42% по мере возрастания ФК расстройства с I до IV. В связи со сказанным выше у всех пациентов с ИМ, хронической стенокардией и после операции аортокоронарного шунтирования рекомендуется обследование на предмет выявления депрессивных расстройств [5].
Все эти факты, собранные воедино, могут свидетельствовать о наличии общего патогенетического начала у депрессивных и сердечно-сосудистых расстройств, хотя в настоящее время лежащие в их основе механизмы остаются мало изученными. Дополнительным доводом в пользу данного предположения является то, что фармакологическая либо психологическая терапия депрессивных расстройств в постинфарктном периоде ассоциируется с улучшением прогноза [6, 7]. Среди антидепрессантов одними из наиболее безопасных при сердечно-сосудистой патологии представляются селективные ингибиторы обратного захвата серотонина (СИОЗС): они не оказывают негативного влияния на сердечную проводимость, не вызывают ортостатической гипотензии, снижают вариабельность сердечного ритма и, что немаловажно, снижают активацию тромбоцитов и уменьшают циркуляцию факторов воспаления [5, 8, 9]. Более того, их применение ассоциируется с 42% редукцией смертности и вероятности повторного возникновения ИМ [6], в том числе и у курильщиков [10], а назначаемые в постинфарктном периоде, они противодействуют депрессивным расстройствам, повышают качество жизни и приверженность терапии [6, 8].
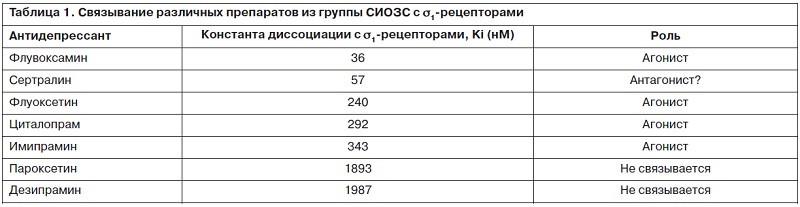
Несмотря на данные высокие показатели эффективности применения СИОЗС, обзорная работа общества Cochrain выявила лишь незначительный положительный эффект СИОЗС у больных с депрессиями, протекающими коморбидно с ССЗ [11]. Вместе с тем высказывается мнение о том [12], что низкая результативность класса СИОЗС может быть связана именно с рассмотрением всех препаратов этой группы вместе, тогда как, несмотря на наличие общего механизма – блокады транспортера серотонина, разные представители СИОЗС различаются по своим фармакодинамическим свойствам и прежде всего по способности связываться с s1-рецепторами [13–15]. Так, флувоксамин является их наиболее мощным агонистом, сертралин – мощным антагонистом, в то время как пароксетин не обладает сродством к s1-рецепторам (табл. 1) [15].
Таким образом, взаимодействие с s1-рецепторами представляется одним из ключевых различий в фармакологических свойствах различных представителей класса СИОЗС, что диктует необходимость хотя бы кратко рассмотреть информацию, известную о s1-рецепторах.
s1-Рецепторы расположены внутри клетки на мембране шероховатой эндоплазматической сети – в месте осуществления трансляции матричной РНК на рибосомах, биосинтеза липидов и участвующей во внутриклеточных процессах гомеостаза кальция, а также играющей важную роль в выживании клетки, клеточной гибели/апоптоза. Процессы, сопряженные с оксидативным стрессом, ишемией, нарушением гомеостаза кальция и повышенным формированием неправильно уложенного белка, приводят к накоплению последнего (так называемый эндоплазматический стресс, ER-стресс) и ответной клеточной реакции в виде повышения активности внутриклеточных шаперонов и деградации неправильно упакованного белка [16, 17]. Вместе с тем оба типа процессов (ER-стресс и ответная реакция) вовлечены в механизмы и сердечно-сосудистых расстройств, и депрессии [16–21]. В частности, в кардиомиоцитах при сердечной недостаточности и в нейронах височной коры при депрессивных расстройствах обнаружено существенное увеличение уровня белка BiP [16, 17]. Следует отметить, что s1-рецепторы в неактивном состоянии находятся в комплексе с BiP, а их активация под действием агонистов приводит к диссоциации данного комплекса. Сами s1-рецепторы также выполняют функции молекулярного шаперона, т.е. способствуют формированию правильной третичной и четвертичной структуры белков (пространственной укладке, фолдингу), способствующей образованию активных центров белковых молекул.
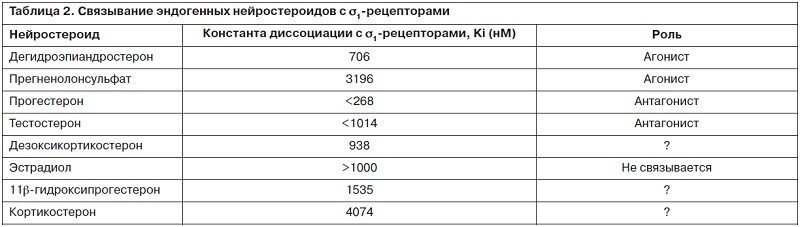
Кроме того, они опосредуют сигнальные функции мобилизованных инозитолтрифосфатом (IP3) ионов кальция, открытие ионных каналов, активацию и локализацию протеинкиназ, клеточные окислительно-восстановительные реакции, высвобождение нейромедиаторов, процессы воспаления, синаптогенеза, процессы дифференциации выживания клеток. В организме известными эндогенными лигандами s1-рецепторов являются нейростероиды, в частности дегидроэпиандростерон – DHEA (агонист), прогестерон (антагонист), тестостерон, аллопрегненолон (табл. 2).
Исчерпывающая информация о структуре и функциях s1-рецепторов в отечественной литературе приводилась в нескольких обзорах, свободно доступных в полнотекстовых вариантах [22–24]. Для целей данной работы важно отметить, что существуют строгие доказательства вовлеченности s1-рецепторов в механизмы депрессивных расстройств и то, что их агонисты проявляют антидепрессивное действие. Вместе с тем моделирование гипертрофии миокарда перегрузкой давлением, связанной с потреблением высокосолевой диеты, выявило тесные взаимосвязи между снижением экспрессии s1-рецепторов в головном мозге и падением концентрации эндогенного агониста s1-рецепторов DHEA в желудочковой системе головного мозга и гипоталамусе не только с формированием «депрессивного» поведения, но и с сердечной дисфункцией [25]. При этом введение агониста s1-рецепторов PRE084 в боковые желудочки мозга вызывало улучшение функций миокарда, которое нивелировалось при одновременном введении антагониста s1-рецепторов BD1063.
в механизмы депрессивных расстройств и то, что их агонисты проявляют антидепрессивное действие. Вместе с тем моделирование гипертрофии миокарда перегрузкой давлением, связанной с потреблением высокосолевой диеты, выявило тесные взаимосвязи между снижением экспрессии s1-рецепторов в головном мозге и падением концентрации эндогенного агониста s1-рецепторов DHEA в желудочковой системе головного мозга и гипоталамусе не только с формированием «депрессивного» поведения, но и с сердечной дисфункцией [25]. При этом введение агониста s1-рецепторов PRE084 в боковые желудочки мозга вызывало улучшение функций миокарда, которое нивелировалось при одновременном введении антагониста s1-рецепторов BD1063.
Помимо этого некоторые лиганды s1-рецепторов, такие как (+)-3-РРР, (+)-пентазоцин и галоперидол, влияют на сократительную способность, токи ионов Ca2+ и ритмическую активность культур клеток кардиомиоцитов [27]. Немаловажно также то, что были получены данные о снижении экспрессии s1-рецепторов в тканях сердечной мышцы по мере развития гипертрофии ЛЖ и сердечной недостаточности. Так, M.Bhuiyan и K.Fukunaga (2009, 2010 г.) в экспериментальных условиях смоделировали развитие гипертрофии ЛЖ путем сужения просвета аорты, и через 4 нед иммуногистохимический анализ продемонстрировал падение экспрессии s1-рецепторов в кардиомиоцитах по мере прогрессирования гипертрофии миокарда и угнетения сердечной функции [12, 26].
В другой работе с использованием этой же модели поперечного сдавливания аорты была выявлена достоверная корреляция между снижением экспрессии
s1-рецепторов в клетках миокарда и выраженностью сердечной недостаточности [28]. При этом введение агониста s1-рецепторов дегидроэпиандростерона (DHEA) противодействовало падению их экспрессии в кардиомиоцитах, наблюдаемому при гипертрофии, и смягчало выраженность моделируемой гипертрофии ЛЖ [26, 27, 29]. В исследовании [29] были получены еще более убедительные данные о вовлеченности s1-рецепторов в механизмы развития гипертрофии миокарда: при одновременном введении DHEA и специфического антагониста s1-рецепторов NE-100 блокировалось антигипертрофическое действие агониста.
Подводя черту под указанными данными, можно сделать заключение о вовлеченности s1-рецепторов в механизмы и депрессивных, и сердечно-сосудистых расстройств, и о том, что изменения экспрессии и активности s1-рецепторов могут выступать в качестве связующего патогенетического звена, по крайней мере частично обусловливающего высокие коморбидные соотношения между этими группами расстройств. Возвращаясь к разногласиям между данными клинических исследований (о существенном снижении риска сердечно-сосудистых событий наряду с улучшением терапевтических перспектив при применении СИОЗС у больных с сочетанием депрессивных и сердечно-сосудистых расстройств) и выводами метаанализа Cochrane (о незначительном эффекте данных препаратов как единой группы), интерес исследователей сфокусировался на сравнительном изучении влияния индивидуальных ее представителей на кардиальную дисфункцию в зависимости от способности связываться с s1-рецепторами.
С этой целью в работе [28] были исследованы два препарата: флувоксамин, являющийся мощным агонистом s1-рецепторов, и не связывающийся с ними по данным позитронной эмиссионной томографии пароксетин [30]. Дизайн данной работы включал 3 группы экспериментальных животных: группу мышей с моделируемой при помощи сдавливания аорты гипертрофией миокарда, наблюдаемых в течение 4 и 6 нед, и группу животных, подвергнувшихся контрольному оперативному вмешательству. В опытной группе мышам вводились флувоксамин, либо пароксетин, либо антагонист s1-рецепторов NE-100, либо комбинация флувоксамина и NE-100. В контрольной группе – флувоксамин, либо пароксетин, либо NE-100. В результатах оценивались экспрессия s1-рецепторов в кардиомиоцитах, выраженность гипертрофии ЛЖ и эхокардиографическая картина тяжести сердечной недостаточности. Данное исследование помимо выявления взаимосвязи между выраженностью гипертрофии миокарда, тяжестью сердечной недостаточности и падением экспрессии s1-рецепторов в миокарде (об этом свидетельствуют различия между животными опытной группы через 4 и 6 нед) продемонстрировало, что флувоксамин, но не пароксетин препятствовал развитию гипертрофии миокарда, его функциональных нарушений и падению экспрессии s1-рецепторов, а введение NE-100 блокировало благоприятные эффекты препарата на гипертрофию ЛЖ и функциональные расстройства, хотя и не влияло на наблюдающееся восстановление экспрессии s1-рецепторов. Представляется интересным, что в этой же работе все выявленные результаты были подтверждены и на другой модели гипертрофии миокарда, вызванной введением ангиотензина.
Таким образом, авторы пришли к выводу, что не все СИОЗС обладают кардиопротективным действием, которое обусловлено не ингибированием активности транспортера серотонина, а активацией s1-рецепторов в клетках сердечной ткани. Кроме того, исследование доказало участие s1-рецепторов в различных механизмах формирования изменений в сердечной ткани и эффективность их профилактики при использовании агониста s1-рецепторов флувоксамина. Интерпретируя результаты данного исследования, авторы особо подчеркивают тот факт, что, хотя введение антагониста s1-рецепторов блокировало кардиопротективные эффекты флувоксамина, оно не препятствовало восстановлению экспрессии s1-рецепторов в эндоплазматическом ретикулуме. В качестве возможного объяснения исследователи высказали предположение о том, что при реализации наблюдаемого кардиопротективного действия играет роль не столько повышение экспрессии рецепторов, сколько запускаемые их активацией каскады последующих внутриклеточных событий, а влияние на экспрессию опосредовано иными комплексными механизмами. В частности, в данном исследовании было обнаружено, что стимуляция s1-рецепторов флувоксамином ассоциировалась с активацией akt-пути с последующим фосфорилированием эндоплазматической NO-синтазы. В отсутствие флувоксамина или при его одновременном введении с NE-100 происходило снижение активности этих внутриклеточных процессов. Таким образом, можно полагать, что антигипертрофическое действие агонистов s1-рецепторов частично обусловлено активацией akt-пути внутриклеточной передачи сигнала и последующей активацией NO-синтазы.
Следует отметить, что кардиопротективный эффект агонистов s1-рецепторов представляется не дискретным, а состоящим из множества влияний. Так, помимо приведенных данных о его взаимосвязи с активацией внутриклеточных механизмов передачи сигнала в исследовании K.Ito и соавт. (2012 г.) [25] было показано, что, как и эндогенный нейростероид DHEA, флувоксамин при введении в желудочки головного мозга ассоциировался не только с редукцией депрессивного поведения экспериментальных животных, но и со смягчением патологических процессов в миокарде.
Таким образом, в качестве одного из элементов комплексного кардиопротективного действия агонистов s1-рецепторов, и в частности флувоксамина, по мнению авторов, могут выступать центральные механизмы снижения тонуса симпатической нервной системы. Наряду с этим другая группа исследователей обнаружила, что длительное введение мощного агониста s1-рецепторов кутамезина (SA4503) приводило к существенному увеличению экспрессии s1-рецепторов наряду со значительным ростом выделения нейротрофного фактора головного мозга (BDNF), обусловленного усилением трансформации про-BDNF в зрелый BDNF [31, 32]. Авторы указывают, что наблюдаемые изменения концентрации BDNF напрямую связаны с шаперонной активностью s1-рецепторов и могут противодействовать индуцированной ER-стрессом агрегации белков (например, BDNF), играющей роль в патогенезе ССЗ и психиатрических заболеваний. В связи с этими обнаружениями следует отметить, что существенную роль в реализации действия антидепрессантов в настоящее время приписывают наблюдающемуся при их применении повышению уровней BDNF, о чем свидетельствуют результаты 3 метаанализов [33–35].
Кроме того, в недавних исследованиях было обнаружено, что при ИБС концентрация BDNF значительно ниже, чем у здоровых людей [36], а также у лиц с нестабильной стенокардией по сравнению со стабильной [37], а его концентрации обнаруживают обратную зависимость с уровнями триглицеридов, липопротеинов низкой плотности, фибриногена, наличием сахарного диабета, мужским полом и возрастом – известными факторами риска ССЗ [38]. Эти данные убедительно свидетельствуют о важной роли BDNF в патогенезе не только депрессивных, но и сердечно-сосудистых расстройств, а также о том, что модуляция активности s1-рецепторов, оказывая влияние на уровни нейротрофного фактора головного мозга, может проявлять благоприятное действие при обеих группах расстройств.
Таким образом, результаты, полученные в исследованиях последних лет, указывают на участие как центральных, так и периферических s1-рецепторов в патогенетических механизмах и депрессивных, и сердечно-сосудистых расстройств и позволяют частично объяснить их тесные коморбидные взаимосвязи, а их агонисты, прежде всего дегидроэпиандростерон и флувоксамин, по данным экспериментальных исследований, оказывая влияние на данное общее звено патогенеза, проявляют и антидепрессивное, и кардиопротективное действие.
Сведения об авторе
Т.С.Сюняков – канд. мед. наук, ст. науч. сотр. ФГБУ НИИ фармакологии им. В.В.Закусова РАМН. E-mail: Sjunja@bk.ru
Ключевые слова: флувоксамин, кардиопротектор, s1-рецепторы.
Fluvoxamine as an antidepressant and cardioprotector:
the role of s1-receptors as the common pathological pathway
in depression and cardiovascular diseases
T.S.Syunyakov
FSBI Zakusov Institute of Pharmacology RAMS, Moscow
Summary. Depression and cardiovascular diseases often co-occur meaning the possibility of existence of common pathological pathway. While causes of this relationships are still not clear the recent studies show that processes linked to s1-receptors expression and functions may partially be causative for both disorders. Thus s1-receptor expression occur not only in the brain tissues but also in the cells of cardiac left and right ventricles. According to experimental studies s1-receptor agonists
(i.e. dehydroepiandrosterone and fluvoxamine) provide both antidepressant action and cardioprotection. The cardioprotective action seems to be complex in nature and consists of sympathetic activity reduction via central mechanisms, direct downstream effects of cardiac s1-receptors activation, and conversion of pro-BDNF into mature BDNF via chaperone activity of s-receptors. This publication is the over view of the sestudies.
Key words: fluvoxamine, cardioprotector, s1-receptors.
Высокая коморбидность депрессивных расстройств и сердечно-сосудистых заболеваний (ССЗ) является предметом активного изучения. У пациентов с ишемической болезнью сердца (ИБС) синдромально завершенные депрессивные расстройства встречаются в 20%, а клинически незавершенные проявления гипотимии – в 27% [1]. Вместе с тем в недавно опубликованном обзоре, посвященном данной проблеме, указывается на то, что масштаб проблемы может быть даже выше и затрагивать не менее 1/2 больных данного контингента [2]. При этом указывается на серьезное взаимное влияние аффективных и сердечно-сосудистых расстройств.
Так, сердечно-сосудистые нарушения могут провоцировать возникновение депрессивных, тогда как последние повышают вероятность возникновения ИБС, инфаркта миокарда (ИМ), артериальной гипертензии (АГ) и отягощают прогноз уже имеющихся за счет расширения и усиления тяжести симптоматики и ассоциируются с повышением вероятности неблагоприятных исходов ССЗ (смертности и повторных сердечно-сосудистых катастроф) вне зависимости от наличия традиционных факторов риска [3]. У лиц с сочетанной патологией депрессивные расстройства обнаруживают взаимосвязь с функциональным классом (ФК) сердечной недостаточности [4]. По данным New York Heart Association (NYHA), распространенность депрессивных нарушений обнаруживает взаимосвязь с ФК сердечной недостаточности, повышаясь с 11 до 20%, 38 и 42% по мере возрастания ФК расстройства с I до IV. В связи со сказанным выше у всех пациентов с ИМ, хронической стенокардией и после операции аортокоронарного шунтирования рекомендуется обследование на предмет выявления депрессивных расстройств [5].
Все эти факты, собранные воедино, могут свидетельствовать о наличии общего патогенетического начала у депрессивных и сердечно-сосудистых расстройств, хотя в настоящее время лежащие в их основе механизмы остаются мало изученными. Дополнительным доводом в пользу данного предположения является то, что фармакологическая либо психологическая терапия депрессивных расстройств в постинфарктном периоде ассоциируется с улучшением прогноза [6, 7]. Среди антидепрессантов одними из наиболее безопасных при сердечно-сосудистой патологии представляются селективные ингибиторы обратного захвата серотонина (СИОЗС): они не оказывают негативного влияния на сердечную проводимость, не вызывают ортостатической гипотензии, снижают вариабельность сердечного ритма и, что немаловажно, снижают активацию тромбоцитов и уменьшают циркуляцию факторов воспаления [5, 8, 9]. Более того, их применение ассоциируется с 42% редукцией смертности и вероятности повторного возникновения ИМ [6], в том числе и у курильщиков [10], а назначаемые в постинфарктном периоде, они противодействуют депрессивным расстройствам, повышают качество жизни и приверженность терапии [6, 8].
Несмотря на данные высокие показатели эффективности применения СИОЗС, обзорная работа общества Cochrain выявила лишь незначительный положительный эффект СИОЗС у больных с депрессиями, протекающими коморбидно с ССЗ [11]. Вместе с тем высказывается мнение о том [12], что низкая результативность класса СИОЗС может быть связана именно с рассмотрением всех препаратов этой группы вместе, тогда как, несмотря на наличие общего механизма – блокады транспортера серотонина, разные представители СИОЗС различаются по своим фармакодинамическим свойствам и прежде всего по способности связываться с s1-рецепторами [13–15]. Так, флувоксамин является их наиболее мощным агонистом, сертралин – мощным антагонистом, в то время как пароксетин не обладает сродством к s1-рецепторам (табл. 1) [15].

Таким образом, взаимодействие с s1-рецепторами представляется одним из ключевых различий в фармакологических свойствах различных представителей класса СИОЗС, что диктует необходимость хотя бы кратко рассмотреть информацию, известную о s1-рецепторах.
s1-Рецепторы расположены внутри клетки на мембране шероховатой эндоплазматической сети – в месте осуществления трансляции матричной РНК на рибосомах, биосинтеза липидов и участвующей во внутриклеточных процессах гомеостаза кальция, а также играющей важную роль в выживании клетки, клеточной гибели/апоптоза. Процессы, сопряженные с оксидативным стрессом, ишемией, нарушением гомеостаза кальция и повышенным формированием неправильно уложенного белка, приводят к накоплению последнего (так называемый эндоплазматический стресс, ER-стресс) и ответной клеточной реакции в виде повышения активности внутриклеточных шаперонов и деградации неправильно упакованного белка [16, 17]. Вместе с тем оба типа процессов (ER-стресс и ответная реакция) вовлечены в механизмы и сердечно-сосудистых расстройств, и депрессии [16–21]. В частности, в кардиомиоцитах при сердечной недостаточности и в нейронах височной коры при депрессивных расстройствах обнаружено существенное увеличение уровня белка BiP [16, 17]. Следует отметить, что s1-рецепторы в неактивном состоянии находятся в комплексе с BiP, а их активация под действием агонистов приводит к диссоциации данного комплекса. Сами s1-рецепторы также выполняют функции молекулярного шаперона, т.е. способствуют формированию правильной третичной и четвертичной структуры белков (пространственной укладке, фолдингу), способствующей образованию активных центров белковых молекул.
Кроме того, они опосредуют сигнальные функции мобилизованных инозитолтрифосфатом (IP3) ионов кальция, открытие ионных каналов, активацию и локализацию протеинкиназ, клеточные окислительно-восстановительные реакции, высвобождение нейромедиаторов, процессы воспаления, синаптогенеза, процессы дифференциации выживания клеток. В организме известными эндогенными лигандами s1-рецепторов являются нейростероиды, в частности дегидроэпиандростерон – DHEA (агонист), прогестерон (антагонист), тестостерон, аллопрегненолон (табл. 2).

Исчерпывающая информация о структуре и функциях s1-рецепторов в отечественной литературе приводилась в нескольких обзорах, свободно доступных в полнотекстовых вариантах [22–24]. Для целей данной работы важно отметить, что существуют строгие доказательства вовлеченности s1-рецепторов
 в механизмы депрессивных расстройств и то, что их агонисты проявляют антидепрессивное действие. Вместе с тем моделирование гипертрофии миокарда перегрузкой давлением, связанной с потреблением высокосолевой диеты, выявило тесные взаимосвязи между снижением экспрессии s1-рецепторов в головном мозге и падением концентрации эндогенного агониста s1-рецепторов DHEA в желудочковой системе головного мозга и гипоталамусе не только с формированием «депрессивного» поведения, но и с сердечной дисфункцией [25]. При этом введение агониста s1-рецепторов PRE084 в боковые желудочки мозга вызывало улучшение функций миокарда, которое нивелировалось при одновременном введении антагониста s1-рецепторов BD1063.
в механизмы депрессивных расстройств и то, что их агонисты проявляют антидепрессивное действие. Вместе с тем моделирование гипертрофии миокарда перегрузкой давлением, связанной с потреблением высокосолевой диеты, выявило тесные взаимосвязи между снижением экспрессии s1-рецепторов в головном мозге и падением концентрации эндогенного агониста s1-рецепторов DHEA в желудочковой системе головного мозга и гипоталамусе не только с формированием «депрессивного» поведения, но и с сердечной дисфункцией [25]. При этом введение агониста s1-рецепторов PRE084 в боковые желудочки мозга вызывало улучшение функций миокарда, которое нивелировалось при одновременном введении антагониста s1-рецепторов BD1063.
Помимо этого некоторые лиганды s1-рецепторов, такие как (+)-3-РРР, (+)-пентазоцин и галоперидол, влияют на сократительную способность, токи ионов Ca2+ и ритмическую активность культур клеток кардиомиоцитов [27]. Немаловажно также то, что были получены данные о снижении экспрессии s1-рецепторов в тканях сердечной мышцы по мере развития гипертрофии ЛЖ и сердечной недостаточности. Так, M.Bhuiyan и K.Fukunaga (2009, 2010 г.) в экспериментальных условиях смоделировали развитие гипертрофии ЛЖ путем сужения просвета аорты, и через 4 нед иммуногистохимический анализ продемонстрировал падение экспрессии s1-рецепторов в кардиомиоцитах по мере прогрессирования гипертрофии миокарда и угнетения сердечной функции [12, 26].
В другой работе с использованием этой же модели поперечного сдавливания аорты была выявлена достоверная корреляция между снижением экспрессии
s1-рецепторов в клетках миокарда и выраженностью сердечной недостаточности [28]. При этом введение агониста s1-рецепторов дегидроэпиандростерона (DHEA) противодействовало падению их экспрессии в кардиомиоцитах, наблюдаемому при гипертрофии, и смягчало выраженность моделируемой гипертрофии ЛЖ [26, 27, 29]. В исследовании [29] были получены еще более убедительные данные о вовлеченности s1-рецепторов в механизмы развития гипертрофии миокарда: при одновременном введении DHEA и специфического антагониста s1-рецепторов NE-100 блокировалось антигипертрофическое действие агониста.
Подводя черту под указанными данными, можно сделать заключение о вовлеченности s1-рецепторов в механизмы и депрессивных, и сердечно-сосудистых расстройств, и о том, что изменения экспрессии и активности s1-рецепторов могут выступать в качестве связующего патогенетического звена, по крайней мере частично обусловливающего высокие коморбидные соотношения между этими группами расстройств. Возвращаясь к разногласиям между данными клинических исследований (о существенном снижении риска сердечно-сосудистых событий наряду с улучшением терапевтических перспектив при применении СИОЗС у больных с сочетанием депрессивных и сердечно-сосудистых расстройств) и выводами метаанализа Cochrane (о незначительном эффекте данных препаратов как единой группы), интерес исследователей сфокусировался на сравнительном изучении влияния индивидуальных ее представителей на кардиальную дисфункцию в зависимости от способности связываться с s1-рецепторами.
С этой целью в работе [28] были исследованы два препарата: флувоксамин, являющийся мощным агонистом s1-рецепторов, и не связывающийся с ними по данным позитронной эмиссионной томографии пароксетин [30]. Дизайн данной работы включал 3 группы экспериментальных животных: группу мышей с моделируемой при помощи сдавливания аорты гипертрофией миокарда, наблюдаемых в течение 4 и 6 нед, и группу животных, подвергнувшихся контрольному оперативному вмешательству. В опытной группе мышам вводились флувоксамин, либо пароксетин, либо антагонист s1-рецепторов NE-100, либо комбинация флувоксамина и NE-100. В контрольной группе – флувоксамин, либо пароксетин, либо NE-100. В результатах оценивались экспрессия s1-рецепторов в кардиомиоцитах, выраженность гипертрофии ЛЖ и эхокардиографическая картина тяжести сердечной недостаточности. Данное исследование помимо выявления взаимосвязи между выраженностью гипертрофии миокарда, тяжестью сердечной недостаточности и падением экспрессии s1-рецепторов в миокарде (об этом свидетельствуют различия между животными опытной группы через 4 и 6 нед) продемонстрировало, что флувоксамин, но не пароксетин препятствовал развитию гипертрофии миокарда, его функциональных нарушений и падению экспрессии s1-рецепторов, а введение NE-100 блокировало благоприятные эффекты препарата на гипертрофию ЛЖ и функциональные расстройства, хотя и не влияло на наблюдающееся восстановление экспрессии s1-рецепторов. Представляется интересным, что в этой же работе все выявленные результаты были подтверждены и на другой модели гипертрофии миокарда, вызванной введением ангиотензина.
Таким образом, авторы пришли к выводу, что не все СИОЗС обладают кардиопротективным действием, которое обусловлено не ингибированием активности транспортера серотонина, а активацией s1-рецепторов в клетках сердечной ткани. Кроме того, исследование доказало участие s1-рецепторов в различных механизмах формирования изменений в сердечной ткани и эффективность их профилактики при использовании агониста s1-рецепторов флувоксамина. Интерпретируя результаты данного исследования, авторы особо подчеркивают тот факт, что, хотя введение антагониста s1-рецепторов блокировало кардиопротективные эффекты флувоксамина, оно не препятствовало восстановлению экспрессии s1-рецепторов в эндоплазматическом ретикулуме. В качестве возможного объяснения исследователи высказали предположение о том, что при реализации наблюдаемого кардиопротективного действия играет роль не столько повышение экспрессии рецепторов, сколько запускаемые их активацией каскады последующих внутриклеточных событий, а влияние на экспрессию опосредовано иными комплексными механизмами. В частности, в данном исследовании было обнаружено, что стимуляция s1-рецепторов флувоксамином ассоциировалась с активацией akt-пути с последующим фосфорилированием эндоплазматической NO-синтазы. В отсутствие флувоксамина или при его одновременном введении с NE-100 происходило снижение активности этих внутриклеточных процессов. Таким образом, можно полагать, что антигипертрофическое действие агонистов s1-рецепторов частично обусловлено активацией akt-пути внутриклеточной передачи сигнала и последующей активацией NO-синтазы.
Следует отметить, что кардиопротективный эффект агонистов s1-рецепторов представляется не дискретным, а состоящим из множества влияний. Так, помимо приведенных данных о его взаимосвязи с активацией внутриклеточных механизмов передачи сигнала в исследовании K.Ito и соавт. (2012 г.) [25] было показано, что, как и эндогенный нейростероид DHEA, флувоксамин при введении в желудочки головного мозга ассоциировался не только с редукцией депрессивного поведения экспериментальных животных, но и со смягчением патологических процессов в миокарде.
Таким образом, в качестве одного из элементов комплексного кардиопротективного действия агонистов s1-рецепторов, и в частности флувоксамина, по мнению авторов, могут выступать центральные механизмы снижения тонуса симпатической нервной системы. Наряду с этим другая группа исследователей обнаружила, что длительное введение мощного агониста s1-рецепторов кутамезина (SA4503) приводило к существенному увеличению экспрессии s1-рецепторов наряду со значительным ростом выделения нейротрофного фактора головного мозга (BDNF), обусловленного усилением трансформации про-BDNF в зрелый BDNF [31, 32]. Авторы указывают, что наблюдаемые изменения концентрации BDNF напрямую связаны с шаперонной активностью s1-рецепторов и могут противодействовать индуцированной ER-стрессом агрегации белков (например, BDNF), играющей роль в патогенезе ССЗ и психиатрических заболеваний. В связи с этими обнаружениями следует отметить, что существенную роль в реализации действия антидепрессантов в настоящее время приписывают наблюдающемуся при их применении повышению уровней BDNF, о чем свидетельствуют результаты 3 метаанализов [33–35].
Кроме того, в недавних исследованиях было обнаружено, что при ИБС концентрация BDNF значительно ниже, чем у здоровых людей [36], а также у лиц с нестабильной стенокардией по сравнению со стабильной [37], а его концентрации обнаруживают обратную зависимость с уровнями триглицеридов, липопротеинов низкой плотности, фибриногена, наличием сахарного диабета, мужским полом и возрастом – известными факторами риска ССЗ [38]. Эти данные убедительно свидетельствуют о важной роли BDNF в патогенезе не только депрессивных, но и сердечно-сосудистых расстройств, а также о том, что модуляция активности s1-рецепторов, оказывая влияние на уровни нейротрофного фактора головного мозга, может проявлять благоприятное действие при обеих группах расстройств.
Таким образом, результаты, полученные в исследованиях последних лет, указывают на участие как центральных, так и периферических s1-рецепторов в патогенетических механизмах и депрессивных, и сердечно-сосудистых расстройств и позволяют частично объяснить их тесные коморбидные взаимосвязи, а их агонисты, прежде всего дегидроэпиандростерон и флувоксамин, по данным экспериментальных исследований, оказывая влияние на данное общее звено патогенеза, проявляют и антидепрессивное, и кардиопротективное действие.
Сведения об авторе
Т.С.Сюняков – канд. мед. наук, ст. науч. сотр. ФГБУ НИИ фармакологии им. В.В.Закусова РАМН. E-mail: Sjunja@bk.ru
Список исп. литературыСкрыть список1. Schleifer SJ et al. The nature and course of depression following myocardial infarction. Arch Intern Med 1989; 149: 1785–9.
2. Смулевич А.Б. Депрессии при сердечно-сосудистых заболеваниях. Психич. расстройства в общей медицине. 2013; 3: 4–9.
3. Whooley MA et al. Depressive symptoms, health behaviors, and risk of cardiovascular events in patients with coronary heart disease. JAMA 2008; 300: 2379–88.
4. Gottlieb SS et al. The influence of age, gender, and race on the prevalence of depression in heart failure patients. J Am Coll Cardiol 2004; 43: 1542–9.
5. Rumsfeld JS, Ho PM. Depression and cardiovascular disease: a call for recognition. Circulation 2005; 111: 250–3.
6. Taylor CB et al. Effects of antidepressant medication on morbidity and mortality in depressed patients after myocardial infarction. Arch Gen Psychiat 2005; 62: 792–8.
7. Медведев В.Э. Профилактика и терапия психопатологических расстройств у пациентов с сердечно-сосудистыми заболеваниями. Неврология, нейропсихиатрия, психосоматика. 2012; 3: 54–9.
8. Glassman AH et al. Sertraline treatment of major depression in patients with acute MI or unstable angina. JAMA 2002; 288: 701–9.
9. Fisch C. Effect of fluoxetine on the electrocardiogram. J Clin Psychiat 1985; 46: 42–4.
10. Sauer WH, Berlin JA, Kimmel SE. Selective serotonin reuptake inhibitors and myocardial infarction. Circulation 2001; 104: 1894–8.
11. Baumeister H, Hutter N, Bengel J. Psychological and pharmacological interventions for depression in patients with coronary artery disease. Cochrane Database Syst Rev 2011; 9.
12. Bhuiyan MS et al. Targeting sigma-1-receptor with fluvoxamine ameliorates pressure-overload-induced hypertrophy and dysfunctions. Expert Opin Ther Targets 2010; 14 (10): 1009–22.
13. Nemeroff CB, Owens MJ. Pharmacologic differences among the SSRIs: focus on monoamine transporters and the HPA axis. CNS Spectr 2004; 9: 23–31.
14. Ishikawa M et al. High Occupancy of Sigma-1 Receptors in the Human Brain after Single Oral Administration of Fluvoxamine: A Positron Emission Tomography Study Using [11C] SA4503. Biol Psychiat 2007; 62: 878–83.
15. Hashimoto K. s1-Receptors and selective serotonin reuptake inhibitors: clinical implications of their relationship. Cent Nerv Syst Agents Med Chem 2009; 9: 197–204.
16. Minamino T, Komuro I, Kitakaze M. Endoplasmic reticulum stress as a therapeutic target in cardiovascular disease. Circ Res 2010; 107: 1071–82.
17. Minamino T, Kitakaze M. ER stress in cardiovascular disease. J Mol Cell Cardiol 2010; 48: 1105–10.
18. Su TP et al. The s1-receptor chaperone as an inter-organelle signaling modulator. Trends Pharmacol Sci 2010; 31: 557–66.
19. Hayashi T et al. Targeting ligand-operated chaperone s1-receptors in the treatment of neuropsychiatric disorders. Expert Opin Ther Targets 2011; 15: 557–77.
20. Groenendyk J et al. Biology of endoplasmic reticulum stress in the heart. Circ Res 2010; 107: 1185–97.
21. Dickhout JG, Carlisle RE, Austin RC. Interrelationship between cardiac hypertrophy, heart failure, and chronic kidney disease: Endoplasmic reticulum stress as a mediator of pathogenesis. Circ Res 2011; 108: 629–42.
22. Морозов П.В. Энигма s-рецепторов. Психиатр. и психофармакотер. им. П.Б.Ганнушкина. 2009; 2: 58–60.
23. Романов Д.В. s1-Рецепторы как потенциальная мишень психофармакотерапии. Психиатр. и психофармакотер.
им. П.Б.Ганнушкина. 2011; 6: 56–60.
24. Медведев В.Э. Cигма-рецепторы: роль в лечении аффективных расстройств. Неврология, нейропсихиатрия, психосоматика. 2012; 2: 105.
25. Ito K et al. Decreased brain s1-receptor contributes to the relationship between heart failure and depression. Cardiovasc Res 2012; 93 (1): 33–40.
26. Bhuiyan MS, Fukunaga K. Stimulation of s1-receptor signaling by dehydroepiandrosterone ameliorates pressure overload-induced hypertrophy and dysfunctions in ovariectomized rats. Expert Opin Ther Targets 2009; 13 (11): 1253–65.
27. Ela C et al. Sigma-receptor ligands modulate contractility, Ca++ influx and beating rate in cultured cardiac myocytes. J Pharmacol Exp Ther 1994; 269: 1300–9.
28. Tagashira H et al. s1-Receptor stimulation with fluvoxamine ameliorates transverse aortic constriction-induced myocardial hypertrophy and dysfunction in mice. Am J Physiol Heart Circ Physiol 2010; 299 (5): H1535–45.
29. Tagashira H et al. Distinct cardioprotective effects of 17b-estradiol and dehydroepiandrosterone on pressure overload-induced hypertrophy in ovariectomized female rats. Menopause 2011; 18 (12): 1317–26.
30. Narita N et al. Interactions of selective serotonin reuptake inhibitors with subtypes of sigma receptors in rat brain. Eur J Pharmacol 1996; 307: 117–9.
31. Fujimoto M et al. s1-Receptor chaperones regulate the secretion of brain-derived neurotrophic factor. Synapse 2012; 66: 630–9.
32. Kikuchi-Utsumi K, Nakaki T. Chronic treatment with a selective ligand for the s1-receptor chaperone, SA4503, up-regulates BDNF protein levels in the rat hippocampus. Neurosci Lett 2008; 440: 19–22.
33. Sen S, Duman R, Sanacora G. Serum Brain-Derived Neurotrophic Factor, Depression, and Antidepressant Medications: Meta-Analyses and Implications. Biol Psychiat 2008; 64: 527–32.
34. Brunoni AR, Lopes M, Fregni F. A systematic review and meta-analysis of clinical studies on major depression and BDNF levels: implications for the role of neuroplasticity in depression. Int J Neuropsychopharmacol 2008; 11: 1169–80.
35. Bocchio-Chiavetto L et al. Serum and plasma BDNF levels in major depression: a replication study and meta-analyses. World J Biol Psychiat 2010; 11: 763–73.
36. Manni L et al. Reduced plasma levels of NGF and BDNF in patients with acute coronary syndromes. Int J Cardiol 2005; 102: 169–71.
37. Ejiri J et al. Possible role of brain-derived neurotrophic factor in the pathogenesis of coronary artery disease. Circulation 2005; 112: 2114–20.
38. Jiang H et al. Association of plasma brain-derived neurotrophic factor and cardiovascular risk factors and prognosis in angina pectoris. Biochem Biophys Res Commun 2011; 415: 99–103.


