Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№02 2014
Эффективность и безопасность применения Вальдоксана (агомелатина) при лечении депрессий в междисциплинарных отделениях общемедицинской сети (наблюдательная программа ФОРУМ) №02 2014
Номера страниц в выпуске:24-40
Накопление эпидемиологических данных по проблеме депрессий в общемедицинской практике подтверждает ее важность: распространенность этой патологии определяется в диапазоне 15–30%, а ее доля от всех психопатологических нарушений составляет 25–50%, при этом риски снижения трудоспособности, серьезных осложнений и преждевременной смертности значимо повышены по сравнению с больными без депрессии.
Резюме. В публикации представлены данные об эффективности и безопасности применения Вальдоксана (агомелатина) при лечении депрессий в междисциплинарных отделениях общемедицинской сети на базе клиник кардиологического, онкологического, пульмонологического, дерматологического, ревматологического, неврологического, эндокринологического, гинекологического профиля. В выборку наблюдательного 12-недельного исследования включены 204 пациента (женщины – 73%; средний возраст 47,43±14,61 года). Проанализированы скорость возникновения первичного терапевтического ответа и спектр клинических эффектов (антидепрессивный, противотревожный, хронобиотический, антидистрессовый), психопатологическая структура и устойчивость достигнутой ремиссии.
Ключевые слова: агомелатин, антидепрессант, депрессия, тревога, нарушения сна, расстройства аффективного спектра, общемедицинская практика, наблюдательное исследование, ремиссия, первичный терапевтический ответ, Вальдоксан.
Effectiveness and safety of agomelatine (Valdoxan) in patients with depression (programma FORUM)
A.B.Smulevich1,2, A.V.Andryushchenko2, А.U.Brazhnikov2, N.B.Zakharova1,2, D.V.Romanov1,2, M.A.Samushiya2, Y.K.Galetskayte2, B.A.Volel1,2
1Department for the Study of borderline mental diseases and psychosomatic disorders MHRC RAMS, Moscow;
2Department for the Psychosomatic medicine, Institute of Professional Education First Moscow State Medical University I.M.Sechenov
Summary. The article summarizes data on effectiveness and safety of agomelatine (Valdoxan) in patients with depression treated in general medicine settings (i.e. cardiology, oncology, pulmonology, dermatology, rheumatology, neurology, endocrinology, gynecology). The observational study sample comprise 204 subjects (73% female, mean age 47,43±14,61 years). The velocity of primary treatment response, the spectrum of clinical effects (antidepressive, anxiolytic, chronobiotic, antidistessive), type and stability of achieved remission have been evaluated.
Key words: agomelatine, antidepressant, depression, anxiety, sleep disturbances, affective spectrum disorders, general medicine, observational study, remission, primary treatment response, Valdoxan.
В сравнительных исследованиях общемедицинских и психиатрических выборок показано сходство симптоматики депрессий и общих принципов для клинических алгоритмов (B.Gaynes и соавт., 2007; А.Б.Смулевич, Э.Б.Дубницкая, М.Ю.Дробижев и соавт., 2007). Собственные данные, накапливаемые 15 лет в междисциплинарных исследованиях, свидетельствуют о гибридном влиянии аутохтонных и средовых (психогенные, нозогенные, соматогенные, лекарственные) осцилляторов, приобретающих особую значимость в ситуациях психотравмирующего воздействия и определяющих широкий диапазон проявлений депрессий в общей медицине – от простых реакций и пограничных аффективных нарушений, маскируемых соматизированными и другими неспецифическими признаками, до выраженной эндоформной патологии при активации ключевых для патогенеза депрессий нейробиологических систем.
Клиническими валидаторами психопатологически выраженных депрессий являются констелляции ядерных нарушений, в числе последних рассматривают котимию меланхолических проявлений (тоска, негативная самооценка, безрадостность) и генерализованной тревоги, сочетание гипотимии с характерными нарушениями моторно-двигательной сферы (моторная заторможенность/ажитация) и аутохтонными патофизиологическими колебаниями (массы тела и др.), биполярность. Ведущие эксперты уделяют особое внимание тревоге, интерпретируя данную патологию в качестве фактора, декомпенсирующего и усиливающего тяжесть депрессии, а также предиктивного валидатора большого депрессивного эпизода и рекуррентного течения (S.Kasper и соавт., 2010; А.Б.Смулевич и соавт., 2013).
Многими авторами выделяются нарушения других систем, играющие роль модуляторов депрессий, в первую очередь хронобиологическую (десинхронизация уровней мелатонина, пролактина, кортизола, внутриклеточных сигналов, иммунных воспалительных и протекторных агентов, расстройства цикла «сон–бодрствование», массы тела, функционирования вегетативной нервной системы и др.) и когнитивную/конатативную (фиксация негативных эмоций, идеи физической/психической неполноценности, виновности, нарушение сосредоточения внимания, рабочей памяти, деморализация, демотивация) (M.Nibuya и соавт., 1996; E.Suzuki и соавт., 1996; J.Arendt 1989, 2000; D.Slattery и соавт., 2004; P.Gorwood, 2010).
Результативность влияния терапевтических средств на отдельные дименсии, валентности, констелляции симптомов депрессий, а также на остаточные симптомы при неполных ремиссиях (резидуальный циклотимический симптомокомплекс, общие с тревожно-
фобическими расстройствами, соматоформными расстройствами – СФР, расстройствами личности – РЛ признаки, сниженный уровень исполнительных функций) активно изучается (А.Б.Смулевич 2014).
В настоящее время благодаря быстрому развитию фармакологических моделей акцент в анализе антидепрессивных свойств ставится на изучении эффектов воздействия медикамента на отдельные биологические мишени (количество отдельных рецепторов, уровень взаимодействия нейротрансмиттерных систем, внутриклеточных сигналов, ответственных за устойчивость эмоционального гомеостаза и пр.) и их консолидации. Для обыденной практики отечественного здравоохранения (в ситуации отсутствия надежных биомаркеров и недоступности нейровизуализационной индикации высокого уровня) сохраняет первостепенное значение подбор средств с опорой на их потенциальные свойства, клинические и психометрические валидаторы эффективности терапии. Построение алгоритма терапии депрессий, наблюдаемых в общемедицинской сети, затруднено в силу ряда нерешенных вопросов, касающихся таргетных симптомокомплексов и диапазона терапевтических доз на разных этапах, возможности тестирования в первые 2 нед эффективности антидепрессанта с целью прогноза, безопасности пролонгированной поддерживающей психофармакотерапии на фоне соматической патологии, оценки комплаентности в системе критериев качества лечения.
Для решения выделенных вопросов и разработки путей повышения психического здоровья пациентов в рамках оказания медицинской помощи создан инициативный многоступенчатый проект ФОРУМ (2012–2017 гг.). Его глобальной целью является создание проекта регистра для сбора данных об эффективности и безопасности применения психотропных средств, в первую очередь антидепрессантов, с помощью которого можно изучать разные аспекты терапевтического ответа, включая уровни лекарственной ремиссии, персонифицированную оценку комплаентности пациента с учетом объема лечебных мероприятий, соматического фона, траектории медицинского маршрута.
Спланированные в этом направлении натуралистические работы позволяют решать проблемы рутинной практики, плохо представленные в рамках жестко регламентируемых РКИ, с помощью ресурсоемких методов. Многомерное изучение случаев в режиме «реального времени» и многоцентровых программ позволяет получить профили больных с недостаточным терапевтическим ответом или неполными ремиссиями, уточнить влияние средовых факторов на лечебные предпочтения врача и пациента, удовлетворенность психофармакотерапевтическим методом, дифференцировать с привлечением клинико-терапевтических данных причины несогласия и несоблюдения стандартной лечебной схемы, выбрать наиболее адекватный диагностический инструмент для оценки психопатологии депрессии, остаточных симптомов и влияющих на медицинское поведение личностных нарушений.
Клинико-терапевтическая программа «Эффективность и безопасность применения агомелатина в общемедицинской практике» разработана как фрагмент проекта ФОРУМ под руководством координатора, академика РАН, профессора А.Б.Смулевича для усовершенствования лечения депрессий и критериев контроля качества специализированной медицинской помощи. Широкие возможности и уникальность агомелатина (Вальдоксана), внедренного в клиническую практику с 2006 г., связаны с его синергичным воздействием одновременно как агониста мелатонинергических MT1- и MT2-рецепторов и как антагониста серотонинергических 5-HT2С-рецепторов (V.Audinot и соавт., 2003; M.Millan и соавт., 2003; M.Lader, 2007). Доказано, что механизм действия препарата позволяет корректировать депрессивную симптоматику и ресинхронизировать вызванные аффективной патологией изменения циркадианных ритмов, несмотря на отсутствие влияния на обратный захват моноаминов.
Согласно результатам сравнительных международных исследований в психиатрической и общемедицинской практике продемонстрирована эффективность Вальдоксана при использовании суточной дозы 25–50 мг и его преимущества перед другими медикаментами: возможность достижения значимого улучшения начиная с 1-й недели; отсутствие синдрома отмены при резком прекращении терапии и ряда других характерных для антидепрессантов проблем – половая дисфункция, повышение массы тела, снижение артериального давления (АД), утренняя сонливость и пр. (G.Goodwin, 2008; A.Нale и соавт., 2009).
В рандомизированных международных исследованиях показаны достоверное улучшение при большой депрессии (по динамике суммарного показателя HAM-D17) при 8-недельной терапии и снижение риска рецидива при пролонгированной 24-недельной терапии (при сравнении с плацебо; р=0,0001) (G.Goodwin и соавт., 2009; S.Stahl и соавт., 2010; J.Zajecka и соавт., 2010), превосходство агомелатина за 6–8 нед у пограничных больных над плацебо-эффектом и сходство по числу респондеров с действием препаратов групп селективных ингибиторов обратного захвата серотонина (флуоксетин, пароксетин, сертралин, эсциталопрам) – 71,75% vs 64,52% и селективных ингибиторов обратного захвата серотонина и норадреналина (венлафаксин XR) – 76,4% vs 70,6% соответственно (S.Kasper и соавт., 2010).
В российских программах ХРОНОС, РИТМ, ВРЕМЯ, ВАЛЬС получены данные об оптимальном соотношении эффективности и переносимости Вальдоксана, соответствующем принципиальному условию общемедицинской сети – «щадящей» психофармакотерапии (С.В.Иванов, 2009; А.Б.Смулевич, А.В.Андрющенко, Д.А.Бескова, 2010). Клинические результаты и экспериментальные данные о способности препарата снижать вызванный стрессом выброс глутамата, повышать уровни норадреналина и дофамина во фронтальной коре, нейротрофического фактора роста BDNF и норадреналина в гиппокампе, а также влиять на согласованность внутриклеточных сигналов, ответственных за синхронизацию биологических ритмов, открывают широкие перспективы применения в междисциплинарных областях (S.Stahl, 2011).
Формирование выборки осуществлено с помощью адекватных для обсервационной программы критериев включения/невключения после подписания пациентом информированного согласия, которое включало нормы обеспечения безопасности для жизни и здоровья при терапии на основе соблюдения Хельсинской декларации Всемирной медицинской ассоциации 2008 г., стандарты GCP, GMP. Психопатологическое и психометрическое исследование проводилось врачами, сертифицированными по специальности «психиатрия». Диагностика депрессии и сбор данных проводились квалифицированными врачами-психиатрами, поскольку в предыдущих собственных исследованиях установлено, что психометрический скрининг депрессий без полного клинического обследования может завышать их частоту в среднем на 10%.
2. Непсихотические депрессивные расстройства.
Диагноз по Международной классификации болезней 10-го пересмотра (МКБ-10) (шифры F3, F4, F5):
а) F32/F33: униполярные депрессии легкой и умеренной степени тяжести (первый/рекуррентный эпизод; дистимия);
б) F31: биполярные аффективные расстройства, депрессии легкой и умеренной степени тяжести (первый/рекуррентный эпизод);
в) F43 и F54: реакции адаптации депрессивного спектра, в том числе обусловленные патогенетическим или нозогенным воздействием соматической патологии.
1. Выраженность депрессивного расстройства не менее 3 баллов по шкале CGI-S (тяжесть с учетом всего спектра легких состояний).
2. Стандартные показания для терапии антидепрессантами согласно полной Инструкции по медицинскому применению препарата Вальдоксан: в качестве первого антидепрессанта или замены предыдущего антидепрессанта в случае его плохой переносимости и/или неудовлетворительной эффективности.
• повышенный суицидальный риск;
• шизофрения, шизоаффективное расстройство, органическое поражение центральной нервной системы, деменция, эпилепсия, болезнь Альцгеймера, черепно-мозговая травма;
• биполярное аффективное расстройство: депрессии с психотическими чертами, бредом, частые маниакальные состояния в анамнезе, короткие циклы;
• алкоголизм или наркомания в анамнезе;
• установленная ранее индивидуальная непереносимость либо неэффективность Вальдоксана в анамнезе при назначении препарата в адекватной дозе (не менее 25 мг/сут) и адекватной длительности (не менее 4 нед);
• резистентность к терапии антидепрессантами в анамнезе;
• одновременное применение средств – сильных ингибиторов цитохрома CYP1A2 (ципрофлоксацин, эстрогены и пр.);
• печеночная недостаточность (цирроз или острая патология печени);
• кормление грудью;
• отказ от применения адекватных медицинских средств контрацепции (внутриматочная спираль, двойной барьерный метод – презерватив в сочетании со спермицидом) для женщин с сохранной детородной функцией.
2. Появление психотических симптомов по клинической оценке лечащего врача.
3. Появление тяжелых проявлений соматических или неврологических заболеваний.
4. Наступившая беременность.
Схема и инструмент для скрининга и мониторинга. Согласно программе, максимально адаптированной к рутинной практике, при лечении депрессий агомелатином осуществлен мониторинг, ориентированный на междисциплинарный подход. На скрининг-визите всем пациентам проведено расширенное клиническое обследование. Для оценки психического состояния использованы стандартные критерии МКБ-10, для верификации и нозогенной природы депрессии и особенностей преморбида, длительности и особенностей динамики аффективной патологии – оригинальное полуструктурированное интервью. С помощью специально разработанной карты и базы данных зарегистрированы актуальные депрессивные симптомы (60 признаков) и синдромы; коморбидные психические расстройства, личностные расстройства и соматоперцептивные акцентуации; гипоманиакальные и маниакальные фазы в анамнезе; социодемографические данные с учетом уровня социального функционирования в течение последнего года, обращаемости за медицинской помощью, психотравмирующих событий и опыта приема психотропных средств в прошлом.
Диагностика соматического состояния проведена квалифицированными специалистами, в ходе скрининга фиксируется обобщенное заключение о соматической патологии и используемых пациентом сомато-тропных средствах в рамках стандартных схем или ургентной терапии.
После скрининга всем пациентам на первом визите назначается агомелатин (Вальдоксан) в стартовой терапевтической дозе 25 мг (1 таблетка целиком) однократно вечером, независимо от приема пищи, за 2 ч до сна. Рекомендуется гибкое дозирование в случае недостаточного эффекта по оценке исследователя: увеличение дозы в первые 2 нед до максимально допустимой дозы – 50 мг (2 таблетки) однократно вечером. После случайного пропуска очередной дозы при следующем запланированном приеме доза остается стандартной (не удваивается). Все пациенты продолжают рекомендованное интернистами стандартное лечение по поводу сопутствующих соматических заболеваний. Кроме того, допускается применение препаратов (за исключением антидепрессантов), стабильно назначаемых ранее врачом по поводу неаффективной патологии, или их назначение (включая транквилизаторы) при нарастании тревоги в первые 2 нед терапии. Мониторинг динамики состояния на лечении Вальдоксаном по основной программе осуществляется в течение 12 нед (6 визитов – V1 скрининг/начальный, V2 – 1 нед, V3 – 2 нед, V4 – 3 нед, V5 – 6 нед, V6 – 12 нед/завершающий).
Для психометрической оценки используется оптимизированный для контингента с высоким уровнем физикальных жалоб и соматизации набор шкал, с понятными и приспособленными для операциональной диагностики вопросами о симптомах депрессии и степени их тяжести, коморбидных тревожных и СФР, резидуальных симптомах в период становления ремиссии.
Для динамических – повизитных оценок признаков депрессии и ассоциированных симптомов выбран следующий инструмент:
1) 7-пунктовые субшкалы общего клинического впечатления CGI-I и PGI-I, заполняемые со 2-го визита1;
2) 17-пунктовая шкала Гамильтона (Hamilton Depression Rating Scale-17, HAM-D17), заполняемая врачом2;
3) 35-пунктовая шкала тревоги Шихана (Sheehan Clinical Anxiety Rating Scale, ShARS)3;
4) 20-пунктовый опросник Спилбергера–Ханина (State-Trait Anxiety Inventory, STAI)4;
5) 69-пунктовый оригинальный опросник соматических симптомов болезни, разработанный в НОКЦ «Психосоматической медицины» ГБОУ ВПО «Первый МГМУ им. И.М.Сеченова» Минздрава России, использовался на начальном визите, после 3 и 6 нед лечения5.
Для оценки нарушений, влияющих на субъективное ощущение благополучия как важного показателя качества жизни, использовались:
6) 10-пунктовый опросник6;
7) 5-пунктовый опросник уровня субъективного благополучия7.
Для оценки выраженности остаточной депрессивной симптоматики у больных, достигших ремиссии по HAM-D17, или признаков инверсии фазы у больных с так называемым биполярным диатезом или верифицированным биполярным аффективным расстройством проведены дополнительные оценки врачом после 6 и 12 нед терапии с помощью:
8) оригинального опросника для оценки субсиндромальных проявлений депрессии, что позволило охарактеризовать резидуальные депрессивные нарушения с учетом выраженности и частоты повторяемости симптомов;
9) валидированного в России опросника для самооценки признаков гипомании (HCL-32), что позволило выявить симптоматику гипомании/мании – от 14 баллов и выше (S.Mosolov и соавт., 2014).
Для оценки безопасности на 1, 4, 6-м или последнем (при неполном курсе) визитах оцениваются основные физиологические показатели пациента (ЧСС, АД, масса тела), клинический и биохимический анализ крови. Повизитно регистрируются и отслеживаются до разрешения все нежелательные явления (НЯ) для оценки их вероятностной связи с приемом Вальдоксана.
Формат исследуемых выборок: общая выборка, все включенные в программу (intention-to-treat, 204 пациента); завершивших полную программу выборка – 12 нед лечения (159 пациентов); выборка преждевременно выбывших из программы (45 пациентов); респондеры (РЕСП – все пациенты, у которых снижение баллов по шкале HAM-D17 на 50%); нонреспондеры (НРЕСП – все пациенты, не соответствующие критериям РЕСП);
ремиттеры (РЕМ – все пациенты, у которых HAM-D17 не более 7 и/или суммарный показатель по субшкале
HAM-D6 0–4, т.е. «нет депрессии»); нонремиттеры (НРЕМ – пациенты, не достигшие ремиссии согласно указанным критериям).
г. Москвы, в том числе в междисциплинарные психосоматические (33,1%), кардиологические (28,9%), онкологические (11,2%), пульмонологические (5,9%), гастроэнтерологические (5,4%), эндокринологические (4,5%), урологические (3,5%), гинекологические (2,5%), ревматологические (2,5%), дерматологические (1,5%), неврологические (1,0%).
В рамках медицинской маршрутизации пациенты были направлены на консультацию в один из центров НОКЦ «Психосоматическая медицина»: кабинеты в поликлинике ЦАО №171, амбулаторный прием в клинике дерматологии, кардиологии, пульмонологии, неврологии, онкологии, гастроэнтерологии, стационарное психотерапевтическое отделение в ГБОУ ВПО «Первый МГМУ им. И.М.Сеченова» Минздрава России, а также амбулаторный кабинет катамнеза, сформированный для изучения ремиссий при аффективной патологии в ФБГУ «НЦПЗ» РАМН8.
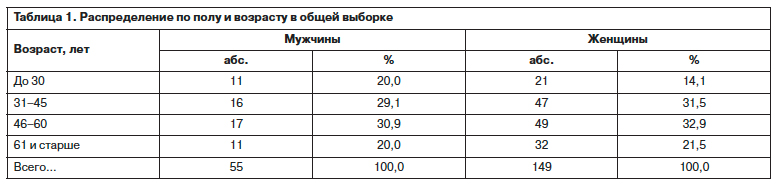
В выборку включены 204 пациента, из них женщин – 73% (149 наблюдений), мужчин – 27% (55), которые согласились на терапию агомелатином по поводу депрессивного эпизода легкой тяжести или более выраженной степени в амбулаторных и/или стационарных условиях с максимальной длительностью непрерывного наблюдения 12 нед после процедуры скрининга. Средний возраст пациентов составил 47,43±14,61 года (женщины 47,91±14,72; мужчины 46,13±14,36). Сравнение распределения по возрасту мужчин и женщин, проведенное при помощи критерия Манна–Уитни для независимых выборок, показало отсутствие статистически значимых различий (табл. 1).
Исходную выборку составили лица с высоким уровнем образования: большинство имели высшее (68,6%), среднее специальное и неоконченное высшее (27,0%), среднее (4,4%). Более 1/2 пациентов состояли в браке: 52,0, 14,2 из 48,0% больных, проживающих в одиночестве или неполных семьях, были в состоянии после развода, а 12,7% перенесли смерть супруга. Распределение по занятости и источнику доходов выявило, что большинство (69,0%) пациентов продолжают работать, из них служащих – 49,5%, рабочих – 8,8%, предпринимателей – 4,9%, лиц творческого труда и учащихся – по 2,9%. На пенсии или социальном пособии – 22,1%, на иждивении других лиц – 8,8%. Уровень социального функционирования из-за аффективной патологии в половине наблюдений был временно снижен у 50,5% пациентов; кроме того, 7,4% больных сменили профессию по этой причине, а 2,9% – стали работать по индивидуальному графику. Инвалидность по психическому заболеванию выявлена в 2 наблюдениях (1 и 3-я группы). Хотя в изученную выборку не включались больные с алкоголизмом, часть пациентов признали употребление алкогольных напитков еженедельно (некрепкие – 45,6%, крепкие – 4,4%) или даже ежедневно (некрепкие – 10,3%, крепкие – 1,5%).
Доли больных общей выборки по шифрам МКБ-10 для аффективной патологии распределяются следующим образом:
• F33 (рекуррентная депрессия) – 49,5%: легкий – 16,2%, умеренный – 33,3%. В анамнезе 1 эпизод – 46 наблюдений (ремиссия от 2 до 30 лет), 2 эпизода – 24 наблюдения (ремиссия от 2 до 7 лет), 3 эпизода – 13 наблюдений (ремиссия от 1 года до 3 лет), 4 эпизода и больше – 18 наблюдений, включая субклинические сезонные фазы – 9 наблюдений (ремиссия от 6 мес до 3 лет);
• F32 (депрессивный эпизод) – 27,9%: легкий – 18,6%; умеренный – 9,3%;
• F 43.21 (депрессивная реакция, расстройство адаптации) – 10,8%;
• F31.31 (биполярная депрессия) – 7,4%: в анамнезе гипомании – 6,9%, мании – 0,5%;
• F34.1 (дистимия) – 3,4%;
• F54 (соматогенная депрессия) – 1,0%.
Согласно данным анамнеза у 9,3% пациентов актуальная патология формируется по типу двойной депрессии (между предыдущим и настоящим эпизодом отмечена дистимия), а у 13,7% пациентов (5,4% – с первичным эпизодом, 8,3% – с повторным) ретроспективно были выявлены субклинические гипоманиакальные кратковременные эпизоды, требующие проведения дифференциальной диагностики с биполярным расстройством.
Общий исходный балл HAM-D17 пациентов выборки находится в диапазоне от 6 до 30 баллов (среднее значение – 18,6 балла, медиана – 19 баллов, мода – 21 балл (рис. 1).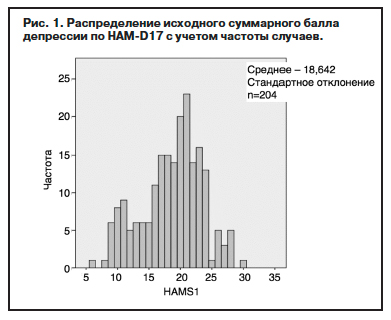
Анализ синдромальной структуры показывает преобладание тревожных депрессивных расстройств – у 42,6% (87 наблюдений) над маскированными (соматизированными) депрессиями – у 34,3% (70 наблюдений; с доминирующей конверсионной симптоматикой – 23,0%, с доминирующей соматовегетативной дисфункцией – 11,3%). В разы реже отмечены синдромы апатической депрессии – у 10,3% (21 наблюдение, при этом в 3,9% – апатия сочетается с дисфорией или тревогой) и тоскливой (без повышенной тревоги) депрессии –
у 7,4% (15 наблюдений; 2,5% – с идеями самообвинения); еще значительно реже выявляются сенесто-ипохондрические депрессии – у 3,4% (7 наблюдений) или депрессии с болезненным бесчувствием, деперсонализацией и дереализацией – у 2,0% (4 наблюдения). Детальное изучение триггерных факторов и особенностей синдромообразования свидетельствует об аутохтонном механизме и отсутствии влияния любых из известных триггеров у 27,9% больных. У 44,2% больных отмечено явное психогенное, нозогенное, соматогенное или связанное с побочными эффектами соматотропных медикаментов и/или оперативных вмешательств воздействие. У 43,1% больных общей выборки формированию депрессии предшествовал острый стресс. Эндореактивный механизм формирования депрессии выявлен у 27,9% больных.
Особенностью общей выборки является то, что у большинства больных диагностированы коморбидные психопатологические симптомы/синдромы: у 78,9% пациентов, почти в 1/3 (23%) этих случаев они прослеживаются в течение последних 5 лет:
• у 43,6% – тревожные (панические атаки у 17,1%, генерализованная тревога у 21,1%, агорафобия у 7,8%, обсессии и/или компульсии у 4,9%, посттравматическое стрессовое расстройство у 2,0%, изолированные фобии, включая ипохондрические, – у 24,5%, при этом более 2 лет – у 11,8%);
• у 37,7% – конверсионные;
• у 24,5% – соматоформная вегетативная дисфункция (гипервентиляция, кардионевроз, синдром раздраженного кишечника или мочевого пузыря, кожный невроз, термоневроз);
• у 17,6% – нарушения сна (при этом они в 5% персистируют более 5 лет);
• у 15,2% – соматогенная астения;
• у 9,1% – легкие диссоциативные расстройства;
• у 8,3% – легкая/умеренная когнитивная дисфункция.
Другой особенностью общей выборки является гипертимная акцентуация в преморбиде у 27,9% пациентов. Изучение личностного профиля показало, что другие акцентуации или РЛ зарегистрированы реже: гистрионные, тревожно-мнительные, пограничные, ананкастные, паранойяльные. Психотических расстройств в анамнезе не выявлено.
Соматические заболевания выявлены у 78,4% пациентов, из них одновременно получали лечение по поводу соматической патологии 55,3% (113 наблюдений), с учетом ее обострения – 18,1% (37 пациентов), при этом почти у 1/5 имеется инвалидность по соматическому заболеванию (17,6%; 1-я группа – 5,4%, 2-я группа – 8,8%, 3-я группа – 3,4%). Среди соматических заболеваний зарегистрированы: заболевания сердечно-сосудистой системы – у 25,9%; онкопатология – у 10,8%; эндокринологические заболевания – у 8,3%; гастроэнтерологическая патология – у 6,4%; неврологическая патология – у 5,4%; хроническая легочная патология – у 3,4%; заболевания кожного покрова – у 3,4%; урологическая патология – у 3,4%; гинекологическая – у 2,9%; ревматологическая – у 2,5%; травматологическая (перелом бедренной кости) – у 0,5%. У 43,6% отмечалось более 2 соматических заболеваний, требующих медицинской помощи и мониторинга.
В ходе обследования установлено, что большинство пациентов данной выборки ранее обращались за психиатрической помощью: 1 раз за амбулаторной помощью обращались 65,7%, многократно – в 4 (15,7%) раза меньше пациентов; стационарную помощь однократно получали 19,6%, многократно – 4,9% пациентов. Эти данные и распределение по диагнозам лишний раз свидетельствуют о важности внесения специализированных алгоритмов в рекомендации для общемедицинской сети, несмотря на предубеждение населения против психиатрической помощи.
Основные индикаторы. Достоверное снижение в общей выборке показателей степени тяжести депрессии в первые 3–6 нед лечения с учетом динамики суммарного балла HAM-D17 и ряда индексов: «чистая депрессия» (НAM-D6), «критическое отношение и суицидальные тенденции» (НAM-D2), «неспецифические симптомы» HAM-D9. Первичный терапевтический ответ: снижение баллов по HAM-D17 не менее чем на 25%; показатели «улучшение» и «значительное улучшение» по CGI-I в первые недели терапии для разных групп. Скорость достижения ремиссии (по HAM-D17) и ее качество в общей выборке, оцениваемое по клиническим критериям, уровню улучшения по CGI-I и PGI-I.
Дополнительные показатели эффективности терапии. Дополнительные измерения необходимы в связи с широким кругом симптомов депрессий в общемедицинской сети и вариантов динамики аффективной патологии. Анксиолитический эффект оценивается в общей выборке по динамике суммарных показателей 35-пунктовой ShARS, ситуационной тревоги по STAI и инд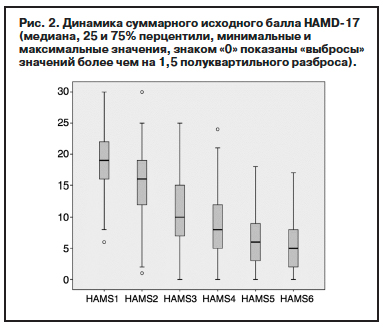 ексу тревоги по HAM-D17, кроме того, по динамике суммарных показателей HAM-D17 у больных тревожной депрессией в сравнении с другими психопатологическими типами депрессивных расстройств. Хронобиотический эффект оценивается по динамике индекса инсомнии HAM-D3 и суммарных показателей LSEQ в общей выборке с учетом 10 показателей цикла «сон–бодрствование». Для изучения антидистрессового (адаптогенного) эффекта оценивается динамика ситуационной тревоги по STAI и индекса «неспецифические симптомы» HAM-D9 в общей выборке.
ексу тревоги по HAM-D17, кроме того, по динамике суммарных показателей HAM-D17 у больных тревожной депрессией в сравнении с другими психопатологическими типами депрессивных расстройств. Хронобиотический эффект оценивается по динамике индекса инсомнии HAM-D3 и суммарных показателей LSEQ в общей выборке с учетом 10 показателей цикла «сон–бодрствование». Для изучения антидистрессового (адаптогенного) эффекта оценивается динамика ситуационной тревоги по STAI и индекса «неспецифические симптомы» HAM-D9 в общей выборке.
Терапевтическая активность агомелатина изучается с учетом медицинских причин преждевременного завершения участия пациентов в программе, социодемографических характеристик и клинических особенностей депрессий у 22,1% (45 наблюдений) пациентов, выбывших из 12-недельной программы. Большинство пациентов завершили участие в программе в первые недели: на 1-й – 4% (8 наблюдений); после 2 или 3 нед – 6,9% (14) и 7,8% (16) соответственно; а после 6 нед – лишь 3,4% (7). Кластеризация причин показывает, что в большей части случаев – 13,2% (27) решение о выходе из программы принято совместно врачом-экспертом и пациентом в связи с изменением тактики при недостаточным улучшении или утяжелении депрессии, усилении тревоги, диспсихофобии, появлении сенесталгий или суицидальных тенденций (после 2-недельного регулярного приема агомелатина – 1 наблюдение или нарушении режима – 1 наблюдение).
Причиной смены также стали инверсия депрессии в гипоманию – 1,5% (после 2 нед приема агомелатина –
1 наблюдение, после 6 нед терапии – 2 наблюдения).
У 2 больных этого кластера дополнительную роль сыграли НЯ: впервые выявленный устойчивый фотодерматит с кожным зудом; ухудшение биохимических показателей у больного с онкопатологией. В 3,4% (7 наблюдений) пациенты отказались от продолжения участия в данной программе после 2–3 нед приема агомелатина в связи с такими НЯ, как головная боль, трудности засыпания, кошмарные сновидения, учащение пробуждений, аллергические реакции (дополнительную роль играло недостаточное снижение болезненного самоощущения). В 3,4% (7 наблюдений) случаев основной причиной завершения программы стала нонкомплаентность в виде отказа от очередного визита, в том числе по немедицинским причинам, или приема агомелатина по схеме. Еще 4 пациента отказались от продолжения лечения на фоне существенного улучшения: через 3 нед – 1 наблюдение, через 6 нед – 3 наблюдения.
Сравнение завершивших и выбывших из программы по возрасту, полу, наличию коморбидной соматической патологии, проведенное при помощи критерия c2, показало отсутствие статистически значимых различий.
В частности, при анализе различий по гендерному признаку установлено, что выбыли из программы 20,1% женщин и 27,3% мужчин, завершили – 79,9% женщин, 72,7% мужчин (р=0,275). Сразу следует подчеркнуть, что высокая частота преждевременного прерывания терапии может быть связана со случайным отбором пациентов и в гораздо меньшей степени – с НЯ. При межгрупповом анализе психопатологических показателей преждевременно выбывших и завершивших программу выявлены некоторые различия, которые будут проанализированы далее.
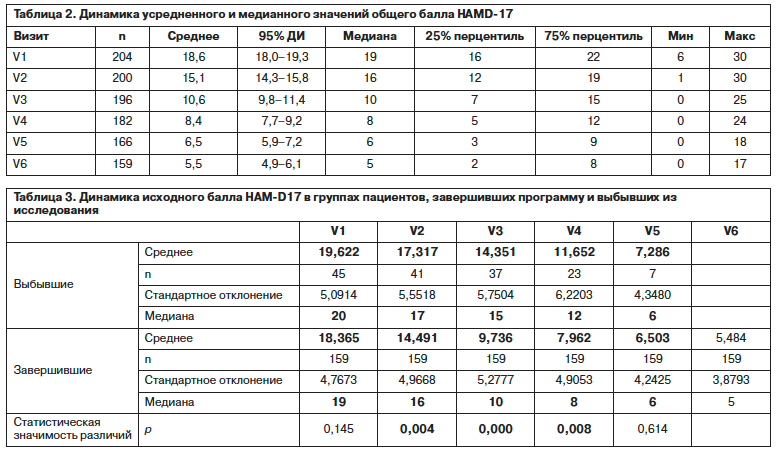
Динамика среднего суммарного балла HAM-D17 по визитам характеризовалась его значимым снижением по сравнению с исходным: с 18,6 (95% доверительный интервал – ДИ 18,0–19,3) на начальном визите до 5,5 (95% ДИ 4,9–6,1) на завершающем визите (медианное значение общего балла уменьшилось сходным образом – с 19 до 5 баллов). Максимальное снижение отмечается на V2 и V3: для среднего значения – на 3,5 и 4,6 балла соответственно, для медианы – 3 и 6 баллов. Затем скорость снижения замедляется: на V4, V5 и V6 для среднего значения – 2,2, 1,9 и 1,1 балла соответственно, для медианного значения – 2 балла на V4 и V5 и 1 балл на V6. Показанные на рис. 2 и в табл. 2 изменения по HAM-D17 не выявляют каких-либо противоречий, подтверждаются статистически значимые различия между визитами при использовании критерия знаковых рангов Вилкоксона для связанных выборок, учета помимо средних медианы 25 и 75% значений, а также минимальных и максимальных значений суммарного балла HAM-D17 (р<0,001).
С помощью межгруппового сравнительного анализа показателей завершивших и преждевременно выбывших из программы изучено влияние клинического типа, тяжести состояния, отдельных дименсий, соматической патологии. Сравнение по клиническим синдромам не выявляет статистически значимых различий. Особое внимание уделено изучению эффективности агомелатина при тревожных депрессиях с учетом их большого удельного веса. Сравнение данного клинического типа с другими формами аффективной патологии показывает следующее распределение: доли тревожных и психопатологически иных депрессий, соответственно, в исходной выборке составляют: 42,6% vs 57,4%; среди преждевременно выбывших пациентов – 48,9% vs 51,1%; среди завершивших программу – 40,9% vs 59,1%. По результатам программы, в том числе при сравнении с помощью критерия c2 для этих 2 групп больных, не выявляется значимых различий (р=0,338), а, следовательно, диагноз «тревожная депрессия» не оказывает существенного влияния на преждевременное выбывание в данной выборке.
Изучение влияния тяжести по данным межгруппового сравнения исходных показателей тяжести депрессий (HAM-D17) между выборками больных, завершивших программу (18,37±4,76) или выбывших из нее (19,62±5,09), не выявляет статистически достоверных различий в средних (t-критерий; р=0,125) и в функциях распределения по критериям Манна–Уитни (р=0,145) и Колмогорова–Смирнова (р=0,573). В обеих группах значение исходного общего балла HAM-D17 снижается (табл. 3), и изменения усредненного значения на последующих визитах, проверенные с помощью критерия знаковых рангов Вилкоксона для связанных выборок, статистически значимы (p<0,001). Исходя из этих данных, начальное значение общего балла HAM-D17 не является основным фактором, который оказывает влияние на преждевременное выбывание больных из программы.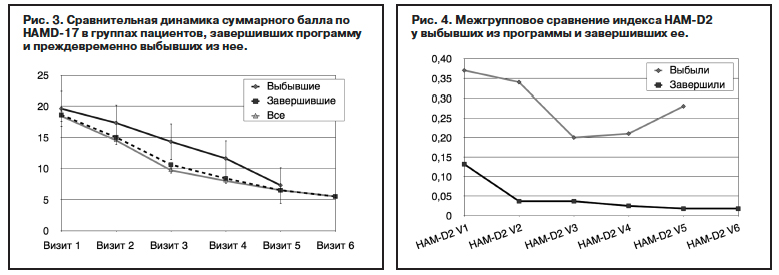
Вместе с тем более детальный анализ данных выявляет определенное влияние исходного уровня тяжести депрессии на длительность лечения агомелатином. Сравнение динамики депрессии показывает статистически значимые различия на V2, V3 и V4 между группами выбывших и завершивших по критерию Манна–Уитни (табл. 4; рис. 3). За период с 1 по 3-ю недели терапии (визиты 2–4) действительно выбывали пациенты с более высокими значениями общего балла по HAM-D17. Некоторые тенденции удается выявить при сравнении удельного веса выбывших из программы в подгруппах пациентов, исходно ранжированных в зависимости от выраженности депрессии. Из 15 пациентов с исходным баллом по HAM-D17>25 (выраженная депрессия) выбыли 40% пациентов (6 наблюдений), из 130 пациентов с умеренным уровнем 17–24 балла по HAM-D17 выбыло меньше – 22,3% (29 наблюдений), из 59 пациентов с легким уровнем менее 17 по HAM-D17 выбыло почти в 3 раза меньше – 16,9% (10 наблюдений).
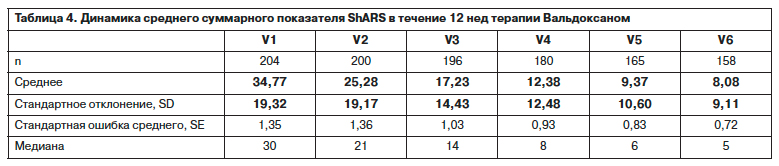
Изучение влияния отдельных компонентов депрессии, измеряемых по интегральным индексам HAM-D17, у выбывших из программы и завершивших ее не выявляет достоверных различий за исключением HAM-D2 (критерий Манна–Уитни для независимых выборок; р<0,0001). Средний показатель индекса HAM-D2 выше «0» обнаружен у 17,7% (36 наблюдений). Сравнение исходных значений индекса HAM-D2 у выбывших из программы и завершивших ее с помощью точного критерия Фишера показывает, что доля больных со значениями выше «0» в группе выбывших почти в 3 раза выше – 35,6% vs 12,6% (р=0,001), а относительный риск выбыть из программы для этих пациентов составил 2,57 (95% ДИ 1,57–4,22). Снижение среднего балла HAM-D2 у завершивших программу было статистически значимым, уже начиная со 2-го визита, в отличие от выбывших из программы, у которых исходное и заключительное значения на статистическом уровне не отличаются (р<0,0001). При этом многие пациенты, у которых не снижалось значение этого индекса, выбывали. Анализ динамики индекса HAM-D2 со значениями выше «0» по распределению в первые недели терапии, начиная со 2-го визита, позволяет утверждать, что отсутствие улучшения в течение 1-й недели при сниженной критике и/или суицидальной настроенности может являться неблагоприятным прогностическим признаком и свидетельствовать о недостаточной эффективности агомелатина (рис. 4).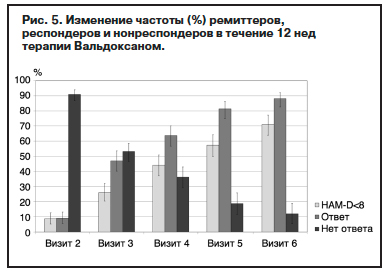
Изучение скорости появления первичного терапевтического ответа показывает, что у большинства больных снижение баллов по HAM-D17 на 25% зарегистрировано уже в первые 2 нед: на V3 – у 78,9% больных (n=161). Межгрупповое сравнение скорости первичного терапевтического ответа на 2 и 3-м визитах показывает различия между ремиттерами: 42,5% (V2) и 94,7% (V3) и больными, не достигшими ремиссии, – нонремиттерами: 21,7% (V2) и 50,0 (V3).
Скорость достижения ремиссии проанализирована с учетом соотношения респондеров, ремиттеров и нонреспондеров, начиная со 2-го визита, т.е. с 1-й недели терапии. На заключительном визите доля ремиттеров достигает 58,3% от исходной общей выборки, включающей 204 пациента. На гистограмме (рис. 5), отражающей распределение среди больных, продолжающих лечение, видно, что в ходе программы достаточно равномерно нарастают доли не только респондеров, но и ремиттеров.
Качество ремиссии при терапии агомелатина изучено с учетом влияния ряда факторов, в первую очередь исходной тяжести депрессии. При этом невозможно анализировать проблему, не учитывая неоднородность состояний ремиссии в клинической практике и трудности достижения бессимптомных состояний, особенно у стигматизированных в плане аффективной патологии больных. Изучение клинических характеристик ремиттеров (по психометрическим критериям), завершивших программу, выявляет, что полные синдромальные (или бессимптомные) ремиссии определяются в 24,0% (49 наблюдений), при этом среди оставшихся – симптоматических ремиссий выделяются состояния с различным качеством: как близкие к полным «с редкими пиками» (от 1 ч до 1 сут) – в 29,9% (61 наблюдение), так и субсиндромальные состояния, «с частыми пиками» – в 12,3% (25). В 2,5% (5) изученной выборки определяются признаки стабильной продуктивной гипомании, близкие к конституциональной гипертимии.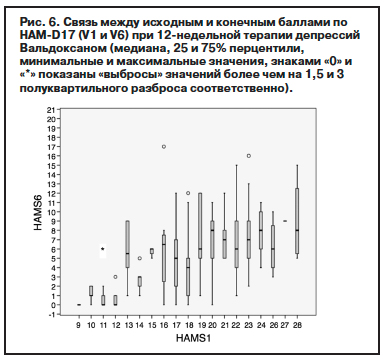
В целом при межгрупповом сравнении обнаруживается статистическое подтверждение факта преобладания невыраженной депрессии у ремиттеров: средний исходный показатель HAM-D17 17,26±4,8 vs 21,08±3,3 у остальных пациентов (р<0,0001). Указанную тенденцию подтверждает и анализ, проведенный с помощью коэффициента Пирсона. На рис. 6 наглядно показана связь между уменьшением доли ремиттеров (критерий HAM-D17<8) и исходным суммарным баллом по данной шкале: выявлены различия между больными с суммарным баллом до 21 и группой с более высокими значениями исходного показателя. В частности, медиана на заключительном визите у этих больных выше значений, свидетельствующих о ремиссии в соответствии с современными стандартами.
С учетом значительного удельного веса тревожного компонента в структуре депрессий и общих симптомов тревоги с коморбидными расстройствами оценка эффективности агомелатина проведена с учетом операциональных параметров по индексу тревоги шкалы HAM-D17 и суммарному показателю ShARS. Динамика среднего показателя ShARS демонстрирует уже к V2 достоверное снижение до нормального уровня (ниже 29 баллов), что коррелирует с отмечаемым врачом клиническим эффектом (см. табл. 4). Оценка статистической значимости изменений ShARS при помощи критерия знаковых рангов Вилкоксона для связанных выборок выявляет статистически значимые различия между всеми визитами (р<0,001).
Подробный анализ возможного анксиолитического действия агомелатина показывает необходимость учитывать различные нюансы. Межгрупповое сравнение динамики состояния между выборками депрессий с ведущим тревожным синдромом и психопатологически иными типами по средним суммарным баллам HAM-D17 выявляет достоверные различия на 2-м визите по t-критерию равенства средних (р=0,048) и по критерию Манна–Уитни для независимых выборок (р=0,03), указывающие на более значимое улучшение при тревожной депрессии на начальных этапах (табл. 5), при этом на остальных визитах достоверных различий между динамикой депрессии в клинически дифференцируемых группах не выявлено (р>0,05).
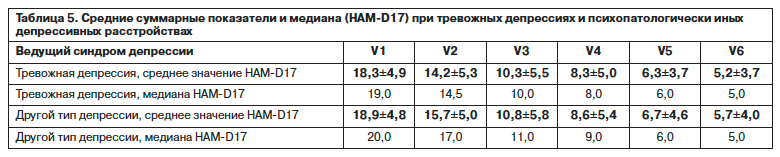
При анализе эффективности агомелатина проведена оценка влияния на различные компоненты дименсии тревоги. Исходный средний показатель STAI в общей выборке подтверждает тенденцию к высокому уровню тревоги, обусловленной психогенными факторами (дистрессом на фоне серьезной соматической патологии), – 49,32±9,7 (согласно используемым в населении точкам разделения 45 баллов и более – отражают высокий уровень тревоги). Получены достоверные различия между визитами, но переход от высокой ситуационной тревоги к умеренной отмечается только к V3 (табл. 6). Несмотря на достоверное снижение среднего суммарного показателя ситуационной тревоги в ходе терапии, на протяжении всего периода мониторинга ее уровень оставался несколько выше нормы, что требует дальнейшего анализа в отношении особенностей состояния больных, подвергающихся стрессовому воздействию, и адекватности формулировки вопросов шкалы.
Следует отметить, что из 111 пациентов с патологической тревогой, зафиксированной с помощью суммарного балла ShARS≥30 баллов, выбыли 25,2% (28 наблюдений), причем в большинстве этих случаев была изменена тактика терапии, что требует проверки предположения о влиянии уровня тяжести тревоги на преждевременное прекращение лечения агомелатином. Полученные данные при сравнении выбывших из программы и завершивших ее по исходным уровням ShARS и STAI, не выявляющие статистически достоверных различий (t-критерий: р=0,172 и р=0,346; критерий Манна–Уитни: р=0,868 и р=0,083; Колмогорова–Смирнова: р=0,669 и р=0,272), позволяют сделать вывод о том, что исходные суммарные значения ShARS и STAI, так же как и HAMD-17, не являются основным фактором влияния на выбывание из программы (табл. 7).
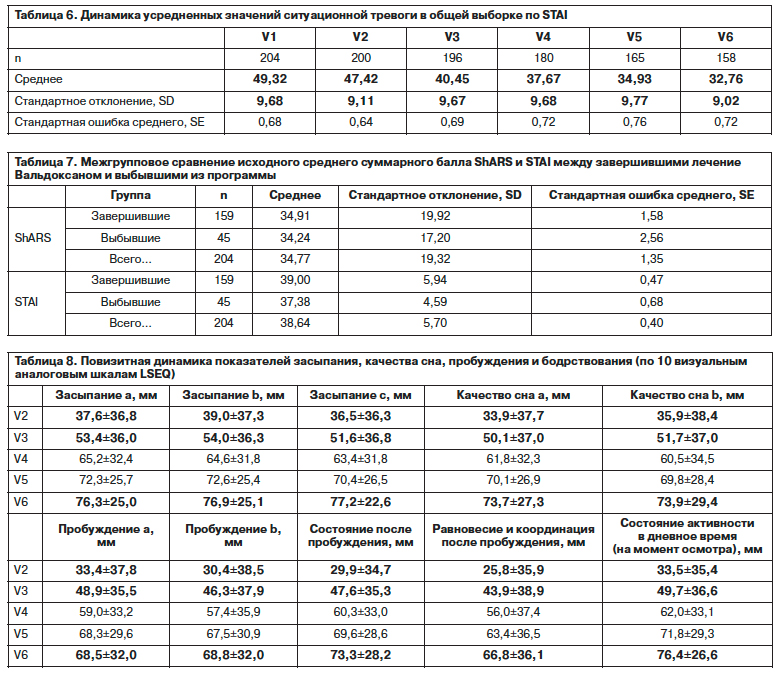
Изучение отдельных аспектов хронобиологического эффекта выявляет следующее. Усредненное исходное значение индекса инсомнии (по HAM-D17) у больных общей выборки составляет 4,58±1,3 балла, при этом выраженные нарушения (свыше 4 баллов) выявлены у 79,4% (162 наблюдения). Скорость динамики этого индекса существенно превышает скорость уменьшения показателей собственно депрессии, что особенно очевидно в первые 2 нед и характеризует первичный ответ. При клинической и психометрической скрининговой оценке инсомния сопряжена с циркадианными нарушениями, отмечаемыми в первую очередь в структуре аутохтонных и эндореактивных депрессий. Изучение динамики среднего суммарного балла LSEQ в общей выборке свидетельствует о статистически значимом различии исходных и заключительных параметров в сторону нормализации цикла «сон–бодрствование». Положительная динамика среднего суммарного показателя по сравнению с исходным нулевым уровнем зафиксирована у ряда больных уже на V2 – 32,4±31,5 (мм), значительно улучшилась в первые 3 нед – 48,7±32,3 мм (р<0,01), V4 – 60,7±29,7 мм (р<0,001). Редукция циркадианных нарушений в сторону привычного соотношения сна и бодрствования и стабилизация нормальной активности в течение дня отмечаются и в течение последующих 9 нед (V5 – 67,8±26,9 мм; V6 – 69,8±26,9 мм). Тенденция суммарной оценки отражает основные особенности динамики 10 анализируемых параметров, а оценка при помощи критерия Вилкоксона для связанных выборок показывает статистически значимый характер этих изменений (табл. 8).
Несмотря на большой разброс индивидуальных ответов, изучение с учетом заданной системы координат
5 параметров, отражающих периоды засыпания и сна в течение ночи, и 5 параметров, отражающи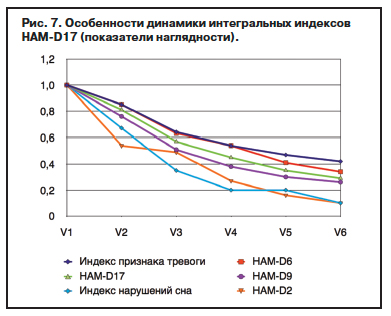 х состояние пробуждения и дневного самочувствия, показывает в целом сбалансированность улучшения сна и бодрствования при небольшом опережении нормализации периода засыпания (уже после 1-й недели терапии). После 2 нед отмечается в среднем почти 50% улучшение состояния пробуждения и бодрствования, более отчетливо эта тенденция прослеживается, начиная с 3-й недели терапии.Обобщая данные об основных и дополнительных эффектах агомелатина, следует указать на некоторые выявленные при анализе зависимости, в частности, при сравнении кривых динамики суммарного показателя HAM-D17 и интегральных индексов шкалы – «чистой депрессии», «тревоги», «инсомнии», «суицидальной настроенности», «неспецифических симптомов». В табл. 9 и на рис. 7 изменения отражены с применением «показателей наглядности», т.е. по сравнению с условной исходной единицей. Траектории свидетельствуют об улучшении (около 65%) индекса, включающего показатели ядерных нарушений, близко стоящего к суммарному показателю HAM-D17 (70–75%). Общий результат достигается в результате того, что в значительной степени редуцируются неспецифические симптомы депрессивного домена, максимально снижаются нарушения сна, суицидальные тенденции и восстанавливается адекватное отношение к депрессивным нарушениям у больных, завершивших программу. При этом редукция тревоги в первые 3 нед совпадает с динамикой собственно гипотимии, но на последующих этапах лечения этот компонент начинает редуцироваться медленнее депрессивного настроения и других элементов, хотя в целом редукция тревоги через 12 нед терапии более существенна и в отличие от других компонентов составляет немного менее 60%.
х состояние пробуждения и дневного самочувствия, показывает в целом сбалансированность улучшения сна и бодрствования при небольшом опережении нормализации периода засыпания (уже после 1-й недели терапии). После 2 нед отмечается в среднем почти 50% улучшение состояния пробуждения и бодрствования, более отчетливо эта тенденция прослеживается, начиная с 3-й недели терапии.Обобщая данные об основных и дополнительных эффектах агомелатина, следует указать на некоторые выявленные при анализе зависимости, в частности, при сравнении кривых динамики суммарного показателя HAM-D17 и интегральных индексов шкалы – «чистой депрессии», «тревоги», «инсомнии», «суицидальной настроенности», «неспецифических симптомов». В табл. 9 и на рис. 7 изменения отражены с применением «показателей наглядности», т.е. по сравнению с условной исходной единицей. Траектории свидетельствуют об улучшении (около 65%) индекса, включающего показатели ядерных нарушений, близко стоящего к суммарному показателю HAM-D17 (70–75%). Общий результат достигается в результате того, что в значительной степени редуцируются неспецифические симптомы депрессивного домена, максимально снижаются нарушения сна, суицидальные тенденции и восстанавливается адекватное отношение к депрессивным нарушениям у больных, завершивших программу. При этом редукция тревоги в первые 3 нед совпадает с динамикой собственно гипотимии, но на последующих этапах лечения этот компонент начинает редуцироваться медленнее депрессивного настроения и других элементов, хотя в целом редукция тревоги через 12 нед терапии более существенна и в отличие от других компонентов составляет немного менее 60%.
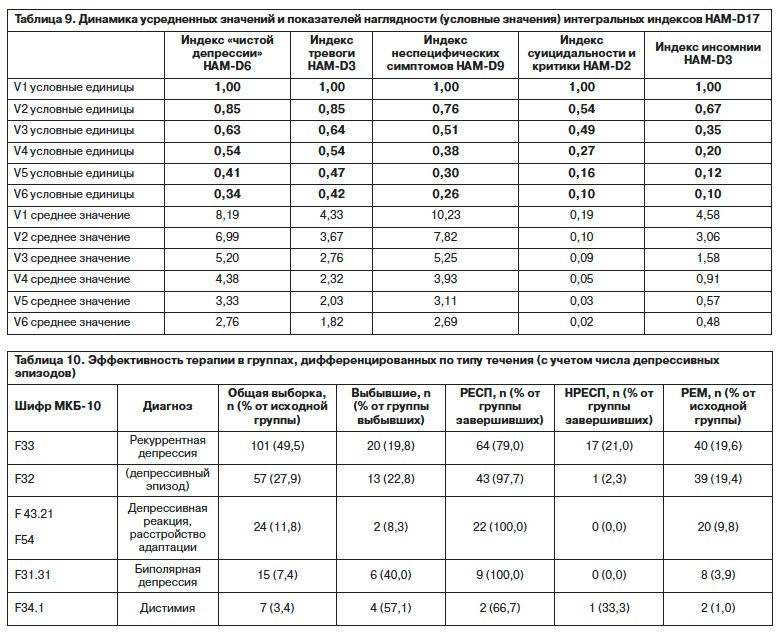
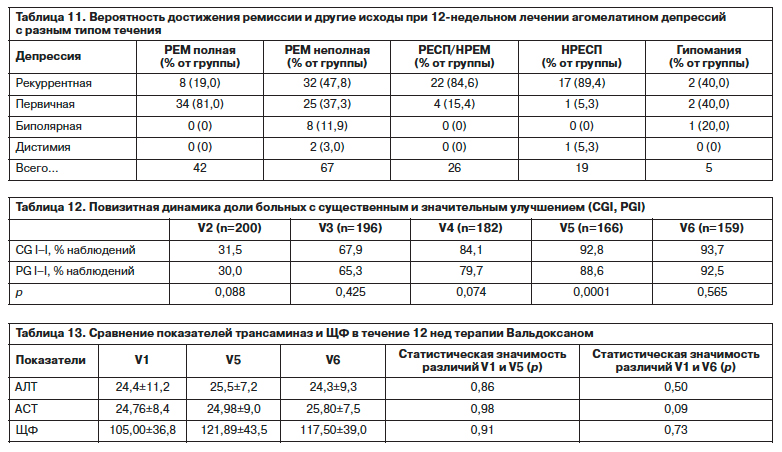
В табл. 10 представлены суммарные данные об особенностях терапии агомелатином в разных диагностических группах, отличающихся по механизму формирования и течению депрессивной патологии с учетом риска выбывания, а также соотношения долей больных с полной и неполной ремиссией, респондеров и нонреспондеров. Сравнение показателей данных в каждой из групп, выделенных с учетом типа течения (по критериям МКБ-10), выявляет оптимальные результаты в группе больных с нозогенными депрессивными реакциями: у 20 из 24 пациентов зарегистрирована ремиссия, преждевременно выбыли всего 2 пациента. Показатели у больных с первичным эпизодом лучше, чем при повторных фазах в плане удельного веса респондеров и ремиттеров, при этом число преждевременно выбывших при первичном обращении в данной группе даже несколько выше, что соответствует более низкому комплаенсу в этой группе по сравнению с больными, имеющими опыт лечения при предшествующих эпизодах. Распределение больных в группе с биполярной депрессией показывает максимальный по сравнению с другими группами процент выбывших (40,0%), но при этом отсутствие нонреспондеров в группе завершивших исследование.
Сравнение данных в группах первичной, рекуррентной, биполярной депрессий и дистимии с учетом достижения ремиссии и ее качества – полной или симптоматической формы, дифференцированных по клиническим критериям (по HAM-D17 суммарный балл в группе ремиттеров не превышает 7 баллов), выявляет различия, свидетельствующие о том, что полная ремиссия легче достигается после первого эпизода при отсутствии гипомании, мании или дистимии в анамнезе (табл. 11). В группе нонреспондеров отмечен высокий риск дистимии в анамнезе (15 из 19 случаев). Гипомании на завершающем визите выявлены у 5 (3,1% от группы завершивших исследование) пациентов, при этом распределение случаев между группами первичной и рекуррентной депрессий сходно с долями, выявленными во время скрининга при изучении анамнеза.
Для оценки результатов лечения с учетом становления ремиссии важны динамика и завершающие показатели CGI и PGI, отражающие целостную оценку, включая полноту редукции симптомов и восстановления функционирования до доболезненного уровня, по мнению врача и пациента. В табл. 12 представлена динамика числа (%) больных с показателями «значительное улучшение» или «улучшение» с учетом показателя достоверности различий, полученного при сравнении объективной и субъективной оценок с помощью коэффициента корреляции Спирмена. Полученные данные свидетельствуют о согласованности клинического впечатления врача и самооценки пациента на большинстве визитов, что вполне соответствует реальной ситуации при данной патологии. Исключение составляет только V5: через 6 нед терапии мнение пациентов отличается от врачебного в сторону завышения оценки эффективности средства. Состояние больных с полной ремиссией коррелирует с оценками «значительное улучшение» по CGI и PGI, в группе неполной ремиссии преобладают оценки «улучшение».
Для оценки переносимости изучены основные физиологические показатели пациента (масса тела, ЧСС, АД) до и после лечения. Средний вес на момент начала исследования составил 68,76 кг (SD 13,59; SE 0,95), на момент окончания исследования – 69,47 кг (SD 13,31;
SE 1,10). Хотя критерий Вилкоксона для связанных выборок показал, что различия носят статистически значимый характер (р<0,001), в целом речь идет о незначительном повышении веса в пределах 0,5–1,5 кг, что может быть связано с различными факторами, в том числе и выходящими за пределы медикаментозной терапии.
Повизитная оценка показала, что в период проведения программы отмечалось небольшое снижение средней ЧСС (с 74,3 до 71,8). Отмечалось также незначительное снижение систолического (с 126,5 до 123,3) и диастолического (с 77,9 до 75,0) АД. Изменения зарегистрированы на 2 и 3-м визитах, после чего на 4 и 5-м визитах они существенно не изменялись. На 6-м визите отмечено некоторое повышение АД по сравнению с 4-м визитом (с 122,9/74,8 до 123,3/73,0), не носящее статистически достоверного характера (р>0,05). Побочных эффектов по типу необъяснимых эпизодов артериальной гипертензии не зарегистрировано.
С целью оценки безопасности проведено сравнение показателей крови в ходе программы (клинический анализ крови; биохимические показатели: аланинаминотрансфераза – АЛТ, аспартатаминотрансфераза – АСТ, щелочная фосфатаза – ЩФ, общий билирубин); табл. 13. Следует отметить, что на скрининге были отмечены пациенты с клинически незначимыми отклонениями, позволяющими проводить терапию агомелатином (в клиническом анализе крови у 2%, АЛТ – 12,7%, АСТ – 8,8%, общий билирубин – 2,5%. Статистически значимых различий в оценке клинического анализа крови не наблюдается (точный критерий Фишера между 1 и 5-м визитами: р=0,179; c2 Пирсона между 1 и 6-м визитами: р=0,96). Сравнительная оценка таких биохимических показателей, как АЛТ, АСТ и ЩФ, между 1, 5 и 6-м визитами статистически значимых различий не выявляет (табл. 14), в том числе у больных с незначительными отклонениями на скрининге (кроме 1 пациента с онкопатологией, который преждевременно выбыл из программы). Сравнение показателей общего билирубина между 1 и 5-м, а также 1 и 6-м визитами также не выявили достоверных различий: 0,36 и 0,41 соответственно.
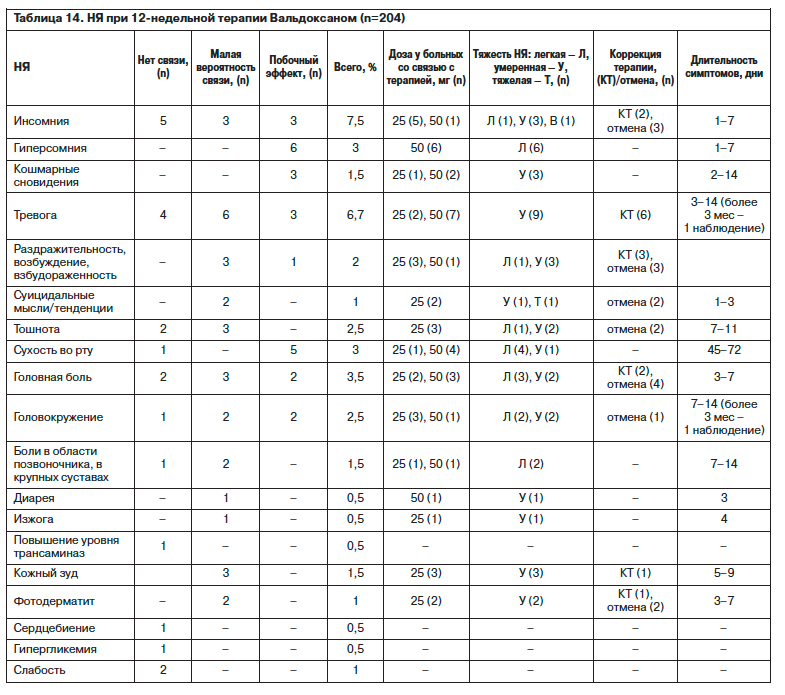
НЯ исследованы с учетом вероятности связи с агомелатином, степени выраженности, времени появления, длительности, используемой дозы агомелатина, необходимости коррекции схемы или отмены агомелатина (см. табл. 14). Изучение сроков проявления побочных эффектов, вероятно, связанных с приемом агомелатина, показывает, что они проявляются в начале приема препарата: в первые 14 дней в легкой или умеренной степени на короткий период времени – в среднем на 3–5 дней (редко на срок более 2 нед) и в основном не являются причиной преждевременного прекращения лечения. Исключением являются усиление тревоги, инсомнии (неприятно окрашенные сновидения, трудности засыпания), раздражительности, взбудораженности и появление суицидальных мыслей в первые дни терапии, которые не купируются с помощью симптоматической терапии.
Ряду респондеров, нуждающихся в пролонгированном лечении при высокой степени приверженности терапии, рекомендовано принимать Вальдоксан в качестве поддерживающей терапии в дозе 25–50 мг после завершения 12-недельной программы. Нонреспондерам предложена смена тактики на разных этапах программы или после ее завершения: добавление антидепрессанта, замена антидепрессанта, добавление психотропного средства (не антидепрессанта) и психотерапии, в 1 случае – электросудорожная терапия.
В связи с актуальностью проблемы оценки качества лечения все более важное значение для амбулаторной практики приобретают нарушения соблюдения предписанного режима. Несмотря на то что экспертами до включения пациента в программу проводилось прогнозирование риска нонкомплаентности, все же по причине нарушений приверженности терапии или отказа от ее продолжения в первые недели преждевременно завершили участие в программе 11 пациентов, что составило 5,4% от общей выборки. Анализ комплаентности показывает, что причинами несоблюдения предписанной схемы агомелатина в равной мере являются как недостаточная эффективность лечения, так и достаточное, по мнению пациента, улучшение состояния. Неожиданное прекращение лечения или тенденция к повторяемости кратковременных пропусков приема медикамента в большой степени объясняются влиянием конституциональных особенностей на медицинское поведение. Экспертная оценка позволяет установить связь между нонкомплаентностью и диссоциальным, импульсивным или шизотипическим радикалом, недостаточной критикой в отношении высокого риска рецидива депрессии. В незначительной степени нонкомплаентность пациентов оказывается связана с побочными эффектами агомелатина.
Преимуществами настоящей программы перед другими исследованиями является мониторинг на протяжении 12-недельной терапии, позволяющий оценить как безопасность, переносимость при пролонгированном (12-недельном) применении агомелатина у больных общемедицинской сети, так и полноту ремиссии с учетом сроков достижения стабильности и особенностей нестабильного состояния, с опорой на комплексную психометрическую оценку ключевых признаков депрессии и резидуальных нарушений (S.Stahl, 2010). Сравнительная оценка переносимости и безопасности агомелатина и других антидепрессантов последних поколений в международных исследованиях (A.Montejo, 2010; D.Stein и соавт., 2012) показывает сходство по числу НЯ при меньшем проценте исключенных по этой причине (р=0,0058).
Полученные данные об отсутствии побочных эффектов у большого числа пациентов или преобладании легких НЯ, не требующих коррекции, совпадают с результатами других исследований и их следует учитывать при создании терапевтических алгоритмов. При сравнении с данными исследования РИТМ видно, что только в первые дни приема агомелатина существует возможность усиления тревоги и инсомнии, в последующем ни один из побочных эффектов в обеих (психиатрической и общемедицинской) программах не достигает 5% барьера.
Профиль динамики депрессии в общей выборке на терапии агомелатином свидетельствует о его антидепрессивных свойствах и особенностях, связанных с хронобиотической, анксиолитической, антидистрессовой терапевтической активностью, что подтверждают данные других российских исследований (С.Н.Мосолов и соавт., 2011, 2012). Изучение эффективности агомелатина в программе ФОРУМ позволило сравнить особенности редукции легких депрессий, наиболее часто выявляемых в общемедицинской сети, по сравнению с выраженными психопатологическими формами, соответствующими умеренной и тяжелой депрессии по критериям HAM-D17, проанализировать влияние ранга депрессии и синдромальной структуры на длительность терапии и досрочное завершение 12-недельного курса агомелатина, выявить некоторые отчетливые тенденции. Хотя исходные суммарные значения HAM-D17, ShARS и STAI не являются основным фактором влияния на преждевременное прекращение данной терапии и при межгрупповом детальном анализе данных выявляется, что эти факторы не является основными.
Проведенный анализ свидетельствует об определенном влиянии исходного уровня тяжести депрессии. Обнаруживается статистическое подтверждение факта преобладания исходной невыраженной депрессии у ремиттеров, меньшее число в этой группе остаточных явлений, меньший риск преждевременного прекращения курса, в том числе больных с тревожными нарушениями в структуре депрессии. Хотя диагноз «тревожная депрессия» не оказывает статистически значимого влияния на смену терапии в первые недели, вместе с тем высокие показатели как генерализованной, так и ситуационной тревоги могут требовать дополнительных усилий по мониторингу и/или комбинирования агомелатина с высокопотенциальными анксиолитическими средствами.
Проведенное сравнение с данными других исследований об информативности первичного терапевтического ответа в первые 2 нед и изучение становления ремиссии на протяжении минимум 12 нед подтверждает вероятностную связь отсутствия улучшения в течение 1-й недели терапии агомелатином с трудностями достижения полной ремиссии. К неблагоприятным прогностическим признакам, свидетельствующим о недостаточной эффективности агомелатина, которые необходимо тестировать в эти сроки, следует отнести в первую очередь сниженную критику и/или суицидальную настроенность и в некоторой степени – сохранение высокого уровня тревоги, а также инверсию в гипоманию. К благоприятным прогностическим признакам следует отнести быстроту динамики клинических проявлений инсомнии и соответствующих параметров HAM-D17 и LSEQ, опережающих скорость уменьшения показателей собственно депрессии, и прослеживание отчетливой тенденции нормализации цикла «сон–бодрствование» на протяжении последующих 10 нед. Нестабильность редукции циркадианных нарушений в сторону привычного соотношения сна и бодрствования и нарушений активности в течение дня могут свидетельствовать о формировании резидуального циклотимического комплекса или общих симптомов, характеризующих неполную ремиссию.
В данной программе, позволившей изучить характеристику и полных, и неполных ремиссий (по психометрическим критериям), подтверждена высокая вероятность симптоматических ремиссий со сходными основными типами («пиками» ядерных и неспецифических нарушений) наряду с полными ремиссиями так же, как это отмечается в психиатрической сети (J.Zajecka, А.Б.Смулевич и соавт., 2014). Программа ФОРУМ показывает важность анализа эффективности в пролонгированных исследованиях с учетом высокой доли неполных ремиссий и особенностей их становления с 3-й по 8–12-ю недели терапии, а также недостаточную разработанность типологии остаточных симптомов при рекуррентных депрессиях в общей медицине. Кроме того, в отдельном изучении нуждаются, в частности, структура и динамика остаточных общих симптомов с учетом высокой степени коморбидности с психической и соматической патологией.
В числе важных аспектов, затрудняющих лечение Вальдоксаном, следует отметить некомплаентность больных, снижение критического отношения, суицидальную настроенность; в меньшей степени имеют значение тяжесть депрессии и неполные нестабильные ремиссии в анамнезе, снижающие вероятность достижения ремиссии с помощью монотерапии и предотвращения риска рецидива без адекватного стабилизирующего и поддерживающего лечения.
2Индикатор тяжести депрессии (суммарная оценка в диапазоне от 0 до 52 баллов), выраженности ядерных признаков – индекс «чистой депрессии» (субшкала HAM-D6: пп. 1 – пониженное настроение, 2 – снижение самооценки и чувство вины, 7 – снижение активности и интересов, 8 – психомоторная заторможенность, 10 – психическая тревога, 13 – общесоматические симптомы. Оценка в диапазоне 0–22 балла: 0–4 балла – нет депрессии, 5–6 баллов – пограничная, 7–8 баллов – легкая, 9–11 баллов – умеренная, 12–22 балла – тяжелая) и поведения, связанного с суицидальным риском и нарушением критики (субшкала HAM-D2: пп. 3,17. Оценка в диапазоне 0–6), а также выраженности неспецифических признаков депрессии – индекс «неспецифических, связанных со стрессом симптомов» (субшкала HAM-D9: пп. 4–6 – инсомния, 9 – психомоторное возбуждение, 11 – тревога соматическая, 12 – желудочно-кишечные симптомы, 14 – сексуальная дисфункция,
15 – озабоченность физикальными симптомами, ипохондрические нарушения, 16 – потеря веса. Оценка в диапазо-
не 0–24), индекс нарушений сна (субшкала инсомнии – пп. 4–6. Оценка в диапазоне 0–6), индекс тревоги (субшкала тревоги – пп. 9–11. Оценка в диапазоне 0–10). Для оценки выраженности нарушений использован модифицированный вариант HAM-D17 в виде таблицы с измерением частоты признака в течение прошлой недели.
3Индикатор симптомов патологической тревоги и ее тяжести (диапазон суммарной оценки от 0 до 140 баллов: 0–29 – клинически незначимая тревога, 30 и более – клинически значимая тревога, при этом свыше 45 – выраженная тревога, свыше 80 – очень высокий уровень). Валидны границы. Выделены отдельные показатели выраженности панических атак (пп. 17–19), расстройств сна (пп. 30, 31), депрессии (п. 32), обсессий (п. 34) и компульсий (п. 35); оценка выраженности каждого признака от 1 до 4, отсутствие – 0.
4Индикатор самооценки уровня тревоги в ответ на актуальные стрессорные ситуации, в частности, связанные с соматической патологией и ее лечением. Вычисляется по стандартной формуле PT=∑1-∑2+50, где ∑1 – сумма зачеркнутых цифр на бланке по пунктам 3, 4, 6, 7, 9, 12–14, 17, 18. ∑2 – сумма остальных зачеркнутых цифр по пунктам 1, 2, 5, 8, 10, 11, 15, 16, 19, 20 (диапазон суммарного значения от 20 до 80 баллов, до 30 баллов – низкая, 31–44 балла – умеренная, 45 и более балов – высокая).
5Индикатор уровня соматизации по комплексной оценке пациентом и врачом уровня физикальных симптомов, связанных с психическим расстройством (оценка 2 в базе данных), и общих для соматической и психической патологии симптомов (оценка 3 в базе данных).
6Индикатор изменения качества сна и бодрствования в рамках суточного ритма по сравнению с периодом до лечения Вальдоксаном, объединяющий особенности засыпания (3 пункта), продолжительности ночного сна (2 пункта), пробуждения (2 пункта) и состояние бодрствования (3 пункта). Выбран один из вариантов аналоговой международной шкалы LSEQ (Leeds Sleep Evaluation Questionnaire). Динамика каждого признака оценивалась с помощью градуированной положительными и отрицательными числами линейки от 0 (состояние без изменений) в сторону улучшения от 1 (минимальное) до 10 (максимальное) или ухудшения от -1 (минимальное) до -10 (максимальное) (расчет в мм, улучшение в направлении от 0 до 100, ухудшение – от 0 до -100).
7Дополнительный индикатор качества жизни, отражающий удовлетворенность сложившейся жизнью с учетом индивидуальных планов, потребностей и суммарного воздействия стрессорных факторов: удовлетворенность – от 5 (минимальная) до 7 (максимальная), неудовлетворенность – от 3 (минимальная) до 1 (максимальная) и 4 – балл, отражающий затруднение дать определенный ответ.
8В междисциплинарных центрах ГБОУ ВПО «Первый МГМУ им. И.М.Сеченова» Минздрава России исследовательская работа проводится в рамках совместных с интернистами эпидемиологических программ, имеющих терапевтическую фазу.
Андрющенко Алиса Владимировна – д-р мед. наук, зав. научно-исследовательским отд. психосоматической медицины НИЦ Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: alissia.va@gmail.com
А.Ю.Бражников – НОКЦ Психосоматическая медицина ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России
Н.В.Захарова – отд. пограничной психической патологии и психосоматических расстройств ФГБУ НЦПЗ РАМН, Москва; НОКЦ Психосоматическая медицина ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России
Романов Дмитрий Владимирович – канд. мед. наук, вед. науч. сотр. НИО Психосоматическая медицина НИЦ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России, доц. каф. психиатрии и психосоматики ИПО ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: newt777@mail.ru
Самушия Марина Антиповна – канд. мед. наук, доц. каф. психиатрии и психосоматики ФППОВ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: sma-psychiatry@mail.ru
Я.К.Галецкайте – НОКЦ Психосоматическая медицина ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России
Волель Беатриса Альбертовна – д-р мед. наук, проф. каф. психиатрии и психосоматики ИПО ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: beatrice.volel@gmail.com
Ключевые слова: агомелатин, антидепрессант, депрессия, тревога, нарушения сна, расстройства аффективного спектра, общемедицинская практика, наблюдательное исследование, ремиссия, первичный терапевтический ответ, Вальдоксан.
Effectiveness and safety of agomelatine (Valdoxan) in patients with depression (programma FORUM)
A.B.Smulevich1,2, A.V.Andryushchenko2, А.U.Brazhnikov2, N.B.Zakharova1,2, D.V.Romanov1,2, M.A.Samushiya2, Y.K.Galetskayte2, B.A.Volel1,2
1Department for the Study of borderline mental diseases and psychosomatic disorders MHRC RAMS, Moscow;
2Department for the Psychosomatic medicine, Institute of Professional Education First Moscow State Medical University I.M.Sechenov
Summary. The article summarizes data on effectiveness and safety of agomelatine (Valdoxan) in patients with depression treated in general medicine settings (i.e. cardiology, oncology, pulmonology, dermatology, rheumatology, neurology, endocrinology, gynecology). The observational study sample comprise 204 subjects (73% female, mean age 47,43±14,61 years). The velocity of primary treatment response, the spectrum of clinical effects (antidepressive, anxiolytic, chronobiotic, antidistessive), type and stability of achieved remission have been evaluated.
Key words: agomelatine, antidepressant, depression, anxiety, sleep disturbances, affective spectrum disorders, general medicine, observational study, remission, primary treatment response, Valdoxan.
Введение
Накопление эпидемиологических данных по проблеме депрессий в общемедицинской практике подтверждает ее важность: распространенность этой патологии определяется в диапазоне 15–30%, а ее доля от всех психопатологических нарушений составляет 25–50%, при этом риски снижения трудоспособности, серьезных осложнений и преждевременной смертности значимо повышены по сравнению с больными без депрессии (W.Katon, 1990; T.Üstün, 1995; R.Kessler и соавт., 2005; F.Creed, 2007; M.Härter и соавт., 2007; M.Ohayon 2007; S.Moussavi и соавт., 2007; L.Zahodne и соавт., 2012; В.С.Собенников, 2001; В.Н.Краснов, 2010). Разброс показателей распространенности депрессии, степени ее влияния на процессы дезадаптации и прогноз во многом определяются спецификой клинической базы, используемого стандарта скрининга и системой организации медицинской помощи данному контингенту (А.В.Андрющенко, 2011).В сравнительных исследованиях общемедицинских и психиатрических выборок показано сходство симптоматики депрессий и общих принципов для клинических алгоритмов (B.Gaynes и соавт., 2007; А.Б.Смулевич, Э.Б.Дубницкая, М.Ю.Дробижев и соавт., 2007). Собственные данные, накапливаемые 15 лет в междисциплинарных исследованиях, свидетельствуют о гибридном влиянии аутохтонных и средовых (психогенные, нозогенные, соматогенные, лекарственные) осцилляторов, приобретающих особую значимость в ситуациях психотравмирующего воздействия и определяющих широкий диапазон проявлений депрессий в общей медицине – от простых реакций и пограничных аффективных нарушений, маскируемых соматизированными и другими неспецифическими признаками, до выраженной эндоформной патологии при активации ключевых для патогенеза депрессий нейробиологических систем.
Клиническими валидаторами психопатологически выраженных депрессий являются констелляции ядерных нарушений, в числе последних рассматривают котимию меланхолических проявлений (тоска, негативная самооценка, безрадостность) и генерализованной тревоги, сочетание гипотимии с характерными нарушениями моторно-двигательной сферы (моторная заторможенность/ажитация) и аутохтонными патофизиологическими колебаниями (массы тела и др.), биполярность. Ведущие эксперты уделяют особое внимание тревоге, интерпретируя данную патологию в качестве фактора, декомпенсирующего и усиливающего тяжесть депрессии, а также предиктивного валидатора большого депрессивного эпизода и рекуррентного течения (S.Kasper и соавт., 2010; А.Б.Смулевич и соавт., 2013).
Многими авторами выделяются нарушения других систем, играющие роль модуляторов депрессий, в первую очередь хронобиологическую (десинхронизация уровней мелатонина, пролактина, кортизола, внутриклеточных сигналов, иммунных воспалительных и протекторных агентов, расстройства цикла «сон–бодрствование», массы тела, функционирования вегетативной нервной системы и др.) и когнитивную/конатативную (фиксация негативных эмоций, идеи физической/психической неполноценности, виновности, нарушение сосредоточения внимания, рабочей памяти, деморализация, демотивация) (M.Nibuya и соавт., 1996; E.Suzuki и соавт., 1996; J.Arendt 1989, 2000; D.Slattery и соавт., 2004; P.Gorwood, 2010).
Результативность влияния терапевтических средств на отдельные дименсии, валентности, констелляции симптомов депрессий, а также на остаточные симптомы при неполных ремиссиях (резидуальный циклотимический симптомокомплекс, общие с тревожно-
фобическими расстройствами, соматоформными расстройствами – СФР, расстройствами личности – РЛ признаки, сниженный уровень исполнительных функций) активно изучается (А.Б.Смулевич 2014).
В настоящее время благодаря быстрому развитию фармакологических моделей акцент в анализе антидепрессивных свойств ставится на изучении эффектов воздействия медикамента на отдельные биологические мишени (количество отдельных рецепторов, уровень взаимодействия нейротрансмиттерных систем, внутриклеточных сигналов, ответственных за устойчивость эмоционального гомеостаза и пр.) и их консолидации. Для обыденной практики отечественного здравоохранения (в ситуации отсутствия надежных биомаркеров и недоступности нейровизуализационной индикации высокого уровня) сохраняет первостепенное значение подбор средств с опорой на их потенциальные свойства, клинические и психометрические валидаторы эффективности терапии. Построение алгоритма терапии депрессий, наблюдаемых в общемедицинской сети, затруднено в силу ряда нерешенных вопросов, касающихся таргетных симптомокомплексов и диапазона терапевтических доз на разных этапах, возможности тестирования в первые 2 нед эффективности антидепрессанта с целью прогноза, безопасности пролонгированной поддерживающей психофармакотерапии на фоне соматической патологии, оценки комплаентности в системе критериев качества лечения.
Для решения выделенных вопросов и разработки путей повышения психического здоровья пациентов в рамках оказания медицинской помощи создан инициативный многоступенчатый проект ФОРУМ (2012–2017 гг.). Его глобальной целью является создание проекта регистра для сбора данных об эффективности и безопасности применения психотропных средств, в первую очередь антидепрессантов, с помощью которого можно изучать разные аспекты терапевтического ответа, включая уровни лекарственной ремиссии, персонифицированную оценку комплаентности пациента с учетом объема лечебных мероприятий, соматического фона, траектории медицинского маршрута.
Спланированные в этом направлении натуралистические работы позволяют решать проблемы рутинной практики, плохо представленные в рамках жестко регламентируемых РКИ, с помощью ресурсоемких методов. Многомерное изучение случаев в режиме «реального времени» и многоцентровых программ позволяет получить профили больных с недостаточным терапевтическим ответом или неполными ремиссиями, уточнить влияние средовых факторов на лечебные предпочтения врача и пациента, удовлетворенность психофармакотерапевтическим методом, дифференцировать с привлечением клинико-терапевтических данных причины несогласия и несоблюдения стандартной лечебной схемы, выбрать наиболее адекватный диагностический инструмент для оценки психопатологии депрессии, остаточных симптомов и влияющих на медицинское поведение личностных нарушений.
Клинико-терапевтическая программа «Эффективность и безопасность применения агомелатина в общемедицинской практике» разработана как фрагмент проекта ФОРУМ под руководством координатора, академика РАН, профессора А.Б.Смулевича для усовершенствования лечения депрессий и критериев контроля качества специализированной медицинской помощи. Широкие возможности и уникальность агомелатина (Вальдоксана), внедренного в клиническую практику с 2006 г., связаны с его синергичным воздействием одновременно как агониста мелатонинергических MT1- и MT2-рецепторов и как антагониста серотонинергических 5-HT2С-рецепторов (V.Audinot и соавт., 2003; M.Millan и соавт., 2003; M.Lader, 2007). Доказано, что механизм действия препарата позволяет корректировать депрессивную симптоматику и ресинхронизировать вызванные аффективной патологией изменения циркадианных ритмов, несмотря на отсутствие влияния на обратный захват моноаминов.
Согласно результатам сравнительных международных исследований в психиатрической и общемедицинской практике продемонстрирована эффективность Вальдоксана при использовании суточной дозы 25–50 мг и его преимущества перед другими медикаментами: возможность достижения значимого улучшения начиная с 1-й недели; отсутствие синдрома отмены при резком прекращении терапии и ряда других характерных для антидепрессантов проблем – половая дисфункция, повышение массы тела, снижение артериального давления (АД), утренняя сонливость и пр. (G.Goodwin, 2008; A.Нale и соавт., 2009).
В рандомизированных международных исследованиях показаны достоверное улучшение при большой депрессии (по динамике суммарного показателя HAM-D17) при 8-недельной терапии и снижение риска рецидива при пролонгированной 24-недельной терапии (при сравнении с плацебо; р=0,0001) (G.Goodwin и соавт., 2009; S.Stahl и соавт., 2010; J.Zajecka и соавт., 2010), превосходство агомелатина за 6–8 нед у пограничных больных над плацебо-эффектом и сходство по числу респондеров с действием препаратов групп селективных ингибиторов обратного захвата серотонина (флуоксетин, пароксетин, сертралин, эсциталопрам) – 71,75% vs 64,52% и селективных ингибиторов обратного захвата серотонина и норадреналина (венлафаксин XR) – 76,4% vs 70,6% соответственно (S.Kasper и соавт., 2010).
В российских программах ХРОНОС, РИТМ, ВРЕМЯ, ВАЛЬС получены данные об оптимальном соотношении эффективности и переносимости Вальдоксана, соответствующем принципиальному условию общемедицинской сети – «щадящей» психофармакотерапии (С.В.Иванов, 2009; А.Б.Смулевич, А.В.Андрющенко, Д.А.Бескова, 2010). Клинические результаты и экспериментальные данные о способности препарата снижать вызванный стрессом выброс глутамата, повышать уровни норадреналина и дофамина во фронтальной коре, нейротрофического фактора роста BDNF и норадреналина в гиппокампе, а также влиять на согласованность внутриклеточных сигналов, ответственных за синхронизацию биологических ритмов, открывают широкие перспективы применения в междисциплинарных областях (S.Stahl, 2011).
Дизайн исследования
Цель – изучение эффективности, переносимости и безопасности агомелатина, а также причин досрочного прекращения или смены метода лечения при 12-недельной терапии депрессий у лиц с сопутствующей кардиологической, онкологической, пульмонологической, дерматологической, ревматологической, неврологической, эндокринологической, гинекологической и соматоформной патологией. В рамках поставленных задач анализируются скорость первичного терапевтического ответа, спектр эффектов (антидепрессивный, противотревожный, хронобиотический, антидистрессовый), структура и устойчивость ремиссии, рассматриваются отдельные клинико-терапевтические закономерности и их предиктивное значение.Формирование выборки осуществлено с помощью адекватных для обсервационной программы критериев включения/невключения после подписания пациентом информированного согласия, которое включало нормы обеспечения безопасности для жизни и здоровья при терапии на основе соблюдения Хельсинской декларации Всемирной медицинской ассоциации 2008 г., стандарты GCP, GMP. Психопатологическое и психометрическое исследование проводилось врачами, сертифицированными по специальности «психиатрия». Диагностика депрессии и сбор данных проводились квалифицированными врачами-психиатрами, поскольку в предыдущих собственных исследованиях установлено, что психометрический скрининг депрессий без полного клинического обследования может завышать их частоту в среднем на 10%.
Критерии включения:
1. Мужчины и женщины в возрасте старше 18 лет (до 75 лет), обратившиеся в учреждения общемедицинской сети.2. Непсихотические депрессивные расстройства.
Диагноз по Международной классификации болезней 10-го пересмотра (МКБ-10) (шифры F3, F4, F5):
а) F32/F33: униполярные депрессии легкой и умеренной степени тяжести (первый/рекуррентный эпизод; дистимия);
б) F31: биполярные аффективные расстройства, депрессии легкой и умеренной степени тяжести (первый/рекуррентный эпизод);
в) F43 и F54: реакции адаптации депрессивного спектра, в том числе обусловленные патогенетическим или нозогенным воздействием соматической патологии.
1. Выраженность депрессивного расстройства не менее 3 баллов по шкале CGI-S (тяжесть с учетом всего спектра легких состояний).
2. Стандартные показания для терапии антидепрессантами согласно полной Инструкции по медицинскому применению препарата Вальдоксан: в качестве первого антидепрессанта или замены предыдущего антидепрессанта в случае его плохой переносимости и/или неудовлетворительной эффективности.
Критерии исключения:
• повышенный суицидальный риск;
• шизофрения, шизоаффективное расстройство, органическое поражение центральной нервной системы, деменция, эпилепсия, болезнь Альцгеймера, черепно-мозговая травма;
• биполярное аффективное расстройство: депрессии с психотическими чертами, бредом, частые маниакальные состояния в анамнезе, короткие циклы;
• алкоголизм или наркомания в анамнезе;
• установленная ранее индивидуальная непереносимость либо неэффективность Вальдоксана в анамнезе при назначении препарата в адекватной дозе (не менее 25 мг/сут) и адекватной длительности (не менее 4 нед);
• резистентность к терапии антидепрессантами в анамнезе;
• одновременное применение средств – сильных ингибиторов цитохрома CYP1A2 (ципрофлоксацин, эстрогены и пр.);
• печеночная недостаточность (цирроз или острая патология печени);
• кормление грудью;
• отказ от применения адекватных медицинских средств контрацепции (внутриматочная спираль, двойной барьерный метод – презерватив в сочетании со спермицидом) для женщин с сохранной детородной функцией.
Критерии, исключающие участие в исследовании:
1. Повышение суицидального риска более 2 баллов по пункту 3 шкалы HAMD-17 и/или по клинической оценке исследователя.2. Появление психотических симптомов по клинической оценке лечащего врача.
3. Появление тяжелых проявлений соматических или неврологических заболеваний.
4. Наступившая беременность.
Схема и инструмент для скрининга и мониторинга. Согласно программе, максимально адаптированной к рутинной практике, при лечении депрессий агомелатином осуществлен мониторинг, ориентированный на междисциплинарный подход. На скрининг-визите всем пациентам проведено расширенное клиническое обследование. Для оценки психического состояния использованы стандартные критерии МКБ-10, для верификации и нозогенной природы депрессии и особенностей преморбида, длительности и особенностей динамики аффективной патологии – оригинальное полуструктурированное интервью. С помощью специально разработанной карты и базы данных зарегистрированы актуальные депрессивные симптомы (60 признаков) и синдромы; коморбидные психические расстройства, личностные расстройства и соматоперцептивные акцентуации; гипоманиакальные и маниакальные фазы в анамнезе; социодемографические данные с учетом уровня социального функционирования в течение последнего года, обращаемости за медицинской помощью, психотравмирующих событий и опыта приема психотропных средств в прошлом.
Диагностика соматического состояния проведена квалифицированными специалистами, в ходе скрининга фиксируется обобщенное заключение о соматической патологии и используемых пациентом сомато-тропных средствах в рамках стандартных схем или ургентной терапии.
После скрининга всем пациентам на первом визите назначается агомелатин (Вальдоксан) в стартовой терапевтической дозе 25 мг (1 таблетка целиком) однократно вечером, независимо от приема пищи, за 2 ч до сна. Рекомендуется гибкое дозирование в случае недостаточного эффекта по оценке исследователя: увеличение дозы в первые 2 нед до максимально допустимой дозы – 50 мг (2 таблетки) однократно вечером. После случайного пропуска очередной дозы при следующем запланированном приеме доза остается стандартной (не удваивается). Все пациенты продолжают рекомендованное интернистами стандартное лечение по поводу сопутствующих соматических заболеваний. Кроме того, допускается применение препаратов (за исключением антидепрессантов), стабильно назначаемых ранее врачом по поводу неаффективной патологии, или их назначение (включая транквилизаторы) при нарастании тревоги в первые 2 нед терапии. Мониторинг динамики состояния на лечении Вальдоксаном по основной программе осуществляется в течение 12 нед (6 визитов – V1 скрининг/начальный, V2 – 1 нед, V3 – 2 нед, V4 – 3 нед, V5 – 6 нед, V6 – 12 нед/завершающий).
Для психометрической оценки используется оптимизированный для контингента с высоким уровнем физикальных жалоб и соматизации набор шкал, с понятными и приспособленными для операциональной диагностики вопросами о симптомах депрессии и степени их тяжести, коморбидных тревожных и СФР, резидуальных симптомах в период становления ремиссии.
Для динамических – повизитных оценок признаков депрессии и ассоциированных симптомов выбран следующий инструмент:
1) 7-пунктовые субшкалы общего клинического впечатления CGI-I и PGI-I, заполняемые со 2-го визита1;
2) 17-пунктовая шкала Гамильтона (Hamilton Depression Rating Scale-17, HAM-D17), заполняемая врачом2;
3) 35-пунктовая шкала тревоги Шихана (Sheehan Clinical Anxiety Rating Scale, ShARS)3;
4) 20-пунктовый опросник Спилбергера–Ханина (State-Trait Anxiety Inventory, STAI)4;
5) 69-пунктовый оригинальный опросник соматических симптомов болезни, разработанный в НОКЦ «Психосоматической медицины» ГБОУ ВПО «Первый МГМУ им. И.М.Сеченова» Минздрава России, использовался на начальном визите, после 3 и 6 нед лечения5.
Для оценки нарушений, влияющих на субъективное ощущение благополучия как важного показателя качества жизни, использовались:
6) 10-пунктовый опросник6;
7) 5-пунктовый опросник уровня субъективного благополучия7.
Для оценки выраженности остаточной депрессивной симптоматики у больных, достигших ремиссии по HAM-D17, или признаков инверсии фазы у больных с так называемым биполярным диатезом или верифицированным биполярным аффективным расстройством проведены дополнительные оценки врачом после 6 и 12 нед терапии с помощью:
8) оригинального опросника для оценки субсиндромальных проявлений депрессии, что позволило охарактеризовать резидуальные депрессивные нарушения с учетом выраженности и частоты повторяемости симптомов;
9) валидированного в России опросника для самооценки признаков гипомании (HCL-32), что позволило выявить симптоматику гипомании/мании – от 14 баллов и выше (S.Mosolov и соавт., 2014).
Для оценки безопасности на 1, 4, 6-м или последнем (при неполном курсе) визитах оцениваются основные физиологические показатели пациента (ЧСС, АД, масса тела), клинический и биохимический анализ крови. Повизитно регистрируются и отслеживаются до разрешения все нежелательные явления (НЯ) для оценки их вероятностной связи с приемом Вальдоксана.
Статистика
Анализ результатов осуществляется с помощью лицензионного статистического пакета IBM SPSS Statistics 21.0. Статистические методы выбраны с учетом соответствия выборки нормальному распределению. Для изучения материала исследования и анализа используются следующие статистические методы: t-критерий Стьюдента, критерий Манна–Уитни, критерий Колмогорова–Смирнова, критерий знаковых рангов Вилкоксона для связанных выборок, коэффициент корреляции Пирсона, позволяющие проводить сравнительный анализ между разными группами: завершившими курсовую программу и выбывшими пациентами, респондерами, в первую очередь ремиттерами и не ответившими на терапию агомелатином, а также групп с различным исходным уровнем депрессии, тревоги, нарушений цикла «сон–бодрствование», неспецифических признаков дистресса. Для применяемых критериев уровень значимости устанавливается равным 5%. Значения средних величин представляются как среднеарифметическое значение (±), стандартная ошибка среднего (SE).Формат исследуемых выборок: общая выборка, все включенные в программу (intention-to-treat, 204 пациента); завершивших полную программу выборка – 12 нед лечения (159 пациентов); выборка преждевременно выбывших из программы (45 пациентов); респондеры (РЕСП – все пациенты, у которых снижение баллов по шкале HAM-D17 на 50%); нонреспондеры (НРЕСП – все пациенты, не соответствующие критериям РЕСП);
ремиттеры (РЕМ – все пациенты, у которых HAM-D17 не более 7 и/или суммарный показатель по субшкале
HAM-D6 0–4, т.е. «нет депрессии»); нонремиттеры (НРЕМ – пациенты, не достигшие ремиссии согласно указанным критериям).
Социодемографическая характеристика общей выборки
В исследование включены пациенты, которые обращались за помощью с октября 2012 г. по 30 июня 2013 г. в разные подразделения общемедицинской сетиг. Москвы, в том числе в междисциплинарные психосоматические (33,1%), кардиологические (28,9%), онкологические (11,2%), пульмонологические (5,9%), гастроэнтерологические (5,4%), эндокринологические (4,5%), урологические (3,5%), гинекологические (2,5%), ревматологические (2,5%), дерматологические (1,5%), неврологические (1,0%).
В рамках медицинской маршрутизации пациенты были направлены на консультацию в один из центров НОКЦ «Психосоматическая медицина»: кабинеты в поликлинике ЦАО №171, амбулаторный прием в клинике дерматологии, кардиологии, пульмонологии, неврологии, онкологии, гастроэнтерологии, стационарное психотерапевтическое отделение в ГБОУ ВПО «Первый МГМУ им. И.М.Сеченова» Минздрава России, а также амбулаторный кабинет катамнеза, сформированный для изучения ремиссий при аффективной патологии в ФБГУ «НЦПЗ» РАМН8.
В выборку включены 204 пациента, из них женщин – 73% (149 наблюдений), мужчин – 27% (55), которые согласились на терапию агомелатином по поводу депрессивного эпизода легкой тяжести или более выраженной степени в амбулаторных и/или стационарных условиях с максимальной длительностью непрерывного наблюдения 12 нед после процедуры скрининга. Средний возраст пациентов составил 47,43±14,61 года (женщины 47,91±14,72; мужчины 46,13±14,36). Сравнение распределения по возрасту мужчин и женщин, проведенное при помощи критерия Манна–Уитни для независимых выборок, показало отсутствие статистически значимых различий (табл. 1).

Исходную выборку составили лица с высоким уровнем образования: большинство имели высшее (68,6%), среднее специальное и неоконченное высшее (27,0%), среднее (4,4%). Более 1/2 пациентов состояли в браке: 52,0, 14,2 из 48,0% больных, проживающих в одиночестве или неполных семьях, были в состоянии после развода, а 12,7% перенесли смерть супруга. Распределение по занятости и источнику доходов выявило, что большинство (69,0%) пациентов продолжают работать, из них служащих – 49,5%, рабочих – 8,8%, предпринимателей – 4,9%, лиц творческого труда и учащихся – по 2,9%. На пенсии или социальном пособии – 22,1%, на иждивении других лиц – 8,8%. Уровень социального функционирования из-за аффективной патологии в половине наблюдений был временно снижен у 50,5% пациентов; кроме того, 7,4% больных сменили профессию по этой причине, а 2,9% – стали работать по индивидуальному графику. Инвалидность по психическому заболеванию выявлена в 2 наблюдениях (1 и 3-я группы). Хотя в изученную выборку не включались больные с алкоголизмом, часть пациентов признали употребление алкогольных напитков еженедельно (некрепкие – 45,6%, крепкие – 4,4%) или даже ежедневно (некрепкие – 10,3%, крепкие – 1,5%).
Доли больных общей выборки по шифрам МКБ-10 для аффективной патологии распределяются следующим образом:
• F33 (рекуррентная депрессия) – 49,5%: легкий – 16,2%, умеренный – 33,3%. В анамнезе 1 эпизод – 46 наблюдений (ремиссия от 2 до 30 лет), 2 эпизода – 24 наблюдения (ремиссия от 2 до 7 лет), 3 эпизода – 13 наблюдений (ремиссия от 1 года до 3 лет), 4 эпизода и больше – 18 наблюдений, включая субклинические сезонные фазы – 9 наблюдений (ремиссия от 6 мес до 3 лет);
• F32 (депрессивный эпизод) – 27,9%: легкий – 18,6%; умеренный – 9,3%;
• F 43.21 (депрессивная реакция, расстройство адаптации) – 10,8%;
• F31.31 (биполярная депрессия) – 7,4%: в анамнезе гипомании – 6,9%, мании – 0,5%;
• F34.1 (дистимия) – 3,4%;
• F54 (соматогенная депрессия) – 1,0%.
Согласно данным анамнеза у 9,3% пациентов актуальная патология формируется по типу двойной депрессии (между предыдущим и настоящим эпизодом отмечена дистимия), а у 13,7% пациентов (5,4% – с первичным эпизодом, 8,3% – с повторным) ретроспективно были выявлены субклинические гипоманиакальные кратковременные эпизоды, требующие проведения дифференциальной диагностики с биполярным расстройством.
Общий исходный балл HAM-D17 пациентов выборки находится в диапазоне от 6 до 30 баллов (среднее значение – 18,6 балла, медиана – 19 баллов, мода – 21 балл (рис. 1).

Анализ синдромальной структуры показывает преобладание тревожных депрессивных расстройств – у 42,6% (87 наблюдений) над маскированными (соматизированными) депрессиями – у 34,3% (70 наблюдений; с доминирующей конверсионной симптоматикой – 23,0%, с доминирующей соматовегетативной дисфункцией – 11,3%). В разы реже отмечены синдромы апатической депрессии – у 10,3% (21 наблюдение, при этом в 3,9% – апатия сочетается с дисфорией или тревогой) и тоскливой (без повышенной тревоги) депрессии –
у 7,4% (15 наблюдений; 2,5% – с идеями самообвинения); еще значительно реже выявляются сенесто-ипохондрические депрессии – у 3,4% (7 наблюдений) или депрессии с болезненным бесчувствием, деперсонализацией и дереализацией – у 2,0% (4 наблюдения). Детальное изучение триггерных факторов и особенностей синдромообразования свидетельствует об аутохтонном механизме и отсутствии влияния любых из известных триггеров у 27,9% больных. У 44,2% больных отмечено явное психогенное, нозогенное, соматогенное или связанное с побочными эффектами соматотропных медикаментов и/или оперативных вмешательств воздействие. У 43,1% больных общей выборки формированию депрессии предшествовал острый стресс. Эндореактивный механизм формирования депрессии выявлен у 27,9% больных.
Особенностью общей выборки является то, что у большинства больных диагностированы коморбидные психопатологические симптомы/синдромы: у 78,9% пациентов, почти в 1/3 (23%) этих случаев они прослеживаются в течение последних 5 лет:
• у 43,6% – тревожные (панические атаки у 17,1%, генерализованная тревога у 21,1%, агорафобия у 7,8%, обсессии и/или компульсии у 4,9%, посттравматическое стрессовое расстройство у 2,0%, изолированные фобии, включая ипохондрические, – у 24,5%, при этом более 2 лет – у 11,8%);
• у 37,7% – конверсионные;
• у 24,5% – соматоформная вегетативная дисфункция (гипервентиляция, кардионевроз, синдром раздраженного кишечника или мочевого пузыря, кожный невроз, термоневроз);
• у 17,6% – нарушения сна (при этом они в 5% персистируют более 5 лет);
• у 15,2% – соматогенная астения;
• у 9,1% – легкие диссоциативные расстройства;
• у 8,3% – легкая/умеренная когнитивная дисфункция.
Другой особенностью общей выборки является гипертимная акцентуация в преморбиде у 27,9% пациентов. Изучение личностного профиля показало, что другие акцентуации или РЛ зарегистрированы реже: гистрионные, тревожно-мнительные, пограничные, ананкастные, паранойяльные. Психотических расстройств в анамнезе не выявлено.
Соматические заболевания выявлены у 78,4% пациентов, из них одновременно получали лечение по поводу соматической патологии 55,3% (113 наблюдений), с учетом ее обострения – 18,1% (37 пациентов), при этом почти у 1/5 имеется инвалидность по соматическому заболеванию (17,6%; 1-я группа – 5,4%, 2-я группа – 8,8%, 3-я группа – 3,4%). Среди соматических заболеваний зарегистрированы: заболевания сердечно-сосудистой системы – у 25,9%; онкопатология – у 10,8%; эндокринологические заболевания – у 8,3%; гастроэнтерологическая патология – у 6,4%; неврологическая патология – у 5,4%; хроническая легочная патология – у 3,4%; заболевания кожного покрова – у 3,4%; урологическая патология – у 3,4%; гинекологическая – у 2,9%; ревматологическая – у 2,5%; травматологическая (перелом бедренной кости) – у 0,5%. У 43,6% отмечалось более 2 соматических заболеваний, требующих медицинской помощи и мониторинга.
В ходе обследования установлено, что большинство пациентов данной выборки ранее обращались за психиатрической помощью: 1 раз за амбулаторной помощью обращались 65,7%, многократно – в 4 (15,7%) раза меньше пациентов; стационарную помощь однократно получали 19,6%, многократно – 4,9% пациентов. Эти данные и распределение по диагнозам лишний раз свидетельствуют о важности внесения специализированных алгоритмов в рекомендации для общемедицинской сети, несмотря на предубеждение населения против психиатрической помощи.
Результаты
Эффективность Вальдоксана. Терапевтическая активность агомелатина анализируется с привлечением основных и дополнительных показателей редукции депрессии при терапии агомелатином, данных межгруппового сравнения между ремиттерами, респондерами и нонремиттерами, а также между пациентами, завершившими программу и преждевременно выбывшими из нее.Основные индикаторы. Достоверное снижение в общей выборке показателей степени тяжести депрессии в первые 3–6 нед лечения с учетом динамики суммарного балла HAM-D17 и ряда индексов: «чистая депрессия» (НAM-D6), «критическое отношение и суицидальные тенденции» (НAM-D2), «неспецифические симптомы» HAM-D9. Первичный терапевтический ответ: снижение баллов по HAM-D17 не менее чем на 25%; показатели «улучшение» и «значительное улучшение» по CGI-I в первые недели терапии для разных групп. Скорость достижения ремиссии (по HAM-D17) и ее качество в общей выборке, оцениваемое по клиническим критериям, уровню улучшения по CGI-I и PGI-I.
Дополнительные показатели эффективности терапии. Дополнительные измерения необходимы в связи с широким кругом симптомов депрессий в общемедицинской сети и вариантов динамики аффективной патологии. Анксиолитический эффект оценивается в общей выборке по динамике суммарных показателей 35-пунктовой ShARS, ситуационной тревоги по STAI и инд
 ексу тревоги по HAM-D17, кроме того, по динамике суммарных показателей HAM-D17 у больных тревожной депрессией в сравнении с другими психопатологическими типами депрессивных расстройств. Хронобиотический эффект оценивается по динамике индекса инсомнии HAM-D3 и суммарных показателей LSEQ в общей выборке с учетом 10 показателей цикла «сон–бодрствование». Для изучения антидистрессового (адаптогенного) эффекта оценивается динамика ситуационной тревоги по STAI и индекса «неспецифические симптомы» HAM-D9 в общей выборке.
ексу тревоги по HAM-D17, кроме того, по динамике суммарных показателей HAM-D17 у больных тревожной депрессией в сравнении с другими психопатологическими типами депрессивных расстройств. Хронобиотический эффект оценивается по динамике индекса инсомнии HAM-D3 и суммарных показателей LSEQ в общей выборке с учетом 10 показателей цикла «сон–бодрствование». Для изучения антидистрессового (адаптогенного) эффекта оценивается динамика ситуационной тревоги по STAI и индекса «неспецифические симптомы» HAM-D9 в общей выборке.
Терапевтическая активность агомелатина изучается с учетом медицинских причин преждевременного завершения участия пациентов в программе, социодемографических характеристик и клинических особенностей депрессий у 22,1% (45 наблюдений) пациентов, выбывших из 12-недельной программы. Большинство пациентов завершили участие в программе в первые недели: на 1-й – 4% (8 наблюдений); после 2 или 3 нед – 6,9% (14) и 7,8% (16) соответственно; а после 6 нед – лишь 3,4% (7). Кластеризация причин показывает, что в большей части случаев – 13,2% (27) решение о выходе из программы принято совместно врачом-экспертом и пациентом в связи с изменением тактики при недостаточным улучшении или утяжелении депрессии, усилении тревоги, диспсихофобии, появлении сенесталгий или суицидальных тенденций (после 2-недельного регулярного приема агомелатина – 1 наблюдение или нарушении режима – 1 наблюдение).
Причиной смены также стали инверсия депрессии в гипоманию – 1,5% (после 2 нед приема агомелатина –
1 наблюдение, после 6 нед терапии – 2 наблюдения).
У 2 больных этого кластера дополнительную роль сыграли НЯ: впервые выявленный устойчивый фотодерматит с кожным зудом; ухудшение биохимических показателей у больного с онкопатологией. В 3,4% (7 наблюдений) пациенты отказались от продолжения участия в данной программе после 2–3 нед приема агомелатина в связи с такими НЯ, как головная боль, трудности засыпания, кошмарные сновидения, учащение пробуждений, аллергические реакции (дополнительную роль играло недостаточное снижение болезненного самоощущения). В 3,4% (7 наблюдений) случаев основной причиной завершения программы стала нонкомплаентность в виде отказа от очередного визита, в том числе по немедицинским причинам, или приема агомелатина по схеме. Еще 4 пациента отказались от продолжения лечения на фоне существенного улучшения: через 3 нед – 1 наблюдение, через 6 нед – 3 наблюдения.
Сравнение завершивших и выбывших из программы по возрасту, полу, наличию коморбидной соматической патологии, проведенное при помощи критерия c2, показало отсутствие статистически значимых различий.
В частности, при анализе различий по гендерному признаку установлено, что выбыли из программы 20,1% женщин и 27,3% мужчин, завершили – 79,9% женщин, 72,7% мужчин (р=0,275). Сразу следует подчеркнуть, что высокая частота преждевременного прерывания терапии может быть связана со случайным отбором пациентов и в гораздо меньшей степени – с НЯ. При межгрупповом анализе психопатологических показателей преждевременно выбывших и завершивших программу выявлены некоторые различия, которые будут проанализированы далее.
Динамика среднего суммарного балла HAM-D17 по визитам характеризовалась его значимым снижением по сравнению с исходным: с 18,6 (95% доверительный интервал – ДИ 18,0–19,3) на начальном визите до 5,5 (95% ДИ 4,9–6,1) на завершающем визите (медианное значение общего балла уменьшилось сходным образом – с 19 до 5 баллов). Максимальное снижение отмечается на V2 и V3: для среднего значения – на 3,5 и 4,6 балла соответственно, для медианы – 3 и 6 баллов. Затем скорость снижения замедляется: на V4, V5 и V6 для среднего значения – 2,2, 1,9 и 1,1 балла соответственно, для медианного значения – 2 балла на V4 и V5 и 1 балл на V6. Показанные на рис. 2 и в табл. 2 изменения по HAM-D17 не выявляют каких-либо противоречий, подтверждаются статистически значимые различия между визитами при использовании критерия знаковых рангов Вилкоксона для связанных выборок, учета помимо средних медианы 25 и 75% значений, а также минимальных и максимальных значений суммарного балла HAM-D17 (р<0,001).

С помощью межгруппового сравнительного анализа показателей завершивших и преждевременно выбывших из программы изучено влияние клинического типа, тяжести состояния, отдельных дименсий, соматической патологии. Сравнение по клиническим синдромам не выявляет статистически значимых различий. Особое внимание уделено изучению эффективности агомелатина при тревожных депрессиях с учетом их большого удельного веса. Сравнение данного клинического типа с другими формами аффективной патологии показывает следующее распределение: доли тревожных и психопатологически иных депрессий, соответственно, в исходной выборке составляют: 42,6% vs 57,4%; среди преждевременно выбывших пациентов – 48,9% vs 51,1%; среди завершивших программу – 40,9% vs 59,1%. По результатам программы, в том числе при сравнении с помощью критерия c2 для этих 2 групп больных, не выявляется значимых различий (р=0,338), а, следовательно, диагноз «тревожная депрессия» не оказывает существенного влияния на преждевременное выбывание в данной выборке.
Изучение влияния тяжести по данным межгруппового сравнения исходных показателей тяжести депрессий (HAM-D17) между выборками больных, завершивших программу (18,37±4,76) или выбывших из нее (19,62±5,09), не выявляет статистически достоверных различий в средних (t-критерий; р=0,125) и в функциях распределения по критериям Манна–Уитни (р=0,145) и Колмогорова–Смирнова (р=0,573). В обеих группах значение исходного общего балла HAM-D17 снижается (табл. 3), и изменения усредненного значения на последующих визитах, проверенные с помощью критерия знаковых рангов Вилкоксона для связанных выборок, статистически значимы (p<0,001). Исходя из этих данных, начальное значение общего балла HAM-D17 не является основным фактором, который оказывает влияние на преждевременное выбывание больных из программы.

Вместе с тем более детальный анализ данных выявляет определенное влияние исходного уровня тяжести депрессии на длительность лечения агомелатином. Сравнение динамики депрессии показывает статистически значимые различия на V2, V3 и V4 между группами выбывших и завершивших по критерию Манна–Уитни (табл. 4; рис. 3). За период с 1 по 3-ю недели терапии (визиты 2–4) действительно выбывали пациенты с более высокими значениями общего балла по HAM-D17. Некоторые тенденции удается выявить при сравнении удельного веса выбывших из программы в подгруппах пациентов, исходно ранжированных в зависимости от выраженности депрессии. Из 15 пациентов с исходным баллом по HAM-D17>25 (выраженная депрессия) выбыли 40% пациентов (6 наблюдений), из 130 пациентов с умеренным уровнем 17–24 балла по HAM-D17 выбыло меньше – 22,3% (29 наблюдений), из 59 пациентов с легким уровнем менее 17 по HAM-D17 выбыло почти в 3 раза меньше – 16,9% (10 наблюдений).

Изучение влияния отдельных компонентов депрессии, измеряемых по интегральным индексам HAM-D17, у выбывших из программы и завершивших ее не выявляет достоверных различий за исключением HAM-D2 (критерий Манна–Уитни для независимых выборок; р<0,0001). Средний показатель индекса HAM-D2 выше «0» обнаружен у 17,7% (36 наблюдений). Сравнение исходных значений индекса HAM-D2 у выбывших из программы и завершивших ее с помощью точного критерия Фишера показывает, что доля больных со значениями выше «0» в группе выбывших почти в 3 раза выше – 35,6% vs 12,6% (р=0,001), а относительный риск выбыть из программы для этих пациентов составил 2,57 (95% ДИ 1,57–4,22). Снижение среднего балла HAM-D2 у завершивших программу было статистически значимым, уже начиная со 2-го визита, в отличие от выбывших из программы, у которых исходное и заключительное значения на статистическом уровне не отличаются (р<0,0001). При этом многие пациенты, у которых не снижалось значение этого индекса, выбывали. Анализ динамики индекса HAM-D2 со значениями выше «0» по распределению в первые недели терапии, начиная со 2-го визита, позволяет утверждать, что отсутствие улучшения в течение 1-й недели при сниженной критике и/или суицидальной настроенности может являться неблагоприятным прогностическим признаком и свидетельствовать о недостаточной эффективности агомелатина (рис. 4).

Изучение скорости появления первичного терапевтического ответа показывает, что у большинства больных снижение баллов по HAM-D17 на 25% зарегистрировано уже в первые 2 нед: на V3 – у 78,9% больных (n=161). Межгрупповое сравнение скорости первичного терапевтического ответа на 2 и 3-м визитах показывает различия между ремиттерами: 42,5% (V2) и 94,7% (V3) и больными, не достигшими ремиссии, – нонремиттерами: 21,7% (V2) и 50,0 (V3).
Скорость достижения ремиссии проанализирована с учетом соотношения респондеров, ремиттеров и нонреспондеров, начиная со 2-го визита, т.е. с 1-й недели терапии. На заключительном визите доля ремиттеров достигает 58,3% от исходной общей выборки, включающей 204 пациента. На гистограмме (рис. 5), отражающей распределение среди больных, продолжающих лечение, видно, что в ходе программы достаточно равномерно нарастают доли не только респондеров, но и ремиттеров.
Качество ремиссии при терапии агомелатина изучено с учетом влияния ряда факторов, в первую очередь исходной тяжести депрессии. При этом невозможно анализировать проблему, не учитывая неоднородность состояний ремиссии в клинической практике и трудности достижения бессимптомных состояний, особенно у стигматизированных в плане аффективной патологии больных. Изучение клинических характеристик ремиттеров (по психометрическим критериям), завершивших программу, выявляет, что полные синдромальные (или бессимптомные) ремиссии определяются в 24,0% (49 наблюдений), при этом среди оставшихся – симптоматических ремиссий выделяются состояния с различным качеством: как близкие к полным «с редкими пиками» (от 1 ч до 1 сут) – в 29,9% (61 наблюдение), так и субсиндромальные состояния, «с частыми пиками» – в 12,3% (25). В 2,5% (5) изученной выборки определяются признаки стабильной продуктивной гипомании, близкие к конституциональной гипертимии.

В целом при межгрупповом сравнении обнаруживается статистическое подтверждение факта преобладания невыраженной депрессии у ремиттеров: средний исходный показатель HAM-D17 17,26±4,8 vs 21,08±3,3 у остальных пациентов (р<0,0001). Указанную тенденцию подтверждает и анализ, проведенный с помощью коэффициента Пирсона. На рис. 6 наглядно показана связь между уменьшением доли ремиттеров (критерий HAM-D17<8) и исходным суммарным баллом по данной шкале: выявлены различия между больными с суммарным баллом до 21 и группой с более высокими значениями исходного показателя. В частности, медиана на заключительном визите у этих больных выше значений, свидетельствующих о ремиссии в соответствии с современными стандартами.
С учетом значительного удельного веса тревожного компонента в структуре депрессий и общих симптомов тревоги с коморбидными расстройствами оценка эффективности агомелатина проведена с учетом операциональных параметров по индексу тревоги шкалы HAM-D17 и суммарному показателю ShARS. Динамика среднего показателя ShARS демонстрирует уже к V2 достоверное снижение до нормального уровня (ниже 29 баллов), что коррелирует с отмечаемым врачом клиническим эффектом (см. табл. 4). Оценка статистической значимости изменений ShARS при помощи критерия знаковых рангов Вилкоксона для связанных выборок выявляет статистически значимые различия между всеми визитами (р<0,001).
Подробный анализ возможного анксиолитического действия агомелатина показывает необходимость учитывать различные нюансы. Межгрупповое сравнение динамики состояния между выборками депрессий с ведущим тревожным синдромом и психопатологически иными типами по средним суммарным баллам HAM-D17 выявляет достоверные различия на 2-м визите по t-критерию равенства средних (р=0,048) и по критерию Манна–Уитни для независимых выборок (р=0,03), указывающие на более значимое улучшение при тревожной депрессии на начальных этапах (табл. 5), при этом на остальных визитах достоверных различий между динамикой депрессии в клинически дифференцируемых группах не выявлено (р>0,05).

При анализе эффективности агомелатина проведена оценка влияния на различные компоненты дименсии тревоги. Исходный средний показатель STAI в общей выборке подтверждает тенденцию к высокому уровню тревоги, обусловленной психогенными факторами (дистрессом на фоне серьезной соматической патологии), – 49,32±9,7 (согласно используемым в населении точкам разделения 45 баллов и более – отражают высокий уровень тревоги). Получены достоверные различия между визитами, но переход от высокой ситуационной тревоги к умеренной отмечается только к V3 (табл. 6). Несмотря на достоверное снижение среднего суммарного показателя ситуационной тревоги в ходе терапии, на протяжении всего периода мониторинга ее уровень оставался несколько выше нормы, что требует дальнейшего анализа в отношении особенностей состояния больных, подвергающихся стрессовому воздействию, и адекватности формулировки вопросов шкалы.
Следует отметить, что из 111 пациентов с патологической тревогой, зафиксированной с помощью суммарного балла ShARS≥30 баллов, выбыли 25,2% (28 наблюдений), причем в большинстве этих случаев была изменена тактика терапии, что требует проверки предположения о влиянии уровня тяжести тревоги на преждевременное прекращение лечения агомелатином. Полученные данные при сравнении выбывших из программы и завершивших ее по исходным уровням ShARS и STAI, не выявляющие статистически достоверных различий (t-критерий: р=0,172 и р=0,346; критерий Манна–Уитни: р=0,868 и р=0,083; Колмогорова–Смирнова: р=0,669 и р=0,272), позволяют сделать вывод о том, что исходные суммарные значения ShARS и STAI, так же как и HAMD-17, не являются основным фактором влияния на выбывание из программы (табл. 7).

Изучение отдельных аспектов хронобиологического эффекта выявляет следующее. Усредненное исходное значение индекса инсомнии (по HAM-D17) у больных общей выборки составляет 4,58±1,3 балла, при этом выраженные нарушения (свыше 4 баллов) выявлены у 79,4% (162 наблюдения). Скорость динамики этого индекса существенно превышает скорость уменьшения показателей собственно депрессии, что особенно очевидно в первые 2 нед и характеризует первичный ответ. При клинической и психометрической скрининговой оценке инсомния сопряжена с циркадианными нарушениями, отмечаемыми в первую очередь в структуре аутохтонных и эндореактивных депрессий. Изучение динамики среднего суммарного балла LSEQ в общей выборке свидетельствует о статистически значимом различии исходных и заключительных параметров в сторону нормализации цикла «сон–бодрствование». Положительная динамика среднего суммарного показателя по сравнению с исходным нулевым уровнем зафиксирована у ряда больных уже на V2 – 32,4±31,5 (мм), значительно улучшилась в первые 3 нед – 48,7±32,3 мм (р<0,01), V4 – 60,7±29,7 мм (р<0,001). Редукция циркадианных нарушений в сторону привычного соотношения сна и бодрствования и стабилизация нормальной активности в течение дня отмечаются и в течение последующих 9 нед (V5 – 67,8±26,9 мм; V6 – 69,8±26,9 мм). Тенденция суммарной оценки отражает основные особенности динамики 10 анализируемых параметров, а оценка при помощи критерия Вилкоксона для связанных выборок показывает статистически значимый характер этих изменений (табл. 8).
Несмотря на большой разброс индивидуальных ответов, изучение с учетом заданной системы координат
5 параметров, отражающих периоды засыпания и сна в течение ночи, и 5 параметров, отражающи
 х состояние пробуждения и дневного самочувствия, показывает в целом сбалансированность улучшения сна и бодрствования при небольшом опережении нормализации периода засыпания (уже после 1-й недели терапии). После 2 нед отмечается в среднем почти 50% улучшение состояния пробуждения и бодрствования, более отчетливо эта тенденция прослеживается, начиная с 3-й недели терапии.Обобщая данные об основных и дополнительных эффектах агомелатина, следует указать на некоторые выявленные при анализе зависимости, в частности, при сравнении кривых динамики суммарного показателя HAM-D17 и интегральных индексов шкалы – «чистой депрессии», «тревоги», «инсомнии», «суицидальной настроенности», «неспецифических симптомов». В табл. 9 и на рис. 7 изменения отражены с применением «показателей наглядности», т.е. по сравнению с условной исходной единицей. Траектории свидетельствуют об улучшении (около 65%) индекса, включающего показатели ядерных нарушений, близко стоящего к суммарному показателю HAM-D17 (70–75%). Общий результат достигается в результате того, что в значительной степени редуцируются неспецифические симптомы депрессивного домена, максимально снижаются нарушения сна, суицидальные тенденции и восстанавливается адекватное отношение к депрессивным нарушениям у больных, завершивших программу. При этом редукция тревоги в первые 3 нед совпадает с динамикой собственно гипотимии, но на последующих этапах лечения этот компонент начинает редуцироваться медленнее депрессивного настроения и других элементов, хотя в целом редукция тревоги через 12 нед терапии более существенна и в отличие от других компонентов составляет немного менее 60%.
х состояние пробуждения и дневного самочувствия, показывает в целом сбалансированность улучшения сна и бодрствования при небольшом опережении нормализации периода засыпания (уже после 1-й недели терапии). После 2 нед отмечается в среднем почти 50% улучшение состояния пробуждения и бодрствования, более отчетливо эта тенденция прослеживается, начиная с 3-й недели терапии.Обобщая данные об основных и дополнительных эффектах агомелатина, следует указать на некоторые выявленные при анализе зависимости, в частности, при сравнении кривых динамики суммарного показателя HAM-D17 и интегральных индексов шкалы – «чистой депрессии», «тревоги», «инсомнии», «суицидальной настроенности», «неспецифических симптомов». В табл. 9 и на рис. 7 изменения отражены с применением «показателей наглядности», т.е. по сравнению с условной исходной единицей. Траектории свидетельствуют об улучшении (около 65%) индекса, включающего показатели ядерных нарушений, близко стоящего к суммарному показателю HAM-D17 (70–75%). Общий результат достигается в результате того, что в значительной степени редуцируются неспецифические симптомы депрессивного домена, максимально снижаются нарушения сна, суицидальные тенденции и восстанавливается адекватное отношение к депрессивным нарушениям у больных, завершивших программу. При этом редукция тревоги в первые 3 нед совпадает с динамикой собственно гипотимии, но на последующих этапах лечения этот компонент начинает редуцироваться медленнее депрессивного настроения и других элементов, хотя в целом редукция тревоги через 12 нед терапии более существенна и в отличие от других компонентов составляет немного менее 60%.

В табл. 10 представлены суммарные данные об особенностях терапии агомелатином в разных диагностических группах, отличающихся по механизму формирования и течению депрессивной патологии с учетом риска выбывания, а также соотношения долей больных с полной и неполной ремиссией, респондеров и нонреспондеров. Сравнение показателей данных в каждой из групп, выделенных с учетом типа течения (по критериям МКБ-10), выявляет оптимальные результаты в группе больных с нозогенными депрессивными реакциями: у 20 из 24 пациентов зарегистрирована ремиссия, преждевременно выбыли всего 2 пациента. Показатели у больных с первичным эпизодом лучше, чем при повторных фазах в плане удельного веса респондеров и ремиттеров, при этом число преждевременно выбывших при первичном обращении в данной группе даже несколько выше, что соответствует более низкому комплаенсу в этой группе по сравнению с больными, имеющими опыт лечения при предшествующих эпизодах. Распределение больных в группе с биполярной депрессией показывает максимальный по сравнению с другими группами процент выбывших (40,0%), но при этом отсутствие нонреспондеров в группе завершивших исследование.
Сравнение данных в группах первичной, рекуррентной, биполярной депрессий и дистимии с учетом достижения ремиссии и ее качества – полной или симптоматической формы, дифференцированных по клиническим критериям (по HAM-D17 суммарный балл в группе ремиттеров не превышает 7 баллов), выявляет различия, свидетельствующие о том, что полная ремиссия легче достигается после первого эпизода при отсутствии гипомании, мании или дистимии в анамнезе (табл. 11). В группе нонреспондеров отмечен высокий риск дистимии в анамнезе (15 из 19 случаев). Гипомании на завершающем визите выявлены у 5 (3,1% от группы завершивших исследование) пациентов, при этом распределение случаев между группами первичной и рекуррентной депрессий сходно с долями, выявленными во время скрининга при изучении анамнеза.
Для оценки результатов лечения с учетом становления ремиссии важны динамика и завершающие показатели CGI и PGI, отражающие целостную оценку, включая полноту редукции симптомов и восстановления функционирования до доболезненного уровня, по мнению врача и пациента. В табл. 12 представлена динамика числа (%) больных с показателями «значительное улучшение» или «улучшение» с учетом показателя достоверности различий, полученного при сравнении объективной и субъективной оценок с помощью коэффициента корреляции Спирмена. Полученные данные свидетельствуют о согласованности клинического впечатления врача и самооценки пациента на большинстве визитов, что вполне соответствует реальной ситуации при данной патологии. Исключение составляет только V5: через 6 нед терапии мнение пациентов отличается от врачебного в сторону завышения оценки эффективности средства. Состояние больных с полной ремиссией коррелирует с оценками «значительное улучшение» по CGI и PGI, в группе неполной ремиссии преобладают оценки «улучшение».

Переносимость и безопасность Вальдоксана
Показатели переносимости и безопасности изучены с учетом ряда оценок возможного влияния на психическое и физикальное состояние терапии агомелатином, для качественных характеристик использованы точный критерий Фишера, для количественных характеристик – критерий Вилкоксона.Для оценки переносимости изучены основные физиологические показатели пациента (масса тела, ЧСС, АД) до и после лечения. Средний вес на момент начала исследования составил 68,76 кг (SD 13,59; SE 0,95), на момент окончания исследования – 69,47 кг (SD 13,31;
SE 1,10). Хотя критерий Вилкоксона для связанных выборок показал, что различия носят статистически значимый характер (р<0,001), в целом речь идет о незначительном повышении веса в пределах 0,5–1,5 кг, что может быть связано с различными факторами, в том числе и выходящими за пределы медикаментозной терапии.
Повизитная оценка показала, что в период проведения программы отмечалось небольшое снижение средней ЧСС (с 74,3 до 71,8). Отмечалось также незначительное снижение систолического (с 126,5 до 123,3) и диастолического (с 77,9 до 75,0) АД. Изменения зарегистрированы на 2 и 3-м визитах, после чего на 4 и 5-м визитах они существенно не изменялись. На 6-м визите отмечено некоторое повышение АД по сравнению с 4-м визитом (с 122,9/74,8 до 123,3/73,0), не носящее статистически достоверного характера (р>0,05). Побочных эффектов по типу необъяснимых эпизодов артериальной гипертензии не зарегистрировано.
С целью оценки безопасности проведено сравнение показателей крови в ходе программы (клинический анализ крови; биохимические показатели: аланинаминотрансфераза – АЛТ, аспартатаминотрансфераза – АСТ, щелочная фосфатаза – ЩФ, общий билирубин); табл. 13. Следует отметить, что на скрининге были отмечены пациенты с клинически незначимыми отклонениями, позволяющими проводить терапию агомелатином (в клиническом анализе крови у 2%, АЛТ – 12,7%, АСТ – 8,8%, общий билирубин – 2,5%. Статистически значимых различий в оценке клинического анализа крови не наблюдается (точный критерий Фишера между 1 и 5-м визитами: р=0,179; c2 Пирсона между 1 и 6-м визитами: р=0,96). Сравнительная оценка таких биохимических показателей, как АЛТ, АСТ и ЩФ, между 1, 5 и 6-м визитами статистически значимых различий не выявляет (табл. 14), в том числе у больных с незначительными отклонениями на скрининге (кроме 1 пациента с онкопатологией, который преждевременно выбыл из программы). Сравнение показателей общего билирубина между 1 и 5-м, а также 1 и 6-м визитами также не выявили достоверных различий: 0,36 и 0,41 соответственно.

НЯ исследованы с учетом вероятности связи с агомелатином, степени выраженности, времени появления, длительности, используемой дозы агомелатина, необходимости коррекции схемы или отмены агомелатина (см. табл. 14). Изучение сроков проявления побочных эффектов, вероятно, связанных с приемом агомелатина, показывает, что они проявляются в начале приема препарата: в первые 14 дней в легкой или умеренной степени на короткий период времени – в среднем на 3–5 дней (редко на срок более 2 нед) и в основном не являются причиной преждевременного прекращения лечения. Исключением являются усиление тревоги, инсомнии (неприятно окрашенные сновидения, трудности засыпания), раздражительности, взбудораженности и появление суицидальных мыслей в первые дни терапии, которые не купируются с помощью симптоматической терапии.
Схема применения Вальдоксана, смена терапевтического метода
В ходе программы 51,5% (105 наблюдений) больным была рекомендована минимальная терапевтическая доза – 25 мг, остальным больным (99 наблюдений) суточная доза повышена до 50 мг/сут, в первую очередь в связи с недостаточным терапевтическим эффектом (V2 – 63 наблюдения, V3 – 84), из них 13 пациентам доза была снижена до первоначальной после V5. Дисперсионный анализ показывает, что повышение дозы, как правило, связано с более высокими оценками врачей тяжести депрессии.Ряду респондеров, нуждающихся в пролонгированном лечении при высокой степени приверженности терапии, рекомендовано принимать Вальдоксан в качестве поддерживающей терапии в дозе 25–50 мг после завершения 12-недельной программы. Нонреспондерам предложена смена тактики на разных этапах программы или после ее завершения: добавление антидепрессанта, замена антидепрессанта, добавление психотропного средства (не антидепрессанта) и психотерапии, в 1 случае – электросудорожная терапия.
В связи с актуальностью проблемы оценки качества лечения все более важное значение для амбулаторной практики приобретают нарушения соблюдения предписанного режима. Несмотря на то что экспертами до включения пациента в программу проводилось прогнозирование риска нонкомплаентности, все же по причине нарушений приверженности терапии или отказа от ее продолжения в первые недели преждевременно завершили участие в программе 11 пациентов, что составило 5,4% от общей выборки. Анализ комплаентности показывает, что причинами несоблюдения предписанной схемы агомелатина в равной мере являются как недостаточная эффективность лечения, так и достаточное, по мнению пациента, улучшение состояния. Неожиданное прекращение лечения или тенденция к повторяемости кратковременных пропусков приема медикамента в большой степени объясняются влиянием конституциональных особенностей на медицинское поведение. Экспертная оценка позволяет установить связь между нонкомплаентностью и диссоциальным, импульсивным или шизотипическим радикалом, недостаточной критикой в отношении высокого риска рецидива депрессии. В незначительной степени нонкомплаентность пациентов оказывается связана с побочными эффектами агомелатина.
Обсуждение
Полученные результаты в целом свидетельствуют об эффективности и хорошей переносимости агомелатина при депрессиях, наблюдаемых в общемедицинской сети, и подтверждают возможность его использования в качестве препарата выбора для лечения аффективной патологии непсихотического уровня. Оценка эффективности агомелатина, проведенная с учетом динамики ключевых нарушений при разном типе течения депрессии, в том числе циркадианных нарушений и базисного компонента – 24-часового цикла инсомнии, а также тревоги, формирующейся либо в структуре депрессии, либо как общий симптом синергичного невротического расстройства, во многом сопоставима с результатами предыдущих российских многоцентровых исследований агомелатина в амбулаторной и госпитальной психиатрической практике по программам ХРОНОС, 2009 г. (8-недельная терапия 6276 пациентов) и РИТМ, 2010 г. (6-недельная терапия 350), показавших высокую вероятность значимого улучшения (до 80% респондеров) и корреляцию раннего ответа (25% улучшения в первые 2 нед терапии) с окончательным результатом, отсутствием психотических черт и выраженных суицидальных тенденций (А.Б.Смулевич и соавт., 2010).Преимуществами настоящей программы перед другими исследованиями является мониторинг на протяжении 12-недельной терапии, позволяющий оценить как безопасность, переносимость при пролонгированном (12-недельном) применении агомелатина у больных общемедицинской сети, так и полноту ремиссии с учетом сроков достижения стабильности и особенностей нестабильного состояния, с опорой на комплексную психометрическую оценку ключевых признаков депрессии и резидуальных нарушений (S.Stahl, 2010). Сравнительная оценка переносимости и безопасности агомелатина и других антидепрессантов последних поколений в международных исследованиях (A.Montejo, 2010; D.Stein и соавт., 2012) показывает сходство по числу НЯ при меньшем проценте исключенных по этой причине (р=0,0058).
Полученные данные об отсутствии побочных эффектов у большого числа пациентов или преобладании легких НЯ, не требующих коррекции, совпадают с результатами других исследований и их следует учитывать при создании терапевтических алгоритмов. При сравнении с данными исследования РИТМ видно, что только в первые дни приема агомелатина существует возможность усиления тревоги и инсомнии, в последующем ни один из побочных эффектов в обеих (психиатрической и общемедицинской) программах не достигает 5% барьера.
Профиль динамики депрессии в общей выборке на терапии агомелатином свидетельствует о его антидепрессивных свойствах и особенностях, связанных с хронобиотической, анксиолитической, антидистрессовой терапевтической активностью, что подтверждают данные других российских исследований (С.Н.Мосолов и соавт., 2011, 2012). Изучение эффективности агомелатина в программе ФОРУМ позволило сравнить особенности редукции легких депрессий, наиболее часто выявляемых в общемедицинской сети, по сравнению с выраженными психопатологическими формами, соответствующими умеренной и тяжелой депрессии по критериям HAM-D17, проанализировать влияние ранга депрессии и синдромальной структуры на длительность терапии и досрочное завершение 12-недельного курса агомелатина, выявить некоторые отчетливые тенденции. Хотя исходные суммарные значения HAM-D17, ShARS и STAI не являются основным фактором влияния на преждевременное прекращение данной терапии и при межгрупповом детальном анализе данных выявляется, что эти факторы не является основными.
Проведенный анализ свидетельствует об определенном влиянии исходного уровня тяжести депрессии. Обнаруживается статистическое подтверждение факта преобладания исходной невыраженной депрессии у ремиттеров, меньшее число в этой группе остаточных явлений, меньший риск преждевременного прекращения курса, в том числе больных с тревожными нарушениями в структуре депрессии. Хотя диагноз «тревожная депрессия» не оказывает статистически значимого влияния на смену терапии в первые недели, вместе с тем высокие показатели как генерализованной, так и ситуационной тревоги могут требовать дополнительных усилий по мониторингу и/или комбинирования агомелатина с высокопотенциальными анксиолитическими средствами.
Проведенное сравнение с данными других исследований об информативности первичного терапевтического ответа в первые 2 нед и изучение становления ремиссии на протяжении минимум 12 нед подтверждает вероятностную связь отсутствия улучшения в течение 1-й недели терапии агомелатином с трудностями достижения полной ремиссии. К неблагоприятным прогностическим признакам, свидетельствующим о недостаточной эффективности агомелатина, которые необходимо тестировать в эти сроки, следует отнести в первую очередь сниженную критику и/или суицидальную настроенность и в некоторой степени – сохранение высокого уровня тревоги, а также инверсию в гипоманию. К благоприятным прогностическим признакам следует отнести быстроту динамики клинических проявлений инсомнии и соответствующих параметров HAM-D17 и LSEQ, опережающих скорость уменьшения показателей собственно депрессии, и прослеживание отчетливой тенденции нормализации цикла «сон–бодрствование» на протяжении последующих 10 нед. Нестабильность редукции циркадианных нарушений в сторону привычного соотношения сна и бодрствования и нарушений активности в течение дня могут свидетельствовать о формировании резидуального циклотимического комплекса или общих симптомов, характеризующих неполную ремиссию.
В данной программе, позволившей изучить характеристику и полных, и неполных ремиссий (по психометрическим критериям), подтверждена высокая вероятность симптоматических ремиссий со сходными основными типами («пиками» ядерных и неспецифических нарушений) наряду с полными ремиссиями так же, как это отмечается в психиатрической сети (J.Zajecka, А.Б.Смулевич и соавт., 2014). Программа ФОРУМ показывает важность анализа эффективности в пролонгированных исследованиях с учетом высокой доли неполных ремиссий и особенностей их становления с 3-й по 8–12-ю недели терапии, а также недостаточную разработанность типологии остаточных симптомов при рекуррентных депрессиях в общей медицине. Кроме того, в отдельном изучении нуждаются, в частности, структура и динамика остаточных общих симптомов с учетом высокой степени коморбидности с психической и соматической патологией.
Заключение
Результаты данной программы (проект ФОРУМ) подтверждают высокий риск повторных депрессий у больных с соматической и психосоматической патологией, как легких, так и умеренно выраженных, высокую потребность в психофармакотерапии, важность получения быстрого терапевтического ответа и достижения стабильной ремиссии с помощью «щадящих» средств (включая отсутствие метаболических, органотоксических, сексуальных и других нарушений). Анализ «жизненного цикла» агомелатина (Вальдоксана) в настоящем исследовании с учетом данных рандомизированных сравнительных и натуралистических программ позволяет рекомендовать препарат для повседневной практики в рамках курсового лечения (суточная доза 25–50 мг). Вальдоксан показан, в частности, пациентам с различными соматическими заболеваниями при соблюдении критериев качества лечения, оценке соотношения «польза–риск», дифференцированного подхода с учетом нозологических и синдромальных особенностей депрессивной патологии.В числе важных аспектов, затрудняющих лечение Вальдоксаном, следует отметить некомплаентность больных, снижение критического отношения, суицидальную настроенность; в меньшей степени имеют значение тяжесть депрессии и неполные нестабильные ремиссии в анамнезе, снижающие вероятность достижения ремиссии с помощью монотерапии и предотвращения риска рецидива без адекватного стабилизирующего и поддерживающего лечения.
Примечания
1Валидный инструмент обобщенных оценок врача и пациента о скорости и качестве динамики в болезненном состоянии (в сравнении с исходным уровнем). Благодаря идентичности рангов шкал возможен анализ согласованности субъективной и объективной оценок (1 – значительно улучшилось, 2 – улучшилось, 3 – незначительно улучшилось, 4 – без изменений, 5 – незначительно ухудшилось, 6 – ухудшилось, 7 – значительно ухудшилось).2Индикатор тяжести депрессии (суммарная оценка в диапазоне от 0 до 52 баллов), выраженности ядерных признаков – индекс «чистой депрессии» (субшкала HAM-D6: пп. 1 – пониженное настроение, 2 – снижение самооценки и чувство вины, 7 – снижение активности и интересов, 8 – психомоторная заторможенность, 10 – психическая тревога, 13 – общесоматические симптомы. Оценка в диапазоне 0–22 балла: 0–4 балла – нет депрессии, 5–6 баллов – пограничная, 7–8 баллов – легкая, 9–11 баллов – умеренная, 12–22 балла – тяжелая) и поведения, связанного с суицидальным риском и нарушением критики (субшкала HAM-D2: пп. 3,17. Оценка в диапазоне 0–6), а также выраженности неспецифических признаков депрессии – индекс «неспецифических, связанных со стрессом симптомов» (субшкала HAM-D9: пп. 4–6 – инсомния, 9 – психомоторное возбуждение, 11 – тревога соматическая, 12 – желудочно-кишечные симптомы, 14 – сексуальная дисфункция,
15 – озабоченность физикальными симптомами, ипохондрические нарушения, 16 – потеря веса. Оценка в диапазо-
не 0–24), индекс нарушений сна (субшкала инсомнии – пп. 4–6. Оценка в диапазоне 0–6), индекс тревоги (субшкала тревоги – пп. 9–11. Оценка в диапазоне 0–10). Для оценки выраженности нарушений использован модифицированный вариант HAM-D17 в виде таблицы с измерением частоты признака в течение прошлой недели.
3Индикатор симптомов патологической тревоги и ее тяжести (диапазон суммарной оценки от 0 до 140 баллов: 0–29 – клинически незначимая тревога, 30 и более – клинически значимая тревога, при этом свыше 45 – выраженная тревога, свыше 80 – очень высокий уровень). Валидны границы. Выделены отдельные показатели выраженности панических атак (пп. 17–19), расстройств сна (пп. 30, 31), депрессии (п. 32), обсессий (п. 34) и компульсий (п. 35); оценка выраженности каждого признака от 1 до 4, отсутствие – 0.
4Индикатор самооценки уровня тревоги в ответ на актуальные стрессорные ситуации, в частности, связанные с соматической патологией и ее лечением. Вычисляется по стандартной формуле PT=∑1-∑2+50, где ∑1 – сумма зачеркнутых цифр на бланке по пунктам 3, 4, 6, 7, 9, 12–14, 17, 18. ∑2 – сумма остальных зачеркнутых цифр по пунктам 1, 2, 5, 8, 10, 11, 15, 16, 19, 20 (диапазон суммарного значения от 20 до 80 баллов, до 30 баллов – низкая, 31–44 балла – умеренная, 45 и более балов – высокая).
5Индикатор уровня соматизации по комплексной оценке пациентом и врачом уровня физикальных симптомов, связанных с психическим расстройством (оценка 2 в базе данных), и общих для соматической и психической патологии симптомов (оценка 3 в базе данных).
6Индикатор изменения качества сна и бодрствования в рамках суточного ритма по сравнению с периодом до лечения Вальдоксаном, объединяющий особенности засыпания (3 пункта), продолжительности ночного сна (2 пункта), пробуждения (2 пункта) и состояние бодрствования (3 пункта). Выбран один из вариантов аналоговой международной шкалы LSEQ (Leeds Sleep Evaluation Questionnaire). Динамика каждого признака оценивалась с помощью градуированной положительными и отрицательными числами линейки от 0 (состояние без изменений) в сторону улучшения от 1 (минимальное) до 10 (максимальное) или ухудшения от -1 (минимальное) до -10 (максимальное) (расчет в мм, улучшение в направлении от 0 до 100, ухудшение – от 0 до -100).
7Дополнительный индикатор качества жизни, отражающий удовлетворенность сложившейся жизнью с учетом индивидуальных планов, потребностей и суммарного воздействия стрессорных факторов: удовлетворенность – от 5 (минимальная) до 7 (максимальная), неудовлетворенность – от 3 (минимальная) до 1 (максимальная) и 4 – балл, отражающий затруднение дать определенный ответ.
8В междисциплинарных центрах ГБОУ ВПО «Первый МГМУ им. И.М.Сеченова» Минздрава России исследовательская работа проводится в рамках совместных с интернистами эпидемиологических программ, имеющих терапевтическую фазу.
Сведения об авторах
Смулевич Анатолий Болеславович – д-р мед. наук, проф., акад. РАМН, рук. отд. по изучению пограничной психической патологии и психосоматических расстройств ФГБУ НЦПЗ РАМН; зав. каф. психиатрии и психосоматики ФППОВ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава РоссииАндрющенко Алиса Владимировна – д-р мед. наук, зав. научно-исследовательским отд. психосоматической медицины НИЦ Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: alissia.va@gmail.com
А.Ю.Бражников – НОКЦ Психосоматическая медицина ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России
Н.В.Захарова – отд. пограничной психической патологии и психосоматических расстройств ФГБУ НЦПЗ РАМН, Москва; НОКЦ Психосоматическая медицина ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России
Романов Дмитрий Владимирович – канд. мед. наук, вед. науч. сотр. НИО Психосоматическая медицина НИЦ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России, доц. каф. психиатрии и психосоматики ИПО ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: newt777@mail.ru
Самушия Марина Антиповна – канд. мед. наук, доц. каф. психиатрии и психосоматики ФППОВ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: sma-psychiatry@mail.ru
Я.К.Галецкайте – НОКЦ Психосоматическая медицина ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России
Волель Беатриса Альбертовна – д-р мед. наук, проф. каф. психиатрии и психосоматики ИПО ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: beatrice.volel@gmail.com
Список исп. литературыСкрыть список1. Андрющенко А.В. Психические и психосоматические расстройства в учреждениях общесоматической сети (клинико-эпидемиологические аспекты, психосоматические соотношения, терапия). Автореф. дис. … д-ра мед. наук, 2011.
2. Иванов С.В. Вальдоксан при терапии умеренных и тяжелых депрессий непсихотического уровня в амбулаторной и госпитальной практике. Психиатр. и психофармакотер. 2009; 6: 15–9.
3. Краснов В.Н. Расстройства аффективного спектра. 2010.
4. Мосолов С.Н., Костюкова Е.Г., Городничев А.В. и др. Эффективность и переносимость агомелатина (Вальдоксана) при депрессивных состояниях. Психофармакотер. депрессии. 2011; 15: 15–24.
5. Мосолов С.Н., Костюкова Е.Г., Ушкалова А.В. Сравнительная эффективность агомелатина при лечении депрессивных состояний у больных с биполярным и монополярным течением аффективных расстройств. Психофармакотер. депрессии. 2012; 16: 17–25.
6. Смулевич А.Б., Андрющенко А.В., Бескова Д.А. Терапия непсихотических депрессий антидепрессантом агомелатин (Вальдоксан): результаты наблюдательного многоцентрового исследования РИТМ. Журн. психиатр. и психофармакотер. им. П.Б.Ганнушкина. 2010; 12 (4): 4–12.
7. Смулевич А.Б., Андрющенко А.В., Бескова Д.А. Новый подход к выбору терапии депрессивной инсомнии (результаты многоцентрового исследования РИТМ). Журн. психиатр. и психофармакотер. им. П.Б.Ганнушкина. 2010; 12 (5): 9–14.
8. Смулевич А.Б., Дубницкая Э.Б., Дробижев М.Ю. и др. Депрессии и возможности их лечения в общемедицинской практике (предварительные результаты программы ПАРУС). Психич. расстройства в общей медицине. 2007; 2 (2): 23–5.
9. Смулевич А.Б., Дубницкая Э.Б., Читлова В.В. Тревожная депрессия: проблема типологии и конституционального предрасположения. Журн. неврол. и психиатр. им. С.С.Корсакова. 2013; 1: 56–68.
10. Смулевич А.Б. Лекции по психосоматике. М., 2014.
11. Смулевич А.Б., Андрющенко А.В., Романов Д.В., Захарова Н.В.
Ремиссии при аффективных заболеваниях (эпидемиология, психопатология, клинический и социальный прогноз, вторичная профилактика). Журн. неврол. и психиатр. им. C.C.Корсакова. 2014; 114 (3): 4–13.
12. Собенников В.С. Соматоформные, депрессивные и тревожные расстройства (клинико-психопатологическое и статистическое исследование коморбидных состояний). Автореф. дис. … д-ра мед. наук. М., 2001.
13. Arendt J. Melatonin: a new probe in psychiatric investigation? Br
J Psychiat 1989; 155: 585–90.
14. Arendt J. Melatonin, circadian rhytms and sleep. New Engl J Med 2000; 343: 1114–6.
15. Audinot V, Mailliet F, Lahaye C et al. New selective ligands of human cloned melatonin MT1- and MT2-receptors. Naunyn Schmiedebergs Arch Pharmacol 2003; 6: 553–61.
16. Carroll BJ. The dexamethasone suppression test for melancholia. Br J Psychiat 1982; 140: 292–304.
17. Creed F, Dickens Ch. Depression in the medically ill. In: Depression and physical illness. Ed. A.Steptoe. Cambridge University Press 2007;
p. 3–18.
18. Gaynes B et al. Ann Fam Med 2007; 5: 126–34.
19. Goodwin G, Emsley R, Rouillon F. Agomelatine prevents relapse in patients with Major Depressive Disorders without evidence of a discontinuation syndrome: A 24-week randomized, double-blind, placebo-controlled trial. J Clin Psychiat 2009; 70: 1128–37.
20. Goodwin GM. Innovation translates into antidepressant effectiveness. J Psychopharmacol 2008; 22 (Suppl. 7): 9–12.
21. Gorwood PJ. Psychopharmacol 2010; 24 (Suppl. 2): 15–9.
22. Нale A, Corall RM, Mencacci C et al. Superior antidepressant efficacy result of agomelatine vs. fluoxetine in severe MDD patient: a randomized, double-blind study. Int Clin Psychopharmacol 2010; 25: 305–14.
23. Härter M, Baumeister H, Reuter K et al. Increased 12-month prevalence rates of mental disorders in patients with chronic somatic diseases. Psychother Psychosom 2007; 76 (6): 354–60.
24. Holsboer F, U von Bardeleben, Wiedemann K et al. Serial assessment of corticotrophin releasing hormone response after dexamethasone in depression: Implications for pathophysiology of DST nonsuppression. Biol Psychiat 1987; 22: 228–34.
25. Kasper S, Hajak G, Wullf K. Efficacy of the novel antidepressant agomelatine on the circadian rest activity cycle and depressive and anxiety symptoms in patients with major depressive disorder: a randomized, double-blind comparison with sertraline. J Clin Psychiat 2010; 71: 109–20.
26. Katon W, Sullivan MD. Depression and chronic medical illness.
J Clin Psychiat 1990; 51: 3–11.
27. Kennedy SH, Rizvi S, Fulton K, Rasmussen J. A double-blind comparison of sexual functioning, antidepressant efficacy, and tolerability between agomelatine and venlafaxine XR. J Clin Psychopharmacol 2008; 28: 329–33.
28. Kessler RC, Chiu WT, Demler O. Prevalence, severity and comorbidity of 12-month DSM-IV disorders in the National Comorbidity Survey Replication. Arch Gen Psychiat 2005; 62: 617–27.
29. Lader M. Pharmacotherapy of mood disorders and treatment discontinuation. Drugs 2007; 67 (12): 1657–63.
30. Millan MJ, Gobert A, Lejeune F et al. The novel melatonin agonist agomelatine (S20098) is an antagonist at 5-hydroxytryptamine 2C-receptors, blockade of which enhances the activity of frontocortical dopaminergic and adrenergic pathways. J Pharmacol Exp Ther 2003; 306: 954–64.
31. Montejo AL, Prieto N, Terleira A et al. Better sexual acceptability of agomelatine (25 and 50 mg) compared with paroxetine (20 mg) in healthy male volunteers. An 8-week placebo-controlled study using the PRSEXDO-SALSEX scale. 2010; 24: 111–20.
32. Mosolov SN, Ushkalova AV, Kostukova EG et al. Validation of the Russian version of the Hypomania Checklist (HCL-32) for the detection of Bipolar II disorder in patients with a current diagnosis of recurrent depression. J Affect Disord 2014; 155: 90–5.
33. Moussavi S, Chatterji S, Verdes E et al. Depression, chronic diseases, and decrements in health: results from the World Health Surveys. Psychosomatics 2007; 48: 394–9.
34. Nibuya M, Nestler EJ, Duman RS. Chronic antidepressant administration increases the expression of cAMP response element binding protein (CREB) in rat hippocampus. J Neurosci 1996; 16: 2365–72.
35. Ohayon MM. Epidemiology of depression and its treatment in the general population. J Psychiat Res 2007; 41 (3–4): 207–13.
36. Slattery DA, Hudson DJ. The evolution of antidepressant mechanisms. Nutt Fundam Clin Pharmacol 2004; 18: 1–21.
37. Stahl SM. Stahl's essential psychopharmacology neuroscientific basis and practical applications 4th ed. Cambridge University Press 2011.
38. Stahl SM, Fava M, Trivedi MH et al. Agomelatine in the treatment of major depressive disorder: an 8-week, multicenter, randomized, placebo-controlled trial. J Clin Psychiat 2010; 71: 616–26.
39. Stein DJ, Lerer B, Stahl SM. Essential evidance-based psychopharmacology. 2012; p. 63.
40. Suzuki E, Shintani F, Kanba S et al. Induction of interleukin-1b and interleukin-1 receptor antagonist mRNA by chronic treatment with various psychotropics in widespread area of rat brain. Neurosci Lett 1996; 215: 201–4.
41. Üstün TB, Sartorius N. Mental Illness in General Health Care: An International Study. John Wiley & Sons. NY, 1995.
42. Zajecka J. Treating Depression to Remission. J Clin Psychiat 2003; 64 (Suppl. 15): 7–12.
43. Zajecka J, Schaltzberg A, Stahl S et al. Efficacy and safety of agomelatine in the treatment of major depressive disorder: a multicenter, randomized, double-blind, placebo-controlled trial. J Clin Psychopharmacol 2010; 30: 135–44.
44. Zahodne LB, Marsiske M, Okun MS, Bowers D. Components of depression in Parkinson Disease. J Geriat Psychiat Neurol 2012; 25 (3): 131–7.
31 октября 2014
Количество просмотров: 3610


