Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№02 2014
Терапевтическое влияние анксиолитиков Феназепама и Афобазола на содержание малонового диальдегида в плазме крови и психическое состояние больных с тревожными расстройствами №02 2014
Номера страниц в выпуске:40-47
Резюме. Представлены результаты клинико-биохимического исследования активности перекисного окисления липидов (ПОЛ), оцениваемого по содержанию малонового диальдегида (МДА) в плазме крови больных с генерализованным тревожным, тревожно-фобическим и тревожно-ипохондрическим расстройствами, и его терапевтических изменений при применении анксиолитиков – бензодиазепина Феназепама и производного меркаптобензимидазола Афобазола. Проведен анализ соотношений между содержанием МДА, психопатологическими показателями состояния больных и их терапевтической динамикой. Использовались стандартизованный дизайн и валидные методики оценки клинических и биохимических показателей.
Исследование проведено у 66 пациентов с тревожными расстройствами. Группу контроля составили 33 здоровых добровольца. У больных с тревожными расстройствами выявлено достоверное (p<0,05) более чем двукратное увеличение уровня МДА в плазме крови по сравнению со здоровыми лицами при отсутствии значимых различий между диагностическими группами. Установлено, что типичный бензодиазепин Феназепам и селективный анксиолитик Афобазол при терапевтическом применении вызывают снижение концентрации МДА. Выявлена более значительная индивидуальная вариабельность изменений уровня МДА в плазме крови больных под влиянием Феназепама по сравнению с Афобазолом. Показаны взаимосвязи между уровнями МДА до начала лечения, а также их изменениями в процессе терапии анксиолитиками и динамикой показателей выраженности психопатологической симптоматики, оцениваемой на основании данных разных методик. При применении Афобазола выявлены статистически достоверные корреляции между терапевтическими изменениями содержания в крови МДА и выраженности тревоги. Предполагается, что выявленные различия во влиянии Феназепама и Афобазола на активность ПОЛ и разный характер клинико-биохимических соотношений могут отражать особенности механизмов действия препаратов и значимость мембранорецепторных взаимодействий в реализации терапевтического действия Афобазола.
Ключевые слова: перекисное окисление липидов, малоновый диальдегид, тревожные расстройства, анксиолитики, Феназепам, Афобазол.
Effects of anxiolytics Phenazepam and Afobazole
on malondialdehyde plasma levels and clinical state
in patients with anxiety disorders
G.G.Neznamov1, T.S.Syunyakov1, N.N.Zolotov1, K.N.Kolyasnikova1, M.V.Metlina2
1Scientific Institution Research Zakusov Institute of Pharmacology, Russian Academy of Medical Sciences, Moscow;
2Psychiatric Clinical Hospital №12, Moscow Health Department
Summary. Concentration of malondialdehyde (MDA) as the measure of lipid peroxidation (LPO) activity and its changes in the course of Phenazepam (benzodiazepine anxiolytic) and Afobazole (anxiolytic, mercaptobenzimidazole derivate) treatment were studied in patients diagnosed with generalized anxiety disorder, panic disorder and hypochondriac disorder. Relationships between MDA plasma levels, psychiatric symptoms and their changes were analyzed. The study utilized a standardized design and valid methods to assess clinical and biochemical parameters. Sixty-six patients with anxiety disorders participated in the study. The control group included 33 healthy volunteers. MDA levels in patients were significantly (more than two-fold) higher than in healthy volunteers (p<0,05) and did not differ between diagnostic groups. Both treatments (with typical benzodiazepine Phenazepam and with selective anxiolytic Afobazole) associated with decrease MDA plasma levels. Nevertheless Phenazepam induced individually more heterogeneous changes in MDA plasma levels comparing to Afobazole. Background plasma MDA levels and its changes throughout the study significantly correlated with changes of anxiety and associated symptoms on several measures in both treatment groups. However, Afobazole treatment associated with statistically significant correlations between changes of MDA plasma levels and changes of anxiety scores. It is suggested that observed differences of Phenazepam and Afobazole effects on LPO and different pattern of relationships between symptoms and MDA levels may reflect distinct underlying mechanisms of drug activity and significance of cell membranes modulation in the therapeutic action of Afobazole.
Key words: lipid peroxidation, malondialdehyde, anxiety disorders, anxiolytic, Phenazepam, Afobazole.
Активация ПОЛ выявлена при разной психической патологии: при неврозах [1, 8], депрессивных состояниях [9–11], эндогенных заболеваниях [12–16]. В настоящее время появляется все больше информации, подтверждающей ранее полученные нами данные о корреляции активации ПОЛ, оцениваемой по содержанию в плазме крови одного из конечных продуктов – малонового диальдегида (МДА), с выраженностью эмоционального напряжения и тревоги у здоровых испытуемых в моделируемых стрессогенных условиях и у больных неврозами [1, 8]. Повышение уровня ПОЛ обнаружено в плазме крови больных при генерализованном тревожном расстройстве (ГТР) [17, 18], социальной фобии [19, 20], обсессивно-компульсивном [21, 22], паническом [23, 24] и других тревожных состояниях [2, 4, 25, 26].
Об участии процессов ПОЛ в этиопатогенезе тревожных нарушений также свидетельствует уменьшение дисбаланса окислительно-восстановительных процессов при терапии больных бензодиазепинами (Феназепамом и уксепамом) [1] в виде снижения исходно высокого содержания в крови больных МДА и повышения сниженного уровня основного компонента «антиоксидантной защиты» – a-токоферола, за счет которого обеспечивается до 60% антирадикальной и 20% антиокислительной активности [27], а также нормализация повышенного уровня МДА в сыворотке крови больных с ГТР и повышения исходно сниженной активности супероксиддисмутазы и глутатиона в результате терапевтического применения антидепрессантов [28]. Показаны важные для оценки взаимосвязи процессов ПОЛ с эффективностью анксиолитиков индивидуальные различия в эффективности бензодиазепинов (Феназепама) у больных с тревожными расстройствами, коррелирующие со снижением на фоне терапии содержания МДА в плазме крови у респондеров и повышением – у нонреспондеров [1].
С позиций анализа рассматриваемой проблемы также показательны экспериментальные и клинические данные о наличии анксиолитических свойств в спектре фармакологической активности антиоксидантов, которые, в частности, были обнаружены у синтетического антиоксиданта дибунола [1, 29] и производного 3-оксипиридина мексидола [30, 31].
Все указанное выше явилось предпосылкой к проведению сравнительного исследования влияния анксиолитиков с разными характеристиками спектра психо-тропной активности – Феназепама и Афобазола – на содержание МДА в плазме крови больных с тревожными расстройствами в сопоставлении с терапевтическим действием препаратов.
10-го пересмотра ГТР (F41.1), агорафобии с паническим расстройством: тревожно-фобического расстройства (ТФР) F40.0 и ипохондрического расстройства (тревожно-ипохондрического расстройства, ТИР) F45.2 – без сопутствующей неврологической и соматической патологии (в том числе алкоголизма, лекарственной и наркотической зависимости), не принимавших препараты с психотропной активностью на протяжении 1 нед до включения в исследование и ранее в течение длительного времени не принимавших Афобазол или Феназепам, с суммарной оценкой депрессивных расстройств по «общему депрессивному фактору» шкалы оценки депрессии Гамильтона (Hamilton Rating Scale for Depression, HDRS) не более 7 баллов. Контрольную группу составили 33 здоровых добровольца (17 мужчин и 16 женщин) без сопутствующей соматической и неврологической патологии в возрасте от 19 до 32 лет.
Пациентам с тревожными расстройствами проводилась терапия анксиолитиками Феназепамом в суточной дозе 2 мг или Афобазолом в суточной дозе
30 мг длительностью 14 дней. Феназепам является типичным бензодиазепиновым анксиолитиком, прямым агонистом ГАМК-А-бензодиазепинового рецепторного комплекса с анксиолитическим, снотворным, противосудорожным, седативным, амнезирующим, миорелаксантным и (в малых дозах) активирующим действием [32]. Афобазол, производное меркаптобензимидазола по классификации Т.А.Ворониной и С.Б.Середенина [32], относится к селективным анксиолитикам, мембранным модуляторам ГАМК-А-бензодиазепинового рецепторного комплекса. В спектре психотропного действия препарата анксиолитическое действие сочетается с психостимулирующим компонентом при отсутствии гипно-седативных свойств. Кроме того, у Афобазола выявлено наличие нейропротективного и мягкого антидепрессивного эффекта. Оригинальные свойства препарата объясняются особенностями его рецепторных взаимодействий с σ1-рецепторами, мелатониновыми рецепторами MT1 и MT3 подтипов и ингибирующим влиянием на активность моноаминооксидазы типа А [33].
Для оценки выраженности психопатологических расстройств и терапевтической динамики применялись шкала оценки тревоги Гамильтона (Hamilton Rating Scale for Anxiety, HAMA) [34] и шкала оценки выраженности симптоматики [35], терапевтической эффективности – шкала общего клинического впечатления (Clinical Global Impression Scale, CGI) [36], на этапе скрининга – шкала оценки депрессии Гамильтона (HDRS) [37]. Также для оценки изменений тревожных и астенических расстройств на фоне терапии использовались методики самооценки: методика Спилбергера–Ханина для оценки ситуационной тревожности [38], мультидименсиональная шкала оценки астении (Multidimensional Fatigue Inventory, MFI) [39]. Стандартизованная оценка состояния больных проводилась до начала и на 14-й день терапии.
Определение содержания МДА проводилось по следующей методике. К 50 мкл плазмы крови добавляли
20 мкл 0,495 М раствора соли Мора и инкубировали при 37°С в течение 30 мин. Затем к образцам добавляли 10–30 мкл 0,9% раствора 2-тиобарбитуровой кислоты в 50% уксусной кислоте, интенсивно встряхивали и инкубировали при 80°С в течение 60 мин. После охлаждения измеряли оптическую плотность образцов на спектрофотометре Beckman DU-50B при 532 нм. Расчет количества МДА проводили на основании коэффициента молярной экстинкции 1,56×105 М-1 см-1 [40]. Все измерения проводили в трех параллелях.
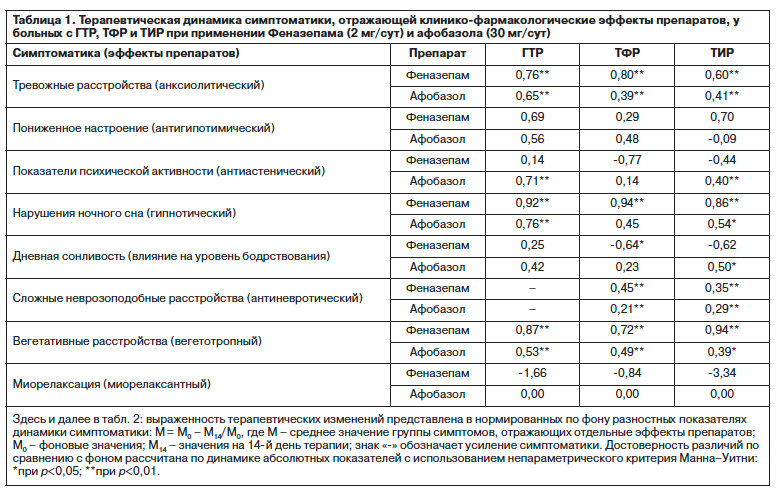
Из приведенных в таблицах данных следует, что различия в терапевтическом действии при простых и сложных по структуре тревожных расстройствах больше выражены у Афобазола по сравнению с Феназепамом (см. табл. 1 и 2), как и более низкие значения анксиолитического, гипнотического, вегетотропного эффектов Афобазола, уступающего Феназепаму по выраженности («мощности») специфической активности (см. табл. 1).
Следует также отметить выявляющиеся принципиальные отличия в спектре действия препаратов в виде разной направленности и выраженности изменений показателей психической активности (повышенной истощаемости, апатичности, безразличия, психомоторной заторможенности), уровня бодрствования, нарушений ночного сна (см. табл. 1) и астении (см. табл. 2), отражающие характерное для Феназепама наличие гипно-седативного компонента [32], а для атипичного анксиолитика Афобазола – стимулирующего [41, 42]. Отсутствие в действии Афобазола типичных для бензодиазепинов седативных и миорелаксантных свойств подтверждает его преимущества при терапии неглубоких тревожно-астенических состояний и при применении в амбулаторной практике, когда требуется поддержание оптимального уровня психофизиологических функций и работоспособности.
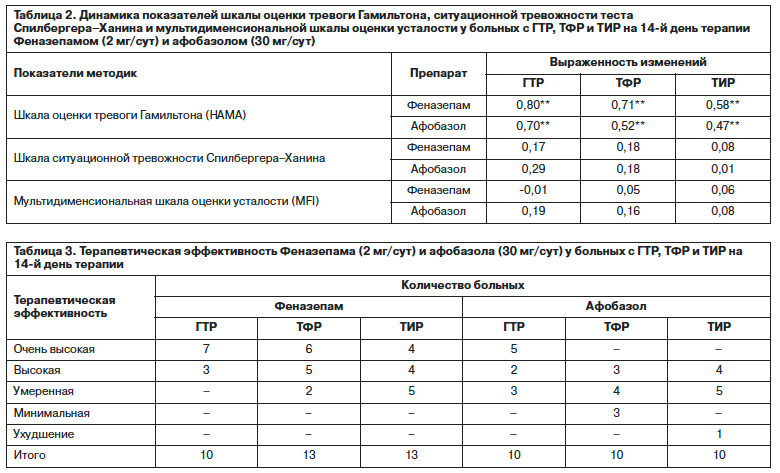
Результаты оценки терапевтической эффективности препаратов по шкале общего клинического впечатления (CGI), по существу, в интегрированном виде подтверждают приведенные выше данные о динамике психопатологических расстройств при применении Феназепама и Афобазола (табл. 3). При этом, отмечая тенденцию к снижению эффективности анксиолитиков при усложнении структуры тревожных расстройств, следует указать, что позитивные результаты их применения при ТФР и ТИР достигались, как правило, у больных, в состоянии которых отмечалось наличие образных, эмоционально насыщенных фобий и иной психопатологической симптоматики, взаимосвязанной с аффектом тревоги.
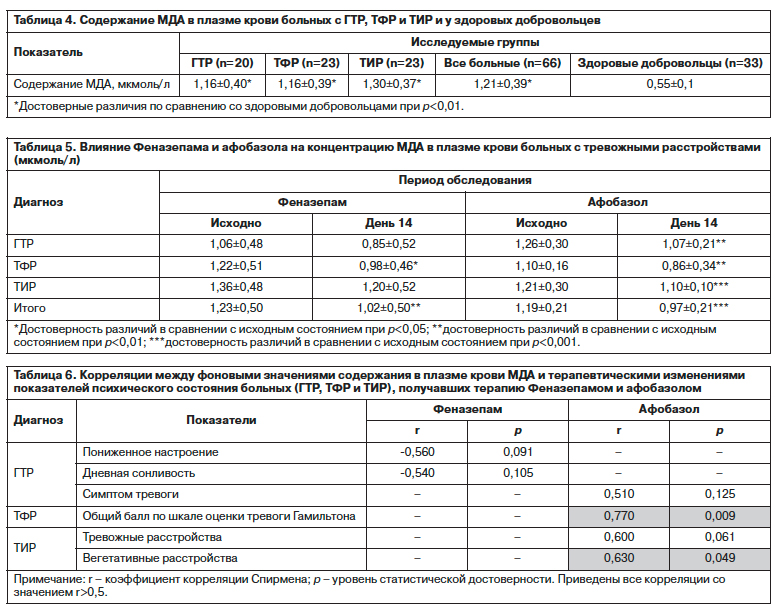
Данные, полученные при изучении содержания в плазме крови больных с тревожными расстройствами МДА, интегрального показателя интенсивности процессов ПОЛ, свидетельствуют об их активации по сравнению с показателями здоровых лиц вне зависимости от структуры психопатологического синдрома. При этом уровень содержания МДА в крови больных с тревожными расстройствами более чем в 2 раза превышает значения у здоровых добровольцев (табл. 4).
Феназепам и Афобазол к 14-му дню терапии вызывали сопоставимое уменьшение интенсивности ПОЛ, о чем можно судить по снижению содержания МДА в плазме крови (табл. 5). При этом не выявлялось статистически достоверных различий в динамике показателя у больных изученных диагностических групп, получавших Феназепам и Афобазол.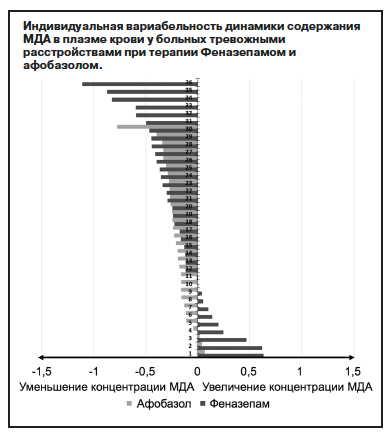
Однако в изменениях содержания МДА в плазме крови больных под влиянием Феназепама отмечалась более значительная индивидуальная вариабельность, чем при терапии Афобазолом, с более выраженной разнонаправленной динамикой показателя как в виде снижения, так и повышения его уровня (см. рисунок). О более однотипной динамике МДА у больных с тревожными нарушениями при терапии Афобазолом свидетельствуют и данные статистического анализа этих изменений (см. табл. 5). Для Феназепама, вероятно, вообще характерен более значительный диапазон терапевтических вариаций уровня МДА в крови [1, 32].
При корреляционном анализе, ориентированном на определение взаимосвязи между содержанием МДА в плазме крови со статическими и динамическими клиническими параметрами при тревожных нарушениях, установлено, что по данным оценки всей совокупности исследованных больных исходный (до начала терапии) уровень содержания МДА коррелирует с показателями «депрессивного» аффекта (r=-0,281; p=0,022), нарушений ночного сна (r=-0,325; p=0,008), дневной сонливости (r=-0,230; p=0,064) и длительности заболевания (r=0,316; p=0,012). При анализе в диагностических группах достоверные корреляции имеются в группе больных ТИР между фоновыми значениями МДА и пониженным настроением (r=-0,629; p=0,001) и дневной сонливостью (r=-0,494; p=0,017).
Выявлены принципиальные особенности взаимосвязи фоновых уровней содержания в плазме крови МДА с терапевтическими изменениями под влиянием Феназепама и Афобазола показателей состояния больных разных диагностических групп. При этом у больных, получавших Феназепам, имелись тенденции в виде статистически недостоверных корреляций по обратной зависимости динамики пониженного настроения и сонливости от исходного уровня МДА при ГТР в отличие от прямых корреляций, в том числе достоверных, динамики проявлений тревожных расстройств и собственно аффекта тревоги при ГТР, ТФР и ТИР с содержанием МДА до начала терапии у пациентов, получавших Афобазол (табл. 6).
Важные данные получены при анализе взаимосвязи динамики МДА и изменений показателей психопатологических расстройств вне зависимости от диагноза у всех больных, получавших Феназепам или Афобазол. Для Феназепама такие статистически значимые корреляции установлены только с изменением дневной сонливости (r=0,34; p=0,042), тогда как для Афобазола –
с редукцией симптома тревоги (r=0,35; p=0,056), группой симптомов, отражающих тревожные расстройства по симптоматической шкале (r=0,36; p=0,049), и астенических нарушений (r=0,48; p=0,007).
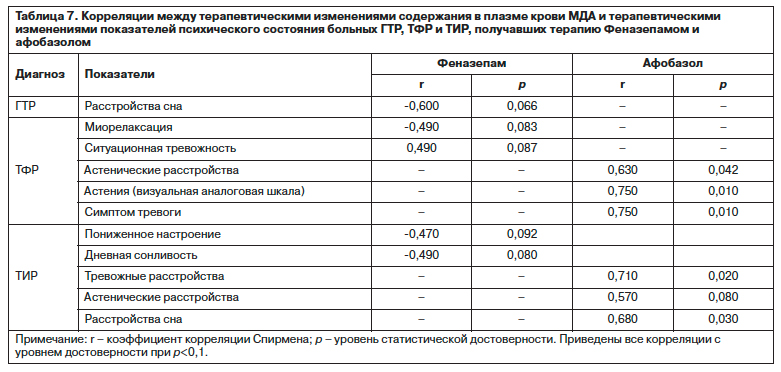
В диагностических группах обращают на себя внимание различия взаимосвязей изменений МДА и терапевтических сдвигов показателей состояния у больных, получавших Феназепам и Афобазол, что отражает сущностные особенности этих соотношений (табл. 7). При этом, если у получавших Феназепам это выявляется в виде тенденции (при p<0,1) в связи с разноплановыми показателями, то для Афобазола выявляются статистически достоверные корреляции динамики МДА с редукцией тревоги и астенических проявлений – основных «симптоматических мишеней», к которым адресовано действие препарата при тревожных расстройствах [41, 42].
Таким образом, результаты сравнительного исследования действия Феназепама и Афобазола у больных с тревожными состояниями принципиально подтвердили ранее полученные данные о различиях психотропной активности этих анксиолитиков [32, 41] и современные представления об участии ПОЛ в патогенезе тревоги [18–24, 28, 29].
Установлено, что активация ПОЛ, регистрируемая по содержанию МДА в плазме крови больных, отмечается вне зависимости от психопатологической структуры тревожных расстройств непсихотического уровня (ГТР, ТФР и ТИР) и уменьшается при применении анксиолитиков Феназепама и Афобазола, различающихся по химическому строению, спектральным характеристикам и механизмам действия.
Можно полагать, что выявленные существенные различия в изменениях содержания МДА в плазме крови на фоне терапии и их взаимосвязи с параметрами состояния больных, получавших Феназепам и Афобазол, отражают особенности механизмов анксиолитического действия препаратов.
Полученные данные о высоких значениях статистически значимых показателей корреляции уровня МДА в плазме крови обследованных больных и его изменений с динамикой тревоги при применении Афобазола могут свидетельствовать о более значимой роли ПОЛ в реализации терапевтического эффекта препарата, чем при применении Феназепама, что, возможно, связано с важным значением мембранорецепторных взаимодействий в механизме фармакологической активности препарата [47].
Сюняков Тимур Сергеевич – канд. мед. наук, ст. науч. сотр. лаб. фармакологической генетики ФГБУ НИИ фармакологии им. В.В.Закусова РАМН, Москва. E-mail: sjunja@bk.ru
Золотов Николай Николаевич – гл. науч. сотр., д-р биол. наук, проф. лаб. психофармакологии ФГБУ НИИ фармакологии им. В.В.Закусова РАМН, Москва. E-mail: zolotovnn@gmail.com
Колясникова Ксения Николаевна – науч. сотр. отд. химии лекарственных препаратов ФГБУ НИИ фармакологии им. В.В.Закусова РАМН, Москва. E-mail: kszolotova@mail.ru
Метлина Марианна Вячеславовна – врач ГБУЗ Психиатрическая клиническая больница №12 Департамента здравоохранения г. Москвы. E-mail: mariannamet@mail.ru
Исследование проведено у 66 пациентов с тревожными расстройствами. Группу контроля составили 33 здоровых добровольца. У больных с тревожными расстройствами выявлено достоверное (p<0,05) более чем двукратное увеличение уровня МДА в плазме крови по сравнению со здоровыми лицами при отсутствии значимых различий между диагностическими группами. Установлено, что типичный бензодиазепин Феназепам и селективный анксиолитик Афобазол при терапевтическом применении вызывают снижение концентрации МДА. Выявлена более значительная индивидуальная вариабельность изменений уровня МДА в плазме крови больных под влиянием Феназепама по сравнению с Афобазолом. Показаны взаимосвязи между уровнями МДА до начала лечения, а также их изменениями в процессе терапии анксиолитиками и динамикой показателей выраженности психопатологической симптоматики, оцениваемой на основании данных разных методик. При применении Афобазола выявлены статистически достоверные корреляции между терапевтическими изменениями содержания в крови МДА и выраженности тревоги. Предполагается, что выявленные различия во влиянии Феназепама и Афобазола на активность ПОЛ и разный характер клинико-биохимических соотношений могут отражать особенности механизмов действия препаратов и значимость мембранорецепторных взаимодействий в реализации терапевтического действия Афобазола.
Ключевые слова: перекисное окисление липидов, малоновый диальдегид, тревожные расстройства, анксиолитики, Феназепам, Афобазол.
Effects of anxiolytics Phenazepam and Afobazole
on malondialdehyde plasma levels and clinical state
in patients with anxiety disorders
G.G.Neznamov1, T.S.Syunyakov1, N.N.Zolotov1, K.N.Kolyasnikova1, M.V.Metlina2
1Scientific Institution Research Zakusov Institute of Pharmacology, Russian Academy of Medical Sciences, Moscow;
2Psychiatric Clinical Hospital №12, Moscow Health Department
Summary. Concentration of malondialdehyde (MDA) as the measure of lipid peroxidation (LPO) activity and its changes in the course of Phenazepam (benzodiazepine anxiolytic) and Afobazole (anxiolytic, mercaptobenzimidazole derivate) treatment were studied in patients diagnosed with generalized anxiety disorder, panic disorder and hypochondriac disorder. Relationships between MDA plasma levels, psychiatric symptoms and their changes were analyzed. The study utilized a standardized design and valid methods to assess clinical and biochemical parameters. Sixty-six patients with anxiety disorders participated in the study. The control group included 33 healthy volunteers. MDA levels in patients were significantly (more than two-fold) higher than in healthy volunteers (p<0,05) and did not differ between diagnostic groups. Both treatments (with typical benzodiazepine Phenazepam and with selective anxiolytic Afobazole) associated with decrease MDA plasma levels. Nevertheless Phenazepam induced individually more heterogeneous changes in MDA plasma levels comparing to Afobazole. Background plasma MDA levels and its changes throughout the study significantly correlated with changes of anxiety and associated symptoms on several measures in both treatment groups. However, Afobazole treatment associated with statistically significant correlations between changes of MDA plasma levels and changes of anxiety scores. It is suggested that observed differences of Phenazepam and Afobazole effects on LPO and different pattern of relationships between symptoms and MDA levels may reflect distinct underlying mechanisms of drug activity and significance of cell membranes modulation in the therapeutic action of Afobazole.
Key words: lipid peroxidation, malondialdehyde, anxiety disorders, anxiolytic, Phenazepam, Afobazole.
Введение
Процессам перекисного окисления липидов (ПОЛ) принадлежит важная роль в механизмах развития эмоционального стресса, нарушений психической адаптации, психических заболеваний и другой патологии центральной нервной системы [1]. Высокий уровень потребления кислорода при относительно невысокой активности ферментов антиоксидантной защиты и значительном содержании липидов обусловливает уязвимость мозга и его повышенную чувствительность к оксидативному стрессу [2–4]. В нервной ткани в связи с особенностями метаболизма наиболее отчетливо проявляется двойственная роль постоянно образующихся в клетке активных форм кислорода – таких как супероксидный радикал и пероксид водорода. Участвуя в поддержании гомеостаза, они выполняют ряд важных функций в опосредовании клеточных сигналов, иммунного ответа, запуске апоптоза, но они же способны разрушать важнейшие макромолекулы, что приводит к развитию разных патологических состояний [5–7].Активация ПОЛ выявлена при разной психической патологии: при неврозах [1, 8], депрессивных состояниях [9–11], эндогенных заболеваниях [12–16]. В настоящее время появляется все больше информации, подтверждающей ранее полученные нами данные о корреляции активации ПОЛ, оцениваемой по содержанию в плазме крови одного из конечных продуктов – малонового диальдегида (МДА), с выраженностью эмоционального напряжения и тревоги у здоровых испытуемых в моделируемых стрессогенных условиях и у больных неврозами [1, 8]. Повышение уровня ПОЛ обнаружено в плазме крови больных при генерализованном тревожном расстройстве (ГТР) [17, 18], социальной фобии [19, 20], обсессивно-компульсивном [21, 22], паническом [23, 24] и других тревожных состояниях [2, 4, 25, 26].
Об участии процессов ПОЛ в этиопатогенезе тревожных нарушений также свидетельствует уменьшение дисбаланса окислительно-восстановительных процессов при терапии больных бензодиазепинами (Феназепамом и уксепамом) [1] в виде снижения исходно высокого содержания в крови больных МДА и повышения сниженного уровня основного компонента «антиоксидантной защиты» – a-токоферола, за счет которого обеспечивается до 60% антирадикальной и 20% антиокислительной активности [27], а также нормализация повышенного уровня МДА в сыворотке крови больных с ГТР и повышения исходно сниженной активности супероксиддисмутазы и глутатиона в результате терапевтического применения антидепрессантов [28]. Показаны важные для оценки взаимосвязи процессов ПОЛ с эффективностью анксиолитиков индивидуальные различия в эффективности бензодиазепинов (Феназепама) у больных с тревожными расстройствами, коррелирующие со снижением на фоне терапии содержания МДА в плазме крови у респондеров и повышением – у нонреспондеров [1].
С позиций анализа рассматриваемой проблемы также показательны экспериментальные и клинические данные о наличии анксиолитических свойств в спектре фармакологической активности антиоксидантов, которые, в частности, были обнаружены у синтетического антиоксиданта дибунола [1, 29] и производного 3-оксипиридина мексидола [30, 31].
Все указанное выше явилось предпосылкой к проведению сравнительного исследования влияния анксиолитиков с разными характеристиками спектра психо-тропной активности – Феназепама и Афобазола – на содержание МДА в плазме крови больных с тревожными расстройствами в сопоставлении с терапевтическим действием препаратов.
Материалы и методы
Исследование выполнено с участием 66 больных в возрасте от 18 до 55 лет с верифицированными диагнозами по Международной классификации болезней10-го пересмотра ГТР (F41.1), агорафобии с паническим расстройством: тревожно-фобического расстройства (ТФР) F40.0 и ипохондрического расстройства (тревожно-ипохондрического расстройства, ТИР) F45.2 – без сопутствующей неврологической и соматической патологии (в том числе алкоголизма, лекарственной и наркотической зависимости), не принимавших препараты с психотропной активностью на протяжении 1 нед до включения в исследование и ранее в течение длительного времени не принимавших Афобазол или Феназепам, с суммарной оценкой депрессивных расстройств по «общему депрессивному фактору» шкалы оценки депрессии Гамильтона (Hamilton Rating Scale for Depression, HDRS) не более 7 баллов. Контрольную группу составили 33 здоровых добровольца (17 мужчин и 16 женщин) без сопутствующей соматической и неврологической патологии в возрасте от 19 до 32 лет.
Пациентам с тревожными расстройствами проводилась терапия анксиолитиками Феназепамом в суточной дозе 2 мг или Афобазолом в суточной дозе
30 мг длительностью 14 дней. Феназепам является типичным бензодиазепиновым анксиолитиком, прямым агонистом ГАМК-А-бензодиазепинового рецепторного комплекса с анксиолитическим, снотворным, противосудорожным, седативным, амнезирующим, миорелаксантным и (в малых дозах) активирующим действием [32]. Афобазол, производное меркаптобензимидазола по классификации Т.А.Ворониной и С.Б.Середенина [32], относится к селективным анксиолитикам, мембранным модуляторам ГАМК-А-бензодиазепинового рецепторного комплекса. В спектре психотропного действия препарата анксиолитическое действие сочетается с психостимулирующим компонентом при отсутствии гипно-седативных свойств. Кроме того, у Афобазола выявлено наличие нейропротективного и мягкого антидепрессивного эффекта. Оригинальные свойства препарата объясняются особенностями его рецепторных взаимодействий с σ1-рецепторами, мелатониновыми рецепторами MT1 и MT3 подтипов и ингибирующим влиянием на активность моноаминооксидазы типа А [33].
Для оценки выраженности психопатологических расстройств и терапевтической динамики применялись шкала оценки тревоги Гамильтона (Hamilton Rating Scale for Anxiety, HAMA) [34] и шкала оценки выраженности симптоматики [35], терапевтической эффективности – шкала общего клинического впечатления (Clinical Global Impression Scale, CGI) [36], на этапе скрининга – шкала оценки депрессии Гамильтона (HDRS) [37]. Также для оценки изменений тревожных и астенических расстройств на фоне терапии использовались методики самооценки: методика Спилбергера–Ханина для оценки ситуационной тревожности [38], мультидименсиональная шкала оценки астении (Multidimensional Fatigue Inventory, MFI) [39]. Стандартизованная оценка состояния больных проводилась до начала и на 14-й день терапии.
Определение содержания МДА проводилось по следующей методике. К 50 мкл плазмы крови добавляли
20 мкл 0,495 М раствора соли Мора и инкубировали при 37°С в течение 30 мин. Затем к образцам добавляли 10–30 мкл 0,9% раствора 2-тиобарбитуровой кислоты в 50% уксусной кислоте, интенсивно встряхивали и инкубировали при 80°С в течение 60 мин. После охлаждения измеряли оптическую плотность образцов на спектрофотометре Beckman DU-50B при 532 нм. Расчет количества МДА проводили на основании коэффициента молярной экстинкции 1,56×105 М-1 см-1 [40]. Все измерения проводили в трех параллелях.
Статистический анализ
Характеристика непрерывных переменных осуществлялась методами описательной статистики с указанием средних арифметических значений и стандартных отклонений. Для анализа отдельных клинико-фармакологических эффектов препаратов проводилась специальная группировка симптомов шкалы оценки выраженности симптоматики [35], как это было описано ранее [32, 41, 42]. Изменение концентрации МДА в процессе терапии Афобазолом и Феназепамом в трех диагностических группах анализировалось при помощи трехфакторного метода ANOVA, в который в качестве зависимой переменной была внесена концентрация МДА, а в качестве независимых категориальных переменных – диагноз и назначенный препарат. Сравнение непрерывных показателей в динамике внутри групп производилось по непараметрическому методу Уилкоксона. Попарное сравнение непрерывных переменных в трех диагностических группах и между препаратами производилось при помощи непараметрической методики Манна–Уитни. Корреляционный анализ проводился по непараметрической методике Спирмена. При проведении статистических расчетов использовались уровни достоверности при p≤0,1, p≤0,05, p≤0,01 и p≤0,001. Статистические расчеты производились при помощи программ Microsoft Excel 2013, Statsoft Statistica 8.0.Результаты и их обсуждение
Приведенные в табл. 1 и 2 данные о терапевтическом действии Феназепама и Афобазола у обследованных больных с тревожными расстройствами дают довольно полное представление об общих закономерностях и особенностях реализации спектральных характеристик этих анксиолитиков в клинических условиях. Прежде всего это тенденция к более полной реализации их терапевтического потенциала при относительно простых тревожных и тревожно-астенических состояниях у больных ГТР и уменьшению позитивных сдвигов при усложнении структуры расстройства у больных с ТФР и ТИР. Эта тенденция отмечается в проявлении анксиолитического и антиастенического эффекта препаратов и позитивном влиянии на пониженное настроение и нарушения ночного сна (см. табл. 1), в динамике показателей объективных и субъективных шкал оценки тревоги Гамильтона и Спилбергера–Ханина (см. табл. 2). Принципиально эти данные соответствуют сформулированным Л.С.Мехилане представлениям об ограниченности терапевтических возможностей анксиолитиков проявлениями эмоционального напряжения и тревоги [43], нашедшим подтверждение в других исследованиях этой проблемы [32, 44–46].
Из приведенных в таблицах данных следует, что различия в терапевтическом действии при простых и сложных по структуре тревожных расстройствах больше выражены у Афобазола по сравнению с Феназепамом (см. табл. 1 и 2), как и более низкие значения анксиолитического, гипнотического, вегетотропного эффектов Афобазола, уступающего Феназепаму по выраженности («мощности») специфической активности (см. табл. 1).
Следует также отметить выявляющиеся принципиальные отличия в спектре действия препаратов в виде разной направленности и выраженности изменений показателей психической активности (повышенной истощаемости, апатичности, безразличия, психомоторной заторможенности), уровня бодрствования, нарушений ночного сна (см. табл. 1) и астении (см. табл. 2), отражающие характерное для Феназепама наличие гипно-седативного компонента [32], а для атипичного анксиолитика Афобазола – стимулирующего [41, 42]. Отсутствие в действии Афобазола типичных для бензодиазепинов седативных и миорелаксантных свойств подтверждает его преимущества при терапии неглубоких тревожно-астенических состояний и при применении в амбулаторной практике, когда требуется поддержание оптимального уровня психофизиологических функций и работоспособности.

Результаты оценки терапевтической эффективности препаратов по шкале общего клинического впечатления (CGI), по существу, в интегрированном виде подтверждают приведенные выше данные о динамике психопатологических расстройств при применении Феназепама и Афобазола (табл. 3). При этом, отмечая тенденцию к снижению эффективности анксиолитиков при усложнении структуры тревожных расстройств, следует указать, что позитивные результаты их применения при ТФР и ТИР достигались, как правило, у больных, в состоянии которых отмечалось наличие образных, эмоционально насыщенных фобий и иной психопатологической симптоматики, взаимосвязанной с аффектом тревоги.

Данные, полученные при изучении содержания в плазме крови больных с тревожными расстройствами МДА, интегрального показателя интенсивности процессов ПОЛ, свидетельствуют об их активации по сравнению с показателями здоровых лиц вне зависимости от структуры психопатологического синдрома. При этом уровень содержания МДА в крови больных с тревожными расстройствами более чем в 2 раза превышает значения у здоровых добровольцев (табл. 4).
Феназепам и Афобазол к 14-му дню терапии вызывали сопоставимое уменьшение интенсивности ПОЛ, о чем можно судить по снижению содержания МДА в плазме крови (табл. 5). При этом не выявлялось статистически достоверных различий в динамике показателя у больных изученных диагностических групп, получавших Феназепам и Афобазол.

Однако в изменениях содержания МДА в плазме крови больных под влиянием Феназепама отмечалась более значительная индивидуальная вариабельность, чем при терапии Афобазолом, с более выраженной разнонаправленной динамикой показателя как в виде снижения, так и повышения его уровня (см. рисунок). О более однотипной динамике МДА у больных с тревожными нарушениями при терапии Афобазолом свидетельствуют и данные статистического анализа этих изменений (см. табл. 5). Для Феназепама, вероятно, вообще характерен более значительный диапазон терапевтических вариаций уровня МДА в крови [1, 32].
При корреляционном анализе, ориентированном на определение взаимосвязи между содержанием МДА в плазме крови со статическими и динамическими клиническими параметрами при тревожных нарушениях, установлено, что по данным оценки всей совокупности исследованных больных исходный (до начала терапии) уровень содержания МДА коррелирует с показателями «депрессивного» аффекта (r=-0,281; p=0,022), нарушений ночного сна (r=-0,325; p=0,008), дневной сонливости (r=-0,230; p=0,064) и длительности заболевания (r=0,316; p=0,012). При анализе в диагностических группах достоверные корреляции имеются в группе больных ТИР между фоновыми значениями МДА и пониженным настроением (r=-0,629; p=0,001) и дневной сонливостью (r=-0,494; p=0,017).
Выявлены принципиальные особенности взаимосвязи фоновых уровней содержания в плазме крови МДА с терапевтическими изменениями под влиянием Феназепама и Афобазола показателей состояния больных разных диагностических групп. При этом у больных, получавших Феназепам, имелись тенденции в виде статистически недостоверных корреляций по обратной зависимости динамики пониженного настроения и сонливости от исходного уровня МДА при ГТР в отличие от прямых корреляций, в том числе достоверных, динамики проявлений тревожных расстройств и собственно аффекта тревоги при ГТР, ТФР и ТИР с содержанием МДА до начала терапии у пациентов, получавших Афобазол (табл. 6).
Важные данные получены при анализе взаимосвязи динамики МДА и изменений показателей психопатологических расстройств вне зависимости от диагноза у всех больных, получавших Феназепам или Афобазол. Для Феназепама такие статистически значимые корреляции установлены только с изменением дневной сонливости (r=0,34; p=0,042), тогда как для Афобазола –
с редукцией симптома тревоги (r=0,35; p=0,056), группой симптомов, отражающих тревожные расстройства по симптоматической шкале (r=0,36; p=0,049), и астенических нарушений (r=0,48; p=0,007).

В диагностических группах обращают на себя внимание различия взаимосвязей изменений МДА и терапевтических сдвигов показателей состояния у больных, получавших Феназепам и Афобазол, что отражает сущностные особенности этих соотношений (табл. 7). При этом, если у получавших Феназепам это выявляется в виде тенденции (при p<0,1) в связи с разноплановыми показателями, то для Афобазола выявляются статистически достоверные корреляции динамики МДА с редукцией тревоги и астенических проявлений – основных «симптоматических мишеней», к которым адресовано действие препарата при тревожных расстройствах [41, 42].
Таким образом, результаты сравнительного исследования действия Феназепама и Афобазола у больных с тревожными состояниями принципиально подтвердили ранее полученные данные о различиях психотропной активности этих анксиолитиков [32, 41] и современные представления об участии ПОЛ в патогенезе тревоги [18–24, 28, 29].
Установлено, что активация ПОЛ, регистрируемая по содержанию МДА в плазме крови больных, отмечается вне зависимости от психопатологической структуры тревожных расстройств непсихотического уровня (ГТР, ТФР и ТИР) и уменьшается при применении анксиолитиков Феназепама и Афобазола, различающихся по химическому строению, спектральным характеристикам и механизмам действия.
Можно полагать, что выявленные существенные различия в изменениях содержания МДА в плазме крови на фоне терапии и их взаимосвязи с параметрами состояния больных, получавших Феназепам и Афобазол, отражают особенности механизмов анксиолитического действия препаратов.
Полученные данные о высоких значениях статистически значимых показателей корреляции уровня МДА в плазме крови обследованных больных и его изменений с динамикой тревоги при применении Афобазола могут свидетельствовать о более значимой роли ПОЛ в реализации терапевтического эффекта препарата, чем при применении Феназепама, что, возможно, связано с важным значением мембранорецепторных взаимодействий в механизме фармакологической активности препарата [47].
Сведения об авторах
Незнамов Григорий Георгиевич – д-р мед. наук, проф., зав. лаб. клин. психофармакологии ФГБУ НИИ фармакологии им. В.В.Закусова РАМН, Москва. E-mail: neznamovpharm@mail.ruСюняков Тимур Сергеевич – канд. мед. наук, ст. науч. сотр. лаб. фармакологической генетики ФГБУ НИИ фармакологии им. В.В.Закусова РАМН, Москва. E-mail: sjunja@bk.ru
Золотов Николай Николаевич – гл. науч. сотр., д-р биол. наук, проф. лаб. психофармакологии ФГБУ НИИ фармакологии им. В.В.Закусова РАМН, Москва. E-mail: zolotovnn@gmail.com
Колясникова Ксения Николаевна – науч. сотр. отд. химии лекарственных препаратов ФГБУ НИИ фармакологии им. В.В.Закусова РАМН, Москва. E-mail: kszolotova@mail.ru
Метлина Марианна Вячеславовна – врач ГБУЗ Психиатрическая клиническая больница №12 Департамента здравоохранения г. Москвы. E-mail: mariannamet@mail.ru
Список исп. литературыСкрыть список1. Александровский Ю.А., Поюровский М.В., Незнамов Г.Г. Неврозы и перекисное окисление липидов. М.: Наука, 1991.
2. Ng F, Berk M, Dean O, Bush AI. Oxidative stress in psychiatric disorders: evidence base and therapeutic implications. Int J Neuropsychopharmacol 2008; 11: 851–76.
3. Halliwell B. Oxidative stress and neurodegeneration: Where are we now? J Neurochem 2006; 97: 1634–58.
4. Hovatta I, Juhila J, Donner J. Oxidative stress in anxiety and comorbid disorders. Neurosci Res 2010; 68 (4): 261–75.
5. Valko M, Leibfritz D, Moncol J et al. Free radicals and antioxidants in normal physiological functions and human disease. Int J Biochem Cell Biol 2007; 39: 44–84.
6. Delattre J, Beaudeux J-L, Bonnefont-Rousselot D. Radicaux libres et stress oxydant: Aspects biologiques et pathologiques. Radicaux Libr. Stress oxydant. Asp Biol Pathol 2007; p. 584.
7. Aitken RJ, Roman SD. Antioxidant systems and oxidative stress in the testes. Adv Exp Med Biol 2008; 636: 154–71.
8. Александровский Ю.А., Поюровский М.В., Незнамов Г.Г., Середенин С.Б. Перекисное окисление липидов при эмоциональном напряжении и неврологических расстройствах. Журн. неврологии и психиатрии. 1988; 88 (11): 95–101.
9. Bilici M, Efe H, Köroǧlu MA et al. Antioxidative enzyme activities and lipid peroxidation in major depression: Alterations by antidepressant treatments. J Affect Disord 2001; 64: 43–51.
10. Yager S, Forlenza MJ, Miller GE. Depression and oxidative damage to lipids. Psychoneuroendocrinology 2010; 35: 1356–62.
11. Leonard B, Maes M. Mechanistic explanations how cell-mediated immune activation, inflammation and oxidative and nitrosative stress pathways and their sequels and concomitants play a role in the pathophysiology of unipolar depression. Neurosci Biobehav Rev 2012; 36: 764–85.
12. Boskovic M, Vovk T, Kores Plesnicar B, Grabnar I. Oxidative Stress in Schizophrenia. Curr Neuropharmacol 2011; 9: 301–12.
13. Bitanihirwe BKY, Woo TUW. Oxidative stress in schizophrenia: An integrated approach. Neurosci Biobehav Rev 2011; 35: 878–93.
14. Кротенко Н.М., Смирнова Л.П., Логинов В.Н. и др. Влияние нейролептической терапии на состояние перекисного окисления липидов и систему глутатиона у больных шизофренией. Сиб. вестн. психиатрии и наркологии. 2010; с. 133–5.
15. Прилипко Л.Л., Ерин А.Н., Беляев Б.С. и др. Активация перекисного окисления липидов в организме больных шизофренией и маниакально-депрессивным психозом. Журн. неврологии и психиатрии им. С.С.Корсакова. 1987; 87 (1): 100–3.
16. Озорнина Н.В., Озорнин А.С., Говорин Н.В. Терешков П.П. Изменения показателей липопероксидации и антирадикальной защиты у больных с первым психотическим эпизодом шизофрении при терапии типичными и атипичными нейролептиками. Забайкальский мед. вестн. 2011; 1: 10–6.
17. Bulut M, Selek S, Bez Y et al. Reduced PON1 enzymatic activity and increased lipid hydroperoxide levels that point out oxidative stress in generalized anxiety disorder. J Affect Disord 2013; 150: 829–33.
18. Kaya MC, Bez Y, Karababa IF et al. Decreased Serum Sulphydryl Levels as a Sign of Increased Oxidative Stress in Generalized Anxiety Disorder. Psychiatry Investig 2013; 10: 281–5.
19. Atmaca M, Tezcan E, Kuloglu M et al. Antioxidant enzyme and malondialdehyde values in social phobia before and after citalopram treatment. Eur Arch Psychiatry Clin Neurosci 2004; 254: 231–5.
20. Atmaca M, Kuloglu M, Tezcan E, Ustundag B. Antioxidant enzyme and malondialdehyde levels in patients with social phobia. Psychiatry Res 2008; 159: 95–100.
21. Chakraborty S, Singh OP, Dasgupta A et al. Correlation between lipid peroxidation-induced TBARS level and disease severity in obsessive-compulsive disorder. Prog. Neuro-Psychopharmacology Biol Psychiatry 2009; 33: 363–6.
22. Behl A, Swami G, Sircar SS et al. Relationship of possible stress-related biochemical markers to oxidative/antioxidative status in obsessive-compulsive disorder. Neuropsychobiology 2010; 61: 210–4.
23. Kuloglu M, Atmaca M, Tezcan E et al. Antioxidant enzyme and malondialdehyde levels in patients with panic disorder. Neuropsychobiology 2002; 46: 186–9.
24. Gul IG, Karlidag R, Cumurcu BE et al. The Effect of Agoraphobia on Oxidative Stress in Panic Disorder. Psychiatry Investig 2013; 10: 317–25.
25. Gingrich JA. Oxidative stress is the new stress. Nat Med 2005; 11: 1281–2.
26. Bouayed J, Rammal H, Soulimani R. Oxidative stress and anxiety: relationship and cellular pathways. Oxid Med Cell Longev 2009; 2 (2): 63–7.
27. Бурлакова В.Б. Закономерности действия антиоксидантов – эффективных мембранопротекторов на нормальное и патологическое состояние клеток. Перспективы биоорганической химии в создании новых лекарственных препаратов. Тезисы докладов всесоюзного симпозиума. Рига, 1982.
28. Khanna RS, Negi R, Pande D et al. Markers of Oxidative Stress in Generalized Anxiety Psychiatric Disorder: Therapeutic Implications. J Stress Physiol Biochem 2012; 8 (2): 32–8.
29. Молодавкин Г.М., Поюровский М.В. Влияние антиоксиданта дибунола и его комбинации с Феназепамом на поведение крыс в условиях конфликтных ситуаций. Бюлл. эксперим. биологии и медицины. 1985; 100 (7): 36–8.
30. Дюмаев К.М., Воронина Т.А., Смирнов Л.Д. Антиоксиданты в профилактике и терапии патологий ЦНС. М., 1995.
31. Незнамов Г.Г., Бочкарев В.К., Лыгалов С.И. Клинико-фармакологический анализ транквилизирующего действия мексидола. Медико-биологические аспекты применения антиоксидантов эмоксипина и мексидола (экспериментальное и клиническое изучение). Бюллетень Всесоюзного научного центра по безопасности биологически активных веществ. Всесоюз. науч. центр по безопасности биологически активных веществ. М., 1992; с. 47–54.
32. Середенин С.Б., Воронина Т.А., Незнамов Г.Г., Жердев В.П.
Феназепам. 25 лет в медицинской практике. М.: Наука, 2007.
33. Середенин С.Б., Воронин М.В. Нейрорецепторные механизмы действия Афобазола. Эксперим. и клин. фармакология. 2009; 72 (1): 3–11.
34. Hamilton M. Hamilton Anxiety Rating Scale (HAM-A). J Med 1959; 61: 81–2.
35. Александровский Ю.А., Руденко Г.М., Незнамов Г.Г. и др. Унифицированная система оценки клинико-фармакологического действия психотропных препаратов у больных с пограничными нервно-психическими расстройствами: метод. рекомендации. М., 1984.
36. Guy W. Clinical Global Impressions (CGI). ECDEU Assess. Man. Psychopharmacol. – Revis. (DHEW Publ No ADM 76–338). Rockville, MD: U.S. Department of Health, Education, and Welfare, Public Health Service, Alcohol, Drug Abuse, and Mental Health Administration, NIMH Psychopharmacology Research Branch, Division of Extramural Research Programs, 1976; p. 218–22.
37. Hamilton M. Development of a rating scale for primary depressive illness. Br J Soc Clin Psychol 1967; 6: 278–96.
38. Ханин Ю.Л. Краткое руководство к применению шкалы реактивной и личностной тревожности Ч.Д.Спилбергера.
Л.: ЛНИИФК, 1976.
39. Smets EM, Garssen B, Bonke B, De Haes JC. The Multidimensional Fatigue Inventory (MFI) psychometric qualities of an instrument to assess fatigue. J Psychosom Res 1995; 39: 315–25.
40. Yagi K. Simple assay for the level of total lipid peroxides in serum or plasma. Methods Mol Biol 1998; 108: 101–6.
41. Незнамов Г.Г., Сюняков С.А., Чумаков Д.В., Маметова Л.Э. Новый селективный анксиолитик Афобазол. Журн. неврологии и психиатрии им. С.С.Корсакова. 2005; 105 (4): 48–54.
42. Незнамов Г.Г., Сюняков С.А., Чумаков Д.В. и др. Результаты клинического изучения селективного анксиолитика Афобазола. Эксперим. и клин. фармакология. 2001; 64 (2): 15–9.
43. Мехилане Л.С. О психофармакотерапии больных невро-
зами. Всесоюзный симпозиум «Химия, фармакология и клиника нейролептиков». Тарту, 1986; с. 140–3.
44. Dorofeeva OA, Syunyakov SA, Mametova LE et al. Therapeutic Abilities of Anxiolytics in Anxiety Disorders of Different Structure. Eur Psychiatry 2012; 27 (Suppl. 1): 1079.
45. Смулевич А.Б. Терапия психических болезней. Руководство по психиатрии. Том 1. Под ред. А.С.Тиганова. М.: Медицина, 1999; с. 250–313.
46. Колюцкая Е.В. Обсессивно-фобические расстройства при шизофрении и нарушениях шизофренического спектра.
Автореф. дис. ... д-ра мед. наук. М., 2001.
47. Середенин С.Б. Лекции по фармакогенетике. М.: Медицинское информационное агентство, 2004.


