Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№03-04 2014
Депрессии при интерферонотерапии гепатита С: диагностика и лечение №03-04 2014
Номера страниц в выпуске:25-30
Хронический гепатит С (ХГС) – одно из наиболее распространенных в мире инфекционных заболеваний, вызывающих тяжелые медицинские и социальные последствия. Адекватная противовирусная терапия (ПВТ) ХГС всегда включает препараты интерферона a (ИФН-a) – отдельно или в комбинации с другими противовирусными средствами. ИФН необходимо применять длительно, в высоких дозах. Применение ИФН-a способствует возникновению психопатологической симптоматики, преимущественно депрессии.
Резюме. Обследовано 278 больных хроническим гепатитом С, получавших противовирусную интерферонотерапию, на которой у 169 (60,7%) пациентов развились депрессивные расстройства. Определены клинические и фармакотерапевтические особенности таких депрессий. Выявлены факторы, влияющие на частоту возникновения и структуру депрессивного синдрома. Разработаны дифференцированные рекомендации по диагностике и терапии изученных состояний.
Ключевые слова: хронический гепатит С, интерферонотерапия, депрессия, психофармакотерапия.
Depression during interferon therapy for hepatitis C:
diagnosis and treatment
N.N.Ivanets, M.A.Kinkulkina, Yu.G.Tikhonova, T.I.Avdeeva, D.I.Morozov, A.V.Volkov
Department of Psychiatry and Addiction, Sechenov First Moscow State Medical University Russian Ministry of Health
Summary. 278 patients with chronic hepatitis C treated with interferon therapy were observed. Depression developed in 169 patients during antiviral therapy. Clinical and therapeutic features of this depression have been defined. Predictors of depression and factors influencing the psychopathology of depressive syndrome have been identified. Guidelines for diagnosis and treatment of interferon-induced depression have been developed.
Key words: chronic hepatitis C, interferon therapy, depression, psychopharmacotherapy.
Хронический гепатит С (ХГС) – одно из наиболее распространенных в мире инфекционных заболеваний, вызывающих тяжелые медицинские и социальные последствия [1, 2]. Адекватная противовирусная терапия (ПВТ) ХГС всегда включает препараты интерферона a (ИФН-a) – отдельно или в комбинации с другими противовирусными средствами. ИФН необходимо применять длительно, в высоких дозах. Применение ИФН-a способствует возникновению психопатологической симптоматики, преимущественно депрессии [3–5]. Однако нет единого мнения как относительно частоты возникновения депрессивных расстройств при ПВТ ХГС, так и их психопатологической квалификации, прогностической значимости для эффективности ПВТ. Существуют разные точки зрения на возможность продолжения курса ПВТ при развитии психических нарушений. До настоящего времени отсутствуют четкие регламентированные стандарты проведения ПВТ у больных ХГС с развившейся при ПВТ депрессией, а также протоколы ПВТ больных ХГС с отягощенным психиатрическим анамнезом.
Цель исследования: комплексное клинико-психопатологическое изучение психических нарушений у больных ХГС, получающих противовирусное лечение; определение факторов, влияющих на развитие и структуру психопатологических нарушений; сравнительная оценка психофармакотерапии разными антидепрессантами и разработка дифференцированных рекомендаций по терапии данной категории больных.
Для оценки состояния больных использовались клинико-психопатологический, клинико-катамнестический методы; применялись стандартизованные психометрические шкалы: шкала Монтгомери–Асберг для оценки депрессий (Montgomery–Asberg Depression Rating Scale – MADRS), шкала Бека для самооценки тяжести депрессии (Beck Depression Inventory – BDI), шкалы оценки патологического влечения к алкоголю и к наркотикам.
Для лечения депрессий у больных ХГС применялись антидепрессанты, разные по механизму действия и по спектру психофармакологической активности: миртазапин, тианептин, миансерин, пароксетин, флувоксамин, эсциталопрам, пирлиндол, амитриптилин, кломипрамин. Терапия антидепрессантами оценивалась как эффективная, если отмечалось отчетливое клиническое улучшение состояния и редукция симптомов по шкале MADRS составляла более 50%. Оценивалась скорость снижения выраженности психопатологической симптоматики, отмечался факт достижения ремиссии (клинически и по психометрическим шкалам).
Анализ результатов исследования проводился с использованием методов статистической обработки, включая описательную статистику, непараметрические методы статистического анализа, в том числе медианный тест, критерий «хи-квадрат», методы Мак-Нимара, Манна–Уитни, Вилкоксона, коэффициент ранговой корреляции Спирмена и двусторонний критерий Фишера. Для получения объективной информации о значимости исследовавшихся показателей использовался кластерный и дисперсионный анализ. Достоверным считался уровень значимости p<0,05.
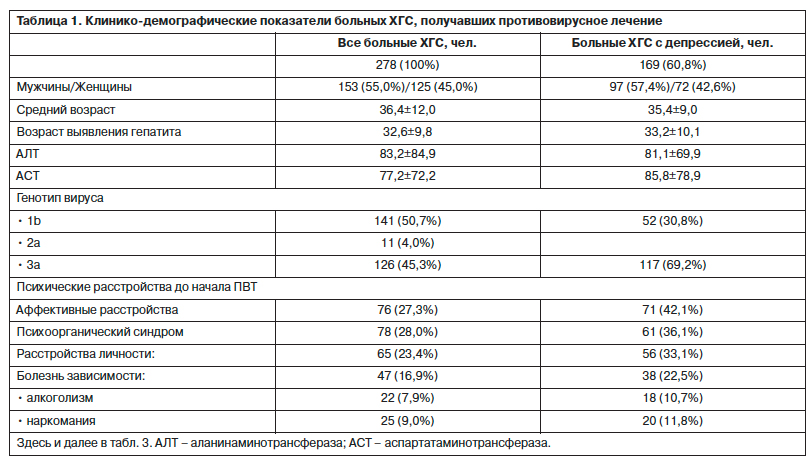
После начала ПВТ у 169 (60,8%) больных ХГС развивалась депрессивная симптоматика разной степени выраженности. Манифестация клинически очерченного депрессивного эпизода приходилась преимущественно на 3–12-ю неделю терапии противовирусными препаратами. При клинико-психопатологической оценке преобладали пациенты с тяжелой и умеренной депрессией – 27 (31,8%) и 25 (29,4%) человек соответственно. Средний суммарный балл выраженности депрессивной симптоматики по шкале MADRS составлял 28,3±5,1. Синдромальная оценка выявленных депрессий показала преобладание тревожных (49,4%) и дисфорических (24,8%) форм. Реже встречались апатическая (10,4%), адинамическая (9,1%) и тоскливая (6,3%) депрессии (рис. 1). Установлено, что наиболее значимым предиктором развития депрессии при ПВТ ХГС является наличие аффективной патологии до начала проведения интерферонотерапии. У больных с аффективными расстройствами в анамнезе депрессия при ПВТ ХГС развивалась существенно чаще, чем в группе больных без депрессии в анамнезе (93,4% против 48,5%). Риск развития депрессии при проведении ПВТ ХГС также был выше у больн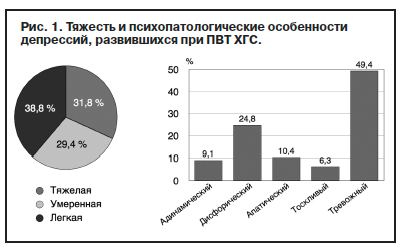 ых с сопутствующей психоорганической патологией, расстройствами личности и отягощенной психопатологической наследственностью. Важным прогностическим фактором развития депрессии при ПВТ являлся генотип вируса: у больных ХГС с генотипом 3a чаще развивалась депрессия, чем у больных с генотипами 1b и 2a.
ых с сопутствующей психоорганической патологией, расстройствами личности и отягощенной психопатологической наследственностью. Важным прогностическим фактором развития депрессии при ПВТ являлся генотип вируса: у больных ХГС с генотипом 3a чаще развивалась депрессия, чем у больных с генотипами 1b и 2a.
Депрессии при применении ИФН имеют ряд клинических особенностей. На фоне выраженного астенического синдрома больные отмечают психическую и/или моторную заторможенность, апатию, нарушения сна при меньшей актуализации собственно симптома сниженного настроения. Особенно ярко в структуре депрессивной симптоматики, наблюдающейся при интерферонотерапии, представлены тревога и раздражительность. Именно эти симптомы сами больные ХГС определяют как наиболее неприятные и мучительные переживания. Тревога и раздражительность наблюдаются более чем у 2/3 больных, получающих ПВТ, что в сочетании с тяжестью депрессивной симптоматики может привести к нарушению приверженности лечению ХГС и выходу из программы ПВТ.
С наибольшей вероятностью депрессии при применении ИФН развиваются в течение первых 12 нед терапии, с максимальным риском – на 3–8-й неделе ПВТ. Астения, наблюдающаяся практически у всех пациентов, получающих интерферонотерапию, может маскировать депрессивную симптоматику. Снижение психической и двигательной активности может характеризовать как тяжелую (что характерно именно для интерферонотерапии) астению, так и развивающуюся депрессию.
Эмоциональная лабильность, нестойкость аффекта, астеническая раздражительность в свою очередь могут ошибочно склонить врача к диагнозу депрессии. Значительную помощь для объективизации клинического впечатления в таких ситуациях оказывают стандартизованные психометрические методики. Врачам-интернистам следует использовать самооценочные шкалы-опросники, предлагая пациентам заполнять их каждые 2 нед после начала применения ИФН. При клиническом осмотре нужно обращать особое внимание на следующие жалобы больных: стойко сниженное настроение, ощущение внутренней психической напряженности, чувство безрадостности, безысходности, нарушения сна с ранним пробуждением, пессимистическими мыслями.
Тактика ведения больных ХГС, получающих интерферонотерапию, предусматривает проведение лечения с учетом клинических и патогенетических особенностей депрессий, развившихся при применении ИФН. Лечение «собственно интерферон-индуцированных» депрессий, т.е. сформировавшихся у больных без сопутствующих психических расстройств (шизофрении, хронической аффективной патологии, болезни зависимости от ПАВ, деменции), как правило, эффективно при применении антидепрессантов разных классов в средних и малых дозах (табл. 2).
Наиболее изученными препаратами, применяемыми при терапии интерферон-индуцированных депрессий, являются антидепрессанты группы селективных ингибиторов обратного захвата серотонина (СИОЗС). Фармакологическое действие препаратов этой группы связано с восстановлением баланса серотонина, в то время как одним из ключевых звеньев патогенеза интерферон-индуцированных депрессий предположительно являются нарушение триптофанового обмена и снижение концентрации нейромедиатора в головном мозге.
В начале 1990-х годов исследователи, столкнувшись с медикаментозной депрессией, развивающейся при применении ИФН, стали применять СИОЗС, опасаясь гепатотоксического эффекта классических трициклических антидепрессантов. С тех пор в литературе накоплены данные об эффективности и хорошей переносимости препаратов этой группы. Одной из важных терапевтических особенностей СИОЗС является противотревожный эффект, что актуально для больных с интерферон-индуцированной депрессией. Учитывая, что лечение таких депрессий проводится преимущественно в условиях общемедицинской сети и амбулаторной практики, сочетание анксиолитического и антидепрессивного эффекта СИОЗС позволяет минимизировать терапевтические схемы и избежать появления нежелательных побочных эффектов, в том числе и связанных с лекарственным взаимодействием. СИОЗС просты и удобны в применении, не требуют значительной титрации дозировок, не оказывают выраженного седативного эффекта и не препятствуют профессиональной деятельности больного. Учитывая, что лечение фармакогенных депрессий предполагает длительный прием антидепрессивной терапии, в том числе и в амбулаторных условиях, перечисленные выше свойства СИОЗС очень важны, так как позволяют распределять прием психо-тропных средств таким образом, чтобы значительно не нарушать распорядок дня пациента.
При выборе антидепрессанта, как уже говорилось, важную роль играют клинические особенности депрессии: выраженность и синдромальная структура депрессивного расстройства. Так, при преобладании в структуре депрессивных переживаний тревоги и нарушений сна рекомендуется применять антидепрессанты с седативным действием: миртазапин, миансерин. При дисфорической депрессии, тревожном синдроме с адинамическим компонентом целесообразно применение препаратов с преимущественно сбалансированным действием: тианептин, флувоксамин, циталопрам, эсциталопрам, сертралин. При апатических, анергических депрессиях – антидепрессанты с преобладанием стимулирующего действия: пирлиндол, пароксетин.
Начинать применять антидепрессанты рекомендуется с минимальных терапевтических дозировок с небыстрым наращиванием доз. Чаще всего интерферон-индуцированные депрессии хорошо поддаются терапии средними и даже низкими дозировками антидепрессантов.
В случае отсутствия эффекта при лечении депрессий одним антидепрессантом применяется комплексная терапия: сочетание антидепрессанта с препаратами других групп (антипсихотики, антиконвульсанты, анксиолитики). При недостаточно выраженном анксиолитическом эффекте антидепрессанта возможно добавление к терапевтической схеме транквилизатора. Рекомендуется применять препараты с наименьшей поведенческой токсичностью и не вызывающие привыкание (грандаксин). Для коррекции нарушений сна возможно кратковременное назначение бензодиазепинов с седативным эффектом (диазепам, клоназепам). При преобладании раздражительности эффективна комплексная терапия антидепрессантом с антиконвульсантом или «мягким» нейролептиком (тиоридазин, хлорпротиксен). При депрессиях с явлениями идеаторного возбуждения целесообразно сочетание антидепрессантов с атипичными нейролептиками (сульпирид, рисперидон, оланзапин). При тяжелых депрессиях, с тоскливым аффектом, при тревожно-ажитированной депрессии показаны трициклические антидепрессанты. Усложнение депрессивного синдрома до появления в его структуре сверхценных образований (в том числе ипохондрического содержания), а тем более бредовых идей, требует пересмотра антидепрессивной терапии и введения в терапевтическую схему антипсихотиков.
Антидепрессивный эффект при лечении интерферон-индуцированных депрессий развивается довольно быстро – уже на 3–4-й неделе применения выраженность депрессивной симптоматики редуцируется более чем вдвое. Соответственно, отсутствие через 3–4 нед после начала терапии клинически значимого эффекта требует коррекции терапии и, возможно, смены антидепрессанта. В такой ситуации рекомендуется назначать препарат другого психофармакологического класса и с более мощным тимолептическим эффектом.
При неэффективности адекватной тимоаналептической терапии интерферон-индуцированной депрессии возможно проведение коррекции схемы проведения ПВТ – замена препаратов ИФН пролонгированного действия на препараты короткого действия (применение пегилированного ИФН является отрицательным предиктором эффективности терапии антидепрессантами).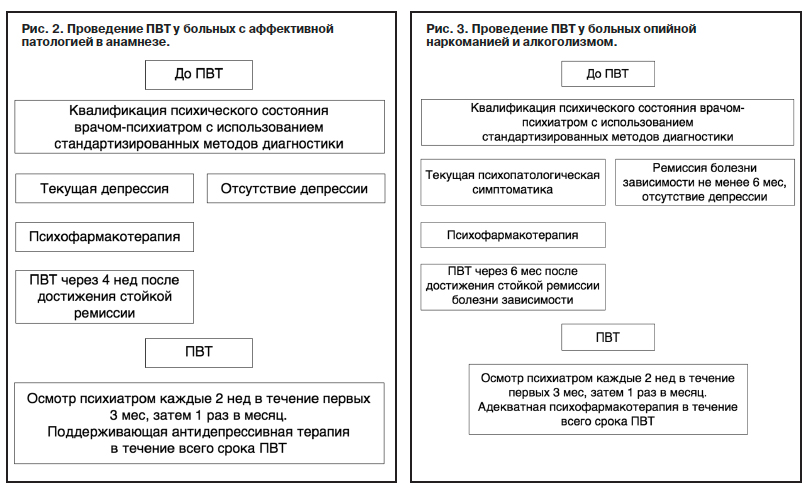
При достижении ремиссии суточные дозы препарата снижают постепенно: резкое снижение доз или отмена препарата может спровоцировать синдром отмены, ухудшение как психического, так и соматического состояния. По данным многих авторов, депрессивные симптомы могут сохраняться у больных ХГС до 6 мес после отмены ПВТ [6, 7]. Рекомендуется продолжать терапию антидепрессантами как минимум в течение 3 мес после завершения курса ПВТ.
Тяжелая некупируемая депрессия с суицидальными мыслями является показанием для немедленной госпитализации в психиатрический стационар и рассмотрения вопроса об отмене противовирусного лечения.
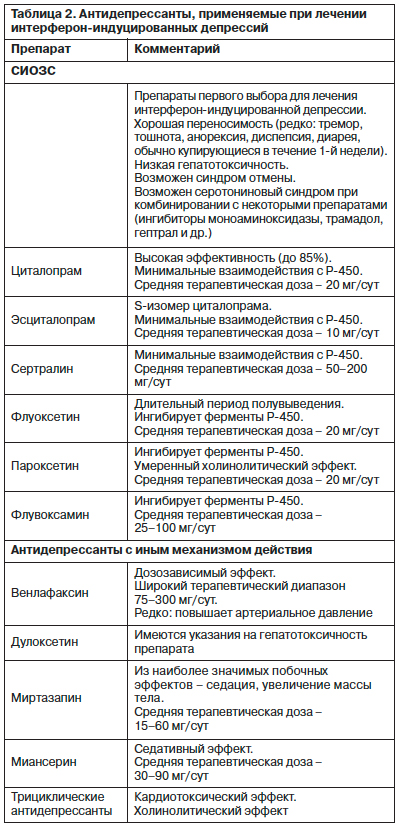
При развитии депрессии при ПВТ ХГС у больных с аффективными расстройствами в анамнезе (рис. 2) необходимо дифференцировать интерферон-индуцированную депрессию от эндогенной депрессивной фазы, спровоцированной и модифицированной ИФН. Жалобы на тревогу, раздражительность, большая выраженность депрессии, быстрое развитие антидепрессивного эффекта говорят в пользу депрессий первого типа.
Такие депрессии высококурабельны, не требуют применения высоких доз антидепрессантов. Наличие в структуре депрессии меланхолических жалоб, медленная редукция симптоматики при терапии антидепрессантами свидетельствуют о развившейся эндогенной депрессивной фазе, требующей иного терапевтического подхода. Здесь эффективно применение более «мощных» антидепрессантов (в первую очередь трициклических) в более высоких дозах. Желаемый терапевтический эффект достигается, как правило, при сочетании антидепрессантов с малыми нейролептиками седативного действия (сонапакс, хлорпротиксен) или с транквилизаторами (феназепам, диазепам, грандаксин). Как и при других хронических аффективных заболеваниях, таким больным необходимо назначение поддерживающей противорецидивной терапии в сочетании с препаратами, стабилизирующими настроение.
Вопрос проведения ПВТ ХГС больным наркоманией и алкоголизмом (рис. 3) должен решаться совместно с психиатром-наркологом. Главным условием проведения ПВТ таким больным является полный отказ от приема ПАВ (с целью повышения эффективности ПВТ, сохранения приверженности терапии и снижения риска психиатрических осложнений интерферонотерапии). Проведение ПВТ ХГС у больных с сопутствующей болезнью зависимости от ПАВ возможно при врачебном катамнестическом прослеживании ремиссии (отказа от употребления ПАВ) сроком не менее 6 мес.
Тактика ведения таких пациентов обязательно должна включать квалифицированную оценку синдрома патологического влечения к ПАВ с адекватной психофармакотерапией всех его компонентов. Появление симптомов депрессивного круга, как правило, свидетельствует об усилении патологического влечения к ПАВ и угрозе рецидива болезни зависимости.
Для лечения депрессий, развившихся при ПВТ ХГС у больных опийной наркоманией и алкоголизмом, следует назначать антидепрессанты с преобладанием седативного и снотворного компонента действия (амитриптилин, миртазапин, миансерин). Психофармакотерапию необходимо проводить комплексом препаратов: антидепрессанты в сочетании с антипсихотическими препаратами и/или антиконвульсантами – стабилизаторами настроения. Комплексную терапию следует продолжать длительное время, так как психофармакологический контроль симптоматики патологического влечения к ПАВ снижает риск рецидива наркомании и алкоголизма и позволяет проводить ПВТ ХГС в полном объеме.
Психофармакотерапия депрессий, развившихся при проведении ПВТ ХГС у больных опийной наркоманией, требует применения более высоких дозировок лекарств и более высокоактивных препаратов, чем у больных
алкоголизмом (см. рис. 3). В комплексной терапии больных наркоманией лучше использовать такие антипсихотики, как галоперидол, кветиапин и клозапин; у больных алкоголизмом – тиоридазин и галоперидол (в меньших дозах).
Психофармакотерапия депрессивных расстройств, развивающихся при проведении ПВТ ХГС, проводилась с учетом требований к ее применению в соматопсихиатрической практике. Выбор антидепрессанта и дозы препарата проводился в соответствии с синдромальной структурой депрессии, соматическим состоянием больного, возрастом, индивидуальной переносимостью, учетом рекомендаций по лечению больных с заболеваниями печени. При необходимости (для купирования бессонницы, коррекции грубых психопатоподобных и дисфорических расстройств) дополнительно назначались препараты других фармакологических групп: антипсихотики (в малых дозах с целью коррекции поведения и усиления снотворного действия антидепрессанта), антиконвульсанты, анксиолитики.
Несмотря на тяжесть депрессивных расстройств, у больных ХГС, получавших противовирусное лечение, отмечена высокая эффективность антидепрессивной терапии. У всех больных, получавших антидепрессанты, клинически отмечено улучшение психического состояния. Доля больных с 50% редукцией депрессивной симптоматики после 12 нед терапии антидепрессантами составила 78,5%. Выявлены факторы, достоверно влияющие на эффективность антидепрессивной терапии, причем наиболее интересной представляется взаимосвязь большей исходной тяжести депрессии с эффективностью психофармакотерапии (табл. 3). Купирование симптомов депрессии позволило продолжить проведение интерферонотерапии в полном объеме у большинства включенных в исследование больных.
Не удалось продолжить противовирусное лечение у 10 (5,9%) больных: у 5 больных депрессивная симптоматика являлась проявлением обострения патологического влечения к ПАВ, причиной выхода из исследования становились отсутствие достаточного комплаенса и рецидив болезни зависимости; в 2 случаях больные отказались от продолжения ПВТ после развития тяжелой депрессии; 3 больных выбыли из программы ПВТ по причине развития тяжелых соматических осложнений интерферонотерапии.
При оценке переносимости антидепрессивной терапии выявлено, что исследуемые антидепрессанты хорошо переносятся больными ХГС. В процессе исследования возникали побочные эффекты, однако они расценивались как легкие или умеренно выраженные и не требовали отмены терапии. Ни один из включенных в исследование больных не выбыл до окончания курса лечения антидепрессантами из-за развития побочных эффектов их применения.
Самостоятельным аспектом исследования являлась разработка рекомендаций по диагностике и лечению интерферон-индуцированных депрессий, направленная на усовершенствование и оптимизацию тактики ведения больных гепатитом С, получающих противовирусное лечение.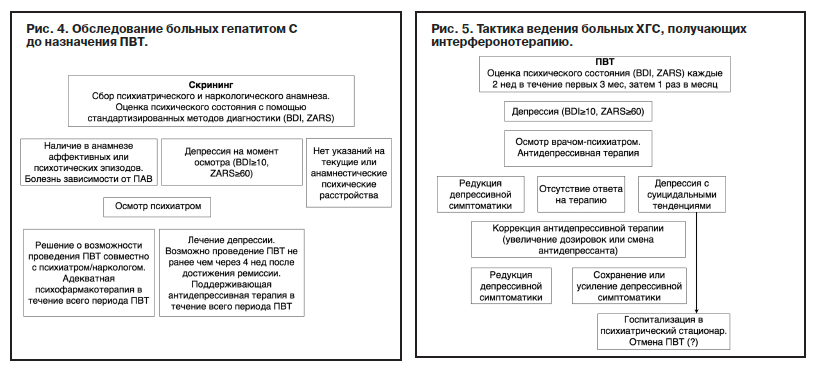
Алгоритм действий психиатра на всех этапах (диагностика, процесс терапии депрессий, назначение ПВТ, оценка динамики, поддерживающая терапия) представлен на рис. 4 и 5; сформулированы принципы ведения изученного контингента.
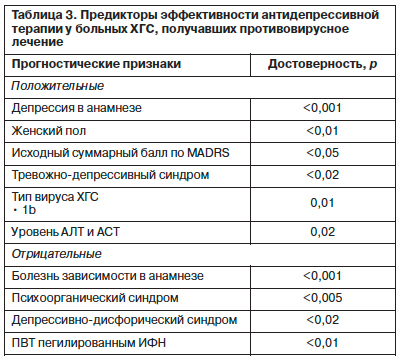
При решении вопроса о проведении ПВТ врачу-интернисту особое внимание следует обращать на психическое состояние больных с такими факторами риска, как аффективная патология и злоупотребление ПАВ в анамнезе, а также на наличие текущих психических расстройств (особенно патологии личности, в том числе органического генеза).
Оценку психического состояния больных рекомендуется проводить с использованием самооценочных шкал-опросников.
Наибольшую валидность при диагностике интерферон-индуцированных депрессий имеют шкала для самооценки депрессии Цунга (Zung Self-Rating Depression Scale – ZARS) и шкала для самооценки тяжести депрессии Бека [8, 9]. Состояние депрессии диагностируется при суммарном балле 60 и выше по шкале Цунга либо при суммарном балле 10 и выше по шкале Бека.
Наличие депрессивной симптоматики, а также выявленные в ходе опроса сведения о текущих или анамнестических психических расстройствах являются показанием для привлечения к диагностическому процессу врача-психиатра.
Необходимо помнить, что применение ИФН провоцирует как развитие депрессии, так и утяжеление уже имеющейся депрессивной симптоматики. Соответственно, выявление до начала интерферонотерапии депрессии, в том числе легкой или даже субклинической, является показанием для проведения психофармакотерапии.
Выбор антидепрессанта, дозировок и сроков терапии определяется врачом в индивидуальном порядке с учетом тяжести психического расстройства, соматического состояния, сопутствующей психической патологии. При редукции депрессивной симптоматики проведение ПВТ возможно не менее чем через 4 нед после стойкого улучшения настроения.
Всем пациентам с момента начала ПВТ (см. рис. 5) необходимо динамическое наблюдение лечащим врачом с целью как можно более раннего выявления развития психиатрических осложнений интерферонотерапии.
2. Рекуррентное депрессивное расстройство и болезнь зависимости не являются противопоказанием для назначения ПВТ больным ХГС. При проведении адекватных диагностических и терапевтических мероприятий удается не только купировать психопатологическую симптоматику, но и продолжить интерферонотерапию в полном объеме.
3. Психофармакотерапия интерферон-индуцированных депрессий успешна более чем у 3/4 больных. Учитывая высокую частоту развития интерферон-индуцированных депрессий, их тяжесть, отрицательное влияние на эффективность ПВТ, обусловленное снижением приверженности программе противовирусного лечения, необходимы своевременная диагностика и адекватное лечение этих расстройств. Купирование депрессивной симптоматики, развивающейся при ПВТ ХГС, повышает эффективность терапии основного заболевания, позволяет «сохранить» пациента в программе противовирусного лечения.
Кинкулькина Марина Аркадьевна – д-р мед. наук, проф. каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: kinkulkina@gmail.com
Тихонова Юлия Гулямовна – канд. мед. наук, ассистент каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России
Авдеева Татьяна Ивановна – д-р мед. наук, доц. каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ
им. И.М.Сеченова; зав. НИО Психического здоровья НОК Центра «Психическое здоровье» ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: t.i.avdeeva@gmail.com
Морозов Дмитрий Игоревич – канд. мед. наук, ассистент каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России
Волков Алексей Владимирович – канд. мед. наук, зав. 4-м общепсихиатрическим отд-нием Клиники психиатрии
им. С.С.Корсакова Университетской клинической больницы №3 ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава
России
Ключевые слова: хронический гепатит С, интерферонотерапия, депрессия, психофармакотерапия.
Depression during interferon therapy for hepatitis C:
diagnosis and treatment
N.N.Ivanets, M.A.Kinkulkina, Yu.G.Tikhonova, T.I.Avdeeva, D.I.Morozov, A.V.Volkov
Department of Psychiatry and Addiction, Sechenov First Moscow State Medical University Russian Ministry of Health
Summary. 278 patients with chronic hepatitis C treated with interferon therapy were observed. Depression developed in 169 patients during antiviral therapy. Clinical and therapeutic features of this depression have been defined. Predictors of depression and factors influencing the psychopathology of depressive syndrome have been identified. Guidelines for diagnosis and treatment of interferon-induced depression have been developed.
Key words: chronic hepatitis C, interferon therapy, depression, psychopharmacotherapy.
Хронический гепатит С (ХГС) – одно из наиболее распространенных в мире инфекционных заболеваний, вызывающих тяжелые медицинские и социальные последствия [1, 2]. Адекватная противовирусная терапия (ПВТ) ХГС всегда включает препараты интерферона a (ИФН-a) – отдельно или в комбинации с другими противовирусными средствами. ИФН необходимо применять длительно, в высоких дозах. Применение ИФН-a способствует возникновению психопатологической симптоматики, преимущественно депрессии [3–5]. Однако нет единого мнения как относительно частоты возникновения депрессивных расстройств при ПВТ ХГС, так и их психопатологической квалификации, прогностической значимости для эффективности ПВТ. Существуют разные точки зрения на возможность продолжения курса ПВТ при развитии психических нарушений. До настоящего времени отсутствуют четкие регламентированные стандарты проведения ПВТ у больных ХГС с развившейся при ПВТ депрессией, а также протоколы ПВТ больных ХГС с отягощенным психиатрическим анамнезом.
Цель исследования: комплексное клинико-психопатологическое изучение психических нарушений у больных ХГС, получающих противовирусное лечение; определение факторов, влияющих на развитие и структуру психопатологических нарушений; сравнительная оценка психофармакотерапии разными антидепрессантами и разработка дифференцированных рекомендаций по терапии данной категории больных.
Материалы и методы
Проведено проспективное исследование больных ХГС старше 18 лет, получавших противовирусное лечение препаратами ИФН. Больные проходили стационарное или амбулаторное лечение в Клинике нефрологии, внутренних и профессиональных болезней им. Е.М.Тареева ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России с 2003 по 2012 г. В исследование не включались больные с шизофренией и шизоаффективным расстройством; с тяжелой соматической патологией, приводящей к появлению дополнительной психопатологической симптоматики (в том числе цирроз печени и проявления печеночной энцефалопатии); больные, злоупотреблявшие психоактивными веществами (ПАВ), включая алкоголь, в течение 6 мес до начала ПВТ.Для оценки состояния больных использовались клинико-психопатологический, клинико-катамнестический методы; применялись стандартизованные психометрические шкалы: шкала Монтгомери–Асберг для оценки депрессий (Montgomery–Asberg Depression Rating Scale – MADRS), шкала Бека для самооценки тяжести депрессии (Beck Depression Inventory – BDI), шкалы оценки патологического влечения к алкоголю и к наркотикам.
Для лечения депрессий у больных ХГС применялись антидепрессанты, разные по механизму действия и по спектру психофармакологической активности: миртазапин, тианептин, миансерин, пароксетин, флувоксамин, эсциталопрам, пирлиндол, амитриптилин, кломипрамин. Терапия антидепрессантами оценивалась как эффективная, если отмечалось отчетливое клиническое улучшение состояния и редукция симптомов по шкале MADRS составляла более 50%. Оценивалась скорость снижения выраженности психопатологической симптоматики, отмечался факт достижения ремиссии (клинически и по психометрическим шкалам).
Анализ результатов исследования проводился с использованием методов статистической обработки, включая описательную статистику, непараметрические методы статистического анализа, в том числе медианный тест, критерий «хи-квадрат», методы Мак-Нимара, Манна–Уитни, Вилкоксона, коэффициент ранговой корреляции Спирмена и двусторонний критерий Фишера. Для получения объективной информации о значимости исследовавшихся показателей использовался кластерный и дисперсионный анализ. Достоверным считался уровень значимости p<0,05.
Результаты
Было обследовано 278 больных ХГС. Их клинико-демографические характеристики представлены в табл. 1. До начала ПВТ уровень депрессии у 90% больных был ниже порогового значения для ремиссии (по субъективной и врачебной оценке – шкалы BDI и MADRS соответственно); у 10% больных превышение порога ремиссии составляло 1–2 балла, выявлялись отдельные депрессивные симптомы, клинически не достигавшие уровня очерченного депрессивного синдрома.
После начала ПВТ у 169 (60,8%) больных ХГС развивалась депрессивная симптоматика разной степени выраженности. Манифестация клинически очерченного депрессивного эпизода приходилась преимущественно на 3–12-ю неделю терапии противовирусными препаратами. При клинико-психопатологической оценке преобладали пациенты с тяжелой и умеренной депрессией – 27 (31,8%) и 25 (29,4%) человек соответственно. Средний суммарный балл выраженности депрессивной симптоматики по шкале MADRS составлял 28,3±5,1. Синдромальная оценка выявленных депрессий показала преобладание тревожных (49,4%) и дисфорических (24,8%) форм. Реже встречались апатическая (10,4%), адинамическая (9,1%) и тоскливая (6,3%) депрессии (рис. 1). Установлено, что наиболее значимым предиктором развития депрессии при ПВТ ХГС является наличие аффективной патологии до начала проведения интерферонотерапии. У больных с аффективными расстройствами в анамнезе депрессия при ПВТ ХГС развивалась существенно чаще, чем в группе больных без депрессии в анамнезе (93,4% против 48,5%). Риск развития депрессии при проведении ПВТ ХГС также был выше у больн
 ых с сопутствующей психоорганической патологией, расстройствами личности и отягощенной психопатологической наследственностью. Важным прогностическим фактором развития депрессии при ПВТ являлся генотип вируса: у больных ХГС с генотипом 3a чаще развивалась депрессия, чем у больных с генотипами 1b и 2a.
ых с сопутствующей психоорганической патологией, расстройствами личности и отягощенной психопатологической наследственностью. Важным прогностическим фактором развития депрессии при ПВТ являлся генотип вируса: у больных ХГС с генотипом 3a чаще развивалась депрессия, чем у больных с генотипами 1b и 2a.
Депрессии при применении ИФН имеют ряд клинических особенностей. На фоне выраженного астенического синдрома больные отмечают психическую и/или моторную заторможенность, апатию, нарушения сна при меньшей актуализации собственно симптома сниженного настроения. Особенно ярко в структуре депрессивной симптоматики, наблюдающейся при интерферонотерапии, представлены тревога и раздражительность. Именно эти симптомы сами больные ХГС определяют как наиболее неприятные и мучительные переживания. Тревога и раздражительность наблюдаются более чем у 2/3 больных, получающих ПВТ, что в сочетании с тяжестью депрессивной симптоматики может привести к нарушению приверженности лечению ХГС и выходу из программы ПВТ.
С наибольшей вероятностью депрессии при применении ИФН развиваются в течение первых 12 нед терапии, с максимальным риском – на 3–8-й неделе ПВТ. Астения, наблюдающаяся практически у всех пациентов, получающих интерферонотерапию, может маскировать депрессивную симптоматику. Снижение психической и двигательной активности может характеризовать как тяжелую (что характерно именно для интерферонотерапии) астению, так и развивающуюся депрессию.
Эмоциональная лабильность, нестойкость аффекта, астеническая раздражительность в свою очередь могут ошибочно склонить врача к диагнозу депрессии. Значительную помощь для объективизации клинического впечатления в таких ситуациях оказывают стандартизованные психометрические методики. Врачам-интернистам следует использовать самооценочные шкалы-опросники, предлагая пациентам заполнять их каждые 2 нед после начала применения ИФН. При клиническом осмотре нужно обращать особое внимание на следующие жалобы больных: стойко сниженное настроение, ощущение внутренней психической напряженности, чувство безрадостности, безысходности, нарушения сна с ранним пробуждением, пессимистическими мыслями.
Тактика ведения больных ХГС, получающих интерферонотерапию, предусматривает проведение лечения с учетом клинических и патогенетических особенностей депрессий, развившихся при применении ИФН. Лечение «собственно интерферон-индуцированных» депрессий, т.е. сформировавшихся у больных без сопутствующих психических расстройств (шизофрении, хронической аффективной патологии, болезни зависимости от ПАВ, деменции), как правило, эффективно при применении антидепрессантов разных классов в средних и малых дозах (табл. 2).

Наиболее изученными препаратами, применяемыми при терапии интерферон-индуцированных депрессий, являются антидепрессанты группы селективных ингибиторов обратного захвата серотонина (СИОЗС). Фармакологическое действие препаратов этой группы связано с восстановлением баланса серотонина, в то время как одним из ключевых звеньев патогенеза интерферон-индуцированных депрессий предположительно являются нарушение триптофанового обмена и снижение концентрации нейромедиатора в головном мозге.
В начале 1990-х годов исследователи, столкнувшись с медикаментозной депрессией, развивающейся при применении ИФН, стали применять СИОЗС, опасаясь гепатотоксического эффекта классических трициклических антидепрессантов. С тех пор в литературе накоплены данные об эффективности и хорошей переносимости препаратов этой группы. Одной из важных терапевтических особенностей СИОЗС является противотревожный эффект, что актуально для больных с интерферон-индуцированной депрессией. Учитывая, что лечение таких депрессий проводится преимущественно в условиях общемедицинской сети и амбулаторной практики, сочетание анксиолитического и антидепрессивного эффекта СИОЗС позволяет минимизировать терапевтические схемы и избежать появления нежелательных побочных эффектов, в том числе и связанных с лекарственным взаимодействием. СИОЗС просты и удобны в применении, не требуют значительной титрации дозировок, не оказывают выраженного седативного эффекта и не препятствуют профессиональной деятельности больного. Учитывая, что лечение фармакогенных депрессий предполагает длительный прием антидепрессивной терапии, в том числе и в амбулаторных условиях, перечисленные выше свойства СИОЗС очень важны, так как позволяют распределять прием психо-тропных средств таким образом, чтобы значительно не нарушать распорядок дня пациента.
При выборе антидепрессанта, как уже говорилось, важную роль играют клинические особенности депрессии: выраженность и синдромальная структура депрессивного расстройства. Так, при преобладании в структуре депрессивных переживаний тревоги и нарушений сна рекомендуется применять антидепрессанты с седативным действием: миртазапин, миансерин. При дисфорической депрессии, тревожном синдроме с адинамическим компонентом целесообразно применение препаратов с преимущественно сбалансированным действием: тианептин, флувоксамин, циталопрам, эсциталопрам, сертралин. При апатических, анергических депрессиях – антидепрессанты с преобладанием стимулирующего действия: пирлиндол, пароксетин.
Начинать применять антидепрессанты рекомендуется с минимальных терапевтических дозировок с небыстрым наращиванием доз. Чаще всего интерферон-индуцированные депрессии хорошо поддаются терапии средними и даже низкими дозировками антидепрессантов.
В случае отсутствия эффекта при лечении депрессий одним антидепрессантом применяется комплексная терапия: сочетание антидепрессанта с препаратами других групп (антипсихотики, антиконвульсанты, анксиолитики). При недостаточно выраженном анксиолитическом эффекте антидепрессанта возможно добавление к терапевтической схеме транквилизатора. Рекомендуется применять препараты с наименьшей поведенческой токсичностью и не вызывающие привыкание (грандаксин). Для коррекции нарушений сна возможно кратковременное назначение бензодиазепинов с седативным эффектом (диазепам, клоназепам). При преобладании раздражительности эффективна комплексная терапия антидепрессантом с антиконвульсантом или «мягким» нейролептиком (тиоридазин, хлорпротиксен). При депрессиях с явлениями идеаторного возбуждения целесообразно сочетание антидепрессантов с атипичными нейролептиками (сульпирид, рисперидон, оланзапин). При тяжелых депрессиях, с тоскливым аффектом, при тревожно-ажитированной депрессии показаны трициклические антидепрессанты. Усложнение депрессивного синдрома до появления в его структуре сверхценных образований (в том числе ипохондрического содержания), а тем более бредовых идей, требует пересмотра антидепрессивной терапии и введения в терапевтическую схему антипсихотиков.
Антидепрессивный эффект при лечении интерферон-индуцированных депрессий развивается довольно быстро – уже на 3–4-й неделе применения выраженность депрессивной симптоматики редуцируется более чем вдвое. Соответственно, отсутствие через 3–4 нед после начала терапии клинически значимого эффекта требует коррекции терапии и, возможно, смены антидепрессанта. В такой ситуации рекомендуется назначать препарат другого психофармакологического класса и с более мощным тимолептическим эффектом.
При неэффективности адекватной тимоаналептической терапии интерферон-индуцированной депрессии возможно проведение коррекции схемы проведения ПВТ – замена препаратов ИФН пролонгированного действия на препараты короткого действия (применение пегилированного ИФН является отрицательным предиктором эффективности терапии антидепрессантами).

При достижении ремиссии суточные дозы препарата снижают постепенно: резкое снижение доз или отмена препарата может спровоцировать синдром отмены, ухудшение как психического, так и соматического состояния. По данным многих авторов, депрессивные симптомы могут сохраняться у больных ХГС до 6 мес после отмены ПВТ [6, 7]. Рекомендуется продолжать терапию антидепрессантами как минимум в течение 3 мес после завершения курса ПВТ.
Тяжелая некупируемая депрессия с суицидальными мыслями является показанием для немедленной госпитализации в психиатрический стационар и рассмотрения вопроса об отмене противовирусного лечения.
При развитии депрессии при ПВТ ХГС у больных с аффективными расстройствами в анамнезе (рис. 2) необходимо дифференцировать интерферон-индуцированную депрессию от эндогенной депрессивной фазы, спровоцированной и модифицированной ИФН. Жалобы на тревогу, раздражительность, большая выраженность депрессии, быстрое развитие антидепрессивного эффекта говорят в пользу депрессий первого типа.
Такие депрессии высококурабельны, не требуют применения высоких доз антидепрессантов. Наличие в структуре депрессии меланхолических жалоб, медленная редукция симптоматики при терапии антидепрессантами свидетельствуют о развившейся эндогенной депрессивной фазе, требующей иного терапевтического подхода. Здесь эффективно применение более «мощных» антидепрессантов (в первую очередь трициклических) в более высоких дозах. Желаемый терапевтический эффект достигается, как правило, при сочетании антидепрессантов с малыми нейролептиками седативного действия (сонапакс, хлорпротиксен) или с транквилизаторами (феназепам, диазепам, грандаксин). Как и при других хронических аффективных заболеваниях, таким больным необходимо назначение поддерживающей противорецидивной терапии в сочетании с препаратами, стабилизирующими настроение.
Вопрос проведения ПВТ ХГС больным наркоманией и алкоголизмом (рис. 3) должен решаться совместно с психиатром-наркологом. Главным условием проведения ПВТ таким больным является полный отказ от приема ПАВ (с целью повышения эффективности ПВТ, сохранения приверженности терапии и снижения риска психиатрических осложнений интерферонотерапии). Проведение ПВТ ХГС у больных с сопутствующей болезнью зависимости от ПАВ возможно при врачебном катамнестическом прослеживании ремиссии (отказа от употребления ПАВ) сроком не менее 6 мес.
Тактика ведения таких пациентов обязательно должна включать квалифицированную оценку синдрома патологического влечения к ПАВ с адекватной психофармакотерапией всех его компонентов. Появление симптомов депрессивного круга, как правило, свидетельствует об усилении патологического влечения к ПАВ и угрозе рецидива болезни зависимости.
Для лечения депрессий, развившихся при ПВТ ХГС у больных опийной наркоманией и алкоголизмом, следует назначать антидепрессанты с преобладанием седативного и снотворного компонента действия (амитриптилин, миртазапин, миансерин). Психофармакотерапию необходимо проводить комплексом препаратов: антидепрессанты в сочетании с антипсихотическими препаратами и/или антиконвульсантами – стабилизаторами настроения. Комплексную терапию следует продолжать длительное время, так как психофармакологический контроль симптоматики патологического влечения к ПАВ снижает риск рецидива наркомании и алкоголизма и позволяет проводить ПВТ ХГС в полном объеме.
Психофармакотерапия депрессий, развившихся при проведении ПВТ ХГС у больных опийной наркоманией, требует применения более высоких дозировок лекарств и более высокоактивных препаратов, чем у больных
алкоголизмом (см. рис. 3). В комплексной терапии больных наркоманией лучше использовать такие антипсихотики, как галоперидол, кветиапин и клозапин; у больных алкоголизмом – тиоридазин и галоперидол (в меньших дозах).
Психофармакотерапия депрессивных расстройств, развивающихся при проведении ПВТ ХГС, проводилась с учетом требований к ее применению в соматопсихиатрической практике. Выбор антидепрессанта и дозы препарата проводился в соответствии с синдромальной структурой депрессии, соматическим состоянием больного, возрастом, индивидуальной переносимостью, учетом рекомендаций по лечению больных с заболеваниями печени. При необходимости (для купирования бессонницы, коррекции грубых психопатоподобных и дисфорических расстройств) дополнительно назначались препараты других фармакологических групп: антипсихотики (в малых дозах с целью коррекции поведения и усиления снотворного действия антидепрессанта), антиконвульсанты, анксиолитики.
Несмотря на тяжесть депрессивных расстройств, у больных ХГС, получавших противовирусное лечение, отмечена высокая эффективность антидепрессивной терапии. У всех больных, получавших антидепрессанты, клинически отмечено улучшение психического состояния. Доля больных с 50% редукцией депрессивной симптоматики после 12 нед терапии антидепрессантами составила 78,5%. Выявлены факторы, достоверно влияющие на эффективность антидепрессивной терапии, причем наиболее интересной представляется взаимосвязь большей исходной тяжести депрессии с эффективностью психофармакотерапии (табл. 3). Купирование симптомов депрессии позволило продолжить проведение интерферонотерапии в полном объеме у большинства включенных в исследование больных.

Не удалось продолжить противовирусное лечение у 10 (5,9%) больных: у 5 больных депрессивная симптоматика являлась проявлением обострения патологического влечения к ПАВ, причиной выхода из исследования становились отсутствие достаточного комплаенса и рецидив болезни зависимости; в 2 случаях больные отказались от продолжения ПВТ после развития тяжелой депрессии; 3 больных выбыли из программы ПВТ по причине развития тяжелых соматических осложнений интерферонотерапии.
При оценке переносимости антидепрессивной терапии выявлено, что исследуемые антидепрессанты хорошо переносятся больными ХГС. В процессе исследования возникали побочные эффекты, однако они расценивались как легкие или умеренно выраженные и не требовали отмены терапии. Ни один из включенных в исследование больных не выбыл до окончания курса лечения антидепрессантами из-за развития побочных эффектов их применения.
Самостоятельным аспектом исследования являлась разработка рекомендаций по диагностике и лечению интерферон-индуцированных депрессий, направленная на усовершенствование и оптимизацию тактики ведения больных гепатитом С, получающих противовирусное лечение.

Алгоритм действий психиатра на всех этапах (диагностика, процесс терапии депрессий, назначение ПВТ, оценка динамики, поддерживающая терапия) представлен на рис. 4 и 5; сформулированы принципы ведения изученного контингента.
При решении вопроса о проведении ПВТ врачу-интернисту особое внимание следует обращать на психическое состояние больных с такими факторами риска, как аффективная патология и злоупотребление ПАВ в анамнезе, а также на наличие текущих психических расстройств (особенно патологии личности, в том числе органического генеза).
Оценку психического состояния больных рекомендуется проводить с использованием самооценочных шкал-опросников.
Наибольшую валидность при диагностике интерферон-индуцированных депрессий имеют шкала для самооценки депрессии Цунга (Zung Self-Rating Depression Scale – ZARS) и шкала для самооценки тяжести депрессии Бека [8, 9]. Состояние депрессии диагностируется при суммарном балле 60 и выше по шкале Цунга либо при суммарном балле 10 и выше по шкале Бека.
Наличие депрессивной симптоматики, а также выявленные в ходе опроса сведения о текущих или анамнестических психических расстройствах являются показанием для привлечения к диагностическому процессу врача-психиатра.
Необходимо помнить, что применение ИФН провоцирует как развитие депрессии, так и утяжеление уже имеющейся депрессивной симптоматики. Соответственно, выявление до начала интерферонотерапии депрессии, в том числе легкой или даже субклинической, является показанием для проведения психофармакотерапии.
Выбор антидепрессанта, дозировок и сроков терапии определяется врачом в индивидуальном порядке с учетом тяжести психического расстройства, соматического состояния, сопутствующей психической патологии. При редукции депрессивной симптоматики проведение ПВТ возможно не менее чем через 4 нед после стойкого улучшения настроения.
Всем пациентам с момента начала ПВТ (см. рис. 5) необходимо динамическое наблюдение лечащим врачом с целью как можно более раннего выявления развития психиатрических осложнений интерферонотерапии.
Заключение
1. ПВТ ХГС более чем у 50% больных сопровождается развитием депрессий. Преобладают депрессии умеренной и тяжелой степени выраженности с тревожной и дисфорической симптоматикой. Манифестация клинически очерченного депрессивного эпизода чаще всего происходит на 3–12-й неделе терапии противовирусными препаратами.2. Рекуррентное депрессивное расстройство и болезнь зависимости не являются противопоказанием для назначения ПВТ больным ХГС. При проведении адекватных диагностических и терапевтических мероприятий удается не только купировать психопатологическую симптоматику, но и продолжить интерферонотерапию в полном объеме.
3. Психофармакотерапия интерферон-индуцированных депрессий успешна более чем у 3/4 больных. Учитывая высокую частоту развития интерферон-индуцированных депрессий, их тяжесть, отрицательное влияние на эффективность ПВТ, обусловленное снижением приверженности программе противовирусного лечения, необходимы своевременная диагностика и адекватное лечение этих расстройств. Купирование депрессивной симптоматики, развивающейся при ПВТ ХГС, повышает эффективность терапии основного заболевания, позволяет «сохранить» пациента в программе противовирусного лечения.
Сведения об авторах
Иванец Николай Николаевич – д-р мед. наук, проф., зав. каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России; чл.-кор. РАН. E-mail: nivanets@mail.ruКинкулькина Марина Аркадьевна – д-р мед. наук, проф. каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: kinkulkina@gmail.com
Тихонова Юлия Гулямовна – канд. мед. наук, ассистент каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России
Авдеева Татьяна Ивановна – д-р мед. наук, доц. каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ
им. И.М.Сеченова; зав. НИО Психического здоровья НОК Центра «Психическое здоровье» ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: t.i.avdeeva@gmail.com
Морозов Дмитрий Игоревич – канд. мед. наук, ассистент каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России
Волков Алексей Владимирович – канд. мед. наук, зав. 4-м общепсихиатрическим отд-нием Клиники психиатрии
им. С.С.Корсакова Университетской клинической больницы №3 ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава
России
Список исп. литературыСкрыть список1. Игнатова Т.М. Хронический гепатит С: клинико-морфологическая характеристика, течение, лечение. Автореф. дис. … д-ра мед. наук. М., 2000.
2. Sockalingam S, Abbey SE. Managing depression during hepatitis C treatment. Can J Psychiatry 2009; 54 (9): 614–25.
3. Crone C, Gabriel GM, Wise TN. Managing the neuropsychiatric side effects of interferon-based therapy for hepatitis C. Cleve Clin J Med 2004; 71 (Suppl. 3): 27–32.
4. Pavlović Z, Delić D, Marić NP et al. Depressive symptoms in patients with hepatitis C treated with pegylated interferon alpha therapy: a
24-week prospective study. Psychiatr Danub 2011; 23 (4): 370–7.
5. Shakoor A, Shafqat F, Mehmud T et al. Frequency of depression and somatic symptoms in patients on interferon alpha/ribavirin for chronic hepatitis C. J Ayub Med Coll Abbottabad 2010; 22 (4): 6–9.
6. Gohier B, Goeb JL, Rannou-Dubas K et al. Hepatitis C, alpha interferon, anxiety and depression disorders: a prospective study of 71 patients. World J Biol Psychiatry 2003; 4 (3): 115–8.
7. Nickel T, Sonntag A, Backmund M et al. Depression during therapy with interferon alpha – how long should antidepressant treatment last? Pharmacopsichiatry 2005; 38 (2): 102–4.
8. Robaeys G, Buntinx F. Treatment of hepatitis C viral infections in substance abusers. Acta Gastroenterol Belg 2005; 68 (1): 55–67.
9. Holtzheimer PE, Veitengruber J, Wang CC et al. Utility of the Beck Depression Inventory to screen for and track depression in injection drug users seeking hepatitis C treatment. Gen Hosp Psychiatry 2010; 32 (4): 426–32.


