Психиатрия Всемирная психиатрия
Психиатрия Всемирная психиатрия
№02 2020
Безопасность применения 80 антидепрессантов, антипсихотиков, препаратов для лечения синдрома дефицита внимания и гиперактивности, стабилизаторов настроения у детей и подростков с психическими расстройствами: крупномасштабный систематический метаобзор 78 н №02 2020
Номера страниц в выпуске:214-232
Резюме
Психические расстройства часто начинаются в детском или подростковом возрасте. Психотропные препараты имеют различные показания для лечения психических расстройств в этой возрастной группе и нередко используются «офф-лейбл» (не в соответствии с инструкцией по применению). Однако побочные эффекты этих препаратов требуют особого внимания в течение критических периодов развития. Для проведения настоящего мета-обзора мы выполнили систематический поиск сетевых мета-анализов и мета-анализов рандомизированных контролируемых исследований (РКИ), РКИ и когортных исследований, сообщающих о 78 априори отобранных нежелательных явлениях, разбитых на 19 категорий, при применении 80 психотропных препаратов, включая антидепрессанты, антипсихотики, лекарства, используемые при синдроме дефицита внимания и гиперактивности (СДВГ), и стабилизаторы настроения у детей и подростков с психическими расстройствами. Мы включили данные девяти сетевых мета-анализов, 39 мета-анализов, 90 РКИ и восьми когортных исследований, включающих 337 686 детей и подростков. Данные о ≥20% из 78 нежелательных явлений были доступны для шести антидепрессантов (сертралин, эсциталопрам, пароксетин, флуоксетин, венлафаксин и вилазодон), восьми антипсихотиков (рисперидон, кветиапин, арипипразол, луразидон, палиперидон, зипрасидон, оланзапин и азенапин), трех препаратов для лечения СДВГ (метилфенидат, атомоксетин и гуанфацин) и двух групп стабилизаторов настроения (вальпроаты и препараты лития). Среди этих препаратов наилучший профиль безопасности был обнаружен у эсциталопрама и флуоксетина среди антидепрессантов, луразидона среди антипсихотиков, метилфенидата среди препаратов для лечения СДВГ и лития среди стабилизаторов настроения. Согласно имеющейся литературе, наибольшие опасения относительно безопасности вызывают венлафаксин, оланзапин, атомоксетин, гуанфацин и вальпроаты. Тошнота/рвота и прекращение приема препарата из-за нежелательных явлений чаще всего были связаны с антидепрессантами; седация, экстрапирамидные побочные эффекты и увеличение веса – с антипсихотиками; анорексия и бессонница – с препаратами для лечения СДВГ; седация и увеличение веса – со стабилизаторами настроения. Результаты этого всестороннего обновленного количественного систематического мета-обзора данных, касающихся безопасности применения антидепрессантов, антипсихотиков, препаратов для лечения СДВГ и стабилизаторов настроения у детей и подростков, могут служить основой для клинической практики, исследований и рекомендаций по лечению.
Ключевые слова: безопасность, переносимость, дети, подростки, психофармакология, антидепрессанты, антипсихотики, стабилизаторы настроения, психостимуляторы, мета-обзор.
Психические расстройства часто начинаются в детском или подростковом возрасте. Психотропные препараты имеют различные показания для лечения психических расстройств в этой возрастной группе и нередко используются «офф-лейбл» (не в соответствии с инструкцией по применению). Однако побочные эффекты этих препаратов требуют особого внимания в течение критических периодов развития. Для проведения настоящего мета-обзора мы выполнили систематический поиск сетевых мета-анализов и мета-анализов рандомизированных контролируемых исследований (РКИ), РКИ и когортных исследований, сообщающих о 78 априори отобранных нежелательных явлениях, разбитых на 19 категорий, при применении 80 психотропных препаратов, включая антидепрессанты, антипсихотики, лекарства, используемые при синдроме дефицита внимания и гиперактивности (СДВГ), и стабилизаторы настроения у детей и подростков с психическими расстройствами. Мы включили данные девяти сетевых мета-анализов, 39 мета-анализов, 90 РКИ и восьми когортных исследований, включающих 337 686 детей и подростков. Данные о ≥20% из 78 нежелательных явлений были доступны для шести антидепрессантов (сертралин, эсциталопрам, пароксетин, флуоксетин, венлафаксин и вилазодон), восьми антипсихотиков (рисперидон, кветиапин, арипипразол, луразидон, палиперидон, зипрасидон, оланзапин и азенапин), трех препаратов для лечения СДВГ (метилфенидат, атомоксетин и гуанфацин) и двух групп стабилизаторов настроения (вальпроаты и препараты лития). Среди этих препаратов наилучший профиль безопасности был обнаружен у эсциталопрама и флуоксетина среди антидепрессантов, луразидона среди антипсихотиков, метилфенидата среди препаратов для лечения СДВГ и лития среди стабилизаторов настроения. Согласно имеющейся литературе, наибольшие опасения относительно безопасности вызывают венлафаксин, оланзапин, атомоксетин, гуанфацин и вальпроаты. Тошнота/рвота и прекращение приема препарата из-за нежелательных явлений чаще всего были связаны с антидепрессантами; седация, экстрапирамидные побочные эффекты и увеличение веса – с антипсихотиками; анорексия и бессонница – с препаратами для лечения СДВГ; седация и увеличение веса – со стабилизаторами настроения. Результаты этого всестороннего обновленного количественного систематического мета-обзора данных, касающихся безопасности применения антидепрессантов, антипсихотиков, препаратов для лечения СДВГ и стабилизаторов настроения у детей и подростков, могут служить основой для клинической практики, исследований и рекомендаций по лечению.
Ключевые слова: безопасность, переносимость, дети, подростки, психофармакология, антидепрессанты, антипсихотики, стабилизаторы настроения, психостимуляторы, мета-обзор.
Детство и юность – это важнейшее время для биопсихосоциального развития1. Многие тяжелые психические расстройства, если не большинство, возникают до 18 лет2. Раннее вмешательство является краеугольным камнем современной психиатрии и продемонстрировало превосходные результаты, например, при психотических расстройствах и биполярном расстройстве3,4. В дополнение к психотерапевтическим и психосоциальным вмешательствам, психотропные препараты часто необходимы для лечения тяжелых психических расстройств и могут вызывать субъективный дистресс и/или выраженные дисфункции у молодых пациентов.
Некоторые антидепрессанты, антипсихотики, препараты для лечения синдрома дефицита внимания и гиперактивности (СДВГ) и стабилизаторы настроения, назначаемые взрослым, получили одобрение регулирующих органов для использования в детском и/или подростковом возрасте5, а многие из них используются офф-лейбл6-10. Однако несмотря на доказательства эффективности ряда психотропных препаратов в молодом возрасте, длительность нелеченного заболевания при депрессивном расстройстве11, биполярном аффективном расстройстве12,13, шизофрении14, обсессивно-компульсивном расстройстве15, тревожном расстройстве16 и других психических расстройствах17 часто бывает большой18,19, что отрицательно сказывается на отдаленных исходах14,20-24. Такая задержка может быть связана с несколькими факторами. Они, безусловно, включают более низкую обращаемость из-за стигматизации и самостигматизации, связанной с психическими заболеваниями25-27, но также актуальны связанные со стигматизацией или основанные на данных исследований опасения по поводу безопасности применения психотропных препаратов в детском и подростковом возрасте28-34.
Низкое качество данных о безопасности применения психотропных препаратов потенциально может быть причиной задержки начала лечения или отказа от него, несмотря на доказательства того, что лекарства, используемые в психиатрии, как правило, не менее эффективны, чем те, которые назначаются в других областях медицины35. Например, плохая отчетность о нежелательных явлениях (НЯ) в доступных рандомизированных контролируемых исследованиях (РКИ) может приводить к неточным оценкам некоторых серьезных явлений, таких как суицидальное поведение при применении антидепрессантов36. Кроме того, регулирующие органы могут обязать вкладывать в упаковки препаратов предупреждения о нежелательных явлениях препаратов, таких как, например, повышение риска суицидального поведения у детей, подростков и молодых взрослых при применении антидепрессантов37, которые могут повлиять на повседневную клиническую практику назначения препаратов38, но обоснованность которых затем может быть поставлена под сомнение39,40. В то же время, вопросы безопасности применения препаратов и предупреждения о них, основанные на доказательствах, необходимы для регулирования клинических руководств, практической помощи и имеют решающее значение для защиты пациентов в соответствии с принципом «не навреди» (primum non nocere).
Данных о безопасности психотропных средств у детей и подростков с психическими расстройствами становится больше41, но они остаются разрозненными. Имеющиеся сетевые метаанализы (СМА) и метаанализы (МА) обычно изучают в качестве своего основного исхода эффективность, в то время как безопасность обычно не ставится во главу угла в РКИ и связанных с ними обзорных работах. Кроме того, СМА и МА, как правило, включают РКИ, касающиеся только одного или, реже, нескольких связанных психических расстройств.
В то время как в РКИ минимизировано влияние нескольких источников систематических ошибок на оценку эффектов лекарств в конкретной популяции, они также имеют строгие критерии отбора, что снижает обобщаемость и внешнюю валидность их выводов. Кроме того, РКИ часто являются относительно небольшими по объему и короткими, что исключает адекватное выявление редких, но серьезных или долгосрочных нежелательных явлений42. Кроме того, СМА и МА обычно рассматривают использование лекарств при расстройствах, для которых они показаны, исключая данные по применению офф-лейбл. Поэтому всестороннее обобщение сведений о безопасности психотропных препаратов при всех психических состояниях, при которых они используются у детей и подростков, основанное на РКИ и больших когортных исследованиях, включающее более обобщаемые выборки и отражающее реальные модели применения препаратов, имеет важное значение с клинической точки зрения.
Насколько нам известно, на настоящий момент не существует систематического метаобзора, в котором основное внимание уделялось бы безопасности психотропных препаратов у детей и подростков в качестве основного исхода, обобщающего данные СМА, МА, крупнейших РКИ и хорошо продуманных когортных исследований по всем соответствующим психическим расстройствам. Цель настоящего метаобзора состояла в том, чтобы максимально полно и всесторонне обобщить существующие сведения о безопасности четырех основных классов психотропных препаратов (антидепрессанты, антипсихотики, препараты для лечения СДВГ, стабилизаторы настроения) у детей и подростков с психическими расстройствами, чтобы предоставить информацию, необходимую для принятия решений в клинической практике и разработки клинических руководств, а также определить области, требующие дальнейших исследований.
МЕТОДЫ
Поиск, критерии включения и исключения
Настоящий систематический мета-обзор проводился в соответствии с a priori протоколом (предоставляется по запросу). Мы выполнили систематический поиск по PubMed и PsycINFO с момента создания баз данных до 7 сентября
2019 г., используя исчерпывающую комбинацию ключевых слов как по психотропным препаратам, так и по нежелательным эффектам (полная строка поиска доступна по запросу). Дополнительно вручную были изучены библиографические списки включенных статей. Авторы парами проводили скрининг заголовков / резюме статей и оценку полнотекстовых версий, а также извлекали данные в заранее составленную таблицу excel. Третий автор разрешал разногласия.
Критериями включения были: а) СМА, МА, РКИ и когортные исследования, оценивающие риск систематических ошибок по показаниям (то есть медикаментозное лечение в сравнении с плацебо/отсутствием медикаментозного лечения у лиц, страдающих одним и тем же расстройством); б) данные о связи между антидепрессантами, антипсихотиками, препаратами для лечения СДВГ, стабилизаторами настроения и неблагоприятными эффектами для здоровья; в) выборка пациентов детского и/или подросткового возраста с любым психическим расстройством.
Критериями исключения были: а) исследования других состояний (не психических расстройств), для которых показаны или используются психотропные препараты (например, эпилепсия); б) риск систематических ошибок по показаниям (то есть сравнение пациентов, принимающих препараты, с контрольными группами здоровых людей), даже если анализ данных был скорректирован по ковариатам;
в) дизайн исследований, отличный от указанного в критериях включения; г) отсутствие данных о связи между изучаемыми препаратами и неблагоприятными эффектами.
Нежелательные явления и психотропные препараты, включенные в метаобзор
78 изначально отобранных нежелательных явлений были разделены на следующие 19 категорий: нежелательные явления со стороны центральной нервной системы (возбуждение, тревога, астения, раздражительность, когнитивные нарушения, депрессия, головокружение, головная боль, мания, психоз, седация, бессонница, судороги, суицидальные идеи/поведение/попытки); пищевые и метаболические (анорексия, переедание / повышенный аппетит, повышенный холестерин, повышенный уровень триглицеридов, метаболический синдром, нарушение регуляции глюкозы / диабет, инсулинорезистентность, увеличение окружности талии, увеличение массы тела / увеличение индекса массы тела, потеря веса); сердечно-сосудистые (аритмии/тахикардия, кардиомиопатия, цереброваскулярные заболевания, ишемическая болезнь сердца, гипертония, гипотония, миокардит, удлинение интервала QT, внезапная сердечная смерть); желудочно-кишечные (боль в животе, запор, диарея, желудочно-кишечные симптомы, поражение печени, тошнота/рвота); мочеполовые (энурез, нефропатия / почечная недостаточность, изменения менструального цикла, синдром поликистозных яичников, сексуальная дисфункция); двигательные расстройства (акатизия, любые экстрапирамидные побочные эффекты, тремор, дистония, поздняя дискинезия); импульсивность и рискованное поведение (преступное поведение, азартные игры, злоупотребление психоактивными веществами, самоповреждения без суицидальной цели); эндокринные (гинекомастия/галакторея, гипо-/гиперпролактинемия, гипо-/гипертиреоз); гематологические (анемия, лейкоцитопения, тромбоцитопения); связанные с ротовой полостью (кариес зубов, сухость во рту, гиперсаливация); респираторные (острая дыхательная недостаточность, астма, назофарингит / инфекция верхних дыхательных путей/пневмония); венозная тромбоэмболия (тромбоз глубоких вен, тромбоэмболия легочной артерии); костные (остеопения/остеопороз, переломы костей); несчастные случаи (любые случаи, падения); нейролептический злокачественный синдром (нейролептический злокачественный синдром / лихорадка / повышение уровня креатинфосфокиназы); любой рак; прекращение приема препарата из-за неблагоприятных явлений; серьезные нежелательные явления; смертность (все причины, связанные с естественными причинами; самоубийства).
80 психотропных препаратов были разделены на четыре категории: антидепрессанты, антипсихотики, препараты для лечения СДВГ, стабилизаторы настроения. Категория антидепрессантов включала девять классов: ингибиторы моноаминоксидазы (ИМАО) (бифемелан, гидракарбазин, изокарбоксазид, моклобемид, ниаламид, фенелзин, пирлиндол, разагилин, сафинамид, селегилин, толоксатон и транилципромин); трициклические (ТЦА) и тетрациклические (ТеЦА) (амитриптилин, амоксапин, кломипрамин, дезипрамин, доксепин, имипрамин, мапротилин, нортриптилин, протриптилин и тримипрамин); селективные ингибиторы обратного захвата серотонина (СИОЗС) (циталопрам, эсциталопрам, флуоксетин, флувоксамин, пароксетин и сертралин); ингибиторы обратного захвата серотонина и норадреналина (ИОЗСН) (дезвенлафаксин, дулоксетин, левомилнаципран, милнаципран и венлафаксин); частичные антагонисты / ингибиторы обратного захвата серотонина (АИОЗС) (нефазодон, тразодон и милазодон); норадренергические и специфические серотонинергические антидепрессанты (НАССА) (миансерин и миртазапин); ингибиторы обратного захвата норадреналина (ИОЗН) (ребоксетин); ингибиторы обратного захвата норадреналина и дофамина (ИОЗНД) (бупропион); другие (агомелатин, эскетамин, S-аденозилметионин и вортиоксетин). Категория антипсихотиков включала два класса: антипсихотики первого поколения (АПП) (хлорпромазин, флуфеназин, галоперидол, локсапин, молиндон, перфеназин, промазин и трифлуоперазин) и антипсихотики второго поколения (АВП) (амисульприд, арипипразол, азенапин, брекспипразол, карипразин, клозапин, илоперидон, луразидон, оланзапин, палиперидон, кветиапин, рисперидон и зипрасидон). Препараты для лечения СДВГ включали психостимуляторы (d-амфетамин, лиздексамфетамин и метилфенидат) и препараты с другими механизмами действия (атомоксетин, клонидин, гуанфацин и модафинил). Стабилизаторы настроения включали противоэпилептические препараты (карбамазепин, габапентин, ламотриджин, прегабалин, окскарбазепин, топирамат и вальпроаты) и литий.
Первичные и вторичные результаты
В качестве первичного исхода оценивалось соотношение «безопасность/охват» (то есть отношение количества нежелательных явлений, значительно более выраженных в сравнении с плацебо / отсутствием лечения, к количеству нежелательных явлений, охваченных литературой) для тех психотропных препаратов, для которых ≥20% из 78 априори выбранных НЯ были описаны в работах. Вторичным исходом был список нежелательных явлений, связанных с каждым препаратом, величина эффекта ± 95% ДИ и качество исследования.
Сила связи каждого препарата с основными нежелательными явлениями расценивалась как слабая (≤0,5), средняя (>0,5 и <0,8) и сильная (≥0,8) для количественных переменных (величина эффектов >0), и инвертированные пороговые значения использовались в случае величины эффектов <0. Для качественных переменных сила связей оценивалась как слабая (<3), средняя (≥3 и <5) и сильная (≥5) при эквивалентных отношениях шансов (эОШ) >1, и обратные пороговые значения – при эОШ <143.
Оценка качества
Качество МА и СМА оценивалось с помощью модифицированной версии A Measurement Tool for the Assessment of Multiple Systematic Reviews (AMSTAR)-PLUS44, которая позволяет оценивать как качество (С)МА, так и исследований, включенных в них (AMSTAR-Content). Качество по AMSTAR оценивалось как низкое при итоговой сумме баллов <4, среднее – при 4–7 баллах, высокое – при >7 баллах45. Для AMSTAR-Content качество оценивалось как низкое при <4 баллах, среднее – при 4–6 баллах, высокое – при >6 баллах. Итоговая оценка качества (С)МА выставлялась по более низкому значению при выборе между AMSTAR и AMSTAR-Content.
Качество РКИ оценивалось с помощью Risk of Bias tool 246, согласно которому работе присваивается высокий, низкий риск систематических ошибок или «некоторые сомнения». Качество когортных исследований оценивалось с помощью шкалы Newcastle-Ottawa Scale (NOS)47, высокое качество присваивалось, когда оценка по NOS составляла ≥7.
Статистический анализ
Используя модель случайных эффектов, мы извлекали величины эффектов ± 95% ДИ для оценки разницы частоты возникновения специфических нежелательных явлений между отдельными препаратами и плацебо (РКИ), или между получающими и не получающими лечение молодыми пациентами с психическими расстройствами (когортные исследования). Мы оценивали ОШ, логарифм ОШ и ОР с соответствующим индексом потенциального вреда (ИПВ) для качественных данных по исходам и стандартизированную разность средних (СРС) или разность средних (РС) для количественных данных по исходам.
Мы рассчитали итоговую пропорцию охвата априори выбранных нежелательных явлений для каждого из психотропных препаратов, используя описательную статистику, и разделили охваченные нежелательные явления на те, которые возникают или не возникают значительно чаще в сравнении с плацебо или соответствующей группой сравнения. Кроме того, мы определили препараты с лучшим или худшим профилем безопасности по соотношению «безопасность/охват» для препаратов, имевших данные по ≥20% нежелательных явлений.
РЕЗУЛЬТАТЫ
Результаты поиска
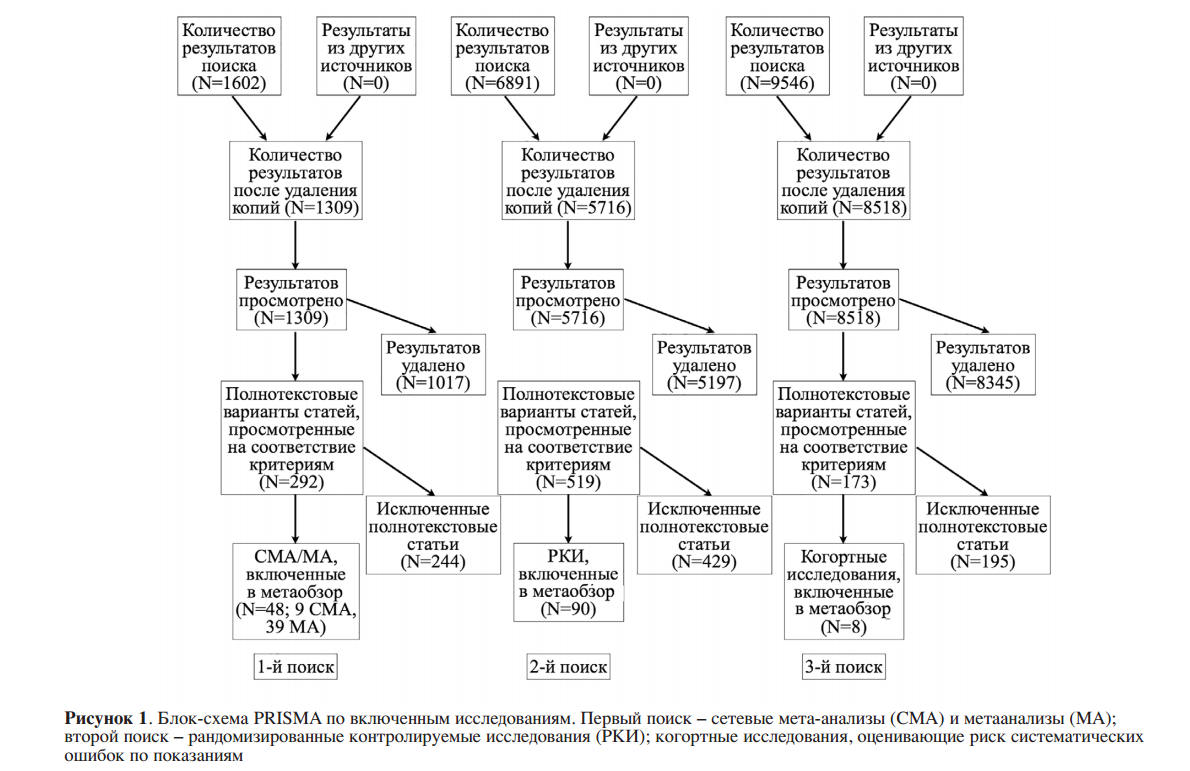
Блок-схема процесса систематического поиска представлена на Рисунке 1. Мы просмотрели заголовки и резюме 1309 СМА и МА, 5716 РКИ и 8518 когортных исследований. Мы оценили полнотекстовые версии 292 СМА и МА, 519 РКИ и 173 когортных исследований. Мы извлекли данные из девяти СМА, 39 МА, 90 РКИ и восьми когортных исследований, которые включали 337 686 детей и подростков (120 637 – антидепрессанты, 66 764 антипсихотики, 148 664 – препараты для лечения СДВГ и 1621 – стабилизаторы настроения). По антидепрессантам мы включили 4 СМА40,48-50, 15 МА36,51-64, 27 РКИ65-91, которые отражены в СМА/МА, 6 дополнительных РКИ92-97 и 3 когортных исследования98-100. Они включали 120 637 молодых пациентов, принимавших антидепрессанты: 24 659 человек в 139 РКИ (после удаления дубликатов РКИ в многочисленных СМА/МА) (22 704 человека в СМА/МА, 1955 в дополнительных РКИ) и 95 978 человек в трех когортных исследованиях.
По антипсихотикам мы включили 3 СМА101-103, 11 МА104-114, 25 РКИ115-139, включенных в СМА/МА, 3 дополнительных РКИ140-142 и 2 когортных исследования99,143. Они включали 66764 молодых пациента, принимавших антипсихотики: 7712 пациентов в 53 РКИ (после удаления дубликатов РКИ в многочисленных СМА/МА) (6725 в СМА/МА, 987 в дополнительных РКИ) и 59 052 человека в когортных исследованиях.
По препаратам для лечения СДВГ мы включили 3 СМА49,144,145, 11 МА146-156, 12 РКИ157-168, включенных в СМА/МА, 5 дополнительных РКИ169-173 и 5 когортных исследований99,174-177. Они включали 148 664 молодых пациента, принимавших препараты для лечения СДВГ: 28 834 человека в 298 РКИ (после удаления дубликатов РКИ в многочисленных СМА/МА) (27 188 в СМА/МА, 1646 в дополнительных РКИ) и 119 830 человек в 5 когортных исследованиях.
По стабилизаторам настроения мы включили 4 МА107,112,178,179, 7 РКИ180-186, включенных в СМА/МА и 5 дополнительных РКИ187-191. Они включали 1621 молодого пациента в 23 РКИ (после удаления дубликатов РКИ в многочисленных СМА/МА) (1244 в СМА/МА, 377 в дополнительных РКИ).
Качество включенных работ
Среди девяти СМА медиана по AMSTAR была 10 (межквартильный размах IQR=9–11), а по AMSTAR-Content –
5 (IQR=5–7). Качество было средним в двух (22,2%) СМА и высоким в остальных семи СМА (77,8%). РКИ, включенные в СМА, были среднего качества в шести (66,7%) СМА и высокого – в трех (33,3%) СМА. Итоговая оценка качества была средней у шести (66,7%) и высокой у трех (33,3%) СМА.
Среди 39 МА медиана по AMSTAR была 9 (IQR=7–10), а по AMSTAR-Content – 5 (IQR=4–6). Качество было средним в 11 МА (28,2%) и высоким в остальных 28 (71,8%). РКИ, включенные в МА, были низкого качества в девяти (23,1%) МА, среднего – в 23 (59,0%) и высокого – в семи (17,9%) МА. Итоговая оценка качества была низкой у 9 (23,1%), средней у 25 (64,1%) и высокой у пяти (12,8%) МА.
Среди 90 РКИ 26 (28,6%) имели высокий риск систематических ошибок, 43 (47,3%) вызывали некоторые сомнения, а в 22 (24,2%) риск систематических ошибок был низким.
Среди восьми когортных исследований шесть (75%) имели высокое качество по шкале Newcastle-Ottawa scale, а медиана была равна семи (IQR=7–8).
Безопасность применения различных классов психотропных препаратов у детей и подростков
с психическими расстройствами
Антидепрессанты
Освещенные в работах данные о нежелательных явлениях были найдены для 18 (40,9%) из 44 антидепрессантов.
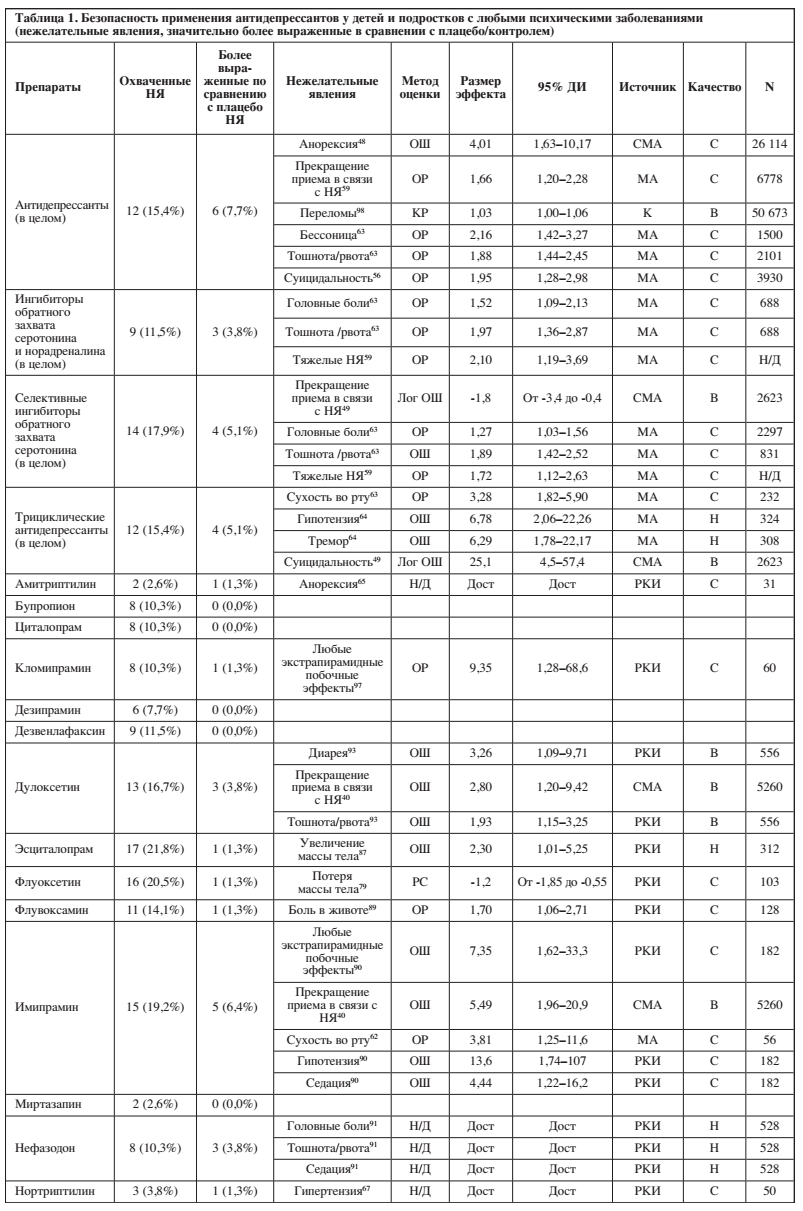
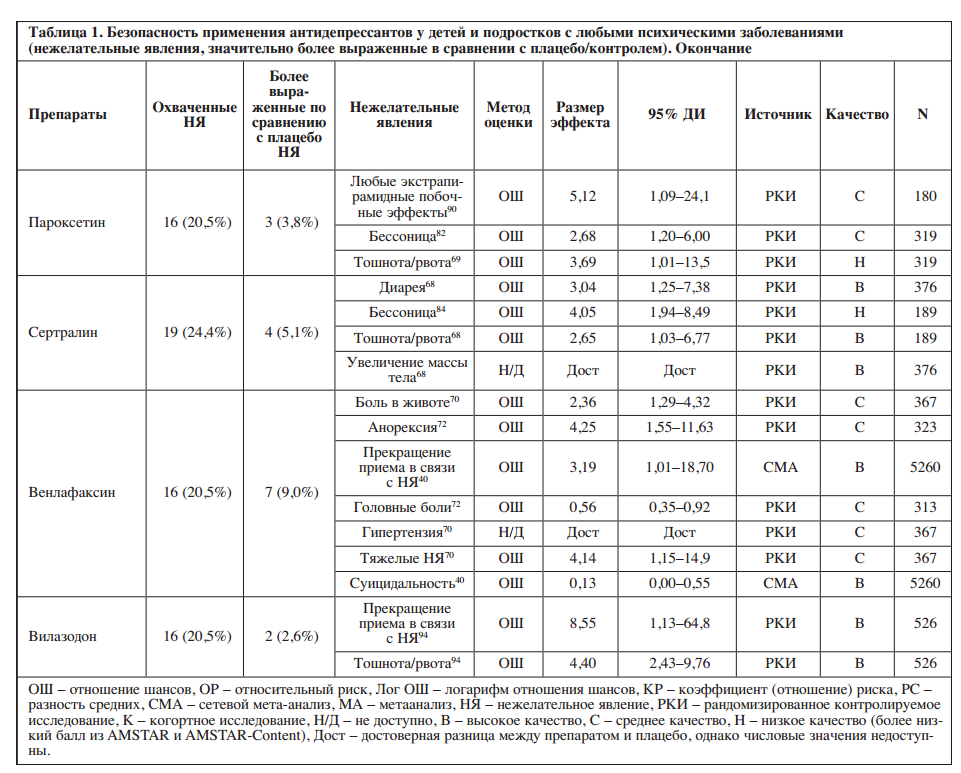
Доступная литература охватывала 0–24,4% (среднее значение: 5,6%, медиана: 0%) исследуемых нежелательных явлений. Подробная информация о доле из 78 нежелательных явлений, освещенных в литературе, и о значительно более выраженных нежелательных явлениях при применении отдельных антидепрессантов по сравнению с плацебо/контролем представлена в Таблице 1 и на Рисунке 2.
Среди антидепрессантов с охватом ≥20% нежелательных явлений, соотношение «безопасность/охват» оказалось наилучшим у эсциталопрама (1/17 охваченных побочных эффектов значительно более выражены) и флуоксетина (1/16), постепенно ухудшаясь у вилазодона (2/16), пароксетина (3/16), сертралина (4/19) и венлафаксина, который имел худшее соотношение «безопасность/охват» (7/16).
Пять антидепрессантов были связаны со значительно более выраженными тошнотой/рвотой (дулоксетин, нефазодон, пароксетин, сертралин, вилазодон), четыре – с прекращением приема в связи с побочными эффектами (дулоксетин, имипрамин, венлафаксин, вилазодон), три – с экстрапирамидными побочными эффектами (кломипрамин, имипрамин, пароксетин), по два – с седацией (имипрамин, нефазодон), диареей (дулоксетин, сертралин), головными болями (нефазодон, венлафаксин), анорексией (амитриптилин, венлафаксин) и увеличением массы тела / увеличением индекса массы тела (эсциталопрам, сертралин), а также по одному с потерей массы тела (флуоксетин) и суицидальным поведением (венлафаксин).
Антипсихотики
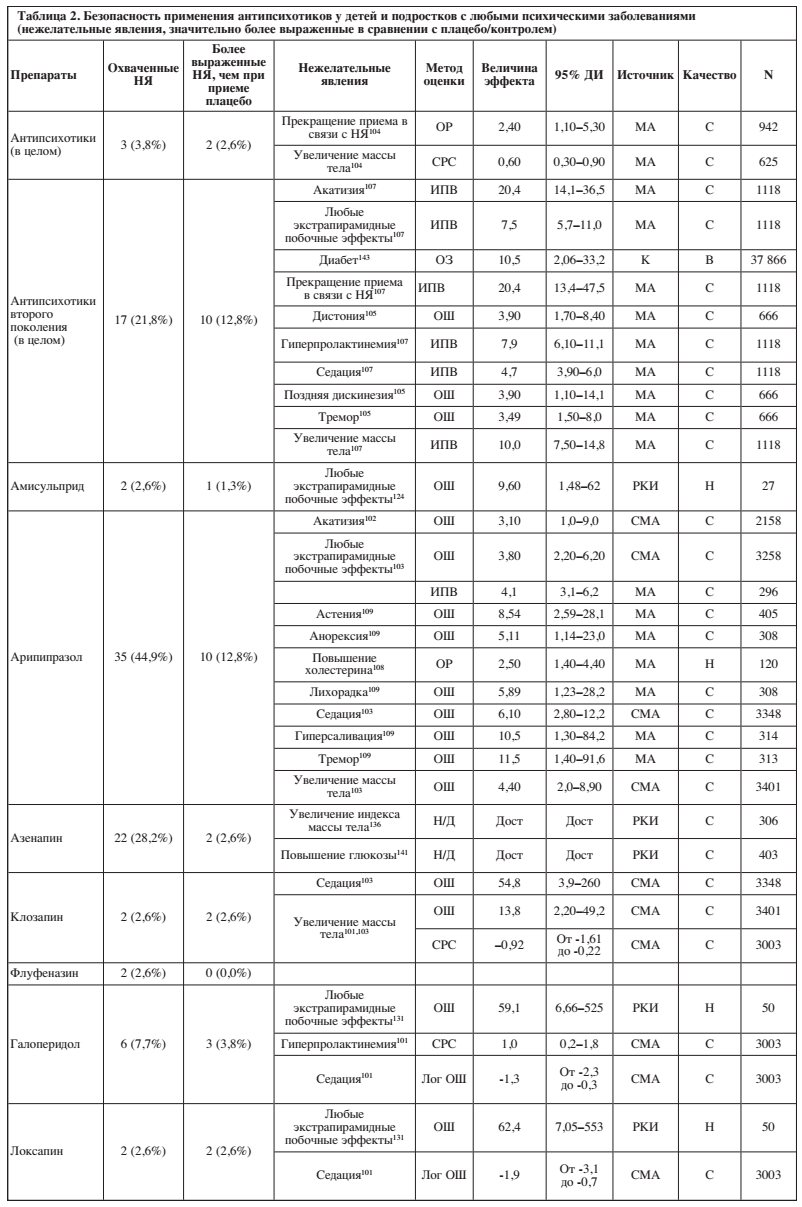
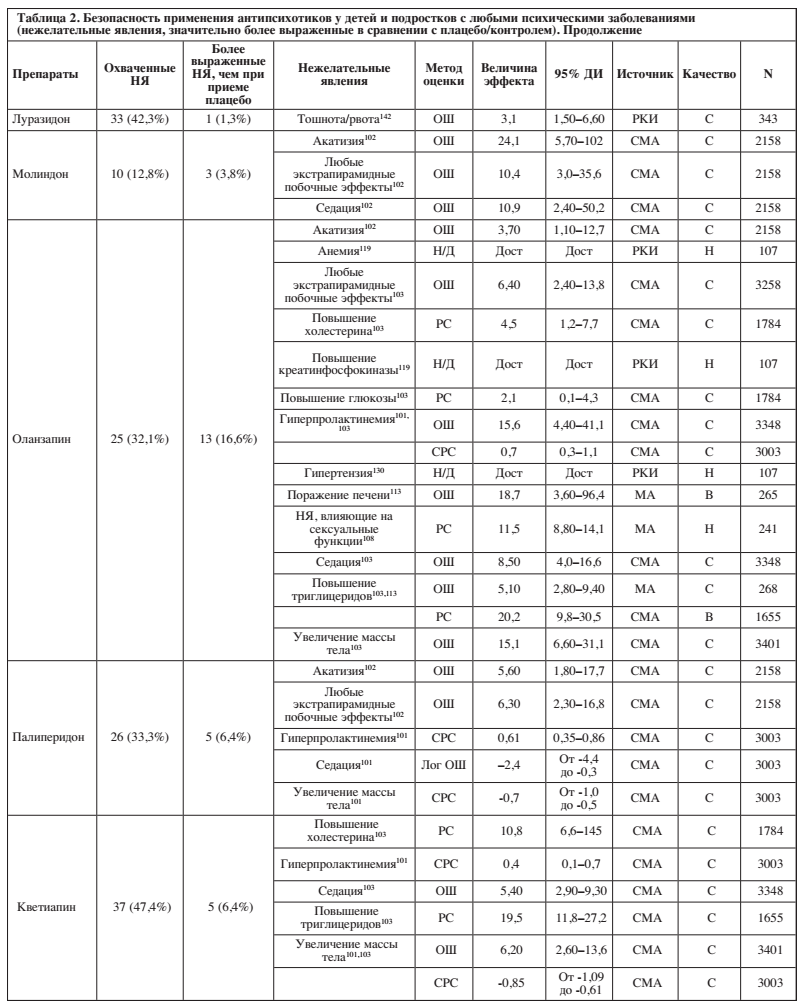
В работах представлена информация о нежелательных явлениях для 15 (71,4%) из 21 антипсихотиков. Доступные работы охватывали 0–56,4% (среднее значение: 16,6%, медиана: 2,6%) исследуемых нежелательных явлений. Подробная информация о доле из 78 нежелательных явлений, освещенных в литературе, и о значительно более выраженных нежелательных явлений при применении отдельных антидепрессантов по сравнению с плацебо/контролем, представлена в Таблице 2 и на Рисунке 2.
Среди антипсихотиков с охватом ≥20% побочных эффектов луразидон имел лучшее соотношение «безопасность/охват» (1/33 охваченных побочных эффектов значительно более выражены), далее в порядке ухудшения шли азенапин (2/22), кветиапин (5/37), зипрасидон (4/25), палиперидон (5/26), рисперидон (12/44), арипипразол (10/35) и оланзапин, который имел худшее соотношение «безопасность/охват» (13/25).
Десять антипсихотиков были связаны со значительно более выраженным седативным эффектом (арипипразол, клозапин, галоперидол, локсапин, молиндон, оланзапин, палиперидон, кветиапин, рисперидон, зипрасидон), девять – с экстрапирамидными побочными эффектами (амисульприд, арипипразол, галоперидол, локсапин, молиндон, оланзапин, палиперидон, рисперидон, зипрасидон), семь – с увеличением массы тела (арипипразол, азенапин, клозапин, оланзапин, палиперидон, кветиапин, рисперидон), пять – с гиперпролактинемией (галоперидол, оланзапин, палиперидон, кветиапин, рисперидон), и по три – с повышенным уровнем холестерина (арипипразол, оланзапин, кветиапин) и повышением уровня глюкозы / диабетом (азенапин, оланзапин, рисперидон).
Препараты для лечения СДВГ
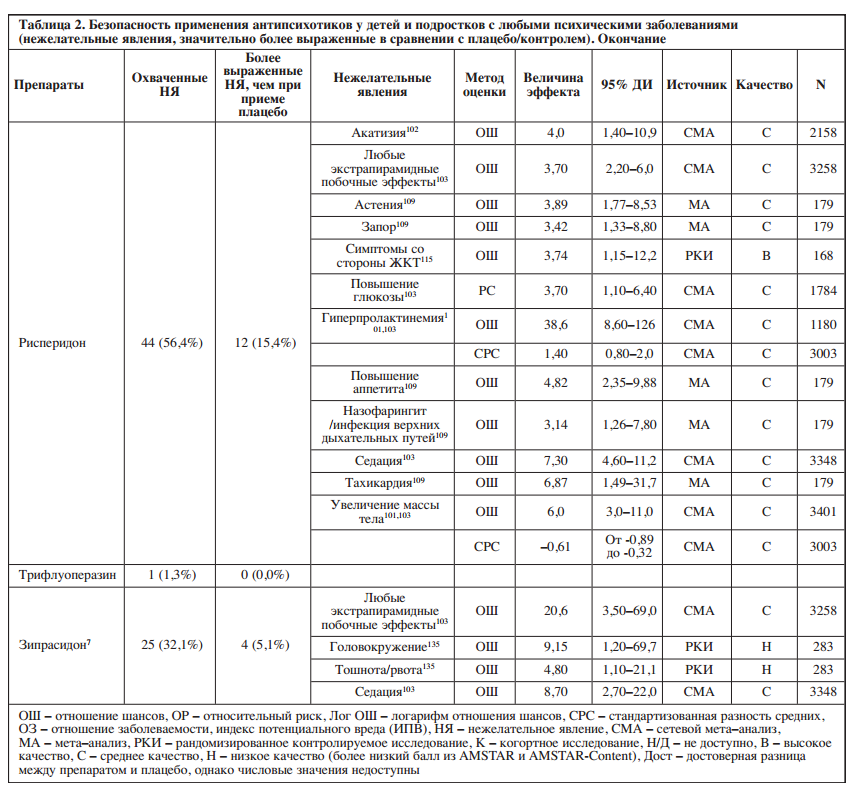
В исследуемой литературе представлена информация о нежелательных явлениях для всех семи препаратов для лечения СДВГ. Доступные работы охватывали 7,7–32,1% (среднее значение: 19,0%, медиана: 17,9%) исследуемых нежелательных явлений. Подробная информация о доле из 78 нежелательных явлений, освещенных в литературе, и о нежелательных явлениях, значительно более выраженных при применении отдельных препаратов для лечения СДВГ по сравнению с плацебо/контролем, представлена в Таблице 3 и на Рисунке 2.
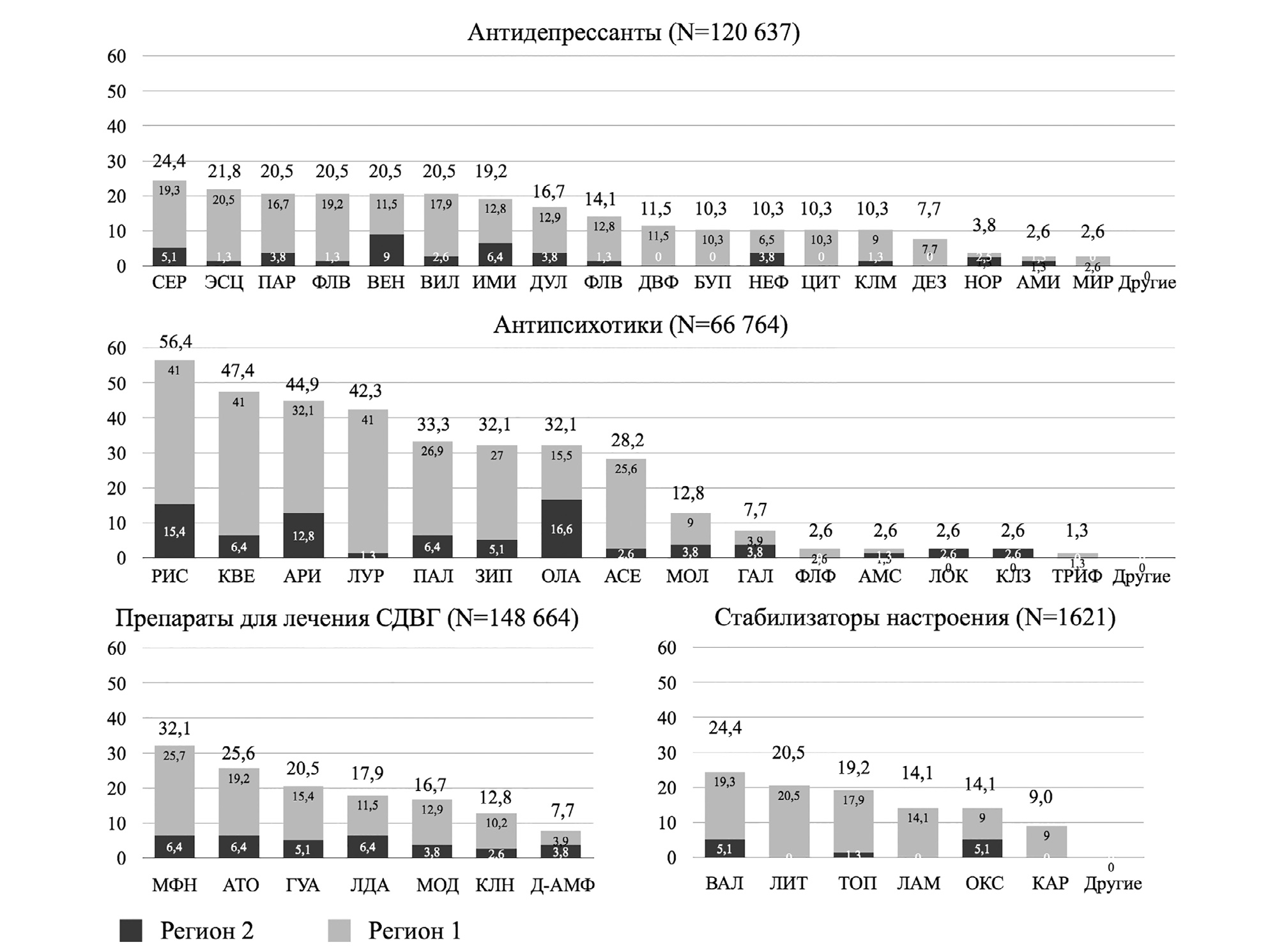
Рисунок 2. Доля нежелательных явлений, освещенных в литературе, которые существенно или несущественно отличались от плацебо, для антидепрессантов, антипсихотиков, препаратов для лечения СДВГ и стабилизаторов настроения у детей и подростков с психическими заболеваниями. АМИ – амитриптилин, АМС – амисульприд, АРИ – арипипразол, АСЕ – азенапин (асенапин), АТО – атомоксетин, БУП – бупропион, ВАЛ – вальпроаты, ВЕН – венлафаксин, ВИЛ – вилазодон, ГАЛ – галоперидол, ГУА – гуанфацин, Д-АМФ – дексамфетамин, ДВФ – дезвенлафаксин, ДЕЗ – дезипрамин, ДУЛ – дулоксетин, ЗИП – зипрасидон, ИМИ – имипрамин, КАР – карбамазепин, КВЕ – кветиапин, КЛЗ – клозапин, КЛМ – кломипрамин, КЛН – клонидин, ЛАМ – ламотриджин, ЛДА – лиздексамфетамин, ЛИТ – литий, ЛОК – локсапин, ЛУР – луразидон, МИР – миртазапин, МОД – модафинил, МОЛ – молиндон, МФН – метилфенидат, НЕФ – нефазодон, НОР – нортриптилин, ОКС – окскарбазепин, ОЛА – оланзапин, ПАЛ – палиперидон, ПАР – пароксетин, РИС – рисперидон, СЕР – сертралин, ТОП – топиромат, ТРИФ – трифлуоперазин, ФЛВ – флувоксамин, ФЛУ – флуоксетин, ФЛФ – флуфеназин, ЦИТ – циталопрам, ЭСЦ – эсциталопрам.
Среди препаратов для лечения СДВГ с охватом ≥20% побочных эффектов метилфенидат имел лучшее соотношение «безопасность/охват» (5/25 охваченных побочных эффектов значительно более выражены), в то время как гуанфацин и атомоксетин – худшее (4/16 и 5/20 соответственно).
Пять препаратов для лечения СДВГ были связаны со значительно более выраженной анорексией (атомоксетин, дексамфетамин, лиздексамфетамин, метилфенидат, модафинил), четыре – с бессонницей (дексамфетамин, лиздексамфетамин, метилфенидат, модафинил), три – с потерей веса (атомоксетин, метилфенидат, модафинил), по два – с болями в животе (метилфенидат, гуанфацин), прекращением приема препарата из-за нежелательных явлений (лиздексамфетамин, гуанфацин), гипертензией (атомоксетин, лиздексамфетамин) и седацией (клонидин, гуанфацин), а также один – с удлинением интервала QT (гуанфацин).
Стабилизаторы настроения
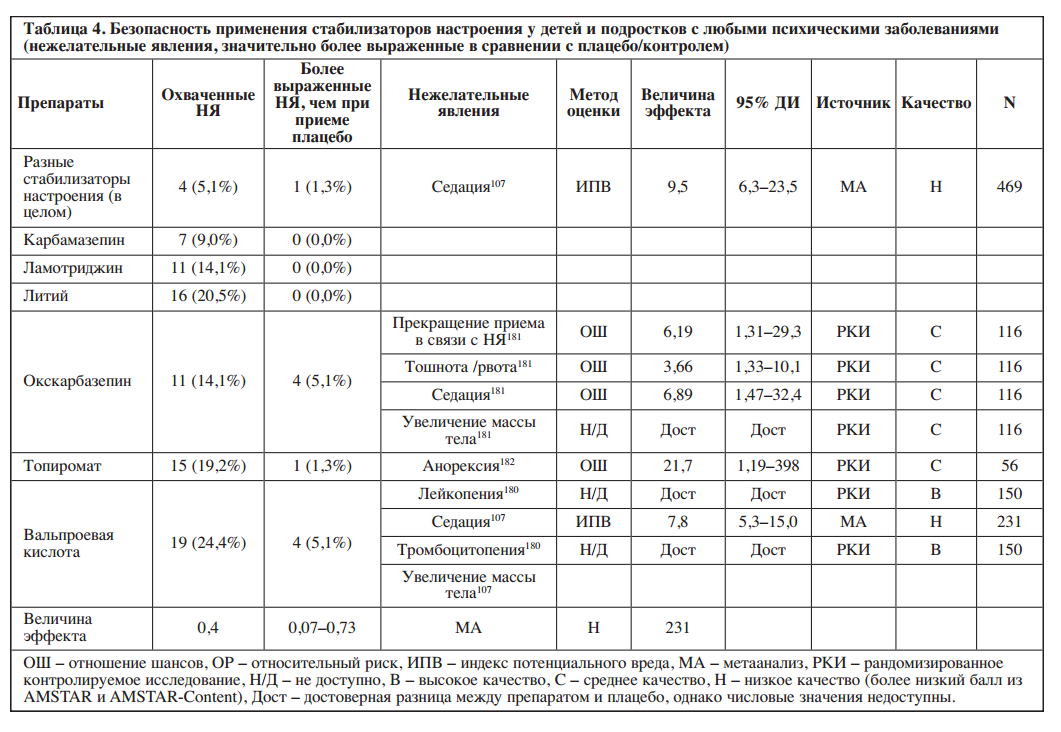
В литературе представлена информация о нежелательных явлениях для шести (75,0%) из восьми стабилизаторов настроения. Доступные работы охватывали 0–24,4% (среднее значение: 12,7%, медиана: 14,1%) исследуемых нежелательных явлений. Подробная информация о доле из 78 нежелательных явлений, освещенных в литературе, и о нежелательных явлениях, значительно более выраженных при применении отдельных стабилизаторов настроения по сравнению с плацебо/контролем, представлена в Таблице 4 и на Рисунке 2.
Среди стабилизаторов настроения с охватом ≥20% нежелательных явлений лучшее соотношение «безопасность/ охват» было выявлено для лития (0/16 охваченных побочных эффектов значительно более выражены), в то время как для вальпроатов – худшее (4/19).
Два стабилизатора настроения были ассоциированы со значительно более выраженным седативным эффектом (окскарбазепин, вальпроаты) и увеличением массы тела (окскарбазепин, вальпроаты), а также по одному – с потерей веса или анорексией (топирамат), тромбоцитопенией и лейкоцитопенией (вальпроаты) и тошнотой/рвотой (окскарбазепин).
Данные из исследований длительностью ≥6 месяцев
В отношении антидепрессантов все РКИ длились менее 6 месяцев, в то время как одно когортное исследование длилось от 6 до 12 месяцев100, а два ≥12 месяцев (диапазон: 12–130 месяцев)98,99. Значимые взаимосвязи отмечались между текущим приемом разных антидепрессантов (в целом) и переломами (небольшая величина эффекта, ≥12 месяцев), но эти связи становились незначимыми при учете предыдущего приема антидепрессантов. Кроме того, в первой версии анализа большого когортного исследования (≥12 месяцев) была выявлена небольшая ассоциация приема антидепрессантов с повышенным риском развития любого рака, но дополнительные анализы из той же базы данных не подтвердили такую ассоциацию при исключении данных по полипрагмазии99.
В отношении антипсихотиков ни одно РКИ не длилось ≥6 месяцев, ни одно когортное исследование не длилось
6–12 месяцев, в то время как два когортных исследования длились ≥12 месяцев (диапазон: 84–130 месяцев)99,143. Была обнаружена сильная связь между приемом разных АВП (в целом) и диабетом (≥12 месяцев).
В отношении препаратов для лечения СДВГ, ни одно РКИ не длилось ≥6 месяцев, ни одно когортное исследование – 6–12 месяцев, в то время как пять когортных исследований шли на протяжении ≥12 месяцев (диапазон: 12–130 месяцев)99,174-177. Выраженные защитные эффекты были обнаружены при анализе взаимосвязи между приемом метилфенидата и развитием любого рака (≥12 месяцев), которые сохранились после дополнительных анализов из той же базы данных при исключении данных по применению нескольких препаратов одновременно99 (*примечание переводчиков: в оригинальном исследовании говорится об отсутствии каких-либо связей между метилфенидатом и раком, а не о защитных эффектах).
В отношении стабилизаторов настроения ни одно РКИ не длилось ≥6 месяцев, когортных исследований не было найдено, поэтому данных о долгосрочных нежелательных явлениях для стабилизаторов настроения не существует.
ОБСУЖДЕНИЕ
Настоящий мета-обзор 80 психотропных препаратов обобщает информацию о 78 заранее выбранных нежелательных явлениях у детей и подростков с психическими заболеваниями, представляя количественные данные по 18 антидепрессантам (N=120 637), 15 антипсихотикам (N=66 764), семи препаратам для лечения СДВГ (N=148 664) и шести стабилизаторам настроения (N=1621).
В целом величина охвата заранее выбранных нежелательных явлений составила 0–24,4% для антидепрессантов (нет данных по 26 антидепрессантам), 0–56,4% для антипсихотиков (нет данных по шести антипсихотикам), 7,7–32,1% для препаратов для лечения СДВГ (данные по всем препаратам) и 0–24,4% для стабилизаторов настроения (нет данных по двум стабилизаторам настроения).
О ≥20% исследуемых нежелательных явлений имелись данные только по 6 антидепрессантам (сертралин, эсциталопрам, пароксетин, флуоксетин, венлафаксин, вилазодон), восьми антипсихотикам (рисперидон, кветиапин, арипипразол, луразидон, палиперидон, зипрасидон, оланзапин, азенапин), трем препаратам для лечения СДВГ (метилфенидат, атомоксетин, гуанфацин) и двум стабилизаторам настроения (вальпроевая кислота, литий).
Таким образом, настоящий метаобзор показывает, что информация о побочных эффектах психотропных препаратов у детей и подростков ограничена и что на настоящее время психостимуляторы являются наиболее изученной группой препаратов.
Основными нежелательными явлениями антидепрессантов были (в порядке убывания количества препаратов, связанных с конкретным побочным эффектом): тошнота/рвота, прекращение приема препарата из-за нежелательных явлений, экстрапирамидные побочные эффекты, увеличение веса, седация, диарея, головные боли и анорексия. Исходя из соотношения «безопасность/охват» среди препаратов, для которых имеются данные по ≥20% нежелательных явлений, наилучший профиль безопасности был выявлен для эсциталопрама и флуоксетина, а худший – для венлафаксина. Эти данные подтверждают в более всесторонней модели результаты предыдущего СМА по антидепрессантам у детей и подростков40 (посвященного, однако, эффективности в качестве основного исхода), в котором было установлено, что флуоксетин и эсциталопрам не были связаны с большим количеством выбываний из исследований, чем плацебо, в то время как для венлафаксина величина эффекта была умеренной (ОШ=3,19). В том же СМА флуоксетин был единственным антидепрессантом, значительно превосходящим плацебо в отношении влияния на депрессивные симптомы (СРС=-0,51).
Объединяя результаты по безопасности из настоящего метаобзора с имеющимися данными об эффективности из указанного СМА40, флуоксетин, вероятно, имеет лучшее соотношение «вред/польза» среди всех антидепрессантов для молодых пациентов и может быть предложен в качестве первой линии лечения депрессивных расстройств у детей и подростков.
Основными побочными эффектами антипсихотиков были (в порядке убывания количества препаратов, связанных с конкретным нежелательным явлением): седация, экстрапирамидные побочные эффекты, увеличение массы тела, гиперпролактинемия, повышение уровня холестерина и глюкозы. Основываясь на соотношении «безопасность/ охват» среди препаратов, для которых имеются данные по ≥20% нежелательных явлений, наилучший профиль безопасности у луразидона, а худший – у оланзапина. Это частично подтверждает в рамках более всесторонней модели результаты крупнейшего СМА антипсихотиков у детей и подростков с шизофренией101 (посвященного, однако, эффективности в качестве основного исхода). В указанном СМА единственным антипсихотиком, превосходящим остальные, был клозапин, без отличий по другим антипсихотикам, за исключением того, что зипрасидон уступал молиндону, оланзапину и рисперидону, а флуфеназин – им всем.
Объединяя результаты настоящего метаобзора по безопасности с имеющимися данными по эффективности101, луразидон может быть предложен в качестве первой линии терапии расстройств шизофренического спектра у детей и подростков. Препараты с худшей переносимостью, но сопоставимой эффективностью могут быть использованы в качестве второй линии терапии, с выбором конкретного препарата на основе ожиданий пациентов и из соображений безопасности (например, сексуально активные пациенты могут предпочесть препараты, не повышающие уровень пролактина). Важно отметить, что клозапин следует рассматривать только в случаях резистентности, учитывая недостаток доказательств о безопасности его применения у детей и подростков, а также плохой профиль безопасности у взрослых192, который, вероятно, будет таким же или даже хуже у детей и подростков.
Основными нежелательными явлениями препаратов для лечения СДВГ были (в порядке убывания количества препаратов, связанных с конкретным нежелательным явлением): анорексия, бессонница, потеря веса, боль в животе, гипертония и седация. Основываясь на соотношении «безопасность/охват» среди препаратов, для которых имеются данные по ≥20% нежелательных явлений, наилучший профиль безопасности наблюдается у метилфенидата, а худший – у атомоксетина и гуанфацина. Наш всесторонний метаобзор дает более детальное представление о нежелательных явлениях препаратов для лечения СДВГ, в то время как в самом большом СМА на сегодняшний день144 не было выявлено различий по переносимости между этими препаратами. Несколько удивительно, что прием метилфенидата оказался защитным фактором в отношении развития рака при оценке длительных исследований, причем такая ассоциация оставалась действительной после проведения дополнительных анализов с исключением полипрагмазии99, что обосновывает значимость дальнейших исследований этого протективного эффекта*.
Наш метаобзор показывает, что и атомоксетин, и метилфенидат стимулируют потерю веса, что согласуется с предыдущими выводами144. Седация наблюдалась только при применении a2-агонистов: клонидина и гуанфацина. В клинической практике этот эффект иногда можно использовать для борьбы с бессонницей, но остаточная дневная седация может ухудшать когнитивное функционирование пациентов с СДВГ. С точки зрения эффективности, в вышеупомянутом СМА144 только метилфенидат превосходил плацебо (СРС=-0,82) по оценкам учителей. Кроме того, метилфенидат превосходил атомоксетин (СРС=0,22). Учитывая имеющиеся данные по безопасности и эффективности, метилфенидат может рассматриваться в качестве первой линии терапии СДВГ у детей и подростков.
Основными побочными эффектами стабилизаторов настроения были (с одинаковым количеством препаратов, связанных с конкретным нежелательным явлением) седация и увеличение веса. Основываясь на соотношении «безопасность/охват» среди препаратов, для которых имеются данные по ≥20% нежелательных явлений, наилучший профиль безопасности наблюдался у лития, а худший – у вальпроевой кислоты. Хотя отсутствие связей между приемом препаратов лития с нарушениями щитовидной железы / почек188, а также набором веса190, вероятно, объясняется небольшим размером выборки включенных РКИ (N=124 и N=31 соответственно) и короткой продолжительностью одного РКИ (3 месяца)188, значимое увеличение веса должно было бы наблюдаться в РКИ длительностью 6 месяцев190. Учитывая признанную эффективность лития, который применяется в качестве первой линии терапии биполярного расстройства у подростков в соответствии с международными рекомендациями193, имеющаяся на настоящий момент информация о соотношении «вред/польза» подтверждает предпочтительный выбор лития среди других стабилизаторов настроения у молодых пациентов. Однако долгосрочные когортные исследования в данной возрастной группе явно необходимы. Согласно настоящему метаобзору, все антипсихотики имеют больше побочных эффектов, чем литий, за исключением луразидона, который, по-видимому, имеет сходный по безопасности профиль и может быть предпочтительнее лития для лечения биполярного депрессивного расстройства193,194.
Результаты настоящего метаобзора необходимо интерпретировать с учетом некоторых ограничений. Во-первых, данные о нежелательных явлениях отсутствуют для некоторых и ограничены для многих рассмотренных психотропных препаратов. Отсутствие доказательств наличия тех или иных нежелательных явлений не может рассматриваться как доказательство их отсутствия. Поэтому в исследованиях, посвященных применению психотропных препаратов у детей и подростков, настоятельно рекомендуется ведение более полной отчетности о нежелательных явлениях.
Во-вторых, информация о нежелательных явлениях преимущественно основывается на спонтанных сообщениях.
В то время как они будут недооценивать частоту таких событий, использование рейтинговых шкал может повысить уровень «шума». Интервьюирование и/или проведение шкал самоопросников обеспечит более полный учет нежелательных явлений, а применение подходящих пороговых значений по степени тяжести и частоте может повысить отношение «сигнал/шум».
В-третьих, долгосрочные и редкие нежелательные явления, скорее всего, недостаточно отражены в анализируемых данных, которые преимущественно основаны на краткосрочных и среднесрочных РКИ, и только восемь когортных исследований достаточного методологического качества были более долгосрочными. В-четвертых, мы не делили нежелательные явления в зависимости от доз препаратов из-за ограниченности данных. В-пятых, мы использовали трансдиагностический подход, чтобы собрать всю имеющуюся информацию. Хотя некоторые нежелательные явления могут различаться в зависимости от психического расстройства, четких доказательств этого нет, и другие факторы, связанные с пациентами и препаратами, которые являются трансдиагностическими (например, возраст, нелеченность пациента, доза, сопутствующие препараты), вероятно, более значимы, чем диагноз.
Конечно, безопасность лекарств должна учитываться наряду с их эффективностью. Это не было целью настоящего крупномасштабного метаобзора, но мы рассмотрели наши выводы в контексте данных самого большого и последнего СМА или МА эффективности соответствующего класса препаратов по его основному показанию. Наконец, в этом мета-обзоре не предлагаются стратегии предотвращения или смягчения побочных эффектов психотропных препаратов у молодых пациентов. Хотя это явно важная область, данная тема выходит за рамки настоящего обзора и должна рассматриваться на основе обзоров и исследований, посвященных конкретным побочным эффектам отдельных лекарственных средств195-201.
Таким образом, результаты настоящего метаобзора имеют клиническое значение и могут служить руководством по применению психотропных препаратов у детей и подростков. Во-первых, информации высокого качества по побочным эффектам некоторых препаратов в данной возрастной группе нет или ее недостаточно, что должно предостерегать от их применения. Во-вторых, в рамках каждого из четырех основных классов мы предлагаем иерархию препаратов на основе имеющихся данных о безопасности: предпочтительными, вероятно, будут флуоксетин и эсциталопрам среди антидепрессантов, луразидон среди антипсихотиков, метилфенидат среди препаратов для лечения СДВГ и литий среди стабилизаторов настроения. Напротив, потенциально наименее предпочтительными препаратами, в соответствии с профилями безопасности, являются венлафаксин среди антидепрессантов, оланзапин среди антипсихотиков, атомоксетин и гуанфацин среди препаратов для лечения СДВГ и вальпроевая кислота среди стабилизаторов настроения.
Вместе с данными об эффективности этих препаратов результаты настоящего всестороннего и обновленного метаобзора высококачественных данных по безопасности применения антидепрессантов, антипсихотиков, препаратов для лечения СДВГ и стабилизаторов настроения у детей и подростков, могут служить основой для клинической практики, исследований и рекомендаций по лечению.
Благодарности
E.G. Ostinelli получает поддержку от National Institute for Health Research (NIHR) Oxford Cognitive Health Clinical Research Facility и NIHR Oxford Health Biomedical Research Centre (грант BRC-1215-20005).
Перевод: Мурашко А. А. (Москва)
Редактура: к.м.н. Дорофейкова М. В. (Санкт-Петербург), к.м.н. Потанин С.С. (Москва)
Solmi M, Fornaro M, Ostinelli E et al. Safety of 80 antidepressants, antipsychotics, anti-attention-deficit/hyperactivity medications and mood stabilizers in children and adolescents with psychiatric disorders: a large scale systematic meta-review of 78 adverse effects. World Psychiatry. 2020;19(2):214-232.
DOI:10.1002/wps.20765
Некоторые антидепрессанты, антипсихотики, препараты для лечения синдрома дефицита внимания и гиперактивности (СДВГ) и стабилизаторы настроения, назначаемые взрослым, получили одобрение регулирующих органов для использования в детском и/или подростковом возрасте5, а многие из них используются офф-лейбл6-10. Однако несмотря на доказательства эффективности ряда психотропных препаратов в молодом возрасте, длительность нелеченного заболевания при депрессивном расстройстве11, биполярном аффективном расстройстве12,13, шизофрении14, обсессивно-компульсивном расстройстве15, тревожном расстройстве16 и других психических расстройствах17 часто бывает большой18,19, что отрицательно сказывается на отдаленных исходах14,20-24. Такая задержка может быть связана с несколькими факторами. Они, безусловно, включают более низкую обращаемость из-за стигматизации и самостигматизации, связанной с психическими заболеваниями25-27, но также актуальны связанные со стигматизацией или основанные на данных исследований опасения по поводу безопасности применения психотропных препаратов в детском и подростковом возрасте28-34.
Низкое качество данных о безопасности применения психотропных препаратов потенциально может быть причиной задержки начала лечения или отказа от него, несмотря на доказательства того, что лекарства, используемые в психиатрии, как правило, не менее эффективны, чем те, которые назначаются в других областях медицины35. Например, плохая отчетность о нежелательных явлениях (НЯ) в доступных рандомизированных контролируемых исследованиях (РКИ) может приводить к неточным оценкам некоторых серьезных явлений, таких как суицидальное поведение при применении антидепрессантов36. Кроме того, регулирующие органы могут обязать вкладывать в упаковки препаратов предупреждения о нежелательных явлениях препаратов, таких как, например, повышение риска суицидального поведения у детей, подростков и молодых взрослых при применении антидепрессантов37, которые могут повлиять на повседневную клиническую практику назначения препаратов38, но обоснованность которых затем может быть поставлена под сомнение39,40. В то же время, вопросы безопасности применения препаратов и предупреждения о них, основанные на доказательствах, необходимы для регулирования клинических руководств, практической помощи и имеют решающее значение для защиты пациентов в соответствии с принципом «не навреди» (primum non nocere).
Данных о безопасности психотропных средств у детей и подростков с психическими расстройствами становится больше41, но они остаются разрозненными. Имеющиеся сетевые метаанализы (СМА) и метаанализы (МА) обычно изучают в качестве своего основного исхода эффективность, в то время как безопасность обычно не ставится во главу угла в РКИ и связанных с ними обзорных работах. Кроме того, СМА и МА, как правило, включают РКИ, касающиеся только одного или, реже, нескольких связанных психических расстройств.
В то время как в РКИ минимизировано влияние нескольких источников систематических ошибок на оценку эффектов лекарств в конкретной популяции, они также имеют строгие критерии отбора, что снижает обобщаемость и внешнюю валидность их выводов. Кроме того, РКИ часто являются относительно небольшими по объему и короткими, что исключает адекватное выявление редких, но серьезных или долгосрочных нежелательных явлений42. Кроме того, СМА и МА обычно рассматривают использование лекарств при расстройствах, для которых они показаны, исключая данные по применению офф-лейбл. Поэтому всестороннее обобщение сведений о безопасности психотропных препаратов при всех психических состояниях, при которых они используются у детей и подростков, основанное на РКИ и больших когортных исследованиях, включающее более обобщаемые выборки и отражающее реальные модели применения препаратов, имеет важное значение с клинической точки зрения.
Насколько нам известно, на настоящий момент не существует систематического метаобзора, в котором основное внимание уделялось бы безопасности психотропных препаратов у детей и подростков в качестве основного исхода, обобщающего данные СМА, МА, крупнейших РКИ и хорошо продуманных когортных исследований по всем соответствующим психическим расстройствам. Цель настоящего метаобзора состояла в том, чтобы максимально полно и всесторонне обобщить существующие сведения о безопасности четырех основных классов психотропных препаратов (антидепрессанты, антипсихотики, препараты для лечения СДВГ, стабилизаторы настроения) у детей и подростков с психическими расстройствами, чтобы предоставить информацию, необходимую для принятия решений в клинической практике и разработки клинических руководств, а также определить области, требующие дальнейших исследований.
МЕТОДЫ
Поиск, критерии включения и исключения
Настоящий систематический мета-обзор проводился в соответствии с a priori протоколом (предоставляется по запросу). Мы выполнили систематический поиск по PubMed и PsycINFO с момента создания баз данных до 7 сентября
2019 г., используя исчерпывающую комбинацию ключевых слов как по психотропным препаратам, так и по нежелательным эффектам (полная строка поиска доступна по запросу). Дополнительно вручную были изучены библиографические списки включенных статей. Авторы парами проводили скрининг заголовков / резюме статей и оценку полнотекстовых версий, а также извлекали данные в заранее составленную таблицу excel. Третий автор разрешал разногласия.
Критериями включения были: а) СМА, МА, РКИ и когортные исследования, оценивающие риск систематических ошибок по показаниям (то есть медикаментозное лечение в сравнении с плацебо/отсутствием медикаментозного лечения у лиц, страдающих одним и тем же расстройством); б) данные о связи между антидепрессантами, антипсихотиками, препаратами для лечения СДВГ, стабилизаторами настроения и неблагоприятными эффектами для здоровья; в) выборка пациентов детского и/или подросткового возраста с любым психическим расстройством.
Критериями исключения были: а) исследования других состояний (не психических расстройств), для которых показаны или используются психотропные препараты (например, эпилепсия); б) риск систематических ошибок по показаниям (то есть сравнение пациентов, принимающих препараты, с контрольными группами здоровых людей), даже если анализ данных был скорректирован по ковариатам;
в) дизайн исследований, отличный от указанного в критериях включения; г) отсутствие данных о связи между изучаемыми препаратами и неблагоприятными эффектами.
Нежелательные явления и психотропные препараты, включенные в метаобзор
78 изначально отобранных нежелательных явлений были разделены на следующие 19 категорий: нежелательные явления со стороны центральной нервной системы (возбуждение, тревога, астения, раздражительность, когнитивные нарушения, депрессия, головокружение, головная боль, мания, психоз, седация, бессонница, судороги, суицидальные идеи/поведение/попытки); пищевые и метаболические (анорексия, переедание / повышенный аппетит, повышенный холестерин, повышенный уровень триглицеридов, метаболический синдром, нарушение регуляции глюкозы / диабет, инсулинорезистентность, увеличение окружности талии, увеличение массы тела / увеличение индекса массы тела, потеря веса); сердечно-сосудистые (аритмии/тахикардия, кардиомиопатия, цереброваскулярные заболевания, ишемическая болезнь сердца, гипертония, гипотония, миокардит, удлинение интервала QT, внезапная сердечная смерть); желудочно-кишечные (боль в животе, запор, диарея, желудочно-кишечные симптомы, поражение печени, тошнота/рвота); мочеполовые (энурез, нефропатия / почечная недостаточность, изменения менструального цикла, синдром поликистозных яичников, сексуальная дисфункция); двигательные расстройства (акатизия, любые экстрапирамидные побочные эффекты, тремор, дистония, поздняя дискинезия); импульсивность и рискованное поведение (преступное поведение, азартные игры, злоупотребление психоактивными веществами, самоповреждения без суицидальной цели); эндокринные (гинекомастия/галакторея, гипо-/гиперпролактинемия, гипо-/гипертиреоз); гематологические (анемия, лейкоцитопения, тромбоцитопения); связанные с ротовой полостью (кариес зубов, сухость во рту, гиперсаливация); респираторные (острая дыхательная недостаточность, астма, назофарингит / инфекция верхних дыхательных путей/пневмония); венозная тромбоэмболия (тромбоз глубоких вен, тромбоэмболия легочной артерии); костные (остеопения/остеопороз, переломы костей); несчастные случаи (любые случаи, падения); нейролептический злокачественный синдром (нейролептический злокачественный синдром / лихорадка / повышение уровня креатинфосфокиназы); любой рак; прекращение приема препарата из-за неблагоприятных явлений; серьезные нежелательные явления; смертность (все причины, связанные с естественными причинами; самоубийства).
80 психотропных препаратов были разделены на четыре категории: антидепрессанты, антипсихотики, препараты для лечения СДВГ, стабилизаторы настроения. Категория антидепрессантов включала девять классов: ингибиторы моноаминоксидазы (ИМАО) (бифемелан, гидракарбазин, изокарбоксазид, моклобемид, ниаламид, фенелзин, пирлиндол, разагилин, сафинамид, селегилин, толоксатон и транилципромин); трициклические (ТЦА) и тетрациклические (ТеЦА) (амитриптилин, амоксапин, кломипрамин, дезипрамин, доксепин, имипрамин, мапротилин, нортриптилин, протриптилин и тримипрамин); селективные ингибиторы обратного захвата серотонина (СИОЗС) (циталопрам, эсциталопрам, флуоксетин, флувоксамин, пароксетин и сертралин); ингибиторы обратного захвата серотонина и норадреналина (ИОЗСН) (дезвенлафаксин, дулоксетин, левомилнаципран, милнаципран и венлафаксин); частичные антагонисты / ингибиторы обратного захвата серотонина (АИОЗС) (нефазодон, тразодон и милазодон); норадренергические и специфические серотонинергические антидепрессанты (НАССА) (миансерин и миртазапин); ингибиторы обратного захвата норадреналина (ИОЗН) (ребоксетин); ингибиторы обратного захвата норадреналина и дофамина (ИОЗНД) (бупропион); другие (агомелатин, эскетамин, S-аденозилметионин и вортиоксетин). Категория антипсихотиков включала два класса: антипсихотики первого поколения (АПП) (хлорпромазин, флуфеназин, галоперидол, локсапин, молиндон, перфеназин, промазин и трифлуоперазин) и антипсихотики второго поколения (АВП) (амисульприд, арипипразол, азенапин, брекспипразол, карипразин, клозапин, илоперидон, луразидон, оланзапин, палиперидон, кветиапин, рисперидон и зипрасидон). Препараты для лечения СДВГ включали психостимуляторы (d-амфетамин, лиздексамфетамин и метилфенидат) и препараты с другими механизмами действия (атомоксетин, клонидин, гуанфацин и модафинил). Стабилизаторы настроения включали противоэпилептические препараты (карбамазепин, габапентин, ламотриджин, прегабалин, окскарбазепин, топирамат и вальпроаты) и литий.
Первичные и вторичные результаты
В качестве первичного исхода оценивалось соотношение «безопасность/охват» (то есть отношение количества нежелательных явлений, значительно более выраженных в сравнении с плацебо / отсутствием лечения, к количеству нежелательных явлений, охваченных литературой) для тех психотропных препаратов, для которых ≥20% из 78 априори выбранных НЯ были описаны в работах. Вторичным исходом был список нежелательных явлений, связанных с каждым препаратом, величина эффекта ± 95% ДИ и качество исследования.
Сила связи каждого препарата с основными нежелательными явлениями расценивалась как слабая (≤0,5), средняя (>0,5 и <0,8) и сильная (≥0,8) для количественных переменных (величина эффектов >0), и инвертированные пороговые значения использовались в случае величины эффектов <0. Для качественных переменных сила связей оценивалась как слабая (<3), средняя (≥3 и <5) и сильная (≥5) при эквивалентных отношениях шансов (эОШ) >1, и обратные пороговые значения – при эОШ <143.
Оценка качества
Качество МА и СМА оценивалось с помощью модифицированной версии A Measurement Tool for the Assessment of Multiple Systematic Reviews (AMSTAR)-PLUS44, которая позволяет оценивать как качество (С)МА, так и исследований, включенных в них (AMSTAR-Content). Качество по AMSTAR оценивалось как низкое при итоговой сумме баллов <4, среднее – при 4–7 баллах, высокое – при >7 баллах45. Для AMSTAR-Content качество оценивалось как низкое при <4 баллах, среднее – при 4–6 баллах, высокое – при >6 баллах. Итоговая оценка качества (С)МА выставлялась по более низкому значению при выборе между AMSTAR и AMSTAR-Content.
Качество РКИ оценивалось с помощью Risk of Bias tool 246, согласно которому работе присваивается высокий, низкий риск систематических ошибок или «некоторые сомнения». Качество когортных исследований оценивалось с помощью шкалы Newcastle-Ottawa Scale (NOS)47, высокое качество присваивалось, когда оценка по NOS составляла ≥7.
Статистический анализ
Используя модель случайных эффектов, мы извлекали величины эффектов ± 95% ДИ для оценки разницы частоты возникновения специфических нежелательных явлений между отдельными препаратами и плацебо (РКИ), или между получающими и не получающими лечение молодыми пациентами с психическими расстройствами (когортные исследования). Мы оценивали ОШ, логарифм ОШ и ОР с соответствующим индексом потенциального вреда (ИПВ) для качественных данных по исходам и стандартизированную разность средних (СРС) или разность средних (РС) для количественных данных по исходам.
Мы рассчитали итоговую пропорцию охвата априори выбранных нежелательных явлений для каждого из психотропных препаратов, используя описательную статистику, и разделили охваченные нежелательные явления на те, которые возникают или не возникают значительно чаще в сравнении с плацебо или соответствующей группой сравнения. Кроме того, мы определили препараты с лучшим или худшим профилем безопасности по соотношению «безопасность/охват» для препаратов, имевших данные по ≥20% нежелательных явлений.

РЕЗУЛЬТАТЫ
Результаты поиска
Блок-схема процесса систематического поиска представлена на Рисунке 1. Мы просмотрели заголовки и резюме 1309 СМА и МА, 5716 РКИ и 8518 когортных исследований. Мы оценили полнотекстовые версии 292 СМА и МА, 519 РКИ и 173 когортных исследований. Мы извлекли данные из девяти СМА, 39 МА, 90 РКИ и восьми когортных исследований, которые включали 337 686 детей и подростков (120 637 – антидепрессанты, 66 764 антипсихотики, 148 664 – препараты для лечения СДВГ и 1621 – стабилизаторы настроения). По антидепрессантам мы включили 4 СМА40,48-50, 15 МА36,51-64, 27 РКИ65-91, которые отражены в СМА/МА, 6 дополнительных РКИ92-97 и 3 когортных исследования98-100. Они включали 120 637 молодых пациентов, принимавших антидепрессанты: 24 659 человек в 139 РКИ (после удаления дубликатов РКИ в многочисленных СМА/МА) (22 704 человека в СМА/МА, 1955 в дополнительных РКИ) и 95 978 человек в трех когортных исследованиях.
По антипсихотикам мы включили 3 СМА101-103, 11 МА104-114, 25 РКИ115-139, включенных в СМА/МА, 3 дополнительных РКИ140-142 и 2 когортных исследования99,143. Они включали 66764 молодых пациента, принимавших антипсихотики: 7712 пациентов в 53 РКИ (после удаления дубликатов РКИ в многочисленных СМА/МА) (6725 в СМА/МА, 987 в дополнительных РКИ) и 59 052 человека в когортных исследованиях.
По препаратам для лечения СДВГ мы включили 3 СМА49,144,145, 11 МА146-156, 12 РКИ157-168, включенных в СМА/МА, 5 дополнительных РКИ169-173 и 5 когортных исследований99,174-177. Они включали 148 664 молодых пациента, принимавших препараты для лечения СДВГ: 28 834 человека в 298 РКИ (после удаления дубликатов РКИ в многочисленных СМА/МА) (27 188 в СМА/МА, 1646 в дополнительных РКИ) и 119 830 человек в 5 когортных исследованиях.
По стабилизаторам настроения мы включили 4 МА107,112,178,179, 7 РКИ180-186, включенных в СМА/МА и 5 дополнительных РКИ187-191. Они включали 1621 молодого пациента в 23 РКИ (после удаления дубликатов РКИ в многочисленных СМА/МА) (1244 в СМА/МА, 377 в дополнительных РКИ).
Качество включенных работ
Среди девяти СМА медиана по AMSTAR была 10 (межквартильный размах IQR=9–11), а по AMSTAR-Content –
5 (IQR=5–7). Качество было средним в двух (22,2%) СМА и высоким в остальных семи СМА (77,8%). РКИ, включенные в СМА, были среднего качества в шести (66,7%) СМА и высокого – в трех (33,3%) СМА. Итоговая оценка качества была средней у шести (66,7%) и высокой у трех (33,3%) СМА.
Среди 39 МА медиана по AMSTAR была 9 (IQR=7–10), а по AMSTAR-Content – 5 (IQR=4–6). Качество было средним в 11 МА (28,2%) и высоким в остальных 28 (71,8%). РКИ, включенные в МА, были низкого качества в девяти (23,1%) МА, среднего – в 23 (59,0%) и высокого – в семи (17,9%) МА. Итоговая оценка качества была низкой у 9 (23,1%), средней у 25 (64,1%) и высокой у пяти (12,8%) МА.
Среди 90 РКИ 26 (28,6%) имели высокий риск систематических ошибок, 43 (47,3%) вызывали некоторые сомнения, а в 22 (24,2%) риск систематических ошибок был низким.
Среди восьми когортных исследований шесть (75%) имели высокое качество по шкале Newcastle-Ottawa scale, а медиана была равна семи (IQR=7–8).
Безопасность применения различных классов психотропных препаратов у детей и подростков
с психическими расстройствами
Антидепрессанты
Освещенные в работах данные о нежелательных явлениях были найдены для 18 (40,9%) из 44 антидепрессантов.


Доступная литература охватывала 0–24,4% (среднее значение: 5,6%, медиана: 0%) исследуемых нежелательных явлений. Подробная информация о доле из 78 нежелательных явлений, освещенных в литературе, и о значительно более выраженных нежелательных явлениях при применении отдельных антидепрессантов по сравнению с плацебо/контролем представлена в Таблице 1 и на Рисунке 2.
Среди антидепрессантов с охватом ≥20% нежелательных явлений, соотношение «безопасность/охват» оказалось наилучшим у эсциталопрама (1/17 охваченных побочных эффектов значительно более выражены) и флуоксетина (1/16), постепенно ухудшаясь у вилазодона (2/16), пароксетина (3/16), сертралина (4/19) и венлафаксина, который имел худшее соотношение «безопасность/охват» (7/16).
Пять антидепрессантов были связаны со значительно более выраженными тошнотой/рвотой (дулоксетин, нефазодон, пароксетин, сертралин, вилазодон), четыре – с прекращением приема в связи с побочными эффектами (дулоксетин, имипрамин, венлафаксин, вилазодон), три – с экстрапирамидными побочными эффектами (кломипрамин, имипрамин, пароксетин), по два – с седацией (имипрамин, нефазодон), диареей (дулоксетин, сертралин), головными болями (нефазодон, венлафаксин), анорексией (амитриптилин, венлафаксин) и увеличением массы тела / увеличением индекса массы тела (эсциталопрам, сертралин), а также по одному с потерей массы тела (флуоксетин) и суицидальным поведением (венлафаксин).
Антипсихотики
В работах представлена информация о нежелательных явлениях для 15 (71,4%) из 21 антипсихотиков. Доступные работы охватывали 0–56,4% (среднее значение: 16,6%, медиана: 2,6%) исследуемых нежелательных явлений. Подробная информация о доле из 78 нежелательных явлений, освещенных в литературе, и о значительно более выраженных нежелательных явлений при применении отдельных антидепрессантов по сравнению с плацебо/контролем, представлена в Таблице 2 и на Рисунке 2.
Среди антипсихотиков с охватом ≥20% побочных эффектов луразидон имел лучшее соотношение «безопасность/охват» (1/33 охваченных побочных эффектов значительно более выражены), далее в порядке ухудшения шли азенапин (2/22), кветиапин (5/37), зипрасидон (4/25), палиперидон (5/26), рисперидон (12/44), арипипразол (10/35) и оланзапин, который имел худшее соотношение «безопасность/охват» (13/25).
Десять антипсихотиков были связаны со значительно более выраженным седативным эффектом (арипипразол, клозапин, галоперидол, локсапин, молиндон, оланзапин, палиперидон, кветиапин, рисперидон, зипрасидон), девять – с экстрапирамидными побочными эффектами (амисульприд, арипипразол, галоперидол, локсапин, молиндон, оланзапин, палиперидон, рисперидон, зипрасидон), семь – с увеличением массы тела (арипипразол, азенапин, клозапин, оланзапин, палиперидон, кветиапин, рисперидон), пять – с гиперпролактинемией (галоперидол, оланзапин, палиперидон, кветиапин, рисперидон), и по три – с повышенным уровнем холестерина (арипипразол, оланзапин, кветиапин) и повышением уровня глюкозы / диабетом (азенапин, оланзапин, рисперидон).
Препараты для лечения СДВГ
В исследуемой литературе представлена информация о нежелательных явлениях для всех семи препаратов для лечения СДВГ. Доступные работы охватывали 7,7–32,1% (среднее значение: 19,0%, медиана: 17,9%) исследуемых нежелательных явлений. Подробная информация о доле из 78 нежелательных явлений, освещенных в литературе, и о нежелательных явлениях, значительно более выраженных при применении отдельных препаратов для лечения СДВГ по сравнению с плацебо/контролем, представлена в Таблице 3 и на Рисунке 2.

Рисунок 2. Доля нежелательных явлений, освещенных в литературе, которые существенно или несущественно отличались от плацебо, для антидепрессантов, антипсихотиков, препаратов для лечения СДВГ и стабилизаторов настроения у детей и подростков с психическими заболеваниями. АМИ – амитриптилин, АМС – амисульприд, АРИ – арипипразол, АСЕ – азенапин (асенапин), АТО – атомоксетин, БУП – бупропион, ВАЛ – вальпроаты, ВЕН – венлафаксин, ВИЛ – вилазодон, ГАЛ – галоперидол, ГУА – гуанфацин, Д-АМФ – дексамфетамин, ДВФ – дезвенлафаксин, ДЕЗ – дезипрамин, ДУЛ – дулоксетин, ЗИП – зипрасидон, ИМИ – имипрамин, КАР – карбамазепин, КВЕ – кветиапин, КЛЗ – клозапин, КЛМ – кломипрамин, КЛН – клонидин, ЛАМ – ламотриджин, ЛДА – лиздексамфетамин, ЛИТ – литий, ЛОК – локсапин, ЛУР – луразидон, МИР – миртазапин, МОД – модафинил, МОЛ – молиндон, МФН – метилфенидат, НЕФ – нефазодон, НОР – нортриптилин, ОКС – окскарбазепин, ОЛА – оланзапин, ПАЛ – палиперидон, ПАР – пароксетин, РИС – рисперидон, СЕР – сертралин, ТОП – топиромат, ТРИФ – трифлуоперазин, ФЛВ – флувоксамин, ФЛУ – флуоксетин, ФЛФ – флуфеназин, ЦИТ – циталопрам, ЭСЦ – эсциталопрам.
Среди препаратов для лечения СДВГ с охватом ≥20% побочных эффектов метилфенидат имел лучшее соотношение «безопасность/охват» (5/25 охваченных побочных эффектов значительно более выражены), в то время как гуанфацин и атомоксетин – худшее (4/16 и 5/20 соответственно).
Пять препаратов для лечения СДВГ были связаны со значительно более выраженной анорексией (атомоксетин, дексамфетамин, лиздексамфетамин, метилфенидат, модафинил), четыре – с бессонницей (дексамфетамин, лиздексамфетамин, метилфенидат, модафинил), три – с потерей веса (атомоксетин, метилфенидат, модафинил), по два – с болями в животе (метилфенидат, гуанфацин), прекращением приема препарата из-за нежелательных явлений (лиздексамфетамин, гуанфацин), гипертензией (атомоксетин, лиздексамфетамин) и седацией (клонидин, гуанфацин), а также один – с удлинением интервала QT (гуанфацин).
Стабилизаторы настроения
В литературе представлена информация о нежелательных явлениях для шести (75,0%) из восьми стабилизаторов настроения. Доступные работы охватывали 0–24,4% (среднее значение: 12,7%, медиана: 14,1%) исследуемых нежелательных явлений. Подробная информация о доле из 78 нежелательных явлений, освещенных в литературе, и о нежелательных явлениях, значительно более выраженных при применении отдельных стабилизаторов настроения по сравнению с плацебо/контролем, представлена в Таблице 4 и на Рисунке 2.
Среди стабилизаторов настроения с охватом ≥20% нежелательных явлений лучшее соотношение «безопасность/ охват» было выявлено для лития (0/16 охваченных побочных эффектов значительно более выражены), в то время как для вальпроатов – худшее (4/19).
Два стабилизатора настроения были ассоциированы со значительно более выраженным седативным эффектом (окскарбазепин, вальпроаты) и увеличением массы тела (окскарбазепин, вальпроаты), а также по одному – с потерей веса или анорексией (топирамат), тромбоцитопенией и лейкоцитопенией (вальпроаты) и тошнотой/рвотой (окскарбазепин).


Данные из исследований длительностью ≥6 месяцев
В отношении антидепрессантов все РКИ длились менее 6 месяцев, в то время как одно когортное исследование длилось от 6 до 12 месяцев100, а два ≥12 месяцев (диапазон: 12–130 месяцев)98,99. Значимые взаимосвязи отмечались между текущим приемом разных антидепрессантов (в целом) и переломами (небольшая величина эффекта, ≥12 месяцев), но эти связи становились незначимыми при учете предыдущего приема антидепрессантов. Кроме того, в первой версии анализа большого когортного исследования (≥12 месяцев) была выявлена небольшая ассоциация приема антидепрессантов с повышенным риском развития любого рака, но дополнительные анализы из той же базы данных не подтвердили такую ассоциацию при исключении данных по полипрагмазии99.
В отношении антипсихотиков ни одно РКИ не длилось ≥6 месяцев, ни одно когортное исследование не длилось
6–12 месяцев, в то время как два когортных исследования длились ≥12 месяцев (диапазон: 84–130 месяцев)99,143. Была обнаружена сильная связь между приемом разных АВП (в целом) и диабетом (≥12 месяцев).

В отношении препаратов для лечения СДВГ, ни одно РКИ не длилось ≥6 месяцев, ни одно когортное исследование – 6–12 месяцев, в то время как пять когортных исследований шли на протяжении ≥12 месяцев (диапазон: 12–130 месяцев)99,174-177. Выраженные защитные эффекты были обнаружены при анализе взаимосвязи между приемом метилфенидата и развитием любого рака (≥12 месяцев), которые сохранились после дополнительных анализов из той же базы данных при исключении данных по применению нескольких препаратов одновременно99 (*примечание переводчиков: в оригинальном исследовании говорится об отсутствии каких-либо связей между метилфенидатом и раком, а не о защитных эффектах).
В отношении стабилизаторов настроения ни одно РКИ не длилось ≥6 месяцев, когортных исследований не было найдено, поэтому данных о долгосрочных нежелательных явлениях для стабилизаторов настроения не существует.
ОБСУЖДЕНИЕ
Настоящий мета-обзор 80 психотропных препаратов обобщает информацию о 78 заранее выбранных нежелательных явлениях у детей и подростков с психическими заболеваниями, представляя количественные данные по 18 антидепрессантам (N=120 637), 15 антипсихотикам (N=66 764), семи препаратам для лечения СДВГ (N=148 664) и шести стабилизаторам настроения (N=1621).
В целом величина охвата заранее выбранных нежелательных явлений составила 0–24,4% для антидепрессантов (нет данных по 26 антидепрессантам), 0–56,4% для антипсихотиков (нет данных по шести антипсихотикам), 7,7–32,1% для препаратов для лечения СДВГ (данные по всем препаратам) и 0–24,4% для стабилизаторов настроения (нет данных по двум стабилизаторам настроения).
О ≥20% исследуемых нежелательных явлений имелись данные только по 6 антидепрессантам (сертралин, эсциталопрам, пароксетин, флуоксетин, венлафаксин, вилазодон), восьми антипсихотикам (рисперидон, кветиапин, арипипразол, луразидон, палиперидон, зипрасидон, оланзапин, азенапин), трем препаратам для лечения СДВГ (метилфенидат, атомоксетин, гуанфацин) и двум стабилизаторам настроения (вальпроевая кислота, литий).
Таким образом, настоящий метаобзор показывает, что информация о побочных эффектах психотропных препаратов у детей и подростков ограничена и что на настоящее время психостимуляторы являются наиболее изученной группой препаратов.
Основными нежелательными явлениями антидепрессантов были (в порядке убывания количества препаратов, связанных с конкретным побочным эффектом): тошнота/рвота, прекращение приема препарата из-за нежелательных явлений, экстрапирамидные побочные эффекты, увеличение веса, седация, диарея, головные боли и анорексия. Исходя из соотношения «безопасность/охват» среди препаратов, для которых имеются данные по ≥20% нежелательных явлений, наилучший профиль безопасности был выявлен для эсциталопрама и флуоксетина, а худший – для венлафаксина. Эти данные подтверждают в более всесторонней модели результаты предыдущего СМА по антидепрессантам у детей и подростков40 (посвященного, однако, эффективности в качестве основного исхода), в котором было установлено, что флуоксетин и эсциталопрам не были связаны с большим количеством выбываний из исследований, чем плацебо, в то время как для венлафаксина величина эффекта была умеренной (ОШ=3,19). В том же СМА флуоксетин был единственным антидепрессантом, значительно превосходящим плацебо в отношении влияния на депрессивные симптомы (СРС=-0,51).


Объединяя результаты по безопасности из настоящего метаобзора с имеющимися данными об эффективности из указанного СМА40, флуоксетин, вероятно, имеет лучшее соотношение «вред/польза» среди всех антидепрессантов для молодых пациентов и может быть предложен в качестве первой линии лечения депрессивных расстройств у детей и подростков.
Основными побочными эффектами антипсихотиков были (в порядке убывания количества препаратов, связанных с конкретным нежелательным явлением): седация, экстрапирамидные побочные эффекты, увеличение массы тела, гиперпролактинемия, повышение уровня холестерина и глюкозы. Основываясь на соотношении «безопасность/ охват» среди препаратов, для которых имеются данные по ≥20% нежелательных явлений, наилучший профиль безопасности у луразидона, а худший – у оланзапина. Это частично подтверждает в рамках более всесторонней модели результаты крупнейшего СМА антипсихотиков у детей и подростков с шизофренией101 (посвященного, однако, эффективности в качестве основного исхода). В указанном СМА единственным антипсихотиком, превосходящим остальные, был клозапин, без отличий по другим антипсихотикам, за исключением того, что зипрасидон уступал молиндону, оланзапину и рисперидону, а флуфеназин – им всем.
Объединяя результаты настоящего метаобзора по безопасности с имеющимися данными по эффективности101, луразидон может быть предложен в качестве первой линии терапии расстройств шизофренического спектра у детей и подростков. Препараты с худшей переносимостью, но сопоставимой эффективностью могут быть использованы в качестве второй линии терапии, с выбором конкретного препарата на основе ожиданий пациентов и из соображений безопасности (например, сексуально активные пациенты могут предпочесть препараты, не повышающие уровень пролактина). Важно отметить, что клозапин следует рассматривать только в случаях резистентности, учитывая недостаток доказательств о безопасности его применения у детей и подростков, а также плохой профиль безопасности у взрослых192, который, вероятно, будет таким же или даже хуже у детей и подростков.
Основными нежелательными явлениями препаратов для лечения СДВГ были (в порядке убывания количества препаратов, связанных с конкретным нежелательным явлением): анорексия, бессонница, потеря веса, боль в животе, гипертония и седация. Основываясь на соотношении «безопасность/охват» среди препаратов, для которых имеются данные по ≥20% нежелательных явлений, наилучший профиль безопасности наблюдается у метилфенидата, а худший – у атомоксетина и гуанфацина. Наш всесторонний метаобзор дает более детальное представление о нежелательных явлениях препаратов для лечения СДВГ, в то время как в самом большом СМА на сегодняшний день144 не было выявлено различий по переносимости между этими препаратами. Несколько удивительно, что прием метилфенидата оказался защитным фактором в отношении развития рака при оценке длительных исследований, причем такая ассоциация оставалась действительной после проведения дополнительных анализов с исключением полипрагмазии99, что обосновывает значимость дальнейших исследований этого протективного эффекта*.
Наш метаобзор показывает, что и атомоксетин, и метилфенидат стимулируют потерю веса, что согласуется с предыдущими выводами144. Седация наблюдалась только при применении a2-агонистов: клонидина и гуанфацина. В клинической практике этот эффект иногда можно использовать для борьбы с бессонницей, но остаточная дневная седация может ухудшать когнитивное функционирование пациентов с СДВГ. С точки зрения эффективности, в вышеупомянутом СМА144 только метилфенидат превосходил плацебо (СРС=-0,82) по оценкам учителей. Кроме того, метилфенидат превосходил атомоксетин (СРС=0,22). Учитывая имеющиеся данные по безопасности и эффективности, метилфенидат может рассматриваться в качестве первой линии терапии СДВГ у детей и подростков.
Основными побочными эффектами стабилизаторов настроения были (с одинаковым количеством препаратов, связанных с конкретным нежелательным явлением) седация и увеличение веса. Основываясь на соотношении «безопасность/охват» среди препаратов, для которых имеются данные по ≥20% нежелательных явлений, наилучший профиль безопасности наблюдался у лития, а худший – у вальпроевой кислоты. Хотя отсутствие связей между приемом препаратов лития с нарушениями щитовидной железы / почек188, а также набором веса190, вероятно, объясняется небольшим размером выборки включенных РКИ (N=124 и N=31 соответственно) и короткой продолжительностью одного РКИ (3 месяца)188, значимое увеличение веса должно было бы наблюдаться в РКИ длительностью 6 месяцев190. Учитывая признанную эффективность лития, который применяется в качестве первой линии терапии биполярного расстройства у подростков в соответствии с международными рекомендациями193, имеющаяся на настоящий момент информация о соотношении «вред/польза» подтверждает предпочтительный выбор лития среди других стабилизаторов настроения у молодых пациентов. Однако долгосрочные когортные исследования в данной возрастной группе явно необходимы. Согласно настоящему метаобзору, все антипсихотики имеют больше побочных эффектов, чем литий, за исключением луразидона, который, по-видимому, имеет сходный по безопасности профиль и может быть предпочтительнее лития для лечения биполярного депрессивного расстройства193,194.
Результаты настоящего метаобзора необходимо интерпретировать с учетом некоторых ограничений. Во-первых, данные о нежелательных явлениях отсутствуют для некоторых и ограничены для многих рассмотренных психотропных препаратов. Отсутствие доказательств наличия тех или иных нежелательных явлений не может рассматриваться как доказательство их отсутствия. Поэтому в исследованиях, посвященных применению психотропных препаратов у детей и подростков, настоятельно рекомендуется ведение более полной отчетности о нежелательных явлениях.
Во-вторых, информация о нежелательных явлениях преимущественно основывается на спонтанных сообщениях.
В то время как они будут недооценивать частоту таких событий, использование рейтинговых шкал может повысить уровень «шума». Интервьюирование и/или проведение шкал самоопросников обеспечит более полный учет нежелательных явлений, а применение подходящих пороговых значений по степени тяжести и частоте может повысить отношение «сигнал/шум».
В-третьих, долгосрочные и редкие нежелательные явления, скорее всего, недостаточно отражены в анализируемых данных, которые преимущественно основаны на краткосрочных и среднесрочных РКИ, и только восемь когортных исследований достаточного методологического качества были более долгосрочными. В-четвертых, мы не делили нежелательные явления в зависимости от доз препаратов из-за ограниченности данных. В-пятых, мы использовали трансдиагностический подход, чтобы собрать всю имеющуюся информацию. Хотя некоторые нежелательные явления могут различаться в зависимости от психического расстройства, четких доказательств этого нет, и другие факторы, связанные с пациентами и препаратами, которые являются трансдиагностическими (например, возраст, нелеченность пациента, доза, сопутствующие препараты), вероятно, более значимы, чем диагноз.
Конечно, безопасность лекарств должна учитываться наряду с их эффективностью. Это не было целью настоящего крупномасштабного метаобзора, но мы рассмотрели наши выводы в контексте данных самого большого и последнего СМА или МА эффективности соответствующего класса препаратов по его основному показанию. Наконец, в этом мета-обзоре не предлагаются стратегии предотвращения или смягчения побочных эффектов психотропных препаратов у молодых пациентов. Хотя это явно важная область, данная тема выходит за рамки настоящего обзора и должна рассматриваться на основе обзоров и исследований, посвященных конкретным побочным эффектам отдельных лекарственных средств195-201.
Таким образом, результаты настоящего метаобзора имеют клиническое значение и могут служить руководством по применению психотропных препаратов у детей и подростков. Во-первых, информации высокого качества по побочным эффектам некоторых препаратов в данной возрастной группе нет или ее недостаточно, что должно предостерегать от их применения. Во-вторых, в рамках каждого из четырех основных классов мы предлагаем иерархию препаратов на основе имеющихся данных о безопасности: предпочтительными, вероятно, будут флуоксетин и эсциталопрам среди антидепрессантов, луразидон среди антипсихотиков, метилфенидат среди препаратов для лечения СДВГ и литий среди стабилизаторов настроения. Напротив, потенциально наименее предпочтительными препаратами, в соответствии с профилями безопасности, являются венлафаксин среди антидепрессантов, оланзапин среди антипсихотиков, атомоксетин и гуанфацин среди препаратов для лечения СДВГ и вальпроевая кислота среди стабилизаторов настроения.
Вместе с данными об эффективности этих препаратов результаты настоящего всестороннего и обновленного метаобзора высококачественных данных по безопасности применения антидепрессантов, антипсихотиков, препаратов для лечения СДВГ и стабилизаторов настроения у детей и подростков, могут служить основой для клинической практики, исследований и рекомендаций по лечению.
Благодарности
E.G. Ostinelli получает поддержку от National Institute for Health Research (NIHR) Oxford Cognitive Health Clinical Research Facility и NIHR Oxford Health Biomedical Research Centre (грант BRC-1215-20005).
Перевод: Мурашко А. А. (Москва)
Редактура: к.м.н. Дорофейкова М. В. (Санкт-Петербург), к.м.н. Потанин С.С. (Москва)
Solmi M, Fornaro M, Ostinelli E et al. Safety of 80 antidepressants, antipsychotics, anti-attention-deficit/hyperactivity medications and mood stabilizers in children and adolescents with psychiatric disorders: a large scale systematic meta-review of 78 adverse effects. World Psychiatry. 2020;19(2):214-232.
DOI:10.1002/wps.20765


