Психиатрия Всемирная психиатрия
Психиатрия Всемирная психиатрия
№01 2019
Оценка риска развития птср у выживших после недавней травмы: результаты Международного консорциума по прогнозированию ПТСР (ICPP) №01 2019
Номера страниц в выпуске:77-87
Перевод: Шуненков Д.А. (Иваново)
Редактура: к.м.н. Потанин С.С. (Москва)
Своевременное определение риска посттравматического стрессового расстройства (ПТСР) является необходимым условием для эффективной медицинской помощи и профилактики. Мы представляем инструмент оценки риска, позволяющий рассчитать индивидуальную вероятность развития ПТСР на основе ранних предикторов. Члены Международного консорциума по прогнозированию ПТСР (ICPP) поделились индивидуальными данными участников из десяти лонгитюдных исследований гражданских пострадавших от травм, обратившихся в центры неотложной помощи в шести странах. Участники, удовлетворяющие критериям включения (N=2473), прошли первоначальную клиническую оценку в течение 60 дней после травмы и по крайней мере одну оценку при последующем наблюдении 4-15 месяцев спустя. Выраженность симптомов ПТСР и диагностический статус каждый раз оценивались по клинической шкале ПТСР для DSM-IV (CAPS). Данные об образовании участников, наличии предшествующей травмы в течение жизни, семейном положении и социально-экономическом статусе, полученные из различных исследований, были оценены и гармонизированы. Основной конечной точкой исследования была вероятность последующего развития ПТСР с учетом ранних предикторов. Распространенность ПТСР при последующем наблюдении составила 11,8% (9,2% для мужчин и 16,4% для женщин). Логистическая модель, основанная на выраженности ранних симптомов ПТСР (начальный общий балл CAPS) в качестве предиктора, дала возможность весьма точной оценки развития ПТСР при последующем наблюдении (прогнозируемые пр. наблюдаемых вероятностей: r=0,976). Добавление женского пола респондентов, более низкого уровня образования и воздействия предшествующей межличностной травмы к модели привело к более высоким оценкам вероятности ПТСР с аналогичной точностью модели (прогнозируемые пр. наблюдаемых вероятностей: r=0,941). Настоящая модель может быть скорректирована с учетом других травматических обстоятельств и факторов риска, не охваченных ICPP (например, биологических, социальных). Наряду с их использованием в общей медицине, модели оценки риска могут быть использованы для принятия клинических решений в психиатрии. Есть надежда, что количественная оценка риска ПТСР станет первым шагом на пути к систематической профилактике этого расстройства.
Ключевые слова: посттравматическое стрессовое расстройство, прогнозирование, инструмент оценки риска, выжившие после травмы, клиническая шкала ПТСР для DSM-IV (CAPS), женский пол, более низкое образование, воздействие предшествующей межличностной травмы, профилактика.
Редактура: к.м.н. Потанин С.С. (Москва)
Своевременное определение риска посттравматического стрессового расстройства (ПТСР) является необходимым условием для эффективной медицинской помощи и профилактики. Мы представляем инструмент оценки риска, позволяющий рассчитать индивидуальную вероятность развития ПТСР на основе ранних предикторов. Члены Международного консорциума по прогнозированию ПТСР (ICPP) поделились индивидуальными данными участников из десяти лонгитюдных исследований гражданских пострадавших от травм, обратившихся в центры неотложной помощи в шести странах. Участники, удовлетворяющие критериям включения (N=2473), прошли первоначальную клиническую оценку в течение 60 дней после травмы и по крайней мере одну оценку при последующем наблюдении 4-15 месяцев спустя. Выраженность симптомов ПТСР и диагностический статус каждый раз оценивались по клинической шкале ПТСР для DSM-IV (CAPS). Данные об образовании участников, наличии предшествующей травмы в течение жизни, семейном положении и социально-экономическом статусе, полученные из различных исследований, были оценены и гармонизированы. Основной конечной точкой исследования была вероятность последующего развития ПТСР с учетом ранних предикторов. Распространенность ПТСР при последующем наблюдении составила 11,8% (9,2% для мужчин и 16,4% для женщин). Логистическая модель, основанная на выраженности ранних симптомов ПТСР (начальный общий балл CAPS) в качестве предиктора, дала возможность весьма точной оценки развития ПТСР при последующем наблюдении (прогнозируемые пр. наблюдаемых вероятностей: r=0,976). Добавление женского пола респондентов, более низкого уровня образования и воздействия предшествующей межличностной травмы к модели привело к более высоким оценкам вероятности ПТСР с аналогичной точностью модели (прогнозируемые пр. наблюдаемых вероятностей: r=0,941). Настоящая модель может быть скорректирована с учетом других травматических обстоятельств и факторов риска, не охваченных ICPP (например, биологических, социальных). Наряду с их использованием в общей медицине, модели оценки риска могут быть использованы для принятия клинических решений в психиатрии. Есть надежда, что количественная оценка риска ПТСР станет первым шагом на пути к систематической профилактике этого расстройства.
Ключевые слова: посттравматическое стрессовое расстройство, прогнозирование, инструмент оценки риска, выжившие после травмы, клиническая шкала ПТСР для DSM-IV (CAPS), женский пол, более низкое образование, воздействие предшествующей межличностной травмы, профилактика.
Перевод: Шуненков Д.А. (Иваново)
Редактура: к.м.н. Потанин С.С. (Москва)
Своевременное определение риска посттравматического стрессового расстройства (ПТСР) является необходимым условием для эффективной медицинской помощи и профилактики. Мы представляем инструмент оценки риска, позволяющий рассчитать индивидуальную вероятность развития ПТСР на основе ранних предикторов. Члены Международного консорциума по прогнозированию ПТСР (ICPP) поделились индивидуальными данными участников из десяти лонгитюдных исследований гражданских пострадавших от травм, обратившихся в центры неотложной помощи в шести странах. Участники, удовлетворяющие критериям включения (N=2473), прошли первоначальную клиническую оценку в течение 60 дней после травмы и по крайней мере одну оценку при последующем наблюдении 4-15 месяцев спустя. Выраженность симптомов ПТСР и диагностический статус каждый раз оценивались по клинической шкале ПТСР для DSM-IV (CAPS). Данные об образовании участников, наличии предшествующей травмы в течение жизни, семейном положении и социально-экономическом статусе, полученные из различных исследований, были оценены и гармонизированы. Основной конечной точкой исследования была вероятность последующего развития ПТСР с учетом ранних предикторов. Распространенность ПТСР при последующем наблюдении составила 11,8% (9,2% для мужчин и 16,4% для женщин). Логистическая модель, основанная на выраженности ранних симптомов ПТСР (начальный общий балл CAPS) в качестве предиктора, дала возможность весьма точной оценки развития ПТСР при последующем наблюдении (прогнозируемые пр. наблюдаемых вероятностей: r=0,976). Добавление женского пола респондентов, более низкого уровня образования и воздействия предшествующей межличностной травмы к модели привело к более высоким оценкам вероятности ПТСР с аналогичной точностью модели (прогнозируемые пр. наблюдаемых вероятностей: r=0,941). Настоящая модель может быть скорректирована с учетом других травматических обстоятельств и факторов риска, не охваченных ICPP (например, биологических, социальных). Наряду с их использованием в общей медицине, модели оценки риска могут быть использованы для принятия клинических решений в психиатрии. Есть надежда, что количественная оценка риска ПТСР станет первым шагом на пути к систематической профилактике этого расстройства.
Ключевые слова: посттравматическое стрессовое расстройство, прогнозирование, инструмент оценки риска, выжившие после травмы, клиническая шкала ПТСР для DSM-IV (CAPS), женский пол, более низкое образование, воздействие предшествующей межличностной травмы, профилактика.
(World Psychiatry 2019;18(1):77–87)
Посттравматическое стрессовое расстройство (ПТСР) является наиболее частым психопатологическим следствием травматических событий1,2. Хроническое ПТСР является стойким, тяжело протекающим и, часто, трудноизлечимым состоянием3-9. Ранние симптомы ПТСР являются чувствительными, но неспецифическими предикторами хронического ПТСР10. Они купируются без лечения более чем у 70% из тех, у кого они проявляются11-13, в то время как у некоторых выживших, не имеющих данных симптомов, наблюдается развитие ПТСР с отсроченным началом14.
Ранние когнитивно-поведенческие вмешательства значительно снижают распространенность ПТСР, и их эффект стабилен8,15,16. Эти вмешательства, однако, являются ресурсоемкими и ненужными для выживших с низким риском, симптомы которых проходят самостоятельно15,17. Таким образом, точная индивидуальная оценка риска развития хронического ПТСР у выживших является необходимым условием для эффективной профилактики и планирования медицинской помощи18.
В предыдущих исследованиях формулировка таких оценок была затруднена из-за множественности, сложности и разнообразия показателей риска ПТСР. Кроме того, большинство исследований пыталось предсказать случаи (т.е., у кого разовьется ПТСР), а не производить оценки вероятности ПТСР для каждого участника (т.е., насколько вероятно, что у человека разовьется ПТСР)19,20.
В лонгитюдных исследованиях, тем не менее, сообщалось о многочисленных групповых показателях риска ПТСР21,22, таких как женский пол23,24, возраст23, образование25, этническая принадлежность26, воздействие травматических событий в течение предшествующей жизни27 и семейное положение24. Было разработано несколько прогностических инструментов, основанных на имеющихся симптомах, стабильно работающих лучше случайной оценки28-31, которые, однако, не могут обеспечить надежную, персонализированную оценку риска32. В мета-анализах21,22 и систематических обзорах21,22,33,34 аналогичным образом были подтверждены групповые показатели риска без указания четкого пути к их клиническому применению34.
Обращения по поводу травм в центры и отделения неотложной помощи представляют первую точку контакта с многочисленными выжившими, находящимися в зоне риска. Отделения неотложной помощи ежегодно оценивают в США более 39 миллионов человек, обратившихся по поводу лечения от травматических повреждений35-39. Во всем мире дорожно-транспортные происшествия, которые являются основной причиной обращения в отделения неотложной помощи, ежегодно вызывают 1,25 миллиона смертей и более 20 миллионов несмертельных повреждений1.
Распространенность ПТСР после обращения в отделения неотложной помощи напоминает таковую среди выживших, которые не требуют или не получают помощь в отделениях неотложной помощи – например, 52% заболеваемость ПТСР среди женщин, переживших насилие в межличностных отношениях, обратившихся в отделения неотложной помощи, против 51-76% среди женщин, получивших помощь в приютах, клиниках, специализирующихся на домашнем насилии, и в терапевтических группах41,42. 18-месячный показатель распространенности ПТСР среди водителей, наблюдавшихся в больницах общего типа после травм, полученных в результате автомобильных аварий (11%), несколько выше, чем у водителей, не наблюдавшихся в отделениях неотложной помощи (7%)43.
Количественное определение индивидуального риска ПТСР после обращения за неотложной помощью по поводу травмы может обеспечить эмпирическую основу для снижения и предотвращения данной серьезной проблемы общественного здравоохранения. Для достижения этой цели члены Международного консорциума по прогнозированию ПТСР (ICPP) поделились индивидуальными данными участников из десяти лонгитюдных исследований раннего развития ПТСР, проведенных на основе центров неотложной помощи в США, Австралии, Японии, Израиле, Швейцарии и Нидерландах. Данные были гармонизированы и объединены в единый индивидуальный набор данных на уровне участников (IPD) и представлены для анализа.
Анализ IPD, или мега-анализ, предлагает разумный подход к объединению данных всех исследований44,45. В отличие от систематических обзоров и мета-анализов, мега-анализ не опирается на аналитические подходы к данным и формы отчетности, использованные в оригинальных исследованиях, а позволяет непосредственно оценивать интересующие параметры (т.е. предикторы, исходы). Это позволяет непосредственно исследовать неоднородность первичных данных и подгрупповых вариаций, а также позволяет оценивать объединенные данные способами, которые не рассматриваются или невозможны в компонентных исследованиях из-за их размера выборки или ограниченного разнообразия46,47.
В соответствии с текущей практикой оценки медицинского риска (например, в онкологии48-50, хирургии или кардиологии51-54), мы использовали IPD ICPP для разработки функции предсказания, которая оценивает вероятность ПТСР с учетом набора ранних, наблюдаемых показателей риска. Основываясь на воспроизводимых демонстрациях их прогностического значения в классификационных моделях55-62, мы позиционировали симптомы ПТСР в качестве ключевого предиктора, впоследствии обогатив прогностические модели включением других ранее задокументированных и клинически оцениваемых индикаторов риска, доступных в наборе данных ICPP (например, пол, тип травмы, история травматических событий в течение жизни).
Используя ранее описанную стратегию поиска литературы63, ICPP IPD включил тринадцать лонгитюдных исследований, основанных на оказании неотложной помощи выжившим после недавней травмы, проведенных в шести странах. Исследователи получили информированное согласие с использованием процедур, одобренных их местными экспертными советами организаций. Данные исследований на уровне отдельных элементов были объединены, гармонизированы (см. ниже) и собраны в единый набор данных. Во всех исследованиях ICPP для определения диагноза ПТСР и тяжести симптомов использовалась модель ПТСР согласно DSM-IV. В этот отчет включены десять исследований15,64-72, в которых для оценки динамики состояния использовалась валидная клиническая шкала ПТСР для DSM-IV (CAPS)73,74.
В исследование были включены участники, проходившие первичную оценку при помощи CAPS в течение 60 дней после травматического события, и, по меньшей мере, одну оценку по той же шкале при последующем наблюдении на сроке от 4 до 15 месяцев (от 122 до 456 дней) после воздействия травмы. Этим критериям соответствовали 2473 участника (таблица 1). Чтобы максимально повысить практичность прогнозирования, мы использовали самое раннее наблюдение для лиц с двумя ранними (<60 дней) оценками и последнее наблюдение для лиц с несколькими оценками при последующем наблюдении.
Информация о критериях Е (длительность не менее одного месяца) и F (клинически значимый дистресс или нарушение) согласно DSM-IV была собрана в четырех из десяти исследований. Анализ чувствительности в рамках этих исследований обнаружил очень высокую согласованность между диагнозами, определенными в соответствии только с критериями симптомов согласно DSM-IV (т.е. критериями B-D) и полученными с использованием как критериев симптомов, так и критериев E и F (чувствительность 0,92, специфичность 1,00, каппа Коэна = 0,95). Следовательно, мы предполагали, что диагноз ПТСР присутствует во всех исследованиях, основанных на соответствии только критериям симптомов ПТСР согласно DSM-IV.
Различия в сборе данных и инструментах различных исследований требовали согласования четырех показателей риска. Уровень образования, который различался в зависимости от образовательных систем участвующих стран, был перекодирован в двоичную переменную, включающую уровень образования менее среднего против наличия по крайней мере среднего образования. Учет воздействия травматических событий в течение жизни был основан на результатах предыдущих исследований, продемонстрировавших наличие сильной связи между межличностными травмами и ПТСР76 и включал: а) воздействие, по меньшей мере, одного эпизода межличностного насилия (например, физическое или сексуальное насилие, война или террор), б) в случае отсутствия эпизодов межличностной травмы, воздействие хотя бы одного эпизода не межличностной травмы (например, дорожно-транспортные происшествия) и с) отсутствие воздействия травмы. Травматические события, приводящие к настоящему обращению в отделение неотложной помощи, были классифицированы как дорожно-транспортные происшествия, другие не межличностные события и межличностное насилие (например, нападения).
Участники, у которых отсутствовала хотя бы одна переменная (N=791; 32%), отличались от участников с полными данными (N=1682) по нескольким показателям риска (таблица 2). Для решения проблемы этих отсутствующих наблюдений мы представляем анализы, в которых отсутствующие предикторы были обработаны методом множественного восстановления цепными уравнениями (MICE), выполненными над IPD77. Десять наборов данных с подстановкой недостающих значений были созданы после двадцати итераций, и результаты были объединены с использованием метода Rubin78. Для полноты мы также вычислили результаты только по участникам, которые имели полные данные (т.е. без подстановки недостающих данных). Результаты не отличались существенно от полученных после расчетов с подстановкой и доступны по запросу.
Относительно большой размер выборки в наборе данных ICPP позволил нам получить простые приближенные оценки вероятности дальнейшего развития ПТСР для каждого суммарного балла по CAPS0. Использовалась оценка доли случаев ПТСР среди всех лиц с заданным баллом CAPS0, сглаженным на интервалы пятью смежными точками. Модели логистической регрессии были получены с помощью CAPS0 в качестве единственного предиктора (модель CAPS0), CAPS0 плюс все предикторы риска (полная модель) и CAPS0 плюс только значимые предикторы (модель значимых предикторов). Подбираемые модели оценивались при помощи показателя Бриера79 (Brier score), R2 Эфрона (Efron’s R2), соотношения прогнозируемому моделей значению к наблюдаемому (model’s predicted-to-raw ratio) и площади под рабочей характеристической кривой (AUC) (area under the receiver operating characteristic curve).
Показатель Бриера79 измеряет точность вероятностных прогнозов. Он выражает среднюю стандартную ошибку квадратной разности между оцененными вероятностями и истинной классификацией ПТСР. Его значение варьирует от 0 до 1. Показатель Бриера, равный нулю, характеризует идеальную модель, а баллы 0,25 или выше сигнализируют о неинформативности модели. R2 Эфрона – это корреляция между предсказанными и сглаженными вероятностями.
Были рассмотрены два варианта выбора свободного члена регрессионной модели (regression model’s intercept): свободный член в модели с постоянными эффектами, когда свободный член оценивается после объединения или «укладки» данных вместе, и свободный член в модели со случайными эффектами, когда он может варьироваться в зависимости от исследования44. Случайные эффекты (или типические (стратифицированные или районированные) подходы) не рекомендуются в тех случаях, когда распространенность исхода существенно варьируется между исследованиями44, как в случае исследований ICPP. В качестве альтернативы можно предположить, что неоднородность в распространенности развития ПТСР в исследованиях ICPP отражает неоднородность в распределении выраженности баллов CAPS0 в исследованиях, что было обусловлено изменчивостью выборочного контроля (sampling routine) в исследованиях. В соответствии с этой гипотезой, исследования ICPP можно рассматривать как представляющие различные выборки из общей генеральной совокупности обратившихся в отделения неотложной помощи при травмах.
Для оценки двух моделей мы сравнили прогностические аппроксимации логистических регрессий постоянных и случайных эффектов с CAPS0 в качестве единственного предиктора, используя бутстрап-подход, в котором участники были отобраны методом случайной выборки с заменой, были получены модели, а затем предсказанные вероятности из обеих моделей были оценены среди оставшихся участников. Для каждого подхода было получено соотношение ожидаемых диагнозов ПТСР и фактических диагнозов ПТСР (ожидаемые/наблюдаемые, или О/Н), калибровочный наклон βoverall (наклон от логистической регрессии предсказанных вероятностей развития ПТСР) и показатель Бриера. Значение О/Н, далекое от 1, указывает, является ли свободный член модели, который определяет прогнозируемую распространенность ПТСР, слишком высоким или слишком низким, в то время как калибровочный наклон отражает неоднородность взаимосвязей предиктор-исход или чрезмерную подгонку данных44. Этот процесс был повторен 100 раз со статистическими показателями, усредненными по итерациям. Обнаружение менее точных результатов в модели постоянных эффектов по сравнению с моделью случайных эффектов указывало бы на то, что исследования были слишком неоднородны для совместного анализа после учета различий в распределении CAPS0.
Различия в прогнозируемой вероятности ПТСР с учетом различных факторов риска были оценены путем проведения 1000 апостериорных симуляций коэффициентов β каждой модели, прогнозируя развитие ПТСР для каждого значении CAPS0 с различными профилями риска (например, мужской против женского пола) и оценивая различия прогнозируемых вероятностей в зависимости от исходного балла CAPS080.
Выбранное временное окно для определения статуса итогового развития ПТСР (122-456 дней; 4-15 месяцев) максимально увеличило количество исследований ICPP, включенных в каждый временной интервал. Чтобы оценить, повлияла ли существенная ширина этого временного окна на результаты, и дополнительно произвести оценку вероятности отсроченного развития ПТСР, мы повторили логистические регрессии, используя участников, чей статус ПТСР был получен через 9-15 месяцев (273-456 дней) после травматических событий.
Результаты
В итоге распространенность ПТСР составила 11,8% (N=291). ПТСР значительно чаще развивалось среди женщин (16,4% по сравнению с 9,2% у мужчин, р<0,001) и среди участников, пострадавших от межличностных травм, по сравнению с пострадавшими от ДТП или других травматических событий (27%, 5% и 13% соответственно, р<0,001). Существенных различий по этническому происхождению, семейному положению или возрасту не наблюдалось (см. таблицу 3).
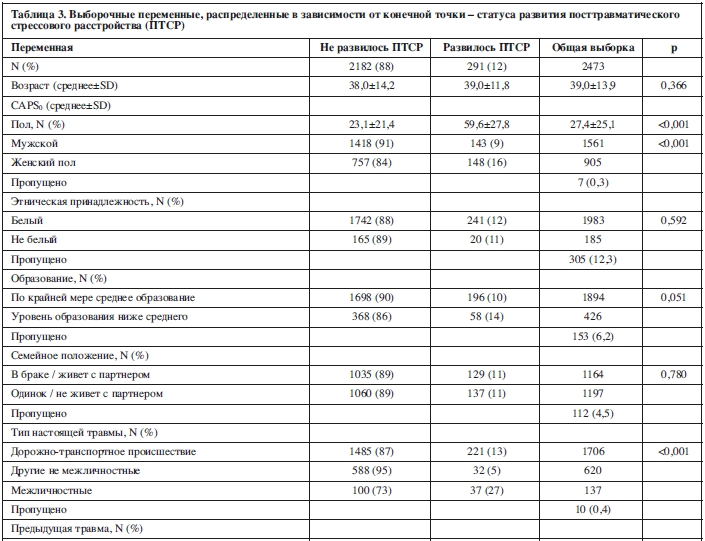

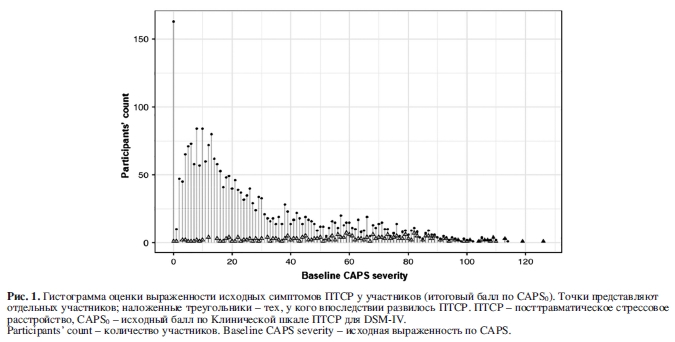
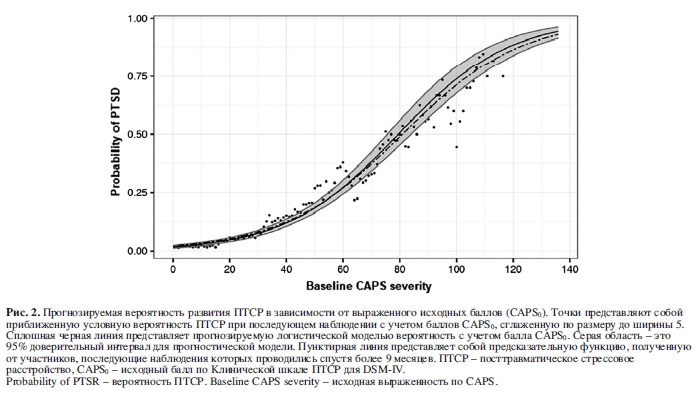
Гистограмма на рисунке 1 показывает количество участников, которые набрали определенный балл CAPS0, сглаженный до интервала в пять пунктов. Как видно, общее количество участников постепенно снижается с увеличением баллов CAPS0. Баллы участников по CAPS0 с развившимся в итоге ПТСР, однако, охватывают весь диапазон выраженности по данной шкале таким образом, что доля лиц с развившимся ПТСР возрастает с увеличением суммарного балла по CAPS0.
Модель CAPS0 (изображенная на рисунке 2 с 95% доверительным интервалом) работает достаточно хорошо (R2 Эфрона=0,230, показатель Бриера=0,080, AUC=0,847), с очень высокой корреляцией между предсказанной моделью вероятности и сглаженной оценкой условной вероятности (r=0,976). Логистическая регрессия с использованием полной модели показала, что женский пол (β=0,309, SE=0,151, p=0,041), уровень образования ниже среднего (β=0,486, SE=0,188, р=0,009), и предшествующие межличностные травмы (β=0,662, SE=0,238, р=0,006) вносят значительный вклад в исход ПТСР.
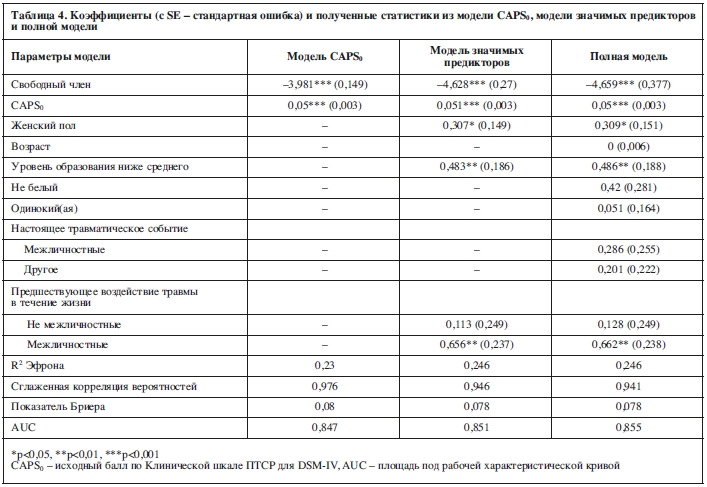
С включением всех показателей риска (полная модель) или тех факторов, которые вносят значительный вклад (модель значимых предикторов), точность остается высокой (корреляция сглаженной вероятности = 0,941, R2 Эфрона = 0,246, показатель Бриера = 0,078, AUC = 0,855; и корреляция сглаженной вероятности = 0,946, R2 Эфрона = 0,246, показатель Бриера = 0,078, AUC = 0,851 соответственно). Таким образом, добавление женского пола, предшествующего воздействия межличностного насилия и наличия менее чем среднего образования к модели CAPS0 увеличило вероятность предсказания ПТСР, сохраняя при этом точность модели CAPS0.
При бутстрап-анализе, сравнивающим логистическую модель постоянных эффектов с моделью случайных эффектов, используя только CAPS0 в качестве предиктора, обнаружилось, что соотношение О/Н и ßoverall для модели постоянных эффектов (1,01 и 1,00 соответственно) было ближе к 1,00, чем для модели случайных эффектов (1,14 и 0,75 соответственно), а показатель Бриера был ниже, в среднем, для модели постоянных эффектов (0,081, SD=0,01), чем для модели случайных эффектов (0,084, SD=0,01). В целом, модель постоянных эффектов, по-видимому, оценивает вероятное число участников с развитием ПТСР при последующем наблюдении более точно, с меньшей неоднородностью или чрезмерной подгонкой, чем модель случайных эффектов, тем самым улучшая объединение данных включенных в анализ исследований.
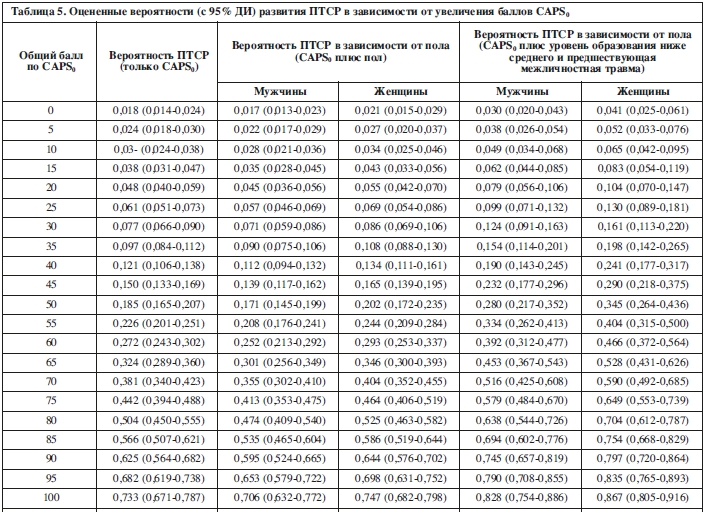
После учета эффекта CAPS0 обнаружилось, что женщины обладали, максимально, на 5% (95% ДИ: -2% до 12%) более высоким риском развития в итоге ПТСР по сравнению с мужчинами. Кроме того, участники со всеми значимыми факторами риска (т.е., женский пол, уровень образования ниже среднего и предшествующая межличностная травма) имели на 34% (95% ДИ: 20-48%) более высокий риск ПТСР по сравнению с участниками без каких-либо существенных факторов риска (т.е., мужчин со средним образованием и без предшествующей межличностной травмы). Оцененные вероятности и 95% доверительные интервалы для развития в итоге ПТСР на основе каждой комбинации значимых предикторов представлены в таблице 5.
Используя данные, полученные от участников, чьи последние оценки при последующем наблюдении проводились в интервале между 9 и 15 месяцами после травматического события (N=1359), для проверки соответствия логистической регрессии только с CAPS0, были получены аналогичные предсказания вероятностей (см. пунктирную линию на рис. 2), с аналогичной точностью модели (R2 Эфрона = 0,195, показатель Бриера = 0,071, AUC = 0,822).
Неожиданной находкой оказался ограниченный инкрементальный эффект нескольких известных факторов риска, предполагающий, что вклад этих факторов в вероятность ПТСР опосредуется их влиянием на выраженность ранних симптомов. В соответствии с этой точкой зрения, предыдущее сравнение ПТСР после терактов с ПТСР после дорожно-транспортных происшествий из тех же отделений неотложной помощи показало, что более высокая распространенность развития ПТСР в течение 4 месяцев после терактов (38% против 19%) была полностью рассчитана на основании ранних реакций выживших, которые включали симптомы ПТСР в первую неделю, оцениваемую в условиях отделений неотложной помощи ЧСС, и перитравматическую диссоциацию61.
Наши результаты расширяют предыдущие выводы о связи между высокими начальными симптомами ПТСР и диагнозом ПТСР55-62, подчеркивая дополнительную информационную ценность оценок правдоподобия относительно прогностической классификации. Равномерное распределение участников относительно исходных баллов ПТСР по CAPS0 иллюстрирует барьер для классификационных моделей: выжившие после травм, у которых в конечном счете развился ПТСР, имели распределение первоначальной выраженности симптомов по всему диапазону итоговых баллов CAPS0, соответственно, использование определенного порога между теми, у кого разовьется или не разовьется расстройство, не представляется возможным. Прогнозирование того, у кого разовьется ПТСР, так же, как и прогнозирование того, у кого среди заядлых курильщиков разовьется рак легких, является трудной задачей, часто заменяемой оценками вероятности. Классификационные модели существенно повлияли на наше понимание этиологии и патогенеза расстройств81-86. Однако оценки вероятности могут лучше подходить для количественного определения индивидуального риска. Как и в других областях медицины48-54, количественная оценка риска, в конечном счете, дает сведения для тех или иных клинических вмешательств.
Как наши результаты могут быть использованы в клинических вмешательствах? Рассмотрим, например, трех выживших женщин с баллами по CAPS0 соответственно 20, 40, 60; имеющих уровень образования ниже среднего и предшествующее воздействие межличностного насилия. Эти лица будут иметь соответственно 10,4% (95% ДИ:
7,0-14,7), 24,1% (95% ДИ: 17,7-31,7) и 46,6% (95% ДИ: 37,2-56,4) вероятности развития хронического ПТСР. Выжившие мужчины с теми же начальными баллами и без дополнительных факторов риска будут иметь соответственно 2,7% (95% ДИ: 1,8-4,0), 7,1% (95% ДИ: 4,8-10,1) и 17,3% (95% ДИ: 12,2-23,4) вероятности развития хронического ПТСР. Лица, набравшие самый высокий балл CAPS0 среди обоих полов, могут рассматриваться как требующие клинического внимания, например, раннего вмешательства. Более низкие баллы могут оправдать «бдительное ожидание» с проведением дополнительных оценок.
Мощность этого исследования обусловлена использованием данных о большом числе участников из различных культурных и географических условий. В каждом включенном исследовании использовался продольный дизайн, оценивались симптомы ПТСР вскоре после травмы, а оценка симптомов и диагностического состояния основывалась на многократном применении валидного инструмента – CAPS.
Тем не менее, при интерпретации наших выводов следует учитывать некоторые ограничения. Во-первых, временные рамки для определения статуса ПТСР в наших основных анализах составили 4-15 месяцев, таким образом, являются очень широкими. Однако, когда данные были ограничены участниками, повторно опрошенными более чем через 9 месяцев после травмы, полученная модель логистического прогнозирования осталась практически неизменной. Наш прогноз, тем не менее, был рассчитан для более широкого и раннего временного интервала и сосредоточен на 333,0±103,1 дня (менее года) от воздействия травмы.
Во-вторых, несколько предикторов риска были согласованы из-за разнообразия инструментов, используемых различными исследователями, что привело к потере детализации. Хотя эти согласованные переменные (уровень образования ниже среднего, предшествующее воздействие межличностного насилия) внесли свой вклад в оценки вероятности ПТСР, в результатах, связанных с перекодированными переменными, может быть пропущена важная информация о предикторах. Упрощенные предикторы, однако, могут быть более доступны в клинической практике и широко используются в прогностических моделях в других областях медицины (например, «курение да/нет» и «диабет да/нет» в Фрамингемской шкале 10-летнего риска сердечно-сосудистых заболеваний).
В-третьих, данные ICPP характеризуются значительной неоднородностью среди представленных исследований, что, как отмечалось выше, вызывает методологические трудности касательно наилучшего подхода к объединению данных. Мы обнаружили, что модель постоянных эффектов была более точной, чем модель случайных эффектов, зависящая от источника данных, и, следовательно, оправдывала объединение данных из разных исследований. Мы также считаем, что модель постоянных эффектов более применима к новым условиям, поскольку совокупный наклон и свободный член были оценены по всем исследованиям. Однако наш выбор не выходит за рамки критики и не лишен значимости: в настоящее время крупные базы данных из нескольких источников оцениваются в рамках генетических, геномных и визуализационных исследований87, и все они должны бороться с неоднородностью источников данных, напоминающих усилия ICPP. Наше теоретическое предположение о том, что исследования ICPP представляли собой дифференцированную выборку подмножеств генеральной совокупности обращений (т.е. обращений за неотложной помощью по поводу травмы), должно быть подтверждено тестированием полученного инструмента оценки риска у недавно обратившихся за неотложной помощью по поводу травмы.
Использование структурированного клинического интервью CAPS может увеличить нагрузку на предоставление услуг, и это интервью не является обязательным скрининговым инструментом. Кроме того, на момент госпитализации в скоропомощное отделение могут отсутствовать некоторые симптомы ПТСР (например, бессонница, избегание, неспособность вспомнить важные аспекты травматического события). Тем не менее, ранние показатели по CAPS являются надежным индикатором риска.
В будущей работе следует изучить более ранние и простые альтернативы скрининга или создать поэтапные модели «скрининга и прогнозирования», начиная с приема в скоропомощное отделение и прогнозирования вероятности проявления выраженных ранних симптомов ПТСР.
Наконец, наша модель была разработана с использованием обращений по поводу острых травм, и как таковая ее реализация в других травматических обстоятельствах (например, длительные невзгоды, такие как войны, плен и переселение) может потребовать корректировки. Вне зависимости от точных оценок риска для других травматических обстоятельств, мы считаем, что выраженность ранних симптомов убедительно продемонстрирована здесь как основной предиктор риска ПТСР и что, как таковая, ее оценка среди отдельных выживших лиц обеспечивает надежное предупреждение и призыв к действию.
Эти ограничения не умаляют надежности наших оценок вероятности и их способности обеспечивать индивидуальную оценку риска у отдельных выживших. Аналогичные инструменты оценки риска используются в других областях медицины для поддержки клинических решений (например, для определения вероятности рака молочной железы48 или легких49,50 с учетом показателей риска). Оценки риска, представленные в этой работе, могут быть аналогичным образом использованы для инициирования действий (либо бдительное наблюдение, либо раннее вмешательство) в соответствии с имеющимися ресурсами и возможностью профилактики.
Количественная оценка индивидуального риска является шагом вперед в планировании медицинской помощи, позволяя сосредоточиться на помощи лицам с высоким риском, и, в конечном счете, обеспечивая снижение бремени ПТСР, возникающего после обращений за неотложной помощью.
ПРИЛОЖЕНИЕ
Членами Международного консорциума по прогнозированию ПТСР являются: Yael Errera-Ankri, Anna C. Barbano, Sarah Freedman, Jessie Frijling, Carel Goslings, Jan Luitse, Alexander McFarlane, Derrick Silove, Hanspeter Moergeli, Joanne Mouthaan, Daisuke Nishi, Meaghan O’Donnell, Marit Sijbrandij, Sharain Suliman and Mirjam van Zuiden.
ВЫРАЖЕНИЕ БЛАГОДАРНОСТИ
A.Y. Shalev, M. Gevonden, A. Ratanatharathorn и E. Laska являются авторами с равным вкладом в опубликованную работу. Исследование финансировалось грантом Национального института психического здоровья США (MH101227), который был предоставлен A. Shalev, R. Kessler и K. Koenen.
DOI: 10.1002/wps.20608
Редактура: к.м.н. Потанин С.С. (Москва)
Своевременное определение риска посттравматического стрессового расстройства (ПТСР) является необходимым условием для эффективной медицинской помощи и профилактики. Мы представляем инструмент оценки риска, позволяющий рассчитать индивидуальную вероятность развития ПТСР на основе ранних предикторов. Члены Международного консорциума по прогнозированию ПТСР (ICPP) поделились индивидуальными данными участников из десяти лонгитюдных исследований гражданских пострадавших от травм, обратившихся в центры неотложной помощи в шести странах. Участники, удовлетворяющие критериям включения (N=2473), прошли первоначальную клиническую оценку в течение 60 дней после травмы и по крайней мере одну оценку при последующем наблюдении 4-15 месяцев спустя. Выраженность симптомов ПТСР и диагностический статус каждый раз оценивались по клинической шкале ПТСР для DSM-IV (CAPS). Данные об образовании участников, наличии предшествующей травмы в течение жизни, семейном положении и социально-экономическом статусе, полученные из различных исследований, были оценены и гармонизированы. Основной конечной точкой исследования была вероятность последующего развития ПТСР с учетом ранних предикторов. Распространенность ПТСР при последующем наблюдении составила 11,8% (9,2% для мужчин и 16,4% для женщин). Логистическая модель, основанная на выраженности ранних симптомов ПТСР (начальный общий балл CAPS) в качестве предиктора, дала возможность весьма точной оценки развития ПТСР при последующем наблюдении (прогнозируемые пр. наблюдаемых вероятностей: r=0,976). Добавление женского пола респондентов, более низкого уровня образования и воздействия предшествующей межличностной травмы к модели привело к более высоким оценкам вероятности ПТСР с аналогичной точностью модели (прогнозируемые пр. наблюдаемых вероятностей: r=0,941). Настоящая модель может быть скорректирована с учетом других травматических обстоятельств и факторов риска, не охваченных ICPP (например, биологических, социальных). Наряду с их использованием в общей медицине, модели оценки риска могут быть использованы для принятия клинических решений в психиатрии. Есть надежда, что количественная оценка риска ПТСР станет первым шагом на пути к систематической профилактике этого расстройства.
Ключевые слова: посттравматическое стрессовое расстройство, прогнозирование, инструмент оценки риска, выжившие после травмы, клиническая шкала ПТСР для DSM-IV (CAPS), женский пол, более низкое образование, воздействие предшествующей межличностной травмы, профилактика.
(World Psychiatry 2019;18(1):77–87)
Посттравматическое стрессовое расстройство (ПТСР) является наиболее частым психопатологическим следствием травматических событий1,2. Хроническое ПТСР является стойким, тяжело протекающим и, часто, трудноизлечимым состоянием3-9. Ранние симптомы ПТСР являются чувствительными, но неспецифическими предикторами хронического ПТСР10. Они купируются без лечения более чем у 70% из тех, у кого они проявляются11-13, в то время как у некоторых выживших, не имеющих данных симптомов, наблюдается развитие ПТСР с отсроченным началом14.
Ранние когнитивно-поведенческие вмешательства значительно снижают распространенность ПТСР, и их эффект стабилен8,15,16. Эти вмешательства, однако, являются ресурсоемкими и ненужными для выживших с низким риском, симптомы которых проходят самостоятельно15,17. Таким образом, точная индивидуальная оценка риска развития хронического ПТСР у выживших является необходимым условием для эффективной профилактики и планирования медицинской помощи18.
В предыдущих исследованиях формулировка таких оценок была затруднена из-за множественности, сложности и разнообразия показателей риска ПТСР. Кроме того, большинство исследований пыталось предсказать случаи (т.е., у кого разовьется ПТСР), а не производить оценки вероятности ПТСР для каждого участника (т.е., насколько вероятно, что у человека разовьется ПТСР)19,20.
В лонгитюдных исследованиях, тем не менее, сообщалось о многочисленных групповых показателях риска ПТСР21,22, таких как женский пол23,24, возраст23, образование25, этническая принадлежность26, воздействие травматических событий в течение предшествующей жизни27 и семейное положение24. Было разработано несколько прогностических инструментов, основанных на имеющихся симптомах, стабильно работающих лучше случайной оценки28-31, которые, однако, не могут обеспечить надежную, персонализированную оценку риска32. В мета-анализах21,22 и систематических обзорах21,22,33,34 аналогичным образом были подтверждены групповые показатели риска без указания четкого пути к их клиническому применению34.
Обращения по поводу травм в центры и отделения неотложной помощи представляют первую точку контакта с многочисленными выжившими, находящимися в зоне риска. Отделения неотложной помощи ежегодно оценивают в США более 39 миллионов человек, обратившихся по поводу лечения от травматических повреждений35-39. Во всем мире дорожно-транспортные происшествия, которые являются основной причиной обращения в отделения неотложной помощи, ежегодно вызывают 1,25 миллиона смертей и более 20 миллионов несмертельных повреждений1.
Распространенность ПТСР после обращения в отделения неотложной помощи напоминает таковую среди выживших, которые не требуют или не получают помощь в отделениях неотложной помощи – например, 52% заболеваемость ПТСР среди женщин, переживших насилие в межличностных отношениях, обратившихся в отделения неотложной помощи, против 51-76% среди женщин, получивших помощь в приютах, клиниках, специализирующихся на домашнем насилии, и в терапевтических группах41,42. 18-месячный показатель распространенности ПТСР среди водителей, наблюдавшихся в больницах общего типа после травм, полученных в результате автомобильных аварий (11%), несколько выше, чем у водителей, не наблюдавшихся в отделениях неотложной помощи (7%)43.
Количественное определение индивидуального риска ПТСР после обращения за неотложной помощью по поводу травмы может обеспечить эмпирическую основу для снижения и предотвращения данной серьезной проблемы общественного здравоохранения. Для достижения этой цели члены Международного консорциума по прогнозированию ПТСР (ICPP) поделились индивидуальными данными участников из десяти лонгитюдных исследований раннего развития ПТСР, проведенных на основе центров неотложной помощи в США, Австралии, Японии, Израиле, Швейцарии и Нидерландах. Данные были гармонизированы и объединены в единый индивидуальный набор данных на уровне участников (IPD) и представлены для анализа.
Анализ IPD, или мега-анализ, предлагает разумный подход к объединению данных всех исследований44,45. В отличие от систематических обзоров и мета-анализов, мега-анализ не опирается на аналитические подходы к данным и формы отчетности, использованные в оригинальных исследованиях, а позволяет непосредственно оценивать интересующие параметры (т.е. предикторы, исходы). Это позволяет непосредственно исследовать неоднородность первичных данных и подгрупповых вариаций, а также позволяет оценивать объединенные данные способами, которые не рассматриваются или невозможны в компонентных исследованиях из-за их размера выборки или ограниченного разнообразия46,47.
В соответствии с текущей практикой оценки медицинского риска (например, в онкологии48-50, хирургии или кардиологии51-54), мы использовали IPD ICPP для разработки функции предсказания, которая оценивает вероятность ПТСР с учетом набора ранних, наблюдаемых показателей риска. Основываясь на воспроизводимых демонстрациях их прогностического значения в классификационных моделях55-62, мы позиционировали симптомы ПТСР в качестве ключевого предиктора, впоследствии обогатив прогностические модели включением других ранее задокументированных и клинически оцениваемых индикаторов риска, доступных в наборе данных ICPP (например, пол, тип травмы, история травматических событий в течение жизни).
МЕТОДЫ
Исследования, участники и переменныеИспользуя ранее описанную стратегию поиска литературы63, ICPP IPD включил тринадцать лонгитюдных исследований, основанных на оказании неотложной помощи выжившим после недавней травмы, проведенных в шести странах. Исследователи получили информированное согласие с использованием процедур, одобренных их местными экспертными советами организаций. Данные исследований на уровне отдельных элементов были объединены, гармонизированы (см. ниже) и собраны в единый набор данных. Во всех исследованиях ICPP для определения диагноза ПТСР и тяжести симптомов использовалась модель ПТСР согласно DSM-IV. В этот отчет включены десять исследований15,64-72, в которых для оценки динамики состояния использовалась валидная клиническая шкала ПТСР для DSM-IV (CAPS)73,74.
В исследование были включены участники, проходившие первичную оценку при помощи CAPS в течение 60 дней после травматического события, и, по меньшей мере, одну оценку по той же шкале при последующем наблюдении на сроке от 4 до 15 месяцев (от 122 до 456 дней) после воздействия травмы. Этим критериям соответствовали 2473 участника (таблица 1). Чтобы максимально повысить практичность прогнозирования, мы использовали самое раннее наблюдение для лиц с двумя ранними (<60 дней) оценками и последнее наблюдение для лиц с несколькими оценками при последующем наблюдении.


Выраженность и диагноз ПТСР
CAPS количественно оценивает частоту и выраженность каждого из семнадцати симптомов ПТСР согласно критериям DSM-IV73, присваивая каждому симптому ранговую оценку от 0 до 4 по частоте и от 0 до 4 – по интенсивности. Степень выраженности ПТСР оценивается путем сложения всех индивидуальных баллов по отдельным симптомам (общий балл CAPS). Диагноз ПТСР определяется с использованием диагностических критериев ПТСР согласно DSM-IV: по крайней мере одного симптома из группы симптомов повторного переживания (критерий B), трех – из группы симптомов избегания/оцепенения (критерий C) и двух симптомов возрастающего возбуждения (критерий D)73. Следуя рекомендациям, симптом ПТСР считался «присутствующим», если его показатель частоты составлял 1 или более, а показатель интенсивности – 2 или более74,75.Информация о критериях Е (длительность не менее одного месяца) и F (клинически значимый дистресс или нарушение) согласно DSM-IV была собрана в четырех из десяти исследований. Анализ чувствительности в рамках этих исследований обнаружил очень высокую согласованность между диагнозами, определенными в соответствии только с критериями симптомов согласно DSM-IV (т.е. критериями B-D) и полученными с использованием как критериев симптомов, так и критериев E и F (чувствительность 0,92, специфичность 1,00, каппа Коэна = 0,95). Следовательно, мы предполагали, что диагноз ПТСР присутствует во всех исследованиях, основанных на соответствии только критериям симптомов ПТСР согласно DSM-IV.
Показатели риска
Основным показателем риска в исследовании была выраженность ПТСР на начальном этапе оценки (CAPS0, размах колебаний 0-136), при этом возраст, пол, этническая принадлежность, образовательный уровень, история воздействия травматических событий в течение жизни и текущий тип травмы рассматривались в качестве дополнительных предикторов.Различия в сборе данных и инструментах различных исследований требовали согласования четырех показателей риска. Уровень образования, который различался в зависимости от образовательных систем участвующих стран, был перекодирован в двоичную переменную, включающую уровень образования менее среднего против наличия по крайней мере среднего образования. Учет воздействия травматических событий в течение жизни был основан на результатах предыдущих исследований, продемонстрировавших наличие сильной связи между межличностными травмами и ПТСР76 и включал: а) воздействие, по меньшей мере, одного эпизода межличностного насилия (например, физическое или сексуальное насилие, война или террор), б) в случае отсутствия эпизодов межличностной травмы, воздействие хотя бы одного эпизода не межличностной травмы (например, дорожно-транспортные происшествия) и с) отсутствие воздействия травмы. Травматические события, приводящие к настоящему обращению в отделение неотложной помощи, были классифицированы как дорожно-транспортные происшествия, другие не межличностные события и межличностное насилие (например, нападения).
Полнота данных и обработка отсутствующих наблюдений
Данные CAPS0 были доступны для всех 2473 участников. Данные о возрасте, поле и текущей травме были доступны для >99% выборки. Данные о семейном положении отсутствовали в 4,5%, об образовании – в 6,2%, этнической принадлежности – в 12,3% и о воздействии предыдущих травм – в 16,8% выборки.Участники, у которых отсутствовала хотя бы одна переменная (N=791; 32%), отличались от участников с полными данными (N=1682) по нескольким показателям риска (таблица 2). Для решения проблемы этих отсутствующих наблюдений мы представляем анализы, в которых отсутствующие предикторы были обработаны методом множественного восстановления цепными уравнениями (MICE), выполненными над IPD77. Десять наборов данных с подстановкой недостающих значений были созданы после двадцати итераций, и результаты были объединены с использованием метода Rubin78. Для полноты мы также вычислили результаты только по участникам, которые имели полные данные (т.е. без подстановки недостающих данных). Результаты не отличались существенно от полученных после расчетов с подстановкой и доступны по запросу.

Анализ данных
Различия в частоте и выраженности предикторов риска между участниками с развившимся и не развившимся в итоге ПТСР оценивались с использованием тестов Манна–Уитни для непрерывных предикторов риска и тестов χ2 для категориальных предикторов риска. Количество участников, набравших балл определенной степени выраженности по CAPS0 (сглаженной до интервалов с помощью пяти точек), было визуализировано с помощью гистограммы, отдельно для всех участников и для тех, у кого наблюдалось развитие ПТСР по итогам исследования.Относительно большой размер выборки в наборе данных ICPP позволил нам получить простые приближенные оценки вероятности дальнейшего развития ПТСР для каждого суммарного балла по CAPS0. Использовалась оценка доли случаев ПТСР среди всех лиц с заданным баллом CAPS0, сглаженным на интервалы пятью смежными точками. Модели логистической регрессии были получены с помощью CAPS0 в качестве единственного предиктора (модель CAPS0), CAPS0 плюс все предикторы риска (полная модель) и CAPS0 плюс только значимые предикторы (модель значимых предикторов). Подбираемые модели оценивались при помощи показателя Бриера79 (Brier score), R2 Эфрона (Efron’s R2), соотношения прогнозируемому моделей значению к наблюдаемому (model’s predicted-to-raw ratio) и площади под рабочей характеристической кривой (AUC) (area under the receiver operating characteristic curve).
Показатель Бриера79 измеряет точность вероятностных прогнозов. Он выражает среднюю стандартную ошибку квадратной разности между оцененными вероятностями и истинной классификацией ПТСР. Его значение варьирует от 0 до 1. Показатель Бриера, равный нулю, характеризует идеальную модель, а баллы 0,25 или выше сигнализируют о неинформативности модели. R2 Эфрона – это корреляция между предсказанными и сглаженными вероятностями.
Были рассмотрены два варианта выбора свободного члена регрессионной модели (regression model’s intercept): свободный член в модели с постоянными эффектами, когда свободный член оценивается после объединения или «укладки» данных вместе, и свободный член в модели со случайными эффектами, когда он может варьироваться в зависимости от исследования44. Случайные эффекты (или типические (стратифицированные или районированные) подходы) не рекомендуются в тех случаях, когда распространенность исхода существенно варьируется между исследованиями44, как в случае исследований ICPP. В качестве альтернативы можно предположить, что неоднородность в распространенности развития ПТСР в исследованиях ICPP отражает неоднородность в распределении выраженности баллов CAPS0 в исследованиях, что было обусловлено изменчивостью выборочного контроля (sampling routine) в исследованиях. В соответствии с этой гипотезой, исследования ICPP можно рассматривать как представляющие различные выборки из общей генеральной совокупности обратившихся в отделения неотложной помощи при травмах.
Для оценки двух моделей мы сравнили прогностические аппроксимации логистических регрессий постоянных и случайных эффектов с CAPS0 в качестве единственного предиктора, используя бутстрап-подход, в котором участники были отобраны методом случайной выборки с заменой, были получены модели, а затем предсказанные вероятности из обеих моделей были оценены среди оставшихся участников. Для каждого подхода было получено соотношение ожидаемых диагнозов ПТСР и фактических диагнозов ПТСР (ожидаемые/наблюдаемые, или О/Н), калибровочный наклон βoverall (наклон от логистической регрессии предсказанных вероятностей развития ПТСР) и показатель Бриера. Значение О/Н, далекое от 1, указывает, является ли свободный член модели, который определяет прогнозируемую распространенность ПТСР, слишком высоким или слишком низким, в то время как калибровочный наклон отражает неоднородность взаимосвязей предиктор-исход или чрезмерную подгонку данных44. Этот процесс был повторен 100 раз со статистическими показателями, усредненными по итерациям. Обнаружение менее точных результатов в модели постоянных эффектов по сравнению с моделью случайных эффектов указывало бы на то, что исследования были слишком неоднородны для совместного анализа после учета различий в распределении CAPS0.
Различия в прогнозируемой вероятности ПТСР с учетом различных факторов риска были оценены путем проведения 1000 апостериорных симуляций коэффициентов β каждой модели, прогнозируя развитие ПТСР для каждого значении CAPS0 с различными профилями риска (например, мужской против женского пола) и оценивая различия прогнозируемых вероятностей в зависимости от исходного балла CAPS080.
Выбранное временное окно для определения статуса итогового развития ПТСР (122-456 дней; 4-15 месяцев) максимально увеличило количество исследований ICPP, включенных в каждый временной интервал. Чтобы оценить, повлияла ли существенная ширина этого временного окна на результаты, и дополнительно произвести оценку вероятности отсроченного развития ПТСР, мы повторили логистические регрессии, используя участников, чей статус ПТСР был получен через 9-15 месяцев (273-456 дней) после травматических событий.
Результаты
Характеристики участников, предикторы риска и баллы по CAPS0
Средний возраст участников на момент начала исследований составил 39,0±13,9 года. В выборке было меньше женщин (37%), чем мужчин. Дорожно-транспортные происшествия (69%) являлись наиболее распространенными травмами, за которыми следовали другие виды не межличностных травм (25%) и межличностные травмы (6%). Медиана времени до первоначальной оценки составила 15±16,7 дня (в диапазоне 1-60). Медиана времени до оценки конечной точки составила 333±103,1 дня (в диапазоне 122-456).В итоге распространенность ПТСР составила 11,8% (N=291). ПТСР значительно чаще развивалось среди женщин (16,4% по сравнению с 9,2% у мужчин, р<0,001) и среди участников, пострадавших от межличностных травм, по сравнению с пострадавшими от ДТП или других травматических событий (27%, 5% и 13% соответственно, р<0,001). Существенных различий по этническому происхождению, семейному положению или возрасту не наблюдалось (см. таблицу 3).


Гистограмма на рисунке 1 показывает количество участников, которые набрали определенный балл CAPS0, сглаженный до интервала в пять пунктов. Как видно, общее количество участников постепенно снижается с увеличением баллов CAPS0. Баллы участников по CAPS0 с развившимся в итоге ПТСР, однако, охватывают весь диапазон выраженности по данной шкале таким образом, что доля лиц с развившимся ПТСР возрастает с увеличением суммарного балла по CAPS0.
Прогнозирование развития ПТСР
В таблице 4 представлены результаты, полученные при анализе модели постоянных эффектов с CAPS0 в качестве единственного предиктора (модель CAPS0), CAPS0 плюс все доступные предикторы риска (полная модель) и CAPS0 плюс только значимые предикторы (модель значимых предикторов).Модель CAPS0 (изображенная на рисунке 2 с 95% доверительным интервалом) работает достаточно хорошо (R2 Эфрона=0,230, показатель Бриера=0,080, AUC=0,847), с очень высокой корреляцией между предсказанной моделью вероятности и сглаженной оценкой условной вероятности (r=0,976). Логистическая регрессия с использованием полной модели показала, что женский пол (β=0,309, SE=0,151, p=0,041), уровень образования ниже среднего (β=0,486, SE=0,188, р=0,009), и предшествующие межличностные травмы (β=0,662, SE=0,238, р=0,006) вносят значительный вклад в исход ПТСР.

С включением всех показателей риска (полная модель) или тех факторов, которые вносят значительный вклад (модель значимых предикторов), точность остается высокой (корреляция сглаженной вероятности = 0,941, R2 Эфрона = 0,246, показатель Бриера = 0,078, AUC = 0,855; и корреляция сглаженной вероятности = 0,946, R2 Эфрона = 0,246, показатель Бриера = 0,078, AUC = 0,851 соответственно). Таким образом, добавление женского пола, предшествующего воздействия межличностного насилия и наличия менее чем среднего образования к модели CAPS0 увеличило вероятность предсказания ПТСР, сохраняя при этом точность модели CAPS0.
При бутстрап-анализе, сравнивающим логистическую модель постоянных эффектов с моделью случайных эффектов, используя только CAPS0 в качестве предиктора, обнаружилось, что соотношение О/Н и ßoverall для модели постоянных эффектов (1,01 и 1,00 соответственно) было ближе к 1,00, чем для модели случайных эффектов (1,14 и 0,75 соответственно), а показатель Бриера был ниже, в среднем, для модели постоянных эффектов (0,081, SD=0,01), чем для модели случайных эффектов (0,084, SD=0,01). В целом, модель постоянных эффектов, по-видимому, оценивает вероятное число участников с развитием ПТСР при последующем наблюдении более точно, с меньшей неоднородностью или чрезмерной подгонкой, чем модель случайных эффектов, тем самым улучшая объединение данных включенных в анализ исследований.
После учета эффекта CAPS0 обнаружилось, что женщины обладали, максимально, на 5% (95% ДИ: -2% до 12%) более высоким риском развития в итоге ПТСР по сравнению с мужчинами. Кроме того, участники со всеми значимыми факторами риска (т.е., женский пол, уровень образования ниже среднего и предшествующая межличностная травма) имели на 34% (95% ДИ: 20-48%) более высокий риск ПТСР по сравнению с участниками без каких-либо существенных факторов риска (т.е., мужчин со средним образованием и без предшествующей межличностной травмы). Оцененные вероятности и 95% доверительные интервалы для развития в итоге ПТСР на основе каждой комбинации значимых предикторов представлены в таблице 5.


Используя данные, полученные от участников, чьи последние оценки при последующем наблюдении проводились в интервале между 9 и 15 месяцами после травматического события (N=1359), для проверки соответствия логистической регрессии только с CAPS0, были получены аналогичные предсказания вероятностей (см. пунктирную линию на рис. 2), с аналогичной точностью модели (R2 Эфрона = 0,195, показатель Бриера = 0,071, AUC = 0,822).


ОБСУЖДЕНИЕ
Результаты данного исследования показывают, что вероятность соответствия критериям диагностики ПТСР через 4-15 месяцев после обращения в центры неотложной помощи достоверно моделируется логистической функцией выраженности начальных симптомов ПТСР. В дополнение к этой модели женский пол, уровень образования ниже среднего и предшествующая межличностная травма были связаны с более высокой вероятностью развития ПТСР. Другие ранее задокументированные факторы риска, такие как возраст, семейное положение и тип настоящей травмы, не улучшили прогноз по сравнению с моделью, в которой показатель CAPS0 выступал единственным предиктором. Важно отметить, что ограниченная погрешность полученной оценки риска позволяет при ее клиническом использовании оценить вероятность ПТСР для каждой комбинации значимых показателей риска.Неожиданной находкой оказался ограниченный инкрементальный эффект нескольких известных факторов риска, предполагающий, что вклад этих факторов в вероятность ПТСР опосредуется их влиянием на выраженность ранних симптомов. В соответствии с этой точкой зрения, предыдущее сравнение ПТСР после терактов с ПТСР после дорожно-транспортных происшествий из тех же отделений неотложной помощи показало, что более высокая распространенность развития ПТСР в течение 4 месяцев после терактов (38% против 19%) была полностью рассчитана на основании ранних реакций выживших, которые включали симптомы ПТСР в первую неделю, оцениваемую в условиях отделений неотложной помощи ЧСС, и перитравматическую диссоциацию61.
Наши результаты расширяют предыдущие выводы о связи между высокими начальными симптомами ПТСР и диагнозом ПТСР55-62, подчеркивая дополнительную информационную ценность оценок правдоподобия относительно прогностической классификации. Равномерное распределение участников относительно исходных баллов ПТСР по CAPS0 иллюстрирует барьер для классификационных моделей: выжившие после травм, у которых в конечном счете развился ПТСР, имели распределение первоначальной выраженности симптомов по всему диапазону итоговых баллов CAPS0, соответственно, использование определенного порога между теми, у кого разовьется или не разовьется расстройство, не представляется возможным. Прогнозирование того, у кого разовьется ПТСР, так же, как и прогнозирование того, у кого среди заядлых курильщиков разовьется рак легких, является трудной задачей, часто заменяемой оценками вероятности. Классификационные модели существенно повлияли на наше понимание этиологии и патогенеза расстройств81-86. Однако оценки вероятности могут лучше подходить для количественного определения индивидуального риска. Как и в других областях медицины48-54, количественная оценка риска, в конечном счете, дает сведения для тех или иных клинических вмешательств.
Как наши результаты могут быть использованы в клинических вмешательствах? Рассмотрим, например, трех выживших женщин с баллами по CAPS0 соответственно 20, 40, 60; имеющих уровень образования ниже среднего и предшествующее воздействие межличностного насилия. Эти лица будут иметь соответственно 10,4% (95% ДИ:
7,0-14,7), 24,1% (95% ДИ: 17,7-31,7) и 46,6% (95% ДИ: 37,2-56,4) вероятности развития хронического ПТСР. Выжившие мужчины с теми же начальными баллами и без дополнительных факторов риска будут иметь соответственно 2,7% (95% ДИ: 1,8-4,0), 7,1% (95% ДИ: 4,8-10,1) и 17,3% (95% ДИ: 12,2-23,4) вероятности развития хронического ПТСР. Лица, набравшие самый высокий балл CAPS0 среди обоих полов, могут рассматриваться как требующие клинического внимания, например, раннего вмешательства. Более низкие баллы могут оправдать «бдительное ожидание» с проведением дополнительных оценок.
Мощность этого исследования обусловлена использованием данных о большом числе участников из различных культурных и географических условий. В каждом включенном исследовании использовался продольный дизайн, оценивались симптомы ПТСР вскоре после травмы, а оценка симптомов и диагностического состояния основывалась на многократном применении валидного инструмента – CAPS.
Тем не менее, при интерпретации наших выводов следует учитывать некоторые ограничения. Во-первых, временные рамки для определения статуса ПТСР в наших основных анализах составили 4-15 месяцев, таким образом, являются очень широкими. Однако, когда данные были ограничены участниками, повторно опрошенными более чем через 9 месяцев после травмы, полученная модель логистического прогнозирования осталась практически неизменной. Наш прогноз, тем не менее, был рассчитан для более широкого и раннего временного интервала и сосредоточен на 333,0±103,1 дня (менее года) от воздействия травмы.
Во-вторых, несколько предикторов риска были согласованы из-за разнообразия инструментов, используемых различными исследователями, что привело к потере детализации. Хотя эти согласованные переменные (уровень образования ниже среднего, предшествующее воздействие межличностного насилия) внесли свой вклад в оценки вероятности ПТСР, в результатах, связанных с перекодированными переменными, может быть пропущена важная информация о предикторах. Упрощенные предикторы, однако, могут быть более доступны в клинической практике и широко используются в прогностических моделях в других областях медицины (например, «курение да/нет» и «диабет да/нет» в Фрамингемской шкале 10-летнего риска сердечно-сосудистых заболеваний).
В-третьих, данные ICPP характеризуются значительной неоднородностью среди представленных исследований, что, как отмечалось выше, вызывает методологические трудности касательно наилучшего подхода к объединению данных. Мы обнаружили, что модель постоянных эффектов была более точной, чем модель случайных эффектов, зависящая от источника данных, и, следовательно, оправдывала объединение данных из разных исследований. Мы также считаем, что модель постоянных эффектов более применима к новым условиям, поскольку совокупный наклон и свободный член были оценены по всем исследованиям. Однако наш выбор не выходит за рамки критики и не лишен значимости: в настоящее время крупные базы данных из нескольких источников оцениваются в рамках генетических, геномных и визуализационных исследований87, и все они должны бороться с неоднородностью источников данных, напоминающих усилия ICPP. Наше теоретическое предположение о том, что исследования ICPP представляли собой дифференцированную выборку подмножеств генеральной совокупности обращений (т.е. обращений за неотложной помощью по поводу травмы), должно быть подтверждено тестированием полученного инструмента оценки риска у недавно обратившихся за неотложной помощью по поводу травмы.
Использование структурированного клинического интервью CAPS может увеличить нагрузку на предоставление услуг, и это интервью не является обязательным скрининговым инструментом. Кроме того, на момент госпитализации в скоропомощное отделение могут отсутствовать некоторые симптомы ПТСР (например, бессонница, избегание, неспособность вспомнить важные аспекты травматического события). Тем не менее, ранние показатели по CAPS являются надежным индикатором риска.
В будущей работе следует изучить более ранние и простые альтернативы скрининга или создать поэтапные модели «скрининга и прогнозирования», начиная с приема в скоропомощное отделение и прогнозирования вероятности проявления выраженных ранних симптомов ПТСР.
Наконец, наша модель была разработана с использованием обращений по поводу острых травм, и как таковая ее реализация в других травматических обстоятельствах (например, длительные невзгоды, такие как войны, плен и переселение) может потребовать корректировки. Вне зависимости от точных оценок риска для других травматических обстоятельств, мы считаем, что выраженность ранних симптомов убедительно продемонстрирована здесь как основной предиктор риска ПТСР и что, как таковая, ее оценка среди отдельных выживших лиц обеспечивает надежное предупреждение и призыв к действию.
Эти ограничения не умаляют надежности наших оценок вероятности и их способности обеспечивать индивидуальную оценку риска у отдельных выживших. Аналогичные инструменты оценки риска используются в других областях медицины для поддержки клинических решений (например, для определения вероятности рака молочной железы48 или легких49,50 с учетом показателей риска). Оценки риска, представленные в этой работе, могут быть аналогичным образом использованы для инициирования действий (либо бдительное наблюдение, либо раннее вмешательство) в соответствии с имеющимися ресурсами и возможностью профилактики.
Количественная оценка индивидуального риска является шагом вперед в планировании медицинской помощи, позволяя сосредоточиться на помощи лицам с высоким риском, и, в конечном счете, обеспечивая снижение бремени ПТСР, возникающего после обращений за неотложной помощью.
ПРИЛОЖЕНИЕ
Членами Международного консорциума по прогнозированию ПТСР являются: Yael Errera-Ankri, Anna C. Barbano, Sarah Freedman, Jessie Frijling, Carel Goslings, Jan Luitse, Alexander McFarlane, Derrick Silove, Hanspeter Moergeli, Joanne Mouthaan, Daisuke Nishi, Meaghan O’Donnell, Marit Sijbrandij, Sharain Suliman and Mirjam van Zuiden.
ВЫРАЖЕНИЕ БЛАГОДАРНОСТИ
A.Y. Shalev, M. Gevonden, A. Ratanatharathorn и E. Laska являются авторами с равным вкладом в опубликованную работу. Исследование финансировалось грантом Национального института психического здоровья США (MH101227), который был предоставлен A. Shalev, R. Kessler и K. Koenen.
DOI: 10.1002/wps.20608
Список исп. литературыСкрыть список1. Stein DJ, Karam EG, Shahly V et al. Post-traumatic stress disorder associated with life-threatening motor vehicle collisions in the WHO World Mental Health Surveys. BMC Psychiatry 2016;16:257.
2. Hoge CW, Castro CA, Messer SC et al. Combat duty in Iraq and Afghanistan, mental health problems, and barriers to care. N Engl J Med 2004;351:13-22.
3. Kessler RC. Posttraumatic stress disorder: the burden to the individual and to society. J Clin Psychiatry 2000;61(Suppl. 5):4-12.
4. Breslau N, Peterson E, Poisson L et al. Estimating post-traumatic stress disorder in the community: lifetime perspective and the impact of typical traumatic events. Psychol Med 2004;34:889-98.
5. Committee on the Assessment of Ongoing Efforts in the Treatment of Posttraumatic Stress Disorder; Board on the Health of Select Populations; Institute of Medicine. Treatment for posttraumatic stress disorder in military and veteran populations: final assessment. Washington: Institute of Medicine National Research Council, 2014.
6. Roberts NP, Roberts PA, Jones N et al. Psychological therapies for post- traumatic stress disorder and comorbid substance use disorder. Cochrane Database Syst Rev 2016;4:CD010204.
7. Sijbrandij M, Kleiboer A, Bisson JI et al. Pharmacological prevention of post- traumatic stress disorder and acute stress disorder: a systematic review and meta-analysis. Lancet Psychiatry 2015;2:413-21.
8. Roberts NP, Roberts PA, Jones N et al. Psychological interventions for post- traumatic stress disorder and comorbid substance use disorder: a systematic review and meta-analysis. Clin Psychol Rev 2015;38:25-38.
9. Hoskins M, Pearce J, Bethell A et al. Pharmacotherapy for post-traumatic stress disorder: systematic review and meta-analysis. Br J Psychiatry 2015;206:93-100.
10. Andrews B, Brewin CR, Philpott R et al. Delayed-onset posttraumatic stress disorder: a systematic review of the evidence. Am J Psychiatry 2007;164:1319-26.
11. Bryant RA, Nickerson A, Creamer M et al. Trajectory of post-traumatic stress following traumatic injury: 6-year follow-up. Br J Psychiatry 2015;206:417-23.
12. Galatzer-Levy IR, Ankri Y, Freedman S et al. Early PTSD symptom trajectories: persistence, recovery, and response to treatment: results from the Jerusalem Trauma Outreach and Prevention Study (J-TOPS). PLoS One 2013;8:e70084.
13. Kessler RC, Rose S, Koenen KC et al. How well can post-traumatic stress disorder be predicted from pre-trauma risk factors? An exploratory study in the WHO World Mental Health Surveys. World Psychiatry 2014;13:265-74.
14. Smid GE, Mooren TT, van der Mast RC et al. Delayed posttraumatic stress disorder: systematic review, meta-analysis, and meta-regression analysis of prospective studies. J Clin Psychiatry 2009;70:1572-82.
15. Shalev AY, Ankri Y, Israeli-Shalev Y et al. Prevention of posttraumatic stress disorder by early treatment: results from the Jerusalem Trauma Outreach and Prevention Study. Arch Gen Psychiatry 2012;69:166-76.
16. Roberts NP, Kitchiner NJ, Kenardy J et al. Multiple session early psychological interventions for the prevention of post-traumatic stress disorder. Cochrane Database Syst Rev 2009;3:CD006869.
17. Sijbrandij M, Olff M, Reitsma JB et al. Treatment of acute posttraumatic stress disorder with brief cognitive behavioral therapy: a randomized controlled trial. Am J Psychiatry 2007;164:82-90.
18. Bryant RA. Early predictors of posttraumatic stress disorder. Biol Psychiatry 2003;53:789-95.
19. Galatzer-Levy IR, Ma S, Statnikov A et al. Utilization of machine learning for prediction of post-traumatic stress: a re-examination of cortisol in the prediction and pathways to non-remitting PTSD. Transl Psychiatry 2017;7:e1070.
20. Bryant RA, O’Donnell ML, Creamer M et al. A multisite analysis of the fluctuating course of posttraumatic stress disorder. JAMA Psychiatry 2013;70:839-46.
21. Brewin CR, Andrews B, Valentine JD. Meta-analysis of risk factors for post- traumatic stress disorder in trauma-exposed adults. J Consult Clin Psychol 2000;68:748-66.
22. Ozer EJ, Best SR, Lipsey TL et al. Predictors of posttraumatic stress disorder and symptoms in adults: a meta-analysis. Psychol Bull 2003;129:52-73.
23. Mollica RF, Sarajlić N, Chernoff M et al. Longitudinal study of psychiatric symptoms, disability, mortality, and emigration among Bosnian refugees. JAMA 2001;286:546-54.
24. Silver RC, Holman EA, McIntosh DN et al. Nationwide longitudinal study of psychological responses to September 11. JAMA 2002;288:1235-44.
25. Dougall AL, Ursano RJ, Posluszny DM et al. Predictors of posttraumatic stress among victims of motor vehicle accidents. Psychosom Med 2001;63: 402-11.
26. Koenen KC, Stellman JM, Stellman SD et al. Risk factors for course of post- traumatic stress disorder among Vietnam veterans: a 14-year follow-up of American legionnaires. J Consult Clin Psychol 2003;71:
980-6.
27. Ryb GE, Dischinger PC, Read KM et al. PTSD after severe vehicular crashes. Ann Adv Automot Med 2009;53:177-93.
28. Ehring T, Kleim B, Clark DM et al. Screening for posttraumatic stress disorder: what combination of symptoms predicts best? J Nerv Ment Dis 2007;195:1004-12.
29. Mouthaan J, Sijbrandij M, Reitsma JB et al. Comparing screening instruments to predict posttraumatic stress disorder. PLoS One 2014;9:e97183.
30. Walters JT, Bisson JI, Shepherd JP. Predicting post-traumatic stress disorder: validation of the Trauma Screening Questionnaire in victims of assault. Psychol Med 2007;37:143-50.
31. O’Donnell ML, Creamer MC, Parslow R et al. A predictive screening index for posttraumatic stress disorder and depression following traumatic injury. J Consult Clin Psychol 2008;76:923-32.
32. Smits N, Smit F, Cuijpers P et al. Using decision theory to derive optimal cut-off scores of screening instruments: an illustration explicating costs and benefits of mental health screening. Int J Methods Psychiatr Res 2007;16: 219-29.
33. Brewin CR. Risk factor effect sizes in PTSD: what this means for intervention. J Trauma Dissociation 2005;6:123-30.
34. Heron-Delaney M, Kenardy J, Charlton E et al. A systematic review of predictors of posttraumatic stress disorder (PTSD) for adult road traffic crash survivors. Injury 2013;44:1413-22.
35. Kilpatrick DG, Resnick HS, Milanak ME et al. National estimates of exposure to traumatic events and PTSD prevalence using DSM-IV and DSM-5 criteria. J Trauma Stress 2013;26:537-47.
36. Bonnie RJ, Fulco CE, Liverman CT (eds). Reducing the burden of injury: advancing prevention and treatment. Washington: National Academy Press, 1999.
37. LF MC. National hospital ambulatory medical care survey emergency department summary. Advance Data from Vital and Health Statistics, Vol. 245. Hyattsville: National Center for Health Statistics, 1992:1994.
38. Rice DP, MacKenzie EJ, Jones AS et al. Cost of injury in the United States: a report to Congress. San Francisco: Institute for Health and Aging, University of California; Baltimore: Injury Prevention Center, Johns Hopkins University, 1989.
39. Bergen GS, National Center for Health Statistics (U.S.). Injury in the United States: 2007 chartbook. Hyattsville: U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Center for Health Statistics, 2008.
40. Ameratunga S, Hijar M, Norton R. Road-traffic injuries: confronting disparities to address a global-health problem. Lancet 2006;367:
1533-40.
41. Lipsky S, Field CA, Caetano R et al. Posttraumatic stress disorder symptomatology and comorbid depressive symptoms among abused women referred from emergency department care. Violence Vict 2005;20:645-59.
42. Golding JM. Intimate partner violence as a risk factor for mental disorders: a meta-analysis. J Fam Violence 1999;14:99-132.
43. Ameratunga S, Tin ST, Coverdale J et al. Posttraumatic stress among hospitalized and nonhospitalized survivors of serious car crashes: a population- based study. Psychiatr Serv 2009;60:402-4.
44. Debray T, Moons KG, Ahmed I et al. A framework for developing, implementing, and evaluating clinical prediction models in an individual participant data meta-analysis. Stat Med 2013;32:3158-80.
45. Chalmers I. The Cochrane collaboration: preparing, maintaining, and disseminating systematic reviews of the effects of health care. Ann N Y Acad Sci 1993;703:156-65.
46. Brincks A, Montag S, Howe GW et al. Addressing methodologic challenges and minimizing threats to validity in synthesizing findings from individual- level data across longitudinal randomized trials. Prev Sci 2018;19(Suppl. 1):60-73.
47. Bainter SA, Curran PJ. Advantages of integrative data analysis for develop- mental research. J Cogn Dev 2015;16:1-10.
48. Gail MH, Brinton LA, Byar DP et al. Projecting individualized probabilities of developing breast cancer for white females who are being examined annually. J Natl Cancer Inst 1989;81:1879-86.
49. Cassidy A, Duffy SW, Myles JP et al. Lung cancer risk prediction: a tool for early detection. Int J Cancer 2007;120:1-6.
50. Cassidy A, Myles JP, van Tongeren M et al. The LLP risk model: an individual risk prediction model for lung cancer. Br J Cancer 2008;98:270-6.
51. Chan DXH, Sim YE, Chan YH et al. Development of the Combined Assessment of Risk Encountered in Surgery (CARES) surgical risk calculator for prediction of postsurgical mortality and need for intensive care unit admission risk: a single-center retrospective study. BMJ Open 2018;8: e019427.
52. Cook NR, Ridker PM. Further insight into the cardiovascular risk calculator: the roles of statins, revascularizations, and underascertainment in the Women’s Health Study. JAMA Intern Med 2014;174:1964-71.
53. Fox ER, Samdarshi TE, Musani SK et al. Development and validation of risk prediction models for cardiovascular events in black adults: the Jackson Heart Study Cohort. JAMA Cardiol 2016;1:15-25.
54. Hippisley-Cox J, Coupland C, Robson J et al. Derivation, validation, and evaluation of a new QRISK model to estimate lifetime risk of cardiovascular disease: cohort study using QResearch database. BMJ 2010;341:c6624.
55. Blanchard EB, Hickling EJ, Forneris CA et al. Prediction of remission of acute posttraumatic stress disorder in motor vehicle accident victims. J Trauma Stress 1997;10:215-34.
56. Frommberger UH, Stieglitz RD, Nyberg E et al. Prediction of posttraumatic stress disorder by immediate reactions to trauma: a prospective study in road traffic accident victims. Eur Arch Psychiatry Clin Neurosci 1998;248:316-21.
57. Jehel L, Paterniti S, Brunet A et al. Prediction of the occurrence and intensity of post-traumatic stress disorder in victims 32 months after bomb attack. Eur Psychiatry 2003;18:172-6.
58. Karstoft KI, Galatzer-Levy IR, Statnikov A et al. Bridging a translational gap: using machine learning to improve the prediction of PTSD. BMC Psychiatry 2015;15:30.
59. Matsuoka Y, Nishi D, Nakajima S et al. Incidence and prediction of psychiatric morbidity after a motor vehicle accident in Japan: the Tachikawa Cohort of Motor Vehicle Accident Study. Crit Care Med 2008;36:74-80.
60. Mayou R, Bryant B, Ehlers A. Prediction of psychological outcomes one year after a motor vehicle accident. Am J Psychiatry 2001;158:1231-8.
61. Shalev AY, Freedman S. PTSD following terrorist attacks: a prospective evaluation. Am J Psychiatry 2005;162:1188-91.
62. Shalev AY, Freedman S, Peri T et al. Predicting PTSD in trauma survivors: prospective evaluation of self-report and clinician-administered instruments. Br J Psychiatry 1997;170:558-64.
63. Qi W, Ratanatharathorn A, Gevonden M et al. Application of data pooling to longitudinal studies of early post-traumatic stress disorder (PTSD): the International Consortium to Predict PTSD (ICPP) project. Eur J Psychotraumatol 2018;9:1476442.
64. Hepp U, Moergeli H, Buchi S et al. Post-traumatic stress disorder in serious accidental injury: 3-year follow-up study. Br J Psychiatry 2008;192:376-83.
65. Shalev AY, Peri T, Brandes D et al. Auditory startle response in trauma survivors with posttraumatic stress disorder: a prospective study. Am J Psychiatry 2000;157:255-61.
66. Frijling JL, van Zuiden M, Koch SBJ et al. Efficacy of oxytocin administration early after psychotrauma in preventing the development of PTSD: study protocol of a randomized controlled trial. BMC Psychiatry 2014;14:92.
67. Jenewein J, Wittmann L, Moergeli H et al. Mutual influence of posttraumatic stress disorder symptoms and chronic pain among injured accident survivors: a longitudinal study. J Trauma Stress 2009;22:540-8.
68. Irish L, Ostrowski SA, Fallon W et al. Trauma history characteristics and subsequent PTSD symptoms in motor vehicle accident victims. J Trauma Stress 2008;21:377-84.
69. Bryant RA, Creamer M, O’Donnell ML et al. A multisite study of the capacity of acute stress disorder diagnosis to predict posttraumatic stress disorder. J Clin Psychiatry 2008;69:923-9.
70. Shalev AY, Videlock EJ, Peleg T et al. Stress hormones and post-traumatic stress disorder in civilian trauma victims: a longitudinal study. Part I: HPA axis responses. Int J Neuropsychopharmacol 2008;11:365-72.
71. Matsuoka Y, Nishi D, Nakajima S et al. The Tachikawa cohort of motor vehicle accident study investigating psychological distress: design, methods and cohort profiles. Soc Psychiatry Psychiatr Epidemiol 2009;44:333-40.
72. Mouthaan J, Sijbrandij M, Luitse JS et al. The role of acute cortisol and DHEAS in predicting acute and chronic PTSD symptoms. Psychoneuroendocrinology 2014;45:179-86.
73. Blake DD, Weathers FW, Nagy LM et al. The development of a Clinician- Administered PTSD Scale. J Trauma Stress 1995;8:75-90.
74. Weathers FW, Keane TM, Davidson JR. Clinician-Administered PTSD Scale: a review of the first ten years of research. Depress Anxiety 2001;13:132-56.
75. Weathers FW, Ruscio AM, Keane TM. Psychometric properties of nine scoring rules for the Clinician-Administered Posttraumatic Stress Disorder Scale. Psychol Assess 1999;11:124-33.
76. Benjet C, Bromet E, Karam E et al. The epidemiology of traumatic event exposure worldwide: results from the World Mental Health Survey Consortium. Psychol Med 2016;46:327-43.
77. Buuren S, Groothuis-Oudshoorn K. MICE: multivariate imputation by chained equations in R. J Stat Softw 2011;45(3).
78. Rubin DB. Multiple imputation for nonresponse in surveys, Vol. 81. Chichester: Wiley, 2004.
79. Brier GW. Verification of forecasts expressed in terms of probability. Mon Weather Rev 1950;78:1-3.
80. Gelman A, Su Y-S, Yajima M et al. Arm: data analysis using regression and multilevel/hierarchical models (R package, version 9.01). http://CRAN.R- project.org/package=arm.
81. Wolf EJ, Maniates H, Nugent N et al. Traumatic stress and accelerated DNA methylation age: a meta-analysis. Psychoneuroendocrinology 2018;92:123-34.
82. Sumner JA, Chen Q, Roberts AL et al. Posttraumatic stress disorder onset and inflammatory and endothelial function biomarkers in women. Brain Behav Immun 2018;69:203-9.
83. Duncan LE, Ratanatharathorn A, Aiello AE et al. Largest GWAS of PTSD (N=20 070) yields genetic overlap with schizophrenia and sex differences in heritability. Mol Psychiatry 2018;23:666-73.
84. Shalev A, Liberzon I, Marmar C. Post-traumatic stress disorder. N Engl J Med 2017;376:2459-69.
85. Liberzon I. Searching for intermediate phenotypes in posttraumatic stress disorder. Biol Psychiatry 2018;83:797-9.
86. Fonzo GA, Goodkind MS, Oathes DJ et al. PTSD psychotherapy outcome predicted by brain activation during emotional reactivity and regulation. Am J Psychiatry 2017;174:1163-74.
87. Logue MW, Amstadter AB, Baker DG et al. The Psychiatric Genomics Consortium Posttraumatic Stress Disorder Workgroup: posttraumatic stress disorder enters the age of large-scale genomic collaboration. Neuropsychopharmacology 2015;40:2287.


