Психиатрия Всемирная психиатрия
Психиатрия Всемирная психиатрия
№02 2019
Долгосрочная эффективность пероральных форм антипсихотиков второго поколения у пациентов с шизофренией и связанных с ней расстройствами: систематический обзор и метаанализ прямых сравнительных исследований №02 2019
Номера страниц в выпуске:214-230
Резюме
Антипсихотики второго поколения (АВП) рекомендованы в качестве поддерживающей терапии при шизофрении. Тем не менее, сравнительная долгосрочная эффективность среди АВП неясна. Мы предлагаем систематический обзор и метаанализ рандомизированных исследований продолжительностью ≥6 месяцев, сравнивающие АВП напрямую (head-to-head) при шизофрении и связанных с ней расстройствах. Первичным результатом было прерывание терапии по всем причинам. Вторичные результаты включали эффективность и переносимость, т.е. психопатологические проявления, прерывание терапии в связи с неэффективностью и непереносимостью, рецидивы, госпитализации, ремиссии, функционирование, качество жизни и нежелательные явления. С помощью моделей со случайными эффектами были рассчитаны объединенный относительный риск и стандартизованная разность средних. В 59 исследованиях (N=45787), длящихся 47,4±32,1 недели (диапазон 24-186), не было выявлено последовательного превосходства каких-либо АВП по эффективности и переносимости. Что касается прерывания терапии по любым причинам, клозапин, оланзапин и рисперидон значительно (p<0,05) превосходили несколько других АВП, в то время как кветиапин уступал нескольким другим АВП. В отношении психопатологических проявлений клозапин и оланзапин превосходили несколько других АВП, в то время как кветиапин и зипрасидон уступали нескольким другим АВП. Данные по другим результатам эффективности были скудными. В отношении прекращения приема препаратов вследствие непереносимости, рисперидон превосходил, а клозапин уступал нескольким другим АВП. По показателю увеличения массы тела оланзапин был хуже в сравнении со всеми АВП, кроме клозапина, и рисперидон был достоверно хуже, чем несколько других АВП. Что касается увеличения уровня пролактина, рисперидон и амисульприд были значительно хуже, чем несколько других АВП. В отношении паркинсонизма оланзапин превосходил рисперидон, без существенных различий по акатизии. Что касается седации и сонливости, клозапин и кветиапин были значительно хуже, чем некоторые другие АВП. Таким образом, определены различные долгосрочные модели эффективности и переносимости АВП. Долгосрочные профили рисков и преимуществ конкретных АВП должны быть использованы в индивидуальном подходе к пациентам для оптимизации результатов поддерживающего лечения.
Ключевые слова: антипсихотики второго поколения, поддерживающая терапия, рандомизированные контролируемые исследования, прерывание терапии, эффективность, переносимость, клозапин, оланзапин, рисперидон.
Антипсихотики второго поколения (АВП) рекомендованы в качестве поддерживающей терапии при шизофрении. Тем не менее, сравнительная долгосрочная эффективность среди АВП неясна. Мы предлагаем систематический обзор и метаанализ рандомизированных исследований продолжительностью ≥6 месяцев, сравнивающие АВП напрямую (head-to-head) при шизофрении и связанных с ней расстройствах. Первичным результатом было прерывание терапии по всем причинам. Вторичные результаты включали эффективность и переносимость, т.е. психопатологические проявления, прерывание терапии в связи с неэффективностью и непереносимостью, рецидивы, госпитализации, ремиссии, функционирование, качество жизни и нежелательные явления. С помощью моделей со случайными эффектами были рассчитаны объединенный относительный риск и стандартизованная разность средних. В 59 исследованиях (N=45787), длящихся 47,4±32,1 недели (диапазон 24-186), не было выявлено последовательного превосходства каких-либо АВП по эффективности и переносимости. Что касается прерывания терапии по любым причинам, клозапин, оланзапин и рисперидон значительно (p<0,05) превосходили несколько других АВП, в то время как кветиапин уступал нескольким другим АВП. В отношении психопатологических проявлений клозапин и оланзапин превосходили несколько других АВП, в то время как кветиапин и зипрасидон уступали нескольким другим АВП. Данные по другим результатам эффективности были скудными. В отношении прекращения приема препаратов вследствие непереносимости, рисперидон превосходил, а клозапин уступал нескольким другим АВП. По показателю увеличения массы тела оланзапин был хуже в сравнении со всеми АВП, кроме клозапина, и рисперидон был достоверно хуже, чем несколько других АВП. Что касается увеличения уровня пролактина, рисперидон и амисульприд были значительно хуже, чем несколько других АВП. В отношении паркинсонизма оланзапин превосходил рисперидон, без существенных различий по акатизии. Что касается седации и сонливости, клозапин и кветиапин были значительно хуже, чем некоторые другие АВП. Таким образом, определены различные долгосрочные модели эффективности и переносимости АВП. Долгосрочные профили рисков и преимуществ конкретных АВП должны быть использованы в индивидуальном подходе к пациентам для оптимизации результатов поддерживающего лечения.
Ключевые слова: антипсихотики второго поколения, поддерживающая терапия, рандомизированные контролируемые исследования, прерывание терапии, эффективность, переносимость, клозапин, оланзапин, рисперидон.
Перевод: Мурашко А.А. (Москва)
Редактура: к.м.н. Потанин С.С. (Москва)
Kishimoto T, Hagi K, Nitta M et al. Long-term effectiveness of oral second-generation antipsychotics in patients with schizophrenia and related disorders: a systematic review and meta-analysis of direct head-to-head comparisons. World Psychiatry 2019; 18(2): 208–224
Резюме
Антипсихотики второго поколения (АВП) рекомендованы в качестве поддерживающей терапии при шизофрении. Тем не менее, сравнительная долгосрочная эффективность среди АВП неясна. Мы предлагаем систематический обзор и метаанализ рандомизированных исследований продолжительностью ≥6 месяцев, сравнивающие АВП напрямую (head-to-head) при шизофрении и связанных с ней расстройствах. Первичным результатом было прерывание терапии по всем причинам. Вторичные результаты включали эффективность и переносимость, т.е. психопатологические проявления, прерывание терапии в связи с неэффективностью и непереносимостью, рецидивы, госпитализации, ремиссии, функционирование, качество жизни и нежелательные явления. С помощью моделей со случайными эффектами были рассчитаны объединенный относительный риск и стандартизованная разность средних. В 59 исследованиях (N=45787), длящихся 47,4±32,1 недели (диапазон 24-186), не было выявлено последовательного превосходства каких-либо АВП по эффективности и переносимости. Что касается прерывания терапии по любым причинам, клозапин, оланзапин и рисперидон значительно (p<0,05) превосходили несколько других АВП, в то время как кветиапин уступал нескольким другим АВП. В отношении психопатологических проявлений клозапин и оланзапин превосходили несколько других АВП, в то время как кветиапин и зипрасидон уступали нескольким другим АВП. Данные по другим результатам эффективности были скудными. В отношении прекращения приема препаратов вследствие непереносимости, рисперидон превосходил, а клозапин уступал нескольким другим АВП. По показателю увеличения массы тела оланзапин был хуже в сравнении со всеми АВП, кроме клозапина, и рисперидон был достоверно хуже, чем несколько других АВП. Что касается увеличения уровня пролактина, рисперидон и амисульприд были значительно хуже, чем несколько других АВП. В отношении паркинсонизма оланзапин превосходил рисперидон, без существенных различий по акатизии. Что касается седации и сонливости, клозапин и кветиапин были значительно хуже, чем некоторые другие АВП. Таким образом, определены различные долгосрочные модели эффективности и переносимости АВП. Долгосрочные профили рисков и преимуществ конкретных АВП должны быть использованы в индивидуальном подходе к пациентам для оптимизации результатов поддерживающего лечения.
Ключевые слова: антипсихотики второго поколения, поддерживающая терапия, рандомизированные контролируемые исследования, прерывание терапии, эффективность, переносимость, клозапин, оланзапин, рисперидон.
Шизофрения – психическое расстройство, течение которого обычно характеризуется неоднократными рецидивами, а также ухудшением психопатологической симптоматики и социального функционирования, что требует поддерживающей терапии1-3. Антипсихотики эффективны для профилактики рецидивов у пациентов, как с хроническим течением, так и первым эпизодом4,5, снижая риск рецидива в 2-6 раз по сравнению с отсутствием лечения антипсихотиками2,4-6.
Предыдущий метаанализ нашей группы был посвящен сравнению антипсихотиков второго поколения (АВП) с антипсихотиками первого поколения (АПП), где было выявлено, что первые как класс превосходят последние
в отношении профилактики рецидивов, прерывания терапии по всем причинам и других связанных с рецидивом исходов3.
Несмотря на важное значение долгосрочного лечения при шизофрении, при котором показатели преимуществ и рисков лекарственных препаратов могут отличаться от таковых при купирующей терапии, в настоящее время не существует комплексного метаанализа сравнительной долгосрочной эффективности и безопасности пероральных АВП7.
Хотя в одном метаанализе исследований поддерживающей терапии сравнивались антипсихотики с плацебо2, косвенные сравнения с использованием плацебо в качестве общего компаратора не являются окончательными8. Кроме того, метаанализ множества видов лечения, который включает косвенные сравнения, необязательно идеален, особенно когда количество исследований, сравнивающих антипсихотики напрямую, ограничено и когда однородность этих исследований не может быть гарантирована9.
Знания о сравнительной эффективности и переносимости АВП при длительном лечении шизофрении имеют важное значение7. В частности, различия в риске побочных эффектов9-11, некоторые могут усиливаться со временем, необходимо сопоставлять с потенциальными различиями в долгосрочной эффективности.
Здесь мы сообщаем о результатах первого комплексного метаанализа рандомизированных контролируемых исследований, сравнивающих два или более АВП напрямую (head-to-head) при долгосрочном лечении шизофрении, с целью оценки сравнительной эффективности и безопасности этих препаратов.
Поиск и критерии включения
Поиск был произведен без ограничений по языку по базам: MEDLINE/PubMed, Cochrane library, ISI Web of Science, PsycINFO, CINAHL и US National Institutes of Health clinical trials registry (http://www.clinicaltrials.gov). Следующие поисковые термины были использованы: antipsychotic(s); neuroleptic(s); названия АВП; schizophrenia; random, randomly, randomized; и maintenance, relapse, discontinuation или long-term. Последний поиск был выполнен 29 октября 2018 года. После поиска по базам данных был произведен ручной поиск по библиографиям соответствующих исследований и обзоров. С авторами и компаниями связывались для предоставления недостающей информации и неопубликованных данных.
Мы включили рандомизированные, прямые (head-to-head) сравнительные исследования оральных форм АВП у взрослых с шизофренией или шизоаффективным расстройством, в которых сообщалось о прерывании терапии, о времени рандомизации (во время купирующей или поддерживающей фазы). Поскольку мы стремились сосредоточить внимание на сравнительной долгосрочной эффективности АВП, мы включали только исследования head-to-head продолжительностью ≥6 месяцев.
Мы исключили исследования, в которых было >20% пациентов без диагноза «шизофрения/шизоаффективное расстройство». Учитывая, что пролонгированные инъекционные формы улучшают приверженность терапии и тем самым влияют на долгосрочные исходы13,14, мы исключили исследования пролонгированных антипсихотиков.
Поиск, отбор литературы и извлечение данных проводились независимо ≥2 рецензентами (KH, MN, TK, CC). Разногласия разрешались на основе консенсуса.
Вторичные результаты включали: а) изменение баллов психопатологической симптоматики по шкалам Positive and Negative Syndrome Scale (PANSS), Brief Psychiatric Rating Scale (BPRS) или Clinical Global Impression – Severity (CGI-S) (смешанные модели или данные последнего проведенного наблюдения были в приоритете над анализом наблюдаемых случаев); б) прекращение терапии в связи с неэффективностью (по информации авторов оригинальных исследований); в) прекращение терапии в связи с непереносимостью (по информации авторов оригинальных исследований); г) рецидивы (по информации авторов оригинальных исследований); д) госпитализации; е) ремиссии (по информации авторов оригинальных исследований); ж) оценку функционирования; з) качество жизни; и) нежелательные явления.
Нежелательные явления включали: повышение массы тела (как изменение от исходного или соотношение пациентов с клинически значимым увеличением); увеличение уровня пролактина (как изменение от исходного или соотношение пациентов с гиперпролактинемией); двигательные побочные эффекты, включая паркинсонизм (который оценивали по шкале Simpson-Angus Rating Scale или применению холинолитических препаратов), акатизию и дискинезию; седацию и/или сонливость.
С помощью моделей случайных эффектов15 были рассчитаны объединенный относительный риск (ОР) и стандартизованная разность средних (СРС) с 95% доверительными интервалами (ДИ). Значения ОР<1 указывают на превосходство первого АВП по отрицательным результатам (таким как прекращение приема терапии по всем причинам, рецидив, прекращение приема терапии в связи с неэффективностью и непереносимостью), в то время как значения ОР >1 указывают на превосходство по единственному положительному результату – ремиссии. Для простоты мы скорректировали размеры эффекта, так что СРС<0 указывает на превосходство первого АВП, независимо от того, является ли более низкое значение (например, психопатологической симптоматики) или более высокое значение (например, функционирования, качества жизни) положительным результатом.
Число больных, которых необходимо лечить (ЧБНЛ), вычислялось, когда различия по категорийным результатам были значительными. Гетерогенность изучалась только при анализе ≥2 исследований с использованием критерия хи-квадрат (p<0,1 указывает на статистически значимую гетерогенность)16 и статистики I2 (I2≥50% указывает на статистически значимую гетерогенность)17. Для оценки качества исследования мы использовали шкалу Jadad18, которая дает суммарный балл для анализа чувствительности.
Кроме того, были проведены анализы подгрупп по первичному результату (при наличии ≥2 исследований), направленные на выявление потенциальных модераторов, методологических систематических ошибок и на возможность обобщения результатов на клинически релевантные субпопуляции или экспериментальные группы. В анализ подгрупп были включены: а) рандомизация по моменту времени (острая фаза или фаза поддерживающей терапии); б) финансовая поддержка (спонсоры конкретных препаратов или научные учреждения в качестве спонсора); в) качество исследования (высокое или низкое по баллу шкалы Jadad)18; г) ослепление (открытое, или простое слепое, или двойное слепое); д) местонахождение (международное/ США/Европа/Азия); е) дозировка (фиксированная или изменяющаяся); ж) первый эпизод расстройства или хронический пациент.
Программное обеспечение Comprehensive Meta-Analysis, версия 3 (Biostat, NJ, США), использовалось для проведения всех двусторонних анализов с альфа=0,05 без корректировок для множественных сравнений. Систематические ошибки публикации оценивались с помощью воронкообразного графика, регрессионного теста Egger’а19 и метода «trim and fill»20 для первичного результата при анализе ≥3 исследований.
Результаты
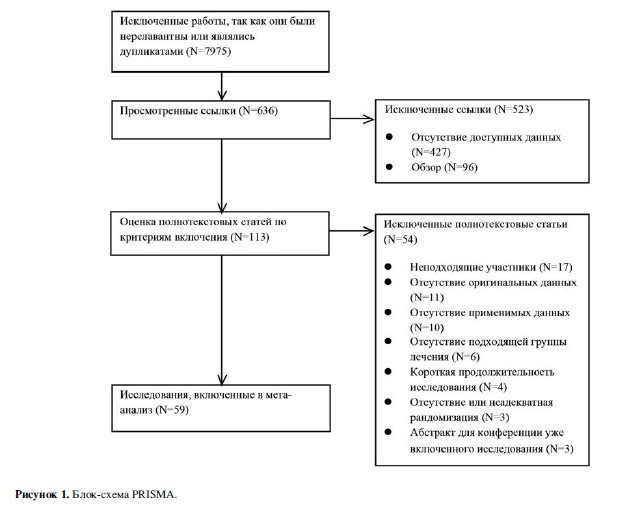
В целом, мы включили 63 статьи21-83 (59 рандомизированных исследований) с 45 787 участниками (медиана: 255 участников/исследование, диапазон: от 12 до 18 154) (таблица 1). Средний возраст участников составил 37,6±7,0 года; 62,1±13,3% были мужского пола и 61,1±28,8% – белые. Средняя продолжительность исследований составила 47,4±32,1 недели (диапазон: 24-186).
Сорок шесть исследований включали пациентов с несколькими эпизодами, восемь – исключительно пациентов с первым эпизодом, четыре – исключительно резистентных к лечению пациентов (все изучали клозапин), и в одном не сообщалось о количестве эпизодов у включенных пациентов79. Тридцать четыре исследования были двойными слепыми, 20 – открытыми, а в пяти были «слепые» рейтеры. Сорок исследований были спонсированы фармацевтическими компаниями, 18 финансировались государством, и в одном был неясен вопрос финансирования77.
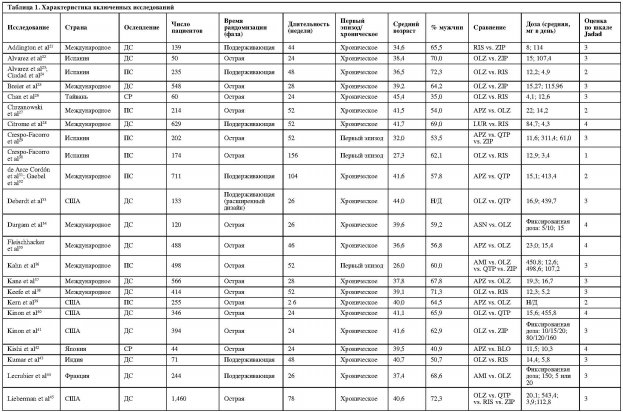
Количество исследований с каждым отдельным АВП составило: оланзапин – 43, рисперидон – 27, кветиапин – 15, зипрасидон – 12, арипипразол – 12, клозапин – 8, амисульприд – 4, асенапин – 4, луразидон – 2, палиперидон – 2, блонансерин – 1, карипразин – 1 и сертиндол – 1.
В 39 (66,1%) исследованиях пациенты были рандомизированы в острой фазе, в восемнадцати (30,5%) – в фазе поддерживающей терапии, для двух исследований время рандомизации неизвестно (3,4%)60,64. В двух исследованиях33,76 согласно дизайну пациенты, стабилизированные на препарате А, были рандомизированы для продолжения лечения или смены препарата на препарат В. В двух исследованиях70,75 был «натуралистический» дизайн, при котором возможна смена изначально назначенного препарата.
В одиннадцати исследованиях сообщалось о рецидивах и в шести – о ремиссиях в качестве результатов. Определение рецидива было различным и совпадало только в двух исследованиях28,47. В трех из шести исследований, содержащих информацию о ремиссии, использовались критерии Andreasen и соавт.84.
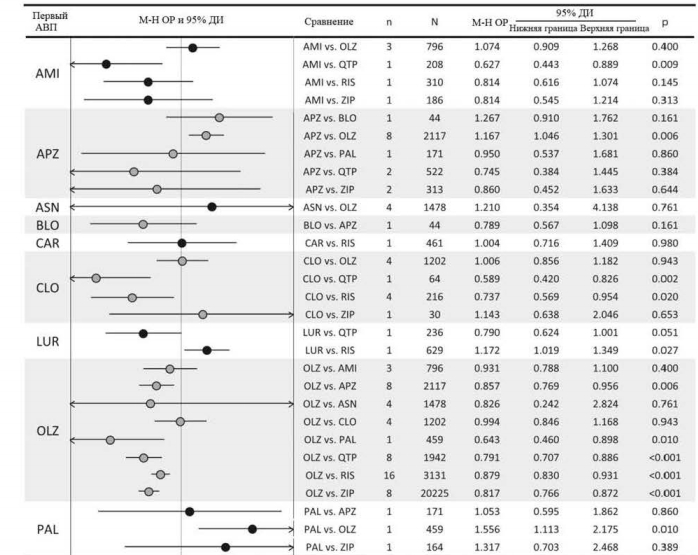
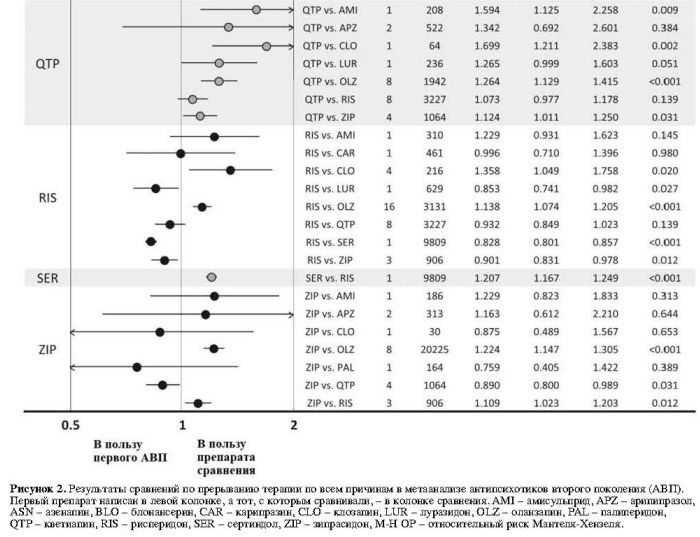
Показатели прерывания терапии по всем причинам у клозапина были значительно ниже в сравнении с кветиапином (одно исследование, N=64, ОР=0,59, 95% ДИ: 0,42-0,83, p=0,002) и рисперидоном (четыре исследования, N=216, ОР=0,74, 95% ДИ: 0,57-0,95, p=0,020, I2=5,1%). Указанные показатели для оланзапина были значительно ниже по сравнению с палиперидоном (одно исследование, N=459, ОР=0,64, 95% ДИ: 0,46-0,90, р=0,010), кветиапином (восемь исследований, N=1942, ОР=0,79, 95% ДИ: 0,71-0,89, р<0,001, I2=55,8%), рисперидоном (16 исследований, N=3131, ОР=0,88, 95% ДИ: 0,83-0,93, р<0,001, I2=0,0%) и зипрасидоном (восемь исследований, N=20 225, ОР=0,82, 95% ДИ: 0,77-0,87, р<0,001, I2=37,0%). Показатели рисперидона по прерыванию терапии по всем причинам были значительно ниже по сравнению с сертиндолом (одно исследование, N=9809, ОР=0,83, 95% ДИ: 0,80-0,86, р<0,001) и зипрасидоном (три исследования, N=906, ОР=0,90, 95% ДИ: 0,83-0,98, р=0,012, I2=0,0%).
Другие достоверные различия включают в себя: значительно более низкие показатели прерывания терапии по всем причинам у амисульприда в сравнении с кветиапином (одно исследование, N=208, ОР=0,63, 95% ДИ: 0,44-0,89, р=0,009); значительно более высокие показатели прерывания терапии для а) арипипразола в сравнении с оланзапином (восемь исследований, N=2117, ОР=1,17; 95% ДИ: 1,05-1,30, р=0,006, I2=28,8%); б) луразидона в сравнении с рисперидоном (одно исследование, N=629, ОР=1,17; 95% ДИ: 1,02-1,35, р=0,027); и в) кветиапина в сравнении с зипрасидоном (четыре исследования, N=1064, ОР=1,12, 95% ДИ: 1,01-1,25, p=0,031, I2=47,0%).
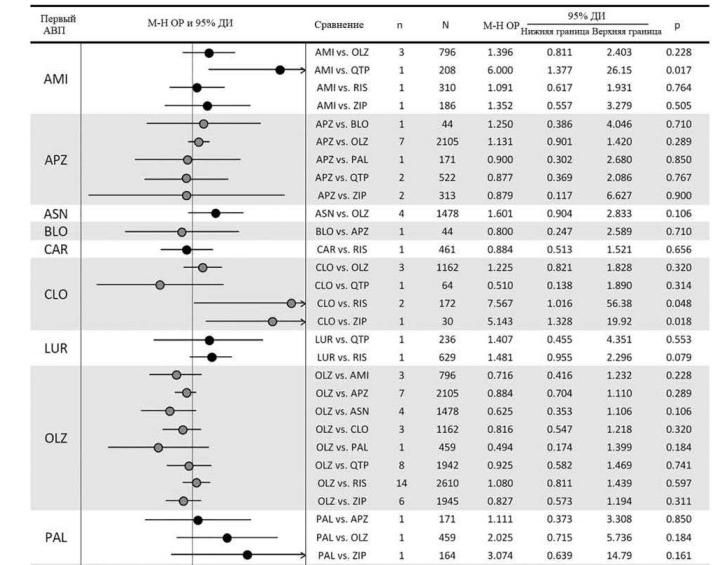
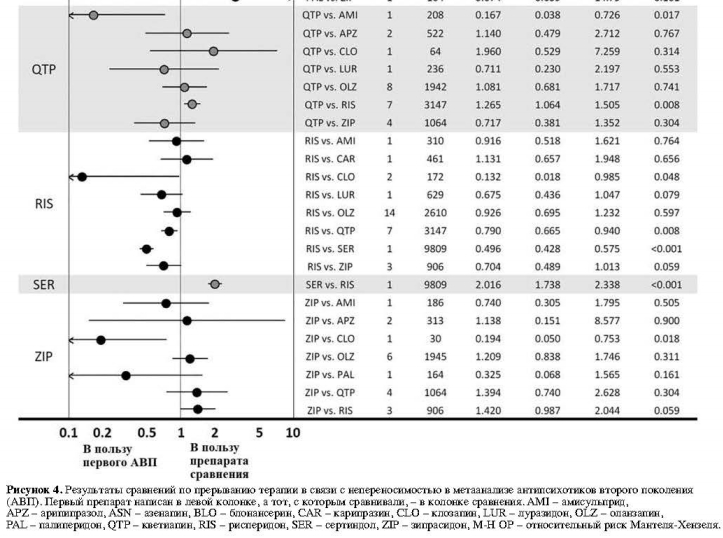
Среди 23 сравнений в отношении прерывания терапии в связи с непереносимостью на основании 50 исследований, выявлены следующие достоверные различия: кветиапин превосходил амисульприд; рисперидон превосходил клозапин, кветиапин и сертиндол; и зипразидон превосходил клозапин (рис. 4).
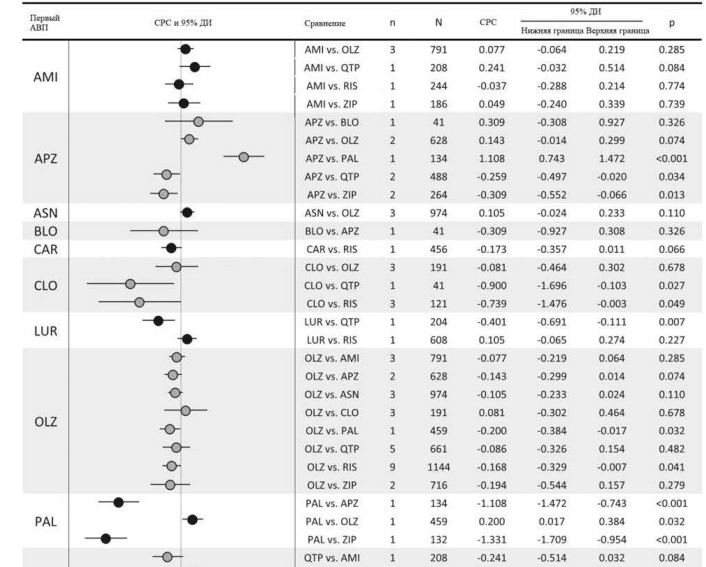
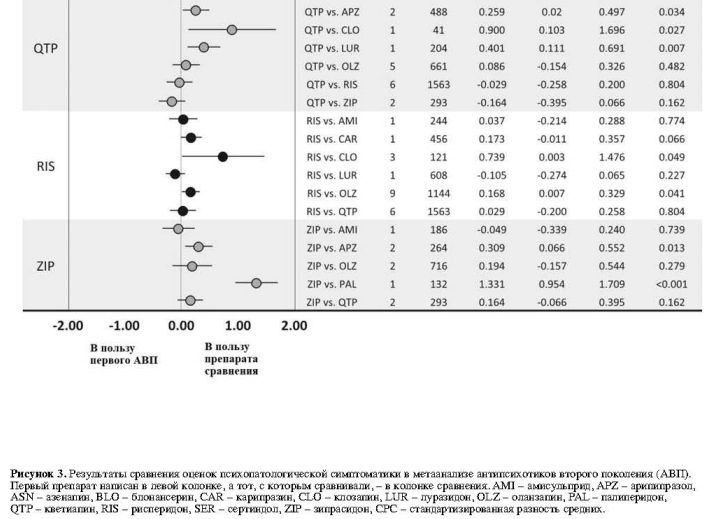
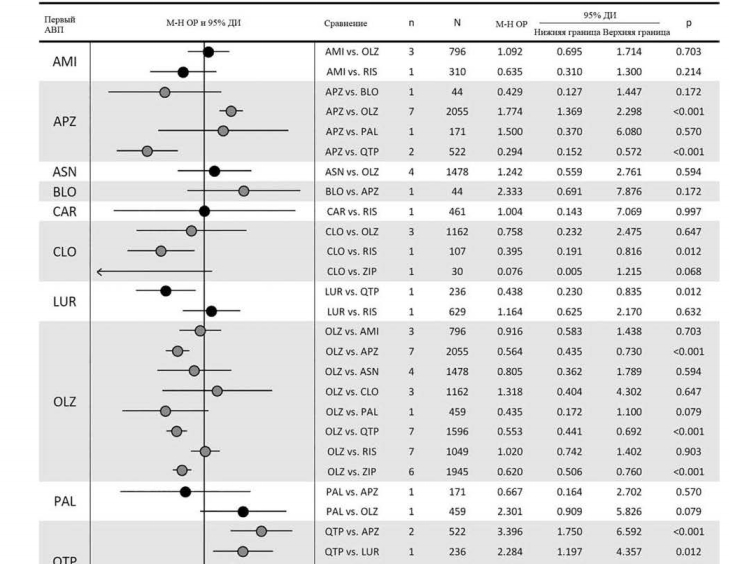
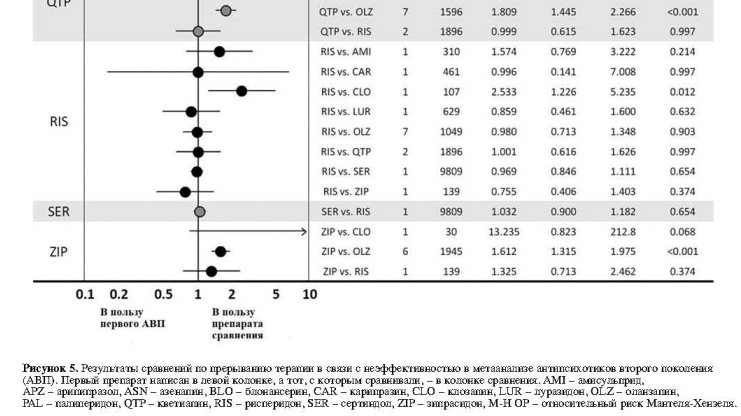
В 20 сравнениях, касающихся прерывания терапии в связи с неэффективностью, на основе 47 исследований были выявлены следующие существенные различия: арипипразол превосходил кветиапин; клозапин превосходил рисперидон; луразидон превосходил кветиапин; и оланзапин превосходил арипипразол, кветиапин и зипразидон (рис. 5).
В 11 сравнениях, касающихся рецидива, выявлено только одно существенное различие: превосходство оланзапина над рисперидоном. В 13 сравнениях, относительно госпитализации, клозапин превосходил оланзапин, а луразидон и рисперидон превосходили кветиапин. В шести сравнениях, содержащих информацию о ремиссии, луразидон превосходил кветиапин, а кветиапин превосходил рисперидон. Среди 12 сравнений в отношении функционирования арипипразол превосходил кветиапин, карипразин превосходил рисперидон, а клозапин превосходил оланзапин. В 11 сравнениях, касающихся качества жизни, не было достоверных различий между парами АВП.
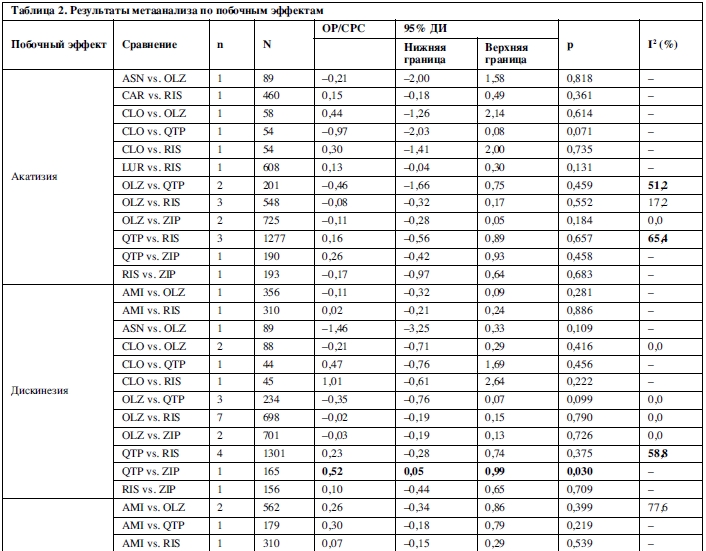
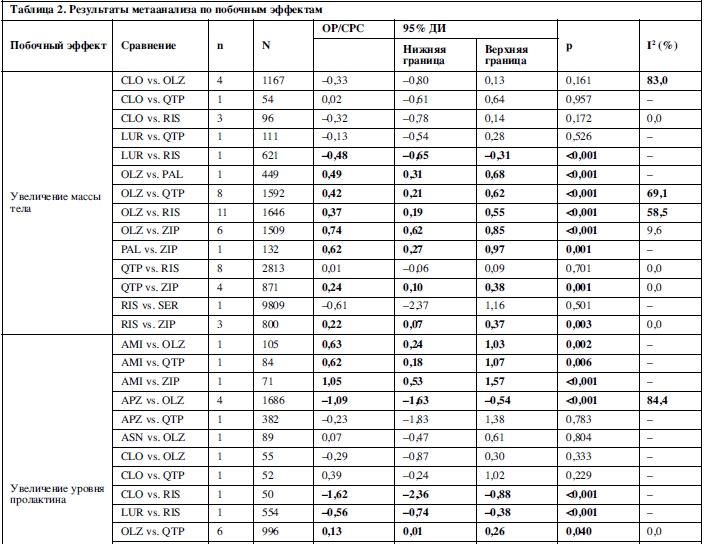
25 сравнений, основанных на 46 исследованиях, были исследованы методами метаанализа в отношении увеличения массы тела. Амисульприд, арипипразол, кветиапин, рисперидон, палиперидон и зипрасидон превосходили оланзапин; амисульприд, карипразин, луразидон и зипрасидон превосходили рисперидон; палиперидон превосходил арипипразол; и зипрасидон превосходил палиперидон и кветиапин (таблица 2).
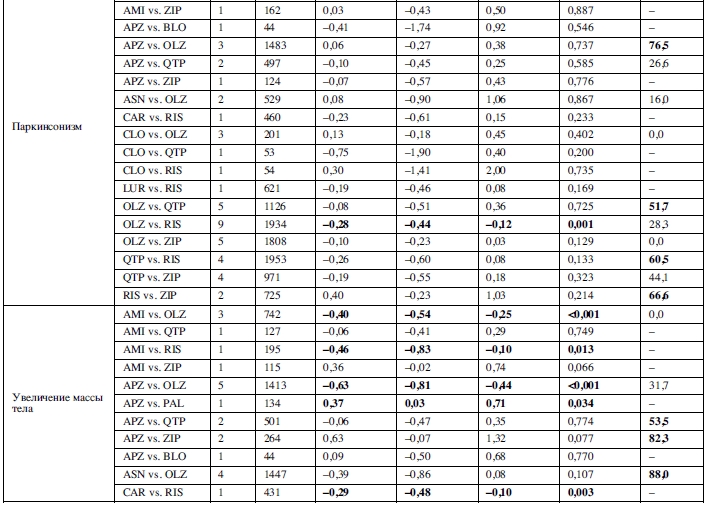
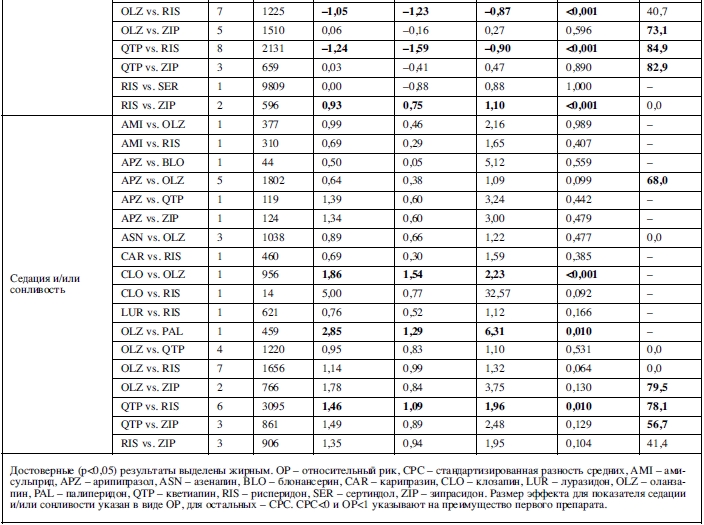
Увеличение уровня пролактина было исследовано в метаанализе 16 сравнений, основанных на 21 исследовании. Клозапин, луразидон, оланзапин, кветиапин и зипрасидон превосходили рисперидон; арипипразол и кветиапин превосходили оланзапин; оланзапин, кветиапин и зипразидон превосходили амисульприд (таблица 2).
Паркинсонизм был исследован в метаанализе 20 сравнений, основанных на 28 исследованиях: оланзапин превосходил рисперидон. Дискинезия была исследована в
11 сравнениях на основе 13 исследований: зипрасидон превосходил кветиапин. Акатизия – в 11 сравнениях на основе 9 исследований: без существенных различий. Седация и/или сонливость – в 17 сравнениях, основанных на 27 исследованиях: оланзапин и палиперидон превосходили клозапин, а рисперидон превосходил кветиапин.
Что касается финансирования, то результаты, указывающие на более низкое положение конкретного препарата, были нейтрализованы при включении трех из 43 исследований, спонсируемых производителями лекарств. Напротив, один результат, показывающий превосходство оланзапина, был нейтрализован, при включении одного исследования, финансируемого производителем.
Что касается ослепления, некоторые результаты изменялись, когда мы ограничивали анализы открытыми или слепыми исследованиями. Ограничив анализ только слепыми исследованиями, 5/39 результатов, которые были статистически значимыми, стали недостоверными. Ограничивая анализ только открытыми исследованиями, 1/39 недостоверных результатов стал статистически значимым.
Ни один из других потенциальных модераторов, рассмотренных при анализе подгрупп, не оказывал отчетливого эффекта. Ни в одном из анализов подгрупп направленность результатов не менялась.
В этом первом комплексном метаанализе сравнительной эффективности и переносимости АВП при долгосрочном лечении шизофрении, включающем 59 исследований и 45 787 участников, не наблюдалось отчетливого превосходства какого-либо одного антипсихотика по нескольким результатам.
В отношении прерывания терапии по всем причинам клозапин, оланзапин и рисперидон превосходили несколько других АВП, в то время как кветиапин уступал нескольким другим АВП. Что касается психопатологической симптоматики, то клозапин и оланзапин превосходили несколько других АВП, в то время как кветиапин, а также зипрасидон уступали нескольким другим АВП. В отношении функционирования, качества жизни и ремиссии данные были скудными.
Относительно прерывания терапии в связи с непереносимостью, рисперидон превосходил, а клозапин уступал нескольким другим АВП. Однако следует иметь в виду, что прекращение лечения в связи с нежелательными явлениями в современных исследованиях часто включает в себя нежелательные явления, связанные с неэффективностью, и поэтому этот результат не отражает исключительно переносимость.
При делении на отдельные побочные эффекты паттерны преимуществ/недостатков стали более ясными в некоторых случаях. Например, оланзапин связан с увеличением массы тела больше, чем все другие АВП, кроме клозапина, в то время как зипрасидон меньше, чем другие АВП; амисульприд и рисперидон повышают уровень пролактина в крови больше, чем другие АВП. Кроме того, седация и/или сонливость чаще наблюдаются при длительном лечении клозапином и кветиапином.
Мы сосредоточились на прямых сравнениях для текущего метаанализа. Относительный недостаток прямых сравнений поддерживающей терапии может вызвать интерес к проведению сетевого метаанализа. Однако, хотя такая методология с использованием непрямых сравнений может привести к ранжированию, отсутствие большого числа сравнений и неоднородность исследований, проводимых в различных популяциях и на протяжении нескольких десятилетий, вероятно, приведут к появлению систематических ошибок, которых нет в метаанализе прямых «head to head» исследований9.
Сравнивая наши результаты с результатами Zhao и соавт.85, которые провели сетевой метаанализ исследований по профилактике рецидивов у стабильных пациентов с шизофренией, где в качестве терапии также включали антипсихотики первого поколения и пролонгированные формы, появляются некоторые различия. Например, единственным достоверным результатом для предотвращения рецидива, связанным с АВП, было превосходство оланзапина над хлорпромазином и галоперидолом, в то время как мы обнаружили, что оланзапин превосходит рисперидон (хотя на основе только одного исследования). Кроме того, в отношении прерывания терапии по всем причинам мы наблюдали значительное превосходство оланзапина над арипипразолом, палиперидоном, кветиапином, рисперидоном и зипрасидоном в прямых сравнениях, в то время как Zhao и соавт., используя косвенные сравнения, обнаружили, что оланзапин превосходит только арипипразол. Таким образом, мы считаем, что ограничение метаанализа исключительно рандомизированными прямыми (head-to-head) сравнениями дает более точные результаты.
Каково применение наших выводов для выбора АВП при долгосрочном лечении шизофрении? Во-первых, мы должны рассмотреть величину размеров эффекта по прерыванию терапии по всем причинам. Поскольку они варьировались от средних до больших, мы считаем, что они клинически значимы, особенно во время фазы поддерживающей терапии2,7,86,87. Результаты, касающиеся психопатологической симптоматики, примерно совпадали с результатами по прерыванию терапии по всем причинам, в том, что клозапин и оланзапин превосходили несколько других АВП, в то время как кветиапин несколько уступал, но в этом случае вместе с зипразидоном. Тем не менее, результаты по различным побочным эффектам, с определенными недостатками у клозапина, оланзапина и рисперидона, подчеркивают тот факт, что крайне важно не рассматривать эффективность в отрыве от переносимости. Например, клозапин и оланзапин относятся к числу препаратов с некоторыми наиболее проблематичными побочными эффектами, такими как увеличение массы тела и метаболические нарушения10,88, а также, в случае клозапина, изменениями в клеточном составе крови89. Учитывая такие противоречивые результаты в различных категориях результатов, следует подчеркнуть важность сбалансированного выбора препарата с индивидуальным подходом для каждого пациента.
Мы выявили сходные результаты поддерживающей терапии при шизофрении в отношении сравнительной эффективности клозапина и оланзапина. Даже в исследованиях, нацеленных на лечение резистентных пациентов, размеры эффекта были одинаковыми. Поскольку сетевой метаанализ краткосрочных исследований пациентов с резистентностью не выявил превосходства клозапина по сравнению с оланзапином, рисперидоном и зипрасидоном90, что могло быть обусловлено использованием субоптимальных доз клозапина или включением нерезистентных пациентов, необходимы дальнейшие высококачественные, краткосрочные и долгосрочные, прямые исследования клозапина с другими АВП.
Необходимо рассмотреть несколько ограничений этого исследования. Большинство сравнений основывалось на относительно небольшом числе прямых исследований. Из всех 250 сравнений 139 были основаны только на одном исследовании, но мы проводили метаанализ только для результатов, по которым имелись данные по крайней мере в двух прямых исследованиях. Количество пациентов на одно исследование также часто было небольшим, и эквивалентные дозы, использованные в исследованиях, возможно, не были сбалансированными или соответствующими. Кроме того, ограниченное число исследований уменьшило мощность анализа подгрупп. Также только в шести и одиннадцати исследованиях сообщалось о ремиссии и рецидиве в качестве результата соответственно. Однако, поскольку психопатологическая симптоматика, ответ на лечение и функционирование могут ухудшаться при повторных рецидивах87,91, информация о ремиссии и риске рецидива при применении отдельных антипсихотиков важна.
Время рандомизации во включенных исследованиях отличалось, т.е. некоторые исследования рандомизировали пациентов во время острой фазы, а другие – во время фазы поддерживающей терапии. Более того, некоторые исследования включали исключительно резистентных к терапии пациентов, в то время как некоторые другие включали исключительно пациентов с первым эпизодом. Определения рецидива и ремиссии различались в разных исследованиях. Кроме того, два из включенных исследований имели расширенный дизайн и в двух была возможна смена терапии после рандомизации, что могло повлиять на результаты. Такая неоднородность дизайна исследований, а также выборок пациентов создают риск появления систематических ошибок. Однако мы оценили влияние характеристик пациентов и дизайна исследований в качестве потенциальных модераторов, проведя анализ подгрупп.
Наконец, хотя эффективность инъекционных антипсихотиков длительного действия (ИАДД) при длительном лечении шизофрении явно важна92, мы исключили исследования ИАДД, поскольку этот аспект уже был всесторонне изучен в метаанализах13,14,93. Включение ИАДД, которые доступны не для всех АВП, в этот метаанализ, привело бы к еще большей неоднородности выборок и методов, сложности анализа и интерпретации результатов.
В заключение следует отметить, что результаты этого метаанализа свидетельствуют о наличии некоторых существенных различий в эффективности и переносимости АВП при поддерживающей терапии шизофрении. Клозапин, оланзапин и рисперидон, по-видимому, превосходят несколько других АВП в отношении прерывания терапии по всем причинам, в то время как кветиапин уступает. Что касается оценки психопатологической симптоматики, клозапин и оланзапин, по-видимому, превосходят несколько других АВП, в то время как кветиапин и зипразидон менее эффективны. В отношении прерывания терапии из-за побочных эффектов только рисперидон превосходит и только клозапин уступает ряду других АВП.
Из-за ограниченного числа прямых исследований сравнительная эффективность некоторых АВП неясна, и результаты должны интерпретироваться с осторожностью, так как они основываются на небольшом числе исследований. Таким образом, для дальнейшего развития доказательной долгосрочной терапии пациентов с шизофренией желательно иметь большую базу данных, включающую в себя многие АВП с детализированными результатами по эффективности и переносимости. В частности, выявление предикторов благоприятных результатов при применении определенных антипсихотиков даст возможность персонализировать лечение.
Благодарности
Эта работа выполнена при поддержке The Zucker Hillside Hospital Advanced Center for Intervention and Services Research for the Study of Schizophrenia grant (MH090590) от US National Institute of Mental Health. Спонсор не имел влияния на дизайн, сбор данных, анализ данных, интерпретацию данных или написание статьи. Авторы благодарны A. Seidman и O. Uzoma за помощь в поиске литературы и абстракции данных. T. Kishimoto и K. Hagi внесли равный вклад в эту работу.
DOI: 10.1002/wps.20632
Редактура: к.м.н. Потанин С.С. (Москва)
Kishimoto T, Hagi K, Nitta M et al. Long-term effectiveness of oral second-generation antipsychotics in patients with schizophrenia and related disorders: a systematic review and meta-analysis of direct head-to-head comparisons. World Psychiatry 2019; 18(2): 208–224
Резюме
Антипсихотики второго поколения (АВП) рекомендованы в качестве поддерживающей терапии при шизофрении. Тем не менее, сравнительная долгосрочная эффективность среди АВП неясна. Мы предлагаем систематический обзор и метаанализ рандомизированных исследований продолжительностью ≥6 месяцев, сравнивающие АВП напрямую (head-to-head) при шизофрении и связанных с ней расстройствах. Первичным результатом было прерывание терапии по всем причинам. Вторичные результаты включали эффективность и переносимость, т.е. психопатологические проявления, прерывание терапии в связи с неэффективностью и непереносимостью, рецидивы, госпитализации, ремиссии, функционирование, качество жизни и нежелательные явления. С помощью моделей со случайными эффектами были рассчитаны объединенный относительный риск и стандартизованная разность средних. В 59 исследованиях (N=45787), длящихся 47,4±32,1 недели (диапазон 24-186), не было выявлено последовательного превосходства каких-либо АВП по эффективности и переносимости. Что касается прерывания терапии по любым причинам, клозапин, оланзапин и рисперидон значительно (p<0,05) превосходили несколько других АВП, в то время как кветиапин уступал нескольким другим АВП. В отношении психопатологических проявлений клозапин и оланзапин превосходили несколько других АВП, в то время как кветиапин и зипрасидон уступали нескольким другим АВП. Данные по другим результатам эффективности были скудными. В отношении прекращения приема препаратов вследствие непереносимости, рисперидон превосходил, а клозапин уступал нескольким другим АВП. По показателю увеличения массы тела оланзапин был хуже в сравнении со всеми АВП, кроме клозапина, и рисперидон был достоверно хуже, чем несколько других АВП. Что касается увеличения уровня пролактина, рисперидон и амисульприд были значительно хуже, чем несколько других АВП. В отношении паркинсонизма оланзапин превосходил рисперидон, без существенных различий по акатизии. Что касается седации и сонливости, клозапин и кветиапин были значительно хуже, чем некоторые другие АВП. Таким образом, определены различные долгосрочные модели эффективности и переносимости АВП. Долгосрочные профили рисков и преимуществ конкретных АВП должны быть использованы в индивидуальном подходе к пациентам для оптимизации результатов поддерживающего лечения.
Ключевые слова: антипсихотики второго поколения, поддерживающая терапия, рандомизированные контролируемые исследования, прерывание терапии, эффективность, переносимость, клозапин, оланзапин, рисперидон.
Шизофрения – психическое расстройство, течение которого обычно характеризуется неоднократными рецидивами, а также ухудшением психопатологической симптоматики и социального функционирования, что требует поддерживающей терапии1-3. Антипсихотики эффективны для профилактики рецидивов у пациентов, как с хроническим течением, так и первым эпизодом4,5, снижая риск рецидива в 2-6 раз по сравнению с отсутствием лечения антипсихотиками2,4-6.
Предыдущий метаанализ нашей группы был посвящен сравнению антипсихотиков второго поколения (АВП) с антипсихотиками первого поколения (АПП), где было выявлено, что первые как класс превосходят последние
в отношении профилактики рецидивов, прерывания терапии по всем причинам и других связанных с рецидивом исходов3.
Несмотря на важное значение долгосрочного лечения при шизофрении, при котором показатели преимуществ и рисков лекарственных препаратов могут отличаться от таковых при купирующей терапии, в настоящее время не существует комплексного метаанализа сравнительной долгосрочной эффективности и безопасности пероральных АВП7.
Хотя в одном метаанализе исследований поддерживающей терапии сравнивались антипсихотики с плацебо2, косвенные сравнения с использованием плацебо в качестве общего компаратора не являются окончательными8. Кроме того, метаанализ множества видов лечения, который включает косвенные сравнения, необязательно идеален, особенно когда количество исследований, сравнивающих антипсихотики напрямую, ограничено и когда однородность этих исследований не может быть гарантирована9.
Знания о сравнительной эффективности и переносимости АВП при длительном лечении шизофрении имеют важное значение7. В частности, различия в риске побочных эффектов9-11, некоторые могут усиливаться со временем, необходимо сопоставлять с потенциальными различиями в долгосрочной эффективности.
Здесь мы сообщаем о результатах первого комплексного метаанализа рандомизированных контролируемых исследований, сравнивающих два или более АВП напрямую (head-to-head) при долгосрочном лечении шизофрении, с целью оценки сравнительной эффективности и безопасности этих препаратов.
Методы
Метаанализ был проведен согласно рекомендациям PRISMA12.Поиск и критерии включения
Поиск был произведен без ограничений по языку по базам: MEDLINE/PubMed, Cochrane library, ISI Web of Science, PsycINFO, CINAHL и US National Institutes of Health clinical trials registry (http://www.clinicaltrials.gov). Следующие поисковые термины были использованы: antipsychotic(s); neuroleptic(s); названия АВП; schizophrenia; random, randomly, randomized; и maintenance, relapse, discontinuation или long-term. Последний поиск был выполнен 29 октября 2018 года. После поиска по базам данных был произведен ручной поиск по библиографиям соответствующих исследований и обзоров. С авторами и компаниями связывались для предоставления недостающей информации и неопубликованных данных.
Мы включили рандомизированные, прямые (head-to-head) сравнительные исследования оральных форм АВП у взрослых с шизофренией или шизоаффективным расстройством, в которых сообщалось о прерывании терапии, о времени рандомизации (во время купирующей или поддерживающей фазы). Поскольку мы стремились сосредоточить внимание на сравнительной долгосрочной эффективности АВП, мы включали только исследования head-to-head продолжительностью ≥6 месяцев.
Мы исключили исследования, в которых было >20% пациентов без диагноза «шизофрения/шизоаффективное расстройство». Учитывая, что пролонгированные инъекционные формы улучшают приверженность терапии и тем самым влияют на долгосрочные исходы13,14, мы исключили исследования пролонгированных антипсихотиков.
Поиск, отбор литературы и извлечение данных проводились независимо ≥2 рецензентами (KH, MN, TK, CC). Разногласия разрешались на основе консенсуса.
Показатели результатов
Первичным результатом было прекращение приема терапии по всем причинам к концу исследования.Вторичные результаты включали: а) изменение баллов психопатологической симптоматики по шкалам Positive and Negative Syndrome Scale (PANSS), Brief Psychiatric Rating Scale (BPRS) или Clinical Global Impression – Severity (CGI-S) (смешанные модели или данные последнего проведенного наблюдения были в приоритете над анализом наблюдаемых случаев); б) прекращение терапии в связи с неэффективностью (по информации авторов оригинальных исследований); в) прекращение терапии в связи с непереносимостью (по информации авторов оригинальных исследований); г) рецидивы (по информации авторов оригинальных исследований); д) госпитализации; е) ремиссии (по информации авторов оригинальных исследований); ж) оценку функционирования; з) качество жизни; и) нежелательные явления.
Нежелательные явления включали: повышение массы тела (как изменение от исходного или соотношение пациентов с клинически значимым увеличением); увеличение уровня пролактина (как изменение от исходного или соотношение пациентов с гиперпролактинемией); двигательные побочные эффекты, включая паркинсонизм (который оценивали по шкале Simpson-Angus Rating Scale или применению холинолитических препаратов), акатизию и дискинезию; седацию и/или сонливость.
Анализ данных
АВП сравнивались отдельно для каждого показателя. Мы применили «once-randomized-analyzed» intent-to-treat (ITT) анализ в конечной точке. В исследованиях, которые оценивали пациентов даже после того, как они прекращали принимать первоначально назначенное лекарство в течение периода исследования, мы проанализировали первичный результат, основанный только на первом лекарстве, но для вторичных результатов мы извлекли и проанализировали данные по выборке ITT.С помощью моделей случайных эффектов15 были рассчитаны объединенный относительный риск (ОР) и стандартизованная разность средних (СРС) с 95% доверительными интервалами (ДИ). Значения ОР<1 указывают на превосходство первого АВП по отрицательным результатам (таким как прекращение приема терапии по всем причинам, рецидив, прекращение приема терапии в связи с неэффективностью и непереносимостью), в то время как значения ОР >1 указывают на превосходство по единственному положительному результату – ремиссии. Для простоты мы скорректировали размеры эффекта, так что СРС<0 указывает на превосходство первого АВП, независимо от того, является ли более низкое значение (например, психопатологической симптоматики) или более высокое значение (например, функционирования, качества жизни) положительным результатом.
Число больных, которых необходимо лечить (ЧБНЛ), вычислялось, когда различия по категорийным результатам были значительными. Гетерогенность изучалась только при анализе ≥2 исследований с использованием критерия хи-квадрат (p<0,1 указывает на статистически значимую гетерогенность)16 и статистики I2 (I2≥50% указывает на статистически значимую гетерогенность)17. Для оценки качества исследования мы использовали шкалу Jadad18, которая дает суммарный балл для анализа чувствительности.
Кроме того, были проведены анализы подгрупп по первичному результату (при наличии ≥2 исследований), направленные на выявление потенциальных модераторов, методологических систематических ошибок и на возможность обобщения результатов на клинически релевантные субпопуляции или экспериментальные группы. В анализ подгрупп были включены: а) рандомизация по моменту времени (острая фаза или фаза поддерживающей терапии); б) финансовая поддержка (спонсоры конкретных препаратов или научные учреждения в качестве спонсора); в) качество исследования (высокое или низкое по баллу шкалы Jadad)18; г) ослепление (открытое, или простое слепое, или двойное слепое); д) местонахождение (международное/ США/Европа/Азия); е) дозировка (фиксированная или изменяющаяся); ж) первый эпизод расстройства или хронический пациент.
Программное обеспечение Comprehensive Meta-Analysis, версия 3 (Biostat, NJ, США), использовалось для проведения всех двусторонних анализов с альфа=0,05 без корректировок для множественных сравнений. Систематические ошибки публикации оценивались с помощью воронкообразного графика, регрессионного теста Egger’а19 и метода «trim and fill»20 для первичного результата при анализе ≥3 исследований.
Результаты
Поиск и характеристики исследований
В общей сложности 8611 исследований было выявлено (рис. 1). После удаления 152 дубликатов мы исключили 7823 из оставшихся 8459 ссылок, основываясь на прочтении названий/резюме. После прочтения полнотекстовых вариантов 113 оставшихся статей 54 были исключены по причинам: неподходящие участники исследований (N=17), обзор/редакционная статья (N=11), отсутствие пригодных для использования данных (N=10), неподходящее лечение (N=6), краткосрочные исследования (N=4), отсутствие/ неадекватная рандомизация (N=3), и абстракты исследований для конференций, которые уже были включены (N=3).
В целом, мы включили 63 статьи21-83 (59 рандомизированных исследований) с 45 787 участниками (медиана: 255 участников/исследование, диапазон: от 12 до 18 154) (таблица 1). Средний возраст участников составил 37,6±7,0 года; 62,1±13,3% были мужского пола и 61,1±28,8% – белые. Средняя продолжительность исследований составила 47,4±32,1 недели (диапазон: 24-186).
Сорок шесть исследований включали пациентов с несколькими эпизодами, восемь – исключительно пациентов с первым эпизодом, четыре – исключительно резистентных к лечению пациентов (все изучали клозапин), и в одном не сообщалось о количестве эпизодов у включенных пациентов79. Тридцать четыре исследования были двойными слепыми, 20 – открытыми, а в пяти были «слепые» рейтеры. Сорок исследований были спонсированы фармацевтическими компаниями, 18 финансировались государством, и в одном был неясен вопрос финансирования77.
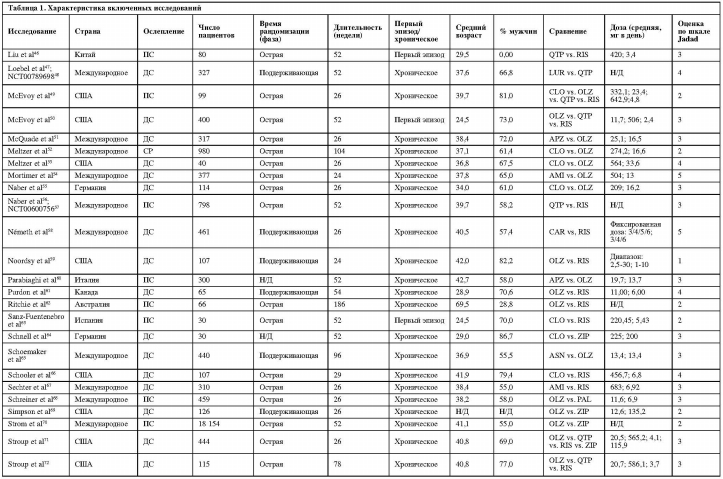
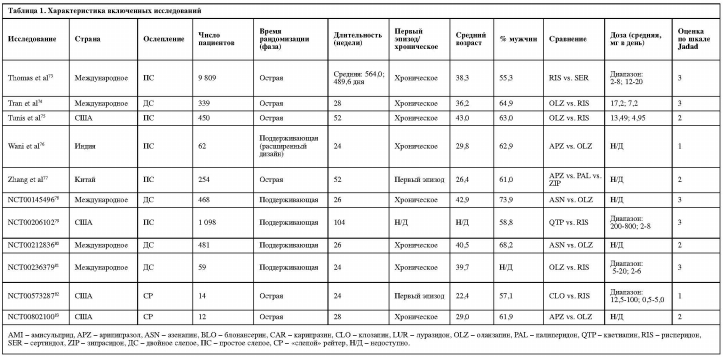
Количество исследований с каждым отдельным АВП составило: оланзапин – 43, рисперидон – 27, кветиапин – 15, зипрасидон – 12, арипипразол – 12, клозапин – 8, амисульприд – 4, асенапин – 4, луразидон – 2, палиперидон – 2, блонансерин – 1, карипразин – 1 и сертиндол – 1.
В 39 (66,1%) исследованиях пациенты были рандомизированы в острой фазе, в восемнадцати (30,5%) – в фазе поддерживающей терапии, для двух исследований время рандомизации неизвестно (3,4%)60,64. В двух исследованиях33,76 согласно дизайну пациенты, стабилизированные на препарате А, были рандомизированы для продолжения лечения или смены препарата на препарат В. В двух исследованиях70,75 был «натуралистический» дизайн, при котором возможна смена изначально назначенного препарата.
В одиннадцати исследованиях сообщалось о рецидивах и в шести – о ремиссиях в качестве результатов. Определение рецидива было различным и совпадало только в двух исследованиях28,47. В трех из шести исследований, содержащих информацию о ремиссии, использовались критерии Andreasen и соавт.84.



Первичный результат: прерывание терапии по всем причинам
Показатели объединенного размера эффекта пар АВП относительно прерывания терапии по всем причинам среди 59 исследований показаны на рис. 2.Показатели прерывания терапии по всем причинам у клозапина были значительно ниже в сравнении с кветиапином (одно исследование, N=64, ОР=0,59, 95% ДИ: 0,42-0,83, p=0,002) и рисперидоном (четыре исследования, N=216, ОР=0,74, 95% ДИ: 0,57-0,95, p=0,020, I2=5,1%). Указанные показатели для оланзапина были значительно ниже по сравнению с палиперидоном (одно исследование, N=459, ОР=0,64, 95% ДИ: 0,46-0,90, р=0,010), кветиапином (восемь исследований, N=1942, ОР=0,79, 95% ДИ: 0,71-0,89, р<0,001, I2=55,8%), рисперидоном (16 исследований, N=3131, ОР=0,88, 95% ДИ: 0,83-0,93, р<0,001, I2=0,0%) и зипрасидоном (восемь исследований, N=20 225, ОР=0,82, 95% ДИ: 0,77-0,87, р<0,001, I2=37,0%). Показатели рисперидона по прерыванию терапии по всем причинам были значительно ниже по сравнению с сертиндолом (одно исследование, N=9809, ОР=0,83, 95% ДИ: 0,80-0,86, р<0,001) и зипрасидоном (три исследования, N=906, ОР=0,90, 95% ДИ: 0,83-0,98, р=0,012, I2=0,0%).
Другие достоверные различия включают в себя: значительно более низкие показатели прерывания терапии по всем причинам у амисульприда в сравнении с кветиапином (одно исследование, N=208, ОР=0,63, 95% ДИ: 0,44-0,89, р=0,009); значительно более высокие показатели прерывания терапии для а) арипипразола в сравнении с оланзапином (восемь исследований, N=2117, ОР=1,17; 95% ДИ: 1,05-1,30, р=0,006, I2=28,8%); б) луразидона в сравнении с рисперидоном (одно исследование, N=629, ОР=1,17; 95% ДИ: 1,02-1,35, р=0,027); и в) кветиапина в сравнении с зипрасидоном (четыре исследования, N=1064, ОР=1,12, 95% ДИ: 1,01-1,25, p=0,031, I2=47,0%).


Вторичные результаты
Среди сравнений 23 АВП в отношении психопатологической симптоматики, основанных на 32 исследованиях, выявлены девять существенных различий: арипипразол превосходил кветиапин и зипрасидон; клозапин превосходил кветиапин и рисперидон; луразидон превосходил кветиапин; оланзапин превосходил палиперидон и рисперидон; и палиперидон превосходил арипипразол и зипрасидон (рис. 3).Среди 23 сравнений в отношении прерывания терапии в связи с непереносимостью на основании 50 исследований, выявлены следующие достоверные различия: кветиапин превосходил амисульприд; рисперидон превосходил клозапин, кветиапин и сертиндол; и зипразидон превосходил клозапин (рис. 4).
В 20 сравнениях, касающихся прерывания терапии в связи с неэффективностью, на основе 47 исследований были выявлены следующие существенные различия: арипипразол превосходил кветиапин; клозапин превосходил рисперидон; луразидон превосходил кветиапин; и оланзапин превосходил арипипразол, кветиапин и зипразидон (рис. 5).
В 11 сравнениях, касающихся рецидива, выявлено только одно существенное различие: превосходство оланзапина над рисперидоном. В 13 сравнениях, относительно госпитализации, клозапин превосходил оланзапин, а луразидон и рисперидон превосходили кветиапин. В шести сравнениях, содержащих информацию о ремиссии, луразидон превосходил кветиапин, а кветиапин превосходил рисперидон. Среди 12 сравнений в отношении функционирования арипипразол превосходил кветиапин, карипразин превосходил рисперидон, а клозапин превосходил оланзапин. В 11 сравнениях, касающихся качества жизни, не было достоверных различий между парами АВП.
25 сравнений, основанных на 46 исследованиях, были исследованы методами метаанализа в отношении увеличения массы тела. Амисульприд, арипипразол, кветиапин, рисперидон, палиперидон и зипрасидон превосходили оланзапин; амисульприд, карипразин, луразидон и зипрасидон превосходили рисперидон; палиперидон превосходил арипипразол; и зипрасидон превосходил палиперидон и кветиапин (таблица 2).




Увеличение уровня пролактина было исследовано в метаанализе 16 сравнений, основанных на 21 исследовании. Клозапин, луразидон, оланзапин, кветиапин и зипрасидон превосходили рисперидон; арипипразол и кветиапин превосходили оланзапин; оланзапин, кветиапин и зипразидон превосходили амисульприд (таблица 2).
Паркинсонизм был исследован в метаанализе 20 сравнений, основанных на 28 исследованиях: оланзапин превосходил рисперидон. Дискинезия была исследована в
11 сравнениях на основе 13 исследований: зипрасидон превосходил кветиапин. Акатизия – в 11 сравнениях на основе 9 исследований: без существенных различий. Седация и/или сонливость – в 17 сравнениях, основанных на 27 исследованиях: оланзапин и палиперидон превосходили клозапин, а рисперидон превосходил кветиапин.






Анализ подгрупп по первичному результату
В результате анализа подгрупп значимость первичных результатов была изменена в 49/267 (18,4%) случаев, но большинство подгрупп были очень малы как по количеству исследований, так и по количеству пациентов. Паттерны сравнительной эффективности были согласованными в исследованиях высокого качества и двойных слепых исследованиях.Что касается финансирования, то результаты, указывающие на более низкое положение конкретного препарата, были нейтрализованы при включении трех из 43 исследований, спонсируемых производителями лекарств. Напротив, один результат, показывающий превосходство оланзапина, был нейтрализован, при включении одного исследования, финансируемого производителем.
Что касается ослепления, некоторые результаты изменялись, когда мы ограничивали анализы открытыми или слепыми исследованиями. Ограничив анализ только слепыми исследованиями, 5/39 результатов, которые были статистически значимыми, стали недостоверными. Ограничивая анализ только открытыми исследованиями, 1/39 недостоверных результатов стал статистически значимым.
Ни один из других потенциальных модераторов, рассмотренных при анализе подгрупп, не оказывал отчетливого эффекта. Ни в одном из анализов подгрупп направленность результатов не менялась.
Систематические ошибки публикации
Систематические ошибки публикации по показателю прерывания терапии по всем причинам оценивались с помощью воронкообразного графика. В девяти из одиннад-цати сравнений с ≥3 исследованиями воронкообразный график был асимметричным. Впоследствии мы применили метод «trim-and-fill» для корректировки потенциальных систематических ошибок публикации и обнаружили, что размеры эффекта были аналогичны после корректировки и что достоверность ОР не изменилась, за исключением двух сравнений. Кветиапин не отличался по наблюдаемым значениям, но уступал рисперидону по скорректированным значениям (исходный ОР=1,07, 95% ДИ: 0,98-1,18; скорректированный ОР=1,11, 95% ДИ: 1,00-1,24). Кветиапин достоверно уступал по наблюдаемым значениям, но не отличался от зипрасидона по скорректированным значениям (исходный ОР=1,12, 95% ДИ: 1,01-1,25; скорректированный ОР=1,08, 95% ДИ: 0,98-1,19).Обсуждение
В этом первом комплексном метаанализе сравнительной эффективности и переносимости АВП при долгосрочном лечении шизофрении, включающем 59 исследований и 45 787 участников, не наблюдалось отчетливого превосходства какого-либо одного антипсихотика по нескольким результатам.
В отношении прерывания терапии по всем причинам клозапин, оланзапин и рисперидон превосходили несколько других АВП, в то время как кветиапин уступал нескольким другим АВП. Что касается психопатологической симптоматики, то клозапин и оланзапин превосходили несколько других АВП, в то время как кветиапин, а также зипрасидон уступали нескольким другим АВП. В отношении функционирования, качества жизни и ремиссии данные были скудными.
Относительно прерывания терапии в связи с непереносимостью, рисперидон превосходил, а клозапин уступал нескольким другим АВП. Однако следует иметь в виду, что прекращение лечения в связи с нежелательными явлениями в современных исследованиях часто включает в себя нежелательные явления, связанные с неэффективностью, и поэтому этот результат не отражает исключительно переносимость.
При делении на отдельные побочные эффекты паттерны преимуществ/недостатков стали более ясными в некоторых случаях. Например, оланзапин связан с увеличением массы тела больше, чем все другие АВП, кроме клозапина, в то время как зипрасидон меньше, чем другие АВП; амисульприд и рисперидон повышают уровень пролактина в крови больше, чем другие АВП. Кроме того, седация и/или сонливость чаще наблюдаются при длительном лечении клозапином и кветиапином.
Мы сосредоточились на прямых сравнениях для текущего метаанализа. Относительный недостаток прямых сравнений поддерживающей терапии может вызвать интерес к проведению сетевого метаанализа. Однако, хотя такая методология с использованием непрямых сравнений может привести к ранжированию, отсутствие большого числа сравнений и неоднородность исследований, проводимых в различных популяциях и на протяжении нескольких десятилетий, вероятно, приведут к появлению систематических ошибок, которых нет в метаанализе прямых «head to head» исследований9.
Сравнивая наши результаты с результатами Zhao и соавт.85, которые провели сетевой метаанализ исследований по профилактике рецидивов у стабильных пациентов с шизофренией, где в качестве терапии также включали антипсихотики первого поколения и пролонгированные формы, появляются некоторые различия. Например, единственным достоверным результатом для предотвращения рецидива, связанным с АВП, было превосходство оланзапина над хлорпромазином и галоперидолом, в то время как мы обнаружили, что оланзапин превосходит рисперидон (хотя на основе только одного исследования). Кроме того, в отношении прерывания терапии по всем причинам мы наблюдали значительное превосходство оланзапина над арипипразолом, палиперидоном, кветиапином, рисперидоном и зипрасидоном в прямых сравнениях, в то время как Zhao и соавт., используя косвенные сравнения, обнаружили, что оланзапин превосходит только арипипразол. Таким образом, мы считаем, что ограничение метаанализа исключительно рандомизированными прямыми (head-to-head) сравнениями дает более точные результаты.
Каково применение наших выводов для выбора АВП при долгосрочном лечении шизофрении? Во-первых, мы должны рассмотреть величину размеров эффекта по прерыванию терапии по всем причинам. Поскольку они варьировались от средних до больших, мы считаем, что они клинически значимы, особенно во время фазы поддерживающей терапии2,7,86,87. Результаты, касающиеся психопатологической симптоматики, примерно совпадали с результатами по прерыванию терапии по всем причинам, в том, что клозапин и оланзапин превосходили несколько других АВП, в то время как кветиапин несколько уступал, но в этом случае вместе с зипразидоном. Тем не менее, результаты по различным побочным эффектам, с определенными недостатками у клозапина, оланзапина и рисперидона, подчеркивают тот факт, что крайне важно не рассматривать эффективность в отрыве от переносимости. Например, клозапин и оланзапин относятся к числу препаратов с некоторыми наиболее проблематичными побочными эффектами, такими как увеличение массы тела и метаболические нарушения10,88, а также, в случае клозапина, изменениями в клеточном составе крови89. Учитывая такие противоречивые результаты в различных категориях результатов, следует подчеркнуть важность сбалансированного выбора препарата с индивидуальным подходом для каждого пациента.
Мы выявили сходные результаты поддерживающей терапии при шизофрении в отношении сравнительной эффективности клозапина и оланзапина. Даже в исследованиях, нацеленных на лечение резистентных пациентов, размеры эффекта были одинаковыми. Поскольку сетевой метаанализ краткосрочных исследований пациентов с резистентностью не выявил превосходства клозапина по сравнению с оланзапином, рисперидоном и зипрасидоном90, что могло быть обусловлено использованием субоптимальных доз клозапина или включением нерезистентных пациентов, необходимы дальнейшие высококачественные, краткосрочные и долгосрочные, прямые исследования клозапина с другими АВП.
Необходимо рассмотреть несколько ограничений этого исследования. Большинство сравнений основывалось на относительно небольшом числе прямых исследований. Из всех 250 сравнений 139 были основаны только на одном исследовании, но мы проводили метаанализ только для результатов, по которым имелись данные по крайней мере в двух прямых исследованиях. Количество пациентов на одно исследование также часто было небольшим, и эквивалентные дозы, использованные в исследованиях, возможно, не были сбалансированными или соответствующими. Кроме того, ограниченное число исследований уменьшило мощность анализа подгрупп. Также только в шести и одиннадцати исследованиях сообщалось о ремиссии и рецидиве в качестве результата соответственно. Однако, поскольку психопатологическая симптоматика, ответ на лечение и функционирование могут ухудшаться при повторных рецидивах87,91, информация о ремиссии и риске рецидива при применении отдельных антипсихотиков важна.
Время рандомизации во включенных исследованиях отличалось, т.е. некоторые исследования рандомизировали пациентов во время острой фазы, а другие – во время фазы поддерживающей терапии. Более того, некоторые исследования включали исключительно резистентных к терапии пациентов, в то время как некоторые другие включали исключительно пациентов с первым эпизодом. Определения рецидива и ремиссии различались в разных исследованиях. Кроме того, два из включенных исследований имели расширенный дизайн и в двух была возможна смена терапии после рандомизации, что могло повлиять на результаты. Такая неоднородность дизайна исследований, а также выборок пациентов создают риск появления систематических ошибок. Однако мы оценили влияние характеристик пациентов и дизайна исследований в качестве потенциальных модераторов, проведя анализ подгрупп.
Наконец, хотя эффективность инъекционных антипсихотиков длительного действия (ИАДД) при длительном лечении шизофрении явно важна92, мы исключили исследования ИАДД, поскольку этот аспект уже был всесторонне изучен в метаанализах13,14,93. Включение ИАДД, которые доступны не для всех АВП, в этот метаанализ, привело бы к еще большей неоднородности выборок и методов, сложности анализа и интерпретации результатов.
В заключение следует отметить, что результаты этого метаанализа свидетельствуют о наличии некоторых существенных различий в эффективности и переносимости АВП при поддерживающей терапии шизофрении. Клозапин, оланзапин и рисперидон, по-видимому, превосходят несколько других АВП в отношении прерывания терапии по всем причинам, в то время как кветиапин уступает. Что касается оценки психопатологической симптоматики, клозапин и оланзапин, по-видимому, превосходят несколько других АВП, в то время как кветиапин и зипразидон менее эффективны. В отношении прерывания терапии из-за побочных эффектов только рисперидон превосходит и только клозапин уступает ряду других АВП.
Из-за ограниченного числа прямых исследований сравнительная эффективность некоторых АВП неясна, и результаты должны интерпретироваться с осторожностью, так как они основываются на небольшом числе исследований. Таким образом, для дальнейшего развития доказательной долгосрочной терапии пациентов с шизофренией желательно иметь большую базу данных, включающую в себя многие АВП с детализированными результатами по эффективности и переносимости. В частности, выявление предикторов благоприятных результатов при применении определенных антипсихотиков даст возможность персонализировать лечение.
Благодарности
Эта работа выполнена при поддержке The Zucker Hillside Hospital Advanced Center for Intervention and Services Research for the Study of Schizophrenia grant (MH090590) от US National Institute of Mental Health. Спонсор не имел влияния на дизайн, сбор данных, анализ данных, интерпретацию данных или написание статьи. Авторы благодарны A. Seidman и O. Uzoma за помощь в поиске литературы и абстракции данных. T. Kishimoto и K. Hagi внесли равный вклад в эту работу.
DOI: 10.1002/wps.20632
Список исп. литературыСкрыть список1. Kahn RS, Sommer IE, Murray RM et al. Schizophrenia. Nat Rev Dis Primers 2015;1:15067.
2. Leucht S, Tardy M, Komossa K et al. Antipsychotic drugs versus placebo for relapse prevention in schizophrenia: a systematic review and meta-analysis. Lancet 2012;379:2063-71.
3. Kishimoto T, Agarwal V, Kishi T et al. Relapse prevention in schizophrenia: a systematic review and meta-analysis of second-generation antipsychotics versus first-generation antipsychotics. Mol Psychiatry 2013;18:53-66.
4. Robinson D, Woerner MG, Alvir JM et al. Predictors of relapse following response from a first episode of schizophrenia or schizoaffective disorder. Arch Gen Psychiatry 1999;56:241-7.
5. Leucht S, Barnes TR, Kissling W et al. Relapse prevention in schizophrenia with new-generation antipsychotics: a systematic review and exploratory meta-analysis of randomized, controlled trials. Am J Psychiatry 2003;160:1209-22.
6. Leucht S, Arbter D, Engel RR et al. How effective are second-generation antipsychotic drugs? A meta-analysis of placebo-controlled trials. Mol Psychiatry 2009;14:429-47.
7. Glick ID, Correll CU, Altamura AC et al. Mid-term and long-term efficacy and effectiveness of antipsychotic medications for schizophrenia: a data-driven, personalized clinical approach. J Clin Psychiatry 2011;72:1616-27.
8. Higgins JPT, Green S. Cochrane handbook for systematic reviews of interventions, version 5.1.0. Chichester: Wiley, 2011.
9. Correll CU, De Hert M. Antipsychotics for acute schizophrenia: making choices. Lancet 2013;382:919-20.
10. De Hert M, Detraux J, van Winkel R et al. Metabolic and cardiovascular adverse effects associated with antipsychotic drugs. Nat Rev Endocrinol 2012;8:114-26.
11. Leucht S, Cipriani A, Spineli L et al. Comparative efficacy and tolerability of 15 antipsychotic drugs in schizophrenia: a multiple-treatments meta-analysis. Lancet 2013;382:951-62.
12. Moher D, Liberati A, Tetzlaff J et al. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. PLoS Med 2009;6:e1000097.
13. Kishimoto T, Nitta M, Borenstein M et al. Long-acting injectable vs. oral antipsychotics in schizophrenia: a systematic review and meta-analysis of mirror-image studies. J Clin Psychiatry 2013;74:957-65.
14. Kishimoto T, Hagi K, Nitta M et al. Effectiveness of long-acting injectable vs oral antipsychotics in patients with schizophrenia: a meta-analysis of prospective and retrospective cohort studies. Schizophr Bull 2018;44:603-19.
15. DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials 1986;7:177-88.
16. Dickersin K, Berlin JA. Meta-analysis: state-of-the-science. Epidemiol Rev 1992;14:154-76.
17. Higgins JP, Thompson SG, Deeks JJ et al. Measuring inconsistency in meta-analyses. BMJ 2003;327:557-60.
18. Jadad AR, Moore RA, Carroll D et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials 1996;17:1-12.
19. Egger M, Davey Smith G, Schneider M et al. Bias in meta-analysis detected by a simple, graphical test. BMJ 1997;315:629-34.
20. Duval S, Tweedie R. A Nonparametric “trim and fill” method of accounting for publication bias in meta-analysis. J Am Statist Assoc 2000;95:89-98.
21. Addington DE, Labelle A, Kulkarni J et al. A comparison of ziprasidone and risperidone in the long-term treatment of schizophrenia: a 44-week, double-blind, continuation study. Can J Psychiatry 2009;54:46-54.
22. Alvarez E, Bernardo M, Gutiérrez-Casares JR et al. Ziprasidone versus olanzapine in the weight gain associated with the treatment of schizophrenia: a six-month double-blind randomized parallel group study. Eur J Psychiatry 2012;26:248-59.
23. Alvarez E, Ciudad A, Olivares JM et al. A randomized, 1-year follow-up study of olanzapine and risperidone in the treatment of negative symptoms in outpatients with schizophrenia. J Clin Psychopharmacol 2006;26:238-49.
24. Ciudad A, Olivares JM, Bousono M et al. Improvement in social functioning in outpatients with schizophrenia with prominent negative symptoms treated with olanzapine or risperidone in a 1 year randomized, open-label trial. Prog Neuropsychopharmacol Biol Psychiatry 2006;30:1515-22.
25. Breier A, Berg PH, Thakore JH et al. Olanzapine versus ziprasidone: results of a 28-week double-blind study in patients with schizophrenia. Am J Psychiatry 2005;162:1879-87.
26. Chan HY, Chiang SC, Chang CJ et al. A randomized controlled trial of risperidone and olanzapine for schizophrenic patients with neuroleptic-induced tardive dyskinesia. J Clin Psychiatry 2010;71:1226-33.
27. Chrzanowski WK, Marcus RN, Torbeyns A et al. Effectiveness of long-term aripiprazole therapy in patients with acutely relapsing or chronic, stable schizophrenia: a 52-week, open-label comparison with olanzapine. Psychopharmacology 2006;189:259-66.
28. Citrome L, Cucchiaro J, Sarma K et al. Long-term safety and tolerability of lurasidone in schizophrenia: a 12-month, double-blind, active-controlled study. Int Clin Psychopharmacol 2012;27:165-76.
29. Crespo-Facorro B, Ortiz-Garcia de la Foz V, Mata I et al. Treatment of first-episode non-affective psychosis: a randomized comparison of aripiprazole, quetiapine and ziprasidone over 1 year. Psychopharmacology 2014;231:357-66.
30. Crespo-Facorro B, Pérez-Iglesias R, Mata I et al. Long-term (3-year) effectiveness of haloperidol, risperidone and olanzapine: results of a randomized, flexible-dose, open-label comparison in first-episode nonaffective psychosis. Psychopharmacology 2012;219:225-33.
31. de Arce Cordon R, Eding E, Marques-Teixeira J et al. Descriptive analyses of the aripiprazole arm in the risperidone long-acting injectable versus quetiapine relapse prevention trial (ConstaTRE). Eur Arch Psychiatry Clin Neurosci 2012;262:139-49.
32. Gaebel W, Schreiner A, Bergmans P et al. Relapse prevention in schizophrenia and schizoaffective disorder with risperidone long-acting injectable vs quetiapine: results of a long-term, open-label, randomized clinical trial. Neuropsychopharmacology 2010;35:2367-77.
33. Deberdt W, Lipkovich I, Heinloth AN et al. Double-blind, randomized trial comparing efficacy and safety of continuing olanzapine versus switching to quetiapine in overweight or obese patients with schizophrenia or schizoaffective disorder. Ther Clin Risk Manag 2008;4:713-20.
34. Durgam S, Landbloom RP, Mackle M et al. Exploring the long-term safety of asenapine in adults with schizophrenia in a double-blind, fixed-dose, extension study. Neuropsychiatr Dis Treat 2017;13:2021-35.
35. Fleischhacker WW, McQuade RD, Marcus RN et al. A double-blind, randomized comparative study of aripiprazole and olanzapine in patients with schizophrenia. Biol Psychiatry 2009;65:510-7.
36. Kahn R, Fleischhacker WW, Boter H et al. Effectiveness of antipsychotic drugs in first-episode schizophrenia and schizophreniform disorder: an open randomised clinical trial. Lancet 2008;371:1085-97.
37. Kane JM, Osuntokun O, Kryzhanovskaya LA et al. A 28-week, randomized, double-blind study of olanzapine versus aripiprazole in the treatment of schizophrenia. J Clin Psychiatry 2009;70:572-81.
38. Keefe RS, Young CA, Rock SL et al. One-year double-blind study of the neurocognitive efficacy of olanzapine, risperidone, and haloperidol in schizophrenia. Schizophr Res 2006;81:1-15.
39. Kern RS, Green MF, Cornblatt BA et al. The neurocognitive effects of aripiprazole: an open-label comparison with olanzapine. Psychopharmacology 2006;187:312-20.
40. Kinon BJ, Noordsy DL, Liu-Seifert H et al. Randomized, double-blind 6-month comparison of olanzapine and quetiapine in patients with schizophrenia or schizoaffective disorder with prominent negative symptoms and poor functioning. J Clin Psychopharmacol 2006;26: 453-61.
41. Kinon BJ, Lipkovich I, Edwards SB et al. A 24-week randomized study of olanzapine versus ziprasidone in the treatment of schizophrenia or schizoaffective disorder in patients with prominent depressive symptoms. J Clin Psychopharmacol 2006;26:157-62.
42. Kishi T, Matsuda Y, Matsunaga S et al. A randomized trial of aripiprazole vs blonanserin for the treatment of acute schizophrenia and related disorders. Neuropsychiatr Dis Treat 2016;12:3041-9.
43. Kumar PNS, Anish PK, Rajmohan V. Olanzapine has better efficacy compared to risperidone for treatment of negative symptoms in schizophrenia. Indian J Psychiatry 2016;58:311-6.
44. Lecrubier Y, Quintin P, Bouhassira M et al. The treatment of negative symptoms and deficit states of chronic schizophrenia: olanzapine compared to amisulpride and placebo in a 6-month double-blind controlled clinical trial. Acta Psychiatr Scand 2006;114:319-27.
45. Lieberman JA, Stroup TS, McEvoy JP et al. Effectiveness of antipsychotic drugs in patients with chronic schizophrenia. N Engl J Med 2005;353:1209-23.
46. Liu J, Sun J, Shen X et al. Randomized controlled trial comparing changes in serum prolactin and weight among female patients with first-episode schizophrenia over 12 months of treatment with risperidone or quetiapine. Shanghai Arch Psychiatry 2014;26:88-94.
47. Loebel A, Cucchiaro J, Xu J et al. Effectiveness of lurasidone vs. quetiapine XR for relapse prevention in schizophrenia: a 12-month, double-blind, noninferiority study. Schizophr Res 2013;147:95-102.
48. A phase 3 randomized, double-blind, active comparator-controlled clinical trial to study the safety and efficacy of lurasidone in subjects with schizophrenia (PEARL 3 Extension Study). Clinical Trials.gov identifier NCT00789698.
49. McEvoy JP, Lieberman JA, Stroup TS et al. Effectiveness of clozapine versus olanzapine, quetiapine, and risperidone in patients with chronic schizophrenia who did not respond to prior atypical antipsychotic treatment. Am J Psychiatry 2006;163:600-10.
50. McEvoy JP, Lieberman JA, Perkins DO et al. Efficacy and tolerability of olanzapine, quetiapine, and risperidone in the treatment of early psychosis: a randomized, double-blind 52-week comparison. Am J Psychiatry 2007;164:1050-60.
51. McQuade RD, Stock E, Marcus R et al. A comparison of weight change during treatment with olanzapine or aripiprazole: results from a randomized, double-blind study. J Clin Psychiatry 2004;65(Suppl. 18):47-56.
52. Meltzer HY, Alphs L, Green AI et al. Clozapine treatment for suicidality in schizophrenia: International Suicide Prevention Trial (InterSePT). Arch Gen Psychiatry 2003;60:82-91.
53. Meltzer HY, Bobo WV, Roy A et al. A randomized, double-blind comparison of clozapine and high-dose olanzapine in treatment-resistant patients with schizophrenia. J Clin Psychiatry 2008;69:274-85.
54. Mortimer A, Martin S, Loo H et al. A double-blind, randomized comparative trial of amisulpride versus olanzapine for 6 months in the treatment of schizophrenia. Int Clin Psychopharmacol 2004;19:63-9.
55. Naber D, Riedel M, Klimke A et al. Randomized double blind comparison of olanzapine vs. clozapine on subjective well-being and clinical outcome in patients with schizophrenia. Acta Psychiatr Scand 2005;111:106-15.
56. Naber D, Peuskens J, Schwarzmann N et al. Subjective well-being in schizophrenia: a randomised controlled open-label 12-month non-inferiority study comparing quetiapine XR with risperidone (RECOVER). Eur Neuropsychopharmacol 2013;23:1257-69.
57. A one-year randomized , prospective, parallel, open comparison of subjective well-being in schizophrenic out-patients treated with quetiapine XR (SEROQUEL XR™) or oral risperidone at flexible dose in a naturalistic setting. Clinical Trials.gov identifier NCT00600756.
58. Németh G, Laszlovszky I, Czobor P et al. Cariprazine versus risperidone monotherapy for treatment of predominant negative symptoms in patients with schizophrenia: a randomised, double-blind, controlled trial. Lancet 2017;389:1103-13.
59. Noordsy DL, Glynn SM, Sugar CA et al. Risperidone versus olanzapine among patients with schizophrenia participating in supported employment: eighteen-month outcomes. J Psychiatr Res 2017;95:299-307.
60. Parabiaghi A, Tettamanti M, D’Avanzo B et al. Metabolic syndrome and drug discontinuation in schizophrenia: a randomized trial comparing aripiprazole, olanzapine and haloperidol. Acta Psychiatr Scand 2016;133:63-75.
61. Purdon SE, Jones BD, Stip E et al. Neuropsychological change in early phase schizophrenia during 12 months of treatment with olanzapine, risperidone, or haloperidol. The Canadian Collaborative Group for Research in Schizophrenia. Arch Gen Psychiatry 2000;57:249-58.
62. Ritchie CW, Harrigan S, Mastwyk M et al. Predictors of adherence to atypical antipsychotics (risperidone or olanzapine) in older patients with schizophrenia: an open study of 31/2 years duration. Int J Geriatr Psychiatry 2010;25:411-8.
63. Sanz-Fuentenebro J, Taboada D, Palomo T et al. Randomized trial of clozapine vs. risperidone in treatment-naive first-episode schizophrenia: results after one year. Schizophr Res 2013;149:156-61.
64. Schnell T, Koethe D, Krasnianski A et al. Ziprasidone versus clozapine in the treatment of dually diagnosed (DD) patients with schizophrenia and cannabis use disorders: a randomized study. Am J Addict 2014;23:308-12.
65. Schoemaker J, Stet L, Vrijland P et al. Long-term efficacy and safety of asenapine or olanzapine in patients with schizophrenia or schizoaffective disorder: an extension study. Pharmacopsychiatry 2012;45:196-203.
66. Schooler NR, Marder SR, Chengappa KNR et al. Clozapine and risperidone in moderately refractory schizophrenia: a 6-month randomized double-blind comparison. J Clin Psychiatry 2016;77:628-34.
67. Sechter D, Peuskens J, Fleurot O et al. Amisulpride vs. risperidone in chronic schizophrenia: results of a 6-month double-blind study. Neuropsychopharmacology 2002;27:1071-81.
68. Schreiner A, Niehaus D, Shuriquie NA et al. Metabolic effects of paliperidone extended release versus oral olanzapine in patients with schizophrenia: a prospective, randomized, controlled trial. J Clin Psychopharmacol 2012;32:449-57.
69. Simpson GM, Weiden P, Pigott T et al. Six-month, blinded, multicenter continuation study of ziprasidone versus olanzapine in schizophrenia. Am J Psychiatry 2005;162:1535-8.
70. Strom BL, Eng SM, Faich G et al. Comparative mortality associated with ziprasidone and olanzapine in real-world use among 18,154 patients with schizophrenia: the Ziprasidone Observational Study of Cardiac Outcomes (ZODIAC). Am J Psychiatry 2011;168:193-201.
71. Stroup TS, Lieberman JA, McEvoy JP et al. Effectiveness of olanzapine, quetiapine, risperidone, and ziprasidone in patients with chronic schizophrenia following discontinuation of a previous atypical antipsychotic. Am J Psychiatry 2006;163:611-22.
72. Stroup TS, Lieberman JA, McEvoy JP et al. Effectiveness of olanzapine, quetiapine, and risperidone in patients with chronic schizophrenia after discontinuing perphenazine: a CATIE study. Am J Psychiatry 2007;164:415-27.
73. Thomas SH, Drici MD, Hall GC et al. Safety of sertindole versus risperidone in schizophrenia: principal results of the sertindole cohort prospective study (SCoP). Acta Psychiatr Scand 2010;122:345-55.
74. Tran PV, Hamilton SH, Kuntz AJ et al. Double-blind comparison of olanzapine versus risperidone in the treatment of schizophrenia and other psychotic disorders. J Clin Psychopharmacol 1997;17:407-
18.
75. Tunis SL, Faries DE, Stensland MD et al. An examination of factors affecting persistence with initial antipsychotic treatment in patients with schizophrenia. Curr Med Res Opin 2007;23:97-104.
76. Wani RA, Dar MA, Chandel RK et al. Effects of switching from olanzapine to aripiprazole on the metabolic profiles of patients with schizophrenia and metabolic syndrome: a double-blind, randomized, open-label study. Neuropsychiatr Dis Treat 2015;11:685-93.
77. Zhang Y, Dai G. Efficacy and metabolic influence of paliperidone ER, aripiprazole and ziprasidone to patients with first-episode schizophrenia through 52 weeks follow-up in China. Hum Psychopharmacol 2012;27:605-14.
78. A multicenter, double-blind, flexible-dose, 6-month trial comparing the efficacy and safety of asenapine with olanzapine in stable subjects with predominant, persistent negative symptoms of schizophrenia. Clinical Trials.gov identifier NCT00145496.
79. A multicenter, open label, flexible-dose, parallel-group evaluation of the cataractogenic potential of quetiapine fumarate (Seroquel) and risperidone (Risperdal) in the long term treatment of participants with schizophrenia or schizoaffective disorder. Clinical Trials.gov identifier NCT00206102.
80. Efficacy and safety of asenapine compared with olanzapine in patients with persistent negative symptoms of schizophrenia (25543) (P05817). Clinical Trials.gov identifier NCT00212836.
81. A six-month, double-blind, randomized, international, multicenter trial to evaluate the glucoregulatory effects of risperidone and olanzapine in subjects with schizophrenia or schizoaffective disorder. Clinical Trials.gov identifier NCT00236379.
82. Clozapine vs. risperidone for people with first episode schizophrenia and co-occurring substance use disorder. Clinical Trials.gov identifier NCT00573287.
83. Comparison of Optimal Antipsychotic Treatments for Adults With Schizophrenia (COATS). Clinical Trials.gov identifier NCT00802100.
84. Andreasen NC, Carpenter WTJr, Kane JM et al. Remission in schizophrenia: proposed criteria and rationale for consensus. Am J Psychiatry 2005;162:441-9.
85. Zhao YJ, Lin L, Teng M et al. Long-term antipsychotic treatment in schizophrenia: systematic review and network meta-analysis of randomised controlled trials. BJPsych Open 2016;2:59-66.
86. Kane JM, Correll CU. Past and present progress in the pharmacologic treatment of schizophrenia. J Clin Psychiatry 2010;79:1115-24.
87. Carbon M, Correll CU. Clinical predictors of therapeutic response to antipsychotics in schizophrenia. Dialogues Clin Neurosci 2014;16:505-24.
88. Nielsen J, Skadhede S, Correll CU. Antipsychotics associated with the development of type 2 diabetes in antipsychotic-naive schizophrenia patients. Neuropsychopharmacology 2010;35:1997-2004.
89. Nielsen J, Correll CU, Manu P et al. Termination of clozapine treatment due to medical reasons: when is it warranted and how can it be avoided? J Clin Psychiatry 2013;74:603-13.
90. Samara MT, Dold M, Gianatsi M et al. Efficacy, acceptability, and tolerability of antipsychotics in treatment-resistant schizophrenia: a network meta-analysis. JAMA Psychiatry 2016;73:199-210.
91. Emsley R, Nuamah I, Hough D et al. Treatment response after relapse in a placebo-controlled maintenance trial in schizophrenia. Schizophr Res 2012;138:29-34.
92. Correll CU, Rubio JM, Kane JM. What is the risk-benefit ratio of long-term antipsychotic treatment in people with schizophrenia? World Psychiatry 2018;17:149-60.
93. Kishimoto T, Robenzadeh A, Leucht C et al. Long-acting injectable vs oral antipsychotics for relapse prevention in schizophrenia: a meta-analysis of randomized trials. Schizophr Bull 2014;40:192-213.
15 мая 2019
Количество просмотров: 1001


