Психиатрия Всемирная психиатрия
Психиатрия Всемирная психиатрия
№01 2020
Добавление метформина vs смена антипсихотика vs продолжение лечения антипсихотиком вместе с обучением здоровому образу жизни у молодых людей с избыточной массой тела или ожирением с тяжелыми психическими расстройствами: результаты исследования IMPACT №01 2020
Номера страниц в выпуске:69-79
Резюме
Антипсихотики используются при многих психических состояниях у молодежи. Хоть и несоответствующий развитию набор веса и метаболические нарушения, которые являются факторами риска для преждевременной сердечно-сосудистой смертности, особенно часто встречаются у молодежи, оптимальные стратегии по уменьшению антипсихотик-индуцированного набора веса и ожирения остаются неясными. Исследование улучшения метаболических параметров при лечении антипсихотиками детей (Improving Metabolic Parameters in Antipsychotic Child Treatment (IMPACT)) было рандомизированным, с параллельными группами, 24-недельным клиническим исследованием, которое включало психически стабильных молодых людей с избыточной массой тела/ожирением, в возрасте 8–19 лет с тяжелым психическим расстройством, диагностированным по DSM-IV (расстройство шизофренического спектра, расстройство биполярного спектра или психотическая депрессия) в четырех университетах США. У всех из них произошел значительный набор веса в ходе лечения антипсихотиками второго поколения. Централизованная компьютерная система рандомизации распределила участников по открытым группам лечения: метформин (MET); смена антипсихотика (арипипразол или, в случае его применения, перфеназин или молиндон, SWITCH); или продолжение базового антипсихотика (CONTROL). Все участники проходили обучение здоровому образу жизни. Первичным клиническим результатом было изменение стандартной оценки (z-score) индекса массы тела (ИМТ) от исходных значений, проанализированное с использованием вычисленных среднеквадратичных средних значений. В целом было рандомизировано 127 участников: 49 в группу MET, 31 в группу SWITCH, и 47 в группу CONTROL. Стандартная оценка ИМТ значимо уменьшилась в группах MET (24 неделя: -0,09±0,03, p=0,002) и SWITCH (24 неделя: -0,11±0,04, р=0,003), в то время как незначимо увеличилась в группе CONTROL (неделя 24: +0,04±0,03). При трехстороннем сравнении изменение стандартной оценки ИМТ значимо различалось (р=0,001). MET и SWITCH каждый превосходил CONTROL (p=0,002), размер эффектов 0,68 и 0,81 соответственно, причем MET и SWITCH не различались. Больше желудочно-кишечных побочных эффектов возникло в группе MET, чем в SWITCH или CONTROL. Комитет по мониторингу данных и безопасности закрыл рукав группы SWITCH, получавших перфеназин, потому что 25,2% участников прекратили лечение из-за ухудшения психического состояния. Эти данные говорят, что избыточная масса тела или ожирение у детей, связанные с приемом антипсихотиков, могут быть уменьшены путем добавления метформина или сменой на антипсихотик меньшего риска. Обучения здоровому образу жизни недостаточно для предотвращения увеличения стандартной оценки ИМТ.
Ключевые слова: антипсихотики, набор веса, молодые люди, ожирение, метформин, смена антипсихотика, обучение здоровому образу жизни, IMPACT.
Антипсихотики используются при многих психических состояниях у молодежи. Хоть и несоответствующий развитию набор веса и метаболические нарушения, которые являются факторами риска для преждевременной сердечно-сосудистой смертности, особенно часто встречаются у молодежи, оптимальные стратегии по уменьшению антипсихотик-индуцированного набора веса и ожирения остаются неясными. Исследование улучшения метаболических параметров при лечении антипсихотиками детей (Improving Metabolic Parameters in Antipsychotic Child Treatment (IMPACT)) было рандомизированным, с параллельными группами, 24-недельным клиническим исследованием, которое включало психически стабильных молодых людей с избыточной массой тела/ожирением, в возрасте 8–19 лет с тяжелым психическим расстройством, диагностированным по DSM-IV (расстройство шизофренического спектра, расстройство биполярного спектра или психотическая депрессия) в четырех университетах США. У всех из них произошел значительный набор веса в ходе лечения антипсихотиками второго поколения. Централизованная компьютерная система рандомизации распределила участников по открытым группам лечения: метформин (MET); смена антипсихотика (арипипразол или, в случае его применения, перфеназин или молиндон, SWITCH); или продолжение базового антипсихотика (CONTROL). Все участники проходили обучение здоровому образу жизни. Первичным клиническим результатом было изменение стандартной оценки (z-score) индекса массы тела (ИМТ) от исходных значений, проанализированное с использованием вычисленных среднеквадратичных средних значений. В целом было рандомизировано 127 участников: 49 в группу MET, 31 в группу SWITCH, и 47 в группу CONTROL. Стандартная оценка ИМТ значимо уменьшилась в группах MET (24 неделя: -0,09±0,03, p=0,002) и SWITCH (24 неделя: -0,11±0,04, р=0,003), в то время как незначимо увеличилась в группе CONTROL (неделя 24: +0,04±0,03). При трехстороннем сравнении изменение стандартной оценки ИМТ значимо различалось (р=0,001). MET и SWITCH каждый превосходил CONTROL (p=0,002), размер эффектов 0,68 и 0,81 соответственно, причем MET и SWITCH не различались. Больше желудочно-кишечных побочных эффектов возникло в группе MET, чем в SWITCH или CONTROL. Комитет по мониторингу данных и безопасности закрыл рукав группы SWITCH, получавших перфеназин, потому что 25,2% участников прекратили лечение из-за ухудшения психического состояния. Эти данные говорят, что избыточная масса тела или ожирение у детей, связанные с приемом антипсихотиков, могут быть уменьшены путем добавления метформина или сменой на антипсихотик меньшего риска. Обучения здоровому образу жизни недостаточно для предотвращения увеличения стандартной оценки ИМТ.
Ключевые слова: антипсихотики, набор веса, молодые люди, ожирение, метформин, смена антипсихотика, обучение здоровому образу жизни, IMPACT.
Перевод: Шишорин Р.М. (Москва)
Редактура: к.м.н. Федотов И.А. (Рязань)
Резюме
Антипсихотики используются при многих психических состояниях у молодежи. Хоть и несоответствующий развитию набор веса и метаболические нарушения, которые являются факторами риска для преждевременной сердечно-сосудистой смертности, особенно часто встречаются у молодежи, оптимальные стратегии по уменьшению антипсихотик-индуцированного набора веса и ожирения остаются неясными. Исследование улучшения метаболических параметров при лечении антипсихотиками детей (Improving Metabolic Parameters in Antipsychotic Child Treatment (IMPACT)) было рандомизированным, с параллельными группами, 24-недельным клиническим исследованием, которое включало психически стабильных молодых людей с избыточной массой тела/ожирением, в возрасте 8–19 лет с тяжелым психическим расстройством, диагностированным по DSM-IV (расстройство шизофренического спектра, расстройство биполярного спектра или психотическая депрессия) в четырех университетах США. У всех из них произошел значительный набор веса в ходе лечения антипсихотиками второго поколения. Централизованная компьютерная система рандомизации распределила участников по открытым группам лечения: метформин (MET); смена антипсихотика (арипипразол или, в случае его применения, перфеназин или молиндон, SWITCH); или продолжение базового антипсихотика (CONTROL). Все участники проходили обучение здоровому образу жизни. Первичным клиническим результатом было изменение стандартной оценки (z-score) индекса массы тела (ИМТ) от исходных значений, проанализированное с использованием вычисленных среднеквадратичных средних значений. В целом было рандомизировано 127 участников: 49 в группу MET, 31 в группу SWITCH, и 47 в группу CONTROL. Стандартная оценка ИМТ значимо уменьшилась в группах MET (24 неделя: -0,09±0,03, p=0,002) и SWITCH (24 неделя: -0,11±0,04, р=0,003), в то время как незначимо увеличилась в группе CONTROL (неделя 24: +0,04±0,03). При трехстороннем сравнении изменение стандартной оценки ИМТ значимо различалось (р=0,001). MET и SWITCH каждый превосходил CONTROL (p=0,002), размер эффектов 0,68 и 0,81 соответственно, причем MET и SWITCH не различались. Больше желудочно-кишечных побочных эффектов возникло в группе MET, чем в SWITCH или CONTROL. Комитет по мониторингу данных и безопасности закрыл рукав группы SWITCH, получавших перфеназин, потому что 25,2% участников прекратили лечение из-за ухудшения психического состояния. Эти данные говорят, что избыточная масса тела или ожирение у детей, связанные с приемом антипсихотиков, могут быть уменьшены путем добавления метформина или сменой на антипсихотик меньшего риска. Обучения здоровому образу жизни недостаточно для предотвращения увеличения стандартной оценки ИМТ.
Ключевые слова: антипсихотики, набор веса, молодые люди, ожирение, метформин, смена антипсихотика, обучение здоровому образу жизни, IMPACT.
Correll C.U., Sikich L., Reeves G. et al. Metformin add-on vs antipsychotic switch vs continued antipsychotic treatment plus healthy lifestyle education in overweight or obese youth with severe mental illness: results from the IMPACT trial. World Psychiatry 2020;19(1):69–80.
Антипсихотики обычно используются для лечения различных психических расстройств1 и часто связаны с набором веса и метаболическими расстройствами2–4, особенно у детей и подростков4–7, что увеличивает риск преждевременной смертности8. Мониторинг кардиометаболических рисков у пациентов, получающих антипсихотики, зачастую недостаточен9,10, особенно у молодежи11–13. Мероприятия, направленные на набор массы тела и ожирение, связанные с приемом антипсихотиков, до сих пор недостаточно налажены и, что важно, нечасто применяются14,15.
Harvard Growth Study обнаружило, что избыточный вес в подростковом возрасте более значимый предиктор заболеваемости ишемической болезнью сердца, чем избыточный вес во взрослом возрасте16. Большое популяционное когортное исследование указало, что ишемическая болезнь сердца взрослых имела положительную связь с индексом массы тела (ИМТ) в возрасте 7–14 лет у мальчиков и 11–13 лет у девочек, причем риск возрастал по всему распределению ИМТ17. Таким образом, избыточная масса тела / ожирение, индуцированные лечением антипсихотиками у молодых людей, является ведущей заботой общественного здравоохранения.
Несколько стратегий по уменьшению набора веса, вызванного антипсихотиками, были протестированы на взрослых14. Они включают поведенческие мероприятия по модификации образа жизни18, смену на антипсихотик низкого риска19 и добавление топирамата20 или метформина21.
У взрослых результаты поведенческих мероприятий были смешанными. Большое рандомизированное контролируемое исследование (РКИ) не показало значимых преимуществ22. Последний метаанализ18 41 БРИ (N=4267) показал, что у взрослых с тяжелыми психическими расстройствами индивидуальные мероприятия по здоровому образу жизни в течение 22 недель смогли уменьшить ИМТ на 0,63 кг/м2 в сравнении с контрольной группой. Однако по прошествии в среднем 32 недель после предпринятых мер размер эффекта оставался одинаковым в 17 РКИ, но более не значимым. Большинство исследований имели очень низкое или низкое качество доказательств, и статистически значимые эффекты были рассмотрены как, вероятней всего, клинически незначимые18.
В противоположность этим данным, приведенным по взрослым, почти не было ни одного РКИ по поведенческим программам уменьшения веса у детей и подростков с набором веса на фоне приема антипсихотиков. Единственное детское РКИ по 52-недельному поведенческому консультированию по поводу веса у подростков с шизофренией или биполярным расстройством не продемонстрировало значимых преимуществ23.
Среди фармакологических мероприятий по снижению веса у взрослых с тяжелыми психическими расстройствами метформин пока является лучше всего изученным14,21.
В метаанализе 19 РКИ (N=1279) добавление метформина к антипсихотику в среднем в течение 3–4 месяцев значимо уменьшало вес тела относительно контрольных условий, со средним размером эффекта 0,6121.
Механизм снижения веса, вызванного метформином, недостаточно ясен, но данные предполагают различные эффекты24. Хорошо известно, что метформин уменьшает печеночный глюконеогенез и увеличивает чувствительность к инсулину печени и мышц. Поскольку уровень инсулина повышен как часть инсулинорезистентности вследствие нефизиологического набора веса, и инсулин увеличивает аппетит, уменьшение инсулинорезистентности метформином может снизить аппетит и потребление калорий. В добавление, метформин показал способность действовать на гипоталамическую сигнализацию, регулирующую чувствительность к лептину, желудочно-кишечную физиологию и циркадианные ритмы, которые могут влиять не только на потребление пищи, но и на окисление жиров и их откладывание в печени, скелетных мышцах и жировой ткани24.
Данные о фармакологических мероприятиях, нацеленных на уменьшение веса у молодежи с избытком массы тела / ожирением, вызванным антипсихотиками, более ограниченны, чем у взрослых. Доступно только 3 РКИ по метформину, проводившихся в течение 12–16 недель25–27.
В исследовании 39 молодых людей со смешанными психическими расстройствами метформин был отделен от плацебо по антропометрическим, но не по метаболическим параметрам25. В исследовании 49 молодых людей с расстройствами шизофренического спектра различия, предпочитающие лечение метформином, не были статистически значимыми по показателям веса тела, и не было значимых трендов в сторону метаболических преимуществ26. В исследовании 60 молодых людей с аутизмом метформин был отделен от плацебо по антропометрическим, но не по метаболическим показателям27.
Более того, ни одно детское или взрослое РКИ на настоящее время не сравнило напрямую эффекты смены антипсихотиков против добавления средства, снижающего вес, и ни одно детское исследование не оценивало комбинированное лечение и поведенческую терапию.
Целью этого исследования являлось сравнение эффективности и переносимости добавления метформина, смены препарата на антипсихотик с меньшим риском метаболических осложнений и продолжением терапии антипсихотиком против фонового обучения здоровому образу жизни (ЗОЖ) у молодых людей с тяжелыми психическими расстройствами и клинически значимым набором веса, связанным с антипсихотиком.
Другими критериями включения являлись: 1) история лечения антипсихотиками второго поколения (АВП) – арипипразол, азенапин, илоперидон, луразидон, оланзапин, палиперидон, кветиапин, рисперидон или зипрасидон – со стабильной дозой в течение минимум 30 дней; 2) клиническая стабильность на данном режиме терапии, оцененная по Общему клиническому впечатлению – тяжесть и улучшение (Clinical Global Impression – Severity and Improvement (CGI-I and CGI-S)31, в течение минимум 30 дней;
3) ИМТ≥85-го процентиля для возраста и пола (т. е. избыточный вес или ожирение); 4) значительный набор веса (>10% исходного веса) в прошлом на фоне приема АВП;
5) наличие первичного опекуна (родителя(-лей), близких родственников в качестве опекунов, законного представителя, или приемного родителя), который знал лицо в течение минимум 6 месяцев до включения в исследование; 6) наличие способности участвовать во всех аспектах протокола согласно клинической оценке исследователя.
Критериями исключения были: 1) лечение более чем одним антипсихотическим препаратом или более чем тремя психиатрическими препаратам (4 допустимо в случае, если два из них были для лечения синдрома дефицита внимания с гиперактивностью (СДВГ)); 2) антипсихотическое лечение клозапином (который используется исключительно для лечения резистентных состояний); 3) изменение психиатрических препаратов или их доз в течение последних 30 дней; 4) какие-либо препараты, влияющие на уровень глюкозы, инсулина или липидов; 5) какое-либо неврологическое или соматическое заболевание, влияющие на массу тела или физическую активность; 6) ненормальная глюкоза натощак (≥126 мг/дл) или уровень креатинина (>1,3 мг/дл); 7) расстройство зависимости от ПАВ (за исключением табачной зависимости) за последний месяц; 8) текущий или в течение жизни диагноз анорексии или нервной булимии;
8) IQ<55; 9) известная гиперчувствительность к арипипразолу, перфеназину или метформину; 10) предыдущие исследования с арипипразолом или перфеназином, длящиеся более 2 недель и приостановленные по соображениям эффективности или переносимости; 11) значительный риск опасности для себя или окружающих; 12) для участниц женского пола: беременность, уход за ребенком или сексуальная активность с нежеланием придерживаться метода двойной контрацепции. Терапия СДВГ и вальпроаты были разрешены.
Все пригодные молодые люди проходили обучение ЗОЖ и были рандомизированы на 24-недельное открытое лечение с либо: 1) добавлением метформина (МЕТ); либо:
2) сменой АВП на антипсихотик с более низким кардиометаболическим риском (арипипразол или, если ранее применялся этот препарат, молиндон – до его выхода с рынка США – или перфеназин) (SWITCH); 3) продолжение лечения на текущем АВП (CONTROL). Всем молодым людям, пролеченным метформином, давался ежедневно мультивитамин для профилактики дефицита витамина В12.
Молиндон обычно выбирался для рукава SWITCH, если пациенты показывали значимый набор веса, принимая арипипразол. Он был выбран, так как на нем набирали меньше всего веса в исследовании «Лечение расстройств шизофренического спектра с ранним началом» (the Treatment of Early-Onset Schizophrenia Spectrum Disorders (TEOSS))33. Когда он стал недоступен в США, NIMH настоятельно рекомендовал сохранить сравнение между АВП (арипипразол) и антипсихотиками первого поколения (АПП) в рукаве SWITCH. Среди доступных АПП мы выбрали перфеназин, так как он имел более благоприятный профиль в плане набора веса и метаболических изменений, чем АВП, в проекте «Клинические исследования антипсихотических средств для изучения результативности вмешательств» (the Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE))34.
Рандомизации были осуществлены централизованной компьютеризированной системой. Они были распределены по текущему АВП (рисперидон, арипипразол или «другой антипсихотик») и диагнозу (расстройство шизофренического спектра или другие расстройства). Пациенты, опекуны и члены команды исследователей узнали о рандомизации в конце исходного визита.
Все условия исследования включали 10 амбулаторных визитов (на 0, 1, 2, 4, 6, 8,12, 16, 20 и 24-й неделе) и 6 телефонных сессий (на 3, 5, 7, 9, 10 и 11 неделе). Метаболические показатели оценивались на исходном уровне, на 12 и 24-й неделе.
Психическая симптоматология была оценена в начале исследования и на 12 и 24 неделе независимыми консультантами (терапевты с опытом работы с психически больными молодыми людьми более 2 лет), «ослепленными» по условиям исследования и побочных эффектах терапии, с использованием 21-пунктной Краткой психиатрической оценочной шкалы для детей (The 21-item Brief Psychiatric Rating Scale for Children (BPRS-C)35.
Длительный мониторинг в течение фазы лечения включал повторную оценку психических симптомов, побочных эффектов и приверженности лечения детскими и подростковыми психиатрами, сертифицированными министерством здравоохранения. Повторная оценка психиатрических симптомов была проведена с использованием CGI-I и CGI-S. Побочные эффекты были оценены по Продольной систематической шкале побочных эффектов (the Systematic Longitudinal Adverse Event Scale (SLAES))36, по Шкале экстрапирамидных симптомов Симпсона-Ангус (the Simpson-Angus Extrapyramidal Symptoms Scale (SAEPS))37, по Оценочная шкале акатизии Барнеса (the Barnes Akathisia Rating Scale (BARS))38 и по Шкале ненормальных непроизвольных движений (the Abnormal Involuntary Movement Scale (AIMS))39.
Все метаболические лабораторные показатели на основных посещениях (исходное, 12 недель, 24 недели) были взяты после ночного голодания в течение минимум 8 часов. Измерялись глюкоза, инсулин, триглицериды, общий холестерин, липопротеины высокой плотности (ЛПВП), липопротеины низкой плотности (ЛПНП), холестерин, гомеостатическая модель оценки резистентности к инсулину (HOMA-IR), гемоглобин А1с (HgbA1c) и С-реактивный белок.
Во всех случаях собирались данные самоотчетной приверженности родителей/пациентов относительно всех психотропных средств. Для всех участников, получающих исследуемое средство (например, сменный антипсихотик или метформин), информация собиралась также путем подсчета таблеток на каждой встрече. Для всех пациентов уровни антипсихотиков в крови измерялись на 12 и 24 неделях.
Пациенты могли отказаться от исследования и быть направлены на клиническое лечение на основании либо: 1) запроса участника или законного опекуна, 2) клинической оценки независимого педиатра или консультирующего детского эндокринолога, что метаболические проблемы требуют лечения вне исследования, либо: 3) значительного ухудшения психических симптомов, используя оценку по шкале CGI-I «значительное ухудшение» или «очень значительное ухудшение» на двух последовательных встречах за период ≥2 неделям.
Молодые люди также могли выйти из исследования, если произошли побочные эффекты тяжелой и средней степени тяжести, которые нельзя исправить коррекцией дозы или добавлением допускаемых одновременных четырех средств, или если доказаны местным главным исследователем, как вследствие некомплаентности или клинического статуса.
Для молодых людей, весивших <50 кг, титрация метформина начиналась с 250 мг, принимаемых в обед, которые были увеличены на 250 мг (принимаемых на завтрак) через 1 неделю, и в последующем с шагом в 250 мг на еженедельной основе (принимаемые 2 раза в день, за завтраком и обедом), до достижения 500 мг дважды в день. Для молодых людей, весивших 50–70 кг, максимальная доза метформина была 500 мг утром и 100 мг вечером.
Для молодых людей весом >70 кг титрация метформин а начиналась с 500 мг, принимаемых в обед, которые были увеличены на 500 мг (принимаемые на завтрак) через 1 неделю, и в последующем с шагом в 500 мг на еженедельной основе (принимаемые два раза в день, за завтраком и обедом) до достижения 1000 мг дважды в день.
В ходе постепенной кросс-титрации с исходного АВП на арипипразол, либо перфеназин, исходный АВП удерживался в той же дозе в течение 3 недель, а затем снижался на 25% от исходной дозы в течение 3 недель. Арипипразол начинали с 2 мг/сутки в течение недели, повышая до 5 мг/сут на второй неделе и затем повышая с шагом в 5 мг до максимальных 30 мг/сут. Перфеназин начинали с 4 мг/сут и повышали каждую неделю на 4 мг до максимальных 64 мг/сут.
Как титрация метформина, так и кросс-титрация АВП могли быть изменены на основании клинического ответа.
В рукаве SWITCH на перфеназин, требовался бензотропин 0,5 мг 2 раза в день при достижении дозы перфеназина >8 мг/сут. Метформин мог использоваться, если возникали симптомы желудочно-кишечной непереносимости.
Показатели безопасности включали продольное наблюдение побочных эффектов, выявленных с использованием SLAES, SAEPS, BARS и AIMS, и психиатрической оценкой «ослепленными» экспертами по CGI-I и BPRS-C.
Время до прерывания лечения было оценено с использованием кривой выживаемости Kaplan-Meier с логарифмическим ранговым критерием для сравнения групп лечения. Демографические данные, побочные эффекты и другие показатели безопасности были суммированы с использованием базовой описательной статистики. Поисковый апостериорный анализ методом c2 сравнивал 3 группы по категориальному набору веса и частоте побочных эффектов без коррекции на множественное сравнение.
На основании вычисления статистической мощности размер выборки в 44 участника в группе (общее N=132) выявил 80% мощность выявления значимых различий относительно первичных результатов, стандартной оценки ИМТ.
Между октябрем 2009 и октябрем 2013 года 127 участников были рандомизированы (CONTROL=47; MET=49; SWITCH=31). Анализ побочных эффектов исключил пять участников (CONTROL=2; MET=2; SWITCH=1), которые прекратили лечение без предоставления информации о побочных эффектах после узнавания их рандомизированного распределения. Анализ первичной эффективности включал 121 участника (CONTROL=44; MET=47; SWITCH=30: арипипразол=12, перфеназин=17; молиндон=1) с ≥1 пост-базовым измерением жизненных показателей.
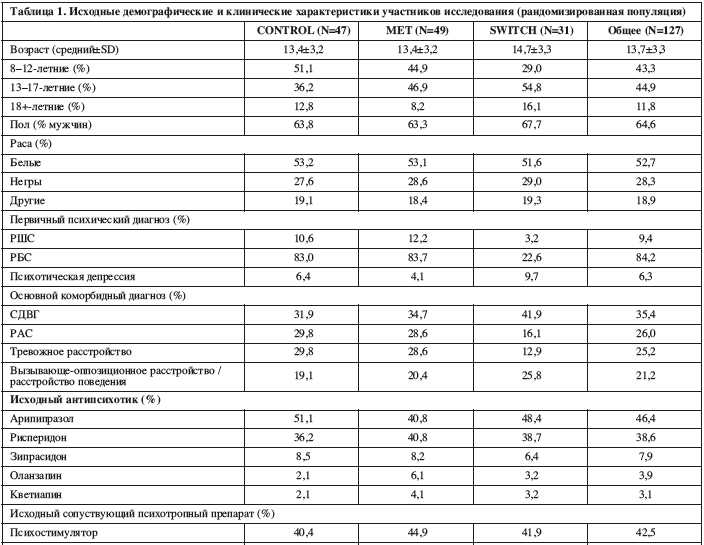
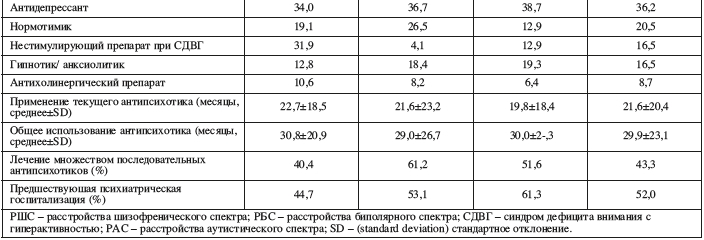
Арипипразол (46,4%) и рисперидон (38,6%) были наиболее частыми антипсихотиками, получаемыми исходно. Средней длительностью текущего и общего применения антипсихотиков был период в 21,6±20.4 и 29,9±23,1 месяцев соответственно. Почти половина (43,3%) были лечены последовательно множеством антипсихотиков. Группы лечения значимо не различались по антропометрическим, психиатрическим и метаболическим параметрам в начале исследования.
Десять (83,3%) участников, сменяющие препарат на арипипразол, достигли целевых доз к 8 неделе; один не смог окончательно прекратить свой исходный АВП. Из тех, кто сменил препарат на перфеназин, 58,8% достигли целевой дозы к 8 неделе; 41,2 не смогли прекратить их исходный АВП. Средние конечные дозы для арипипразола были 12,8±9,0 мг/сутки и 11,6±10,2 мг/сут для перфеназина. Другие психотропные препараты остались практически без изменений в ходе исследования.
Средняя длительность лечения была равна 19,4±8,4 недели для группы CONTROL, 20,3±7,2 недели для MET и 18,2±8,3 недели для SWITCH (р=0,113) с значимым различием между арипипразолом (20,6±8,3 недели), перфеназином (16,9±8,0 недель) и молиндоном (12 недель).
Прекращение лечения от всех причин было значительно выше в группе SWITCH с перфеназином (52,9%), чем во всех других группах (р=0,041; CONTROL=25,5%, MET=21,2%, SWITCH=36,6%, SWITCH с арипипразолом=8,3%), в первую очередь от неадекватной психиатрической эффективности (р=0,0014, CONTROL=6,3%, MET=4,1%, SWITCH с арипипразолом=0%, SWITCH с перфеназином=35,2%). В связи с этим, комитет по мониторингу данных безопасности NIHM закрыл рукав SWITCH с перфеназином 8 февраля 2013 года.
Стандартные оценки ИМТ значимо снизились как в группе MET (12 неделя: -0,03±0,01, р=0,019; 24 неделя: -0,09±0,03, р=0,02), так и в группе SWITCH (12 неделя: -0,05±0,02, р=0,008; 24 неделя: -0,11±0,04, р=0,003), в то время как она незначимо увеличилась в группе CONTROL (12 неделя: +0,03±0,01; 24 неделя: +0,04±0,03).
Изменение стандартной оценки ИМТ сильно различалось между тремя группами на 12 неделе (р=0,002) и на 24 неделе (р=0,001), причем как MET (p=0,005 и р=0,002 соответственно), так и SWITCH (p=0,002 в обоих случаях) превосходили группу CONTROL, с размерами эффектов от 0,40 до 0,81 и без значимых различий между MET и SWITCH (Таблица 2 и Рисунок 1).
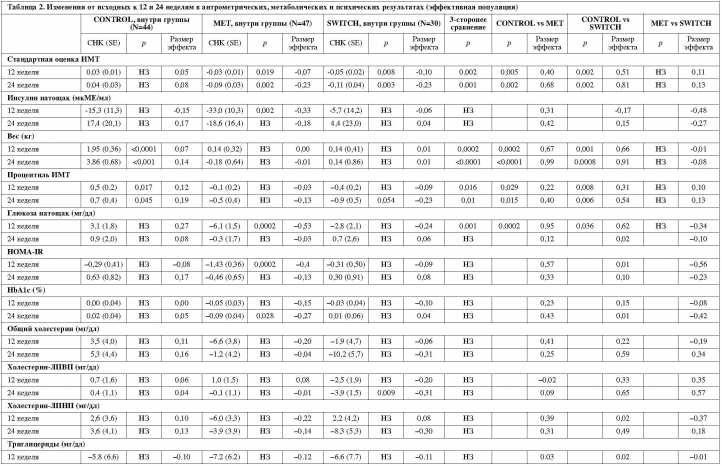
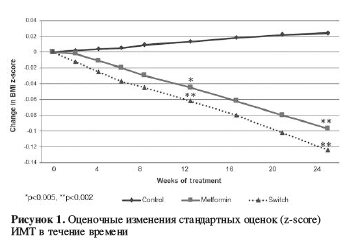 Все антропометрические показатели имели ту же самую картину, что и первичные результаты (Таблица 2). Вес значимо вырос в группе CONTROL (12 неделя: +1,95±0,36 кг, p<0,0001; 24 неделя: +3,85±0,68 кг, р<0,001), оставаясь практически теми же в группе MET (+0,13±0,31 кг и -0,18±0,64 кг) и группе SWITCH (+0,13±0,4 кг и +0,13±0,86 кг). Трехстороннее сравнение было значимо на 12 неделе (р=0,0002) и на 24 неделе (p<0,0001), причем как MET, так и SWITCH превосходили CONTROL оба раза (размер эффекта от 0,66 до 0,99).
Все антропометрические показатели имели ту же самую картину, что и первичные результаты (Таблица 2). Вес значимо вырос в группе CONTROL (12 неделя: +1,95±0,36 кг, p<0,0001; 24 неделя: +3,85±0,68 кг, р<0,001), оставаясь практически теми же в группе MET (+0,13±0,31 кг и -0,18±0,64 кг) и группе SWITCH (+0,13±0,4 кг и +0,13±0,86 кг). Трехстороннее сравнение было значимо на 12 неделе (р=0,0002) и на 24 неделе (p<0,0001), причем как MET, так и SWITCH превосходили CONTROL оба раза (размер эффекта от 0,66 до 0,99).
Снижение веса происходило в 55,1% случаев в MET, 46,7% в SWITCH и 10,6% в CONTROL. Более того, 88,6% субъектов группы CONTROL набрали вес, причем 22,7% из них набрали ≥7% от исходного веса, в сравнении лишь с 6,1% в MET и 9,7% в SWITCH.
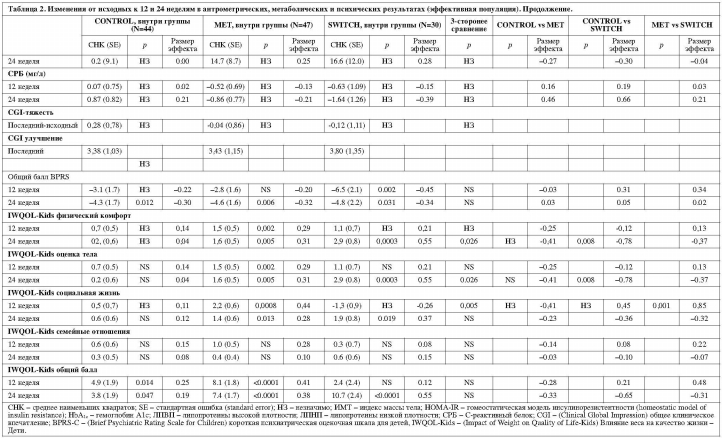
Качество жизни, связанное с весом, улучшилось во всех группах, причем единственные различия между вариантами лечения наблюдались по подшкале социальной жизни на 12 неделе (р=0.005), MET превосходит SWITCH (p=0,001), и подшкале физического комфорта на 24 неделе (р=0,026), Switch превосходит CONTROL (p=0,008).
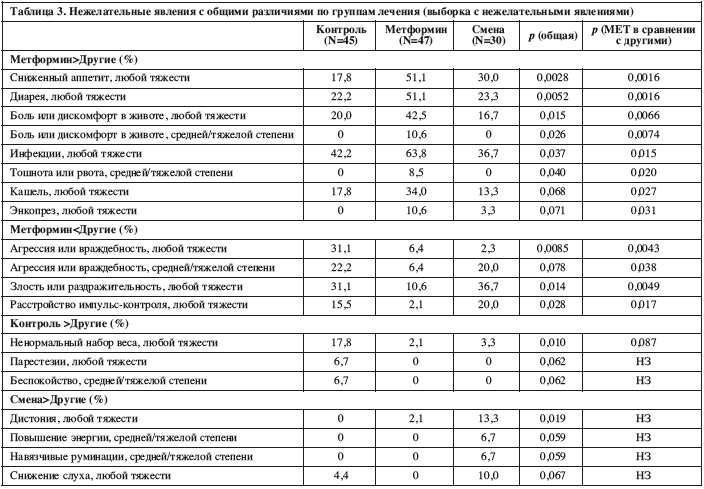
Метформин был связан со значительно большей частотой абдоменалгий как умеренных, так и тяжелых (р=0,0074) и всех степеней тяжести (р=0,0066); инфекций, всех степеней тяжести (р=0,015); сниженного аппетита, всех степеней тяжести (р=0,0016); диареи, всех степеней тяжести (р=0,0016); тошнота или рвота, средней/тяжелой степени тяжести (р=0,020); и недержание кала, всех степеней тяжести (р=0,031).
Перфеназин имел численно, но не статистически, большие пропорции как средней/тяжелой степени тяжести, так и всех степеней тяжести гиперсомнии и всех степеней тяжести начальной инсомнии. Арипипразол имел статистически большую частоту легкой дистонии (р=0,013).
MET была связана со значительно меньшими проблемами с агрессивностью/враждебностью как средней/тяжелой (р=0,038) и всех степеней тяжести (р=0,0043), и имела меньше всех степеней тяжести злости/раздражительности (р=0,0049) и импульсивности (р=0,017).
Поскольку угол наклонной кривой снижения веса в двух активных рукавах оказался линейным, без достижения какого-либо плато в течение 6-месячного периода исследования, требуются более длительные исследования для подтверждения, что преимущества продолжат расти со временем, и для определения момента, когда эти преимущества достигнут плато.
Метаболические преимущества и воспалительные изменения были минимальными и, похоже, уменьшаются со временем. Большинство участников оставались психически стабильными, за исключением рукава SWITCH с перфеназином, который был закрыт из-за частых психиатрических обострений, приводящих к прекращению участия 35,2% участников. В целом как MET, так и SWITCH с арипипразолом хорошо переносились, хотя MET ассоциировался с большей частотой желудочно-кишечных побочных эффектов.
Несмотря на данные побочные эффекты, MET не был связан с большей частотой прекращения лечения по причине побочных эффектов. Эти результаты поддерживает наблюдение, что большая часть желудочно-кишечных побочных эффектов были легкой или средней степени тяжести, возникшими рано в ходе фазы титрования и были по большей части преходящими, или могли решиться уменьшением скорости титрации и/или остановкой на более низкой дозе метформина.
Противоположно и удивительно, что MET был связан с меньшей частотой сообщений о проблемах с агрессией/враждебностью и импульсивностью, чем CONTROL или SWITCH. Остается неясным, может ли это быть связано с меньшим количеством проблем с питанием из-за сниженного аппетита и/или действием метформина на гомеостаз глюкозы в мозге или когнитивные функции, похожие на те, что наблюдаются в животных моделях43,44.
Результаты кардиометаболических и побочных эффектов в основном согласуются с теми, что были в трех более мелких и коротких исследованиях метформина у молодежи, принимающей антипсихотики, демонстрируя остановку дальнейшего набора веса, но минимальную потерю веса с метформином и минимальные метаболические эффекты в ходе исследования. Однако это исследование распространяется на все существующие исследования метформина у лиц, принимающих антипсихотики, демонстрируя также сравнительную пользу для веса со сменой препарата на антипсихотик более низкого риска метаболических осложнений.
Минимальная метаболическая польза метформина согласуется с предшествующими исследованиями и может быть связана с тем фактом, что пациенты выбирались прежде всего по набору веса, а не по метаболическим нарушениям. Тем не менее данные индивидуальных групп несколько отличались от данных исследований у взрослых16–19,34,45,46, в которых ни MET, ни SWITCH не были связаны с потерей веса, а поведенческое обучение ЗОЖ ассоциировалось с дальнейшим набором веса. Это различие может относиться как к нормальным механизмам развития, способствующим продолжающемуся росту молодых людей, так и к длительному применению антипсихотиков у большинства участников.
В добавление, касательно физиологического роста, имеющего место в течение 6-месячного периода исследования, молодые люди в группах MET и SWITCH имели отрицательные стандартные оценки (z-score) ИМТ и процентные изменения ИМТ, скорректированные по полу и возрасту, в то время как молодежь в группе CONTROL претерпели не только увеличение массы тела, но и увеличение в значениях стандартной оценки ИМТ и процентном изменении ИМТ. Этот результат указывает, что относительно нормального развития, MET и SWITCH вели к снижению веса, пока CONTROL ассоциировался с набором веса в добавление к тому, который мог быть ожидаем в ходе роста. Важно, что различия между CONTROL и MET или SWITCH возросли между 12 неделей (размер эффекта 0,67 и 0,66) и 24 неделей (размер эффекта 0,99 и 0,91), говоря о том, что продолжение использования MET или SWITCH с вероятностью увеличит пользу.
Высокая частота декомпенсации на перфеназине, основанная на «ослепленной» оценке по CGI-I и BPRS-C, не ожидалась, принимая во внимание, что этот препарат имел сравнительную эффективность со множеством АВП у взрослых с шизофренией33. Но его эффективность при детских психотических и аффективных расстройствах никогда не оценивалась. Наблюдаемая декомпенсация не кажется вызванной слишком быстрой сменой препарата (принимая во внимание медленную постепенную кросс-титрацию и факт, что 41,2% участников не смогли прекратить принимать их исходной антипсихотик) или экстрапирамидными побочными эффектами (учитывая использование профилактического антихолинергического лечения и лишь легкие паркинсонические симптомы у двух пациентов). Однако, нежелательные явления ограничили нашу возможность увеличить дозу перфеназина так, как нам бы хотелось, что говорит о низком соотношении «риск – польза» для перфеназина у молодежи.
Данные этого исследования должны быть интерпретированы согласно его ограничениям. Во-первых, хоть это и было самым крупным исследованием метформина, проведенным в настоящее время у молодых людей, принимающих антипсихотики, размеры отдельных групп были средними, особенно в рукаве SWITCH, и вторичный анализ не был скорректирован на множественную проверку. Метаболические изменения могли бы быть более достоверными в большей выборке.
Во-вторых, было небольшое количество участников в рукаве SWITCH. Причины включали приостановленную рандомизацию с того момента, как молиндон прекратил выход на рынок США, до утверждения рукава SWITCH с перфеназином, и последующей остановке смены на перфеназин из-за возросшего психического ухудшения участников. Так как SWITCH с перфеназином плохо переносился и приводил к последующему прекращению лечения из-за неэффективности, дополнительные агенты с более низким потенциалом набора веса нужно исследовать. В этом контексте остается неясным, будут ли в этом исследовании иметь схожие со SWITCH эффекты смены одного препарата с низким риском, такие как арипипразол, на другой препарат низкого риска, включая зипрасидон и луразидон, или (основываясь на данных по взрослым) карипразин или брекспипразол5,47,48.
В-третьих, мы не сравнивали MET и SWITCH с официальными мерами снижения веса, но вместо этого использовали обучение ЗОЖ, состоящее из образования и строгого мониторинга веса. Будущие исследования необходимы для изучения эффективности официальных стратегий снижения веса у молодежи, принимающей антипсихотики, с избыточным весом / ожирением. Хоть и предыдущие исследования говорили, что официальные стратегии снижения веса были эффективны у взрослых с набором веса, вызванным антипсихотиками18, но крупнейшее исследование по использованию поведенческих мер снижения веса у взрослых, принимающих антипсихотики, не показало их превосходства над стандартным лечением22.
В-четвертых, исследование было открытым, без контроля плацебо, которое, вероятно, повлияло на то, что некоторые участники прекратили участие сразу после рандомизации. Но открытое лечение повысило экологическую валидность наших данных, большая часть результатов были объективными показателями и BPRS-C и CGI оценивались «ослепленными» экспертами, минимизируя риск системных ошибок.
В-пятых, мы остановили выбор на достаточно медленной титрации метформина в течение 4 недель с целью уменьшить дозозависимые и зависимые от титрации побочные эффекты, которые могли увеличить частоту нежелательных выбываний из исследования. Хотя более быстрая титрация метформина могла привести к большим эффектам, тем более что линейный наклон изменения стандартный оценки ИМТ не предполагает большого увеличения эффективности по мере достижения более высокой дозы.
В-шестых, пациенты могли принимать в общей сложности три (или четыре, если 2 препарата использовались при СДВГ) психотропных препарата. В то же время эффекты сопутствующих препаратов могли потенциально исказить результаты, методология этого исследования удостоверяет большую обобщаемость, так как пациенты, принимающие антипсихотики, часто принимают множество психотропных препаратов. Далее, рандомизированные группы отличались лишь на 3–5%, принимая во внимание применение психостимуляторов и антидепрессантов, и 8–14%, рассматривая прием тимостабилизаторов.
Наконец, хотя частота сопутствующего применения психостимуляторов была относительно высока среди трех экспериментальных групп (40–45%), это вряд ли повлияло на результаты. Предшествующие исследования показали, что набор веса, связанный с антипсихотиками, не тормозится и не уменьшается при сопутствующем использовании психостимуляторов49,50. Более того, все пациенты в этом исследовании имели значительную прибавку в весе, несмотря на факт того, что они получали сопутствующие психостимуляторы, что не менялось в ходе исследования.
В качестве резюме, наши результаты свидетельствуют, что как MET, так и смена на арипипразол снижают бремя набора веса, связанного с АВП, у молодых людей. Необходимы дальнейшие исследования для определения, может ли, как доказано для взрослых21, польза от MET быть сильнее у молодежи с более ограниченной прибавкой веса или в ходе начала приема антипсихотиков51. Однако минимальный наблюдаемый эффект на метаболические показатели требует рутинного мониторинга метаболических показателей и тщательного рассмотрения других стратегий лечения с более низким риском набора веса до начала применения антипсихотика52.
Далее, хоть и смена на арипипразол была связана со значительным снижением показателей веса по сравнению с контрольной группой, большая частота его текущего (46,4%) и предшествующего (26,0%) применения в данной выборке говорит, что ограниченная субпопуляция детей может иметь выгоду от этой стратегии. Оценка других возможных препаратов на смену, профилактическое использование метформина, других препаратов, которые могут уменьшить набор веса, связанный с антипсихотиками, и возможный положительный эффект MET на агрессию требуется для молодежи.
Благодарности
Исследование IMPACT было поддержано грантами NIMH (R01 MH080270, R01 MH080274, RR118535 и R01 MH080325). В добавление, некоторые методики были поддержаны the Johns Hopkins Institute for Clinical and Translational Research (NIH UL1TR001079), the National Institute of Health Clinical and Translational Science Award (CTSA) program at University of North Carolina, Chapel Hill (RR0046 and UL1TR001111), и the University of Maryland School of Medicine General Clinical Research Center and Mid-Atlantic Nutrition Obesity Research Center (2P30DK072488-11). NIMH не имел роли в дизайне и проведении исследования; сборе, управлении, анализе или интерпретации данных; подготовке, правке или одобрении рукописи; или решении о публикации рукописи. Авторы хотели бы поблагодарить участвовавших пациентов и их семьи, которые способствовали выполнению этого исследования. Они также благодарны исследовательской группе, которая помогла провести исследование, и работникам здравоохранения, направлявшим возможных участников. Наконец, они хотели бы поблагодарить M. Freemark, J. Newcomer и S. Snitker за их советы в разработке дизайна исследования.
DOI:10.1002/wps.20714
Редактура: к.м.н. Федотов И.А. (Рязань)
Резюме
Антипсихотики используются при многих психических состояниях у молодежи. Хоть и несоответствующий развитию набор веса и метаболические нарушения, которые являются факторами риска для преждевременной сердечно-сосудистой смертности, особенно часто встречаются у молодежи, оптимальные стратегии по уменьшению антипсихотик-индуцированного набора веса и ожирения остаются неясными. Исследование улучшения метаболических параметров при лечении антипсихотиками детей (Improving Metabolic Parameters in Antipsychotic Child Treatment (IMPACT)) было рандомизированным, с параллельными группами, 24-недельным клиническим исследованием, которое включало психически стабильных молодых людей с избыточной массой тела/ожирением, в возрасте 8–19 лет с тяжелым психическим расстройством, диагностированным по DSM-IV (расстройство шизофренического спектра, расстройство биполярного спектра или психотическая депрессия) в четырех университетах США. У всех из них произошел значительный набор веса в ходе лечения антипсихотиками второго поколения. Централизованная компьютерная система рандомизации распределила участников по открытым группам лечения: метформин (MET); смена антипсихотика (арипипразол или, в случае его применения, перфеназин или молиндон, SWITCH); или продолжение базового антипсихотика (CONTROL). Все участники проходили обучение здоровому образу жизни. Первичным клиническим результатом было изменение стандартной оценки (z-score) индекса массы тела (ИМТ) от исходных значений, проанализированное с использованием вычисленных среднеквадратичных средних значений. В целом было рандомизировано 127 участников: 49 в группу MET, 31 в группу SWITCH, и 47 в группу CONTROL. Стандартная оценка ИМТ значимо уменьшилась в группах MET (24 неделя: -0,09±0,03, p=0,002) и SWITCH (24 неделя: -0,11±0,04, р=0,003), в то время как незначимо увеличилась в группе CONTROL (неделя 24: +0,04±0,03). При трехстороннем сравнении изменение стандартной оценки ИМТ значимо различалось (р=0,001). MET и SWITCH каждый превосходил CONTROL (p=0,002), размер эффектов 0,68 и 0,81 соответственно, причем MET и SWITCH не различались. Больше желудочно-кишечных побочных эффектов возникло в группе MET, чем в SWITCH или CONTROL. Комитет по мониторингу данных и безопасности закрыл рукав группы SWITCH, получавших перфеназин, потому что 25,2% участников прекратили лечение из-за ухудшения психического состояния. Эти данные говорят, что избыточная масса тела или ожирение у детей, связанные с приемом антипсихотиков, могут быть уменьшены путем добавления метформина или сменой на антипсихотик меньшего риска. Обучения здоровому образу жизни недостаточно для предотвращения увеличения стандартной оценки ИМТ.
Ключевые слова: антипсихотики, набор веса, молодые люди, ожирение, метформин, смена антипсихотика, обучение здоровому образу жизни, IMPACT.
Correll C.U., Sikich L., Reeves G. et al. Metformin add-on vs antipsychotic switch vs continued antipsychotic treatment plus healthy lifestyle education in overweight or obese youth with severe mental illness: results from the IMPACT trial. World Psychiatry 2020;19(1):69–80.
Антипсихотики обычно используются для лечения различных психических расстройств1 и часто связаны с набором веса и метаболическими расстройствами2–4, особенно у детей и подростков4–7, что увеличивает риск преждевременной смертности8. Мониторинг кардиометаболических рисков у пациентов, получающих антипсихотики, зачастую недостаточен9,10, особенно у молодежи11–13. Мероприятия, направленные на набор массы тела и ожирение, связанные с приемом антипсихотиков, до сих пор недостаточно налажены и, что важно, нечасто применяются14,15.
Harvard Growth Study обнаружило, что избыточный вес в подростковом возрасте более значимый предиктор заболеваемости ишемической болезнью сердца, чем избыточный вес во взрослом возрасте16. Большое популяционное когортное исследование указало, что ишемическая болезнь сердца взрослых имела положительную связь с индексом массы тела (ИМТ) в возрасте 7–14 лет у мальчиков и 11–13 лет у девочек, причем риск возрастал по всему распределению ИМТ17. Таким образом, избыточная масса тела / ожирение, индуцированные лечением антипсихотиками у молодых людей, является ведущей заботой общественного здравоохранения.
Несколько стратегий по уменьшению набора веса, вызванного антипсихотиками, были протестированы на взрослых14. Они включают поведенческие мероприятия по модификации образа жизни18, смену на антипсихотик низкого риска19 и добавление топирамата20 или метформина21.
У взрослых результаты поведенческих мероприятий были смешанными. Большое рандомизированное контролируемое исследование (РКИ) не показало значимых преимуществ22. Последний метаанализ18 41 БРИ (N=4267) показал, что у взрослых с тяжелыми психическими расстройствами индивидуальные мероприятия по здоровому образу жизни в течение 22 недель смогли уменьшить ИМТ на 0,63 кг/м2 в сравнении с контрольной группой. Однако по прошествии в среднем 32 недель после предпринятых мер размер эффекта оставался одинаковым в 17 РКИ, но более не значимым. Большинство исследований имели очень низкое или низкое качество доказательств, и статистически значимые эффекты были рассмотрены как, вероятней всего, клинически незначимые18.
В противоположность этим данным, приведенным по взрослым, почти не было ни одного РКИ по поведенческим программам уменьшения веса у детей и подростков с набором веса на фоне приема антипсихотиков. Единственное детское РКИ по 52-недельному поведенческому консультированию по поводу веса у подростков с шизофренией или биполярным расстройством не продемонстрировало значимых преимуществ23.
Среди фармакологических мероприятий по снижению веса у взрослых с тяжелыми психическими расстройствами метформин пока является лучше всего изученным14,21.
В метаанализе 19 РКИ (N=1279) добавление метформина к антипсихотику в среднем в течение 3–4 месяцев значимо уменьшало вес тела относительно контрольных условий, со средним размером эффекта 0,6121.
Механизм снижения веса, вызванного метформином, недостаточно ясен, но данные предполагают различные эффекты24. Хорошо известно, что метформин уменьшает печеночный глюконеогенез и увеличивает чувствительность к инсулину печени и мышц. Поскольку уровень инсулина повышен как часть инсулинорезистентности вследствие нефизиологического набора веса, и инсулин увеличивает аппетит, уменьшение инсулинорезистентности метформином может снизить аппетит и потребление калорий. В добавление, метформин показал способность действовать на гипоталамическую сигнализацию, регулирующую чувствительность к лептину, желудочно-кишечную физиологию и циркадианные ритмы, которые могут влиять не только на потребление пищи, но и на окисление жиров и их откладывание в печени, скелетных мышцах и жировой ткани24.
Данные о фармакологических мероприятиях, нацеленных на уменьшение веса у молодежи с избытком массы тела / ожирением, вызванным антипсихотиками, более ограниченны, чем у взрослых. Доступно только 3 РКИ по метформину, проводившихся в течение 12–16 недель25–27.
В исследовании 39 молодых людей со смешанными психическими расстройствами метформин был отделен от плацебо по антропометрическим, но не по метаболическим параметрам25. В исследовании 49 молодых людей с расстройствами шизофренического спектра различия, предпочитающие лечение метформином, не были статистически значимыми по показателям веса тела, и не было значимых трендов в сторону метаболических преимуществ26. В исследовании 60 молодых людей с аутизмом метформин был отделен от плацебо по антропометрическим, но не по метаболическим показателям27.
Более того, ни одно детское или взрослое РКИ на настоящее время не сравнило напрямую эффекты смены антипсихотиков против добавления средства, снижающего вес, и ни одно детское исследование не оценивало комбинированное лечение и поведенческую терапию.
Целью этого исследования являлось сравнение эффективности и переносимости добавления метформина, смены препарата на антипсихотик с меньшим риском метаболических осложнений и продолжением терапии антипсихотиком против фонового обучения здоровому образу жизни (ЗОЖ) у молодых людей с тяжелыми психическими расстройствами и клинически значимым набором веса, связанным с антипсихотиком.
МЕТОДЫ
Исследование улучшения метаболических параметров при лечении антипсихотиками детей (Improving Metabolic Parameters in Antipsychotic Child Treatment (IMPACT)) было рандомизированным, немаскированным с параллельными группами клиническим исследованием, утвержденным и наблюдаемым экспертным советом медицинского учреждения Zucker/Hillside Hospital, John Hopkins University, University of Maryland и University of North Carolina в Chapel Hill28. Спонсировано Национальным институтом психического здоровья США (the US National Institute of Mental Health (NIMH).Участники
Молодые люди в возрасте 8–19 лет были включены в исследование, если у них был выставлен первичный диагноз по DSM-IV «расстройство шизофренического спектра», «расстройство биполярного спектра» или «большое депрессивное расстройство с психотическими симптомами». Психиатрические диагнозы были установлены на скрининговой встрече с использованием модификации Перечня признаков аффективных нарушений и шизофрении у детей школьного возраста – Версия для настоящей оценки и пожизненной (the Leibenluft modification of the Kiddie Schedule for Affective Disorders and Schizophrenia for School-Age Children – Present and Lifetime version (K-SADS-PL))29,30.Другими критериями включения являлись: 1) история лечения антипсихотиками второго поколения (АВП) – арипипразол, азенапин, илоперидон, луразидон, оланзапин, палиперидон, кветиапин, рисперидон или зипрасидон – со стабильной дозой в течение минимум 30 дней; 2) клиническая стабильность на данном режиме терапии, оцененная по Общему клиническому впечатлению – тяжесть и улучшение (Clinical Global Impression – Severity and Improvement (CGI-I and CGI-S)31, в течение минимум 30 дней;
3) ИМТ≥85-го процентиля для возраста и пола (т. е. избыточный вес или ожирение); 4) значительный набор веса (>10% исходного веса) в прошлом на фоне приема АВП;
5) наличие первичного опекуна (родителя(-лей), близких родственников в качестве опекунов, законного представителя, или приемного родителя), который знал лицо в течение минимум 6 месяцев до включения в исследование; 6) наличие способности участвовать во всех аспектах протокола согласно клинической оценке исследователя.
Критериями исключения были: 1) лечение более чем одним антипсихотическим препаратом или более чем тремя психиатрическими препаратам (4 допустимо в случае, если два из них были для лечения синдрома дефицита внимания с гиперактивностью (СДВГ)); 2) антипсихотическое лечение клозапином (который используется исключительно для лечения резистентных состояний); 3) изменение психиатрических препаратов или их доз в течение последних 30 дней; 4) какие-либо препараты, влияющие на уровень глюкозы, инсулина или липидов; 5) какое-либо неврологическое или соматическое заболевание, влияющие на массу тела или физическую активность; 6) ненормальная глюкоза натощак (≥126 мг/дл) или уровень креатинина (>1,3 мг/дл); 7) расстройство зависимости от ПАВ (за исключением табачной зависимости) за последний месяц; 8) текущий или в течение жизни диагноз анорексии или нервной булимии;
8) IQ<55; 9) известная гиперчувствительность к арипипразолу, перфеназину или метформину; 10) предыдущие исследования с арипипразолом или перфеназином, длящиеся более 2 недель и приостановленные по соображениям эффективности или переносимости; 11) значительный риск опасности для себя или окружающих; 12) для участниц женского пола: беременность, уход за ребенком или сексуальная активность с нежеланием придерживаться метода двойной контрацепции. Терапия СДВГ и вальпроаты были разрешены.
Методика
Все 18–19-летние участники и минимум один родитель несовершеннолетнего давали письменное информированное согласие; все участники <18 лет предоставляли согласие несовершеннолетнего. Пригодность пациента к участию в исследовании была определена на основании 3-недельного скринингового периода для установки психиатрического и физического состояния и стабильности.Все пригодные молодые люди проходили обучение ЗОЖ и были рандомизированы на 24-недельное открытое лечение с либо: 1) добавлением метформина (МЕТ); либо:
2) сменой АВП на антипсихотик с более низким кардиометаболическим риском (арипипразол или, если ранее применялся этот препарат, молиндон – до его выхода с рынка США – или перфеназин) (SWITCH); 3) продолжение лечения на текущем АВП (CONTROL). Всем молодым людям, пролеченным метформином, давался ежедневно мультивитамин для профилактики дефицита витамина В12.
Молиндон обычно выбирался для рукава SWITCH, если пациенты показывали значимый набор веса, принимая арипипразол. Он был выбран, так как на нем набирали меньше всего веса в исследовании «Лечение расстройств шизофренического спектра с ранним началом» (the Treatment of Early-Onset Schizophrenia Spectrum Disorders (TEOSS))33. Когда он стал недоступен в США, NIMH настоятельно рекомендовал сохранить сравнение между АВП (арипипразол) и антипсихотиками первого поколения (АПП) в рукаве SWITCH. Среди доступных АПП мы выбрали перфеназин, так как он имел более благоприятный профиль в плане набора веса и метаболических изменений, чем АВП, в проекте «Клинические исследования антипсихотических средств для изучения результативности вмешательств» (the Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE))34.
Рандомизации были осуществлены централизованной компьютеризированной системой. Они были распределены по текущему АВП (рисперидон, арипипразол или «другой антипсихотик») и диагнозу (расстройство шизофренического спектра или другие расстройства). Пациенты, опекуны и члены команды исследователей узнали о рандомизации в конце исходного визита.
Все условия исследования включали 10 амбулаторных визитов (на 0, 1, 2, 4, 6, 8,12, 16, 20 и 24-й неделе) и 6 телефонных сессий (на 3, 5, 7, 9, 10 и 11 неделе). Метаболические показатели оценивались на исходном уровне, на 12 и 24-й неделе.
Психическая симптоматология была оценена в начале исследования и на 12 и 24 неделе независимыми консультантами (терапевты с опытом работы с психически больными молодыми людьми более 2 лет), «ослепленными» по условиям исследования и побочных эффектах терапии, с использованием 21-пунктной Краткой психиатрической оценочной шкалы для детей (The 21-item Brief Psychiatric Rating Scale for Children (BPRS-C)35.
Длительный мониторинг в течение фазы лечения включал повторную оценку психических симптомов, побочных эффектов и приверженности лечения детскими и подростковыми психиатрами, сертифицированными министерством здравоохранения. Повторная оценка психиатрических симптомов была проведена с использованием CGI-I и CGI-S. Побочные эффекты были оценены по Продольной систематической шкале побочных эффектов (the Systematic Longitudinal Adverse Event Scale (SLAES))36, по Шкале экстрапирамидных симптомов Симпсона-Ангус (the Simpson-Angus Extrapyramidal Symptoms Scale (SAEPS))37, по Оценочная шкале акатизии Барнеса (the Barnes Akathisia Rating Scale (BARS))38 и по Шкале ненормальных непроизвольных движений (the Abnormal Involuntary Movement Scale (AIMS))39.
Все метаболические лабораторные показатели на основных посещениях (исходное, 12 недель, 24 недели) были взяты после ночного голодания в течение минимум 8 часов. Измерялись глюкоза, инсулин, триглицериды, общий холестерин, липопротеины высокой плотности (ЛПВП), липопротеины низкой плотности (ЛПНП), холестерин, гомеостатическая модель оценки резистентности к инсулину (HOMA-IR), гемоглобин А1с (HgbA1c) и С-реактивный белок.
Во всех случаях собирались данные самоотчетной приверженности родителей/пациентов относительно всех психотропных средств. Для всех участников, получающих исследуемое средство (например, сменный антипсихотик или метформин), информация собиралась также путем подсчета таблеток на каждой встрече. Для всех пациентов уровни антипсихотиков в крови измерялись на 12 и 24 неделях.
Пациенты могли отказаться от исследования и быть направлены на клиническое лечение на основании либо: 1) запроса участника или законного опекуна, 2) клинической оценки независимого педиатра или консультирующего детского эндокринолога, что метаболические проблемы требуют лечения вне исследования, либо: 3) значительного ухудшения психических симптомов, используя оценку по шкале CGI-I «значительное ухудшение» или «очень значительное ухудшение» на двух последовательных встречах за период ≥2 неделям.
Молодые люди также могли выйти из исследования, если произошли побочные эффекты тяжелой и средней степени тяжести, которые нельзя исправить коррекцией дозы или добавлением допускаемых одновременных четырех средств, или если доказаны местным главным исследователем, как вследствие некомплаентности или клинического статуса.
Условия лечения
Обучение ЗОЖ состояло из обучения стратегиям по улучшению питания и увеличению физической активности, а также регулярного измерения веса40. Частота визитов увеличивалась в случае, если участник набрал 5% или 10% от исходного веса.Для молодых людей, весивших <50 кг, титрация метформина начиналась с 250 мг, принимаемых в обед, которые были увеличены на 250 мг (принимаемых на завтрак) через 1 неделю, и в последующем с шагом в 250 мг на еженедельной основе (принимаемые 2 раза в день, за завтраком и обедом), до достижения 500 мг дважды в день. Для молодых людей, весивших 50–70 кг, максимальная доза метформина была 500 мг утром и 100 мг вечером.
Для молодых людей весом >70 кг титрация метформин а начиналась с 500 мг, принимаемых в обед, которые были увеличены на 500 мг (принимаемые на завтрак) через 1 неделю, и в последующем с шагом в 500 мг на еженедельной основе (принимаемые два раза в день, за завтраком и обедом) до достижения 1000 мг дважды в день.
В ходе постепенной кросс-титрации с исходного АВП на арипипразол, либо перфеназин, исходный АВП удерживался в той же дозе в течение 3 недель, а затем снижался на 25% от исходной дозы в течение 3 недель. Арипипразол начинали с 2 мг/сутки в течение недели, повышая до 5 мг/сут на второй неделе и затем повышая с шагом в 5 мг до максимальных 30 мг/сут. Перфеназин начинали с 4 мг/сут и повышали каждую неделю на 4 мг до максимальных 64 мг/сут.
Как титрация метформина, так и кросс-титрация АВП могли быть изменены на основании клинического ответа.
В рукаве SWITCH на перфеназин, требовался бензотропин 0,5 мг 2 раза в день при достижении дозы перфеназина >8 мг/сут. Метформин мог использоваться, если возникали симптомы желудочно-кишечной непереносимости.
Результаты
Первичным результатом являлось изменение стандартной оценки (z-score) ИМТ. Стандартная оценка ИМТ рассчитывалась с использованием программы, предоставленной Детским исследовательским центром питания (the Children’s Nutrition Research Center) в Baylor College of Medicine. Вторичные показатели включали изменения в других антропометрических показателях, показателях глюкозы и липидов, С-реактивного белка, и шкалы Влияния веса на качество жизни детей child-rated Impact of Weight on Quality of Life-Kids (IWQOL-Kids)41.Показатели безопасности включали продольное наблюдение побочных эффектов, выявленных с использованием SLAES, SAEPS, BARS и AIMS, и психиатрической оценкой «ослепленными» экспертами по CGI-I и BPRS-C.
Статистический анализ
Результаты эффективности субъектов с исходным и ≥1 пост-базовым значением были проанализированы с помощью продольной смешанной модели, вводя предикторы для лечения, посещений (рассматриваемые как категориальная переменная с неструктурированым ковариантной картиной для отражения связей между каждым визитом субъекта), взаимодействия фактора лечения в зависимости от визита и исходным баллом в модель. Средние наименьших квадратов (Least squares means (LSMs)) изменений от исходных были оценены на каждом визите для каждой группы лечения и для различий между каждой парой групп лечения. LSMs были описаны лишь на 12 и 24 неделях. Данные по досрочному завершению терапии с 1 по 11 неделю были перенесены на 12 неделю; данные с 13 по 23 неделю – на 24 неделю. Степени свободы Kenward-Roger42 использовались в знаменателе проверки достоверности для учитывания в множественном сравнении.Время до прерывания лечения было оценено с использованием кривой выживаемости Kaplan-Meier с логарифмическим ранговым критерием для сравнения групп лечения. Демографические данные, побочные эффекты и другие показатели безопасности были суммированы с использованием базовой описательной статистики. Поисковый апостериорный анализ методом c2 сравнивал 3 группы по категориальному набору веса и частоте побочных эффектов без коррекции на множественное сравнение.
На основании вычисления статистической мощности размер выборки в 44 участника в группе (общее N=132) выявил 80% мощность выявления значимых различий относительно первичных результатов, стандартной оценки ИМТ.
РЕЗУЛЬТАТЫ
УчастникиМежду октябрем 2009 и октябрем 2013 года 127 участников были рандомизированы (CONTROL=47; MET=49; SWITCH=31). Анализ побочных эффектов исключил пять участников (CONTROL=2; MET=2; SWITCH=1), которые прекратили лечение без предоставления информации о побочных эффектах после узнавания их рандомизированного распределения. Анализ первичной эффективности включал 121 участника (CONTROL=44; MET=47; SWITCH=30: арипипразол=12, перфеназин=17; молиндон=1) с ≥1 пост-базовым измерением жизненных показателей.
Исходные характеристики
Исходные демографические и клинические характеристики пациентов приведены в Таблице 1. Средний возраст был 13,7±3,3 года, 64,6% были мужчины, и 52,7% были белыми. Первичными диагнозами были расстройства биполярного спектра у 84,2% пациентов, расстройства шизофренического спектра у 9,4% и психотическая депрессия у 6,3%. Наиболее частыми коморбидными диагнозами были СДВГ (35,4%), расстройства аутистического спектра (26,0%), тревожные расстройства (25,2%) и вызывающе-оппозиционное расстройство или расстройство поведения (21,2%). Среди участников 52,0% имели предшествующие госпитализации в психиатрический стационар.Арипипразол (46,4%) и рисперидон (38,6%) были наиболее частыми антипсихотиками, получаемыми исходно. Средней длительностью текущего и общего применения антипсихотиков был период в 21,6±20.4 и 29,9±23,1 месяцев соответственно. Почти половина (43,3%) были лечены последовательно множеством антипсихотиков. Группы лечения значимо не различались по антропометрическим, психиатрическим и метаболическим параметрам в начале исследования.


Лечение
Большинство (72,3%) участников достигли их целевой дозы метформина к 12 неделе. Один дополнительный участник достиг его к 24 неделе. Средние конечные дозы метформина были 1000±500 мг/сут для молодых людей весом <50 кг; 1250±500 мг/сут для тех, кто весит 50–70 кг, и 1766±442 мг/сут для тех, кто >70 кг.Десять (83,3%) участников, сменяющие препарат на арипипразол, достигли целевых доз к 8 неделе; один не смог окончательно прекратить свой исходный АВП. Из тех, кто сменил препарат на перфеназин, 58,8% достигли целевой дозы к 8 неделе; 41,2 не смогли прекратить их исходный АВП. Средние конечные дозы для арипипразола были 12,8±9,0 мг/сутки и 11,6±10,2 мг/сут для перфеназина. Другие психотропные препараты остались практически без изменений в ходе исследования.
Средняя длительность лечения была равна 19,4±8,4 недели для группы CONTROL, 20,3±7,2 недели для MET и 18,2±8,3 недели для SWITCH (р=0,113) с значимым различием между арипипразолом (20,6±8,3 недели), перфеназином (16,9±8,0 недель) и молиндоном (12 недель).
Прекращение лечения от всех причин было значительно выше в группе SWITCH с перфеназином (52,9%), чем во всех других группах (р=0,041; CONTROL=25,5%, MET=21,2%, SWITCH=36,6%, SWITCH с арипипразолом=8,3%), в первую очередь от неадекватной психиатрической эффективности (р=0,0014, CONTROL=6,3%, MET=4,1%, SWITCH с арипипразолом=0%, SWITCH с перфеназином=35,2%). В связи с этим, комитет по мониторингу данных безопасности NIHM закрыл рукав SWITCH с перфеназином 8 февраля 2013 года.
Первичные результаты
Таблица 2 показывает измеренные изменения от исходных к конечным, значения р и размеры эффектов для внутригрупповых изменений, трехстороннего сравнения и, если сравнение было достоверным, попарное групповое сравнение для всех показателей эффективности.Стандартные оценки ИМТ значимо снизились как в группе MET (12 неделя: -0,03±0,01, р=0,019; 24 неделя: -0,09±0,03, р=0,02), так и в группе SWITCH (12 неделя: -0,05±0,02, р=0,008; 24 неделя: -0,11±0,04, р=0,003), в то время как она незначимо увеличилась в группе CONTROL (12 неделя: +0,03±0,01; 24 неделя: +0,04±0,03).
Изменение стандартной оценки ИМТ сильно различалось между тремя группами на 12 неделе (р=0,002) и на 24 неделе (р=0,001), причем как MET (p=0,005 и р=0,002 соответственно), так и SWITCH (p=0,002 в обоих случаях) превосходили группу CONTROL, с размерами эффектов от 0,40 до 0,81 и без значимых различий между MET и SWITCH (Таблица 2 и Рисунок 1).


Вторичные антропометрические результаты
 Все антропометрические показатели имели ту же самую картину, что и первичные результаты (Таблица 2). Вес значимо вырос в группе CONTROL (12 неделя: +1,95±0,36 кг, p<0,0001; 24 неделя: +3,85±0,68 кг, р<0,001), оставаясь практически теми же в группе MET (+0,13±0,31 кг и -0,18±0,64 кг) и группе SWITCH (+0,13±0,4 кг и +0,13±0,86 кг). Трехстороннее сравнение было значимо на 12 неделе (р=0,0002) и на 24 неделе (p<0,0001), причем как MET, так и SWITCH превосходили CONTROL оба раза (размер эффекта от 0,66 до 0,99).
Все антропометрические показатели имели ту же самую картину, что и первичные результаты (Таблица 2). Вес значимо вырос в группе CONTROL (12 неделя: +1,95±0,36 кг, p<0,0001; 24 неделя: +3,85±0,68 кг, р<0,001), оставаясь практически теми же в группе MET (+0,13±0,31 кг и -0,18±0,64 кг) и группе SWITCH (+0,13±0,4 кг и +0,13±0,86 кг). Трехстороннее сравнение было значимо на 12 неделе (р=0,0002) и на 24 неделе (p<0,0001), причем как MET, так и SWITCH превосходили CONTROL оба раза (размер эффекта от 0,66 до 0,99).Снижение веса происходило в 55,1% случаев в MET, 46,7% в SWITCH и 10,6% в CONTROL. Более того, 88,6% субъектов группы CONTROL набрали вес, причем 22,7% из них набрали ≥7% от исходного веса, в сравнении лишь с 6,1% в MET и 9,7% в SWITCH.
Метаболические параметры
Из всех измеренных метаболических параметров только глюкоза натощак на 12 неделе значимо различалась в трехстороннем сравнении (р=0,001), причем MET с большим эффектом (р=0,001, размер эффекта 0,95), а SWITCH со средним эффектом (р=0,036, размер эффекта 0,62) в сравнении с CONTROL. В группе MET также выявилось значимое снижение инсулина (р=0,002) и HOMA-IR (p=0,0002) на 12 неделе и HgbA1c (p=0,028) на 24 неделе. Ни одна из групп не показала значимых изменений в липидах и С-реактивном белке.Психические симптомы
Психические симптомы, оцененные вслепую по BPRS-C, улучшились во всех группах и не различались между группами (к 24 неделе: CONTROL: -4,3±1,7, MET -4,6±1,6; SWITCH -4,8±2,2). Около 1/5 каждой группы показали сильное или значительное улучшение по оцененной вслепую CGI-I. Ухудшение (CGI-I ≥5) произошло в приблизительно 10% группы CONTROL и MET, никто из группы SWITCH с арипипразолом, 52,9% из группы SWITCH с перфеназином и единственный участник из группы SWITCH с молиндоном.Качество жизни, связанное с весом, улучшилось во всех группах, причем единственные различия между вариантами лечения наблюдались по подшкале социальной жизни на 12 неделе (р=0.005), MET превосходит SWITCH (p=0,001), и подшкале физического комфорта на 24 неделе (р=0,026), Switch превосходит CONTROL (p=0,008).
Неблагоприятные события
В Таблице 3 приведены неблагоприятные события с общей разницей между группами лечения р<0,10. Прекращение участия из-за побочных эффектов было нечастым (3/47 в группе CONTROL, 4/46 в группе MET и 1/30 в группе SWITCH).Метформин был связан со значительно большей частотой абдоменалгий как умеренных, так и тяжелых (р=0,0074) и всех степеней тяжести (р=0,0066); инфекций, всех степеней тяжести (р=0,015); сниженного аппетита, всех степеней тяжести (р=0,0016); диареи, всех степеней тяжести (р=0,0016); тошнота или рвота, средней/тяжелой степени тяжести (р=0,020); и недержание кала, всех степеней тяжести (р=0,031).
Перфеназин имел численно, но не статистически, большие пропорции как средней/тяжелой степени тяжести, так и всех степеней тяжести гиперсомнии и всех степеней тяжести начальной инсомнии. Арипипразол имел статистически большую частоту легкой дистонии (р=0,013).
MET была связана со значительно меньшими проблемами с агрессивностью/враждебностью как средней/тяжелой (р=0,038) и всех степеней тяжести (р=0,0043), и имела меньше всех степеней тяжести злости/раздражительности (р=0,0049) и импульсивности (р=0,017).

ОБСУЖДЕНИЕ
Это первое рандомизированное исследование, которое напрямую сравнивает несколько стратегий (поведенческое обучение ЗОЖ, добавление метформина или смена антипсихотика на препарат с меньшим риском метаболических осложнений) для уменьшения набора веса, связанного с антипсихотиками, у молодежи. Результаты, связанные с весом, для MET и SWITCH превосходили CONTROL, с размером эффектов от 0,40 до 0,99, без разницы между друг другом.Поскольку угол наклонной кривой снижения веса в двух активных рукавах оказался линейным, без достижения какого-либо плато в течение 6-месячного периода исследования, требуются более длительные исследования для подтверждения, что преимущества продолжат расти со временем, и для определения момента, когда эти преимущества достигнут плато.
Метаболические преимущества и воспалительные изменения были минимальными и, похоже, уменьшаются со временем. Большинство участников оставались психически стабильными, за исключением рукава SWITCH с перфеназином, который был закрыт из-за частых психиатрических обострений, приводящих к прекращению участия 35,2% участников. В целом как MET, так и SWITCH с арипипразолом хорошо переносились, хотя MET ассоциировался с большей частотой желудочно-кишечных побочных эффектов.
Несмотря на данные побочные эффекты, MET не был связан с большей частотой прекращения лечения по причине побочных эффектов. Эти результаты поддерживает наблюдение, что большая часть желудочно-кишечных побочных эффектов были легкой или средней степени тяжести, возникшими рано в ходе фазы титрования и были по большей части преходящими, или могли решиться уменьшением скорости титрации и/или остановкой на более низкой дозе метформина.
Противоположно и удивительно, что MET был связан с меньшей частотой сообщений о проблемах с агрессией/враждебностью и импульсивностью, чем CONTROL или SWITCH. Остается неясным, может ли это быть связано с меньшим количеством проблем с питанием из-за сниженного аппетита и/или действием метформина на гомеостаз глюкозы в мозге или когнитивные функции, похожие на те, что наблюдаются в животных моделях43,44.
Результаты кардиометаболических и побочных эффектов в основном согласуются с теми, что были в трех более мелких и коротких исследованиях метформина у молодежи, принимающей антипсихотики, демонстрируя остановку дальнейшего набора веса, но минимальную потерю веса с метформином и минимальные метаболические эффекты в ходе исследования. Однако это исследование распространяется на все существующие исследования метформина у лиц, принимающих антипсихотики, демонстрируя также сравнительную пользу для веса со сменой препарата на антипсихотик более низкого риска метаболических осложнений.
Минимальная метаболическая польза метформина согласуется с предшествующими исследованиями и может быть связана с тем фактом, что пациенты выбирались прежде всего по набору веса, а не по метаболическим нарушениям. Тем не менее данные индивидуальных групп несколько отличались от данных исследований у взрослых16–19,34,45,46, в которых ни MET, ни SWITCH не были связаны с потерей веса, а поведенческое обучение ЗОЖ ассоциировалось с дальнейшим набором веса. Это различие может относиться как к нормальным механизмам развития, способствующим продолжающемуся росту молодых людей, так и к длительному применению антипсихотиков у большинства участников.
В добавление, касательно физиологического роста, имеющего место в течение 6-месячного периода исследования, молодые люди в группах MET и SWITCH имели отрицательные стандартные оценки (z-score) ИМТ и процентные изменения ИМТ, скорректированные по полу и возрасту, в то время как молодежь в группе CONTROL претерпели не только увеличение массы тела, но и увеличение в значениях стандартной оценки ИМТ и процентном изменении ИМТ. Этот результат указывает, что относительно нормального развития, MET и SWITCH вели к снижению веса, пока CONTROL ассоциировался с набором веса в добавление к тому, который мог быть ожидаем в ходе роста. Важно, что различия между CONTROL и MET или SWITCH возросли между 12 неделей (размер эффекта 0,67 и 0,66) и 24 неделей (размер эффекта 0,99 и 0,91), говоря о том, что продолжение использования MET или SWITCH с вероятностью увеличит пользу.
Высокая частота декомпенсации на перфеназине, основанная на «ослепленной» оценке по CGI-I и BPRS-C, не ожидалась, принимая во внимание, что этот препарат имел сравнительную эффективность со множеством АВП у взрослых с шизофренией33. Но его эффективность при детских психотических и аффективных расстройствах никогда не оценивалась. Наблюдаемая декомпенсация не кажется вызванной слишком быстрой сменой препарата (принимая во внимание медленную постепенную кросс-титрацию и факт, что 41,2% участников не смогли прекратить принимать их исходной антипсихотик) или экстрапирамидными побочными эффектами (учитывая использование профилактического антихолинергического лечения и лишь легкие паркинсонические симптомы у двух пациентов). Однако, нежелательные явления ограничили нашу возможность увеличить дозу перфеназина так, как нам бы хотелось, что говорит о низком соотношении «риск – польза» для перфеназина у молодежи.
Данные этого исследования должны быть интерпретированы согласно его ограничениям. Во-первых, хоть это и было самым крупным исследованием метформина, проведенным в настоящее время у молодых людей, принимающих антипсихотики, размеры отдельных групп были средними, особенно в рукаве SWITCH, и вторичный анализ не был скорректирован на множественную проверку. Метаболические изменения могли бы быть более достоверными в большей выборке.
Во-вторых, было небольшое количество участников в рукаве SWITCH. Причины включали приостановленную рандомизацию с того момента, как молиндон прекратил выход на рынок США, до утверждения рукава SWITCH с перфеназином, и последующей остановке смены на перфеназин из-за возросшего психического ухудшения участников. Так как SWITCH с перфеназином плохо переносился и приводил к последующему прекращению лечения из-за неэффективности, дополнительные агенты с более низким потенциалом набора веса нужно исследовать. В этом контексте остается неясным, будут ли в этом исследовании иметь схожие со SWITCH эффекты смены одного препарата с низким риском, такие как арипипразол, на другой препарат низкого риска, включая зипрасидон и луразидон, или (основываясь на данных по взрослым) карипразин или брекспипразол5,47,48.
В-третьих, мы не сравнивали MET и SWITCH с официальными мерами снижения веса, но вместо этого использовали обучение ЗОЖ, состоящее из образования и строгого мониторинга веса. Будущие исследования необходимы для изучения эффективности официальных стратегий снижения веса у молодежи, принимающей антипсихотики, с избыточным весом / ожирением. Хоть и предыдущие исследования говорили, что официальные стратегии снижения веса были эффективны у взрослых с набором веса, вызванным антипсихотиками18, но крупнейшее исследование по использованию поведенческих мер снижения веса у взрослых, принимающих антипсихотики, не показало их превосходства над стандартным лечением22.
В-четвертых, исследование было открытым, без контроля плацебо, которое, вероятно, повлияло на то, что некоторые участники прекратили участие сразу после рандомизации. Но открытое лечение повысило экологическую валидность наших данных, большая часть результатов были объективными показателями и BPRS-C и CGI оценивались «ослепленными» экспертами, минимизируя риск системных ошибок.
В-пятых, мы остановили выбор на достаточно медленной титрации метформина в течение 4 недель с целью уменьшить дозозависимые и зависимые от титрации побочные эффекты, которые могли увеличить частоту нежелательных выбываний из исследования. Хотя более быстрая титрация метформина могла привести к большим эффектам, тем более что линейный наклон изменения стандартный оценки ИМТ не предполагает большого увеличения эффективности по мере достижения более высокой дозы.
В-шестых, пациенты могли принимать в общей сложности три (или четыре, если 2 препарата использовались при СДВГ) психотропных препарата. В то же время эффекты сопутствующих препаратов могли потенциально исказить результаты, методология этого исследования удостоверяет большую обобщаемость, так как пациенты, принимающие антипсихотики, часто принимают множество психотропных препаратов. Далее, рандомизированные группы отличались лишь на 3–5%, принимая во внимание применение психостимуляторов и антидепрессантов, и 8–14%, рассматривая прием тимостабилизаторов.
Наконец, хотя частота сопутствующего применения психостимуляторов была относительно высока среди трех экспериментальных групп (40–45%), это вряд ли повлияло на результаты. Предшествующие исследования показали, что набор веса, связанный с антипсихотиками, не тормозится и не уменьшается при сопутствующем использовании психостимуляторов49,50. Более того, все пациенты в этом исследовании имели значительную прибавку в весе, несмотря на факт того, что они получали сопутствующие психостимуляторы, что не менялось в ходе исследования.
В качестве резюме, наши результаты свидетельствуют, что как MET, так и смена на арипипразол снижают бремя набора веса, связанного с АВП, у молодых людей. Необходимы дальнейшие исследования для определения, может ли, как доказано для взрослых21, польза от MET быть сильнее у молодежи с более ограниченной прибавкой веса или в ходе начала приема антипсихотиков51. Однако минимальный наблюдаемый эффект на метаболические показатели требует рутинного мониторинга метаболических показателей и тщательного рассмотрения других стратегий лечения с более низким риском набора веса до начала применения антипсихотика52.
Далее, хоть и смена на арипипразол была связана со значительным снижением показателей веса по сравнению с контрольной группой, большая частота его текущего (46,4%) и предшествующего (26,0%) применения в данной выборке говорит, что ограниченная субпопуляция детей может иметь выгоду от этой стратегии. Оценка других возможных препаратов на смену, профилактическое использование метформина, других препаратов, которые могут уменьшить набор веса, связанный с антипсихотиками, и возможный положительный эффект MET на агрессию требуется для молодежи.
Благодарности
Исследование IMPACT было поддержано грантами NIMH (R01 MH080270, R01 MH080274, RR118535 и R01 MH080325). В добавление, некоторые методики были поддержаны the Johns Hopkins Institute for Clinical and Translational Research (NIH UL1TR001079), the National Institute of Health Clinical and Translational Science Award (CTSA) program at University of North Carolina, Chapel Hill (RR0046 and UL1TR001111), и the University of Maryland School of Medicine General Clinical Research Center and Mid-Atlantic Nutrition Obesity Research Center (2P30DK072488-11). NIMH не имел роли в дизайне и проведении исследования; сборе, управлении, анализе или интерпретации данных; подготовке, правке или одобрении рукописи; или решении о публикации рукописи. Авторы хотели бы поблагодарить участвовавших пациентов и их семьи, которые способствовали выполнению этого исследования. Они также благодарны исследовательской группе, которая помогла провести исследование, и работникам здравоохранения, направлявшим возможных участников. Наконец, они хотели бы поблагодарить M. Freemark, J. Newcomer и S. Snitker за их советы в разработке дизайна исследования.
DOI:10.1002/wps.20714
Список исп. литературыСкрыть список1. Olfson M, Blanco C, Wang S et al. National trends in the mental health care of children, adolescents, and adults by office-based physicians. JAMA Psychiatry 2014;71:81-90
2. Vancampfort D, Correll CU, Galling B et al. Diabetes mellitus in people with schizophrenia, bipolar disorder and major depressive disorder: a systematic review and large scale meta-analysis. World Psychiatry 2016;15:166-74.
3. Vancampfort D, Stubbs B, Mitchell AJ et al. Risk of metabolic syndrome and its components in people with schizophrenia and related psychotic disorders, bipolar disorder and major depressive disorder: a systematic review and meta-analysis. World Psychiatry 2015;14:339-47.
4. De Hert M, Detraux J, van Winkel R et al. Metabolic and cardiovascular adverse effects associated with antipsychotic drugs. Nat Rev Endocrinol 2011;8:114-26.
5. Correll CU, Manu P, Olshanskiy V et al. Cardiometabolic risk of second-generation antipsychotic medications during first-time use in children and adolescents. JAMA 2009;302:1765-73.
6. Galling B, Roldan A, Nielsen RE et al. Type 2 diabetes mellitus in youth exposed to antipsychotics: a systematic review and meta-analysis. JAMA Psychiatry 2016;73:247-59.
7. Arango C, Giraldez M, Merchan-Naranjo J et al. Second-generation antipsychotic use in children and adolescents: a six-month prospective cohort study in drug-naive patients. J Am Acad Child Adolesc Psychiatry 2014;53:1179-90.
8. Correll CU, Solmi M, Veronese N et al. Prevalence, incidence and mortality from cardiovascular disease in patients with pooled and specific severe mental illness: a large-scale meta-analysis of 3,211,768 patients and 113,383,368 controls. World Psychiatry 2017;16:163-80.
9. Morrato EH, Campagna EJ, Brewer SE et al. Metabolic testing for adults in a state Medicaid program receiving antipsychotics: remaining barriers to achieving population health prevention goals. JAMA Psychiatry 2016;73:721-30.
10. Mitchell AJ, Delaffon V, Vancampfort D et al. Guideline concordant monitoring of metabolic risk in people treated with antipsychotic medication: systematic review and meta-analysis of screening practices. Psychol Med 2012;42:125-47.
11. Morrato EH, Nicol GE, Maahs D et al. Metabolic screening in children receiving antipsychotic drug treatment. Arch Pediatr Adolesc Med 2010;164:344-51.
12. Rodday AM, Parsons SK, Mankiw C et al. Child and adolescent psychiatrists’ reported monitoring behaviors for second-generation antipsychotics. J Child Adolesc Psychopharmacol 2015;25:351-61.
13. Raebel MA, Penfold R, McMahon AW et al. Adherence to guidelines for glucose assessment in starting second-generation antipsychotics. Pediatrics 2014;134:e1308-14.
14. Vancampfort D, Firth J, Correll CU et al. The impact of pharmacological and non-pharmacological interventions to improve physical health outcomes in people with schizophrenia: a meta-review of meta-analyses of randomized controlled trials. World Psychiatry 2019;18:53-66.
15. Firth J, Siddiqi N, Koyanagi A et al. The Lancet Psychiatry Commission: a blueprint for protecting physical health in people with mental illness. Lancet Psychiatry 2019;6:675-712.
16. Must A, Jacques PF, Dallal GE et al. Long-term morbidity and mortality of overweight adolescents – a follow-up of the Harvard Growth Study of 1922 to 1935. N Engl J Med 1992;327:1350-5.
17. Baker JL, Olsen LW, Sorensen TI. Childhood body-mass index and the risk of coronary heart disease in adult. N Engl J Med 2007;357:2329-37.
18. Speyer H, Jakobsen AS, Westergaard C et al. Lifestyle interventions for weight management in people with serious mental illness: a systematic review with meta-analysis, trial sequential analysis, and meta-regression analysis exploring the mediators and moderators of treatment effects. Psychother Psychosom (in press).
19. Mukundan A, Faulkner G, Cohn T et al. Antipsychotic switching for people with schizophrenia who have neuroleptic-induced weight or metabolic problems. Cochrane Database Syst Rev 2010;12:CD006629.
20. Correll CU, Maayan L, Kane J et al. Efficacy for psychopathology and body weight and safety of topiramate-antipsychotic cotreatment in patients with schizophrenia spectrum disorders: results from a meta-analysis of randomized controlled trials. J Clin Psychiatry 2016;77:e746-56.
21. Zheng W, Li XB, Tang YL et al. Metformin for weight gain and metabolic abnormalities associated with antipsychotic treatment: meta-analysis of randomized placebo-controlled trials. J Clin Psychopharmacol 2015;35:499-509.
22. Speyer H, Norgaard HCB, Birk M et al. The CHANGE trial: no superiority of lifestyle coaching plus care coordination plus treatment as usual compared to treatment as usual alone in reducing risk of cardiovascular disease in adults with schizophrenia spectrum disorders and abdominal obesity. World Psychiatry 2016;15:155-65.
23. Detke HC, DelBello MP, Landry J et al. A 52-week study of olanzapine with a randomized behavioral weight counseling intervention in adolescents with schizophrenia or bipolar I disorder. J Child Adolesc Psychopharmacol 2016;26:922-34.
24. Malin SK, Kashyap SR. Effects of metformin on weight loss: potential mechanisms. Curr Opin Endocrinol Diabetes Obes 2014;21:323-9.
25. Klein DJ, Cottingham EM, Sorter M et al. A randomized, double-blind, placebo-controlled trial of metformin treatment of weight gain associated with initiation of atypical antipsychotic therapy in children and adolescents. Am J Psychiatry 2006;163:2072-9.
26. Arman S, Sadramely MR, Nadi M et al. A randomized, double-blind, placebo-controlled trial of metformin treatment for weight gain associated with initiation of risperidone in children and adolescents. Saudi Med J 2008;29:1130-4.
27. Anagnostou E, Aman MG, Handen BL et al. Metformin for treatment of overweight induced by atypical antipsychotic medication in young people with autism spectrum disorder: a randomized clinical trial. JAMA Psychiatry 2016;73:928-37.
28. Reeves GM, Keeton C, Correll CU et al. Improving metabolic parameters of antipsychotic child treatment (IMPACT) study: rationale, design, and methods. Child Adolesc Psychiatry Ment Health 2013;7:31.
29. Leibenluft E, Charney DS, Towbin KE et al. Defining clinical phenotypes of juvenile mania. Am J Psychiatry 2003;160:430-7.
30. Kaufman J, Birmaher B, Brent D et al. Schedule for Affective Disorders and Schizophrenia for School-Age Children – Present and Lifetime Version (K-SADS-PL): initial reliability and validity data. J Am Acad Child Adolesc Psychiatry 1997;36:980-8.
31. Busner J, Targum SD. The Clinical Global Impressions Scale: applying a research tool in clinical practice. Psychiatry 2007;4:28-37.
32. Chapman LE, Darling AL, Brown JE. Association between metformin and vitamin B12 deficiency in patients with type 2 diabetes: a systematic review and meta-analysis. Diabetes Metab 2016;42:316-27.
33. Sikich L, Frazier JA, McClellan J et al. Double-blind comparison of first- and second-generation antipsychotics in early-onset schizophrenia and schizo-affective disorder: findings from the Treatment of Early-Onset Schizophrenia Spectrum Disorders (TEOSS) study. Am J Psychiatry 2008;165:1420-31.
34. Lieberman JA, Stroup TS, McEvoy JP et al. Effectiveness of antipsychotic drugs in patients with chronic schizophrenia. N Engl J Med 2005;353:1209-23.
35. Hughes CW, Rintelmann J, Emslie GJ et al. A revised anchored version of the BPRS-C for childhood psychiatric disorders. J Child Adolesc Psychopharmacol 2001;11:77-93.
36. Greenhill LL, Vitiello B, Fisher P et al. Comparison of increasingly detailed elicitation methods for the assessment of adverse events in pediatric psychopharmacology. J Am Acad Child Adolesc Psychiatry 2004;43:1488-96.
37. Simpson GM, Angus JW. A rating scale for extrapyramidal side effects. Acta Psychiatr Scand 1970;45(Suppl. 212):11-9.
38. Barnes TR. A rating scale for drug-induced akathisia. Br J Psychiatry 1989;154:672-6.
39. Lane RD, Glazer WM, Hansen TE et al. Assessment of tardive dyskinesia using the Abnormal Involuntary Movement Scale. J Nerv Ment Dis 1985;173:353-7.
40. Barlow SE. Expert committee recommendations regarding the prevention, assessment, and treatment of child and adolescent overweight and obesity: summary report. Pediatrics 2007;120(Suppl. 4):S164-92.
41. Kolotkin RL, Crosby RD, Corey-Lisle PK et al. Performance of a weight-related measure of quality of life in a psychiatric sample. Qual Life Res 2006;15:587-96.
42. Arnau J, Bendayan R, Blanca MJ et al. Should we rely on the Kenward-Roger approximation when using linear mixed models if the groups have different distributions? Br J Math Statist Psychol 2014;67:408-29.
43. Derakhshan F, Toth C. Insulin and the brain. Curr Diabetes Rev 2013;9:102-16.
44. Mostafa DK, Ismail CA, Ghareeb DA. Differential metformin dose-dependent effects on cognition in rats: role of Akt. Psychopharmacology 2016;233:2513-24.
45. Stroup TS, McEvoy JP, Ring KD et al. A randomized trial examining the effectiveness of switching from olanzapine, quetiapine, or risperidone to aripiprazole to reduce metabolic risk: comparison of antipsychotics for metabolic problems (CAMP). Am J Psychiatry 2011;168:947-56.
46. Correll CU. Antipsychotic use in children and adolescents: minimizing adverse effects to maximize outcomes. J Am Acad Child Adolesc Psychiatry 2008;47:9-20.
47. Kane JM, Skuban A, Hobart M et al. Overview of short- and long-term tolerability and safety of brexpiprazole in patients with schizophrenia. Schizophr Res 2016;174:93-8.
48. Citrome L. Cariprazine for the treatment of schizophrenia: a review of this dopamine D3-preferring D3/D2 receptor partial agonist. Clin Schizophr Relat Psychoses 2016;10:109-19.
49. Aman MG, Binder C, Turgay A. Risperidone effects in the presence/absence of psychostimulant medicine in children with ADHD, other disruptive behavior disorders, and subaverage IQ. J Child Adolesc Psychopharmacol 2004;14:243-54.
50. Penzner JB, Dudas M, Saito E et al. Lack of effect of stimulant combination with second-generation antipsychotics on weight gain, metabolic changes, prolactin levels, and sedation in youth with clinically relevant aggression or oppositionality. J Child Adolesc Psychopharmacol 2009;19:563-73.
51. Correll CU, Sikich L, Reeves G et al. Metformin for antipsychotic-related weight gain and metabolic abnormalities: when, for whom, and for how long? Am J Psychiatry 2013;170:947-52.
52. Correll CU, Blader JC. Antipsychotic use in youth without psychosis: a double-edged sword. JAMA Psychiatry 2015;72:859-60.


