Психиатрия Всемирная психиатрия
Психиатрия Всемирная психиатрия
№01 2019
Влияние фармакологических и нефармакологических методов интервенции на улучшение показателей физического здоровья у людей с шизофренией: мета-обзор мета-анализов рандомизированных клинических исследований №01 2019
Номера страниц в выпуске:54-66
Перевод: Шишорин Родион (Москва)
Редактура: к.м.н. Бойко А.С. (Томск)
Резюме
Мы объединили и сравнили мета-анализы фармакологических и нефармакологических мер, направленных на показатели физического здоровья людей с расстройствами шизофренического спектра. Большая часть баз данных была просмотрена до 1 июня 2018 года. Из 3709 совпадений при поиске было включено 27 мета-анализов, представляющих 128 мета-проанализированных исследований и 47 231 обследованного участника.
В целом мета-анализы характеризуются адекватностью и высоким качеством, но анализируемые исследования – в меньшей степени. Наиболее эффективными мерами по снижению веса были индивидуальное консультирование по образу жизни (стандартная разница средних – standardized mean difference, SMD=-0,98)) и применение физических упражнений (SMD=-0,96), за которыми следуют обучение психологической самопомощи (SMD=-0,77), поддержка арипипразолом (SMD=-0,73), применение топирамата (SMD=-0,72), d-фенфлурамина (SMD=-0,54) и метформина (SMD=-0,53). Относительно уменьшение окружности талии поддержка арипипразолом (SMD=-1,10) и применение топирамата (SMD=-0,69) показали наилучшую достоверность, потом следует контроль за питанием (SMD=-0,39). Контроль за питанием был единственной мерой, которая достоверно улучшала (диастолическое) артериальное давление (SMD=-0,39). Смена препарата с оланзапина на кветиапин или арипипразол (SMD=-0,71) и применение метформина (SMD=-0,65) показали наибольшую эффективность по снижению уровня глюкозы крови, за чем следовали применение агонистов рецепторов глюкагоноподобного пептида-1 (SMD=-0,39), контроль за питанием (SMD=-0,37) и поддержка арипипразолом (SMD=-0,34); в свою очередь преодолевать инсулинорезистентность удавалось лучше всего с метформином (SMD=-0,75) и розиглитазоном (SMD=-0,44). Топирамат имел наибольший эффект относительно концентраций триглицеридов (SMD=-0,68) и липопротеинов низкой плотности (ЛПНП) (SMD=-0,80); в свою очередь метформин имел наиболее благоприятный эффект на общий холестерин (SMD=-0,51) и липопротеины высокой плотности (ЛПВП) (SMD=-0,45). Коррекция образа жизни давала малый эффект относительно триглицеридов, общего холестерина и ЛПНП (SMD= от -0,35 до -0,37). Только применение физических упражнений увеличивало толерантность к физической нагрузке (SMD=1,81). Несмотря на частые физические сопутствующие заболевания и преждевременную смертность, главным образом из-за этих повышенных рисков для физического здоровья, современные данные о фармакологических и немедикаментозных вмешательствах у людей с шизофренией для профилактики и лечения этих состояний по-прежнему ограничены, и в ближайшее время требуется больше масштабных исследований в этом направлении.
Ключевые слова: шизофрения, психоз, физическое здоровье, масса тела, артериальное давление, глюкоза, инсулин, триглицериды, холестерин, консультирование по образу жизни, физическая активность, контроль за питанием, метформин, топирамат, смена антипсихотиков.
Редактура: к.м.н. Бойко А.С. (Томск)
Резюме
Мы объединили и сравнили мета-анализы фармакологических и нефармакологических мер, направленных на показатели физического здоровья людей с расстройствами шизофренического спектра. Большая часть баз данных была просмотрена до 1 июня 2018 года. Из 3709 совпадений при поиске было включено 27 мета-анализов, представляющих 128 мета-проанализированных исследований и 47 231 обследованного участника.
В целом мета-анализы характеризуются адекватностью и высоким качеством, но анализируемые исследования – в меньшей степени. Наиболее эффективными мерами по снижению веса были индивидуальное консультирование по образу жизни (стандартная разница средних – standardized mean difference, SMD=-0,98)) и применение физических упражнений (SMD=-0,96), за которыми следуют обучение психологической самопомощи (SMD=-0,77), поддержка арипипразолом (SMD=-0,73), применение топирамата (SMD=-0,72), d-фенфлурамина (SMD=-0,54) и метформина (SMD=-0,53). Относительно уменьшение окружности талии поддержка арипипразолом (SMD=-1,10) и применение топирамата (SMD=-0,69) показали наилучшую достоверность, потом следует контроль за питанием (SMD=-0,39). Контроль за питанием был единственной мерой, которая достоверно улучшала (диастолическое) артериальное давление (SMD=-0,39). Смена препарата с оланзапина на кветиапин или арипипразол (SMD=-0,71) и применение метформина (SMD=-0,65) показали наибольшую эффективность по снижению уровня глюкозы крови, за чем следовали применение агонистов рецепторов глюкагоноподобного пептида-1 (SMD=-0,39), контроль за питанием (SMD=-0,37) и поддержка арипипразолом (SMD=-0,34); в свою очередь преодолевать инсулинорезистентность удавалось лучше всего с метформином (SMD=-0,75) и розиглитазоном (SMD=-0,44). Топирамат имел наибольший эффект относительно концентраций триглицеридов (SMD=-0,68) и липопротеинов низкой плотности (ЛПНП) (SMD=-0,80); в свою очередь метформин имел наиболее благоприятный эффект на общий холестерин (SMD=-0,51) и липопротеины высокой плотности (ЛПВП) (SMD=-0,45). Коррекция образа жизни давала малый эффект относительно триглицеридов, общего холестерина и ЛПНП (SMD= от -0,35 до -0,37). Только применение физических упражнений увеличивало толерантность к физической нагрузке (SMD=1,81). Несмотря на частые физические сопутствующие заболевания и преждевременную смертность, главным образом из-за этих повышенных рисков для физического здоровья, современные данные о фармакологических и немедикаментозных вмешательствах у людей с шизофренией для профилактики и лечения этих состояний по-прежнему ограничены, и в ближайшее время требуется больше масштабных исследований в этом направлении.
Ключевые слова: шизофрения, психоз, физическое здоровье, масса тела, артериальное давление, глюкоза, инсулин, триглицериды, холестерин, консультирование по образу жизни, физическая активность, контроль за питанием, метформин, топирамат, смена антипсихотиков.
Перевод: Шишорин Родион (Москва)
Редактура: к.м.н. Бойко А.С. (Томск)
Резюме
Мы объединили и сравнили мета-анализы фармакологических и нефармакологических мер, направленных на показатели физического здоровья людей с расстройствами шизофренического спектра. Большая часть баз данных была просмотрена до 1 июня 2018 года. Из 3709 совпадений при поиске было включено 27 мета-анализов, представляющих 128 мета-проанализированных исследований и 47 231 обследованного участника.
В целом мета-анализы характеризуются адекватностью и высоким качеством, но анализируемые исследования – в меньшей степени. Наиболее эффективными мерами по снижению веса были индивидуальное консультирование по образу жизни (стандартная разница средних – standardized mean difference, SMD=-0,98)) и применение физических упражнений (SMD=-0,96), за которыми следуют обучение психологической самопомощи (SMD=-0,77), поддержка арипипразолом (SMD=-0,73), применение топирамата (SMD=-0,72), d-фенфлурамина (SMD=-0,54) и метформина (SMD=-0,53). Относительно уменьшение окружности талии поддержка арипипразолом (SMD=-1,10) и применение топирамата (SMD=-0,69) показали наилучшую достоверность, потом следует контроль за питанием (SMD=-0,39). Контроль за питанием был единственной мерой, которая достоверно улучшала (диастолическое) артериальное давление (SMD=-0,39). Смена препарата с оланзапина на кветиапин или арипипразол (SMD=-0,71) и применение метформина (SMD=-0,65) показали наибольшую эффективность по снижению уровня глюкозы крови, за чем следовали применение агонистов рецепторов глюкагоноподобного пептида-1 (SMD=-0,39), контроль за питанием (SMD=-0,37) и поддержка арипипразолом (SMD=-0,34); в свою очередь преодолевать инсулинорезистентность удавалось лучше всего с метформином (SMD=-0,75) и розиглитазоном (SMD=-0,44). Топирамат имел наибольший эффект относительно концентраций триглицеридов (SMD=-0,68) и липопротеинов низкой плотности (ЛПНП) (SMD=-0,80); в свою очередь метформин имел наиболее благоприятный эффект на общий холестерин (SMD=-0,51) и липопротеины высокой плотности (ЛПВП) (SMD=-0,45). Коррекция образа жизни давала малый эффект относительно триглицеридов, общего холестерина и ЛПНП (SMD= от -0,35 до -0,37). Только применение физических упражнений увеличивало толерантность к физической нагрузке (SMD=1,81). Несмотря на частые физические сопутствующие заболевания и преждевременную смертность, главным образом из-за этих повышенных рисков для физического здоровья, современные данные о фармакологических и немедикаментозных вмешательствах у людей с шизофренией для профилактики и лечения этих состояний по-прежнему ограничены, и в ближайшее время требуется больше масштабных исследований в этом направлении.
Ключевые слова: шизофрения, психоз, физическое здоровье, масса тела, артериальное давление, глюкоза, инсулин, триглицериды, холестерин, консультирование по образу жизни, физическая активность, контроль за питанием, метформин, топирамат, смена антипсихотиков.
(World Psychiatry 2019;18(1):53–66)
Люди с шизофренией имеют значительно худшее физическое здоровье в сравнении с общей популяцией1-4, что часто связывают с взаимодействием между социальными обстоятельствами, факторами образа жизни и эффектами терапии5. Например, поведенческие исследования показали, что люди с шизофренией малоактивны физически и демонстрируют преобладание сидячего образа жизни по сравнению с общей популяцией6, употребляют большие объемы пищи, зачастую плохого качества7 и имеют больше вредных привычек, таких как курение8. Более того, психиатрическое лечение антипсихотиками и другими назначаемыми препаратами, такими как нормотимики и антидепрессанты, еще больше увеличивают риск соматических заболеваний9,10. Как следствие, люди с шизофренией чаще имеют кардиометаболические заболевания11-13, респираторные заболевания14, хронические боли15, получают переломы16 и обладают низкой физической подготовкой17,18 по сравнению с общей популяцией.
Такой повышенный соматический риск ассоциирован со снижением качества жизни пациентов из-за нехватки физического компонента здоровья19,20, но, несмотря на повышенный риск, доступность наблюдения за здоровьем, медицинской помощи и методов интервенции для лиц с шизофренией является недостаточной в сравнении с общей популяцией21,22. В результате люди с шизофренией имеют дефицит в ожидаемой продолжительности жизни в 10-20 лет, в первую очередь из-за худшего соматического здоровья13,23. Кроме того, неравенства в отношении физического здоровья, с которыми сталкиваются люди с шизофренией, наблюдаются во всем мире24 и не улучшаются с течением времени25.
В связи с таким явным несоответствием, отмечался значительный рост усилий по улучшению физического здоровья этой популяции группы риска5,26. Для устранения различий в физическом здоровье ряд отдельных мета-анализов привел к национальным и международным научно обоснованным рекомендациям за или против конкретных вариантов фармакологического и нефармакологического методов интервенции27-34.
Несмотря на быстрое расширение мета-аналитических данных о методах интервенции в целях борьбы с плохим физическим здоровьем у людей с шизофренией, отсутствует обобщение этих высококачественных доказательств, равно как и прямого количественного сравнения доказательств между всеми индивидуальными и/или комбинированными фармакологическими и нефармакологическими стратегиями. Более того, не было достаточным образом оценено качество этих мета-анализов и включенных статей, что является обязательным шагом перед тем, как с уверенностью могут быть сделаны более серьезные рекомендации по лечению.
С целью заполнения данного пробела литературы, мы поставили перед собой задачу собрать в целое существующие высококачественные доказательства из наиболее последних/масштабных мета-анализов рандомизированных исследований методов интервенции по улучшению физического здоровья, чтобы определить сравнительное качество доказательств и величину эффективности фармакологических и нефармакологических методов, направленных на улучшение показателей физического здоровья среди лиц с расстройствами шизофренического спектра.
Поиск
Четверо авторов, независимо друг от друга, искали в базах данных MEDLINE/PubMed, PsycINFO, EMBASE и Cochrane, начиная с их соответствующих исходных дат и заканчивая 1 июня 2018 г., без языковых ограничений, мета-анализы рандомизированных контролируемых исследований лиц с расстройствами шизофренического спектра, в которых улучшение физического здоровья было первичным результатом.
Поисковые слова включали («мета-анализ» ИЛИ «систематический обзор») И («случайный» ИЛИ «плацебо» ИЛИ «контроль») И («шизофрения» ИЛИ «шизоаффективный» ИЛИ «шизофреническое расстройство» ИЛИ «психоз» ИЛИ «психотический» ИЛИ «тяжелое психическое расстройство») И («физическое здоровье» ИЛИ «кардио*» ИЛИ «метабол*» ИЛИ «респир*» ИЛИ «*вес» ИЛИ «боль» ИЛИ «соматический») Мы просмотрели списки литературы всех включенных статей.
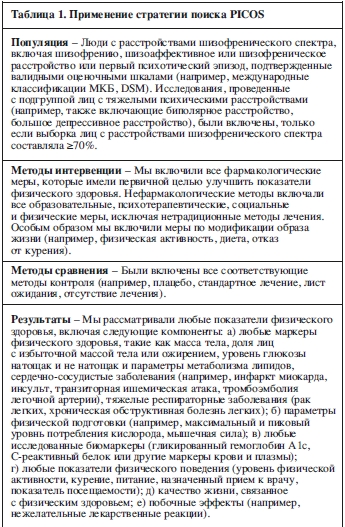 Критерии включения
Критерии включения
Критерии включения были составлены в соответствии со структурой отчетности, включающей популяцию, методы интервенции и сравнения, результаты и учреждение/дизайн исследования (Population, Interventions, Comparisons, Outcomes and Setting/study design – PICOS) (см. таблицу 1).
Извлечение данных, результаты и синтез данных
Рассматривая эффективность и нежелательные лекарственные реакции, мы вручную извлекли данные о величине эффекта (с 95% доверительным интервалом, ДИ) для всех соответствующих показателей, а также количество испытуемых в исследуемой и контрольной группах для каждой величины эффекта. В частности, данные по величине эффекта непрерывных показателей были извлечены или пересчитаны в виде стандартной разницы средних (SMD), которая выражает разницу средних между исследуемой и контрольной группами в единицах стандартного отклонения с 95% ДИ. В целом значение SMD меньше 0,2 рассматривается как статистически незначимая, SMD между 0,2 и 0,5 является малой, SMD между 0,5 и 0,8 – средняя, а SMD более 0,8 является большой35. Отношение рисков (risk ratio, RR) использовалось для категориальных показателей. Если присутствовало значение отношения шансов, оно было пересчитано как отношение рисков. Для обоих типов показателей мы следовали решениям изначальных авторов относительно моделей с фиксированными и случайными эффектами.
Оценка качества проанализированных исследований
Включенные мета-анализы были оценены с помощью «Измерительного инструмента для оценки систематических обзоров» («A Measurement Tool to Assess Systematic Reviews» (AMSTAR)) (диапазон оценок 0-11, где оценка выше 8 обозначает высокое качество)36.
Несмотря на то, что AMSTAR надежный и достоверный инструмент для оценки методологического качества мета-анализов, значение его оценки не отражает качества проанализированных исследований, которые могут привнести систематическую ошибку в общий результат. Например, мета-анализ, удовлетворяющий всем критериям качества, но анализирующий возможно необъективные исследования, может иметь хорошую оценку по методологическому качеству, но иметь низкое качество по содержанию.
Поэтому для более комплексной оценки достоверности содержания включенных мета-анализов мы использовали набор из шести дополнительных, ранее разработанных пунктов, оценивающих качество, каждый в диапазоне между 0 и 1 или 2, который оценивает качество содержания проанализированных статей (AMSTAR-Plus Content, диапазон оценок 0-8, где оценка выше 4 обозначает высокое качество)37.
Статистический анализ
Мы проанализировали данные в том виде, в каком они были напрямую взяты из опубликованных мета-анализов, или, при необходимости, после их приведения к стандартизированным показателям, используя комплексный мата-анализ (КМА, 3 версия (Comprehensive Meta-Analysis, CMA)) (Biostat). Для сравнения SMD экспериментальных фармакологических и нефармакологических методов интервенции и контрольных вмешательств мы провели раздельный мета-анализ случайных эффектов для каждой переменной, используя КМА.
Оценки AMSTAR и AMSTAR-plus Content и размеры выборки использовались там, где было возможно в мета-регрессионном анализе, который проводился отдельно для фармакологических и нефармакологических стратегий. При возможности мы также проводили мета-регрессионный анализ и анализ в подгруппах для изучения предполагаемых факторов, которые могли влиять на размер эффекта для каждого показателя физического здоровья в отдельности, включая характеристики участников (например, средний возраст, соотношение полов) и дизайн метода интервенции (длительность лечения в неделях, оказание помощи психиатрической или терапевтической службой, лечебное учреждение, доля посещенных консультаций/приверженность, групповое или индивидуальное лечение).
Гетерогенность была оценена с помощью Q- и I2-статистики, где значения <25%, 25-50% и >50% обозначают низкую, среднюю и высокую гетерогенность соответственно. Если было невозможно извлечь данные по размеру эффекта для комплексного мета-анализа, мы сообщали о результатах на уровне отдельного исследования в наративном синтезе.
Результаты систематического поиска
Из 3709 поисковых совпадений были включены 27 мета-анализов39-65, представляющих в общей сложности 128 проанализированных исследований и 47 231 участника исследований.
Имелись мета-аналитические данные для 17 различных фармакологических методов интервенции: арипипра-зол 43,47,53,55, флуоксетин55, метформин46,48,49,54,55,61,62, низатидин54,55, антигонисты NMDA-рецепторов, включая амантадин и мемантин45,55,57,60, ранитидин42, топирамат39, метформин в комбинации с сибутрамином64, орлистат64, розиглитазон64, флувоксамин64, агонисты рецепторов глюкагоноподобного пептида-1 (аГПП-1)40 и смена препарата с оланзапина на кветиапин или апипразол65.
Были доступны мета-аналитические данные по 6 нефармакологическим методам интервенции: индивидуальное консультирование по образу жизни58,59,63, групповое консультирование по образу жизни58,59,63, когнитивно-поведенческая терапия58,59, обучение психологической самопомощи58, физические упражнения50, 56,58 и контроль за питанием44,58. Один мета-анализ исследовал общий эффект совместного применения модификации образа жизни и метформина41.
В общей сложности было исследовано 17 показателей физического здоровья: вес, индекс массы тела, окружность талии, отношение окружности талии к окружности бедер, систолическое и диастолическое артериальное давление, глюкоза натощак, уровень инсулина, индекс инсулинорезистентности, гликированный гемоглобин А1с, триглицериды, общий холестерин, липопротеины высокой плотности (ЛПВП), липопротеины низкой плотности (ЛПНП), соотношение «мужского»/»женского» жира (т.е. соотношение доли жира, отложившегося по мужскому типу, к доле жира, отложившегося по женскому типу), висцеральный жир и толерантность к физическим нагрузкам.
Контрольные методы интервенции включали плацебо, продолжающееся психотропное лечение или стандартное лечение для фармакологических исследований и стандартное лечение для нефармакологических исследований.
Количество исследований по специфическому показателю здоровья находилось в диапазоне от одного до 29, причем медиана была равна 5 исследованиям (межквартильный размах =5). Исследования продолжались от 6 до 72 недель. Если сообщалось, средний возраст участников был 34,9±2 года, и 58,4% были мужчины.
Оценка качества включенных мета-анализов
Средний балл по шкале AMSTAR составил 8,8±1,0 в общей выборке, 8,9±0,9 в выборке фармакологических методов интервенций и 8,7±1,0 в выборке нефармакологических методов. Двадцать четыре проанализированных исследования (89%) имели балл по AMSTAR 8 и выше, но только два42,65 (4%) имели максимальный балл (11) по AMSTAR. Средний балл по AMSTAR-Plus Content составил 3,4±1,5 в общей выборке, 3,2±1,6 в выборке фармакологических мероприятий и 3,7±1,1 в выборке нефармакологических мероприятий. Ни одно исследование не имело максимум баллов (8).
Только одиннадцать мета-анализов (41%) были оценены как высококачественные на основе проанализированных исследований. Семь из 27 анализов включали только двойные слепые исследования (26%). В 16 мета-анализах (59%) общая объединенная выборка была меньше 500 случаев, в то время, как только 5 мета-анализов (18%) имели совокупную выборку более 1000 исследуемых. Лишь два мета-анализа49,53 (7%) имели по одному включенному исследованию с как минимум 200 исследуемых. В заключение, согласно критериям AMSTAR-Plus Content, достоверная разнородность исследований была выявлена в 12 мета-анализах (44%), а 18 (67%) не смогли опровергнуть наличие систематических ошибок, связанных с предпочтительной публикацией положительных результатов исследований.
Далее мы исследовали отношение между размерами эффекта как для фармакологических, так и для нефармакологических методов интервенции и контрольными условиями с оценкой качества (AMSTAR и AMSTAR-Plus Content). SMD для фармакологических и нефармакологических методов не связана в значительной степени с методологическим качеством мета-анализов, измеренным по AMSTAR (p=0,37-0,52), и не связана с качеством содержания мета-анализов при оценке по AMSTAR-Plus Content (p=0,17-0,97).
Показатели физического здоровья при использовании фармакологических и нефармакологических методов интервенции
Обзор различных показателей физического здоровья при использовании фармакологических и нефармакологических методов у людей с шизофренией, основанный на SMD и качестве проанализированных исследований, оцененных по баллам согласно AMSTAR и AMSTAR-Plus, представлена в таблице 2 (антропометрические результаты) и таблице 3 (артериальное давление, показатели метаболизма и физической подготовленности).
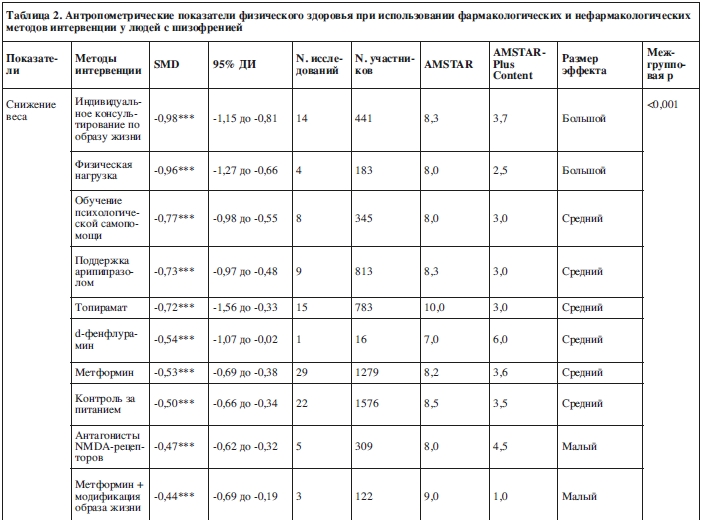
Шесть мета-анализов проводились относительно нефармакологических методов по уменьшению массы тела (78 исследований, N=3944). Средний балл по AMSTAR составил 8,2±0,2, средний балл по AMSTAR-Plus Content – 3,3±0,4.
Индивидуальное консультирование по образу жизни оказалось наиболее эффективным методом (SMD=-0,98, 95% ДИ: от -1,15 до -0,81, p<0,001; 14 исследований, N=411, I2=0%, Q=0,5, т.е. большой эффект), затем следовала физическая нагрузка (SMD=-0,96, 95% ДИ: от -1,15 до -0,81, p<0,001: 4 исследования, N=183, I2=0, Q=0, т.е. большой эффект).
Обучение психологической самопомощи, нацеленной на поддержание здорового образа жизни, дало средний эффект (SMD=-0,77, 95% ДИ: от -0,98 до -0,55, p<0,001: 8 исследований, N=345, I2=0, Q=0). Так же показали себя меры по контролю за питанием (SMD=-0,50, 95% ДИ: от -0,66 до -0,34, p<0,001; 22 исследования, N=1576, I2=94%, Q=15,8).
Малый эффект наблюдался при использовании когнитивно-поведенческой терапии, нацеленной на поддержание здорового образа жизни (SMD=-0,37, 95% ДИ: от -0,55 до -0,18, p=0,22; 11 исследований, N=546, I2=0%, Q=0,2), и группового консультирования по образу жизни (SMD=-0,39, 95% ДИ: от -0,54 до -0,23, p<0,001; 19 исследований, N=883, I2=28%, Q=2,8).
Относительно предупреждения увеличения веса мультидисциплинарное консультирование по поведению/образу жизни показало средний эффект (SMD=–0,69, 95% ДИ: от -0,84 до -0,54, р<0,001; 14 исследований, N=694, I2=0%, Q=1,4).
Фармакологические методы интервенции14 мета-анализов проводились относительно фармакологических методов интервенции для снижения массы тела (82 исследования, N=4691). Средняя оценка по AMSTAR была 8,1±1,3 и средний балл по AMSTAR-Plus Content был 4,0±1,7.
Средний размер эффекта наблюдался при поддержке арипипразолом (SMD=-0,73, 95% ДИ: от -0,97 до -0,48, p<0,001; 9 исследований, N=813, I2=68%, Q=6,2), при использовании топирамата (SMD=-0,72, 95% ДИ: от -1,56 до -0,33, p<0,001; 15 исследований, N=783, I2=92,7%, Q=13,7), d-фенфлурамина (SMD=-0,54, 95% ДИ: от -1,07 до -0,02, p<0,001; одно исследование, N=16) и метформина (SMD=-0,53, 95% ДИ: от -0,69 до -0,38, p<0,001; 29 исследований, N=1279, I2=39,4%, Q=1,6).
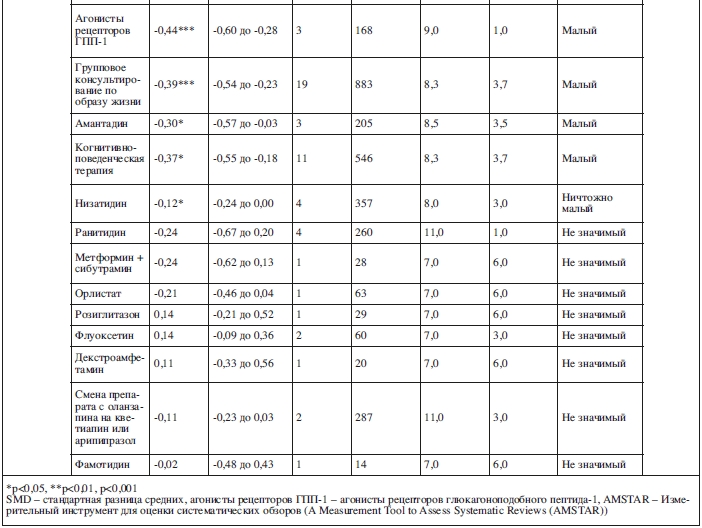
Малая значимость эффекта была показана при использовании антагонистов NMDA-рецепторов (SMD=-0,47, 95% ДИ: от -0,62 до -0,32, p<0,001; 5 исследований, N=309, I2=0%, Q=0,1), агонистов рецепторов ГПП-1 (SMD=-0,44, 95% ДИ: от -0,60 до -0,28, p<0,001; 3 исследования, N=168, I2=0%, Q=0,1) и амантадина (SMD=-0,30, 95% ДИ: от -0,57 до -0,03, p=0,03; 3 исследования, N=205, I2=0%, Q=0). Назитидин показал ничтожно малый эффект (SMD=-0,12, 95% ДИ: от -0,24 до 0,00, p=0,02; 4 исследования, N=357, I2=0%, Q=0,4).
Не наблюдалось значимого снижения веса по сравнению с контрольной группой при использовании флуоксетина (SMD=0,14, 95% ДИ: от –0,09 до 0,36, p=0,22; 2 исследования, N=60, I2=0%, Q=0), декстроамфетамина (SMD=0,11, 95% ДИ: от -0,33 до 0,56, p=0,60; одно исследование, N=20), ранитидина (SMD=-0,24, 95% ДИ: от -0,67 до 0,20, p=0,05; 4 исследования, N=260), фамотидина (SMD=-0,02, 95% ДИ: от -0,48 до 0,43, p=0,91; одно исследование, N=14), комбинации метформина с сибутрамином (SMD=-0,24, 95% ДИ: от -0,62 до 0,13, p=0,19; одно исследование, N=28), орлистата (SMD=-0,21, 95% ДИ: от -0,46 до 0,04, p=0,09; одно исследование, N=63) и розиглитазона (SMD=0,14, 95% ДИ: от -0,21 до 0,52, p=0,19; одно исследование, N=29). Смена препарата с оланзапина на кветиапин или арипипразол не показала значимых результатов (SMD=–0,11, 95% ДИ: от –0,23 до 0,03, p=0,06; 2 исследования, N=287).
Комбинированные фармакологические и нефармакологические методы интервенции
В одном мета-анализе были исследованы комбинация метформина с мероприятиями по модификации образа жизни, они продемонстрировали малый эффект (SMD=–0,44, 95% ДИ: от –0,69 до –0,19, p<0,001; 3 исследования, N=122, I2=0, Q=0).
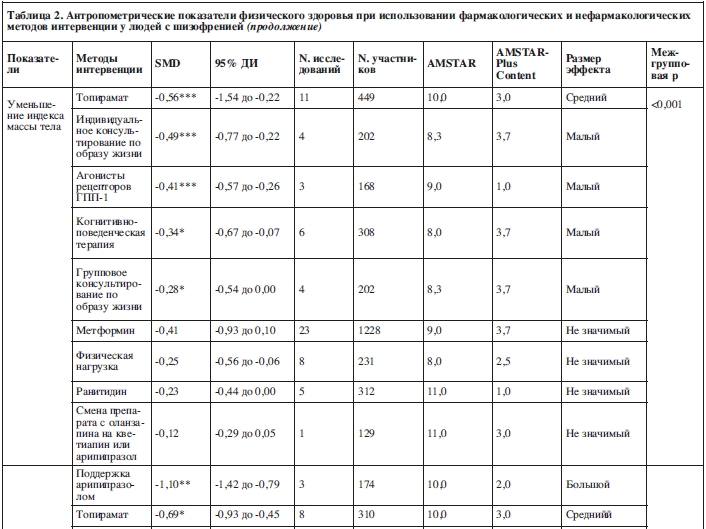
Четыре мета-анализа было проведено относительно нефармакологических методов по снижению индекса массы тела (42 исследования, N=2157). Средний балл по AMSTAR был равен 9,7±0,8 и средний балл по AMSTAR-Plus Content составил 2,2±1,2.
Малый эффект наблюдался при использовании группового консультирования по образу жизни (SMD=–0,28, 95% ДИ: от –0,54 до 0,00, p=0,04; 4 исследования, N=202, I2=0%, Q=0), индивидуального консультирования по образу жизни (SMD=–0,49, 95% ДИ: от –0,77 до –0,22, p<0,001; 4 исследования, N=202, I2=0%, Q=0), и когнитивно-поведенческой терапии, нацеленной на поддержание здорового образа жизни (SMD=–0,34, 95% ДИ: от –0,67 до –0,07, p=0,02; 6 исследований, N=308, I2=0%, Q=0,2).
Не наблюдалось значимого снижения ИМТ по сравнению с контрольной группой при использовании физических упражнений (SMD=–0,25, 95% ДИ: от –0,56 до 0,06, p=0,11; 8 исследований, N=231, I2 =0%, Q=0,4).
Фармакологические методы интервенции
Шесть мета-анализов изучали фармакологические методы по снижению ИМТ (81 исследование, N=4533). Средний балл по AMSTAR был равен 8,1±1,3 и средний балл по AMSTAR-Plus Content составил 4,0±1,9.
Топирамат (SMD=–0,56, 95% ДИ: от –1,54 до –0,22, p<0,001; 11 исследований, N=449, I2=0%, Q=0) имел средний эффект снижения ИМТ, в то время как агонисты рецепторов ГПП-1 показали лишь малый эффект (SMD=–0,41, 95% ДИ: от –0,57 до –0,26, p<0,001; 3 исследования, N=168, I2=0%, Q=0).
Снижения индекса массы тела не наблюдалось при использовании метформина (SMD=–0,41, 95% ДИ: от –0,93 до 0,10, p=0,10; 23 исследования, N=1228, I2=90%, Q=20,0), ранитидина (SMD=–0,23, 95% ДИ: от –0,44 до 0,00, p=0,55; 5 исследований, N=312, I2=0%, Q=0) и при смене препаратов с оланзапина на кветиапин (SMD=–0,12, 95% ДИ: от –0,29 до 0,05, p=0,16; одно исследование, N=129).
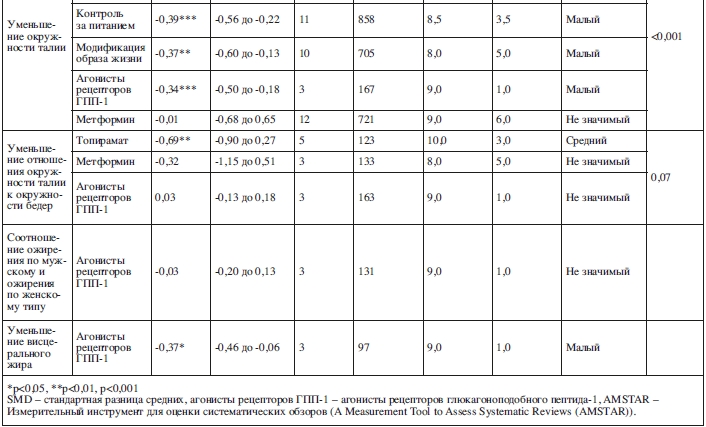
Три мета-анализа изучали нефармакологические методы по уменьшению окружности талии (24 исследования, N=1709). Средний балл по AMSTAR составил 9,3±0,5 и средний балл по AMSTAR-Plus Content равен 4,0±0,8.
Малую эффективность относительно уменьшения окружности талии по сравнению со стандартным лечением показал контроль за питанием (SMD=–0,39, 95% ДИ: от –0,56 до –0,22, p<0,001; 11 исследований, N=858, I2=0%, Q=0) и междисциплинарные меры по изменению поведения/образа жизни (SMD=–0,37, 95% ДИ: от –0,60 до -0,13, p=0,002; 10 исследований, N=705, I2=0%, Q=0).
Фармакологические методы интервенции
Семь мета-анализов исследовали фармакологические методы по уменьшению окружности талии (32 исследования, N=1755). Средний балл по AMSTAR был равен 9,3±0,7 и средний балл по AMSTAR-Plus Content равен 2,8±1,6.
По сравнению с контрольной группой наиболее эффективным методом интервенции оказалась поддержка арипипразолом (SMD=–1,10, 95% ДИ: от –1,42 до –0,79, p=0,001; 3 исследования, N=174, I2=0%, Q=0, т.е. большой эффект).
Топирамат оказывал средний эффект (SMD=–0,69, 95% ДИ: от –0,93 до –0,45, p<0,05; 8 исследований, N=310, I2=0%, Q=0). Агнонисты рецепторов ГПП-1 имели малый эффект (SMD=–0,34, 95% ДИ: от –0,50 до –0,18, p<0,001; 3 исследования, N=167, I2=0%, Q=0). По сравнению с плацебо-контролируемой группой статистически значимого уменьшения окружности талии не наблюдалось при использовании метформина (SMD=–0,01, 95% ДИ: от –0,68 до 0,65, p=0,97; 12 исследований, N=721, I2=82%, Q=17,1).
Отношение окружности талии к окружности бедер
Три мета-анализа изучали эффекты фармакологических методов на отношение окружности талии к окружности бедер (11 исследований, N=419). Средний балл по AMSTAR был равен 9,3±0,7 и средний балл по AMSTAR-Plus Content составил 2,8±1,6.
Малый эффект на уменьшение отношения окружности талии к окружности бедер наблюдался при использовании топирамата (SMD=–0,69, 95% ДИ: от –0,90 до 0,27, p=0,009; 5 исследований, N=123, I+=0%, Q=0) и метформина (SMD=–0,32, 95% ДИ: от –1,15 до 0,51, p=0,29; 3 исследования, N=133, I2=0%, Q=0). Агонисты рецепторов ГПП-1 не продемонстрировали значимого эффекта: (SMD=0,03, 95% ДИ: от –0,13 до 0,18, p=0,39; 3 исследования, N=163, I2=0%, Q=0).
Соотношение ожирения по мужскому и женскому типу
Основываясь на данных одного мета-анализа, агонисты рецепторов ГПП-1 не превзошли контрольную группу по эффекту на соотношение ожирения по мужскому и женскому типу (SMD=–0,03, 95% ДИ: от –0,20 до 0,13, p=0,46; 3 исследования, N=131, I2=0%, Q=0).
Висцеральный жир
Основываясь на данных одного мета-анализа, агонисты рецепторов ГПП-1 имели малый эффект на уменьшение висцерального жира (SMD=–0,37, 95% ДИ: от –0,46 до –0,06, p=0,02; 3 исследования, N=97, I2=0%, Q=0).
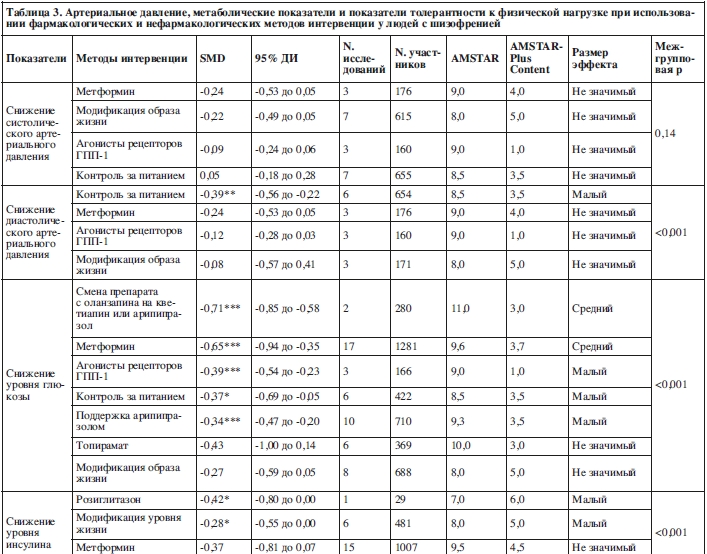
Четыре мета-анализа исследовали нефармакологические мероприятия по снижению артериального давления (23 исследования, N=2095). Средний балл по AMSTAR был равен 9,0±0,0 и средний балл по AMSTAR-Plus Content равен 4,5±0,5.
При рассмотрении только контроля за питанием наблюдался малый эффект на снижение диастолического давления по сравнению со стандартным лечением (SMD=–0,39, 95% ДИ: от –0,56 до –0,22, p<0,01; 6 исследований, N=654, I2=0, Q=0).
По сравнению со стандартным лечением, при использовании междисциплинарных мер по изменению поведения/образа жизни не наблюдалось значимого снижения ни систолического (SMD=–0,22, 95% ДИ: от –0,49 до 0,05, p=0,11; 7 исследований, N=615, I2=0, Q=0), ни диастолического артериального давления (SMD=–0,08, 95% ДИ: от –0,57 до 0,41, p=0,74; 3 исследования, N=171, I2=0, Q=0).
Фармакологические методы интервенции
Два мета-анализа изучали фармакологические методы по снижению артериального давления (6 исследований, N=336). Средний балл по AMSTAR был равен 9,5±0,5 и средний балл по AMSTAR-Plus Content составил 1,5±0,5.
По сравнению с группой плацебо, не наблюдалось значимого снижения систолического и диастолического артериального давления при использовании агонистов рецепторов ГПП-1 и метформина.
Три мета-анализа исследовали нефармакологические методы интервенции по снижению уровня глюкозы крови натощак (16 исследований, N=1256). Средний балл по AMSTAR был равен 9,3±0,5 и средний балл по AMSTAR-Plus Content составил 4,0±0,8.
Контроль за питанием дал малый эффект по снижению уровня глюкозы (SMD=–0,37, 95% ДИ: от –0,69 до –0,05, p=0,03; 6 исследований, N=422, I2=0%, Q=0).
Значимого снижения уровня глюкозы не наблюдалось в сравнении со стандартным лечением при использовании мультидисциплинарных мер по изменению поведении/образа жизни (SMD=–0,27, 95% ДИ: от –0,59 до 0,05, p=0,10; 8 исследований, N=688, I2=0%, Q=0).
Фармакологические методы интервенции
Семь мета-анализов исследовали эффекты фармакологических мер по снижению уровня глюкозы крови натощак (54 исследования, N=3617). Средний балл по AMSTAR составил 9,6±0,6 и средний балл по AMSTAR-Plus Content равен 3,1±1,9.
Средний эффект на снижение уровня глюкозы натощак был обнаружен при смене препарата с оланзапина на кветиапин или арипипразол (SMD=–0,71, 95% ДИ: от –0,85 до –0,58, p<0,001; 2 исследования, N=280) и при использовании метформина (SMD=–0,65, 95% ДИ: от –0,94 до –0,35, p<0,001; 17 исследований, N=1281, I2=0%, Q=0).
Малый эффект был выявлен при поддержке арипипразолом (SMD=–0,34, 95% ДИ: от –0,47 до –0,21, p<0,001; 10 исследований, N=710, I2=0%, Q=0) и при использовании агонистов рецепторов ГПП-1 (SMD=–0,39, 95% ДИ: от –0,54 до –0,23, p<0,001; 3 исследования, N=166, I2=0%, Q=0).
Значимого снижения уровня глюкозы по сравнению с контролем не наблюдалось при использовании и топирамата (SMD=–0,43, 95% ДИ: от –1,00 до 0,14, p=0,14; 6 исследований, N=369, I2=0%, Q=0).
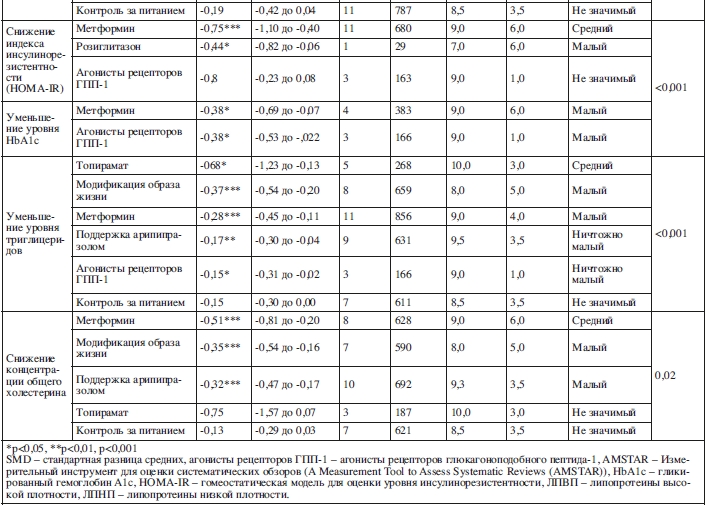
Два мета-анализа исследовали эффект нефармакологических методов интервенции на уровень инсулина (9 исследований, N=1268). Средний балл по AMSTAR был равен 9,0±0,0 и средний балл по AMSTAR-Plus Content равен 4,5±0,7.
Мультидисциплинарные меры по изменению поведения/образа жизни имели малый эффект на улучшение чувствительности к инсулину (SMD=–0,28, 95% ДИ: от –0,55 до 0,00, p=0,04; 6 исследований, N=481, I2=0%, Q=0). Только контроль за питанием не превзошел группу контроля (SMD=–0,19, 95% ДИ: от –0,42 до 0,04, p=0,10; 11 исследований, N=787, I2=0%, Q=0).
Фармакологические методы интервенции
Пять мета-анализов изучали эффективность фармакологических мер относительно уровеня инсулина (23 исследования, N=1479). Средний балл по AMSTAR был равен 8,4±1,2 и средний балл по AMSTAR-Plus Content равен 4,2±2,2.
Розиглитазон имел малый эффект (SMD=–0,42, 95% ДИ: от –0,80 до 0,00, p=0,03; одно исследование, N=29). Метформин не превзошел показателей контрольной группы (SMD=–0,37, 95% ДИ: от –0,81 до 0,07, p=0,10; 15 исследований, N=1007, I2=79,2%, Q=4,8).
Пять мета-анализов исследовали эффект фармакологических мероприятий на гомеостатическую модель оценки уровня инсулинорезистентности (19 исследований, N=1158). Средний балл по AMSTAR был равен 8,4±1,2 и средний балл по AMSTAR-Plus Content равен 4,2±2,2.
Метформин (SMD=–0,75; 95% ДИ: от –1,10 до –0,40, p<0,001; 11 исследований, N=680, I2=0%, Q=0, т.е. средний эффект) и розиглитазон (SMD=–0,44; 95% ДИ: от –0,82 до –0,06, p=0,02; одно исследование, N=29, т.е. малый эффект) значимо превзошли контрольную группу, в то время как агонисты рецепторов ГПП-1 – нет (SMD=–0,08; 95% ДИ: от –0,23 до 0,08, p=0,10; 3 исследования, N=163, I2=0%, Q=0).
Гликированный гемоглобин A1c
Два мета-анализа изучали эффективность фармакологических методов на уровень гемоглобина A1c (7 исследований, N=549). Средний балл по AMSTAR был равен 9,0±0,0 и средний балл по AMSTAR-Plus Content равен 3,5±3,5.
Метформин (SMD=–0,38; 95% ДИ: от –0,69 до –0,07, p=0,016; 4 исследования, N=383, I2=0%, Q=0) и агонисты рецепторов ГПП-1 (SMD=–0,38; 95% ДИ: от –0,53 до –0,22, p=0,02; 3 исследования, N=166, I2=0%, Q=0) незначительно превзошли группу плацебо и показали малый эффект.
Четыре мета-анализа изучали влияние нефармакологических мероприятий на уровень триглицеридов (22 исследования, N=1671). Средний балл по AMSTAR был равен 8,7±1,1 и средний балл по AMSTAR-Plus Content равен 4,2±0,8.
Междисциплинарные меры относительно изменения поведения/образа жизни имели малый эффект в сравнении со стандартным лечением (SMD=–0,37, 95% ДИ: от –0,54 до –0,20, p<0,001; 8 исследований, N=659, I2=40,0%, Q=1,7). Контроль за питанием не превзошел стандартное лечение (SMD=–0,15; 95% ДИ: от –0,30 до 0,00, p=0,06; 7 исследований, N=611, I2=0%, Q=0).
Фармакологические методы интервенции
Семь мета-анализов изучали эффект фармакологических мероприятий на уровень триглицеридов (36 исследований, N=2564). Средний балл по AMSTAR был равен 9,1±1,0 и средний балл по AMSTAR-Plus Content равен 3,6±1,9.
Эффект, в сравнении с контрольными условиями, был средним при использовании топирамата (SMD=–0,68, 95% ДИ: от –1,23 до –0,13, p=0,016; 5 исследований, N=268, I2=0%, Q=0), малым при использовании метформина (SMD=–0,28, 95% ДИ: от –0,45 до –0,11, p<0,001; 11 исследований, N=856, I2=5%, Q=2,1), и ничтожно малым при поддержке арипипразолом (SMD=–0,17, 95% ДИ: от –0,30 до –0,04, p=0,009; 9 исследований, N=631, I+=0%, Q=0) и использовании агонистов рецепторов ГПП-1 (SMD=–0,15, 95% ДИ: от –0,31 до –0,02, p=0,04; 3 исследования, N=166, I2=0%, Q=0).
Десять мета-анализов изучали нефармакологические методы для уменьшения уровня холестерина (56 исследований, N=4288). Средний балл по AMSTAR был равен 8,5±1,0 и средний балл по AMSTAR-Plus Content равен 4,5±0,7.
Относительно уровня общего холестерина мультидисциплинарные меры по изменению поведения имели малый эффект (SMD=–0,35, 95% ДИ: от –0,54 до –0,16, p=0,003; 7 исследований, N=590, I2=0%, Q=0,3), в то время как контроль за питанием не превзошел эффект стандартного лечения (SMD=–0,13; 95% ДИ: от –0,29 до 0,03, p=0,10; 7 исследований, N=621, I2=0%, Q=0).
Относительно ЛПНП мультидисциплинарные меры по изменению поведения/образа жизни показали малый эффект (SMD=–0,36, 95% ДИ: от –0,60 до –0,12, p=0,003; 5 исследований, N=590, I2=0%, Q=0,2).
Достоверных эффектов на уровень ЛПВП не было обнаружено при применении мер по изменению образа жизни или контроля за питанием.
Фармакологические методы интервенции
Пятнадцать мета-анализов изучали фармакологические методы по уменьшению уровня холестерина (74 исследования, N=5295). Средний балл по AMSTAR был равен 9,4±0,8 и средний балл по AMSTAR-Plus Content равен 3,3±1,8.
Относительно уровня общего холестерина метформин (SMD=–0,51, 95% ДИ: от –0,81 до –0,20, p<0,001; 8 исследований, N=628, I2=0%, Q=0) продемонстрировал средний эффект, в то время как поддержка арипипразолом имела малый эффект (SMD=–0,32, 95% ДИ: от –0,47 до –0,17, p<0,001; 10 исследований, N=692, I2=0%, Q=0). Значимого снижения по сравнению с контрольными условиями не наблюдалось при применении топирамата (SMD=–0,75, 95% ДИ: от –1,57 до 0,07, p=0,07; 3 иследования, N=187, I2=0%, Q=0).
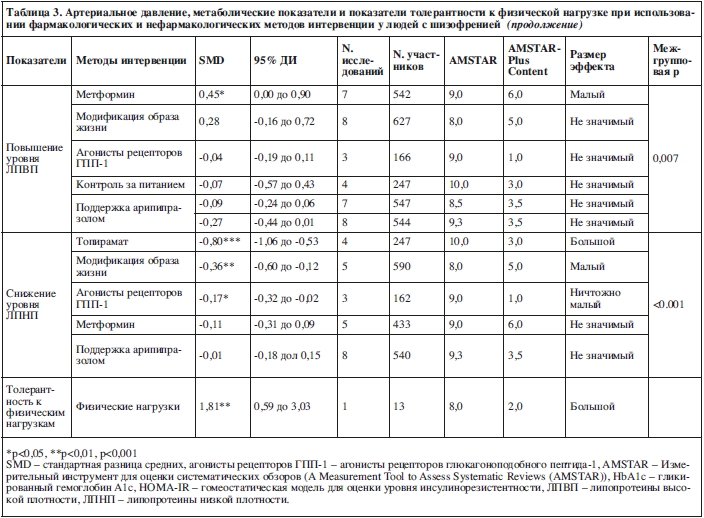
В отношении уроня ЛПНП топирамат (SMD=–0,80, 95% ДИ: от –1,06 до –0,53, p<0,001; 4 исследования, N=247, I2=0%, Q=0) и агонисты рецепторов ГПП-1 (SMD=–0,17, 95% ДИ: от –0,32 до –0,02, p=0,04; 3 исследования, N=162, I2=0%, Q=0) превзошли контрольные условия, хотя во втором случае эффект был ничтожно малым. Не было обнаружено значимого снижения уровня ЛПНП по сравнению с контрольными условиями при поддержке арипипразолом (SMD=–0,01, 95% ДИ: от –0,18 до 0,15, p=0,88; 8 исследований, N=540, I2=0%, Q=0) и при использовании метформина (SMD=–0,11, 95% ДИ: от –0,31 до 0,09, p=0,29; 5 исследований, N=433, I2=0%, Q=0,2).
Относительно ЛПВП только метформин имел малый эффект (SMD=0,45, 95% ДИ: 0,00 до 0,90, p=0,049; 7 исследований, N=542, I2=0%, Q=0), в то время как поддержка арипипразолом, топирамат и агонисты рецепторов ГПП-1 не отличались от контрольных условий.
Толерантность к физическим нагрузкам
Основываясь на данных одного метаанализа, физические упражнения превзошли эффект стандартного лечения (SMD=1,81; 95% ДИ: от 0,59 до 3,03, p=0,004; одно исследование, N=13, I2=0%, Q=0, т.е., большой эффект).
Нежелательные эффекты от препаратов
По сравнению с плацебо Арипипразол чаще вызывал тревогу (number needed to harm, NNH (индекс потенциального вреда, ИПВ)=8, 95% ДИ: 5–20, p<0,001)47 и ажитацию/акатизию (RR=7,59, 95% ДИ: 1,43–40,18, p=0,02)53. Амантадин был ассоциирован с более высокой частотой инсомнии (RR=3,83, 95% ДИ: 1,41–10,38, p=0,008, NNH=9)57 и дискомфортом в животе (количественные данные не были приведены)60. Агонисты рецепторов ГПП-1 были связаны с повышенной частотой тошноты (NNH=3,8, 95% ДИ: 2,4–9,7, p<0,05)40. Среди Н2-антагонистов, фамотидин и ранитидин не ассоциировались с высокой частотой нежелательных явлений, в то время как назитидин чаще вызывал сухость во рту (RR=4,89, p=0,04; NNH=17, p=0,03) и депрессию (RR=5,00, p=0,03; NNH=17, p=0,02)52.
Из шести включенных мета-анализов по метформину пять сообщали об отсутствии различий в частоте нежелательных явлений, в то время как один из них сообщал о более высокой частоте тошноты/рвоты (NNH=16, 95% ДИ: 10–50, p=0,01) и диареи (NNH=6,95% ДИ: 3–25, p=0,01)49. Хотя не было различий в частоте отказа от лечения орлистатом, но диарея была основной причиной прекращения лечения48.
Сибутрамин плюс метформин ассоциировались с повышенной частотой психотических симптомов. Топирамат чаще вызывал парестезии (RR=2,31, 95% ДИ: 1,17–4,56, p<0,05)39. Данные по декстроамфетамину, d-фенфлурамину и розиглитазону отсутствуют. Смена антипсихотиков (оланзапин на кветиапин) была ассоциирована с повышенной частотой психиатрических нежелательных явлений54.
Ни один из мета-анализов не сообщал о нежелательных явлениях нефармакологических методов интервенции.
Исследование уровня различий в возрасте и поле не объясняют различия в весе, индексе массы тела или уровне триглицеридов после фармакологических или нефармакологических методов интервенции.
При рассмотрении нефармакологических методов интервенции индивидуальное консультирование по образу жизни показало большой эффект по уменьшению веса. Относительно контроля за питанием эффект снижения веса был средним, а эффект снижения диастолического артериального давления и снижения уровня глюкозы были малыми. Физическая нагрузка продемонстрировала большой эффект снижения веса и большой эффект по увеличению толерантности к физическим нагрузкам, хотя данные по последнему ограничены одним небольшим исследованием.
Характеристики методов интервенции по изменению образа жизни были оценены для предоставления руководств для дальнейшей клинической практики. Одной ключевой находкой было то, что индивидуальное консультирование по образу жизни показало большой эффект по снижению массы тела, в то время как для групповых подходов был лишь малый эффект. По-видимому, преимущества индивидуальной стратегии, такие как персональные советы и внимание, удовлетворяющие специфические потребности пациента, и индивидуальный план действий превосходят преимущества групповых сессий, такие как межличностное обучение, подражательное поведение, распознавание схожих черт у других членов группы, групповая сплоченность и партнерская поддержка66. Будущие исследования должны изучить, будет ли комбинированный подход, заключающий в себе групповые сессии, одновременно направленные на специфические потребности пациента с индивидуальным планом действий, наиболее эффективен.
Когнитивно-поведенческая терапия, нацеленная на снижение веса и обучение психологической самопомощи, продемонстрировала малый и средний эффекты соответственно.
Среди 17 фармакологических стратегий 12 превзошли контрольные условия по различным показателям физического здоровья. Не было обнаружено никаких благоприятных эффектов флуоксетина, ранитидина, орлистата, декстроамфетамина и фамотидина на какие-либо показатели физического здоровья.
Топирамат показал большой эффект по уменьшению ЛПНП и средний эффект по уменьшению веса, индекса массы тела, окружности талии и уровня триглицеридов. Метформин продемонстрировал средний эффект по снижению веса, общего холестерина, уровня глюкозы натощак и индекса инсулинорезистентности, а также малый эффект по уменьшению уровня гемоглобина А1с, триглицеридов и ЛПВП.
Смена препарата с оланзапина на кветиапин или арипипразол показала средний эффект по уменьшению уровня глюкозы натощак, притом что эффект от поддержки арипипразолом по этому параметру был малым. Поддержка арипипразолом продемонстрировала также большой эффект по уменьшению окружности талии и средний эффект по уменьшению массы тела.
Малый эффект по снижению массы тела был обнаружен у антагонистов рецепторов NMDA. Агонисты рецепторов ГПП-1 показали малый эффект по уменьшению окружности талии, уровня глюкозы и гемоглобина А1с. Розиглитазон имел небольшой улучшающий эффект на уровень инсулинорезистентности. Малый эффект поддержки арипипразолом и агонистов рецепторов ГПП-1 выявлен по снижению уровня триглицеридов, а агонисты рецепторов ГПП-1 показали по снижению уровня ЛПНП.
В заключение, основываясь на SMD и совокупном высоком методологическом качестве оригинальных мета-анализов (но с более низким качеством содержания мета-анализов), индивидуальное консультирование по образу жизни и физические упражнения показали наибольший эффект снижения веса, затем следуют обучение психологической самопомощи, поддержка арипипразолом, использование топирамата, d-фенфлурамина и метформина. Относительно окружности талии поддержка арипипразолом и применение топирамата продемонстрировали наилучший эффект, затем следует контроль за питанием. Контроль за питанием был единственным значимо повлиявшим на диастолическое артериальное давление.
Смена препарата с оланзапина на кветиапин или арипипразол и метформин продемонстрировала лучший значимый эффект по снижению уровня глюкозы, затем следуют агонисты рецепторов ГПП-1, контроль за питанием и поддержка арипипразолом. Уровень гемоглобина А1с был статистически значимо снижен как метформином, так и агонистами рецепторов ГПП-1. Индекс инсулинорезистентности значимо изменился при применении метформина и розиглитазона.
Уменьшение уровня триглицеридов было наибольшим при применении топирамата, затем следуют мультидисциплинарные меры по изменению поведения/образа жизни, метформин, поддержка арипипразолом и агонисты рецепторов ГПП-1. Общий холестерин был уменьшен при использовании метформина, модификации образа жизни и поддержке арипипразолом, в то время как уменьшение уровня ЛПНП было значимым при использовании топирамата, модификации образа жизни и агонистов рецепторов ГПП-1. Уровень ЛПВП увеличился только при применении метформина. И только физические упражнения были мета-проанализированы как способ повышения толерантности к физической нагрузке, демонстрируя наибольший размер эффекта из всех методов в данном обзоре по какому-либо показателю (SMD=1,81), однако эти данные были основаны только на одном исследовании.
В своей совокупности наши данные предлагают клиницистам некоторые точки зрения по потенциально лучшим методам решения специфических проблем с физическим здоровьем людей с шизофренией. Суммируя, для снижения веса практикующим врачам следует рассматривать индивидуальное консультирование по образу жизни как лучшее из нефармакологических методов интервенции. Физические упражнения также могут привести к снижению веса, хотя мы может включить лишь только четыре исследования. Контроль за питанием также может быть перспективным. Относительно фармакологических методов клиницистам следует рассматривать дополнительное использование топирамата, но эта мера должна быть рассмотрена в противовесе с возможным возникновением парестезий и когнитивных нежелательных явлений (последние изучены недостаточно). Данные по метформину были несколько разнородными, так как средство имело средний эффект по снижению веса, но никакого эффекта на индекс массы тела, хотя последнее могло быть скорее вследствие небольшого количества исследований, оценивающих этот показатель. Метформин может быть ассоциирован с возникновением тошноты и диареи. Дальнейшие исследования необходимы для определения эффектов комбинации этих стратегий.
Что касается других показателей физического здоровья и сердечно-сосудистого риска, имеется достаточная значимость, что клиницисты могут использовать их для уменьшения уровня глюкозы крови, уровня инсулинорезистентности и общего холестерина, в то время как имеется лишь малый эффект по уменьшению уровня триглицеридов, гемоглобина А1с и ЛПНП. Людям с шизофренией, принимающим оланзапин, смена препарата на кветиапин или арипипразол также может дать средний эффект снижения глюкозы крови. Стоит отметить, что только контроль за питанием показал значительное улучшение показателя диастолического артериального давления.
Наши данные имеют некоторые ограничения. Во-первых, хоть включенные мета-анализы и были наиболее обновленными и/или крупными для каждой определенной стратегии и показателя, отдельные исследования, опубликованные с момента даты последнего поиска включенных мета-анализов, не были добавлены. Во-вторых, по причине ограниченности данных по характеристикам участников и методам интервенций, проведение мета-регрессивного анализа не было возможным. В-третьих, в то время как качество мета-анализов было в основном высокое, содержание проанализированных исследований часто вызывало сомнение. В-четвертых, основываясь на баллах по AMSTAR-Plus Content, публикационные систематические ошибки были проблемой для примерно половины из всех мета-анализов, что могло привести к переоценке обобщенных размеров эффекта. Последнее, преобладание исследований с небольшой выборкой, в которых только большие эффекты были статистически значимыми, представляет проблему.
В заключение: несмотря на высокий риск физических коморбидностей у людей с шизофренией и факт их преждевременной смертности в основном из-за повышенного риска физических заболеваний, существующие данные по фармакологическим и нефармакологическим методам профилактики и лечения этих состояний все еще ограничены. Отличные по качеству и достаточно большие индивидуальные рандомизированные клинические исследования остаются необходимыми.
В добавление, эта область должна перейти от мета-анализа на уровне исследования к мета-анализу на уровне пациента, поскольку это обеспечит более персонализированную картину эффектов лечения для отдельных лиц, полученную из адекватных анализов модератора, медиатора и подгруппы. Сравнение фармакологических и нефармакологических методов в одном и том же исследовании остается предпочтительным, а также есть потребность в крупномасштабных исследованиях комбинированных режимов (т.е. использование смены антипсихотического препарата и дополнительное назначение сопутствующей модификации образа жизни) и профилактических мероприятий (например, тех, которые нацелены на предотвращение физических коморбидностей до их развития).
БЛАГОДАРНОСТИ
Б. Стаббс читает клинические лекции при поддержке Health Education England и the National Institute for Health Research (NIHR) Integrated Clinical Academic Programme (ICA-CL-2017-03-001). Б. Стаббс и Ф. Гогран частично поддерживаются благотворительной организацией The Maudsley Charity и the NIHR Collaboration for Leadership in Applied Health Research and Care South London at King’s College Hospital NHS Foundation Trust. Мнения, выраженные в этой статье, принадлежат авторам и необязательно совпадают с вышеуказанными.
DOI: 10.1002/wps.20614
Редактура: к.м.н. Бойко А.С. (Томск)
Резюме
Мы объединили и сравнили мета-анализы фармакологических и нефармакологических мер, направленных на показатели физического здоровья людей с расстройствами шизофренического спектра. Большая часть баз данных была просмотрена до 1 июня 2018 года. Из 3709 совпадений при поиске было включено 27 мета-анализов, представляющих 128 мета-проанализированных исследований и 47 231 обследованного участника.
В целом мета-анализы характеризуются адекватностью и высоким качеством, но анализируемые исследования – в меньшей степени. Наиболее эффективными мерами по снижению веса были индивидуальное консультирование по образу жизни (стандартная разница средних – standardized mean difference, SMD=-0,98)) и применение физических упражнений (SMD=-0,96), за которыми следуют обучение психологической самопомощи (SMD=-0,77), поддержка арипипразолом (SMD=-0,73), применение топирамата (SMD=-0,72), d-фенфлурамина (SMD=-0,54) и метформина (SMD=-0,53). Относительно уменьшение окружности талии поддержка арипипразолом (SMD=-1,10) и применение топирамата (SMD=-0,69) показали наилучшую достоверность, потом следует контроль за питанием (SMD=-0,39). Контроль за питанием был единственной мерой, которая достоверно улучшала (диастолическое) артериальное давление (SMD=-0,39). Смена препарата с оланзапина на кветиапин или арипипразол (SMD=-0,71) и применение метформина (SMD=-0,65) показали наибольшую эффективность по снижению уровня глюкозы крови, за чем следовали применение агонистов рецепторов глюкагоноподобного пептида-1 (SMD=-0,39), контроль за питанием (SMD=-0,37) и поддержка арипипразолом (SMD=-0,34); в свою очередь преодолевать инсулинорезистентность удавалось лучше всего с метформином (SMD=-0,75) и розиглитазоном (SMD=-0,44). Топирамат имел наибольший эффект относительно концентраций триглицеридов (SMD=-0,68) и липопротеинов низкой плотности (ЛПНП) (SMD=-0,80); в свою очередь метформин имел наиболее благоприятный эффект на общий холестерин (SMD=-0,51) и липопротеины высокой плотности (ЛПВП) (SMD=-0,45). Коррекция образа жизни давала малый эффект относительно триглицеридов, общего холестерина и ЛПНП (SMD= от -0,35 до -0,37). Только применение физических упражнений увеличивало толерантность к физической нагрузке (SMD=1,81). Несмотря на частые физические сопутствующие заболевания и преждевременную смертность, главным образом из-за этих повышенных рисков для физического здоровья, современные данные о фармакологических и немедикаментозных вмешательствах у людей с шизофренией для профилактики и лечения этих состояний по-прежнему ограничены, и в ближайшее время требуется больше масштабных исследований в этом направлении.
Ключевые слова: шизофрения, психоз, физическое здоровье, масса тела, артериальное давление, глюкоза, инсулин, триглицериды, холестерин, консультирование по образу жизни, физическая активность, контроль за питанием, метформин, топирамат, смена антипсихотиков.
(World Psychiatry 2019;18(1):53–66)
Люди с шизофренией имеют значительно худшее физическое здоровье в сравнении с общей популяцией1-4, что часто связывают с взаимодействием между социальными обстоятельствами, факторами образа жизни и эффектами терапии5. Например, поведенческие исследования показали, что люди с шизофренией малоактивны физически и демонстрируют преобладание сидячего образа жизни по сравнению с общей популяцией6, употребляют большие объемы пищи, зачастую плохого качества7 и имеют больше вредных привычек, таких как курение8. Более того, психиатрическое лечение антипсихотиками и другими назначаемыми препаратами, такими как нормотимики и антидепрессанты, еще больше увеличивают риск соматических заболеваний9,10. Как следствие, люди с шизофренией чаще имеют кардиометаболические заболевания11-13, респираторные заболевания14, хронические боли15, получают переломы16 и обладают низкой физической подготовкой17,18 по сравнению с общей популяцией.
Такой повышенный соматический риск ассоциирован со снижением качества жизни пациентов из-за нехватки физического компонента здоровья19,20, но, несмотря на повышенный риск, доступность наблюдения за здоровьем, медицинской помощи и методов интервенции для лиц с шизофренией является недостаточной в сравнении с общей популяцией21,22. В результате люди с шизофренией имеют дефицит в ожидаемой продолжительности жизни в 10-20 лет, в первую очередь из-за худшего соматического здоровья13,23. Кроме того, неравенства в отношении физического здоровья, с которыми сталкиваются люди с шизофренией, наблюдаются во всем мире24 и не улучшаются с течением времени25.
В связи с таким явным несоответствием, отмечался значительный рост усилий по улучшению физического здоровья этой популяции группы риска5,26. Для устранения различий в физическом здоровье ряд отдельных мета-анализов привел к национальным и международным научно обоснованным рекомендациям за или против конкретных вариантов фармакологического и нефармакологического методов интервенции27-34.
Несмотря на быстрое расширение мета-аналитических данных о методах интервенции в целях борьбы с плохим физическим здоровьем у людей с шизофренией, отсутствует обобщение этих высококачественных доказательств, равно как и прямого количественного сравнения доказательств между всеми индивидуальными и/или комбинированными фармакологическими и нефармакологическими стратегиями. Более того, не было достаточным образом оценено качество этих мета-анализов и включенных статей, что является обязательным шагом перед тем, как с уверенностью могут быть сделаны более серьезные рекомендации по лечению.
С целью заполнения данного пробела литературы, мы поставили перед собой задачу собрать в целое существующие высококачественные доказательства из наиболее последних/масштабных мета-анализов рандомизированных исследований методов интервенции по улучшению физического здоровья, чтобы определить сравнительное качество доказательств и величину эффективности фармакологических и нефармакологических методов, направленных на улучшение показателей физического здоровья среди лиц с расстройствами шизофренического спектра.
МЕТОДЫ
Поиск
Четверо авторов, независимо друг от друга, искали в базах данных MEDLINE/PubMed, PsycINFO, EMBASE и Cochrane, начиная с их соответствующих исходных дат и заканчивая 1 июня 2018 г., без языковых ограничений, мета-анализы рандомизированных контролируемых исследований лиц с расстройствами шизофренического спектра, в которых улучшение физического здоровья было первичным результатом.
Поисковые слова включали («мета-анализ» ИЛИ «систематический обзор») И («случайный» ИЛИ «плацебо» ИЛИ «контроль») И («шизофрения» ИЛИ «шизоаффективный» ИЛИ «шизофреническое расстройство» ИЛИ «психоз» ИЛИ «психотический» ИЛИ «тяжелое психическое расстройство») И («физическое здоровье» ИЛИ «кардио*» ИЛИ «метабол*» ИЛИ «респир*» ИЛИ «*вес» ИЛИ «боль» ИЛИ «соматический») Мы просмотрели списки литературы всех включенных статей.
 Критерии включения
Критерии включенияКритерии включения были составлены в соответствии со структурой отчетности, включающей популяцию, методы интервенции и сравнения, результаты и учреждение/дизайн исследования (Population, Interventions, Comparisons, Outcomes and Setting/study design – PICOS) (см. таблицу 1).
Извлечение данных, результаты и синтез данных
Рассматривая эффективность и нежелательные лекарственные реакции, мы вручную извлекли данные о величине эффекта (с 95% доверительным интервалом, ДИ) для всех соответствующих показателей, а также количество испытуемых в исследуемой и контрольной группах для каждой величины эффекта. В частности, данные по величине эффекта непрерывных показателей были извлечены или пересчитаны в виде стандартной разницы средних (SMD), которая выражает разницу средних между исследуемой и контрольной группами в единицах стандартного отклонения с 95% ДИ. В целом значение SMD меньше 0,2 рассматривается как статистически незначимая, SMD между 0,2 и 0,5 является малой, SMD между 0,5 и 0,8 – средняя, а SMD более 0,8 является большой35. Отношение рисков (risk ratio, RR) использовалось для категориальных показателей. Если присутствовало значение отношения шансов, оно было пересчитано как отношение рисков. Для обоих типов показателей мы следовали решениям изначальных авторов относительно моделей с фиксированными и случайными эффектами.
Оценка качества проанализированных исследований

Включенные мета-анализы были оценены с помощью «Измерительного инструмента для оценки систематических обзоров» («A Measurement Tool to Assess Systematic Reviews» (AMSTAR)) (диапазон оценок 0-11, где оценка выше 8 обозначает высокое качество)36.
Несмотря на то, что AMSTAR надежный и достоверный инструмент для оценки методологического качества мета-анализов, значение его оценки не отражает качества проанализированных исследований, которые могут привнести систематическую ошибку в общий результат. Например, мета-анализ, удовлетворяющий всем критериям качества, но анализирующий возможно необъективные исследования, может иметь хорошую оценку по методологическому качеству, но иметь низкое качество по содержанию.
Поэтому для более комплексной оценки достоверности содержания включенных мета-анализов мы использовали набор из шести дополнительных, ранее разработанных пунктов, оценивающих качество, каждый в диапазоне между 0 и 1 или 2, который оценивает качество содержания проанализированных статей (AMSTAR-Plus Content, диапазон оценок 0-8, где оценка выше 4 обозначает высокое качество)37.
Статистический анализ
Мы проанализировали данные в том виде, в каком они были напрямую взяты из опубликованных мета-анализов, или, при необходимости, после их приведения к стандартизированным показателям, используя комплексный мата-анализ (КМА, 3 версия (Comprehensive Meta-Analysis, CMA)) (Biostat). Для сравнения SMD экспериментальных фармакологических и нефармакологических методов интервенции и контрольных вмешательств мы провели раздельный мета-анализ случайных эффектов для каждой переменной, используя КМА.
Оценки AMSTAR и AMSTAR-plus Content и размеры выборки использовались там, где было возможно в мета-регрессионном анализе, который проводился отдельно для фармакологических и нефармакологических стратегий. При возможности мы также проводили мета-регрессионный анализ и анализ в подгруппах для изучения предполагаемых факторов, которые могли влиять на размер эффекта для каждого показателя физического здоровья в отдельности, включая характеристики участников (например, средний возраст, соотношение полов) и дизайн метода интервенции (длительность лечения в неделях, оказание помощи психиатрической или терапевтической службой, лечебное учреждение, доля посещенных консультаций/приверженность, групповое или индивидуальное лечение).
Гетерогенность была оценена с помощью Q- и I2-статистики, где значения <25%, 25-50% и >50% обозначают низкую, среднюю и высокую гетерогенность соответственно. Если было невозможно извлечь данные по размеру эффекта для комплексного мета-анализа, мы сообщали о результатах на уровне отдельного исследования в наративном синтезе.
Результаты
Результаты систематического поиска
Из 3709 поисковых совпадений были включены 27 мета-анализов39-65, представляющих в общей сложности 128 проанализированных исследований и 47 231 участника исследований.
Имелись мета-аналитические данные для 17 различных фармакологических методов интервенции: арипипра-зол 43,47,53,55, флуоксетин55, метформин46,48,49,54,55,61,62, низатидин54,55, антигонисты NMDA-рецепторов, включая амантадин и мемантин45,55,57,60, ранитидин42, топирамат39, метформин в комбинации с сибутрамином64, орлистат64, розиглитазон64, флувоксамин64, агонисты рецепторов глюкагоноподобного пептида-1 (аГПП-1)40 и смена препарата с оланзапина на кветиапин или апипразол65.
Были доступны мета-аналитические данные по 6 нефармакологическим методам интервенции: индивидуальное консультирование по образу жизни58,59,63, групповое консультирование по образу жизни58,59,63, когнитивно-поведенческая терапия58,59, обучение психологической самопомощи58, физические упражнения50, 56,58 и контроль за питанием44,58. Один мета-анализ исследовал общий эффект совместного применения модификации образа жизни и метформина41.
В общей сложности было исследовано 17 показателей физического здоровья: вес, индекс массы тела, окружность талии, отношение окружности талии к окружности бедер, систолическое и диастолическое артериальное давление, глюкоза натощак, уровень инсулина, индекс инсулинорезистентности, гликированный гемоглобин А1с, триглицериды, общий холестерин, липопротеины высокой плотности (ЛПВП), липопротеины низкой плотности (ЛПНП), соотношение «мужского»/»женского» жира (т.е. соотношение доли жира, отложившегося по мужскому типу, к доле жира, отложившегося по женскому типу), висцеральный жир и толерантность к физическим нагрузкам.
Контрольные методы интервенции включали плацебо, продолжающееся психотропное лечение или стандартное лечение для фармакологических исследований и стандартное лечение для нефармакологических исследований.
Количество исследований по специфическому показателю здоровья находилось в диапазоне от одного до 29, причем медиана была равна 5 исследованиям (межквартильный размах =5). Исследования продолжались от 6 до 72 недель. Если сообщалось, средний возраст участников был 34,9±2 года, и 58,4% были мужчины.
Оценка качества включенных мета-анализов
Средний балл по шкале AMSTAR составил 8,8±1,0 в общей выборке, 8,9±0,9 в выборке фармакологических методов интервенций и 8,7±1,0 в выборке нефармакологических методов. Двадцать четыре проанализированных исследования (89%) имели балл по AMSTAR 8 и выше, но только два42,65 (4%) имели максимальный балл (11) по AMSTAR. Средний балл по AMSTAR-Plus Content составил 3,4±1,5 в общей выборке, 3,2±1,6 в выборке фармакологических мероприятий и 3,7±1,1 в выборке нефармакологических мероприятий. Ни одно исследование не имело максимум баллов (8).
Только одиннадцать мета-анализов (41%) были оценены как высококачественные на основе проанализированных исследований. Семь из 27 анализов включали только двойные слепые исследования (26%). В 16 мета-анализах (59%) общая объединенная выборка была меньше 500 случаев, в то время, как только 5 мета-анализов (18%) имели совокупную выборку более 1000 исследуемых. Лишь два мета-анализа49,53 (7%) имели по одному включенному исследованию с как минимум 200 исследуемых. В заключение, согласно критериям AMSTAR-Plus Content, достоверная разнородность исследований была выявлена в 12 мета-анализах (44%), а 18 (67%) не смогли опровергнуть наличие систематических ошибок, связанных с предпочтительной публикацией положительных результатов исследований.
Далее мы исследовали отношение между размерами эффекта как для фармакологических, так и для нефармакологических методов интервенции и контрольными условиями с оценкой качества (AMSTAR и AMSTAR-Plus Content). SMD для фармакологических и нефармакологических методов не связана в значительной степени с методологическим качеством мета-анализов, измеренным по AMSTAR (p=0,37-0,52), и не связана с качеством содержания мета-анализов при оценке по AMSTAR-Plus Content (p=0,17-0,97).
Показатели физического здоровья при использовании фармакологических и нефармакологических методов интервенции
Обзор различных показателей физического здоровья при использовании фармакологических и нефармакологических методов у людей с шизофренией, основанный на SMD и качестве проанализированных исследований, оцененных по баллам согласно AMSTAR и AMSTAR-Plus, представлена в таблице 2 (антропометрические результаты) и таблице 3 (артериальное давление, показатели метаболизма и физической подготовленности).







Масса тела
Нефармакологические методы интервенцииШесть мета-анализов проводились относительно нефармакологических методов по уменьшению массы тела (78 исследований, N=3944). Средний балл по AMSTAR составил 8,2±0,2, средний балл по AMSTAR-Plus Content – 3,3±0,4.
Индивидуальное консультирование по образу жизни оказалось наиболее эффективным методом (SMD=-0,98, 95% ДИ: от -1,15 до -0,81, p<0,001; 14 исследований, N=411, I2=0%, Q=0,5, т.е. большой эффект), затем следовала физическая нагрузка (SMD=-0,96, 95% ДИ: от -1,15 до -0,81, p<0,001: 4 исследования, N=183, I2=0, Q=0, т.е. большой эффект).
Обучение психологической самопомощи, нацеленной на поддержание здорового образа жизни, дало средний эффект (SMD=-0,77, 95% ДИ: от -0,98 до -0,55, p<0,001: 8 исследований, N=345, I2=0, Q=0). Так же показали себя меры по контролю за питанием (SMD=-0,50, 95% ДИ: от -0,66 до -0,34, p<0,001; 22 исследования, N=1576, I2=94%, Q=15,8).
Малый эффект наблюдался при использовании когнитивно-поведенческой терапии, нацеленной на поддержание здорового образа жизни (SMD=-0,37, 95% ДИ: от -0,55 до -0,18, p=0,22; 11 исследований, N=546, I2=0%, Q=0,2), и группового консультирования по образу жизни (SMD=-0,39, 95% ДИ: от -0,54 до -0,23, p<0,001; 19 исследований, N=883, I2=28%, Q=2,8).
Относительно предупреждения увеличения веса мультидисциплинарное консультирование по поведению/образу жизни показало средний эффект (SMD=–0,69, 95% ДИ: от -0,84 до -0,54, р<0,001; 14 исследований, N=694, I2=0%, Q=1,4).
Фармакологические методы интервенции14 мета-анализов проводились относительно фармакологических методов интервенции для снижения массы тела (82 исследования, N=4691). Средняя оценка по AMSTAR была 8,1±1,3 и средний балл по AMSTAR-Plus Content был 4,0±1,7.
Средний размер эффекта наблюдался при поддержке арипипразолом (SMD=-0,73, 95% ДИ: от -0,97 до -0,48, p<0,001; 9 исследований, N=813, I2=68%, Q=6,2), при использовании топирамата (SMD=-0,72, 95% ДИ: от -1,56 до -0,33, p<0,001; 15 исследований, N=783, I2=92,7%, Q=13,7), d-фенфлурамина (SMD=-0,54, 95% ДИ: от -1,07 до -0,02, p<0,001; одно исследование, N=16) и метформина (SMD=-0,53, 95% ДИ: от -0,69 до -0,38, p<0,001; 29 исследований, N=1279, I2=39,4%, Q=1,6).
Малая значимость эффекта была показана при использовании антагонистов NMDA-рецепторов (SMD=-0,47, 95% ДИ: от -0,62 до -0,32, p<0,001; 5 исследований, N=309, I2=0%, Q=0,1), агонистов рецепторов ГПП-1 (SMD=-0,44, 95% ДИ: от -0,60 до -0,28, p<0,001; 3 исследования, N=168, I2=0%, Q=0,1) и амантадина (SMD=-0,30, 95% ДИ: от -0,57 до -0,03, p=0,03; 3 исследования, N=205, I2=0%, Q=0). Назитидин показал ничтожно малый эффект (SMD=-0,12, 95% ДИ: от -0,24 до 0,00, p=0,02; 4 исследования, N=357, I2=0%, Q=0,4).
Не наблюдалось значимого снижения веса по сравнению с контрольной группой при использовании флуоксетина (SMD=0,14, 95% ДИ: от –0,09 до 0,36, p=0,22; 2 исследования, N=60, I2=0%, Q=0), декстроамфетамина (SMD=0,11, 95% ДИ: от -0,33 до 0,56, p=0,60; одно исследование, N=20), ранитидина (SMD=-0,24, 95% ДИ: от -0,67 до 0,20, p=0,05; 4 исследования, N=260), фамотидина (SMD=-0,02, 95% ДИ: от -0,48 до 0,43, p=0,91; одно исследование, N=14), комбинации метформина с сибутрамином (SMD=-0,24, 95% ДИ: от -0,62 до 0,13, p=0,19; одно исследование, N=28), орлистата (SMD=-0,21, 95% ДИ: от -0,46 до 0,04, p=0,09; одно исследование, N=63) и розиглитазона (SMD=0,14, 95% ДИ: от -0,21 до 0,52, p=0,19; одно исследование, N=29). Смена препарата с оланзапина на кветиапин или арипипразол не показала значимых результатов (SMD=–0,11, 95% ДИ: от –0,23 до 0,03, p=0,06; 2 исследования, N=287).
Комбинированные фармакологические и нефармакологические методы интервенции
В одном мета-анализе были исследованы комбинация метформина с мероприятиями по модификации образа жизни, они продемонстрировали малый эффект (SMD=–0,44, 95% ДИ: от –0,69 до –0,19, p<0,001; 3 исследования, N=122, I2=0, Q=0).
Индекс массы тела
Нефармакологические методы интервенцииЧетыре мета-анализа было проведено относительно нефармакологических методов по снижению индекса массы тела (42 исследования, N=2157). Средний балл по AMSTAR был равен 9,7±0,8 и средний балл по AMSTAR-Plus Content составил 2,2±1,2.
Малый эффект наблюдался при использовании группового консультирования по образу жизни (SMD=–0,28, 95% ДИ: от –0,54 до 0,00, p=0,04; 4 исследования, N=202, I2=0%, Q=0), индивидуального консультирования по образу жизни (SMD=–0,49, 95% ДИ: от –0,77 до –0,22, p<0,001; 4 исследования, N=202, I2=0%, Q=0), и когнитивно-поведенческой терапии, нацеленной на поддержание здорового образа жизни (SMD=–0,34, 95% ДИ: от –0,67 до –0,07, p=0,02; 6 исследований, N=308, I2=0%, Q=0,2).
Не наблюдалось значимого снижения ИМТ по сравнению с контрольной группой при использовании физических упражнений (SMD=–0,25, 95% ДИ: от –0,56 до 0,06, p=0,11; 8 исследований, N=231, I2 =0%, Q=0,4).
Фармакологические методы интервенции
Шесть мета-анализов изучали фармакологические методы по снижению ИМТ (81 исследование, N=4533). Средний балл по AMSTAR был равен 8,1±1,3 и средний балл по AMSTAR-Plus Content составил 4,0±1,9.
Топирамат (SMD=–0,56, 95% ДИ: от –1,54 до –0,22, p<0,001; 11 исследований, N=449, I2=0%, Q=0) имел средний эффект снижения ИМТ, в то время как агонисты рецепторов ГПП-1 показали лишь малый эффект (SMD=–0,41, 95% ДИ: от –0,57 до –0,26, p<0,001; 3 исследования, N=168, I2=0%, Q=0).
Снижения индекса массы тела не наблюдалось при использовании метформина (SMD=–0,41, 95% ДИ: от –0,93 до 0,10, p=0,10; 23 исследования, N=1228, I2=90%, Q=20,0), ранитидина (SMD=–0,23, 95% ДИ: от –0,44 до 0,00, p=0,55; 5 исследований, N=312, I2=0%, Q=0) и при смене препаратов с оланзапина на кветиапин (SMD=–0,12, 95% ДИ: от –0,29 до 0,05, p=0,16; одно исследование, N=129).
Окружность талии
Нефармакологические методы интервенцииТри мета-анализа изучали нефармакологические методы по уменьшению окружности талии (24 исследования, N=1709). Средний балл по AMSTAR составил 9,3±0,5 и средний балл по AMSTAR-Plus Content равен 4,0±0,8.
Малую эффективность относительно уменьшения окружности талии по сравнению со стандартным лечением показал контроль за питанием (SMD=–0,39, 95% ДИ: от –0,56 до –0,22, p<0,001; 11 исследований, N=858, I2=0%, Q=0) и междисциплинарные меры по изменению поведения/образа жизни (SMD=–0,37, 95% ДИ: от –0,60 до -0,13, p=0,002; 10 исследований, N=705, I2=0%, Q=0).
Фармакологические методы интервенции
Семь мета-анализов исследовали фармакологические методы по уменьшению окружности талии (32 исследования, N=1755). Средний балл по AMSTAR был равен 9,3±0,7 и средний балл по AMSTAR-Plus Content равен 2,8±1,6.
По сравнению с контрольной группой наиболее эффективным методом интервенции оказалась поддержка арипипразолом (SMD=–1,10, 95% ДИ: от –1,42 до –0,79, p=0,001; 3 исследования, N=174, I2=0%, Q=0, т.е. большой эффект).
Топирамат оказывал средний эффект (SMD=–0,69, 95% ДИ: от –0,93 до –0,45, p<0,05; 8 исследований, N=310, I2=0%, Q=0). Агнонисты рецепторов ГПП-1 имели малый эффект (SMD=–0,34, 95% ДИ: от –0,50 до –0,18, p<0,001; 3 исследования, N=167, I2=0%, Q=0). По сравнению с плацебо-контролируемой группой статистически значимого уменьшения окружности талии не наблюдалось при использовании метформина (SMD=–0,01, 95% ДИ: от –0,68 до 0,65, p=0,97; 12 исследований, N=721, I2=82%, Q=17,1).
Отношение окружности талии к окружности бедер
Три мета-анализа изучали эффекты фармакологических методов на отношение окружности талии к окружности бедер (11 исследований, N=419). Средний балл по AMSTAR был равен 9,3±0,7 и средний балл по AMSTAR-Plus Content составил 2,8±1,6.
Малый эффект на уменьшение отношения окружности талии к окружности бедер наблюдался при использовании топирамата (SMD=–0,69, 95% ДИ: от –0,90 до 0,27, p=0,009; 5 исследований, N=123, I+=0%, Q=0) и метформина (SMD=–0,32, 95% ДИ: от –1,15 до 0,51, p=0,29; 3 исследования, N=133, I2=0%, Q=0). Агонисты рецепторов ГПП-1 не продемонстрировали значимого эффекта: (SMD=0,03, 95% ДИ: от –0,13 до 0,18, p=0,39; 3 исследования, N=163, I2=0%, Q=0).
Соотношение ожирения по мужскому и женскому типу
Основываясь на данных одного мета-анализа, агонисты рецепторов ГПП-1 не превзошли контрольную группу по эффекту на соотношение ожирения по мужскому и женскому типу (SMD=–0,03, 95% ДИ: от –0,20 до 0,13, p=0,46; 3 исследования, N=131, I2=0%, Q=0).
Висцеральный жир
Основываясь на данных одного мета-анализа, агонисты рецепторов ГПП-1 имели малый эффект на уменьшение висцерального жира (SMD=–0,37, 95% ДИ: от –0,46 до –0,06, p=0,02; 3 исследования, N=97, I2=0%, Q=0).
Артериальное давление
Нефармакологические методы интервенцииЧетыре мета-анализа исследовали нефармакологические мероприятия по снижению артериального давления (23 исследования, N=2095). Средний балл по AMSTAR был равен 9,0±0,0 и средний балл по AMSTAR-Plus Content равен 4,5±0,5.
При рассмотрении только контроля за питанием наблюдался малый эффект на снижение диастолического давления по сравнению со стандартным лечением (SMD=–0,39, 95% ДИ: от –0,56 до –0,22, p<0,01; 6 исследований, N=654, I2=0, Q=0).
По сравнению со стандартным лечением, при использовании междисциплинарных мер по изменению поведения/образа жизни не наблюдалось значимого снижения ни систолического (SMD=–0,22, 95% ДИ: от –0,49 до 0,05, p=0,11; 7 исследований, N=615, I2=0, Q=0), ни диастолического артериального давления (SMD=–0,08, 95% ДИ: от –0,57 до 0,41, p=0,74; 3 исследования, N=171, I2=0, Q=0).
Фармакологические методы интервенции
Два мета-анализа изучали фармакологические методы по снижению артериального давления (6 исследований, N=336). Средний балл по AMSTAR был равен 9,5±0,5 и средний балл по AMSTAR-Plus Content составил 1,5±0,5.
По сравнению с группой плацебо, не наблюдалось значимого снижения систолического и диастолического артериального давления при использовании агонистов рецепторов ГПП-1 и метформина.
Глюкоза
Нефармакологические методы интервенцииТри мета-анализа исследовали нефармакологические методы интервенции по снижению уровня глюкозы крови натощак (16 исследований, N=1256). Средний балл по AMSTAR был равен 9,3±0,5 и средний балл по AMSTAR-Plus Content составил 4,0±0,8.
Контроль за питанием дал малый эффект по снижению уровня глюкозы (SMD=–0,37, 95% ДИ: от –0,69 до –0,05, p=0,03; 6 исследований, N=422, I2=0%, Q=0).
Значимого снижения уровня глюкозы не наблюдалось в сравнении со стандартным лечением при использовании мультидисциплинарных мер по изменению поведении/образа жизни (SMD=–0,27, 95% ДИ: от –0,59 до 0,05, p=0,10; 8 исследований, N=688, I2=0%, Q=0).
Фармакологические методы интервенции
Семь мета-анализов исследовали эффекты фармакологических мер по снижению уровня глюкозы крови натощак (54 исследования, N=3617). Средний балл по AMSTAR составил 9,6±0,6 и средний балл по AMSTAR-Plus Content равен 3,1±1,9.
Средний эффект на снижение уровня глюкозы натощак был обнаружен при смене препарата с оланзапина на кветиапин или арипипразол (SMD=–0,71, 95% ДИ: от –0,85 до –0,58, p<0,001; 2 исследования, N=280) и при использовании метформина (SMD=–0,65, 95% ДИ: от –0,94 до –0,35, p<0,001; 17 исследований, N=1281, I2=0%, Q=0).
Малый эффект был выявлен при поддержке арипипразолом (SMD=–0,34, 95% ДИ: от –0,47 до –0,21, p<0,001; 10 исследований, N=710, I2=0%, Q=0) и при использовании агонистов рецепторов ГПП-1 (SMD=–0,39, 95% ДИ: от –0,54 до –0,23, p<0,001; 3 исследования, N=166, I2=0%, Q=0).
Значимого снижения уровня глюкозы по сравнению с контролем не наблюдалось при использовании и топирамата (SMD=–0,43, 95% ДИ: от –1,00 до 0,14, p=0,14; 6 исследований, N=369, I2=0%, Q=0).
Инсулин
Нефармакологические методы интервенцииДва мета-анализа исследовали эффект нефармакологических методов интервенции на уровень инсулина (9 исследований, N=1268). Средний балл по AMSTAR был равен 9,0±0,0 и средний балл по AMSTAR-Plus Content равен 4,5±0,7.
Мультидисциплинарные меры по изменению поведения/образа жизни имели малый эффект на улучшение чувствительности к инсулину (SMD=–0,28, 95% ДИ: от –0,55 до 0,00, p=0,04; 6 исследований, N=481, I2=0%, Q=0). Только контроль за питанием не превзошел группу контроля (SMD=–0,19, 95% ДИ: от –0,42 до 0,04, p=0,10; 11 исследований, N=787, I2=0%, Q=0).
Фармакологические методы интервенции
Пять мета-анализов изучали эффективность фармакологических мер относительно уровеня инсулина (23 исследования, N=1479). Средний балл по AMSTAR был равен 8,4±1,2 и средний балл по AMSTAR-Plus Content равен 4,2±2,2.
Розиглитазон имел малый эффект (SMD=–0,42, 95% ДИ: от –0,80 до 0,00, p=0,03; одно исследование, N=29). Метформин не превзошел показателей контрольной группы (SMD=–0,37, 95% ДИ: от –0,81 до 0,07, p=0,10; 15 исследований, N=1007, I2=79,2%, Q=4,8).
Гомеостатическая модель оценки уровня инсулинорезистентности
Фармакологические методы интервенцииПять мета-анализов исследовали эффект фармакологических мероприятий на гомеостатическую модель оценки уровня инсулинорезистентности (19 исследований, N=1158). Средний балл по AMSTAR был равен 8,4±1,2 и средний балл по AMSTAR-Plus Content равен 4,2±2,2.
Метформин (SMD=–0,75; 95% ДИ: от –1,10 до –0,40, p<0,001; 11 исследований, N=680, I2=0%, Q=0, т.е. средний эффект) и розиглитазон (SMD=–0,44; 95% ДИ: от –0,82 до –0,06, p=0,02; одно исследование, N=29, т.е. малый эффект) значимо превзошли контрольную группу, в то время как агонисты рецепторов ГПП-1 – нет (SMD=–0,08; 95% ДИ: от –0,23 до 0,08, p=0,10; 3 исследования, N=163, I2=0%, Q=0).
Гликированный гемоглобин A1c
Два мета-анализа изучали эффективность фармакологических методов на уровень гемоглобина A1c (7 исследований, N=549). Средний балл по AMSTAR был равен 9,0±0,0 и средний балл по AMSTAR-Plus Content равен 3,5±3,5.
Метформин (SMD=–0,38; 95% ДИ: от –0,69 до –0,07, p=0,016; 4 исследования, N=383, I2=0%, Q=0) и агонисты рецепторов ГПП-1 (SMD=–0,38; 95% ДИ: от –0,53 до –0,22, p=0,02; 3 исследования, N=166, I2=0%, Q=0) незначительно превзошли группу плацебо и показали малый эффект.
Триглицериды
Нефармакологические методы интервенцииЧетыре мета-анализа изучали влияние нефармакологических мероприятий на уровень триглицеридов (22 исследования, N=1671). Средний балл по AMSTAR был равен 8,7±1,1 и средний балл по AMSTAR-Plus Content равен 4,2±0,8.
Междисциплинарные меры относительно изменения поведения/образа жизни имели малый эффект в сравнении со стандартным лечением (SMD=–0,37, 95% ДИ: от –0,54 до –0,20, p<0,001; 8 исследований, N=659, I2=40,0%, Q=1,7). Контроль за питанием не превзошел стандартное лечение (SMD=–0,15; 95% ДИ: от –0,30 до 0,00, p=0,06; 7 исследований, N=611, I2=0%, Q=0).
Фармакологические методы интервенции
Семь мета-анализов изучали эффект фармакологических мероприятий на уровень триглицеридов (36 исследований, N=2564). Средний балл по AMSTAR был равен 9,1±1,0 и средний балл по AMSTAR-Plus Content равен 3,6±1,9.
Эффект, в сравнении с контрольными условиями, был средним при использовании топирамата (SMD=–0,68, 95% ДИ: от –1,23 до –0,13, p=0,016; 5 исследований, N=268, I2=0%, Q=0), малым при использовании метформина (SMD=–0,28, 95% ДИ: от –0,45 до –0,11, p<0,001; 11 исследований, N=856, I2=5%, Q=2,1), и ничтожно малым при поддержке арипипразолом (SMD=–0,17, 95% ДИ: от –0,30 до –0,04, p=0,009; 9 исследований, N=631, I+=0%, Q=0) и использовании агонистов рецепторов ГПП-1 (SMD=–0,15, 95% ДИ: от –0,31 до –0,02, p=0,04; 3 исследования, N=166, I2=0%, Q=0).
Холестерин
Нефармакологические методы интервенцииДесять мета-анализов изучали нефармакологические методы для уменьшения уровня холестерина (56 исследований, N=4288). Средний балл по AMSTAR был равен 8,5±1,0 и средний балл по AMSTAR-Plus Content равен 4,5±0,7.
Относительно уровня общего холестерина мультидисциплинарные меры по изменению поведения имели малый эффект (SMD=–0,35, 95% ДИ: от –0,54 до –0,16, p=0,003; 7 исследований, N=590, I2=0%, Q=0,3), в то время как контроль за питанием не превзошел эффект стандартного лечения (SMD=–0,13; 95% ДИ: от –0,29 до 0,03, p=0,10; 7 исследований, N=621, I2=0%, Q=0).
Относительно ЛПНП мультидисциплинарные меры по изменению поведения/образа жизни показали малый эффект (SMD=–0,36, 95% ДИ: от –0,60 до –0,12, p=0,003; 5 исследований, N=590, I2=0%, Q=0,2).
Достоверных эффектов на уровень ЛПВП не было обнаружено при применении мер по изменению образа жизни или контроля за питанием.
Фармакологические методы интервенции
Пятнадцать мета-анализов изучали фармакологические методы по уменьшению уровня холестерина (74 исследования, N=5295). Средний балл по AMSTAR был равен 9,4±0,8 и средний балл по AMSTAR-Plus Content равен 3,3±1,8.
Относительно уровня общего холестерина метформин (SMD=–0,51, 95% ДИ: от –0,81 до –0,20, p<0,001; 8 исследований, N=628, I2=0%, Q=0) продемонстрировал средний эффект, в то время как поддержка арипипразолом имела малый эффект (SMD=–0,32, 95% ДИ: от –0,47 до –0,17, p<0,001; 10 исследований, N=692, I2=0%, Q=0). Значимого снижения по сравнению с контрольными условиями не наблюдалось при применении топирамата (SMD=–0,75, 95% ДИ: от –1,57 до 0,07, p=0,07; 3 иследования, N=187, I2=0%, Q=0).
В отношении уроня ЛПНП топирамат (SMD=–0,80, 95% ДИ: от –1,06 до –0,53, p<0,001; 4 исследования, N=247, I2=0%, Q=0) и агонисты рецепторов ГПП-1 (SMD=–0,17, 95% ДИ: от –0,32 до –0,02, p=0,04; 3 исследования, N=162, I2=0%, Q=0) превзошли контрольные условия, хотя во втором случае эффект был ничтожно малым. Не было обнаружено значимого снижения уровня ЛПНП по сравнению с контрольными условиями при поддержке арипипразолом (SMD=–0,01, 95% ДИ: от –0,18 до 0,15, p=0,88; 8 исследований, N=540, I2=0%, Q=0) и при использовании метформина (SMD=–0,11, 95% ДИ: от –0,31 до 0,09, p=0,29; 5 исследований, N=433, I2=0%, Q=0,2).
Относительно ЛПВП только метформин имел малый эффект (SMD=0,45, 95% ДИ: 0,00 до 0,90, p=0,049; 7 исследований, N=542, I2=0%, Q=0), в то время как поддержка арипипразолом, топирамат и агонисты рецепторов ГПП-1 не отличались от контрольных условий.
Толерантность к физическим нагрузкам
Основываясь на данных одного метаанализа, физические упражнения превзошли эффект стандартного лечения (SMD=1,81; 95% ДИ: от 0,59 до 3,03, p=0,004; одно исследование, N=13, I2=0%, Q=0, т.е., большой эффект).
Нежелательные эффекты от препаратов
По сравнению с плацебо Арипипразол чаще вызывал тревогу (number needed to harm, NNH (индекс потенциального вреда, ИПВ)=8, 95% ДИ: 5–20, p<0,001)47 и ажитацию/акатизию (RR=7,59, 95% ДИ: 1,43–40,18, p=0,02)53. Амантадин был ассоциирован с более высокой частотой инсомнии (RR=3,83, 95% ДИ: 1,41–10,38, p=0,008, NNH=9)57 и дискомфортом в животе (количественные данные не были приведены)60. Агонисты рецепторов ГПП-1 были связаны с повышенной частотой тошноты (NNH=3,8, 95% ДИ: 2,4–9,7, p<0,05)40. Среди Н2-антагонистов, фамотидин и ранитидин не ассоциировались с высокой частотой нежелательных явлений, в то время как назитидин чаще вызывал сухость во рту (RR=4,89, p=0,04; NNH=17, p=0,03) и депрессию (RR=5,00, p=0,03; NNH=17, p=0,02)52.
Из шести включенных мета-анализов по метформину пять сообщали об отсутствии различий в частоте нежелательных явлений, в то время как один из них сообщал о более высокой частоте тошноты/рвоты (NNH=16, 95% ДИ: 10–50, p=0,01) и диареи (NNH=6,95% ДИ: 3–25, p=0,01)49. Хотя не было различий в частоте отказа от лечения орлистатом, но диарея была основной причиной прекращения лечения48.
Сибутрамин плюс метформин ассоциировались с повышенной частотой психотических симптомов. Топирамат чаще вызывал парестезии (RR=2,31, 95% ДИ: 1,17–4,56, p<0,05)39. Данные по декстроамфетамину, d-фенфлурамину и розиглитазону отсутствуют. Смена антипсихотиков (оланзапин на кветиапин) была ассоциирована с повышенной частотой психиатрических нежелательных явлений54.
Ни один из мета-анализов не сообщал о нежелательных явлениях нефармакологических методов интервенции.
Мета-регрессивный анализ
Из-за ограниченного количества данных мета-регрессивный анализ или анализ по подгруппам не проводился для оценки, могут ли длительность лечения или болезни, проведение лечения психиатрическим или терапевтическим персоналом, медицинское учреждение, доля посещенных сессий или приверженность лечению объяснить различия в результатах лечебных методов интервенции.Исследование уровня различий в возрасте и поле не объясняют различия в весе, индексе массы тела или уровне триглицеридов после фармакологических или нефармакологических методов интервенции.
ОБСУЖДЕНИЕ
Насколько нам известно, этот мета-обзор мета-анализов является первым, который систематически и количественно сравнивает фармакологические и нефармакологические методы интервенции, которые были исследованы для улучшения показателей физического здоровья людей с шизофренией. Наши данные пролили свет на те области, где имелись или отсутствовали значимые данные по улучшению физического здоровья у этих людей, и должны помочь вести клиническую практику и указывать, на чем должны сконцентрироваться дальнейшие приоритеты исследования.При рассмотрении нефармакологических методов интервенции индивидуальное консультирование по образу жизни показало большой эффект по уменьшению веса. Относительно контроля за питанием эффект снижения веса был средним, а эффект снижения диастолического артериального давления и снижения уровня глюкозы были малыми. Физическая нагрузка продемонстрировала большой эффект снижения веса и большой эффект по увеличению толерантности к физическим нагрузкам, хотя данные по последнему ограничены одним небольшим исследованием.
Характеристики методов интервенции по изменению образа жизни были оценены для предоставления руководств для дальнейшей клинической практики. Одной ключевой находкой было то, что индивидуальное консультирование по образу жизни показало большой эффект по снижению массы тела, в то время как для групповых подходов был лишь малый эффект. По-видимому, преимущества индивидуальной стратегии, такие как персональные советы и внимание, удовлетворяющие специфические потребности пациента, и индивидуальный план действий превосходят преимущества групповых сессий, такие как межличностное обучение, подражательное поведение, распознавание схожих черт у других членов группы, групповая сплоченность и партнерская поддержка66. Будущие исследования должны изучить, будет ли комбинированный подход, заключающий в себе групповые сессии, одновременно направленные на специфические потребности пациента с индивидуальным планом действий, наиболее эффективен.
Когнитивно-поведенческая терапия, нацеленная на снижение веса и обучение психологической самопомощи, продемонстрировала малый и средний эффекты соответственно.
Среди 17 фармакологических стратегий 12 превзошли контрольные условия по различным показателям физического здоровья. Не было обнаружено никаких благоприятных эффектов флуоксетина, ранитидина, орлистата, декстроамфетамина и фамотидина на какие-либо показатели физического здоровья.
Топирамат показал большой эффект по уменьшению ЛПНП и средний эффект по уменьшению веса, индекса массы тела, окружности талии и уровня триглицеридов. Метформин продемонстрировал средний эффект по снижению веса, общего холестерина, уровня глюкозы натощак и индекса инсулинорезистентности, а также малый эффект по уменьшению уровня гемоглобина А1с, триглицеридов и ЛПВП.
Смена препарата с оланзапина на кветиапин или арипипразол показала средний эффект по уменьшению уровня глюкозы натощак, притом что эффект от поддержки арипипразолом по этому параметру был малым. Поддержка арипипразолом продемонстрировала также большой эффект по уменьшению окружности талии и средний эффект по уменьшению массы тела.
Малый эффект по снижению массы тела был обнаружен у антагонистов рецепторов NMDA. Агонисты рецепторов ГПП-1 показали малый эффект по уменьшению окружности талии, уровня глюкозы и гемоглобина А1с. Розиглитазон имел небольшой улучшающий эффект на уровень инсулинорезистентности. Малый эффект поддержки арипипразолом и агонистов рецепторов ГПП-1 выявлен по снижению уровня триглицеридов, а агонисты рецепторов ГПП-1 показали по снижению уровня ЛПНП.
В заключение, основываясь на SMD и совокупном высоком методологическом качестве оригинальных мета-анализов (но с более низким качеством содержания мета-анализов), индивидуальное консультирование по образу жизни и физические упражнения показали наибольший эффект снижения веса, затем следуют обучение психологической самопомощи, поддержка арипипразолом, использование топирамата, d-фенфлурамина и метформина. Относительно окружности талии поддержка арипипразолом и применение топирамата продемонстрировали наилучший эффект, затем следует контроль за питанием. Контроль за питанием был единственным значимо повлиявшим на диастолическое артериальное давление.
Смена препарата с оланзапина на кветиапин или арипипразол и метформин продемонстрировала лучший значимый эффект по снижению уровня глюкозы, затем следуют агонисты рецепторов ГПП-1, контроль за питанием и поддержка арипипразолом. Уровень гемоглобина А1с был статистически значимо снижен как метформином, так и агонистами рецепторов ГПП-1. Индекс инсулинорезистентности значимо изменился при применении метформина и розиглитазона.
Уменьшение уровня триглицеридов было наибольшим при применении топирамата, затем следуют мультидисциплинарные меры по изменению поведения/образа жизни, метформин, поддержка арипипразолом и агонисты рецепторов ГПП-1. Общий холестерин был уменьшен при использовании метформина, модификации образа жизни и поддержке арипипразолом, в то время как уменьшение уровня ЛПНП было значимым при использовании топирамата, модификации образа жизни и агонистов рецепторов ГПП-1. Уровень ЛПВП увеличился только при применении метформина. И только физические упражнения были мета-проанализированы как способ повышения толерантности к физической нагрузке, демонстрируя наибольший размер эффекта из всех методов в данном обзоре по какому-либо показателю (SMD=1,81), однако эти данные были основаны только на одном исследовании.
В своей совокупности наши данные предлагают клиницистам некоторые точки зрения по потенциально лучшим методам решения специфических проблем с физическим здоровьем людей с шизофренией. Суммируя, для снижения веса практикующим врачам следует рассматривать индивидуальное консультирование по образу жизни как лучшее из нефармакологических методов интервенции. Физические упражнения также могут привести к снижению веса, хотя мы может включить лишь только четыре исследования. Контроль за питанием также может быть перспективным. Относительно фармакологических методов клиницистам следует рассматривать дополнительное использование топирамата, но эта мера должна быть рассмотрена в противовесе с возможным возникновением парестезий и когнитивных нежелательных явлений (последние изучены недостаточно). Данные по метформину были несколько разнородными, так как средство имело средний эффект по снижению веса, но никакого эффекта на индекс массы тела, хотя последнее могло быть скорее вследствие небольшого количества исследований, оценивающих этот показатель. Метформин может быть ассоциирован с возникновением тошноты и диареи. Дальнейшие исследования необходимы для определения эффектов комбинации этих стратегий.
Что касается других показателей физического здоровья и сердечно-сосудистого риска, имеется достаточная значимость, что клиницисты могут использовать их для уменьшения уровня глюкозы крови, уровня инсулинорезистентности и общего холестерина, в то время как имеется лишь малый эффект по уменьшению уровня триглицеридов, гемоглобина А1с и ЛПНП. Людям с шизофренией, принимающим оланзапин, смена препарата на кветиапин или арипипразол также может дать средний эффект снижения глюкозы крови. Стоит отметить, что только контроль за питанием показал значительное улучшение показателя диастолического артериального давления.
Наши данные имеют некоторые ограничения. Во-первых, хоть включенные мета-анализы и были наиболее обновленными и/или крупными для каждой определенной стратегии и показателя, отдельные исследования, опубликованные с момента даты последнего поиска включенных мета-анализов, не были добавлены. Во-вторых, по причине ограниченности данных по характеристикам участников и методам интервенций, проведение мета-регрессивного анализа не было возможным. В-третьих, в то время как качество мета-анализов было в основном высокое, содержание проанализированных исследований часто вызывало сомнение. В-четвертых, основываясь на баллах по AMSTAR-Plus Content, публикационные систематические ошибки были проблемой для примерно половины из всех мета-анализов, что могло привести к переоценке обобщенных размеров эффекта. Последнее, преобладание исследований с небольшой выборкой, в которых только большие эффекты были статистически значимыми, представляет проблему.
В заключение: несмотря на высокий риск физических коморбидностей у людей с шизофренией и факт их преждевременной смертности в основном из-за повышенного риска физических заболеваний, существующие данные по фармакологическим и нефармакологическим методам профилактики и лечения этих состояний все еще ограничены. Отличные по качеству и достаточно большие индивидуальные рандомизированные клинические исследования остаются необходимыми.
В добавление, эта область должна перейти от мета-анализа на уровне исследования к мета-анализу на уровне пациента, поскольку это обеспечит более персонализированную картину эффектов лечения для отдельных лиц, полученную из адекватных анализов модератора, медиатора и подгруппы. Сравнение фармакологических и нефармакологических методов в одном и том же исследовании остается предпочтительным, а также есть потребность в крупномасштабных исследованиях комбинированных режимов (т.е. использование смены антипсихотического препарата и дополнительное назначение сопутствующей модификации образа жизни) и профилактических мероприятий (например, тех, которые нацелены на предотвращение физических коморбидностей до их развития).
БЛАГОДАРНОСТИ
Б. Стаббс читает клинические лекции при поддержке Health Education England и the National Institute for Health Research (NIHR) Integrated Clinical Academic Programme (ICA-CL-2017-03-001). Б. Стаббс и Ф. Гогран частично поддерживаются благотворительной организацией The Maudsley Charity и the NIHR Collaboration for Leadership in Applied Health Research and Care South London at King’s College Hospital NHS Foundation Trust. Мнения, выраженные в этой статье, принадлежат авторам и необязательно совпадают с вышеуказанными.
DOI: 10.1002/wps.20614
Список исп. литературыСкрыть список1. Vancampfort D, Wampers M, Mitchell A et al. A meta-analysis of cardiometabolic abnormalities in drug naпve, first-episode and multi-episode patients with schizophrenia versus general population controls. World Psychiatry 2013;12:240-50.
2. Stubbs B, De Hert M, Sepehry A et al. A meta-analysis of prevalence estimatesand moderators of low bone mass in people with schizophrenia. Acta Psychiatr Scand 2014;130:470-86.
3. Stubbs B, Koyanagi A, Veronese N et al. Physical multimorbidity and psychosis: comprehensive cross sectional analysis including 242,952 people across 48 low- and middle-income countries. BMC Med 2016;14:189.
4. Vancampfort D, Stubbs B, Mitchell AJ et al. Risk of metabolic syndrome and its components in people with schizophrenia and related psychotic disorders, bipolar disorder and major depressive disorder: a systematic review and meta-analysis. World Psychiatry 2015;14:339-47.
5. Liu NH, Daumit GL, Dua T et al. Excess mortality in persons with severe mental disorders: a multilevel intervention framework and priorities for clinical practice, policy and research agendas. World Psychiatry 2017;16:30-40.
6. Vancampfort D, Firth J, Schuch FB et al. Sedentary behavior and physical activity levels in people with schizophrenia, bipolar disorder and major depressive disorder: a global systematic review and meta-analysis. World Psychiatry 2017;16:308-15.
7. Firth J, Stubbs B, Teasdale SB et al. Diet as a hot topic in psychiatry: a population-scale study of nutritional intake and inflammatory potential in severe mental illness. World Psychiatry 2018;17:365-6.
8. Schroeder SA. Smoking cessation should be an integral part of serious mental illness treatment. World Psychiatry 2016;15:175-6.
9. Correll C, Detraux J, De Lepeleire J et al. Effects of antipsychotics, antidepressants and mood stabilizers on risk for physical diseases in people with schizophrenia, depression and bipolar disorder. World Psychiatry 2015;14:119-36.
10. Galling B, Roldбn A, Nielsen RE et al. Type 2 diabetes mellitus in youth exposed to antipsychotics: a systematic review and meta-analysis. JAMA Psychiatry 2016;73:247-59.
11. Vancampfort D, Correll CU, Galling B et al. Diabetes mellitus in people with schizophrenia, bipolar disorder and major depressive disorder: a systematic review and large scale meta-analysis. World Psychiatry 2016;15:166-74.
12. De Hert M, Schreurs V, Vancampfort D et al. Metabolic syndrome in people with schizophrenia: a review. World Psychiatry 2009;8:15-22.
13. Correll CU, Solmi M, Veronese N et al. Prevalence, incidence and mortality from cardiovascular disease in patients with pooled and specific severe mental illness: a large-scale meta-analysis of 3,211,768 patients and 113,383,368 controls. World Psychiatry 2017;16:163-80.
14. Schoepf D, Uppal H, Potluri R et al. Physical comorbidity and its relevance on mortality in schizophrenia: a naturalistic 12-year follow-up in general hospital admissions. Eur Arch Clin Neurosci 2014;264:3-28.
15. Stubbs B, Koyanagi A, Thompson T et al. The epidemiology of back pain and its relationship with depression, psychosis, anxiety, sleep disturbances, and stress sensitivity: data from 43 low- and middle-income countries. Gen Hosp Psychiatry 2016;43:63-70.
16. Stubbs B, Gaughran F, Mitchell AJ et al. Schizophrenia and the risk of fractures: a systematic review and comparative meta-analysis. Gen Hosp Psychiatry 2015;37:126-33.
17. Vancampfort D, Rosenbaum S, Probst M et al. Promotion of cardiorespiratory fitness in schizophrenia: a clinical overview and meta-analysis. Acta Psychiatr Scand 2015;132:131-43.
18. Vancampfort D, Rosenbaum S, Schuch F et al. Cardiorespiratory fitness in severe mental illness: a systematic review and meta-analysis. Sports Med 2017;47:343-52.
19. Vancampfort D, Guelinckx H, Probst M et al. Health-related quality of life and aerobic fitness in people with schizophrenia. Int J Ment Health Nurs 2015;24:394-402.
20. Vancampfort D, Probst M, Scheewe T et al. Lack of physical activity during leisure time contributes to an impaired health related quality of life in patients with schizophrenia. Schizophr Res 2011;129:122-7.
21. Saxena S, Maj M. Physical health of people with severe mental disorders: leave no one behind. World Psychiatry 2017;16:1-2.
22. Mitchell AJ, Delaffon V, Vancampfort D et al. Guideline concordant monitoring of metabolic risk in people treated with antipsychotic medication: systematic review and meta-analysis of screening practices. Psychol Med 2012;42:125-47.
23. Zhuo C, Tao R, Jiang R et al. Cancer mortality in patients with schizophrenia: systematic review and meta-analysis. Br J Psychiatry 2017;211:7-13.
24. Hjorthøj C, Stürup AE, McGrath JJ et al. Years of potential life lost and life expectancy in schizophrenia: a systematic review and meta-analysis. Lancet Psychiatry 2017;4:295-301.
25. Oakley P, Kisely S, Baxter A et al. Increased mortality among people with schizophrenia and other non-affective psychotic disorders in the community: a systematic review and meta-analysis. J Psychiatr Res 2018;102:245-53.
26. Moore S, Shiers D, Daly B et al. Promoting physical health for people with schizophrenia by reducing disparities in medical and dental care. Acta Psychiatr Scand 2015;132:109-21.
27. De Hert M, Cohen D, Bobes J et al. Physical illness in patients with severe mental disorders. II. Barriers to care, monitoring and treatment guidelines, plus recommendations at the system and individual level. World Psychiatry 2011;10:138-51.
28. Lambert TJ, Reavley NJ, Jorm AF et al. Royal Australian and New Zealand College of Psychiatrists expert consensus statement for the treatment, management and monitoring of the physical health of people with an enduring psychotic illness. Aust N Z J Psychiatry 2017;51:
322-37.
29. Cooper SJ, Reynolds GP, Barnes T et al. BAP guidelines on the management of weight gain, metabolic disturbances and cardiovascular risk associated with psychosis and antipsychotic drug treatment. J Psychopharmacol 2016;30:717-48.
30. Bobes-García J, Saiz-Ruiz J, Bernardo-Arroyo M et al. Delphi consensus on the physical health of patients with schizophrenia: evaluation of the recommendations of the Spanish Societies of Psychiatry and Biological Psychiatry by a panel of experts. Actas Esp Psiquiatr 2012;40:114-28.
31. Chaudhry I, Jordan J, Cousin F-R et al. Management of physical health in patients with schizophrenia: international insights. Eur Psychiatry 2010;25:S37-40.
32. Saravane D, Feve B, Frances Y et al. Drawing up guidelines for the attendance of physical health of patients with severe mental illness. Encephale 2009;35:330-9.
33. De Hert M, Dekker JM, Wood D et al. Cardiovascular disease and diabetes in people with severe mental illness position statement from the European Psychiatric Association (EPA), supported by the European Association for the Study of Diabetes (EASD) and the European Society of Cardiology (ESC). Eur Psychiatry 2009;24:412-24.
34. Marder SR, Essock SM, Miller AL et al. Physical health monitoring of patients with schizophrenia. Am J Psychiatry 2004;161:1334-49.
35. Cohen J. Statistical power analysis for the behavioral sciences. New York: Lawrence Erlbaum, 1988.
36. Shea BJ, Hamel C, Wells GA et al. AMSTAR is a reliable and valid measurement tool to assess the methodological quality of systematic reviews. J Clin Epidemiol 2009;62:1013-20.
37. Correll CU, Rubio JM, Inczedy-Farkas G et al. Efficacy of 42 pharmacologic cotreatment strategies added to antipsychotic monotherapy in schizophrenia: systematic overview and quality appraisal of the meta-analytic evidence. JAMA Psychiatry 2017;74:675-84.
38. Higgins JPT, Thompson SG, Deeks JJ et al. Measuring inconsistency in metaanalyses. BMJ 2003;327:557-60.
39. Goh KK, Chen C-H, Lu M-L. Topiramate mitigates weight gain in antipsychotic- treated patients with schizophrenia: meta-analysis of randomised controlled trials. Int J Psychiatry Clin Pract 2018:1-19.
40. Siskind D, Hahn M, Correll CU et al. Glucagon-like peptide-1 receptor-agonists for antipsychotic-associated cardio-metabolic risk factors: a systematic review and individual participant data meta-analysis. Diabetes Obes Metab (in press).
41. Zheng W, Zhang Q-E, Cai D-B et al. Combination of metformin and lifestyle intervention for antipsychotic-related weight gain: a meta-analysis of randomized controlled trials. Pharmacopsychiatry (in press).
42. Gu X-J, Chen R, Sun C-H et al. Effect of adjunctive ranitidine for antipsychotic- induced weight gain: a systematic review of randomized placebo controlled trials. J Int Med Res 2018;46:22-32.
43. Galling B, Roldán A, Hagi K et al. Antipsychotic augmentation vs. monotherapy in schizophrenia: systematic review, meta-analysis and meta-regression analysis. World Psychiatry 2017;16:77-89.
44. Teasdale SB, Ward PB, Rosenbaum S et al. Solving a weighty problem: systematic review and meta-analysis of nutrition interventions in severe mental illness. Br J Psychiatry 2017;210:110-8.
45. Zheng W, Wang S, Ungvari GS et al. Amantadine for antipsychotic-related weight gain: meta-analysis of randomized placebo-controlled trials. J Clin Psychopharmacol 2017;37:341-6.
46. Siskind DJ, Leung J, Russell AW et al. Metformin for clozapine associated obesity: a systematic review and meta-analysis. PLoS One 2016;11:e0156208.
47. Zheng W, Zheng Y-J, Li X-B et al. Efficacy and safety of adjunctive aripiprazole in schizophrenia: meta-analysis of randomized controlled trials. J Clin Psychopharmacol 2016;36:628-36.
48. Zimbron J, Khandaker GM, Toschi C et al. A systematic review and meta-analysis of randomised controlled trials of treatments for clozapineinduced obesity and metabolic syndrome. Eur Neuropsychopharmacol 2016;26:1353-65.
49. Zheng W, Li X-B, Tang Y-L et al. Metformin for weight gain and metabolic abnormalities associated with antipsychotic treatment: meta-analysis of randomized placebo-controlled trials. J Clin Psychopharmacol 2015;35:499-509.
50. Firth J, Cotter J, Elliott R et al. A systematic review and meta-analysis of exercise interventions in schizophrenia patients. Psychol Med 2015;45:1343-61.
51. Bruins J, Jцrg F, Bruggeman R et al. The effects of lifestyle interventions on (long-term) weight management, cardiometabolic risk and depressive symptoms in people with psychotic disorders: a meta-analysis. PLoS One 2014; 9:e112276.
52. Kishi T, Iwata N. Efficacy and tolerability of histamine-2 receptor antagonist adjunction of antipsychotic treatment in schizophrenia: a meta-analysis of randomized placebo-controlled trials. Pharmacopsychiatry 2015;48:30-6.
53. Srisurapanont M, Suttajit S, Maneeton N et al. Efficacy and safety of aripiprazole augmentation of clozapine in schizophrenia: a systematic review and meta-analysis of randomized-controlled trials. J Psychiatr Res 2015;62:38-47.
54. Gierisch JM, Nieuwsma JA, Bradford DW et al. Pharmacologic and behavioral interventions to improve cardiovascular risk factors in adults with serious mental illness: a systematic review and meta-analysis. J Clin Psychiatry 2014;75:e424-40.
55. Mizuno Y, Suzuki T, Nakagawa A et al. Pharmacological strategies to counteract antipsychotic-induced weight gain and metabolic adverse effects in schizophrenia: a systematic review and meta-analysis. Schizophr Bull 2014;40:1385-403.
56. Pearsall R, Smith DJ, Pelosi A et al. Exercise therapy in adults with serious mental illness: a systematic review and meta-analysis. BMC Psychiatry 2014;14:117.
57. Kishi T, Iwata N. NMDA receptor antagonists interventions in schizophrenia: meta-analysis of randomized, placebo-controlled trials. J Psychiatr Res 2013;47:1143-9.
58. Bonfioli E, Berti L, Goss C et al. Health promotion lifestyle interventions for weight management in psychosis: a systematic review and meta-analysis of randomised controlled trials. BMC Psychiatry 2012;12:78.
59. Caemmerer J, Correll CU, Maayan L. Acute and maintenance effects of nonpharmacologic interventions for antipsychotic associated weight gain and metabolic abnormalities: a meta-analytic comparison of randomized controlled trials. Schizophr Res 2012;140:159-68.
60. Praharaj SK, Sharma PSVN. Amantadine for olanzapine-induced weight gain: a systematic review and meta-analysis of randomized placebo-controlled trials. Ther Adv Psychopharmacol 2012;2:151-6.
61. Bjцrkhem-Bergman L, Asplund AB, Lindh JD. Metformin for weight reduction in non-diabetic patients on antipsychotic drugs: a systematic review and meta-analysis. J Psychopharmacol 2011;25:299-305.
62. Praharaj SK, Jana AK, Goyal N et al. Metformin for olanzapine-induced weight gain: a systematic review and meta-analysis. Br J Clin Pharmacol 2011;71:377-82.
63. Alvarez-Jimenez M, Hetrick SE, Gonzalez-Blanch C et al. Non-pharmacological management of antipsychotic-induced weight gain: systematic review and meta-analysis of randomised controlled trials. Br J Psychiatry 2008;193:101-7.
64. Maayan L, Vakhrusheva J, Correll CU. Effectiveness of medications used to attenuate antipsychotic-related weight gain and metabolic abnormalities: a systematic review and meta-analysis. Neuropsychopharmacology 2010;35:1520-30.
65. Mukundan A, Faulkner G, Cohn T et al. Antipsychotic switching for people with schizophrenia who have neuroleptic-induced weight or metabolic problems. Cochrane Database Syst Rev 2010;12:CD006629.
66. Yalom ID. Inpatient group psychotherapy. New York: Basic Books, 1983.
22 января 2019
Количество просмотров: 977


