Психиатрия Всемирная психиатрия
Психиатрия Всемирная психиатрия
№03 2018
Коррекция распространенных побочных эффектов антипсихотических препаратов №03 2018
Номера страниц в выпуске:333-348
Положительные эффекты антипсихотических препаратов иногда перекрываются неблагоприятными последствиями лечения. Эти последствия варьируют от относительно небольших проблем с переносимостью (например, умеренного седативного эффекта или сухости во рту) до очень неприятных (например, запора, акатизии, сексуальной дисфункции), болезненных (как, например, острое расстройство мышечного тонуса), уродующих (увеличения массы тела, поздней дискинезии), а также угрожающих жизни (например, миокардита или агранулоцитоза). Важно отметить, что профили побочных эффектов являются специфическими для каждого антипсихотического препарата и не полностью вписываются в классификацию антипсихотиков на препараты первого и второго поколений. В этой статье рассматриваются стратегии управления наиболее частыми побочными эффектами и определяются общие принципы, призванные оптимизировать положительные эффекты антипсихотиков. Антипсихотические препараты должны назначаться только при точных показаниях; продолжать применение антипсихотических препаратов следует при ощутимых преимуществах их воздействия. Если антипсихотик оказывает существенную пользу и побочный эффект от него не опасен для жизни, тогда первый метод регулирования его применения заключается в снижении дозы или корректировке графика дозирования. Следующий вариант – поменять антипсихотический препарат; это часто бывает разумным, если риск рецидива невысок. В некоторых случаях можно попытаться использовать поведенческую терапию. Наконец, во многих случаях необходимо применение сопутствующих лекарств, которые могут привести к значительному улучшению, хотя обычно их использование нежелательно. Среди таких методик лечения дистоний и паркинсонизма довольно часто эффективно применение антихолинергических препаратов; бета-блокаторы и антихолинергические препараты благоприятны при акатизии; метформин может привести к легкой или умеренной потере массы тела. Применение антихолинергических капель сублингвально уменьшает слюноотделение. Обычно лекарственная коррекция эффективна также при запоре или дислипидемии. Клиническая польза недавно одобренных методов лечения поздней дискинезии, валбеназина и деутетрабеназина, пока неясна.
Ключевые слова: антипсихотики, побочные действия, шизофрения, акатизия, тардивная дискинезия, паркинсонизм, дистония, импульсивные расстройства, слюнотечение, седация, сексуальные дисфункции, ортостатическая гипотензия, злокачественный нейролептический синдром, метаболические эффекты, агранулоцитоз.
Ключевые слова: антипсихотики, побочные действия, шизофрения, акатизия, тардивная дискинезия, паркинсонизм, дистония, импульсивные расстройства, слюнотечение, седация, сексуальные дисфункции, ортостатическая гипотензия, злокачественный нейролептический синдром, метаболические эффекты, агранулоцитоз.
Перевод: Пикиреня Л.Ю. (Минск), Пикиреня В.И. (Минск)
Редактура: к.м.н. Федотов И.А. (Рязань)
Положительные эффекты антипсихотических препаратов иногда перекрываются неблагоприятными последствиями лечения. Эти последствия варьируют от относительно небольших проблем с переносимостью (например, умеренного седативного эффекта или сухости во рту) до очень неприятных (например, запора, акатизии, сексуальной дисфункции), болезненных (как, например, острое расстройство мышечного тонуса), уродующих (увеличения массы тела, поздней дискинезии), а также угрожающих жизни (например, миокардита или агранулоцитоза). Важно отметить, что профили побочных эффектов являются специфическими для каждого антипсихотического препарата и не полностью вписываются в классификацию антипсихотиков на препараты первого и второго поколений. В этой статье рассматриваются стратегии управления наиболее частыми побочными эффектами и определяются общие принципы, призванные оптимизировать положительные эффекты антипсихотиков. Антипсихотические препараты должны назначаться только при точных показаниях; продолжать применение антипсихотических препаратов следует при ощутимых преимуществах их воздействия. Если антипсихотик оказывает существенную пользу и побочный эффект от него не опасен для жизни, тогда первый метод регулирования его применения заключается в снижении дозы или корректировке графика дозирования. Следующий вариант – поменять антипсихотический препарат; это часто бывает разумным, если риск рецидива невысок. В некоторых случаях можно попытаться использовать поведенческую терапию. Наконец, во многих случаях необходимо применение сопутствующих лекарств, которые могут привести к значительному улучшению, хотя обычно их использование нежелательно. Среди таких методик лечения дистоний и паркинсонизма довольно часто эффективно применение антихолинергических препаратов; бета-блокаторы и антихолинергические препараты благоприятны при акатизии; метформин может привести к легкой или умеренной потере массы тела. Применение антихолинергических капель сублингвально уменьшает слюноотделение. Обычно лекарственная коррекция эффективна также при запоре или дислипидемии. Клиническая польза недавно одобренных методов лечения поздней дискинезии, валбеназина и деутетрабеназина, пока неясна.
Ключевые слова: антипсихотики, побочные действия, шизофрения, акатизия, тардивная дискинезия, паркинсонизм, дистония, импульсивные расстройства, слюнотечение, седация, сексуальные дисфункции, ортостатическая гипотензия, злокачественный нейролептический синдром, метаболические эффекты, агранулоцитоз.
(World Psychiatry 2018;17(3): 341-356)
Применение антипсихотических препаратов – это первая линия научно обоснованного лечения шизофрении и других первичных психотических расстройств. Некоторые антипсихотики также одобрены для лечения биполярного расстройства, резистентной депрессии, аутизма и расстройства Туретта. Кроме того, эти препараты назначаются off-label лицам с другими состояниями, такими как пограничное расстройство личности, обсессивно-компульсивное расстройство, нервная анорексия, бессонница, бред и различные синдромы деменции, включая болезнь Альцгеймера. Польза этих препаратов снижается их побочными эффектами, которые должны быть сопоставлены с их преимуществами относительно этих состояний.
У людей с шизофренией антипсихотические препараты часто оказывают колоссальное симптоматическое облегчение при галлюцинациях и бреде, а также улучшение дезорганизованных мыслей и поведения. Однако, поскольку их применение связано со множеством побочных эффектов, некоторые из которых являются серьезными с медицинской точки зрения, а многие из них влияют на отношение пациентов к лечению, в обсуждениях об использовании этих препаратов часто преобладает факт возникновения побочных эффектов, а не преимуществ от лечения ими. Это подчеркивается тем фактом, что эксперты и инструкции по применению обычно рекомендуют выбирать антипсихотические препараты на основе характеристик их побочных эффектов, которые значительно различаются, а не эффективности, которая у всех препаратов считается похожей1,2. При непсихотических расстройствах и при off-label назначении, для которых действие антипсихотических препаратов часто неясно, учет побочных эффектов жизненно важен, поскольку соотношение положительных воздействий к рискам ниже и значимо влияет на решение об использовании этих лекарств.
Оценки риска и положительного эффекта относительно того, следует ли назначать антипсихотические препараты для индивидуума, следует делать в соответствии с конкретными лекарствами (они различаются «поколениями» или «классом» лекарственного средства) и конкретной ситуацией (т. е. фактическими оценками благоприятного/неблагоприятного эффекта, ожидаемыми или испытываемыми индивидуумом). Поскольку преимущества от применения антипсихотиков иногда перекрываются их побочными эффектами и медицинскими рисками, понимание того, как таких проблем можно избежать и успешно управлять ими, важно для оптимизации использования этих важных, но противоречивых лекарств.
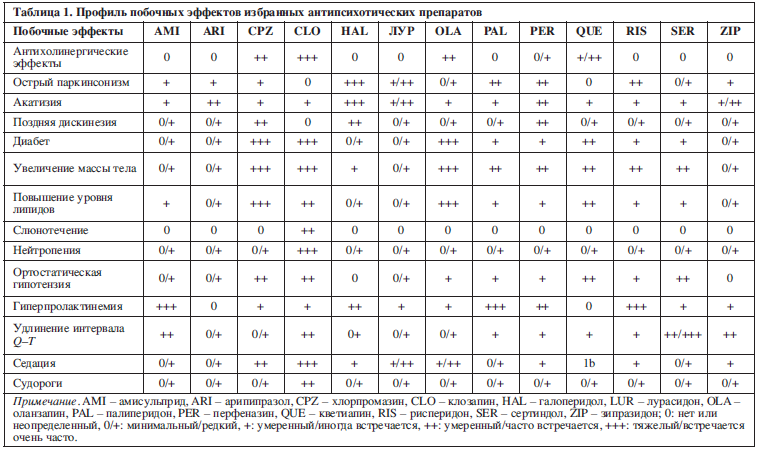
Каждый антипсихотический препарат имеет уникальный профиль побочных эффектов, который по-своему воздействует на людей. Поскольку частота побочных эффектов значительно различается при большом количестве антипсихотических препаратов, мы составили табл. 1, в которой оценивается относительная способность обычно используемых препаратов вызывать специфические побочные эффекты. В табл. 1 показано, что характеристики медицинских препаратов не сильно связаны с классификациями антипсихотиков первого и второго поколений. За важным исключением поздней дискинезии, которая чаще встречается у пациентов, получавших препараты первого поколения, такие как хлорпромазин и галоперидол, нет класс-специфичных побочных эффектов. Такой побочный эффект, как увеличение массы тела, не уникален для новых лекарств, он также присутствует и не во всех новых лекарственных средствах. Аналогичным образом, такие побочные эффекты, как акатизия и паркинсонизм, характерны для препаратов более старого поколения и некоторых более новых препаратов. Несколько побочных эффектов – судорожные припадки, нейтропения, сиалорея – появляются, фактически, только у клозапина.
Некоторые группы населения отчетливо реагируют на действие антипсихотических препаратов. Например, дети, подростки и пожилые люди с большей вероятностью будут испытывать определенные побочные эффекты или переносят их более тяжело. Молодежь более восприимчива к увеличению массы тела и седации, тогда как пожилые люди более уязвимы к последствиям ортостатической гипотонии (падения) и антихолинергическим воздействиям (когнитивным нарушениям). Кроме того, у разных людей риск развития и проявления побочных эффектов значительно различается.
Снижение дозы. Это актуально, когда антипсихотик приносит пользу, а побочный эффект связан с дозой и не требует неотложного лечения. Как правило, рекомендуется использовать самую низкую эффективную для достижения целей лечения дозу, что уменьшает связанные с дозой эффекты, такие как паркинсонизм, седативный эффект, гиперпролактинемия, ортостатическая гипотония и антихолинергические эффекты. На практике поиск оптимальной самой низкой эффективной дозы – это индивидуализированный эмпирический процесс, который должен уравновешивать максимальную эффективность и минимизировать побочные эффекты3.
Переход на антипсихотик с другими побочными эффектами. Переход на лекарственный препарат, который не вызывает проблемный эффект, является общей стратегией, доказавшей свою эффективность, по крайней мере, для некоторых побочных эффектов, например для устранения дислипидемии или снижения массы тела4,5. Доступность различных антипсихотических препаратов при риске акатизии, паркинсонизма и гиперпролактинемии позволяет ожидать более благоприятного исхода, что подтверждается данными обсервационных и рандомизированных исследований4,5. В идеале, переход необходимо делать постепенно, а не одномоментно, чтобы избежать обострения и возобновления симптомов. Одно рандомизированное контролируемое исследование показало адекватность кросс-титрования, выполненного в течение 2–4 недель5. Риск перехода с эффективного антипсихотика заключается в том, что новый препарат может быть не столь эффективным; поэтому пациенты, которым меняют препарат, должны быть под повышенным наблюдением для своевременного распознавания симптоматики. Если пациент отвечал только на клозапин, переход на другой антипсихотический препарат будет предпочтительным если побочные эффекты невозможно убрать с помощью корректировки дозы.
Применение нефармакологического воздействия. Нефармакологическое воздействие для уменьшения побочных эффектов привлекательно, но, как правило, недоступно. Программы диеты и физических упражнений не сильно эффективны в отношении увеличения массы телаа и связанных с ним липидных нарушений6.
Применение дополнительных препаратов. Использование лекарств для контроля за антипсихотическими побочными эффектами является распространенным, но часто не самым оптимальным подходом, поскольку благоприятные эффекты сопутствующих препаратов зачастую недостаточны, они могут иметь побочные эффекты, а также могут привести к межлекарственному взаимодействию. Например, антихолинергические препараты, которые применяются для лечения паркинсонизма, могут привести к когнитивным нарушениям и запорам. Кроме того, эффективность назначения лишь некоторых препаратов подтверждается данными рандомизированных контролируемых исследований.
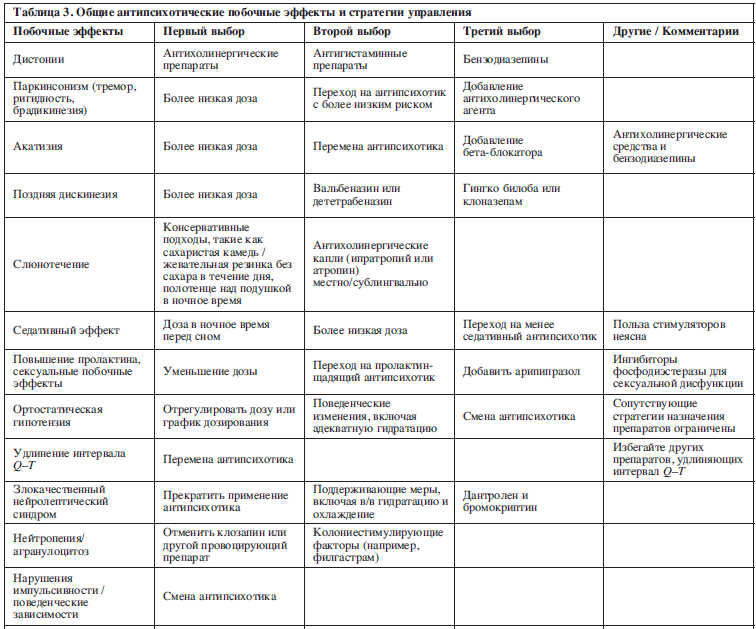
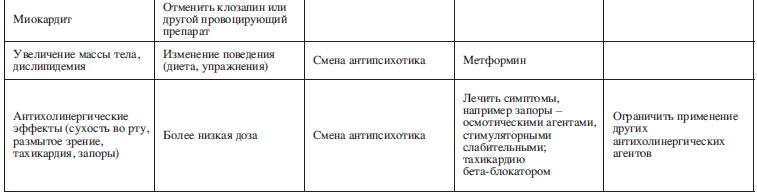
В следующем разделе мы описали общие антипсихотические побочные эффекты и подходы к их профилактике и контролю (см. также табл. 3). Мы сосредоточились на наиболее распространенных и важных побочных эффектах, а не на возможных, но относительно редких. Акцент делается нами на основанных на фактических данных стратегиях управления, но во многих случаях доказательства основаны скорее на здравом смысле и примерах из жизни, чем на рандомизированных контролируемых исследованиях.
Неврологические побочные эффекты, известные как экстрапирамидальные симптомы и проявляющиеся при назначении антипсихотических препаратов, и риск их развития значительно варьируют среди отдельных антипсихотиков, причем высокоинтенсивные лекарственные средства, такие как галоперидол, несут наибольший риск (см. табл. 1). Характерными побочными эффектами являются дистонии, акатизия и паркинсонизм; поздние симптомы будут обсуждаются далее. Дистонии являются непроизвольными сокращениями антагонистических групп мышц, что приводит к скручиванию, длительным и повторяющимся движениям или аномальным позам, чаще всего на голове, лице и шее. Это может быть болезненным и очень мучительным. Акатизия относится к ощущению беспокойства и напряжения, которое обычно (но не всегда) заставляет страдающего почти постоянно находиться в движении, вызывая дисфорию, и даже повышает суицидальный риск7. Паркинсонизм включает в себя ряд вызванных лекарственными средствами симптомов, напоминающих болезнь Паркинсона, таких как брадикинезия, ригидность и тремор.
Дистонии обычно начинаются через несколько часов или дней после приема антипсихотических препаратов или увеличения дозы, почти всегда в течение первых пяти дней8. Распространенность широко варьирует в зависимости от конкретных лекарств и факторов риска9. Экстрапирамидные побочные эффекты в анамнезе являются наиболее значимым фактором риска с относительным риском около шести10. Молодой возраст и мужской пол также являются явными факторами риска10–12. Два наиболее важных из них – ларингоспазм, который является редким, но опасным для жизни13, и окулогирический кризис, с очень болезненным и труднопереносимым тоническим отклонением в глазах, что может стать рецидивирующим или хроническим14.
Поскольку дистонии являются болезненными и очень мучительными, их профилактика – лучшая стратегия.
В основе профилактики дистоний лежит применение антихолинергических лекарственных средств. Профилактика с использованием бензтропина подходит при применении сильнодействующих антипсихотиков15–18, но может быть неэффективным при применении слабых антипсихотиков19. Пока нет консенсуса в отношении того, когда показана профилактика, но клиническое суждение об относительном риске дистонии против риска антихолинергических побочных эффектов и полипрагмазии свидетельствует о многих случаях, когда четко показано использование профилактических мероприятий (например, когда получатель лечения – молодой мужчина, начинающий принимать сильнодействующий антипсихотик). Профилактику следует применять, если пациент получает первую дозу сильнодействующего антипсихотического препарата, такого как галоперидол, путем инъекции. Когда пациент принимает стабильную дозу антипсихотических и антихолинергических препаратов, возможна постепенная отмена антихолинергического средства20, хотя четверти пациентов может потребоваться возобновить его прием21. Для пациентов, которые принимают сильнодействующие антипсихотики с развивающейся при этом дистонией, переход на антипсихотик с более низкой активностью может снизить риск развития дистонии, а также предотвратить паркинсонизм22.
При острых дистонических реакциях, требующих срочного лечения, показаны внутримышечные антихолинергические средства (например, бипериден 5 мг) или антигистаминные препараты (например, дифенгидрамин 50 мг)9. Для первоначального ответа может потребоваться несколько доз, и обычно нужно еще 1–2 дня назначений, пока из организма не выведется антипсихотик, явившийся причиной побочных реакций. Также считается, что при лечении дистоний эффективны бензодиазепины23,24.
Паркинсонизм обычно появляется постепенно (от нескольких дней до месяцев)8. В отличие от дистоний, риск проявления паркинсонизма выше у женщин и пожилых пациентов25. К дополнительным факторам риска относят ранее существовавшую ригидность26 и СПИД27,28. Лечение психоза у пациентов с болезнью Паркинсона является сложным и более детально описано в других источниках.
При лечении паркинсонизма, индуцированного антипсихотиками, в первую очередь должно быть рассмотрено снижение дозы32; также может быть эффективным переход с сильнодействующего антипсихотика на более слабый33. Применение дополнительных лекарственных препаратов является третьим подходом, который полезен, если перемена антипсихотиков нежелательна. При лечении паркинсонизма эффективны антихолинергические препараты, но эта стратегия не подвергалась тщательному изучению34,35; риск развития антихолинергических побочных эффектов у пожилых людей выше (хотя они же более подвержены развитию паркинсонизма). Бензтропин, который широко используется, и этопропазин, который, вероятно, не так широко доступен, являются антихолинергическими препаратами, которые, как известно, эффективны при паркинсонизме36,37. Применение амантадина в дозе 100–400 мг ежедневно широко освещено в литературных источниках36,38–40 и может быть особенно полезным у пациентов пожилого возраста, которым необходимо избегать антихолинергических побочных эффектов32.
Акатизия обычно развивается постепенно в течение срока от нескольких дней до недель от начала лечения, хотя может проявляться и более остро41. Не существует достоверных доказательств факторов риска, за исключением таких факторов, как текущая доза антипсихотических препаратов и темпов увеличения дозы42,43. Акатизия встречается при применении многих антипсихотических препаратов, причем использование сильнодействующих агентов и арипипразола особенно характерны для ее развития, тогда как клозапин, оланзапин и кветиапин являются антипсихотиками с более низкими рисками44,45.
Бета-адреномиметики центрального действия, в первую очередь пропранолол, уже давно, с умеренной эффективностью, используются в качестве терапии первой линии при акатизии45,46, что подтверждается многочисленными небольшими плацебо-контролируемыми исследованиями47-50. Ортостатическая гипотензия и брадикардия являются существенными недостатками приема бета-блокаторов. Антихолинергические средства, такие как бензтропин, также использовались при акатизии, но их эффективность не была продемонстрирована при систематическом приеме51. Антихолинергические средства могут наилучшим образом воздействовать на акатизию, когда она проявляется вместе с паркинсонизмом52.
Серотонинергические методы лечения привлекают больше внимания к лечению акатизии. Антидепрессант миртазапин дозой 15 мг/сут показал в нескольких исследованиях сопоставимую с пропранололом эффективность и, по-видимому, хорошо переносится в краткосрочной перспективе43,50,51, хотя он может приводить к увеличению массы тела, что является особенно важным для тех, кто получает антипсихотические препараты. Селективные 5-НТ2А/C антагонисты миансерин и ритансерин также показали эффективность в небольших открытых исследованиях52–58. Было установлено, что золмитриптан (агонист 5-HT1B/1D) и ципрогептадин (который имеет антагонизм 5-HT2 в дополнение к антихолинергическим и антигистаминным свойствам) показали такую же эффективность, как пропранолол, в небольших рандомизированных исследованиях59,60.
Бензодиазепины также широко используются для лечения акатизии. В тяжелых острых случаях внутривенное введение диазепама вызывает быстрое устранение симптомов61. Клоназепам и лоразепам показали эффективность в нескольких небольших исследованиях62–64, по крайней мере в некоторых был показан дозозависимый эффект. Учитывая толерантность, которая развивается при приеме этих препаратов, необходимы дальнейшие, в частности долгосрочные, исследования65. Возможная связь бензодиазепинов с повышенным уровнем смертности при шизофрении снижает энтузиазм в отношении этого подхода66.
Нами было рассмотрено несколько других подходов к акатизии, но они имеют очень ограниченные эмпирические доказательства. Небольшое слепое исследование показало, что высокая доза витамина B6 (600 мг/сут) ведет к субъективному улучшению67, однако такая доза при длительном лечении приводит к риску периферической нейропатии68. Клонидин показал сходную с бета-блокаторами эффективность, но с более низкой переносимостью52. Дифенгидрамин дал смешанные результаты в небольших исследованиях акатизии, вызванной метоклопрамидом и прохлорперазином69–71.
Оценки их распространенности различны, но большой систематический обзор почти 40 тыс. пациентов, опубликованный в 1992 г., показал, что около 24% пациентов, получавших антипсихотические препараты, имели позднюю дискинезию74; считается, что с тех пор распространенность снижается из-за применения новых лекарств и более умеренного дозирования. Факторы риска синдрома включают раннее наличие экстрапирамидных симптомов75 и, возможно, африканскую этническую принадлежность и старший возраст72,74,76. Женский пол также может увеличить риск72,74, хотя имеющиеся данные противоречивы76–78. Раннее появление экстрапирамидных симптомов является важным фактором риска, потенциально позволяющим клиницистам снижать дозу или менять антипсихотические препараты до наступления поздней дискинезии. Вероятно, существует связь между применением антихолинергических препаратов и поздней дискинезией, что пока остается необъяснимым77; возможно, наличие экстрапирамидных симптомов объясняет эту корреляцию.
Во многих исследованиях пытались определить вклад в риск развития поздней дискинезии генетических факторов. В целом до сих пор не было найдено достаточно убедительных результатов и с эффектом, аналогичным данным скрининга. Полиморфизм в генах катехол-O-метилтрансферазы79,80, нейротрофическом факторе мозга (BDNF)81, рецепторе дофамина-282 и супероксиддисмутазы марганца79 слабо связаны с доказательствами риска. Имеются также данные о том, что риск может быть связан с полиморфизмами генов, участвующих в ГАМК и серотонинергической сигнализации83–85. В ближайшем будущем может быть разработан клинически полезный генетический скрининг-тест на риск развития поздней дискинезии83.
Более новые (второго поколения) антипсихотики менее склонны вызывать позднюю дискинезию85: основываясь на результатах двенадцати испытаний, ежегодную заболеваемость оценивают в 3,9% (против 5,5% у препаратов первого поколения)86. Различия в риске могут быть более выраженными у пожилых людей87,88. Как правило, если у пациента развилась поздняя дискинезия на фоне приема антипсихотика первого поколения, его переводят на препарат второго поколения, но эмпирические данные, подтверждающие это, являются неубедительными; эта тактика изучалась только в небольших исследованиях рисперидона и оланзапина89–91. Как правило, рекомендуется уменьшить дозировку, чтобы предотвратить ухудшение поздней дискинезии, однако убедительных доказательств эффективности этой методики мало92.
Для лечения поздней дискинезии изучались многие фармацевтические стратегии. Ингибиторы везикулярного моноаминового транспортера 2 (VMAT2) наиболее заметны: вальбеназин был недавно одобрен Управлением по контролю за продуктами и лекарствами США (FDA)93. Близкое к нему лекарственное средство тетрабеназин, одобренное для лечения болезни Хантингтона, используемое off-label при различных гиперкинезах, также показало свою эффективность при лечении поздней дискинезии94,95. Пока не ясно различие этих препаратов по степени безопасности или эффективности96. Деутетрабеназин, изотопный изомер тетрабеназина, также был недавно одобрен FDA для лечения поздней дискинезии97. Результаты этих новых методов лечения в настоящее время неясны.
Большинство тестируемых агонистов ГАМК, включая вальпроат, баклофен, прогабид и тетрагидроизоксазолопиридин, не показали каких-либо достоверных положительных результатов и могут ухудшить психическое состояние98. Однако клоназепам показал некоторую эффективность в одном из немногих двойных слепых рандомизированных клинических испытаний поздней дискинезии99;
к антидискинетическому эффекту развивается толерантность, но чувствительность может возобновиться путем кратковременного вымывания. Также следует отметить, что эффективность была более выраженной у лиц с преимущественно дистоническими симптомами, в отличие от хореоатетоидной дискинезии.
В одном довольно крупном рандомизированном контролируемом исследовании было обнаружено, что экстракт гинкго билоба улучшает симптомы поздней дискинезии и хорошо переносится100. Этот эффект, возможно, опосредован увеличением BDNF101. Другие стратегии, основанные на приеме добавок, включают использование витамина B6 (пиридоксин 5’-фосфат), а недавно проведенный мета-анализ дал слабое тому подтверждение102. Имеются также слабые доказательства того, что витамин Е может предотвратить утяжеление течения поздней дискинезии, но этот результат также требует дальнейшего изучения103.
Ряд потенциальных методов лечения поздней дискинезии имеет очень ограниченную или противоречивую доказательную базу, включая блокаторы кальциевых каналов, ингибиторы других VMAT, такие как резерпин, холинергические и антихолинергические лекарственные средства, амантадин и леветирацетам104–106.
В последнее время появляется все больше доказательств того, что стимуляция мозга и хирургические подходы могут обеспечить устойчивое облегчение тяжелой поздней дискинезии, особенно обнадеживающи данные при стимуляции области globus pallidus107–109. Были также некоторые сообщения о случаях, указывающие на потенциальные преимущества хирургических вмешательств в областях globus pallidus или таламуса110.
В целом, существует множество вариантов лечения поздней дискинезии, но, за исключением валбеназина и деутетрабеназина, ни один из них не достиг уровня клинической эффективности и безопасности, достаточных для одобрения регуляторами. До их разработки основанные на фактических данных руководящие принципы Американской академии неврологии сообщили о самых сильных («умеренных») доказательствах эффективности клоназепама и гинкго билоба104.
Считается, что, как и со многими другими антипсихотическими побочными эффектами, использование минимальной необходимой дозы и наблюдение за постепенным графиком титрования может свести к минимуму развитие сиалореи118. Был изучен ряд методов лечения, главным образом антимускариновых и альфа-адренергических агентов. Исследования сосредоточены почти исключительно на индуцированной клозапином сиалорее119, поэтому результаты воздействия других антипсихотиков пока не получены.
Было показано, что наиболее часто применяемая терапия антихолинергическими средствами, как правило, путем введения офтальмологического или ингаляторного препарата подъязычно, улучшает симптомы. Атропин кажется эффективным, хотя короткий период полураспада ограничивает полезность его приема на ночь120–122. Ипратропиум также показал хороший эффект в нескольких тематических исследованиях122–124, хотя результаты рандомизированного контролируемого исследования не показали его эффективность125.
Что касается приема системных антимускариновых агентов, имеются данные об эффективности бензтропина21,126, тригексилфенидила127, гликопирролата128 и пирензепина129,130. В серии случаев был опробован амитриптилин, результаты чего были многообещающими131. Однако постоянный прием антимускариновых препаратов вызывает другие риски (спутанность, помутнение зрения, запор), которые могут усиливать собственные антихолинергические эффекты клозапина.
Адренергические средства также эффективны при индуцированном антипсихотиками слюнотечении, хотя механизм этого неясен. Применение клонидина показало обнадеживающие результаты в отдельных случаях132,133. Другой агонист альфа-2, гуанфацин, был эффективен в одном случае134. Альфа-1 антагонист теразозина показал статистически значимую эффективность в небольшом исследовании126, но далее его не изучали. Хотя в этих исследованиях не сообщалось об основных побочных эффектах, есть вероятность утяжеления антипсихотик-индуцированной ортостатической гипотензии.
Были изучены некоторые другие фармакологические стратегии. Антипсихотики сульпирид и амисульприд показали многообещающие результаты в нескольких небольших исследованиях135–137, а также ингибитор моноаминоксидазы моклобемид136,138. Наконец, было показано, что инъекция ботулотоксина существенно улучшает индуцированную антипсихотиками сиалорею в течение 8–16 недель139,140.
Если консервативные нефармакологические подходы неэффективны, мы предполагаем, что следует начать местное лечение ипратропиумом или атропином, учитывая их относительную безопасность и переносимость. Если эти агенты неэффективны, можно использовать системные лекарства, выбирая из вышеупомянутых агентов на основании клинической картины пациента (например, используя клонидин у пациента с гипертензией, бензтропин при наличии других экстрапирамидных симптомов, прием амисульприда при устойчивых психотических симптомах).
Хотя это общий побочный эффект и часто упоминаемая причина неприверженности лечению, способы влияния на седативный эффект широко не изучалось. Перенос дозы на ночное время и уменьшение общей суточной дозы являются первоначально рекомендованными подходами143, далее – переход к менее седативному антипсихотику. Кроме того, следует прекратить или изменить, если это возможно, прием других седативных препаратов. Также распространено использование кофеина, хотя его действие систематически не изучали.
Стимуляторы и модафинил могут улучшать когнитивные и негативные симптомы шизофрении144, но относительно небольшое исследование сфокусировалось на их потенциальной эффективности при антипсихотическом седативном воздействии. По результатам двух случаев метилфенидат был эффективен и безопасен при лечении пациентов с тяжелой и неустойчивой седацией из-за клозапина145. Небольшое двойное слепое перекрестное исследование метилфенидата, в котором изучение не было нацелено именно на седативный эффект от приема антипсихотических средств, не нашло каких-либо положительных сдвигов в клинических параметрах146. Более того, было показано, что метилфенидат также ухудшает дезорганизацию у пациентов с шизофренией147. Кроме того, несмотря на сообщения о случаях, предполагающих, что прием модафинила может лечить седативный эффект148, систематический обзор литературы показал слабую или недостаточную доказательную базу этого предположения, проведение рандомизированного контролируемого исследования также не обнаружило статистистически значимой пользы от его приема150. Вызывает беспокойство то, что эти лекарства могут привести к ухудшению двигательных расстройств151,152.
Сексуальная дисфункция, включая снижение либидо, аноргазмию и эректильную дисфункцию, распространена у пациентов, принимающих антипсихотические препараты155,156, и лечащему врачу необходимо их контролировать. Одной из шкал, которую можно использовать, является опросник «Антипсихотики и сексуальная функция»157. Оценка пациента с сексуальной дисфункцией должна включать в себя анализ уровней пролактина, учет других лекарств, которые могут этому способствовать, и исключение потенциальных сопутствующих причин158. Основной стратегией лечения является уменьшение дозы антипсихотика или переход на пролактин-щадящий антипсихотик (хотя сексуальная дисфункция также распространена при приеме клозапина и оланзапина)159. Для лечения конкретной симптоматики (кроме ингибиторов фосфодиэстеразы при эректильной дисфункции) не хватает данных160.
Многочисленные исследования также выявили увеличение частоты остеопении и остеопороза у пациентов с шизофренией161,162; однако на это могут влиять многочисленные факторы, помимо антипсихотиков, включая курение, употребление алкоголя, малоподвижный образ жизни и плохое питание153. Исследования показали, что снижение минеральной плотности костной ткани и увеличение скорости переломов тазобедренного сустава связаны с пролактин-индуцирующими антипсихотиками163,164. Также есть опасения, что повышенный уровень пролактина может вести к развитию рака молочной железы у женщин, страдающих шизофренией165, хотя доказательства этого далеко не убедительны из-за множественного ассоциированного образа жизни и метаболических факторов166.
До сих пор нет консенсуса относительно надлежащего мониторинга и лечения гиперпролактинемии у лиц, получающих антипсихотические препараты167–169. В целом, перед началом приема атипсихотического лечения пациентов необходимо опрашивать относительно их сексуальной дисфункции, нарушенияй менструального цикла и галактореи. Консенсус по поводу определения базового уровня пролактина отсутствует. Консервативный подход представляет собой периодический опрос пациентов о симптомах гиперпролактинемии и проверку у них уровня пролактина. Другим рациональным подходом является получение информации об уровне пролактина в начале, а затем примерно через три месяца после начала антипсихотического лечения, поскольку уровень пролактина к тому времени будет максимальным167.
Считается, что некоторые конкретные группы населения подвержены особенно высокому риску заболеваемости из-за гиперпролактинемии и, если это клинически возможно, им следует назначать антипсихотические препараты с минимальным риском повышения уровня пролактина169. Во-первых, это пациенты с диагностированной остеопенией или остеопорозом, для которых предпочтительным является пролактин-щадящий антипсихотик. Это также можно использовать для пациентов в возрасте до 25 лет, у которых масса костной ткани еще не достигла своего максимального значения, особенно для женщин, которые подвержены риску развития позднего остеопороза170. Во-вторых, для женщин, которые намерены забеременеть, пролактин-щадящий антипсихотик менее вероятно приведет к нежелательному влиянию на репродуктивную функцию.
В-третьих, известно довольно спекулятивное утверждение, что у пациентов, у которых в анамнезе есть риск развития рака молочной железы, существует большая опасность развития рака или рецидива при лечении препаратами, повышающими уровень пролактина171.
При развитии гиперпролактинемии у пациента, принимающего антипсихотические препараты, лечащий психиатр часто сталкивается с проблемой назначения дальнейшего обследования. Если был получен базовый уровень пролактина и повышение его уровня, очевидно, связано с приемом антипсихотика, дальнейшее обследование, вероятно, не потребуется. Более значимые признаки включают симптомы заболевания гипофиза (головные боли, зрительные изменения) и уровень пролактина более чем в четыре раза превышает верхний предел (>150 нг/мл), в этом случае осмотр эндокринологом и рентгенорадиологическое обследование (предпочтительно магнитно-резонансная томография) обязательны167,169. В неопределенных случаях (и когда риск дестабилизации у пациента низкий) после 3–4-дневной отмены антипсихотических препаратов может быть проведена оценка уровня пролактина; значительное его снижение свидетельствует о том, что нет соматической патологии.
В случаях подтвержденной антипсихотической индуцированной гиперпролактинемии, которая является симптоматической, основным методом воздействия является снижение дозы или переход на пролактин-щадящий антипсихотик. Если клинический риск снижения дозы или переключения считается слишком высоким, альтернативная стратегия заключается в добавлении арипипразола, что, как было показано, снижает уровень пролактина у пациентов, получавших рисперидон172. Более экспериментальная стратегия заключается в использовании агонистов допамина, таких как бромокриптин или каберголин, которые, как было выяснено, снижают концентрацию пролактина и улучшают сексуальную функцию, хотя это может привести к обострению психотических симптомов173,174.
Важным, но не решенным является вопрос о роли скрининга плотности кости у пациентов на антипсихотических препаратах. Целевая группа по профилактике США рекомендует скрининг всем женщинам в возрасте 65 лет, в то время как Национальный фонд остеопороза в США, помимо этого, рекомендует скрининг мужчинам старше 70 лет, а также женщинам в период менопаузы с факторами риска. Поскольку люди с шизофренией часто имеют множество факторов риска, помимо приема антипсихотического лечения (например, курение, ожирение, диабет), для них показано проведение более тщательного скрининга, чем для населения в целом.
Предпочтительным является переход на антипсихотик, который редко связывают с развитием ортостатической гипотензии. На профилактику ортостатической гипотензии влияет выбор антипсихотических препаратов, постепенного титрования и дозирования в течение дня (для минимизации пиковых уровней)175. Достаточное потребление воды и увеличение потребления соли (доза 1–2 г/сут), если это не является противопоказанием, могут уменьшить симптоматическую гипотензию180. Ношение бандажей и компрессионных чулок могут уменьшить венозный пул и улучшить симптоматику181.
Фармакологическое лечение требуется в редких случаях. Потребление кофеина может иметь благоприятный, мягкий прессорный эффект180. Флудрокортизон широко используется для лечения ортостатической гипотензии и успешно применяется при клозапин-индуцированной ортостатической гипотензии182, однако его существенным недостатком является негативное воздействие на сахар и электролиты в крови, особенно это относится к пациентам, у которых уже есть метаболические побочные эффекты175. При изучении альфа-1-агониста мидодрина выяснилось175,183, что его назначение в сочетании с антипсихотическими препаратами было связано с развитием острых дистоний184,185.
Ведущим предложенным механизмом является блокада реполяризации калиевых токов и продление интервала Q–T, которые, как считается, приводят к желудочковым аритмиям. С точки зрения риска, измерение Q–T имеет ограниченную предсказательную силу; тем не менее Q–Tc >500 мс или подъем на 60 мс выше базовой линии рассматривается как явное нарушение193. Для практикующего врача важно учесть все лекарства, которые принимает пациент, поскольку разнообразные препараты могут вызывать продление интервала Q–T194. Ряд факторов могут сделать умеренное удлинение интервала Q–T опасным, включая брадикардию, гипокалиемию, гипомагниемию, застойную сердечную недостаточность, фибрилляцию предсердий, женский пол, полиморфизмы ионного канала194, хроническое употребление кокаина и алкоголя193.
Некоторые эксперты утверждают, что электрокардиограмма должна быть получена до и вскоре после начала приема антипсихотических препаратов, как часть рутинного исследования195. Чтобы поддержать это мнение, они ссылаются на значительно более высокий абсолютный риск смерти от внезапной остановки сердца, чем от индуцированного клозапином агранулоцитоза, для которого существует обширная система мониторинга. Другие рекомендуют контролировать только определенные антипсихотики или при наличии других факторов риска196. Последние рекомендации Американской психиатрической ассоциации рекомендуют тщательный физикальный осмотр и лабораторный скрининг, при этом ЭКГ показана при назначении тиоридазина, зипразидона, пимозида или мезоридазина; при наличии семейных случаев смерти от внезапной остановки сердца или синдрома удлиненного интервала Q–T; при наличии случаев обмороков или известных заболеваний сердца в анамнезе, или при наличии электролитных нарушений197. Национальная служба здравоохранения Великобритании в список препаратов с «высоким риском» включает галоперидол, сертиндол и пимозид, прием которых должен сопровождаться проведением рутинной процедуры ЭКГ, и рекомендует проведение ЭКГ, если факторы риска присутствуют с препаратами «умеренного риска», такими как хлорпромазин, амисульприд, лурасидон, кветиапин, зотепин, промозин и мельперон198. Пациентам, которые принимают более одного препарата, удлиняющего интервал Q–T, требуются тщательный скрининг и мониторинг.
Злокачественный нейролептический синдром является неотложным состоянием, часто требующим интенсивной терапии. Данные берутся из отчетов и не основываются на рандомизированных клинических испытаниях. Психиатр первым делом должен отменить прием всех антипсихотиков и схожих с ними лекарств (например, метоклопрамида), предпринять меры по охлаждению и перевести на более высокий уровень оказания помощи203. Необходимы активная внутривенная гидратация и коррекция аномалий электролитов. Бензодиазепины могут помочь в лечении синдрома и предпочтительны для физического удержания ажитированных пациентов200. Миорелаксант дантролен и D2-агонист бромкриптин относятся к препаратам первой линии для лечения умеренного или тяжелого злокачественного нейролептического синдрома199. Электросудорожная терапия успешно используется при устойчивых к лечению случаях209.
Возврат пациента, который выздоровел от нейролептического злокачественного синдрома, к приему антипсихотика представляет собой клиническую сложность. Вероятность рецидива неизвестна, но, она может составлять 10–40%210–212. Более длительная пауза после лечения синдрома до возобновления лечения связана с уменьшением риска рецидива209. В некоторых случаях может потребоваться лечение пациента с помощью электросудорожной терапии для поддержания контроля симптомов в течение длительного периода до повторного назначения213. При повторном назначении антипсихотического препарата целесообразно выбирать препарат с более низким действием на D2 рецепторы (например, кветиапин или клозапин), проводить очень постепенное титрование дозы и тщательно контролировать.
Наиболее важной стратегией при нейтропении или агранулоцитозе является их раннее выявление, которое предотвратит оппортунистические инфекции. Поскольку наибольший риск существует в первые месяцы лечения215, количество нейтрофилов измеряется более часто в первые месяцы (еженедельно в течение 6 месяцев в США), затем раз в две недели на оставшуюся часть первого года, а затем ежемесячно на весь период лечения.
Если развивается нейтропения, рекомендованы более частый мониторинг и прерывание лечения. Для пациентов со стабильным, но незначительным количеством нейтрофилов некоторые клиницисты используют литий с целью увеличения уровней гранулоцитов выше пороговых значений, для избегания высоких требований к проведению мониторинга222,223. Механизм, с помощью которого литий увеличивает уровень гранулоцитов, неизвестен224.
Фармацевтические варианты гранулоцитарного колониестимулирующего фактора, гликопротеина, который индуцирует костный мозг для продуцирования и высвобождения гранулоцитов, могут краткосрочно использоваться для лечения агранулоцитоза225,226. У пациентов, которые ответили только на клозапин, такие препараты могут играть более долгосрочную роль в предотвращении агранулоцитоза. Например, филгастрам может применяться в течение продолжительного периода времени для поддержания адекватного количества нейтрофилов во избежание инфекций. Основные проблемы – то, что филгастрам вводится парентерально и является дорогостоящим препаратом.
Снижение дозы не является эффективным подходом при нейтропении, появившейся в результате приема клозапина224. Прекращение приема клозапина является окончательным решением при вызванной клозапином нейтропении. Этот подход обычно требует переход на другой антипсихотик. Для тех пациентов, которые ответили только на клозапин, повторное назначение клозапина после агранулоцитоза не было успешным, но в отчетах описывается успешное повторное введение после нейтропении клозапина с использованием лития или филгастрама для увеличения количества нейтрофилов227.
Ключом к управлению компульсивным поведением является признание того, что они вызваны медикаментами, а не просто являются частью основного психического или поведенческого состояния. Во всех зарегистрированных случаях снижение дозы или прекращение приема было эффективным для прекращения неконтролируемого поведения в течение нескольких недель228,233,234. Если необходим антипсихотик, следует выбрать препарат без эффектов агониста дофамина.
Если диагноз миокардита подтвердился, прием клозапина следует незамедлительно прекратить, необходим общий или специальный уход за больным. Во многих случаях сердечная функция возвращается в норму после прекращения приема клозапина. Частота рецидивов индуцированного клозапином миокардита высока; если считается, что возможные преимущества препарата оправдывают этот риск, его прием следует возобновить в больнице под тщательным контролем241.
Несколько антипсихотиков связаны со значительным увеличением массы тела, и, как известно, практически все антипсихотики вызывают ее увеличение у молодых людей3. Увеличение массы тела является одним из наиболее важных антипсихотических побочных эффектов, так как приводит к дистрессу у пациентов и увеличивает риск неблагоприятных последствий для здоровья, таких как дегенеративное заболевание суставов, сахарный диабет 2-го типа и его осложнения, сердечно-сосудистые и цереброваскулярные заболевания, а также некоторые виды рака, заболевания печени и почек. Хотя увеличение массы тела обычно сопровождает другие неблагоприятные метаболические эффекты, неблагоприятные изменения в липидах и чувствительность к инсулину могут возникать независимо от увеличения веса3.
Любой, кто принимает антипсихотические препараты, должен регулярно контролироваться для выявления метаболических побочных эффектов. Если эти эффекты происходят, широко рекомендуется изменение образа жизни в качестве первого шага для людей, принимающих антипсихотические препараты. Было протестировано несколько структурированных поведенческих программ, которые были признаны эффективными у лиц с тяжелыми психическими заболеваниями242–245. Переход на антипсихотик с меньшим риском развития метаболических проблем может быть эффективным, помогая людям сбросить вес и улучшить метаболические показатели4,5.
Метаболические проблемы, которые развиваются в контексте успешного лечения антипсихотиками, также можно лечить симптоматически, так как они касаются всего населения в целом. Например, статины используются для лечения дислипидемии, а антигипертензивные препараты – для лечения гипертензии. Метформин, как было неоднократно показано в рандомизированных контролируемых исследованиях, демонстрирует эффективность слабой силы в похудании пациентов, принимающих антипсихотические средства, даже если увеличение массы тела было не недавним246–249. Последние одобренные препараты для похудения – лорказерин, бупропион/налтрексон и лираглутид – не были протестированы при увеличении массы тела, вызванном антипсихотическими свойствами. Только предварительные данные говорят о том, что налтрексон может быть эффективен250. Психостимуляторы не рекомендуются для снижения массы тела из-за их пропсихотического эффекта.
Снижение дозы антипсихотических препаратов является стратегией первой линии для управления антихолинергическими побочными эффектами. Переход на лекарство с меньшим количеством антихолинергических эффектов также может быть эффективным251. Наконец, симптоматическое управление является разумным подходом, но существует мало доказательств, специфичных для антихолинергических эффектов, вызванных антипсихотическими свойствами.
Запор, вызванный антипсихотическими средствами, особенно клозапином, может быть тяжелым побочным эффектом и привести к кишечной непроходимости252,253. Предупреждение и раннее выявление имеют решающее значение. Рекомендуемые стратегии управления включают адекватную гидратацию; использование осмотических агентов, таких как сорбит, лактулоза или полиэтиленгликоль, и стимуляторные слабительные, такие как сенна или бисакодил. Эффект от таких слабительных, как докузат натрия, неясен4. Массообразующие, основанные на волокнах слабительные, как правило, не рекомендуются при запоре со снижением моторики, например, вызванном антихолинергическими эффектами254.
Тем не менее несколько ключевых принципов применяются довольно широко. Это применение антипсихотиков лишь при достаточных и точных показаниях, продолжение приема антипсихотиков необходимо только если есть значимые преимущества. Если антипсихотик приносит существенную пользу, и неблагоприятный эффект не опасен для жизни, тогда первый выбор при коррекции побочных действий заключается в снижении дозы или корректировке графика дозирования. Далее следует сменить антипсихотик; это часто бывает разумным, если риск рецидива не высок, например когда человек только реагировал на клозапин. В некоторых случаях можно попытаться использовать поведенческие вмешательства. Наконец, во многих случаях необходимы сопутствующие лекарственные средства, хотя они обычно нежелательны.
Данные свидетельствуют о том, что побочные эффекты не являются основной причиной, по которой люди прекращают прием антипсихотических препаратов255. Тем не менее оптимальное управление побочными эффектами улучшит качество жизни пациентов и их функциональные исходы.
БЛАГОДАРНОСТЬ
Этот документ частично поддерживался Глобальной программой психического здоровья в Колумбийском университете. Авторы благодарят S. Wetzler за ее помощь.
DOI: 10.1002/wps.20567
Редактура: к.м.н. Федотов И.А. (Рязань)
Положительные эффекты антипсихотических препаратов иногда перекрываются неблагоприятными последствиями лечения. Эти последствия варьируют от относительно небольших проблем с переносимостью (например, умеренного седативного эффекта или сухости во рту) до очень неприятных (например, запора, акатизии, сексуальной дисфункции), болезненных (как, например, острое расстройство мышечного тонуса), уродующих (увеличения массы тела, поздней дискинезии), а также угрожающих жизни (например, миокардита или агранулоцитоза). Важно отметить, что профили побочных эффектов являются специфическими для каждого антипсихотического препарата и не полностью вписываются в классификацию антипсихотиков на препараты первого и второго поколений. В этой статье рассматриваются стратегии управления наиболее частыми побочными эффектами и определяются общие принципы, призванные оптимизировать положительные эффекты антипсихотиков. Антипсихотические препараты должны назначаться только при точных показаниях; продолжать применение антипсихотических препаратов следует при ощутимых преимуществах их воздействия. Если антипсихотик оказывает существенную пользу и побочный эффект от него не опасен для жизни, тогда первый метод регулирования его применения заключается в снижении дозы или корректировке графика дозирования. Следующий вариант – поменять антипсихотический препарат; это часто бывает разумным, если риск рецидива невысок. В некоторых случаях можно попытаться использовать поведенческую терапию. Наконец, во многих случаях необходимо применение сопутствующих лекарств, которые могут привести к значительному улучшению, хотя обычно их использование нежелательно. Среди таких методик лечения дистоний и паркинсонизма довольно часто эффективно применение антихолинергических препаратов; бета-блокаторы и антихолинергические препараты благоприятны при акатизии; метформин может привести к легкой или умеренной потере массы тела. Применение антихолинергических капель сублингвально уменьшает слюноотделение. Обычно лекарственная коррекция эффективна также при запоре или дислипидемии. Клиническая польза недавно одобренных методов лечения поздней дискинезии, валбеназина и деутетрабеназина, пока неясна.
Ключевые слова: антипсихотики, побочные действия, шизофрения, акатизия, тардивная дискинезия, паркинсонизм, дистония, импульсивные расстройства, слюнотечение, седация, сексуальные дисфункции, ортостатическая гипотензия, злокачественный нейролептический синдром, метаболические эффекты, агранулоцитоз.
(World Psychiatry 2018;17(3): 341-356)
Применение антипсихотических препаратов – это первая линия научно обоснованного лечения шизофрении и других первичных психотических расстройств. Некоторые антипсихотики также одобрены для лечения биполярного расстройства, резистентной депрессии, аутизма и расстройства Туретта. Кроме того, эти препараты назначаются off-label лицам с другими состояниями, такими как пограничное расстройство личности, обсессивно-компульсивное расстройство, нервная анорексия, бессонница, бред и различные синдромы деменции, включая болезнь Альцгеймера. Польза этих препаратов снижается их побочными эффектами, которые должны быть сопоставлены с их преимуществами относительно этих состояний.
У людей с шизофренией антипсихотические препараты часто оказывают колоссальное симптоматическое облегчение при галлюцинациях и бреде, а также улучшение дезорганизованных мыслей и поведения. Однако, поскольку их применение связано со множеством побочных эффектов, некоторые из которых являются серьезными с медицинской точки зрения, а многие из них влияют на отношение пациентов к лечению, в обсуждениях об использовании этих препаратов часто преобладает факт возникновения побочных эффектов, а не преимуществ от лечения ими. Это подчеркивается тем фактом, что эксперты и инструкции по применению обычно рекомендуют выбирать антипсихотические препараты на основе характеристик их побочных эффектов, которые значительно различаются, а не эффективности, которая у всех препаратов считается похожей1,2. При непсихотических расстройствах и при off-label назначении, для которых действие антипсихотических препаратов часто неясно, учет побочных эффектов жизненно важен, поскольку соотношение положительных воздействий к рискам ниже и значимо влияет на решение об использовании этих лекарств.
Оценки риска и положительного эффекта относительно того, следует ли назначать антипсихотические препараты для индивидуума, следует делать в соответствии с конкретными лекарствами (они различаются «поколениями» или «классом» лекарственного средства) и конкретной ситуацией (т. е. фактическими оценками благоприятного/неблагоприятного эффекта, ожидаемыми или испытываемыми индивидуумом). Поскольку преимущества от применения антипсихотиков иногда перекрываются их побочными эффектами и медицинскими рисками, понимание того, как таких проблем можно избежать и успешно управлять ими, важно для оптимизации использования этих важных, но противоречивых лекарств.
ОБЗОР РИСКОВ И ПОБОЧНЫХ ЭФФЕКТОВ
Побочные эффекты от антипсихотических эффектов варьируют от относительно небольших проблем с переносимостью (например, умеренный седативный эффект или сухость во рту) до очень неприятных (запор, акатизия, сексуальная дисфункция и т. д.), болезненных (таких как острое расстройство мышечного тонуса), уродующих (увеличение массы тела, поздняя дискинезия и др.), а также угрожающих жизни (к примеру, миокардит или агранулоцитоз). Некоторые побочные эффекты имеют небольшие краткосрочные клинические воздействия (например, повышение уровня пролактина или сывороточного липида), но могут включать долгосрочный риск медицинских осложнений.Каждый антипсихотический препарат имеет уникальный профиль побочных эффектов, который по-своему воздействует на людей. Поскольку частота побочных эффектов значительно различается при большом количестве антипсихотических препаратов, мы составили табл. 1, в которой оценивается относительная способность обычно используемых препаратов вызывать специфические побочные эффекты. В табл. 1 показано, что характеристики медицинских препаратов не сильно связаны с классификациями антипсихотиков первого и второго поколений. За важным исключением поздней дискинезии, которая чаще встречается у пациентов, получавших препараты первого поколения, такие как хлорпромазин и галоперидол, нет класс-специфичных побочных эффектов. Такой побочный эффект, как увеличение массы тела, не уникален для новых лекарств, он также присутствует и не во всех новых лекарственных средствах. Аналогичным образом, такие побочные эффекты, как акатизия и паркинсонизм, характерны для препаратов более старого поколения и некоторых более новых препаратов. Несколько побочных эффектов – судорожные припадки, нейтропения, сиалорея – появляются, фактически, только у клозапина.

Некоторые группы населения отчетливо реагируют на действие антипсихотических препаратов. Например, дети, подростки и пожилые люди с большей вероятностью будут испытывать определенные побочные эффекты или переносят их более тяжело. Молодежь более восприимчива к увеличению массы тела и седации, тогда как пожилые люди более уязвимы к последствиям ортостатической гипотонии (падения) и антихолинергическим воздействиям (когнитивным нарушениям). Кроме того, у разных людей риск развития и проявления побочных эффектов значительно различается.
ПРИНЦИПЫ НАЗНАЧЕНИЯ АНТИПСИХОТИЧЕСКИХ ПРЕПАРАТОВ
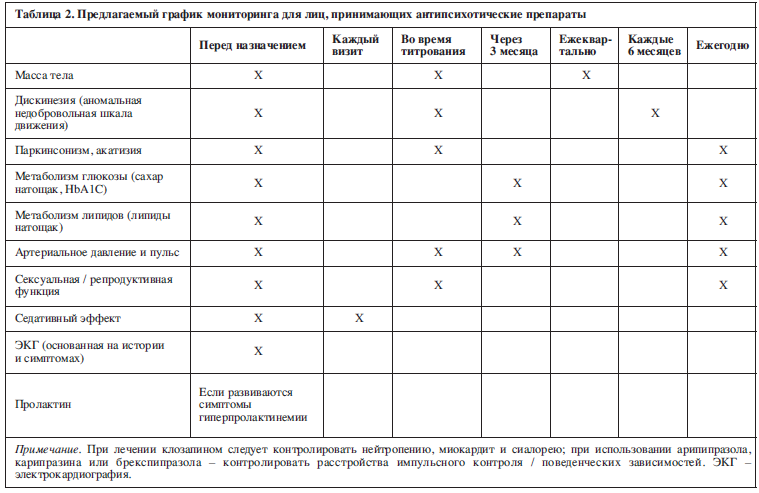
Прежде чем обсуждать регулирование конкретных побочных эффектов, мы предлагаем рассмотреть некоторые общие принципы оптимального назначения антипсихотических препаратов. Во-первых, антипсихотические препараты назначаются только тогда, когда их применение будет иметь явное преимущество и не существует более безопасной альтернативы. Во-вторых, выбирать антипсихотический препарат необходимо, основываясь на клинической ситуации и предпочтениях пациента (например, не назначать лекарства, вызывающие ортостатические гипотонии у пожилых людей, не назначать лекарства, ведущие к существенному увеличению массы тела пациентов, контролирующих свой вес, избегать назначение препаратов, удлиняющих интервал Q–T, пациентам с историей сердечных заболеваний, аритмий или синкопе). В-третьих, назначается самая низкая эффективная доза антипсихотических препаратов, которая должна быть определена эмпирически для каждого человека. В-четвертых, необходимо прекратить применение антипсихотика, если от него нет эффекта. Однако, если некоторая польза есть, необходимо проведение индивидуальной оценки риска и пользы, в соответствии с побочными эффектами. Наконец, необходимо регулярное наблюдение за имеющимися побочными эффектами (см. табл. 2). В остальной части статьи рассматриваются действия при возникновении побочных эффектов.
ОБЩИЕ СТРАТЕГИИ ДЛЯ УПРАВЛЕНИЯ ПОБОЧНЫМИ ЭФФЕКТАМИ ОТ ПРИЕМА АНТИПСИХОТИКОВ
Прием антипсихотических препаратов, которые не являются эффективными или необходимыми, должен быть прекращен. Рассмотрим основные стратегии управления побочными эффектами.Снижение дозы. Это актуально, когда антипсихотик приносит пользу, а побочный эффект связан с дозой и не требует неотложного лечения. Как правило, рекомендуется использовать самую низкую эффективную для достижения целей лечения дозу, что уменьшает связанные с дозой эффекты, такие как паркинсонизм, седативный эффект, гиперпролактинемия, ортостатическая гипотония и антихолинергические эффекты. На практике поиск оптимальной самой низкой эффективной дозы – это индивидуализированный эмпирический процесс, который должен уравновешивать максимальную эффективность и минимизировать побочные эффекты3.
Переход на антипсихотик с другими побочными эффектами. Переход на лекарственный препарат, который не вызывает проблемный эффект, является общей стратегией, доказавшей свою эффективность, по крайней мере, для некоторых побочных эффектов, например для устранения дислипидемии или снижения массы тела4,5. Доступность различных антипсихотических препаратов при риске акатизии, паркинсонизма и гиперпролактинемии позволяет ожидать более благоприятного исхода, что подтверждается данными обсервационных и рандомизированных исследований4,5. В идеале, переход необходимо делать постепенно, а не одномоментно, чтобы избежать обострения и возобновления симптомов. Одно рандомизированное контролируемое исследование показало адекватность кросс-титрования, выполненного в течение 2–4 недель5. Риск перехода с эффективного антипсихотика заключается в том, что новый препарат может быть не столь эффективным; поэтому пациенты, которым меняют препарат, должны быть под повышенным наблюдением для своевременного распознавания симптоматики. Если пациент отвечал только на клозапин, переход на другой антипсихотический препарат будет предпочтительным если побочные эффекты невозможно убрать с помощью корректировки дозы.
Применение нефармакологического воздействия. Нефармакологическое воздействие для уменьшения побочных эффектов привлекательно, но, как правило, недоступно. Программы диеты и физических упражнений не сильно эффективны в отношении увеличения массы телаа и связанных с ним липидных нарушений6.
Применение дополнительных препаратов. Использование лекарств для контроля за антипсихотическими побочными эффектами является распространенным, но часто не самым оптимальным подходом, поскольку благоприятные эффекты сопутствующих препаратов зачастую недостаточны, они могут иметь побочные эффекты, а также могут привести к межлекарственному взаимодействию. Например, антихолинергические препараты, которые применяются для лечения паркинсонизма, могут привести к когнитивным нарушениям и запорам. Кроме того, эффективность назначения лишь некоторых препаратов подтверждается данными рандомизированных контролируемых исследований.
В следующем разделе мы описали общие антипсихотические побочные эффекты и подходы к их профилактике и контролю (см. также табл. 3). Мы сосредоточились на наиболее распространенных и важных побочных эффектах, а не на возможных, но относительно редких. Акцент делается нами на основанных на фактических данных стратегиях управления, но во многих случаях доказательства основаны скорее на здравом смысле и примерах из жизни, чем на рандомизированных контролируемых исследованиях.


ОТДЕЛЬНЫЕ ПОБОЧНЫЕ ЭФФЕКТЫ
Неврологические побочные эффектыНеврологические побочные эффекты, известные как экстрапирамидальные симптомы и проявляющиеся при назначении антипсихотических препаратов, и риск их развития значительно варьируют среди отдельных антипсихотиков, причем высокоинтенсивные лекарственные средства, такие как галоперидол, несут наибольший риск (см. табл. 1). Характерными побочными эффектами являются дистонии, акатизия и паркинсонизм; поздние симптомы будут обсуждаются далее. Дистонии являются непроизвольными сокращениями антагонистических групп мышц, что приводит к скручиванию, длительным и повторяющимся движениям или аномальным позам, чаще всего на голове, лице и шее. Это может быть болезненным и очень мучительным. Акатизия относится к ощущению беспокойства и напряжения, которое обычно (но не всегда) заставляет страдающего почти постоянно находиться в движении, вызывая дисфорию, и даже повышает суицидальный риск7. Паркинсонизм включает в себя ряд вызванных лекарственными средствами симптомов, напоминающих болезнь Паркинсона, таких как брадикинезия, ригидность и тремор.
Дистонии обычно начинаются через несколько часов или дней после приема антипсихотических препаратов или увеличения дозы, почти всегда в течение первых пяти дней8. Распространенность широко варьирует в зависимости от конкретных лекарств и факторов риска9. Экстрапирамидные побочные эффекты в анамнезе являются наиболее значимым фактором риска с относительным риском около шести10. Молодой возраст и мужской пол также являются явными факторами риска10–12. Два наиболее важных из них – ларингоспазм, который является редким, но опасным для жизни13, и окулогирический кризис, с очень болезненным и труднопереносимым тоническим отклонением в глазах, что может стать рецидивирующим или хроническим14.
Поскольку дистонии являются болезненными и очень мучительными, их профилактика – лучшая стратегия.
В основе профилактики дистоний лежит применение антихолинергических лекарственных средств. Профилактика с использованием бензтропина подходит при применении сильнодействующих антипсихотиков15–18, но может быть неэффективным при применении слабых антипсихотиков19. Пока нет консенсуса в отношении того, когда показана профилактика, но клиническое суждение об относительном риске дистонии против риска антихолинергических побочных эффектов и полипрагмазии свидетельствует о многих случаях, когда четко показано использование профилактических мероприятий (например, когда получатель лечения – молодой мужчина, начинающий принимать сильнодействующий антипсихотик). Профилактику следует применять, если пациент получает первую дозу сильнодействующего антипсихотического препарата, такого как галоперидол, путем инъекции. Когда пациент принимает стабильную дозу антипсихотических и антихолинергических препаратов, возможна постепенная отмена антихолинергического средства20, хотя четверти пациентов может потребоваться возобновить его прием21. Для пациентов, которые принимают сильнодействующие антипсихотики с развивающейся при этом дистонией, переход на антипсихотик с более низкой активностью может снизить риск развития дистонии, а также предотвратить паркинсонизм22.
При острых дистонических реакциях, требующих срочного лечения, показаны внутримышечные антихолинергические средства (например, бипериден 5 мг) или антигистаминные препараты (например, дифенгидрамин 50 мг)9. Для первоначального ответа может потребоваться несколько доз, и обычно нужно еще 1–2 дня назначений, пока из организма не выведется антипсихотик, явившийся причиной побочных реакций. Также считается, что при лечении дистоний эффективны бензодиазепины23,24.
Паркинсонизм обычно появляется постепенно (от нескольких дней до месяцев)8. В отличие от дистоний, риск проявления паркинсонизма выше у женщин и пожилых пациентов25. К дополнительным факторам риска относят ранее существовавшую ригидность26 и СПИД27,28. Лечение психоза у пациентов с болезнью Паркинсона является сложным и более детально описано в других источниках.
При лечении паркинсонизма, индуцированного антипсихотиками, в первую очередь должно быть рассмотрено снижение дозы32; также может быть эффективным переход с сильнодействующего антипсихотика на более слабый33. Применение дополнительных лекарственных препаратов является третьим подходом, который полезен, если перемена антипсихотиков нежелательна. При лечении паркинсонизма эффективны антихолинергические препараты, но эта стратегия не подвергалась тщательному изучению34,35; риск развития антихолинергических побочных эффектов у пожилых людей выше (хотя они же более подвержены развитию паркинсонизма). Бензтропин, который широко используется, и этопропазин, который, вероятно, не так широко доступен, являются антихолинергическими препаратами, которые, как известно, эффективны при паркинсонизме36,37. Применение амантадина в дозе 100–400 мг ежедневно широко освещено в литературных источниках36,38–40 и может быть особенно полезным у пациентов пожилого возраста, которым необходимо избегать антихолинергических побочных эффектов32.
Акатизия обычно развивается постепенно в течение срока от нескольких дней до недель от начала лечения, хотя может проявляться и более остро41. Не существует достоверных доказательств факторов риска, за исключением таких факторов, как текущая доза антипсихотических препаратов и темпов увеличения дозы42,43. Акатизия встречается при применении многих антипсихотических препаратов, причем использование сильнодействующих агентов и арипипразола особенно характерны для ее развития, тогда как клозапин, оланзапин и кветиапин являются антипсихотиками с более низкими рисками44,45.
Бета-адреномиметики центрального действия, в первую очередь пропранолол, уже давно, с умеренной эффективностью, используются в качестве терапии первой линии при акатизии45,46, что подтверждается многочисленными небольшими плацебо-контролируемыми исследованиями47-50. Ортостатическая гипотензия и брадикардия являются существенными недостатками приема бета-блокаторов. Антихолинергические средства, такие как бензтропин, также использовались при акатизии, но их эффективность не была продемонстрирована при систематическом приеме51. Антихолинергические средства могут наилучшим образом воздействовать на акатизию, когда она проявляется вместе с паркинсонизмом52.
Серотонинергические методы лечения привлекают больше внимания к лечению акатизии. Антидепрессант миртазапин дозой 15 мг/сут показал в нескольких исследованиях сопоставимую с пропранололом эффективность и, по-видимому, хорошо переносится в краткосрочной перспективе43,50,51, хотя он может приводить к увеличению массы тела, что является особенно важным для тех, кто получает антипсихотические препараты. Селективные 5-НТ2А/C антагонисты миансерин и ритансерин также показали эффективность в небольших открытых исследованиях52–58. Было установлено, что золмитриптан (агонист 5-HT1B/1D) и ципрогептадин (который имеет антагонизм 5-HT2 в дополнение к антихолинергическим и антигистаминным свойствам) показали такую же эффективность, как пропранолол, в небольших рандомизированных исследованиях59,60.
Бензодиазепины также широко используются для лечения акатизии. В тяжелых острых случаях внутривенное введение диазепама вызывает быстрое устранение симптомов61. Клоназепам и лоразепам показали эффективность в нескольких небольших исследованиях62–64, по крайней мере в некоторых был показан дозозависимый эффект. Учитывая толерантность, которая развивается при приеме этих препаратов, необходимы дальнейшие, в частности долгосрочные, исследования65. Возможная связь бензодиазепинов с повышенным уровнем смертности при шизофрении снижает энтузиазм в отношении этого подхода66.
Нами было рассмотрено несколько других подходов к акатизии, но они имеют очень ограниченные эмпирические доказательства. Небольшое слепое исследование показало, что высокая доза витамина B6 (600 мг/сут) ведет к субъективному улучшению67, однако такая доза при длительном лечении приводит к риску периферической нейропатии68. Клонидин показал сходную с бета-блокаторами эффективность, но с более низкой переносимостью52. Дифенгидрамин дал смешанные результаты в небольших исследованиях акатизии, вызванной метоклопрамидом и прохлорперазином69–71.
Поздние синдромы
Поздняя дискинезия – одно из самых тяжелых осложнений антипсихотического лечения, хотя оно может возникать и вследствие приема других групп препаратов72. Она обычно развивается после нескольких месяцев или лет воздействия и характеризуется непроизвольными атетоидными или хорееобразными движениями нижней части лица, конечностей и/или мышц туловища. Чаще всего они присутствуют как гримасничанье, причмокивание губами, движения языка и чрезмерное мигание. Наиболее тяжело то, что симптомы сохраняются долго после того, как прием препарата прекращен, и в некоторых случаях могут стать постоянными (дискинезия, продолжающаяся менее месяца после отмены, рассматривается как отдельная нозологическая единица – дискинезия отмены). Другие поздние проявления могут включать акатизию, стереотипии, дистонии, паркинсонизм, тремор, миоклонус и туретто-подобный синдром (туреттизм)73.Оценки их распространенности различны, но большой систематический обзор почти 40 тыс. пациентов, опубликованный в 1992 г., показал, что около 24% пациентов, получавших антипсихотические препараты, имели позднюю дискинезию74; считается, что с тех пор распространенность снижается из-за применения новых лекарств и более умеренного дозирования. Факторы риска синдрома включают раннее наличие экстрапирамидных симптомов75 и, возможно, африканскую этническую принадлежность и старший возраст72,74,76. Женский пол также может увеличить риск72,74, хотя имеющиеся данные противоречивы76–78. Раннее появление экстрапирамидных симптомов является важным фактором риска, потенциально позволяющим клиницистам снижать дозу или менять антипсихотические препараты до наступления поздней дискинезии. Вероятно, существует связь между применением антихолинергических препаратов и поздней дискинезией, что пока остается необъяснимым77; возможно, наличие экстрапирамидных симптомов объясняет эту корреляцию.
Во многих исследованиях пытались определить вклад в риск развития поздней дискинезии генетических факторов. В целом до сих пор не было найдено достаточно убедительных результатов и с эффектом, аналогичным данным скрининга. Полиморфизм в генах катехол-O-метилтрансферазы79,80, нейротрофическом факторе мозга (BDNF)81, рецепторе дофамина-282 и супероксиддисмутазы марганца79 слабо связаны с доказательствами риска. Имеются также данные о том, что риск может быть связан с полиморфизмами генов, участвующих в ГАМК и серотонинергической сигнализации83–85. В ближайшем будущем может быть разработан клинически полезный генетический скрининг-тест на риск развития поздней дискинезии83.
Более новые (второго поколения) антипсихотики менее склонны вызывать позднюю дискинезию85: основываясь на результатах двенадцати испытаний, ежегодную заболеваемость оценивают в 3,9% (против 5,5% у препаратов первого поколения)86. Различия в риске могут быть более выраженными у пожилых людей87,88. Как правило, если у пациента развилась поздняя дискинезия на фоне приема антипсихотика первого поколения, его переводят на препарат второго поколения, но эмпирические данные, подтверждающие это, являются неубедительными; эта тактика изучалась только в небольших исследованиях рисперидона и оланзапина89–91. Как правило, рекомендуется уменьшить дозировку, чтобы предотвратить ухудшение поздней дискинезии, однако убедительных доказательств эффективности этой методики мало92.
Для лечения поздней дискинезии изучались многие фармацевтические стратегии. Ингибиторы везикулярного моноаминового транспортера 2 (VMAT2) наиболее заметны: вальбеназин был недавно одобрен Управлением по контролю за продуктами и лекарствами США (FDA)93. Близкое к нему лекарственное средство тетрабеназин, одобренное для лечения болезни Хантингтона, используемое off-label при различных гиперкинезах, также показало свою эффективность при лечении поздней дискинезии94,95. Пока не ясно различие этих препаратов по степени безопасности или эффективности96. Деутетрабеназин, изотопный изомер тетрабеназина, также был недавно одобрен FDA для лечения поздней дискинезии97. Результаты этих новых методов лечения в настоящее время неясны.
Большинство тестируемых агонистов ГАМК, включая вальпроат, баклофен, прогабид и тетрагидроизоксазолопиридин, не показали каких-либо достоверных положительных результатов и могут ухудшить психическое состояние98. Однако клоназепам показал некоторую эффективность в одном из немногих двойных слепых рандомизированных клинических испытаний поздней дискинезии99;
к антидискинетическому эффекту развивается толерантность, но чувствительность может возобновиться путем кратковременного вымывания. Также следует отметить, что эффективность была более выраженной у лиц с преимущественно дистоническими симптомами, в отличие от хореоатетоидной дискинезии.
В одном довольно крупном рандомизированном контролируемом исследовании было обнаружено, что экстракт гинкго билоба улучшает симптомы поздней дискинезии и хорошо переносится100. Этот эффект, возможно, опосредован увеличением BDNF101. Другие стратегии, основанные на приеме добавок, включают использование витамина B6 (пиридоксин 5’-фосфат), а недавно проведенный мета-анализ дал слабое тому подтверждение102. Имеются также слабые доказательства того, что витамин Е может предотвратить утяжеление течения поздней дискинезии, но этот результат также требует дальнейшего изучения103.
Ряд потенциальных методов лечения поздней дискинезии имеет очень ограниченную или противоречивую доказательную базу, включая блокаторы кальциевых каналов, ингибиторы других VMAT, такие как резерпин, холинергические и антихолинергические лекарственные средства, амантадин и леветирацетам104–106.
В последнее время появляется все больше доказательств того, что стимуляция мозга и хирургические подходы могут обеспечить устойчивое облегчение тяжелой поздней дискинезии, особенно обнадеживающи данные при стимуляции области globus pallidus107–109. Были также некоторые сообщения о случаях, указывающие на потенциальные преимущества хирургических вмешательств в областях globus pallidus или таламуса110.
В целом, существует множество вариантов лечения поздней дискинезии, но, за исключением валбеназина и деутетрабеназина, ни один из них не достиг уровня клинической эффективности и безопасности, достаточных для одобрения регуляторами. До их разработки основанные на фактических данных руководящие принципы Американской академии неврологии сообщили о самых сильных («умеренных») доказательствах эффективности клоназепама и гинкго билоба104.
Слюнотечение
Сиалорея, чрезмерное производство слюны, является побочным эффектом, наиболее часто наблюдаемым у пациентов, получавших клозапин (возможно, более 90% пациентов)111, но может встречаться и с другими антипсихотиками. Считается, что это связано с воздействием на мускариновые и адренергические рецепторы в слюнных железах112,113. Это неудобно, смущает и стигматизирует и даже может привести к развитию аспирационной пневмонии114,115. В некоторых случаях может возникать болезненное опухание околоушной слюнной железы116,117.Считается, что, как и со многими другими антипсихотическими побочными эффектами, использование минимальной необходимой дозы и наблюдение за постепенным графиком титрования может свести к минимуму развитие сиалореи118. Был изучен ряд методов лечения, главным образом антимускариновых и альфа-адренергических агентов. Исследования сосредоточены почти исключительно на индуцированной клозапином сиалорее119, поэтому результаты воздействия других антипсихотиков пока не получены.
Было показано, что наиболее часто применяемая терапия антихолинергическими средствами, как правило, путем введения офтальмологического или ингаляторного препарата подъязычно, улучшает симптомы. Атропин кажется эффективным, хотя короткий период полураспада ограничивает полезность его приема на ночь120–122. Ипратропиум также показал хороший эффект в нескольких тематических исследованиях122–124, хотя результаты рандомизированного контролируемого исследования не показали его эффективность125.
Что касается приема системных антимускариновых агентов, имеются данные об эффективности бензтропина21,126, тригексилфенидила127, гликопирролата128 и пирензепина129,130. В серии случаев был опробован амитриптилин, результаты чего были многообещающими131. Однако постоянный прием антимускариновых препаратов вызывает другие риски (спутанность, помутнение зрения, запор), которые могут усиливать собственные антихолинергические эффекты клозапина.
Адренергические средства также эффективны при индуцированном антипсихотиками слюнотечении, хотя механизм этого неясен. Применение клонидина показало обнадеживающие результаты в отдельных случаях132,133. Другой агонист альфа-2, гуанфацин, был эффективен в одном случае134. Альфа-1 антагонист теразозина показал статистически значимую эффективность в небольшом исследовании126, но далее его не изучали. Хотя в этих исследованиях не сообщалось об основных побочных эффектах, есть вероятность утяжеления антипсихотик-индуцированной ортостатической гипотензии.
Были изучены некоторые другие фармакологические стратегии. Антипсихотики сульпирид и амисульприд показали многообещающие результаты в нескольких небольших исследованиях135–137, а также ингибитор моноаминоксидазы моклобемид136,138. Наконец, было показано, что инъекция ботулотоксина существенно улучшает индуцированную антипсихотиками сиалорею в течение 8–16 недель139,140.
Если консервативные нефармакологические подходы неэффективны, мы предполагаем, что следует начать местное лечение ипратропиумом или атропином, учитывая их относительную безопасность и переносимость. Если эти агенты неэффективны, можно использовать системные лекарства, выбирая из вышеупомянутых агентов на основании клинической картины пациента (например, используя клонидин у пациента с гипертензией, бензтропин при наличии других экстрапирамидных симптомов, прием амисульприда при устойчивых психотических симптомах).
Седативный эффект
Наблюдения показывают, что все антипсихотические препараты могут вызывать седативный эффект, но его тяжесть и частота сильно среди агентов сильно варьируют141. Седативный эффект может быть причиной повышенного риска развития венозной тромбоэмболии у пациентов, получавших антипсихотические препараты142.Хотя это общий побочный эффект и часто упоминаемая причина неприверженности лечению, способы влияния на седативный эффект широко не изучалось. Перенос дозы на ночное время и уменьшение общей суточной дозы являются первоначально рекомендованными подходами143, далее – переход к менее седативному антипсихотику. Кроме того, следует прекратить или изменить, если это возможно, прием других седативных препаратов. Также распространено использование кофеина, хотя его действие систематически не изучали.
Стимуляторы и модафинил могут улучшать когнитивные и негативные симптомы шизофрении144, но относительно небольшое исследование сфокусировалось на их потенциальной эффективности при антипсихотическом седативном воздействии. По результатам двух случаев метилфенидат был эффективен и безопасен при лечении пациентов с тяжелой и неустойчивой седацией из-за клозапина145. Небольшое двойное слепое перекрестное исследование метилфенидата, в котором изучение не было нацелено именно на седативный эффект от приема антипсихотических средств, не нашло каких-либо положительных сдвигов в клинических параметрах146. Более того, было показано, что метилфенидат также ухудшает дезорганизацию у пациентов с шизофренией147. Кроме того, несмотря на сообщения о случаях, предполагающих, что прием модафинила может лечить седативный эффект148, систематический обзор литературы показал слабую или недостаточную доказательную базу этого предположения, проведение рандомизированного контролируемого исследования также не обнаружило статистистически значимой пользы от его приема150. Вызывает беспокойство то, что эти лекарства могут привести к ухудшению двигательных расстройств151,152.
Пролактин, половая функция и минеральная плотность костной ткани
Многие антипсихотики способны увеличивать выработку пролактина, что может привести к ряду острых побочных эффектов: половой дисфункции, ановуляции, самопроизвольного истечения молока (галактореи) и гинекомастии. Антипсихотики могут быть приблизительно разделены на те, что индуцируют повышение пролактина и пролактин-щадящие. Первые включают в себя все антипсихотики первого поколения, рисперидон, палиперидон и амисульприд; последние включают клозапин, кветиапин, зипразидон и арипипразол153. Длительная гиперпролактинемия также связана с уменьшением минеральной плотности костной ткани и остеопорозом154.Сексуальная дисфункция, включая снижение либидо, аноргазмию и эректильную дисфункцию, распространена у пациентов, принимающих антипсихотические препараты155,156, и лечащему врачу необходимо их контролировать. Одной из шкал, которую можно использовать, является опросник «Антипсихотики и сексуальная функция»157. Оценка пациента с сексуальной дисфункцией должна включать в себя анализ уровней пролактина, учет других лекарств, которые могут этому способствовать, и исключение потенциальных сопутствующих причин158. Основной стратегией лечения является уменьшение дозы антипсихотика или переход на пролактин-щадящий антипсихотик (хотя сексуальная дисфункция также распространена при приеме клозапина и оланзапина)159. Для лечения конкретной симптоматики (кроме ингибиторов фосфодиэстеразы при эректильной дисфункции) не хватает данных160.
Многочисленные исследования также выявили увеличение частоты остеопении и остеопороза у пациентов с шизофренией161,162; однако на это могут влиять многочисленные факторы, помимо антипсихотиков, включая курение, употребление алкоголя, малоподвижный образ жизни и плохое питание153. Исследования показали, что снижение минеральной плотности костной ткани и увеличение скорости переломов тазобедренного сустава связаны с пролактин-индуцирующими антипсихотиками163,164. Также есть опасения, что повышенный уровень пролактина может вести к развитию рака молочной железы у женщин, страдающих шизофренией165, хотя доказательства этого далеко не убедительны из-за множественного ассоциированного образа жизни и метаболических факторов166.
До сих пор нет консенсуса относительно надлежащего мониторинга и лечения гиперпролактинемии у лиц, получающих антипсихотические препараты167–169. В целом, перед началом приема атипсихотического лечения пациентов необходимо опрашивать относительно их сексуальной дисфункции, нарушенияй менструального цикла и галактореи. Консенсус по поводу определения базового уровня пролактина отсутствует. Консервативный подход представляет собой периодический опрос пациентов о симптомах гиперпролактинемии и проверку у них уровня пролактина. Другим рациональным подходом является получение информации об уровне пролактина в начале, а затем примерно через три месяца после начала антипсихотического лечения, поскольку уровень пролактина к тому времени будет максимальным167.
Считается, что некоторые конкретные группы населения подвержены особенно высокому риску заболеваемости из-за гиперпролактинемии и, если это клинически возможно, им следует назначать антипсихотические препараты с минимальным риском повышения уровня пролактина169. Во-первых, это пациенты с диагностированной остеопенией или остеопорозом, для которых предпочтительным является пролактин-щадящий антипсихотик. Это также можно использовать для пациентов в возрасте до 25 лет, у которых масса костной ткани еще не достигла своего максимального значения, особенно для женщин, которые подвержены риску развития позднего остеопороза170. Во-вторых, для женщин, которые намерены забеременеть, пролактин-щадящий антипсихотик менее вероятно приведет к нежелательному влиянию на репродуктивную функцию.
В-третьих, известно довольно спекулятивное утверждение, что у пациентов, у которых в анамнезе есть риск развития рака молочной железы, существует большая опасность развития рака или рецидива при лечении препаратами, повышающими уровень пролактина171.
При развитии гиперпролактинемии у пациента, принимающего антипсихотические препараты, лечащий психиатр часто сталкивается с проблемой назначения дальнейшего обследования. Если был получен базовый уровень пролактина и повышение его уровня, очевидно, связано с приемом антипсихотика, дальнейшее обследование, вероятно, не потребуется. Более значимые признаки включают симптомы заболевания гипофиза (головные боли, зрительные изменения) и уровень пролактина более чем в четыре раза превышает верхний предел (>150 нг/мл), в этом случае осмотр эндокринологом и рентгенорадиологическое обследование (предпочтительно магнитно-резонансная томография) обязательны167,169. В неопределенных случаях (и когда риск дестабилизации у пациента низкий) после 3–4-дневной отмены антипсихотических препаратов может быть проведена оценка уровня пролактина; значительное его снижение свидетельствует о том, что нет соматической патологии.
В случаях подтвержденной антипсихотической индуцированной гиперпролактинемии, которая является симптоматической, основным методом воздействия является снижение дозы или переход на пролактин-щадящий антипсихотик. Если клинический риск снижения дозы или переключения считается слишком высоким, альтернативная стратегия заключается в добавлении арипипразола, что, как было показано, снижает уровень пролактина у пациентов, получавших рисперидон172. Более экспериментальная стратегия заключается в использовании агонистов допамина, таких как бромокриптин или каберголин, которые, как было выяснено, снижают концентрацию пролактина и улучшают сексуальную функцию, хотя это может привести к обострению психотических симптомов173,174.
Важным, но не решенным является вопрос о роли скрининга плотности кости у пациентов на антипсихотических препаратах. Целевая группа по профилактике США рекомендует скрининг всем женщинам в возрасте 65 лет, в то время как Национальный фонд остеопороза в США, помимо этого, рекомендует скрининг мужчинам старше 70 лет, а также женщинам в период менопаузы с факторами риска. Поскольку люди с шизофренией часто имеют множество факторов риска, помимо приема антипсихотического лечения (например, курение, ожирение, диабет), для них показано проведение более тщательного скрининга, чем для населения в целом.
Ортостатическая гипотензия
Все антипсихотики несут некоторый риск ортостатической гипотензии, которое определяется падением систолического давления на величину до 20 мм рт. ст. или падение диастолического артериального давления на величину до 10 мм рт. ст. в течение трех минут от принятия вертикального положения. Ортостатическая гипотензия может привести к головокружению, обмороку, падению, усилению стенокардии, и ее следует оценивать как по истории болезни, так и по измерениям. Факторы риска включают системные заболевания, вызывающие вегетативную нестабильность (например, сахарный диабет, алкогольную зависимость, болезнь Паркинсона), обезвоживание, межлекарственное взаимодействие и возраст. Хлорпромазин, сертиндол, клозапин и кветиапин, по-видимому, имеют наибольший риск176,177, и данные свидетельствуют о том, что илоперидон также можно отнести к этой группе178. Механизмом развития считается блокада альфа-1-адренорецепторов и антихолинергических эффектов179.Предпочтительным является переход на антипсихотик, который редко связывают с развитием ортостатической гипотензии. На профилактику ортостатической гипотензии влияет выбор антипсихотических препаратов, постепенного титрования и дозирования в течение дня (для минимизации пиковых уровней)175. Достаточное потребление воды и увеличение потребления соли (доза 1–2 г/сут), если это не является противопоказанием, могут уменьшить симптоматическую гипотензию180. Ношение бандажей и компрессионных чулок могут уменьшить венозный пул и улучшить симптоматику181.
Фармакологическое лечение требуется в редких случаях. Потребление кофеина может иметь благоприятный, мягкий прессорный эффект180. Флудрокортизон широко используется для лечения ортостатической гипотензии и успешно применяется при клозапин-индуцированной ортостатической гипотензии182, однако его существенным недостатком является негативное воздействие на сахар и электролиты в крови, особенно это относится к пациентам, у которых уже есть метаболические побочные эффекты175. При изучении альфа-1-агониста мидодрина выяснилось175,183, что его назначение в сочетании с антипсихотическими препаратами было связано с развитием острых дистоний184,185.
Смерть от внезапной остановки сердца и синдром удлиненного интервала Q–T
Смертность от внезапной остановки сердца в 1,5–4 раза выше при приеме антипсихотических препаратов. К факторам риска относятся назначение высокой дозы или быстрое ее введение, прием тиоридазина или бутирофеноновых антипсихотиков, а также гипертензия или ишемическая болезнь сердца в анамнезе188,190,191. Имеются противоречивые данные, связанные с возрастом188,192. Нет никаких доказательств того, что антипсихотики второго поколения более безопасны, чем препараты первого поколения, как класс187.Ведущим предложенным механизмом является блокада реполяризации калиевых токов и продление интервала Q–T, которые, как считается, приводят к желудочковым аритмиям. С точки зрения риска, измерение Q–T имеет ограниченную предсказательную силу; тем не менее Q–Tc >500 мс или подъем на 60 мс выше базовой линии рассматривается как явное нарушение193. Для практикующего врача важно учесть все лекарства, которые принимает пациент, поскольку разнообразные препараты могут вызывать продление интервала Q–T194. Ряд факторов могут сделать умеренное удлинение интервала Q–T опасным, включая брадикардию, гипокалиемию, гипомагниемию, застойную сердечную недостаточность, фибрилляцию предсердий, женский пол, полиморфизмы ионного канала194, хроническое употребление кокаина и алкоголя193.
Некоторые эксперты утверждают, что электрокардиограмма должна быть получена до и вскоре после начала приема антипсихотических препаратов, как часть рутинного исследования195. Чтобы поддержать это мнение, они ссылаются на значительно более высокий абсолютный риск смерти от внезапной остановки сердца, чем от индуцированного клозапином агранулоцитоза, для которого существует обширная система мониторинга. Другие рекомендуют контролировать только определенные антипсихотики или при наличии других факторов риска196. Последние рекомендации Американской психиатрической ассоциации рекомендуют тщательный физикальный осмотр и лабораторный скрининг, при этом ЭКГ показана при назначении тиоридазина, зипразидона, пимозида или мезоридазина; при наличии семейных случаев смерти от внезапной остановки сердца или синдрома удлиненного интервала Q–T; при наличии случаев обмороков или известных заболеваний сердца в анамнезе, или при наличии электролитных нарушений197. Национальная служба здравоохранения Великобритании в список препаратов с «высоким риском» включает галоперидол, сертиндол и пимозид, прием которых должен сопровождаться проведением рутинной процедуры ЭКГ, и рекомендует проведение ЭКГ, если факторы риска присутствуют с препаратами «умеренного риска», такими как хлорпромазин, амисульприд, лурасидон, кветиапин, зотепин, промозин и мельперон198. Пациентам, которые принимают более одного препарата, удлиняющего интервал Q–T, требуются тщательный скрининг и мониторинг.
Злокачественный нейролептический синдром
Злокачественный нейролептический синдром является одним из наиболее опасных побочных эффектов от приема антипсихотических препаратов. Признаками синдрома являются лихорадка, вегетативная нестабильность, ригидность и измененный психический статус, при сопутствующем лейкоцитозе и повышенном уровне креатинфосфокиназы. Смертность от него оценивается примерно в 5%199. Злокачественный нейролептический синдром, связанный с приемом антипсихотических препаратов второго поколения, особенно клозапином, может с меньшей вероятностью проявляться признаками паркинсонизма200,201. Оценки заболеваемости сильно различаются, причем самые последние данные за последние годы свидетельствуют о том, что показатели варьируют от 0,02 до 0,04%199,202,203. Важнейшим фактором риска является наличие синдрома в анамнезе. Фармакологические факторы риска включают антипсихотическую полипрагмазию, сильнодействующие антипсихотики, парентеральное введение, ускоренное повышение дозы, прием арипипразола, лития и бензодиазепина199,202,203. Множественные сопутствующие заболевания, тепловое воздействие, обезвоживание и использование фиксации также связаны с синдромом196,202–208.Злокачественный нейролептический синдром является неотложным состоянием, часто требующим интенсивной терапии. Данные берутся из отчетов и не основываются на рандомизированных клинических испытаниях. Психиатр первым делом должен отменить прием всех антипсихотиков и схожих с ними лекарств (например, метоклопрамида), предпринять меры по охлаждению и перевести на более высокий уровень оказания помощи203. Необходимы активная внутривенная гидратация и коррекция аномалий электролитов. Бензодиазепины могут помочь в лечении синдрома и предпочтительны для физического удержания ажитированных пациентов200. Миорелаксант дантролен и D2-агонист бромкриптин относятся к препаратам первой линии для лечения умеренного или тяжелого злокачественного нейролептического синдрома199. Электросудорожная терапия успешно используется при устойчивых к лечению случаях209.
Возврат пациента, который выздоровел от нейролептического злокачественного синдрома, к приему антипсихотика представляет собой клиническую сложность. Вероятность рецидива неизвестна, но, она может составлять 10–40%210–212. Более длительная пауза после лечения синдрома до возобновления лечения связана с уменьшением риска рецидива209. В некоторых случаях может потребоваться лечение пациента с помощью электросудорожной терапии для поддержания контроля симптомов в течение длительного периода до повторного назначения213. При повторном назначении антипсихотического препарата целесообразно выбирать препарат с более низким действием на D2 рецепторы (например, кветиапин или клозапин), проводить очень постепенное титрование дозы и тщательно контролировать.
Нейтропения/агранулоцитоз
Нейтропения – наличие в крови слишком малого количества нейтрофилов, что связано с инфекцией, и ее крайняя форма – агранулоцитоз – чаще всего развиваются в связи с приемом клозапина. Эти признаки и обусловленная ими повышенная восприимчивость к инфекции являются достаточно значимыми, чтобы обязательно мониторировать гранулоциты во время курса лечения клозапином. Клозапин привел к агранулоцитозу в 16 случаях, включая восемь смертей, данные о которых были опубликованы вскоре после того, как препарат был представлен в Финляндии в 1975 г.214. Хотя было зарегистрировано много случаев, когда прием клозапина приводил к агранулоцитозу215, небольшое количество отчетов, появившихся в 1950-х годах, свидетельствуют об агранулоцитозе, возникшем в результате применения фенотиазинов, в том числе хлорпромазина216–218. Имеются также отчеты об оланзапине219 и рисперидоне220. Приблизительно у 3% пациентов, получавших клозапин, развивается нейтропения, у 1% – агранулоцитоз221. Считается, что риск от других антипсихотиков намного ниже.Наиболее важной стратегией при нейтропении или агранулоцитозе является их раннее выявление, которое предотвратит оппортунистические инфекции. Поскольку наибольший риск существует в первые месяцы лечения215, количество нейтрофилов измеряется более часто в первые месяцы (еженедельно в течение 6 месяцев в США), затем раз в две недели на оставшуюся часть первого года, а затем ежемесячно на весь период лечения.
Если развивается нейтропения, рекомендованы более частый мониторинг и прерывание лечения. Для пациентов со стабильным, но незначительным количеством нейтрофилов некоторые клиницисты используют литий с целью увеличения уровней гранулоцитов выше пороговых значений, для избегания высоких требований к проведению мониторинга222,223. Механизм, с помощью которого литий увеличивает уровень гранулоцитов, неизвестен224.
Фармацевтические варианты гранулоцитарного колониестимулирующего фактора, гликопротеина, который индуцирует костный мозг для продуцирования и высвобождения гранулоцитов, могут краткосрочно использоваться для лечения агранулоцитоза225,226. У пациентов, которые ответили только на клозапин, такие препараты могут играть более долгосрочную роль в предотвращении агранулоцитоза. Например, филгастрам может применяться в течение продолжительного периода времени для поддержания адекватного количества нейтрофилов во избежание инфекций. Основные проблемы – то, что филгастрам вводится парентерально и является дорогостоящим препаратом.
Снижение дозы не является эффективным подходом при нейтропении, появившейся в результате приема клозапина224. Прекращение приема клозапина является окончательным решением при вызванной клозапином нейтропении. Этот подход обычно требует переход на другой антипсихотик. Для тех пациентов, которые ответили только на клозапин, повторное назначение клозапина после агранулоцитоза не было успешным, но в отчетах описывается успешное повторное введение после нейтропении клозапина с использованием лития или филгастрама для увеличения количества нейтрофилов227.
Поведенческая зависимость / расстройства импульсивного поведения
Прием арипипразола был связан с началом или обострением расстройств импульсного контроля или поведенческой зависимости, включая патологический гэмблинг и компульсивное питание, расходы, шоппинг и сексуальное поведение228,229. Поскольку агонисты дофамина, используемые для лечения болезни Паркинсона, также вызывают импульсные расстройства контроля у значительной части пациентов, частичный эффект агонизма дофамина у арипипразола, как предполагается, и является механизмом, увеличивающим эту склонность230–232. Таким образом, вполне вероятно, что другие антипсихотики с агонистической дофаминовой активностью, такие как карипразин и брекспипразол, могут иметь этот же эффект.Ключом к управлению компульсивным поведением является признание того, что они вызваны медикаментами, а не просто являются частью основного психического или поведенческого состояния. Во всех зарегистрированных случаях снижение дозы или прекращение приема было эффективным для прекращения неконтролируемого поведения в течение нескольких недель228,233,234. Если необходим антипсихотик, следует выбрать препарат без эффектов агониста дофамина.
Миокардит
Миокардит, или воспаление сердечной мышцы, – это редкий, но важный побочный эффект лечения клозапином, который почти всегда развивается в течение первых двух месяцев лечения235,236. Поскольку миокардит может быстро прогрессировать при кардиомиопатии и сердечной недостаточности, лучшей стратегией является мониторинг для раннего распознавания. Может помочь медленное титрование237,238. Как минимум пациенты, начинающие принимать клозапин, должны еженедельно отслеживать признаки и симптомы миокардита, включая боль в груди, одышку, ортопноэ, периферический отек, учащенное сердцебиение, усталость, симптомы гриппа, включая повышение температуры, тошноту и рвоту, а также потоотделение239. При подозрении на миокардит необходимо сделать ЭКГ для оценки сердечных ферментов. Лабораторные тесты, предполагающие миокардит в контексте недавно начатого приема клозапина, включают повышенное количество эозинофилов, уровень С-реактивного белка, скорость седиментации и тропонины. При подозрении на миокардит эхокардиограмма может оценивать функционирование желудочков и сердечных клапанов; эхокардиограмма как стандартное обследование для всех пациентов не является необходимой239,240.Если диагноз миокардита подтвердился, прием клозапина следует незамедлительно прекратить, необходим общий или специальный уход за больным. Во многих случаях сердечная функция возвращается в норму после прекращения приема клозапина. Частота рецидивов индуцированного клозапином миокардита высока; если считается, что возможные преимущества препарата оправдывают этот риск, его прием следует возобновить в больнице под тщательным контролем241.
Метаболические побочные эффекты
Многие антипсихотические препараты связаны, в различной степени, с увеличением массы тела, гипертензией и неблагоприятным воздействием на метаболизм липидов и глюкозы.Несколько антипсихотиков связаны со значительным увеличением массы тела, и, как известно, практически все антипсихотики вызывают ее увеличение у молодых людей3. Увеличение массы тела является одним из наиболее важных антипсихотических побочных эффектов, так как приводит к дистрессу у пациентов и увеличивает риск неблагоприятных последствий для здоровья, таких как дегенеративное заболевание суставов, сахарный диабет 2-го типа и его осложнения, сердечно-сосудистые и цереброваскулярные заболевания, а также некоторые виды рака, заболевания печени и почек. Хотя увеличение массы тела обычно сопровождает другие неблагоприятные метаболические эффекты, неблагоприятные изменения в липидах и чувствительность к инсулину могут возникать независимо от увеличения веса3.
Любой, кто принимает антипсихотические препараты, должен регулярно контролироваться для выявления метаболических побочных эффектов. Если эти эффекты происходят, широко рекомендуется изменение образа жизни в качестве первого шага для людей, принимающих антипсихотические препараты. Было протестировано несколько структурированных поведенческих программ, которые были признаны эффективными у лиц с тяжелыми психическими заболеваниями242–245. Переход на антипсихотик с меньшим риском развития метаболических проблем может быть эффективным, помогая людям сбросить вес и улучшить метаболические показатели4,5.
Метаболические проблемы, которые развиваются в контексте успешного лечения антипсихотиками, также можно лечить симптоматически, так как они касаются всего населения в целом. Например, статины используются для лечения дислипидемии, а антигипертензивные препараты – для лечения гипертензии. Метформин, как было неоднократно показано в рандомизированных контролируемых исследованиях, демонстрирует эффективность слабой силы в похудании пациентов, принимающих антипсихотические средства, даже если увеличение массы тела было не недавним246–249. Последние одобренные препараты для похудения – лорказерин, бупропион/налтрексон и лираглутид – не были протестированы при увеличении массы тела, вызванном антипсихотическими свойствами. Только предварительные данные говорят о том, что налтрексон может быть эффективен250. Психостимуляторы не рекомендуются для снижения массы тела из-за их пропсихотического эффекта.
Антихолинергические эффекты
Антихолинергические побочные эффекты антипсихотиков включают уменьшение слюноотделения, приводящее к сухости во рту, снижение моторики кишечника, приводящее к запорам, ухудшение зрительной аккомодации, приводящее к помутнению зрения, увеличению размера зрачка, а также тахикардию251. Эти эффекты могут привести к таким осложнениям, как кариес зубов, кишечная непроходимость и стенокардия или инфаркт миокарда. Поскольку увеличенный размер зрачка может усугубить закрытоугольную глаукому, это необходимо лечить до начала антипсихотического лечения; следует выбрать антипсихотик с минимальными антихолинергическими эффектами. Точно так же следует лечить гипертрофию простаты и использовать антипсихотик с небольшим антихолинергическим эффектом251.Снижение дозы антипсихотических препаратов является стратегией первой линии для управления антихолинергическими побочными эффектами. Переход на лекарство с меньшим количеством антихолинергических эффектов также может быть эффективным251. Наконец, симптоматическое управление является разумным подходом, но существует мало доказательств, специфичных для антихолинергических эффектов, вызванных антипсихотическими свойствами.
Запор, вызванный антипсихотическими средствами, особенно клозапином, может быть тяжелым побочным эффектом и привести к кишечной непроходимости252,253. Предупреждение и раннее выявление имеют решающее значение. Рекомендуемые стратегии управления включают адекватную гидратацию; использование осмотических агентов, таких как сорбит, лактулоза или полиэтиленгликоль, и стимуляторные слабительные, такие как сенна или бисакодил. Эффект от таких слабительных, как докузат натрия, неясен4. Массообразующие, основанные на волокнах слабительные, как правило, не рекомендуются при запоре со снижением моторики, например, вызванном антихолинергическими эффектами254.
ВЫВОДЫ
Значительные преимущества антипсихотических препаратов перевешивают их побочные действия. Соответствующая профилактика и раннее управление этими эффектами могут повысить преимущества применения антипсихотических препаратов. В нашем обзоре было установлено, что точными эмпирическими данными подкрепляются в целом небольшое количество подходов к управлению побочными эффектами; рекомендации часто основаны, по крайней мере частично, только на мнениях экспертов.Тем не менее несколько ключевых принципов применяются довольно широко. Это применение антипсихотиков лишь при достаточных и точных показаниях, продолжение приема антипсихотиков необходимо только если есть значимые преимущества. Если антипсихотик приносит существенную пользу, и неблагоприятный эффект не опасен для жизни, тогда первый выбор при коррекции побочных действий заключается в снижении дозы или корректировке графика дозирования. Далее следует сменить антипсихотик; это часто бывает разумным, если риск рецидива не высок, например когда человек только реагировал на клозапин. В некоторых случаях можно попытаться использовать поведенческие вмешательства. Наконец, во многих случаях необходимы сопутствующие лекарственные средства, хотя они обычно нежелательны.
Данные свидетельствуют о том, что побочные эффекты не являются основной причиной, по которой люди прекращают прием антипсихотических препаратов255. Тем не менее оптимальное управление побочными эффектами улучшит качество жизни пациентов и их функциональные исходы.
БЛАГОДАРНОСТЬ
Этот документ частично поддерживался Глобальной программой психического здоровья в Колумбийском университете. Авторы благодарят S. Wetzler за ее помощь.
DOI: 10.1002/wps.20567
Список исп. литературыСкрыть список1. Goff DC. Maintenance treatment with long-acting injectable antipsychotics: comparing old with new. JAMA 2014;311:1973-4.
2. International College of Neuropsychopharmacology . CINP schizophrenia guidelines. http://cinp.org/cinp-schizophrenia-guidelines/.
3. Schimmelmann BG, Schmidt SJ, Carbon M et al. Treatment of adolescents with early-onset schizophrenia spectrum disorders: in search of a rational, evidence-informed approach. Curr Opin Psychiatry 2013;26:219-30.
4. Newcomer JW, Weiden PJ, Buchanan RW. Switching antipsychotic medications to reduce adverse event burden in schizophrenia: establishing evidence-based practice. J Clin Psychiatry 2013;74:1108-20.
5. Stroup TS, McEvoy JP, Ring KD et al. A randomized trial examining the effectiveness of switching from olanzapine, quetiapine, or risperidone to aripiprazole to reduce metabolic risk: comparison of antipsychotics for metabolic problems (CAMP). Am J Psychiatry 2011;168:947-56.
6. Brar JS, Ganguli R, Pandina G et al. Effects of behavioral therapy on weight loss in overweight and obese patients with schizophrenia or schizoaffective disorder. J Clin Psychiatry 2005;66:205-12.
7. Seemuller F, Lewitzka U, Bauer M. The relationship of akathisia with treatment emergent suicidality among patients with first-episode schizophrenia treated with haloperidol or risperidone. Pharmacopsychiatry 2012;45:292-6.
8. Tarsy D. Neuroleptic-induced extrapyramidal reactions: classification, description, and diagnosis. Clin Neuropharmacol 1983;6(Suppl. 1):
S9-26.
9. van Harten PN, Hoek HW, Kahn RS. Acute dystonia induced by drug treatment. BMJ 1999;319:623-6.
10. Keepers GA, Casey DE. Use of neuroleptic-induced extrapyramidal symptoms to predict future vulnerability to side effects. Am J Psychiatry 1991;148:85-9.
11. Aguilar EJ, Keshavan MS, Martinez-Quiles MD et al. Predictors of acute dystonia in first-episode psychotic patients. Am J Psychiatry 1994;151:1819-21.
12. Swett C Jr. Drug-induced dystonia. Am J Psychiatry 1975;132:532-4.
13. Koek RJ, Pi EH. Acute laryngeal dystonic reactions to neuroleptics. Psychosomatics 1989;30:359-64.
14. Gardner DM, Abidi S, Ursuliak Z et al. Incidence of oculogyric crisis and long-term outcomes with second-generation antipsychotics in a first-episode psychosis program. J Clin Psychopharmacol 2015;35:
715-8.
15. Arana GW, Goff DC, Baldessarini RJ et al. Efficacy of anticholinergic prophylaxis for neuroleptic-induced acute dystonia. Am J Psychiatry 1988;145:993-6.
16. Goff DC, Arana GW, Greenblatt DJ et al. The effect of benztropine on haloperidol-induced dystonia, clinical efficacy and pharmacokinetics: a prospective, double-blind trial. J Clin Psychopharmacol 1991;11:
106-12.
17. Stern TA, Anderson WH. Benztropine prophylaxis of dystonic reactions. Psychopharmacology 1979;61:261-2.
18. Winslow RS, Stillner V, Coons DJ et al. Prevention of acute dystonic reactions in patients beginning high-potency neuroleptics. Am J Psychiatry 1986;143:706-10.
19. Swett C Jr, Cole JO, Shapiro S et al. Extrapyramidal side effects in chlorpromazine recipients: emergence according to benztropine prophylaxis. Arch Gen Psychiatry 1977;34:942-3.
20. Desmarais JE, Beauclair L, Annable L et al. Effects of discontinuing anticholinergic treatment on movement disorders, cognition and psychopathology in patients with schizophrenia. Ther Adv Psychopharmacol 2014;4:257-67.
21. Caradoc-Davies G, Menkes DB, Clarkson HO et al. A study of the need for anticholinergic medication in patients treated with long-term antipsychotics. Aust N Z J Psychiatry 1986;20:225-32.
22. Chan HY, Chang CJ, Chiang SC et al. A randomised controlled study of risperidone and olanzapine for schizophrenic patients with neuroleptic-induced acute dystonia or parkinsonism. J Psychopharmacol 2010;24:91-8.
23. Altamura AC, Mauri MC, Mantero M et al. Clonazepam/haloperidol combination therapy in schizophrenia: a double blind study. Acta Psychiatr Scand 1987;76:702-6.
24. Gagrat D, Hamilton J, Belmaker RH. Intravenous diazepam in the treatment of neuroleptic-induced acute dystonia and akathisia.
Am J Psychiatry 1978;135:1232-3.
25. Thanvi B, Treadwell S. Drug induced parkinsonism: a common cause of parkinsonism in older people. Postgrad Med J 2009;85:322-6.
26. Caligiuri MP, Lohr JB. Instrumental motor predictors of neuroleptic-induced parkinsonism in newly medicated schizophrenia patients.
J Neuropsychiatry Clin Neurosci 1997;9:562-7.
27. Hriso E, Kuhn T, Masdeu JC et al. Extrapyramidal symptoms due to dopamine-blocking agents in patients with AIDS encephalopathy.
Am J Psychiatry 1991;148:1558-61.
28. Lera G, Zirulnik J. Pilot study with clozapine in patients with
HIV-associated psychosis and drug-induced parkinsonism. Mov Disord 1999;14:128-31.
29. Chang A, Fox SH. Psychosis in Parkinson's disease: epidemiology, pathophysiology, and management. Drugs 2016;76:1093-18.
30. Samudra N, Patel N, Womack KB et al. Psychosis in Parkinson disease: a review of etiology, phenomenology, and management. Drugs Aging 2016;33:855-63.
31. Taylor J, Anderson WS, Brandt J et al. Neuropsychiatric complications of Parkinson disease treatments: importance of multidisciplinary care. Am J Geriatr Psychiatry 2016;24:1171-80.
32. Mamo DC, Sweet RA, Keshavan MS. Managing antipsychotic- induced parkinsonism. Drug Saf 1999;20:269-75.
33. Cortese L, Caligiuri MP, Williams R et al. Reduction in neuroleptic- induced movement disorders after a switch to quetiapine in patients with schizophrenia. J Clin Psychopharmacol 2008;28: 69-73.
34. Magnus RV. A comparison of biperiden hydrochloride (Akineton) and benzhexol (Artane) in the treatment of drug-induced Parkinsonism.
J Int Med Res 1980;8:343-6.
35. Dayalu P, Chou KL. Antipsychotic-induced extrapyramidal symptoms and their management. Expert Opin Pharmacother 2008;9:1451-62.
36. Ananth J, Sangani H, Noonan JP. Amantadine in drug-induced extrapyramidal signs: a comparative study. Int J Clin Pharmacol Biopharm 1975;11:323-6.
37. Chouinard G, Annable L, Ross-Chouinard A et al. Ethopropazine and benztropine in neuroleptic-induced parkinsonism. J Clin Psychiatry 1979;40:147-52.
38. Kelly JT, Zimmermann RL, Abuzzahab FS et al. A double-blind study of amantadine hydrochloride versus benztropine mesylate in drug-induced parkinsonism. Pharmacology 1974;12:65-73.
39. Mindham RH, Gaind R, Anstee BH et al. Comparison of amantadine, orphenadrine, and placebo in the control of phenothiazine-induced Parkinsonism. Psychol Med 1972;2:406-13.
40. Silver H, Geraisy N, Schwartz M. No difference in the effect of biperiden and amantadine on parkinsonian- and tardive dyskinesia-type involuntary movements: a double-blind crossover, placebo-controlled study in medicated chronic schizophrenic patients. J Clin Psychiatry 1995;56:167-70.
41. Van Putten T. Vulnerability to extrapyramidal side effects. Clin Neuropharmacol 1983;6(Suppl. 1):S27-34.
42. Miller CH, Hummer M, Oberbauer H et al. Risk factors for the development of neuroleptic induced akathisia. Eur Neuropsychopharmacol 1997;7:51-5.
43. Sachdev P, Kruk J. Clinical characteristics and predisposing factors in acute drug-induced akathisia. Arch Gen Psychiatry 1994;51:963-74.
44. Juncal-Ruiz M, Ramirez-Bonilla M, Gomez-Arnau J et al. Incidence and risk factors of acute akathisia in 493 individuals with first episode non-affective psychosis: a 6-week randomised study of antipsychotic treatment. Psychopharmacology 2017;234:2563-70.
45. Poyurovsky M. Acute antipsychotic-induced akathisia revisited.
Br J Psychiatry 2010;196:89-91.
46. Poyurovsky M, Pashinian A, Weizman R et al. Low-dose mirtazapine: a new option in the treatment of antipsychotic-induced akathisia. A randomized, double-blind, placebo- and propranolol-controlled trial. Biol Psychiatry 2006;59:1071-7.
47. Adler L, Angrist B, Peselow E et al. A controlled assessment of propranolol in the treatment of neuroleptic-induced akathisia. Br J Psychiatry 1986;149:42-5.
48. Kramer MS, Gorkin R, DiJohnson C. Treatment of neuroleptic-induced akathisia with propranolol: a controlled replication study. Hillside
J Clin Psychiatry 1989;11:107-19.
49. Kramer MS, Gorkin RA, DiJohnson C et al. Propranolol in the treatment of neuroleptic-induced akathisia (NIA) in schizophrenics: a double-blind, placebo-controlled study. Biol Psychiatry 1988;24:823-7.
50. Lima AR, Bacalcthuk J, Barnes TR et al. Central action beta-blockers versus placebo for neuroleptic-induced acute akathisia. Cochrane Database Syst Rev 2004;4:CD001946.
51. Rathbone J, Soares-Weiser K. Anticholinergics for neuroleptic- induced acute akathisia. Cochrane Database Syst Rev 2006;4: CD003727.
52. Fleischhacker WW, Roth SD, Kane JM. The pharmacologic treatment of neuroleptic-induced akathisia. J Clin Psychopharmacol 1990;10:12-21.
53. Hieber R, Dellenbaugh T, Nelson LA. Role of mirtazapine in the treatment of antipsychotic-induced akathisia. Ann Pharmacother 2008;42:841-6.
54. Praharaj SK, Kongasseri S, Behere RV et al. Mirtazapine for antipsychotic-induced acute akathisia: a systematic review and meta-analysis of randomized placebo-controlled trials. Ther Adv Psychopharmacol 2015;5:307-13.
55. Miller CH, Fleischhacker WW, Ehrmann H et al. Treatment of neuroleptic induced akathisia with the 5-HT2 antagonist ritanserin. Psychopharmacol Bull 1990;26:373-6.
56. Miller CH, Hummer M, Pycha R et al. The effect of ritanserin on treatment-resistant neuroleptic induced akathisia: case reports. Prog Neuropsychopharmacol Biol Psychiatry 1992;16:247-51.
57. Poyurovsky M, Fuchs C, Weizman A. Low-dose mianserin in treatment of acute neuroleptic-induced akathisia. J Clin Psychopharmacol 1998;18:253-4.
58. Poyurovsky M, Shardorodsky M, Fuchs C et al. Treatment of neuroleptic-induced akathisia with the 5-HT2 antagonist mianserin. Double-blind, placebo-controlled study. Br J Psychiatry 1999;174:238-42.
59. Avital A, Gross-Isseroff R, Stryjer R et al. Zolmitriptan compared to propranolol in the treatment of acute neuroleptic-induced akathisia: a comparative double-blind study. Eur Neuropsychopharmacol 2009;19:476-82.
60. Fischel T, Hermesh H, Aizenberg D et al. Cyproheptadine versus propranolol for the treatment of acute neuroleptic-induced akathisia: a comparative double-blind study. J Clin Psychopharmacol 2001;21:612-5.
61. Hirose S, Ashby CR. Immediate effect of intravenous diazepam in neuroleptic-induced acute akathisia: an open-label study. J Clin Psychiatry 2002;63:524-7.
62. Bartels M, Heide K, Mann K et al. Treatment of akathisia with lorazepam. An open clinical trial. Pharmacopsychiatry 1987;20:51-3.
63. Kutcher S, Williamson P, MacKenzie S et al. Successful clonazepam treatment of neuroleptic-induced akathisia in older adolescents and young adults: a double-blind, placebo-controlled study. J Clin Psychopharmacol 1989;9:403-6.
64. Pujalte D, Bottai T, Hue B et al. A double-blind comparison of clonazepam and placebo in the treatment of neuroleptic-induced akathisia. Clin Neuropharmacol 1994;17:236-42.
65. Lima AR, Soares-Weiser K, Bacaltchuk J et al. Benzodiazepines for neuroleptic-induced acute akathisia. Cochrane Database Syst Rev 2002;1:CD001950.
66. Tiihonen J, Mittendorfer-Rutz E, Torniainen M et al. Mortality and cumulative exposure to antipsychotics, antidepressants, and benzodiazepines in patients with schizophrenia: an observational follow-up study. Am J Psychiatry 2016;173:600-6.
67. Lerner V, Bergman J, Statsenko N et al. Vitamin B6 treatment in acute neuroleptic-induced akathisia: a randomized, double-blind, placebo-controlled study. J Clin Psychiatry 2004;65:1550-4.
68. Bernstein AL. Vitamin B6 in clinical neurology. Ann N Y Acad Sci 1990;585:250-60.
69. Erdur B, Tura P, Aydin B et al. A trial of midazolam vs diphenhydramine in prophylaxis of metoclopramide-induced akathisia. Am
J Emerg Med 2012;30:84-91.
70. Friedman BW, Bender B, Davitt M et al. A randomized trial of diphenhydramine as prophylaxis against metoclopramide-induced akathisia in nauseated emergency department patients. Ann Emerg Med 2009;53:379-85.
71. Vinson DR. Diphenhydramine in the treatment of akathisia induced by prochlorperazine. J Emerg Med 2004;26:265-70.
72. Cornett EM, Novitch M, Kaye AD et al. Medication-induced tardive dyskinesia: a review and update. Ochsner J 2017;17:162-74.
73. Bhidayasiri R, Boonyawairoj S. Spectrum of tardive syndromes: clinical recognition and management. Postgrad Med J 2011;87:132-41.
74. Yassa R, Jeste DV. Gender differences in tardive dyskinesia: a critical review of the literature. Schizophr Bull 1992;18:701-15.
75. Tenback DE, van Harten PN, Slooff CJ et al. Evidence that early extrapyramidal symptoms predict later tardive dyskinesia: a prospective analysis of 10,000 patients in the European Schizophrenia Outpatient Health Outcomes (SOHO) study. Am J Psychiatry 2006;163:1438-40.
76. Tenback DE, van Harten PN, van Os J. Non-therapeutic risk factors for onset of tardive dyskinesia in schizophrenia: a meta-analysis. Mov Disord 2009;24:2309-15.
77. Miller DD, McEvoy JP, Davis SM et al. Clinical correlates of tardive dyskinesia in schizophrenia: baseline data from the CATIE schizophrenia trial. Schizophr Res 2005;80:33-43.
78. Zhang XY, Chen DC, Qi LY et al. Gender differences in the prevalence, risk and clinical correlates of tardive dyskinesia in Chinese schizophrenia. Psychopharmacology 2009;205:647-54.
79. Bakker PR, van Harten PN, van Os J. Antipsychotic-induced tardive dyskinesia and polymorphic variations in COMT, DRD2, CYP1A2 and MnSOD genes: a meta-analysis of pharmacogenetic interactions. Mol Psychiatry 2008;13:544-56.
80. Zai CC, Tiwari AK, Muller DJ et al. The catechol-O-methyl-transferase gene in tardive dyskinesia. World J Biol Psychiatry 2010;11:803-12.
81. Miura I, Zhang JP, Nitta M et al. BDNF Val66Met polymorphism and antipsychotic-induced tardive dyskinesia occurrence and severity: a meta-analysis. Schizophr Res 2014;152:365-72.
82. Inada T, Koga M, Ishiguro H et al. Pathway-based association analysis of genome-wide screening data suggest that genes associated with the gamma-aminobutyric acid receptor signaling pathway are involved in neuroleptic-induced, treatment-resistant tardive dyskinesia. Pharmacogenet Gen 2008;18:317-23.
83. Lanning RK, Zai CC, Muller DJ. Pharmacogenetics of tardive dyskinesia: an updated review of the literature. Pharmacogenomics 2016;17:1339-51.
84. Son WY, Lee HJ, Yoon HK et al. GABA transporter SLC6A11 gene polymorphism associated with tardive dyskinesia. Nordic J Psychiatry 2014;68:123-8.
85. Carbon M, Hsieh CH, Kane JM et al. Tardive dyskinesia prevalence in the period of second-generation antipsychotic use: a meta-analysis.
J Clin Psychiatry 2017;78:e264-78.
86. Correll CU, Schenk EM. Tardive dyskinesia and new antipsychotics. Curr Opin Psychiatry 2008;21:151-6.
87. Correll CU, Leucht S, Kane JM. Lower risk for tardive dyskinesia associated with second-generation antipsychotics: a systematic review of
1-year studies. Am J Psychiatry 2004;161:414-25.
88. O'Brien A. Comparing the risk of tardive dyskinesia in older adults with first-generation and second-generation antipsychotics: a systematic review and meta-analysis. Int J Geriatr Psychiatry 2016;31:683-93.
89. Bai YM, Yu SC, Chen JY et al. Risperidone for pre-existing severe tardive dyskinesia: a 48-week prospective follow-up study. Int Clin Psychopharmacol 2005;20:79-85.
90. Chan HY, Chiang SC, Chang CJ et al. A randomized controlled trial of risperidone and olanzapine for schizophrenic patients with neuroleptic-induced tardive dyskinesia. J Clin Psychiatry 2010;71:1226-33.
91. Chouinard G. Effects of risperidone in tardive dyskinesia: an analysis of the Canadian multicenter risperidone study. J Clin Psychopharmacol 1995;15:36S-44S.
92. Bergman H, Walker DM, Nikolakopoulou A et al. Systematic review of interventions for treating or preventing antipsychotic-induced tardive dyskinesia. Health Technol Assess 2017;21:1-218. [PMC free article]
93. Hauser RA, Factor SA, Marder SR et al. KINECT 3: a phase 3 randomized, double-blind, placebo-controlled trial of valbenazine for tardive dyskinesia. Am J Psychiatry 2017;174:476-84.
94. Leung JG, Breden EL. Tetrabenazine for the treatment of tardive dyskinesia. Ann Pharmacother 2011;45:525-31.
95. Ondo WG, Hanna PA, Jankovic J. Tetrabenazine treatment for tardive dyskinesia: assessment by randomized videotape protocol. Am J Psychiatry 1999;156:1279-81.
96. Citrome L. Valbenazine for tardive dyskinesia: a systematic review of the efficacy and safety profile for this newly approved novel medication – what is the number needed to treat, number needed to harm and likelihood to be helped or harmed? Int J Clin Pract (in press).
97. Fernandez HH, Factor SA, Hauser RA et al. Randomized controlled trial of deutetrabenazine for tardive dyskinesia: the ARM-TD study. Neurology 2017;88:2003-10.
98. Alabed S, Latifeh Y, Mohammad HA et al. Gamma-aminobutyric acid agonists for neuroleptic-induced tardive dyskinesia. Cochrane Database Syst Rev 2011;4:CD000203.
99. Thaker GK, Nguyen JA, Strauss ME et al. Clonazepam treatment of tardive dyskinesia: a practical GABAmimetic strategy. Am J Psychiatry 1990;147:445-51.
100. Zhang WF, Tan YL, Zhang XY et al. Extract of Ginkgo biloba treatment for tardive dyskinesia in schizophrenia: a randomized, double-blind, placebo-controlled trial. J Clin Psychiatry 2011;72:615-21.
101. Zhang XY, Zhang WF, Zhou DF et al. Brain-derived neurotrophic factor levels and its Val66Met gene polymorphism predict tardive dyskinesia treatment response to Ginkgo biloba. Biol Psychiatry 2012;72:700-6.
102. Adelufosi AO, Abayomi O, Ojo TM. Pyridoxal 5 phosphate for neuroleptic-induced tardive dyskinesia. Cochrane Database Syst Rev 2015;4:CD010501.
103. Soares-Weiser K, Maayan N, McGrath J. Vitamin E for neuroleptic-induced tardive dyskinesia. Cochrane Database Syst Rev 2011;2:CD000209.
104. Bhidayasiri R, Fahn S, Weiner WJ et al. Evidence-based guideline: treatment of tardive syndromes: report of the Guideline Development Subcommittee of the American Academy of Neurology. Neurology 2013;81:463-9.
105. El-Sayeh HG, Lyra da Silva JP, Rathbone J et al. Non-neuroleptic catecholaminergic drugs for neuroleptic-induced tardive dyskinesia. Cochrane Database Syst Rev 2006;1:CD000458.
106. Essali A, Deirawan H, Soares-Weiser K et al. Calcium channel blockers for neuroleptic-induced tardive dyskinesia. Cochrane Database Syst Rev 2011;11:CD000206.
107. Pouclet-Courtemanche H, Rouaud T, Thobois S et al. Long-term efficacy and tolerability of bilateral pallidal stimulation to treat tardive dyskinesia. Neurology 2016;86:651-9.
108. Saleh C, Gonzalez V, Coubes P. Role of deep brain stimulation in the treatment of secondary dystonia-dyskinesia syndromes. Handb Clin Neurol 2013;116:189-208.
109. Sobstyl M, Zabek M. Deep brain stimulation for intractable tardive dystonia: literature overview. Neurol Neurochir Pol 2016;50:114-22.
110. Thobois S, Poisson A, Damier P. Surgery for tardive dyskinesia. Int Rev Neurobiol 2011;98:289-96.
111. Maher S, Cunningham A, O'Callaghan N et al. Clozapine-induced hypersalivation: an estimate of prevalence, severity and impact on quality of life. Ther Adv Psychopharmacol 2016;6:178-84.
112. Corrigan FM, MacDonald S, Reynolds GP. Clozapine-induced hypersalivation and the alpha 2 adrenoceptor. Br J Psychiatry 1995;167:412.
113. Ukai Y, Taniguchi N, Ishima T et al. Muscarinic supersensitivity and subsensitivity induced by chronic treatment with atropine and diisopropylfluorophosphate in rat submaxillary glands. Arch Int Pharmacodyn Ther 1989;297:148-57.
114. Saenger RC, Finch TH, Francois D. Aspiration pneumonia due to clozapine-induced sialorrhea. Clin Schizophr Relat Psychoses 2016;9:170-2.
115. Trigoboff E, Grace J, Szymanski H et al. Sialorrhea and aspiration pneumonia: a case study. Innov Clin Neurosci 2013;10:20-7.
116. Acosta-Armas AJ. Two cases of parotid gland swelling in patients taking clozapine. Hosp Med 2001;62:704-5.
117. Patkar AA, Alexander RC. Parotid gland swelling with clozapine.
J Clin Psychiatry 1996;57:488.
118. Bird AM, Smith TL, Walton AE. Current treatment strategies for clozapine-induced sialorrhea. Ann Pharmacother 2011;45:667-75.
119. Essali A, Rihawi A, Altujjar M et al. Anticholinergic medication for non-clozapine neuroleptic-induced hypersalivation in people with schizophrenia. Cochrane Database Syst Rev 2013;12:CD009546.
120. Antonello C, Tessier P. Clozapine and sialorrhea: a new intervention for this bothersome and potentially dangerous side effect. J Psychiatry Neurosci 1999;24:250.
121. Sharma A, Ramaswamy S, Dahl E et al. Intraoral application of atropine sulfate ophthalmic solution for clozapine-induced sialorrhea. Ann Pharmacother 2004;38:1538.
122. Tessier P, Antonello C. Clozapine and sialorrhea: update. J Psychiatry Neurosci 2001;26:253.
123. Calderon J, Rubin E, Sobota WL. Potential use of ipratropium bromide for the treatment of clozapine-induced hypersalivation: a preliminary report. Int Clin Psychopharmacol 2000;15:49-52.
124. Freudenreich O, Beebe M, Goff DC. Clozapine-induced sialorrhea treated with sublingual ipratropium spray: a case series. J Clin Psychopharmacol 2004;24:98-100.
125. Sockalingam S, Shammi C, Remington G. Treatment of clozapine-induced hypersalivation with ipratropium bromide: a randomized, double-blind, placebo-controlled crossover study. J Clin Psychiatry 2009;70:1114-9.
126. Reinstein M, Sirotovskaya L, Chasanov M et al. Comparative efficacy and tolerability of benztropine and terazosin in the treatment of hypersalivation secondary to clozapine. Clin Drug Invest 1999;17:97-102.
127. Spivak B, Adlersberg S, Rosen L et al. Trihexyphenidyl treatment of clozapine-induced hypersalivation. Int Clin Psychopharmacol 1997;12:213-5.
128. Liang CS, Ho PS, Shen LJ et al. Comparison of the efficacy and impact on cognition of glycopyrrolate and biperiden for clozapine-induced sialorrhea in schizophrenic patients: a randomized, double-blind, crossover study. Schizophr Res 2010;119:138-44.
129. Bai YM, Lin CC, Chen JY et al. Therapeutic effect of pirenzepine for clozapine-induced hypersalivation: a randomized, double-blind, placebo-controlled, cross-over study. J Clin Psychopharmacol 2001;21:608-11.
130. Schneider B, Weigmann H, Hiemke C et al. Reduction of clozapine-induced hypersalivation by pirenzepine is safe. Pharmacopsychiatry 2004;37:43-5.
131. Copp PJ, Lament R, Tennent TG. Amitriptyline in clozapine-induced sialorrhoea. Br J Psychiatry 1991;159:166.
132. Grabowski J. Clonidine treatment of clozapine-induced hypersalivation. J Clin Psychopharmacol 1992;12:69-70.
133. Praharaj SK, Verma P, Roy D et al. Is clonidine useful for treatment of clozapine-induced sialorrhea? J Psychopharmacol 2005;19:426-8.
134. Webber MA, Szwast SJ, Steadman TM et al. Guanfacine treatment of clozapine-induced sialorrhea. J Clin Psychopharmacol 2004;24:675-6.
135. Kreinin A, Epshtein S, Sheinkman A et al. Sulpiride addition for the treatment of clozapine-induced hypersalivation: preliminary study. Isr J Psychiatry Relat Sci 2005;42:61-3.
136. Kreinin A, Miodownik C, Sokolik S et al. Amisulpride versus moclobemide in treatment of clozapine-induced hypersalivation. World J Biol Psychiatry 2011;12:620-6.
137. Kreinin A, Novitski D, Weizman A. Amisulpride treatment of clozapine-induced hypersalivation in schizophrenia patients: a randomized, double-blind, placebo-controlled cross-over study. Int Clin Psychopharmacol 2006;21:99-103.
138. Kreinin A, Miodownik C, Libov I et al. Moclobemide treatment of clozapine-induced hypersalivation: pilot open study. Clin Neuropharmacol 2009;32:151-3.
139. Kahl KG, Hagenah J, Zapf S et al. Botulinum toxin as an effective treatment of clozapine-induced hypersalivation. Psychopharmacology 2004;173:229-30.
140. Steinlechner S, Klein C, Moser A et al. Botulinum toxin B as an effective and safe treatment for neuroleptic-induced sialorrhea. Psychopharmacology 2010;207:593-7.
141. Leucht S, Cipriani A, Spineli L et al. Comparative efficacy and tolerability of 15 antipsychotic drugs in schizophrenia: a multiple-treatments meta-analysis. Lancet 2013;382:951-62.
142. Masopust J, Maly R, Valis M. Risk of venous thromboembolism during treatment with antipsychotic agents. Psychiatry Clin Neurosci 2012;66:541-52.
143. Miller DD. Atypical antipsychotics: sleep, sedation, and efficacy. Prim Care Companion J Clin Psychiatry 2004;6(Suppl. 2):3-7.
144. Andrade C, Kisely S, Monteiro I et al. Antipsychotic augmentation with modafinil or armodafinil for negative symptoms of schizophrenia: systematic review and meta-analysis of randomized controlled trials. J Psychiatr Res 2015;60:14-21.
145. Burke M, Sebastian CS. Treatment of clozapine sedation. Am J Psychiatry 1993;150:1900-1.
146. Carpenter MD, Winsberg BG, Camus LA. Methylphenidate augmentation therapy in schizophrenia. J Clin Psychopharmacol 1992;12:273-5.
147. Szeszko PR, Bilder RM, Dunlop JA et al. Longitudinal assessment of methylphenidate effects on oral word production and symptoms in first-episode schizophrenia at acute and stabilized phases. Biol Psychiatry 1999;45:680-6.
148. Makela EH, Miller K, Cutlip WD 2nd. Three case reports of modafinil use in treating sedation induced by antipsychotic medications. J Clin Psychiatry 2003;64:485-6.
149. Saavedra-Velez C, Yusim A, Anbarasan D et al. Modafinil as an adjunctive treatment of sedation, negative symptoms, and cognition in schizophrenia: a critical review. J Clin Psychiatry 2009;70:104-12.
150. Freudenreich O, Henderson DC, Macklin EA et al. Modafinil for clozapine-treated schizophrenia patients: a double-blind, placebo-controlled pilot trial. J Clin Psychiatry 2009;70:1674-80.
151. Miller SC. Methylphenidate for clozapine sedation. Am J Psychiatry 1996;153:1231-2.
152. Saraf G, Viswanath B, Narayanaswamy JC et al. Modafinil for the treatment of antipsychotic-induced excessive daytime sedation: does it exacerbate tics? J Neuropsychiatry Clin Neurosci 2013;25:E35-6.
153. Chen CY, Lane HY, Lin CH. Effects of antipsychotics on bone mineral density in patients with schizophrenia: gender differences. Clin Psychopharmacol Neurosci 2016;14:238-49.
154. Kollin E, Gergely I, Szucs J et al. Decreased bone density in hyperprolactinemic women. N Engl J Med 1981;304:1362-3.
155. Gonzalez-Blanco L, Greenhalgh AM, Garcia-Rizo C et al. Prolactin concentrations in antipsychotic-naive patients with schizophrenia and related disorders: a meta-analysis. Schizophr Res 2016;174:156-60.
156. La Torre A, Conca A, Duffy D et al. Sexual dysfunction related to psychotropic drugs: a critical review part II: antipsychotics. Pharmacopsychiatry 2013;46:201-8.
157. de Boer MK, Castelein S, Bous J et al. The Antipsychotics and Sexual Functioning Questionnaire (ASFQ): preliminary evidence for reliability and validity. Schizophr Res 2013;150:410-5.
158. Compton MT, Miller AH. Antipsychotic-induced hyperprolactinemia and sexual dysfunction. Psychopharmacol Bull 2002;36:143-64.
159. Serretti A, Chiesa A. A meta-analysis of sexual dysfunction in psychiatric patients taking antipsychotics. Int Clin Psychopharmacol 2011;26:130-40.
160. Berner MM, Hagen M, Kriston L. Management of sexual dysfunction due to antipsychotic drug therapy. Cochrane Database Syst Rev 2007;1:CD003546.
161. Renn JH, Yang NP, Chueh CM et al. Bone mass in schizophrenia and normal populations across different decades of life. BMC Musculoskelet Disord 2009;10:1.
162. Stubbs B, De Hert M, Sepehry AA et al. A meta-analysis of prevalence estimates and moderators of low bone mass in people with schizophrenia. Acta Psychiatr Scand 2014;130:470-86.
163. Howard L, Kirkwood G, Leese M. Risk of hip fracture in patients with a history of schizophrenia. Br J Psychiatry 2007;190:129-34.
164. Lin CH, Lin CY, Huang TL et al. Sex-specific factors for bone density in patients with schizophrenia. Int Clin Psychopharmacol 2015;30:96-102.
165. Catala-Lopez F, Suarez-Pinilla M, Suarez-Pinilla P et al. Inverse and direct cancer comorbidity in people with central nervous system disorders: a meta-analysis of cancer incidence in 577,013 participants of 50 observational studies. Psychother Psychosom 2014;83:89-105.
166. De Hert M, Peuskens J, Sabbe T et al. Relationship between prolactin, breast cancer risk, and antipsychotics in patients with schizophrenia: a critical review. Acta Psychiatr Scand 2016;133:5-22.
167. Holt RI, Peveler RC. Antipsychotics and hyperprolactinaemia: mechanisms, consequences and management. Clin Endocrinol 2011;74:141-7.
168. Lehman AF, Lieberman JA, Dixon LB et al. Practice guideline for the treatment of patients with schizophrenia, second edition. Am J Psychiatry 2004;161:1-56.
169. Peveler RC, Branford D, Citrome L et al. Antipsychotics and hyperprolactinaemia: clinical recommendations. J Psychopharmacol 2008;22:98-103.
170. Hernandez CJ, Beaupre GS, Carter DR. A theoretical analysis of the relative influences of peak BMD, age-related bone loss and menopause on the development of osteoporosis. Osteoporos Int 2003;14:843-7.
171. Tworoger SS, Eliassen AH, Sluss P et al. A prospective study of plasma prolactin concentrations and risk of premenopausal and postmenopausal breast cancer. J Clin Oncol 2007;25:1482-8.
172. Kane JM, Correll CU, Goff DC et al. A multicenter, randomized, double-blind, placebo-controlled, 16-week study of adjunctive aripiprazole for schizophrenia or schizoaffective disorder inadequately treated with quetiapine or risperidone monotherapy. J Clin Psychiatry 2009;70:1348-57.
173. Chang SC, Chen CH, Lu ML. Cabergoline-induced psychotic exacerbation in schizophrenic patients. Gen Hosp Psychiatry 2008;30:
378-80.
174. Costa AM, Lima MS, Mari Jde J. A systematic review on clinical management of antipsychotic-induced sexual dysfunction in schizophrenia. Sao Paulo Med J 2006;124:291-7.
175. Gugger JJ. Antipsychotic pharmacotherapy and orthostatic hypotension: identification and management. CNS Drugs 2011;25:659-71.
176. Drici MD, Priori S. Cardiovascular risks of atypical antipsychotic drug treatment. Pharmacoepidemiol Drug Safety 2007;16:882-90.
177. Stroup TS, Lieberman JA, McEvoy JP et al. Results of phase 3 of the CATIE schizophrenia trial. Schizophr Res 2009;107:1-12.
178. Citrome L. Iloperidone for schizophrenia: a review of the efficacy and safety profile for this newly commercialised second-generation antipsychotic. Int J Clin Pract 2009;63:1237-48.
179. Leung JY, Barr AM, Procyshyn RM et al. Cardiovascular side-effects of antipsychotic drugs: the role of the autonomic nervous system. Pharmacol Ther 2012;135:113-22.
180. Freeman R. Current pharmacologic treatment for orthostatic hypotension. Clin Autonom Res 2008;18(Suppl. 1):14-8.
181. Figueroa JJ, Basford JR, Low PA. Preventing and treating orthostatic hypotension: as easy as A, B, C. Cleve Clin J Med 2010;77:298-306.
182. Testani M Jr. Clozapine-induced orthostatic hypotension treated with fludrocortisone. J Clin Psychiatry 1994;55:497-8.
183. Kurihara J, Takata Y, Suzuki S et al. Effect of midodrine on chlorpromazine-induced orthostatic hypotension in rabbits: comparison with amezinium, etilefrine and droxidopa. Biol Pharmaceut Bull 2000;23:1445-9.
184. Castrioto A, Tambasco N, Rossi A et al. Acute dystonia induced by the combination of midodrine and perphenazine. J Neurol 2008;255:767-8.
185. Takahashi H. Acute dystonia induced by adding midodrine, a selective alpha 1 agonist, to risperidone in a patient with catatonic schizophrenia. J Neuropsychiatry Clin Neurosci 2000;12:285-6.
186. Hou PY, Hung GC, Jhong JR et al. Risk factors for sudden cardiac death among patients with schizophrenia. Schizophr Res 2015;168:395-401.
187. Ray WA, Chung CP, Murray KT et al. Atypical antipsychotic drugs and the risk of sudden cardiac death. N Engl J Med 2009;360:225-35.
188. Straus SM, Bleumink GS, Dieleman JP et al. Antipsychotics and the risk of sudden cardiac death. Arch Int Med 2004;164:1293-7.
189. Wu CS, Tsai YT, Tsai HJ. Antipsychotic drugs and the risk of ventricular arrhythmia and/or sudden cardiac death: a nation-wide case-crossover study. J Am Heart Assoc 2015;4:e001568.
190. Mehtonen OP, Aranko K, Malkonen L et al. A survey of sudden death associated with the use of antipsychotic or antidepressant drugs: 49 cases in Finland. Acta Psychiatr Scand 1991;84:58-64.
191. Reilly JG, Ayis SA, Ferrier IN et al. Thioridazine and sudden unexplained death in psychiatric in-patients. Br J Psychiatry 2002;180:515-22.
192. Ray WA, Meredith S, Thapa PB et al. Antipsychotics and the risk of sudden cardiac death. Arch Gen Psychiatry 2001;58:1161-7.
193. Haddad PM, Anderson IM. Antipsychotic-related QTc prolongation, torsade de pointes and sudden death. Drugs 2002;62:1649-71.
194. Heist EK, Ruskin JN. Drug-induced proarrhythmia and use of QTc-prolonging agents: clues for clinicians. Heart Rhythm 2005;2:S1-8.
195. Schneeweiss S, Avorn J. Antipsychotic agents and sudden cardiac death – how should we manage the risk? N Engl J Med 2009;360:294-6.
196. Shah AA, Aftab A, Coverdale J. QTc prolongation with antipsychotics: is routine ECG monitoring recommended? J Psychiatr Pract 2014;20:196-206.
197. Lieberman JA, Merrill D, Parameswaran S. APA guidance on the use of antipsychotic drugs and cardiac sudden death. https://www.omh.ny.gov.
198. Kavanaugh G, Brown G, Khan I et al. Guidance on the use of antipsychotics, Version 3.2. London: National Health Service, 2015.
199. Pileggi DJ, Cook AM. Neuroleptic malignant syndrome. Ann Pharmacother 2016;50:973-81.
200. Trollor JN, Chen X, Chitty K et al. Comparison of neuroleptic malignant syndrome induced by first- and second-generation antipsychotics. Br J Psychiatry 2012;201:52-6.
201. Trollor JN, Chen X, Sachdev PS. Neuroleptic malignant syndrome associated with atypical antipsychotic drugs. CNS Drugs 2009;23:477-92.
202. Nielsen RE, Wallenstein Jensen SO, Nielsen J. Neuroleptic malignant syndrome – an 11-year longitudinal case-control study. Can J Psychiatry 2012;57:512-8.
203. Strawn JR, Keck PE Jr, Caroff SN. Neuroleptic malignant syndrome. Am J Psychiatry 2007;164:870-6.
204. Su YP, Chang CK, Hayes RD et al. Retrospective chart review on exposure to psychotropic medications associated with neuroleptic malignant syndrome. Acta Psychiatr Scand 2014;130:52-60.
205. Tse L, Barr AM, Scarapicchia V et al. Neuroleptic malignant syndrome: a review from a clinically oriented perspective. Curr Neuropharmacol 2015;13:395-406.
206. Lee JW. Serum iron in catatonia and neuroleptic malignant syndrome. Biol Psychiatry 1998;44:499-507.
207. Patil BS, Subramanyam AA, Singh SL et al. Low serum iron as a possible risk factor for neuroleptic malignant syndrome. Int J Appl Basic Med Res 2014;4:117-8.
208. Rosebush PI, Mazurek MF. Serum iron and neuroleptic malignant syndrome. Lancet 1991;338:149-51.
209. Patel AL, Shaikh WA, Khobragade AK et al. Electroconvulsive therapy in drug resistant neuroleptic malignant syndrome. J Assoc Physicians India 2008;56:49-50.
210. Caroff SN, Mann SC. Neuroleptic malignant syndrome. Med Clin North Am 1993;77:185-202.
211. Wells AJ, Sommi RW, Crismon ML. Neuroleptic rechallenge after neuroleptic malignant syndrome: case report and literature review. Drug Intell Clin Pharm 1988;22:475-80.
212. Rosebush PI, Stewart TD, Gelenberg AJ. Twenty neuroleptic rechallenges after neuroleptic malignant syndrome in 15 patients. J Clin Psychiatry 1989;50:295-8.
213. Trollor JN, Sachdev PS. Electroconvulsive treatment of neuroleptic malignant syndrome: a review and report of cases. Aust N Z J Psychiatry 1999;33:650-9.
214. Idänpään-Heikkilä J, Alhava E, Olkinuora M et al. Clozapine and agranulocytosis. Lancet 1975;306:611.
215. Alvir JM, Lieberman JA, Safferman AZ et al. Clozapine-induced agranulocytosis. Incidence and risk factors in the United States. N Engl J Med 1993;329:162-7.
216. Canoso RT, Lewis ME, Yunis EJ. Association of HLA-Bw44 with chlorpromazine-induced autoantibodies. Clin Immunol Immunopathol 1982;25:278-82.
217. Fiore JM, Francis MN. Agranulocytosis due to mepazine (phenothiazine): report of three cases. N Engl J Med 1959;260:375-8.
218. Goldman D. Agranulocytosis associated with administration of chlorpromazine: report of three cases with description of treatment and recovery. AMA Arch Int Med 1955;96:496.
219. Stergiou V, Bozikas VP, Garyfallos G et al. Olanzapine-induced leucopenia and neutropenia. Prog Neuropsychopharmacol Biol Psychiatry 2005;29:992-4.
220. Sluys M, Güzelcan Y, Casteelen G et al. Risperidone-induced leucopenia and neutropenia: a case report. Eur Psychiatry 2004;
19:117.
221. Munro J, O'Sullivan D, Andrews C et al. Active monitoring of 12,760 clozapine recipients in the UK and Ireland. Beyond pharmacovigilance. Br J Psychiatry 1999;175:576-80.
222. Sporn A, Gogtay N, Ortiz-Aguayo R et al. Clozapine-induced neutropenia in children: management with lithium carbonate. J Child Adolesc Psychopharmacol 2003;13:401-4.
223. Papetti F, Darcourt G, Giordana J-Y et al. Treatment of clozapine-induced granulocytopenia with lithium (two observations). Encéphale 2004;30:578-82.
224. Yadav D, Burton S, Sehgal C. Clozapine-induced neutropenia reversed by lithium. Prog Neurol Psychiatry 2016;20:13-5.
225. Nielsen H. Recombinant human granulocyte colony-stimulating factor (rhG-CSF; filgrastim) treatment of clozapine-induced agranulocytosis. J Int Med 1993;234:529-31.
226. Lamberti JS, Bellnier TJ, Schwarzkopf SB et al. Filgrastim treatment of three patients with clozapine-induced agranulocytosis. J Clin Psychiatry 1995;56:256-9.
227. Simon L, Cazard F. Clozapine rechallenge after neutropenia in resistant schizophrenia: a review. Encéphale 2016;42:346-53.
228. Gaboriau L, Victorri-Vigneau C, Gérardin M et al. Aripiprazole: a new risk factor for pathological gambling? A report of 8 case reports. Addict Behav 2014;39:562-5.
229. Smith N, Kitchenham N, Bowden-Jones H. Pathological gambling and the treatment of psychosis with aripiprazole: case reports.
Br J Psychiatry 2011;199:158-9.
230. Nirenberg MJ, Waters C. Compulsive eating and weight gain related to dopamine agonist use. Mov Disord 2006;21:524-9.
231. Claassen DO, van den Wildenberg WP, Ridderinkhof KR et al. The risky business of dopamine agonists in Parkinson disease and impulse control disorders. Behav Neurosci 2011;125:492-500.
232. Etminan M, Sodhi M, Samii A et al. Risk of gambling disorder and impulse control disorder with aripiprazole, pramipexole, and ropinirole: a pharmacoepidemiologic study. J Clin Psychopharmacol 2017;37:102-4.
233. Cheon E, Koo BH, Seo SS et al. Two cases of hypersexuality probably associated with aripiprazole. Psychiatry Invest 2013;10:200-2. [PMC free article]
234. Cohen J, Magalon D, Boyer L et al. Aripiprazole-induced pathological gambling: a report of 3 cases. Curr Drug Saf 2011;6:51-3.
235. Haas SJ, Hill R, Krum H et al. Clozapine-associated myocarditis: a review of 116 cases of suspected myocarditis associated with the use of clozapine in Australia during 1993-2003. Drug Saf 2007;30:47-57.
236. Ronaldson K, Fitzgerald P, Taylor A et al. Clinical course and analysis of ten fatal cases of clozapine-induced myocarditis and comparison with 66 surviving cases. Schizophr Res 2011;128:161-5.
237. Chopra N, de Leon J. Clozapine-induced myocarditis may be associated with rapid titration: a case report verified with autopsy. Int J Psychiatry Med 2016;51:104-15.
238. Youssef DL, Narayanan P, Gill N. Incidence and risk factors for clozapine-induced myocarditis and cardiomyopathy at a regional mental health service in Australia. Australas Psychiatry 2016;24:176-80.
239. Freudenreich O. Clozapine-induced myocarditis: prescribe safely but do prescribe. Acta Psychiatr Scand 2015;132:240-1.
240. Ellis PM, Cameron CR. Clozapine-induced myocarditis and baseline echocardiograms. Aust N Z J Psychiatry 2012;46:1005-6.
241. Ittasakul P, Archer A, Kezman J et al. Rapid re-challenge with clozapine following pronounced myocarditis in a treatment-resistance schizophrenia patient. Clin Schizophr Relat Psychoses 2013;10:120-2.
242. Ganguli R. Behavioral therapy for weight loss in patients with schizophrenia. J Clin Psychiatry 2007;68(Suppl. 4):19-25.
243. Daumit GL, Dickerson FB, Wang NY et al. A behavioral weight-loss intervention in persons with serious mental illness. N Engl J Med 2013;368:1594-602.
244. Bartels SJ, Pratt SI, Aschbrenner KA et al. Pragmatic replication trial of health promotion coaching for obesity in serious mental illness and maintenance of outcomes. Am J Psychiatry 2015;172:344-52.
245. Green CA, Yarborough BJ, Leo MC et al. The STRIDE weight loss and lifestyle intervention for individuals taking antipsychotic medications: a randomized trial. Am J Psychiatry 2015;172:71-81.
246. Wu RR, Zhao JP, Guo XF et al. Metformin addition attenuates olanzapine-induced weight gain in drug-naive first-episode schizophrenia patients: a double-blind, placebo-controlled study. Am J Psychiatry 2008;165:352-8.
247. Wu RR, Zhao JP, Jin H et al. Lifestyle intervention and metformin for treatment of antipsychotic induced weight gain: a randomized controlled trial. JAMA 2008;299:185-93.
248. Jarskog LF, Hamer RM, Catellier DJ et al. Metformin for weight loss and metabolic control in overweight outpatients with schizophrenia and schizoaffective disorder. Am J Psychiatry 2013;170: 1032-40.
249. Baptista T, Rangel N, Fernández V et al. Metformin as an adjunctive treatment to control body weight and metabolic dysfunction during olanzapine administration: a multicentric, double-blind, placebo-controlled trial. Schizophr Res 2007;93:99-108.
250. Tek C, Ratliff J, Reutenauer E et al. A randomized, double-blind, placebo-controlled pilot study of naltrexone to counteract antipsychotic-associated weight gain: proof of concept. J Clin Psychopharmacol 2014;34:608-12.
251. Lieberman JA 3rd. Managing anticholinergic side effects. Prim Care Companion J Clin Psychiatry 2004;6(Suppl. 2):20-3.
252. Nielsen J, Meyer JM. Risk factors for ileus in patients with schizophrenia. Schizophr Bull 2012;38:592-8.
253. Every-Palmer S, Ellis PM. Clozapine-induced gastrointestinal hypomotility: a 22-year bi-national pharmacovigilance study of serious or fatal ‘slow gut’ reactions, and comparison with international drug safety advice. CNS Drugs 2017;31:699-709.
254. Hayat U, Dugum M, Garg S. Chronic constipation: update on management. Cleve Clin J Med 2017;84:397-408.
255. Lieberman JA, Stroup TS, McEvoy JP et al. Effectiveness of antipsychotic drugs in patients with chronic schizophrenia. N Engl J Med 2005;353:1209-23.


