Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№01 2013
Факторы риска фармакогенной прибавки веса у пациентов с аффективным расстройством №01 2013
Номера страниц в выпуске:15-20
При изучении фармакогенной прибавки веса выделены 4 кластера рисков – структура депрессии, гормональные показатели, показатели липидного спектра, наличие избыточного веса или ожирения. Полученные результаты могут способствовать предотвращению развития сердечно-сосудистых заболеваний и связанных с ними осложнений.
Резюме. При изучении фармакогенной прибавки веса выделены 4 кластера рисков – структура депрессии, гормональные показатели, показатели липидного спектра, наличие избыточного веса или ожирения. Полученные результаты могут способствовать предотвращению развития сердечно-сосудистых заболеваний и связанных с ними осложнений.
Ключевые слова: фармакогенная прибавка веса, сердечно-сосудистые заболевания, липидный спектр, ожирение.
Risk factors for pharmacogenic weight gain in patients with mood disorders
G.E.Mazo1,2, T.M.Shmaneva1, N.A.Sokolayn1
1St.-Petersburg Psychoneurological Research Institute named V.M.Bekhterev
2St.-Petersburg State University
Summary. Pharmacogenic weight gain was studied in this article. In order to prevent this side effect of treatment four risk clusters such as structure of depression, some of hormones, lipid spectrum and presence of overweight or obesity were taken into consideration. This data can help to prevent cardiovascular diseases or decrease the probability of complications.
Key words: pharmacogenic weight gain, cardiovascular diseases, obesity, lipid spectrum.
Введение
При решении проблем эффективного использования психотропных средств и дифференцированного подхода к их назначению необходимо учитывать побочные эффекты лечения и связанные с ними возможные осложнения. При этом особого внимания заслуживает вопрос профилактики развития сердечно-сосудистых заболеваний у пациентов с депрессивным расстройством.
В течение последних 10 лет в научной литературе рассматривается вопрос о связи сердечно-сосудистых заболеваний с расстройствами настроения, и в первую очередь с депрессией (S.Williams и соавт., 2002; Н.Г.Незнанов, Е.В.Шляхто и соавт., 2009; А.Б.Смулевич, 2011; С.Н.Козлова, Е.В.Шляхто, А.В.Голубев и соавт., 2011). Косвенно о связи депрессии и сосудистых заболеваний могут свидетельствовать данные о высокой распространенности у пациентов с аффективными нарушениями метаболического синдрома, который относят к факторам риска развития сердечной патологии. Если в общей популяции частота метаболического синдрома составляет 13–15%, то среди пациентов с депрессивными расстройствами значение этого показателя достигает 36–58% (L.Kinder и соавт., 2004; T.Heiskanen и соавт., 2006; K.Räikkönen и соавт., 2002; H.Tuula и соавт., 2006).
С позиций менеджмента побочные эффекты, сопровождающие терапию депрессий, относятся к группе факторов, которые допустимо анализировать с точки зрения управления рисками. Отсюда вытекает необходимость выделения показателей, которые, с одной стороны, могут являться предикторами развития рисков, а с другой, при эффективном контроле и минимизации – способствовать снижению риска побочных эффектов и осложнений.
Для эффективного терапевтического менеджмента депрессии в качестве фактора риска развития сердечно-сосудистых заболеваний мы предлагаем рассматривать фармакогенную прибавку веса (ФПВ). Выделение этого параметра может быть обосновано следующими аргументами:
• показатели, характеризующие ожирение (прежде всего абдоминальную форму), обязательный компонент метаболического синдрома, рассматривают в ряду факторов риска развития сердечно-сосудистых заболеваний (Консенсус группы организаций…, 2007);
Цель исследования – анализ рисков развития ФПВ у пациентов с депрессивными состояниями.
В исследование были включены 89 пациентов, проходящих лечение в отделении биологической терапии психически больных НИПНИ им. В.М.Бехтерева. Критерии включения: возраст от 18 до 60 лет, наличие актуальной депрессивной симптоматики в рамках диагностических критериев Международной классификации болезней 10-го пересмотра (МКБ-10) для аффективных расстройств.
В исследование не включались пациенты с тяжелой соматической патологией (включая диабет в стадии декомпенсации), а также женщины, принимающие комбинированные оральные контрацептивы или гормонозаместительную терапию в период постменопаузы.
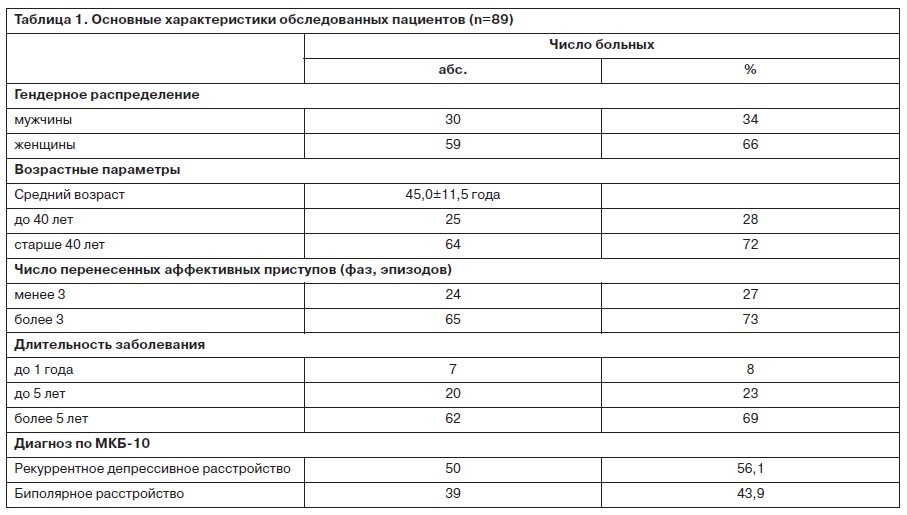
Все пациенты в течение 6 нед получали антидепрессивную терапию, соответствующую современным стандартам лечения депрессий. Основные характеристики пациентов изученной выборки приведены в табл. 1.
Наряду с психопатологическим обследованием использовались психометрические методики: динамика депрессии в процессе терапии оценивалась по шкале HDRS-17 (M.Hamilton, 1959), пищевое поведение измерялось с помощью соответствующего опросника (Dutch Eating Behaviour Questionnaire – DEBQ)1 (Т. van Strien и соавт., 1986). Использовались также антропометрический и лабораторные методы обследования: оценивались показатели тиреоидной оси (тиреотропный гормон – ТТГ, Т3 свободный, Т4 свободный), половой оси (тестостерон у мужчин, эстрадиол – Е2 у женщин), определялись уровни лептина, инсулина, аполипопротеинов А (апо-А), аполипопротеинов В (апо-B), липидограмма.
Результаты исследования
Традиционно ФПВ определяется как увеличение массы тела в процессе проведения фармакотерапии на 5% от исходной (D.Allison и соавт., 1999). Именно такая прибавка веса может ухудшить метаболические показатели и свидетельствовать о повышении риска развития сердечно-сосудистых заболеваний и сахарного диабета типа 2. Соответственно, несмотря на отсутствие в доступной литературе указаний на методики оценки ФПВ при депрессии, в настоящем исследовании это нарушение регистрировалось при увеличении веса на 5% сравнительно с массой тела до развития депрессивного состояния.
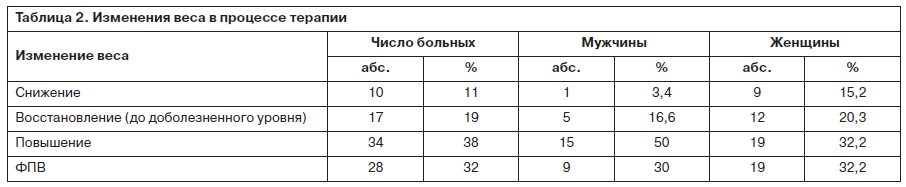
Данные об изменении веса обследованных в процессе 6-недельной стандартной терапии приведены в табл. 2, из которых следует, что ФПВ выявлена у 32% пациентов, причем с одинаковой частотой у мужчин и женщин.
С тем чтобы оценить влияние методики терапии на риски развития ФПВ, пациенты изученной выборки были разделены на 3 группы. Первая группа – 45 пациентов, получавших монотерапию антидепрессантами (СИОЗС или СИОЗСН), 2-я группа – 19 пациентов, которым проводилось комбинированное лечение с использованием антидепрессантов в сочетании с метаболически нейтральными препаратами; к 3-й группе отнесены пациенты (25 наблюдений), у которых антидепрессанты комбинировались с оланзапином, имеющим метаболически негативный спектр (E.Koller и соавт., 2001, 2002; J.Newcomer и соавт., 2004).
При использовании монотерапии антидепрессантами (1-я группа) ФПВ регистрировалась достаточно редко (2% пациентов). Значимо чаще (р<0,001) ФПВ выявлялась при использовании комбинированной терапии – у 10% пациентов 2-й группы и у 19% – 3-й группы. При этом статистически достоверных различий при сравнении двух методик комбинированной терапии (антидепрессант + метаболически нейтральный препарат или антидепрессант + метаболически негативный антипсихотик оланзапин) не получено (р>0,05). Этот факт, возможно, связан с малыми дозами оланзапина (не выше 7,5 мг/сут), применявшегося в изученных случаях (пациенты 3-й группы), а его влияние на массу тела является дозозависимым побочным эффектом (Л.Н.Горобец, 2008).
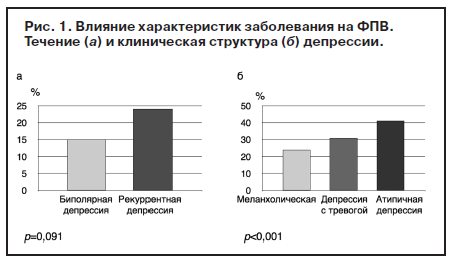 На рис. 1 графически представлены данные о влиянии таких характеристик заболевания, как полярность аффекта и структура депрессии на развитие ФПВ.
На рис. 1 графически представлены данные о влиянии таких характеристик заболевания, как полярность аффекта и структура депрессии на развитие ФПВ.
Из рис. 1, а, видно, что при биполярном течении ФПВ зарегистрирована у 10% пациентов, при рекуррентном – у 21% (р=0,091). Если в пределах этого соотношения различия недостоверны, то при анализе влияния клинической структуры депрессивного состояния на риск развития ФПВ выявляются следующие зависимости. При атипичной депрессии, как это показано на рис. 1, а, ФПВ развивается с высокой степенью статистической достоверности (р<0,001) чаще (43% случаев), чем при меланхолической депрессии (25%) и при депрессии с тревогой (32%).
Установленная при атипичной депрессии склонность к формированию метаболических нарушений полностью соотносится с психопатологической характеристикой гипотимических состояний этого типа, при которых наблюдаются реверсивные (обратные по отношению к соматическому симптомокомплексу классической меланхолии, протекающей с депрессивной анорексией) вегетативные симптомы: повышение аппетита и потребности в богатой углеводами пище.
Алиментарный фактор – один из основных показателей, который определяет риски развития ожирения (А.В.Аныкина, 2008; J.Swinbourne и соавт., 2007; A.Giannini, 1993), может играть важную роль и в развитии ФПВ. Известно, что у пациентов с депрессивными нарушениями нередко выявляются нарушения пищевого поведения (S.Park и соавт., 1999). В настоящем исследовании рассмотрена связь нарушений пищевого поведения с риском развития ФПВ. С помощью психометрических методик (Dutch Eating Behaviour Questionnaire – DEBQ) показано, что 84,2% пациентов изучаемой группы имели нарушения пищевого поведения. Причем при ограничительном типе пищевого поведения ФПВ развивалась только в 7% случаев; чаще ФПВ регистрировалась при переедании – как эмоциогенном (54%), так и экстернальном (25,1%). У пациентов со смешанным типом пищевого поведения (сочетание эпизодов переедания с ограничительной диетой) частота развития ФПВ составила 25%.
Предпринятый в настоящем исследовании анализ соотношения ФПВ с ответом на терапию связан с неоднозначностью представлений о результатах лечения у пациентов с депрессией. С одной стороны, существует точка зрения о хорошем ответе на антидепрессивную терапию у пациентов, быстро набирающих массу тела, а с другой – приводятся данные, свидетельствующие о терапевтической резистентности пациентов с ИМТ (S.Kloiber, M.Ising, S.Reppermund и соавт., 2007). Динамика баллов по HDRS-17 позволила выделить 3 группы:
 Влияние биохимических и гормональных показателей на риски развития ФПВ оценивалось с помощью корреляционного анализа (использовался коэффициент корреляции Спирмена, т.е. учитывались результаты со степенью достоверности не ниже 95%; p<0,05). Точное вычисление различий долей (процентов) производилось по f* – критерию углового преобразования Фишера. На основе общего массива показателей, имеющих статистическую значимость, была построена модель основных факторов риска, влияющих на развитие ФПВ (рис. 3). Выделено 4 кластера нарушений, от которых зависит уровень повышения веса в процессе проведения антидепрессивной терапии.
Влияние биохимических и гормональных показателей на риски развития ФПВ оценивалось с помощью корреляционного анализа (использовался коэффициент корреляции Спирмена, т.е. учитывались результаты со степенью достоверности не ниже 95%; p<0,05). Точное вычисление различий долей (процентов) производилось по f* – критерию углового преобразования Фишера. На основе общего массива показателей, имеющих статистическую значимость, была построена модель основных факторов риска, влияющих на развитие ФПВ (рис. 3). Выделено 4 кластера нарушений, от которых зависит уровень повышения веса в процессе проведения антидепрессивной терапии.
В рамках кластера I, объединяющего депрессии по клинической структуре, выделена атипичная депрессия, при которой может реализоваться наибольший риск развития ФПВ (f* 3,01; p<0,01). Кластер II – это уже существующие метаболические нарушения (ИМТ –
f* 2,22; p<0,05 и абдоминальный тип ожирения – f* 3,96; p<0,01), которые характеризуют уязвимость этой группы пациентов к дальнейшему нарастанию массы тела в условиях применения психофармакотерапии. Кластер III представлен гормональными нарушениями, отражающими «задействованность» тиреоидной и половой осей, а также уровня инсулина. Кластер IV характеризует состояние липидного обмена: ФПВ зависит от уровня липопротеинов низкой плотности – ЛПНП (r 0,46; p<0,05), а также от отношения аполипопротеинов В/А
(r 0,41; p<0,05) и коэффициента атерогенности (r 0,41; p<0,05).
Исследование показало, что диапазон изменения массы тела в процессе терапии достаточно широк и подвержен влиянию индивидуальных особенностей пациентов: эндокринных и метаболических показателей, клинической структуры депрессии.
В ходе исследования выдвинуто предположение о существовании у части депрессивных пациентов уязвимости к формированию обменных нарушений, реализующейся при воздействии психофармакотерапии как провоцирующего фактора.
В настоящем исследовании получены данные, свидетельствующие о роли половых гормонов в риске развития ФПВ. Они касаются снижения уровня тестостерона у мужчин (t 3,14; p<0,05). Результаты определения уровня эстрадиола у женщин, несмотря на более низкие значения в группе больных с ФПВ, не достигали статистически значимых различий (t 1,18; p>0,05). Возможно, это было связано с широким разбросом показателей данного гормона в зависимости от фазы менструального цикла у женщин до менопаузы и в постменопаузальном периоде. В литературе описана связь метаболических нарушений с проявлениями гипогонадизма. Известно, что у мужчин дефицит андрогенов способствует увеличению количества жировой ткани (В.В.Долгов и соавт., 2006), а снижение уровня эстрогенов у женщин провоцирует развитие абдоминального ожирения, артериальной гипертензии, дислипидемий. Этот фактор настолько весом, что часто говорят о «менопаузальном метаболическом синдроме» (Проект рекомендаций экспертов…, 2009). Однако снижение уровня половых гормонов может определяться не только возрастным гипогонадизмом, но и быть результатом применения препаратов, имеющих пролактинстимулирующую активность. Известно, что повышение уровня пролактина способствует уменьшению выработки половых стероидов (T.Baptista и соавт., 1999; М.Я.Ладыженский и соавт., 2008).
Полученные данные свидетельствуют и о влиянии тиреоидной оси на формирование ФПВ. Повышение уровня ТТГ в процессе терапии (t 4,58; p<0,01) может указывать на развитие субклинических форм гипотиреоза, одно из клинических проявлений которого – повышение массы тела. Имеются убедительные данные, утверждающие, что патология щитовидной железы у пациентов с аффективным расстройством встречается чаще, чем в общей популяции (H.Leigh, S.Kramer, 1984; K.Fountoulakis, A.Iacovides, P.Grammaticos и соавт., 2004). Кроме того, необходимо учитывать и влияние антидепрессантов на уровень тиреоидных гормонов. Так, анализ 12 исследований различных антидепрессантов показал, что 10 из них свидетельствуют о снижении функционирования щитовидной железы в процессе терапии (O.Abulseoud, N.Sane, A.Cozzolino и соавт., 2007).
Важное практическое значение имеют полученные нами данные об уровне аполипопротеинов как одном из факторов риска развития ФПВ. Известно, что апо-А является основным белком липопротеинов высокой плотности – ЛПВП, апо-В – ЛПНП. Поэтому определение апо-А и апо-В дает более точную информацию о содержании соответствующих липопротеинов, чем их определение по концентрации холестерина. В отличие от концентраций холестерина и триглицеридов, которые в значительной степени зависят от факторов среды (диета, образ жизни, физиологическое состояние организма), уровни апо-А и апо-В, а особенно их соотношение, находятся под генетическим контролем, являются более стабильными. Исследования взаимосвязей между содержанием аполипопротеинов и наличием атеросклероза выявило обратную для апо-А и прямую для апо-В корреляцию между уровнем этих аполипопротеинов и риском развития коронарного атеросклероза (J.Stengard и соавт., 2005; P.Talmud и соавт., 2002; W.Wong и соавт., 2003).
В проведенном нами исследовании выявлена взаимосвязь развития ФПВ с уровнем отношения апо-В к апо-А (r 0,41; p<0,05). Учитывая, что данные показатели позволяют комплексно подойти к оценке темпов развития атеросклероза и рисков развития сердечно-сосудистых заболеваний, можно утверждать, что пациенты с высоким риском развития сердечно-сосудистой патологии (о чем свидетельствует и коэффициент атерогенности – r 0,41; p<0,05) имеют большую тропность к формированию ФПВ в условиях использования психотропных препаратов. Таким образом, пациенты, уже находящиеся в группе риска по развитию сердечно-сосудистых заболеваний, наиболее уязвимы к развитию ФПВ, которая может способствовать ухудшению их соматического состояния.
Эффективный терапевтический менеджмент пациентов с депрессией требует разработки профилактических мероприятий, нацеленных на выявление и минимизацию риска ФПВ и, соответственно, снижение осложнений психофармакотерапии. С этой целью необходимо всесторонне обследовать пациента до назначения антидепрессивной терапии, но стандарты скрининга и мониторинга лабораторных показателей, нацеливающих врача на особое внимание к соматическому состоянию пациента и на выбор назначаемых ему препаратов, в настоящее время отсутствуют. В этом случае ФПВ можно рассматривать как «индикатор», который свидетельствует о возможном нарастании соматического неблагополучия.
В то же время это показатель, на который можно оказывать влияние с помощью замены применяемых антидепрессантов на метаболически нейтральные. Повышение массы тела зависит от характера питания и образа жизни. Именно поэтому очевидна необходимость разработки психообразовательных программ, которые должны включать задачи формирования здорового рациона питания (адекватного по калорийности и количеству овощей и фруктов) и привлечения к спортивным занятиям (включая период пребывания в стационаре). Внедрение такого подхода в повседневную врачебную практику при терапии депрессии будет способствовать минимизации рисков не только собственно ФПВ, но и сердечно-сосудистых заболеваний у пациентов с депрессивным расстройством.
Сведения об авторах
Мазо Галина Элевна – д-р мед. наук, вед. науч. сотр. группы эндокринологической психиатрии СПб НИПНИ им. В.М.Бехтерева, проф. каф. психиатрии СПбГУ. E-mail: Galina-mazo@yandex.ru
Шманева Татьяна Михайловна – мл. науч. сотр. группы эндокринологической психиатрии СПб НИПНИ им. В.М.Бехтерева. E-mail: Tatyana-shmaneva@yandex.ru
Соколян Нина Агвановна – канд. биол. наук, ст. науч. сотр. клинико-диагностической лаборатории СПб НИПНИ им. В.М.Бехтерева
Ключевые слова: фармакогенная прибавка веса, сердечно-сосудистые заболевания, липидный спектр, ожирение.
Risk factors for pharmacogenic weight gain in patients with mood disorders
G.E.Mazo1,2, T.M.Shmaneva1, N.A.Sokolayn1
1St.-Petersburg Psychoneurological Research Institute named V.M.Bekhterev
2St.-Petersburg State University
Summary. Pharmacogenic weight gain was studied in this article. In order to prevent this side effect of treatment four risk clusters such as structure of depression, some of hormones, lipid spectrum and presence of overweight or obesity were taken into consideration. This data can help to prevent cardiovascular diseases or decrease the probability of complications.
Key words: pharmacogenic weight gain, cardiovascular diseases, obesity, lipid spectrum.
Введение
При решении проблем эффективного использования психотропных средств и дифференцированного подхода к их назначению необходимо учитывать побочные эффекты лечения и связанные с ними возможные осложнения. При этом особого внимания заслуживает вопрос профилактики развития сердечно-сосудистых заболеваний у пациентов с депрессивным расстройством.
В течение последних 10 лет в научной литературе рассматривается вопрос о связи сердечно-сосудистых заболеваний с расстройствами настроения, и в первую очередь с депрессией (S.Williams и соавт., 2002; Н.Г.Незнанов, Е.В.Шляхто и соавт., 2009; А.Б.Смулевич, 2011; С.Н.Козлова, Е.В.Шляхто, А.В.Голубев и соавт., 2011). Косвенно о связи депрессии и сосудистых заболеваний могут свидетельствовать данные о высокой распространенности у пациентов с аффективными нарушениями метаболического синдрома, который относят к факторам риска развития сердечной патологии. Если в общей популяции частота метаболического синдрома составляет 13–15%, то среди пациентов с депрессивными расстройствами значение этого показателя достигает 36–58% (L.Kinder и соавт., 2004; T.Heiskanen и соавт., 2006; K.Räikkönen и соавт., 2002; H.Tuula и соавт., 2006).
С позиций менеджмента побочные эффекты, сопровождающие терапию депрессий, относятся к группе факторов, которые допустимо анализировать с точки зрения управления рисками. Отсюда вытекает необходимость выделения показателей, которые, с одной стороны, могут являться предикторами развития рисков, а с другой, при эффективном контроле и минимизации – способствовать снижению риска побочных эффектов и осложнений.
Для эффективного терапевтического менеджмента депрессии в качестве фактора риска развития сердечно-сосудистых заболеваний мы предлагаем рассматривать фармакогенную прибавку веса (ФПВ). Выделение этого параметра может быть обосновано следующими аргументами:
• показатели, характеризующие ожирение (прежде всего абдоминальную форму), обязательный компонент метаболического синдрома, рассматривают в ряду факторов риска развития сердечно-сосудистых заболеваний (Консенсус группы организаций…, 2007);
• нарастание массы тела – показатель, влекущий за собой развитие других компонентов метаболического синдрома (нарушений углеводного и липидного обмена) и, следовательно, определяющий риски формирования сердечно-сосудистых заболеваний и сахарного диабета типа 2 (A.Folsom и соавт., 2000; C.Ardern и соавт., 2003);Своевременное выявление ФПВ и адекватная коррекция терапевтической тактики, способствующая минимизации рисков развития метаболического синдрома, а следовательно, развития сердечно-сосудистых заболеваний, представляется актуальным направлением научного поиска.
• на ранних стадиях метаболический синдром является потенциально обратимым состоянием, и при соответствующем лечении можно добиться исчезновения или уменьшения выраженности его основных проявлений (И.Е.Чазова, 2004);
• изучение особенностей формирования ФПВ у пациентов с аффективными расстройствами определяется участием в патогенезе депрессии эндокринных нарушений (В.Weber-Hamann и соавт., 2005; B.Weber-Hamann и соавт., 2006; N.Vogelzangs и соавт., 2007), которые могут способствовать большей уязвимости пациентов к увеличению веса и ее последствий;
• современные средства психофармакотерапии, применяемые при лечении пациентов с аффективными расстройствами, в зависимости от используемого препарата (или комбинации препаратов) различаются по признаку влияния на вес. Если трициклические антидепрессанты – препараты, использование которых влечет увеличение веса, то селективные ингибиторы обратного захвата серотонина (СИОЗС) практически не оказывают влияния на этот показатель(B.Weber-Hamann, 2006).
Цель исследования – анализ рисков развития ФПВ у пациентов с депрессивными состояниями.
В исследование были включены 89 пациентов, проходящих лечение в отделении биологической терапии психически больных НИПНИ им. В.М.Бехтерева. Критерии включения: возраст от 18 до 60 лет, наличие актуальной депрессивной симптоматики в рамках диагностических критериев Международной классификации болезней 10-го пересмотра (МКБ-10) для аффективных расстройств.
В исследование не включались пациенты с тяжелой соматической патологией (включая диабет в стадии декомпенсации), а также женщины, принимающие комбинированные оральные контрацептивы или гормонозаместительную терапию в период постменопаузы.
Все пациенты в течение 6 нед получали антидепрессивную терапию, соответствующую современным стандартам лечения депрессий. Основные характеристики пациентов изученной выборки приведены в табл. 1.
Наряду с психопатологическим обследованием использовались психометрические методики: динамика депрессии в процессе терапии оценивалась по шкале HDRS-17 (M.Hamilton, 1959), пищевое поведение измерялось с помощью соответствующего опросника (Dutch Eating Behaviour Questionnaire – DEBQ)1 (Т. van Strien и соавт., 1986). Использовались также антропометрический и лабораторные методы обследования: оценивались показатели тиреоидной оси (тиреотропный гормон – ТТГ, Т3 свободный, Т4 свободный), половой оси (тестостерон у мужчин, эстрадиол – Е2 у женщин), определялись уровни лептина, инсулина, аполипопротеинов А (апо-А), аполипопротеинов В (апо-B), липидограмма.

Результаты исследования
Традиционно ФПВ определяется как увеличение массы тела в процессе проведения фармакотерапии на 5% от исходной (D.Allison и соавт., 1999). Именно такая прибавка веса может ухудшить метаболические показатели и свидетельствовать о повышении риска развития сердечно-сосудистых заболеваний и сахарного диабета типа 2. Соответственно, несмотря на отсутствие в доступной литературе указаний на методики оценки ФПВ при депрессии, в настоящем исследовании это нарушение регистрировалось при увеличении веса на 5% сравнительно с массой тела до развития депрессивного состояния.
Данные об изменении веса обследованных в процессе 6-недельной стандартной терапии приведены в табл. 2, из которых следует, что ФПВ выявлена у 32% пациентов, причем с одинаковой частотой у мужчин и женщин.

С тем чтобы оценить влияние методики терапии на риски развития ФПВ, пациенты изученной выборки были разделены на 3 группы. Первая группа – 45 пациентов, получавших монотерапию антидепрессантами (СИОЗС или СИОЗСН), 2-я группа – 19 пациентов, которым проводилось комбинированное лечение с использованием антидепрессантов в сочетании с метаболически нейтральными препаратами; к 3-й группе отнесены пациенты (25 наблюдений), у которых антидепрессанты комбинировались с оланзапином, имеющим метаболически негативный спектр (E.Koller и соавт., 2001, 2002; J.Newcomer и соавт., 2004).
При использовании монотерапии антидепрессантами (1-я группа) ФПВ регистрировалась достаточно редко (2% пациентов). Значимо чаще (р<0,001) ФПВ выявлялась при использовании комбинированной терапии – у 10% пациентов 2-й группы и у 19% – 3-й группы. При этом статистически достоверных различий при сравнении двух методик комбинированной терапии (антидепрессант + метаболически нейтральный препарат или антидепрессант + метаболически негативный антипсихотик оланзапин) не получено (р>0,05). Этот факт, возможно, связан с малыми дозами оланзапина (не выше 7,5 мг/сут), применявшегося в изученных случаях (пациенты 3-й группы), а его влияние на массу тела является дозозависимым побочным эффектом (Л.Н.Горобец, 2008).
 На рис. 1 графически представлены данные о влиянии таких характеристик заболевания, как полярность аффекта и структура депрессии на развитие ФПВ.
На рис. 1 графически представлены данные о влиянии таких характеристик заболевания, как полярность аффекта и структура депрессии на развитие ФПВ.
Из рис. 1, а, видно, что при биполярном течении ФПВ зарегистрирована у 10% пациентов, при рекуррентном – у 21% (р=0,091). Если в пределах этого соотношения различия недостоверны, то при анализе влияния клинической структуры депрессивного состояния на риск развития ФПВ выявляются следующие зависимости. При атипичной депрессии, как это показано на рис. 1, а, ФПВ развивается с высокой степенью статистической достоверности (р<0,001) чаще (43% случаев), чем при меланхолической депрессии (25%) и при депрессии с тревогой (32%).
Установленная при атипичной депрессии склонность к формированию метаболических нарушений полностью соотносится с психопатологической характеристикой гипотимических состояний этого типа, при которых наблюдаются реверсивные (обратные по отношению к соматическому симптомокомплексу классической меланхолии, протекающей с депрессивной анорексией) вегетативные симптомы: повышение аппетита и потребности в богатой углеводами пище.
Алиментарный фактор – один из основных показателей, который определяет риски развития ожирения (А.В.Аныкина, 2008; J.Swinbourne и соавт., 2007; A.Giannini, 1993), может играть важную роль и в развитии ФПВ. Известно, что у пациентов с депрессивными нарушениями нередко выявляются нарушения пищевого поведения (S.Park и соавт., 1999). В настоящем исследовании рассмотрена связь нарушений пищевого поведения с риском развития ФПВ. С помощью психометрических методик (Dutch Eating Behaviour Questionnaire – DEBQ) показано, что 84,2% пациентов изучаемой группы имели нарушения пищевого поведения. Причем при ограничительном типе пищевого поведения ФПВ развивалась только в 7% случаев; чаще ФПВ регистрировалась при переедании – как эмоциогенном (54%), так и экстернальном (25,1%). У пациентов со смешанным типом пищевого поведения (сочетание эпизодов переедания с ограничительной диетой) частота развития ФПВ составила 25%.
Предпринятый в настоящем исследовании анализ соотношения ФПВ с ответом на терапию связан с неоднозначностью представлений о результатах лечения у пациентов с депрессией. С одной стороны, существует точка зрения о хорошем ответе на антидепрессивную терапию у пациентов, быстро набирающих массу тела, а с другой – приводятся данные, свидетельствующие о терапевтической резистентности пациентов с ИМТ (S.Kloiber, M.Ising, S.Reppermund и соавт., 2007). Динамика баллов по HDRS-17 позволила выделить 3 группы:
1-я – пациенты, достигшие ремиссии (HDRS-17 менее 7 баллов на момент окончания курса лечения; 22,4%);
2-я – респондеры (снижение рейтинга HDRS-17≥50%; 39,3%); 3-я – нонреспондеры (38,2%). Как видно из рис. 2, ФПВ практически с одинаковой частотой регистрируются во всех 3 группах, т.е. как у пациентов с положительным ответом на терапию, так и резистентных к лечению.
 Влияние биохимических и гормональных показателей на риски развития ФПВ оценивалось с помощью корреляционного анализа (использовался коэффициент корреляции Спирмена, т.е. учитывались результаты со степенью достоверности не ниже 95%; p<0,05). Точное вычисление различий долей (процентов) производилось по f* – критерию углового преобразования Фишера. На основе общего массива показателей, имеющих статистическую значимость, была построена модель основных факторов риска, влияющих на развитие ФПВ (рис. 3). Выделено 4 кластера нарушений, от которых зависит уровень повышения веса в процессе проведения антидепрессивной терапии.
Влияние биохимических и гормональных показателей на риски развития ФПВ оценивалось с помощью корреляционного анализа (использовался коэффициент корреляции Спирмена, т.е. учитывались результаты со степенью достоверности не ниже 95%; p<0,05). Точное вычисление различий долей (процентов) производилось по f* – критерию углового преобразования Фишера. На основе общего массива показателей, имеющих статистическую значимость, была построена модель основных факторов риска, влияющих на развитие ФПВ (рис. 3). Выделено 4 кластера нарушений, от которых зависит уровень повышения веса в процессе проведения антидепрессивной терапии.
В рамках кластера I, объединяющего депрессии по клинической структуре, выделена атипичная депрессия, при которой может реализоваться наибольший риск развития ФПВ (f* 3,01; p<0,01). Кластер II – это уже существующие метаболические нарушения (ИМТ –
f* 2,22; p<0,05 и абдоминальный тип ожирения – f* 3,96; p<0,01), которые характеризуют уязвимость этой группы пациентов к дальнейшему нарастанию массы тела в условиях применения психофармакотерапии. Кластер III представлен гормональными нарушениями, отражающими «задействованность» тиреоидной и половой осей, а также уровня инсулина. Кластер IV характеризует состояние липидного обмена: ФПВ зависит от уровня липопротеинов низкой плотности – ЛПНП (r 0,46; p<0,05), а также от отношения аполипопротеинов В/А
(r 0,41; p<0,05) и коэффициента атерогенности (r 0,41; p<0,05).
Исследование показало, что диапазон изменения массы тела в процессе терапии достаточно широк и подвержен влиянию индивидуальных особенностей пациентов: эндокринных и метаболических показателей, клинической структуры депрессии.
В ходе исследования выдвинуто предположение о существовании у части депрессивных пациентов уязвимости к формированию обменных нарушений, реализующейся при воздействии психофармакотерапии как провоцирующего фактора.
В настоящем исследовании получены данные, свидетельствующие о роли половых гормонов в риске развития ФПВ. Они касаются снижения уровня тестостерона у мужчин (t 3,14; p<0,05). Результаты определения уровня эстрадиола у женщин, несмотря на более низкие значения в группе больных с ФПВ, не достигали статистически значимых различий (t 1,18; p>0,05). Возможно, это было связано с широким разбросом показателей данного гормона в зависимости от фазы менструального цикла у женщин до менопаузы и в постменопаузальном периоде. В литературе описана связь метаболических нарушений с проявлениями гипогонадизма. Известно, что у мужчин дефицит андрогенов способствует увеличению количества жировой ткани (В.В.Долгов и соавт., 2006), а снижение уровня эстрогенов у женщин провоцирует развитие абдоминального ожирения, артериальной гипертензии, дислипидемий. Этот фактор настолько весом, что часто говорят о «менопаузальном метаболическом синдроме» (Проект рекомендаций экспертов…, 2009). Однако снижение уровня половых гормонов может определяться не только возрастным гипогонадизмом, но и быть результатом применения препаратов, имеющих пролактинстимулирующую активность. Известно, что повышение уровня пролактина способствует уменьшению выработки половых стероидов (T.Baptista и соавт., 1999; М.Я.Ладыженский и соавт., 2008).
Полученные данные свидетельствуют и о влиянии тиреоидной оси на формирование ФПВ. Повышение уровня ТТГ в процессе терапии (t 4,58; p<0,01) может указывать на развитие субклинических форм гипотиреоза, одно из клинических проявлений которого – повышение массы тела. Имеются убедительные данные, утверждающие, что патология щитовидной железы у пациентов с аффективным расстройством встречается чаще, чем в общей популяции (H.Leigh, S.Kramer, 1984; K.Fountoulakis, A.Iacovides, P.Grammaticos и соавт., 2004). Кроме того, необходимо учитывать и влияние антидепрессантов на уровень тиреоидных гормонов. Так, анализ 12 исследований различных антидепрессантов показал, что 10 из них свидетельствуют о снижении функционирования щитовидной железы в процессе терапии (O.Abulseoud, N.Sane, A.Cozzolino и соавт., 2007).
Важное практическое значение имеют полученные нами данные об уровне аполипопротеинов как одном из факторов риска развития ФПВ. Известно, что апо-А является основным белком липопротеинов высокой плотности – ЛПВП, апо-В – ЛПНП. Поэтому определение апо-А и апо-В дает более точную информацию о содержании соответствующих липопротеинов, чем их определение по концентрации холестерина. В отличие от концентраций холестерина и триглицеридов, которые в значительной степени зависят от факторов среды (диета, образ жизни, физиологическое состояние организма), уровни апо-А и апо-В, а особенно их соотношение, находятся под генетическим контролем, являются более стабильными. Исследования взаимосвязей между содержанием аполипопротеинов и наличием атеросклероза выявило обратную для апо-А и прямую для апо-В корреляцию между уровнем этих аполипопротеинов и риском развития коронарного атеросклероза (J.Stengard и соавт., 2005; P.Talmud и соавт., 2002; W.Wong и соавт., 2003).
В проведенном нами исследовании выявлена взаимосвязь развития ФПВ с уровнем отношения апо-В к апо-А (r 0,41; p<0,05). Учитывая, что данные показатели позволяют комплексно подойти к оценке темпов развития атеросклероза и рисков развития сердечно-сосудистых заболеваний, можно утверждать, что пациенты с высоким риском развития сердечно-сосудистой патологии (о чем свидетельствует и коэффициент атерогенности – r 0,41; p<0,05) имеют большую тропность к формированию ФПВ в условиях использования психотропных препаратов. Таким образом, пациенты, уже находящиеся в группе риска по развитию сердечно-сосудистых заболеваний, наиболее уязвимы к развитию ФПВ, которая может способствовать ухудшению их соматического состояния.
Эффективный терапевтический менеджмент пациентов с депрессией требует разработки профилактических мероприятий, нацеленных на выявление и минимизацию риска ФПВ и, соответственно, снижение осложнений психофармакотерапии. С этой целью необходимо всесторонне обследовать пациента до назначения антидепрессивной терапии, но стандарты скрининга и мониторинга лабораторных показателей, нацеливающих врача на особое внимание к соматическому состоянию пациента и на выбор назначаемых ему препаратов, в настоящее время отсутствуют. В этом случае ФПВ можно рассматривать как «индикатор», который свидетельствует о возможном нарастании соматического неблагополучия.
В то же время это показатель, на который можно оказывать влияние с помощью замены применяемых антидепрессантов на метаболически нейтральные. Повышение массы тела зависит от характера питания и образа жизни. Именно поэтому очевидна необходимость разработки психообразовательных программ, которые должны включать задачи формирования здорового рациона питания (адекватного по калорийности и количеству овощей и фруктов) и привлечения к спортивным занятиям (включая период пребывания в стационаре). Внедрение такого подхода в повседневную врачебную практику при терапии депрессии будет способствовать минимизации рисков не только собственно ФПВ, но и сердечно-сосудистых заболеваний у пациентов с депрессивным расстройством.
Сведения об авторах
Мазо Галина Элевна – д-р мед. наук, вед. науч. сотр. группы эндокринологической психиатрии СПб НИПНИ им. В.М.Бехтерева, проф. каф. психиатрии СПбГУ. E-mail: Galina-mazo@yandex.ru
Шманева Татьяна Михайловна – мл. науч. сотр. группы эндокринологической психиатрии СПб НИПНИ им. В.М.Бехтерева. E-mail: Tatyana-shmaneva@yandex.ru
Соколян Нина Агвановна – канд. биол. наук, ст. науч. сотр. клинико-диагностической лаборатории СПб НИПНИ им. В.М.Бехтерева
Список исп. литературыСкрыть список1. Abulseoud O, Sane N, Cozzolino A et al. Free T4 index and clinical outcome in patients with depression. J Affect Dis 2007; 100: 271–7.
2. Allison DB, Mentore JL, Heo M et al. Antipsychotic-induced weight gain: a comprehensive research synthesis. Am J Psychiat 1999; 156: 1686–96.
3. Ardern CI, Katzmarzyk P, Janssen I et al. Discrimination of health risk by combined body mass index and waist circumference. Obes Res 2003; 11: 135–42.
4. Baptista T, Reyes D, Hernandez L. Antipsychotic drugs and reproductive hormones: relationship to body weight regulation. Pharmacol Biochem Behav 1999; 62: 409–17.
5. Folsom AR, Kushi LH, Anderson KE. Associations of general and abdominal obesity with multiple health outcomes in older women. Arch Intern Med 2000; 160: 2117–28.
6. Fountoulakis K, Iacovides A, Grammaticos P et al. Thyroid function and clinical subtypes of major depression. An exploratory study. BMC Psychiat 2004; 4: 6.
7. Giannini AJ, Slaby AE. Eating Dis 1993; Spring-Verlag, NY Inc.
8. Haffner SN, Valdez R, Hazuda H et al. Prospective analysis of the insulin-resistance syndrome (syndrome X). Diabetes 1992; 41: 715–22.
9. Hamilton M. The assessment of anxiety states beating. Br J Med Psychol 1959; 32: 50–5.
10. Hanley AJ, Karter AJ, Festa A. Factor analysis of metabolic syndrome using directly measured insulin sensitivity. The Insulin Resistance Atherosclerosis Study. Diabetes 2002; 51: 2642–7.
11. Heiskanen TH, Niskanen LK, Hintikka JJ et al. Metabolic syndrome and depression: a cross-sectional analysis. J Clin Psychiat 2006; 67: 422–7.
12. Kinder LS, Carnethon MR, Palaniappan LP et al. Depression and the metabolic syndrome in young adults. Findings from the 3rd National Health and Nutrition Examination Survey. Psychosom Med 2004; 66: 316–22.
13. Kloiber S, Ising M, Reppermund S et al. Overweight and obesity affect treatment response in major depression. Biol Psychiat 2007; 62: 321–6.
14. Koller E, Schneider B, Bennett K, Dubitsky G. Clozapine associated diabetes. Am J Med 2001; 111: 716–23.
15. Leigh H, Cramer SI. The psychiatric manifestations of endocrine disease. Adv Intern Med 1984; 29: 413–45.
16. Meigs JB, D’Agostino RB, Wilson PW et al. Risk variable clustering in the insulin resistance syndrome. The Framingham Offspring Study. Diabetes 1997; 46: 1594–600.
17. Newcomer JW, Nasrallah HA, Loebel AD. The atypical antipsychotic therapy and metabolic issues national survey: practice patterns and knowledge of psychiatrists. J Clin Psychopharmacol 2004; 24 (Suppl. 1): 1–6.
18. Park S, Harrolod JA, Widdowson PS, Williams G. Brain Res 1999; 847: 90–7.
19. Parker G. Classifying depression: should paradigms lost be regained? Am J Psychiat 2000; 157: 1195–203.
20. Parker G. Diagnosis, classification and differential diagnosis of the mood disorders. In: M.Gelder, J.Lopez-Ibor & N.Andreasen. New Oxford Textbook of Psychiat 2000; 1: 688–95.
21. Polosky KS, Given BD, Van Cauter E. J Clin Invest 1988; 81: 442–8.
22. Raikkonen K, Matthews KA, Kuller LH. The relationship between psychological risk attributes and the metabolic syndrome in healthy women: antecedent or consequence? Metabolism 2002; 51: 1573–7.
23. Stengard JH, Kardia SL, Hamon SC et al. Contribution of regulatory and structural variations in APOE to predicting dyslipidemia. J Lipid Res 2006; 47 (2): 318–28.
24. Swinbourne JM et al. The co-morbidity of eating disorders and anxiety disorders: a review. J Eat Dis Ass 2007; 15 (44): 253–74.
25. Talmud PJ, Hawe E, Martin S et al. Relative contribution of variation within the APOC3/A4/A5 gene cluster in determining plasma triglycerides. Hum Mol Gen 2002; 11 (24): 3039–46.
26. Heiskanen TH, Niskanen LK, Hintikka JJ, Heli T. Metabolic syndrome and depression: a cross-sectional analysis. J Clin Psychiat 2006; 67: 1422–7.
27. Van Strien Т, Frijters JE, Bergers GP, Defares PB. The Dutch Eating Behavior Questionnaire (DEBQ) for assessment of restrained, emotional and external eating behavior. Int J Eat Dis 1986; 5 (2): 295–315.
28. Vogelzangs N, Suthers K, Ferrucci L et al. Hypercortisolemic depression is associated with the metabolic syndrome in late-life. Psychoneuroendocrinol 2007; 32 (2): 151–9.
29. Weber-Hamann B, Kopf D, Lederbogen F et al. Activity of the hypothalamus-pituitary-adrenal system and oral glucose tolerance in depressed patients. Neuroendocrinol 2005; 81: 200–4.
30. Weber-Hamann B, Werner M, Hentschel F et al. Metabolic changes in elderly patients with major depression: evidence for increased accumulation of visceral fat at follow-up. Psychoneuroendocrinol 2006; 31: 347–54.
31. Williams SA, Kasl SV, Heiat A et al. Depression and risk of heart failure among the elderly. A prospective community-based study. Psychosom Med 2002; 64 (1): 6–12.
32. Wong WM, Hawe E, Li LK et al. Apolipoprotein AIV gene variant S347 is associated with increased risk of coronary heart disease and lower plasma apolipoprotein AIV levels. Circ Res 2003; 92 (9): 969–75.
33. Аныкина А.В. Некоторые особенности личности пациентов с нарушениями пищевого поведения. Человек, алкоголь, курение и пищевые аддикции (соматические и наркопсихиатрические аспекты). Материалы 2-го Междисциплинарного конгресса с международным участием. СПб., 2008.
34. Горобец Л.Н. К проблеме увеличения массы тела у больных шизофренией и шизоаффективным расстройством при купирующей антипсихотической терапии. Психич. расстройства в общей медицине. 2008; 3: 37–41.
35. Долгов В.В., Селиванова А.В., Ройтман А.П. Лабораторная диагностика нарушений обмена углеводов. Метаболический синдром и сахарный диабет. М.: Триада, 2006.
36. Козлова С.Н., Шляхто Е.В., Голубев А.В. и др. Алгоритм выявления тревожно-депрессивных расстройств у больных ишемической болезнью сердца в общетерапевтической практике. Терапевт. арх. 2011; 83 (1): 17–21.
37. Консенсус Группы организаций здоровья Америки. Окружность талии и кардиометаболический риск. Ассоциация по профилактике ожирения и коррекции массы тела, Североамериканская ассоциация по изучению ожирения, Общество по ожирению, Американское общество по проблемам питания, Американская диабетологическая ассоциация. Артериальная гипертензия. 2007; 13 (3): 1–6.
38. Ладыженский М.Я., Мосолов С.Н., Потапов А.В. Метаболические нарушения при лечении больных шизофренией. Рус. мед. журн. 2008; 16 (15): 1028–39.
39. Незнанов Н.Г., Шляхто Е.В., Голубев А.В. и др. Потенциальная роль провоспалительных цитокинов в развитии тревожно-депрессивных расстройств у больных ишемической болезнью сердца. Артериальная гипертензия. 2009; 15 (4): 497–501.
40. Проект рекомендаций экспертов Всероссийского научного общества кардиологов по диагностике и лечению метаболического синдрома (2-й пересмотр). М., 2009. http://www.cardiosite.ru/recommendations/article.asp?id=6247
41. Смулевич А.Б. Депрессии и коморбидные расстройства. 2011.
42. Чазова И.Е., Мычка В.Б. Метаболический синдром. М.: Медиа Медика, 2004.


