Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№02 2013
Психические расстройства у больных с заболеваниями системы крови (обзор литературы) №02 2013
Номера страниц в выпуске:26-35
Заболевания системы крови1 (ЗСК) представляют собой гетерогенную группу онкологических и неонкологических заболеваний, при которых психические расстройства (ПР) манифестируют в среднем в 1/2 наблюдений.
Заболевания системы крови1 (ЗСК) представляют собой гетерогенную группу онкологических и неонкологических заболеваний, при которых психические расстройства (ПР) манифестируют в среднем в 1/2 наблюдений.
Сопоставимые показатели распространенности ПР при ЗСК (37,5–48%) представлены в работах J.Prieto и соавт. (2002 г.), D.Stark и соавт. (2002 г.), T.Sasaki и соавт. (2000 г.) и G.Lloyd и соавт. (1984 г.), проводивших исследования на выборках пациентов с разными гематологическими нозологиями.
Так, J.Prieto и соавт. (2002 г.) [1] в рамках проспективного исследования, проведенного с июля 1994 по август 1997 г., наблюдали 220 больных в возрасте от 16 до 65 лет с различными формами лейкозов, перенесших трансплантацию костного мозга (ТКМ). Авторы оценивали психическое состояние пациентов при поступлении и еженедельно во время госпитализации до выписки или смерти. Распространенность ПР в изученной выборке составила 44,1%. Расстройства настроения диагностированы в 14,1% (31 наблюдение) случаев, из них в 12,3% (27 наблюдений) – большой депрессивный эпизод, в 0,9% (2 наблюдения) – дистимическое расстройство, в 1,4% (3 наблюдения) – индуцированное кортикостероидами расстройство настроения. Тревожные расстройства выявлены у 8,2% (18 наблюдений) пациентов, из них фобическое расстройство – у 1,8% (4 наблюдения), генерализованное тревожное расстройство – у 1,8% (4 наблюдения), паническое расстройство – у 1,4% (3 наблюдения), индуцированное кортикостероидами тревожное расстройство – у 4,0% (9 наблюдений).
Распространенность расстройств адаптации составила 50 (22,7%) наблюдений, из них депрессивные реакции – 16 (7,3%), с тревогой – 15 (6,8%), смешанное (тревожно-депрессивное) расстройство – 19 (8,6%) наблюдений. Делирий зафиксирован у 16 (7,3%) пациентов. D.Stark и соавт. (2002 г.) [2] в исследовании с участием 178 пациентов с неходжкинскими лимфомами, лимфогранулематозом (ЛГМ), плазмоклеточными гемобластозами (включались также пациенты с меланомой) выявили тревожное расстройство в 48% наблюдений.
По данным T.Sasaki и соавт. (2000 г.) [3], ПР диагностированы у 16 из 39 (41%) пациентов, страдающих лейкозами. В исследовании G.Lloyd и соавт. (1984 г.) 15 из 40 (37,5%) пациентов со злокачественными лимфомами, относящимися к наиболее тяжелому полюсу ЗСК, имели значимую психическую патологию [4].
Данные еще 2 исследований несколько отличаются от предыдущих. Так, T.Hosaka и соавт. (1994 г.) провели исследование, в котором выделяли отдельные типы ПР у 31 пациента с ЗСК. Использование в работе более строгой методики (структурированное интервью, основанное на критериях DSM-IV) может объяснить тот факт, что ПР установлены у значительно меньшей доли (29%) больных в сравнении с данными цитированных выше работ [5].
С другой стороны, F.Hurtado и соавт. (1993 г.) [6] в результате обследования однородной группы из 22 пациентов с лейкозами выявили психические нарушения в 77% наблюдений. Хотя авторы не предлагают собственного объяснения столь высокого показателя, более чем в 2 раза превосходящего значения, полученные в большинстве других работ, можно предположить, что одной из причин такого расхождения является влияние фактора тяжести соматического состояния, традиционно рассматриваемого как значимый предиктор более высокой частоты и выраженности психической патологии, коморбидной соматическим заболеваниям [7].
Таким образом, несмотря на отмеченные расхождения в данных, ЗСК характеризуются высокой коморбидностью с ПР, что подтверждает актуальность дальнейшего их изучения.
Влияние ПР на течение ЗСК
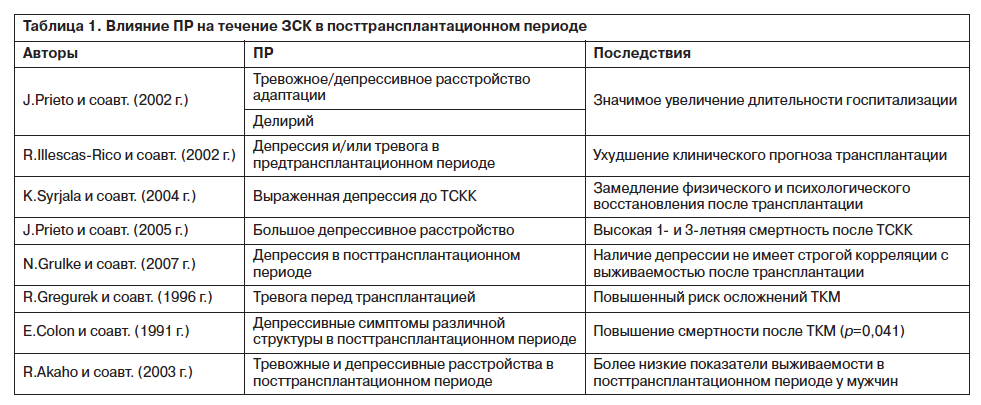
Сведения о неблагоприятном влиянии коморбидных ПР на клинический исход и качество жизни больных с ЗСК представлены в табл. 1.
Соматогенные психозы
Типологическая дифференциация соматогенных психозов, несмотря на бесспорную научную и практическую актуальность, оставалась до последнего времени недостаточно разработанной. В большинстве исследований полиморфные проявления соматогенных психозов либо объединялись собирательным термином «психоз», либо квалифицировались в соответствии с этиопатогенетическим фактором, которому отводилась роль ведущего классифицирующего признака.
В рамках первого из этих направлений объединяются гетерогенные по своим клиническим проявлениям психозы – от абортивных (субсиндромальных) форм до клинически завершенных и затяжных. При обсуждении изучаемых психопатологических расстройств ряд авторов указывают, что такие нарушения при ЗСК ограничиваются формированием отдельных признаков расстройств восприятия (гипнагогические галлюцинации) и аффективных нарушений (растерянность и тревога) на фоне астении [15–17].
J.Haber (1952 г.), описывая соматогенные психозы при полицитемии [18], указывал, что психопатологическая картина ограничивается состояниями оглушенности, спутанности и зрительными галлюцинациями. Другие исследователи выделяют более сложные психопатологические расстройства (в основном в терминальном периоде ЗСК) – аментивное помрачение сознания, эпилептиформное возбуждение, делириозное помрачение сознания, бредовые расстройства [19–22, 25].
В отечественной литературе также приводятся основанные на казуистических наблюдениях указания на возможность развития соматогенных психозов у больных с ЗСК. Так, В.И.Максименко (1967 г.) наблюдал 2 случая соматогенных психозов у больных ЛГМ: фантастически-иллюзорный онейроид с тревогой и подавленностью на фоне соматогенной астении и «гипоактивный» делирий (астенические расстройства с присоединением явлений дезориентировки и гипнагогических галлюцинаций) [20].
К.В.Москети и К.С.Терновой (1970 г.) наблюдали развитие галлюцинаторно-бредового синдрома у больного эритремией [26] и выдвинули предположение о связи психопатологических расстройств с коагулологическими, ассоциированными с нарушениями трофики мозговой ткани, характерными для эндартериита. Целенаправленное изучение психической патологии при ЗСК представлено в работах Б.А.Целибеева, результаты которых обобщены в монографии «Психические нарушения при соматических заболеваниях» (1972 г.) [25]. Автор подчеркивает, что в терминальном периоде острых лейкозов психотические нарушения, которым предшествует тяжелая астения, а нередко и апатическая депрессия, встречаются довольно часто. При этом преобладают делириозные расстройства – от редуцированного до «гиперактивного» делирия.
В исследовании, датированном 1964 г. (выполнено в соавторстве), в период обострения хронического миелолейкоза (ХМЛ) выявлено формирование на фоне тяжелой астении и обнубиляции сознания депрессивного состояния с бредовыми идеями самообвинения и отравления. Авторы приводят 2 случая соматогенных психозов у больных ЛГМ (у одного из пациентов выявлен бред отравления, завершившийся в терминальной стадии заболевания присоединением расстройств сознания с аменцией; у другого – в периоды ухудшения соматического состояния – психомоторное возбуждение с отрывочными бредовыми идеями, слуховыми и зрительными галлюцинациями). При полицитемии (эритремии) авторы отметили у 4 больных манифестацию шизофреноподобного психоза с развитием обманов восприятия (угрожающие убийством «голоса» соседей внутри головы); редукция психотической симптоматики сопровождалась становлением астении. В другом случае развитию бреда преследования и самообвинения и затем синдрома Котара предшествовал дебют с тревогой и страхами. У 2 других пациентов выявлены острый параноидный психоз и органическая деменция [19].
Таким образом, психозы у больных с ЗСК чаще всего проекают в форме делириозных расстройств, распространенность которых, по данным J.Prieto и соавт. (2002 г.), составляет 7,3% [1], а по результатам других исследований [23, 24] этот показатель достигает 41–43%. Можно предположить, что приведенные расхождения связаны с различиями по признаку степени тяжести ЗСК в изученных выборках.
В этом контексте можно рассматривать результаты, полученные другими авторами. Так, J.Fann и соавт. (2002 г.) выявили признаки делириозного помрачения сознания более чем у 1/2 (54%) больных, перенесших ТКМ. Авторы выделяют факторы риска претрансплантационных делириев: низкое когнитивное функционирование, высокий уровень азота мочевины, щелочной фосфатазы, также солей магния крови, дефицит физической активности. Кроме того, развитию тяжелого делирия в период ТКМ, по мнению авторов, способствует высокий уровень креатинина крови, перенесенное тотальное облучение, предельно высокий показатель щелочной фосфатазы, женский пол, пожилой возраст и злоупотребление алкоголем либо наркотическими препаратами [28]. Высокие цифры распространенности, судя по данным, приводимым в статье, можно объяснить преобладанием пациентов с диагнозами тяжелой онкогематологической патологии (острые лейкозы, лимфосаркомы), а также значительной долей среди них лиц с медикаментозной/алкогольной зависимостью и делириозными расстройствами в анамнезе.
D.Ross и C.Alexander (2001 г.), описывая делириозное помрачение сознания у онкологических больных, акцентируют внимание на том факте, что в терминальной стадии таких заболеваний (включая болезни крови) распространенность делирия может достигать 85% [29]. В качестве факторов, способствующих развитию делирия, авторы выделяют гипоксию, наличие инфекции (например, банальная инфекция мочевых путей), лихорадку, обезвоживание, реакцию отмены опиоидов либо бензодиазепинов. Исследование показало, что делирий обратим приблизительно у 50% терминальных пациентов. Авторы отмечают и факторы, ассоциированные с повышенным риском делирия у пациентов старше 80 лет: нарушение зрения, тяжелые сопутствующие соматические заболевания, признаки дегидратации, когнитивные нарушения, а также соматогенную астению.
В ряде работ приводятся казуистические наблюдения. Так, S.Passik и M.Cooper (1999 г.) описывают 59-летнюю женщину с острым миелобластным лейкозом (ОМЛ) и болями неясной этиологии, у которой развился делирий, причем повышение дозы прохлорперазина осложнилось экстрапирамидным синдромом [30].
B.Meyers и R. van Ojen (2004 г.) выявили у пациента 21 года с В-клеточной лимфомой манифестировавший на фоне соматогенной астении гипоактивный делирий, ограниченный дезориентировкой в пространстве и времени и отрывочными «видениями»; состояние купировано психостимулятором метилфенидатом [31]. M.Chawla и J.Lindesay (1993 г.) приводят наблюдение 65-летней женщины с эритремией и делирием [33].
P.Silberfarb и G.Bates (1983 г.) приводят 5 наблюдений (больные среднего и пожилого возраста с множественной миеломой – ММ тяжелого течения, требующего применения высоких доз химиотерапевтических препаратов, в том числе кортикостероидов) [32]; у 4 пациентов зарегистрировано делириозное помрачение сознания, у 1 – делирий сменился депрессией.
Приводятся указания на вероятность возникновения делириозных расстройств при ММ и острых лейкозах, сопровождающихся характерной для этого заболевания гипераммониемической энцефалопатией [34–36].
В качестве еще одного фактора риска соматогенных психозов при злокачественных ЗСК рассматривается органическое поражение центральной нервной системы (ЦНС) с метастазированием в оболочки и ткань головного либо спинного мозга (нейролейкемия). Развитие психозов предпочтительно для острых лейкозов, протекающих с гиперлейкоцитозом (содержание лейкоцитов в периферической крови более 30¥109/л), хотя при нейролейкемии они наблюдаются достаточно редко [37].
В то же время нейролейкемия рассматривается в качестве значимого фактора развития психоза, завершающегося формированием слабоумия [38]. Вовлечение ЦНС в поражение лейкемическими клетками является хорошо распознаваемым осложнением острого лимфобластного лейкоза (ОЛЛ) у детей, но с улучшением результатов системной терапии и длительным выживанием распространенность этого осложнения повышается и у взрослых. Среди психопатологических расстройств, сопряженных с нейролейкемией, авторы упоминают психоорганические синдромы.
Среди поражений ЦНС, которые могут вызывать ПР у больных с ЗСК, упоминается «синдром Офелии» – паранеопластический лимбический энцефалит, описанный у больных ЛГМ [39], на фоне которого вероятно развитие делириозного помрачения сознания [40].
В исходе делириозного помрачения сознания у больных с ЗСК многие авторы наблюдают энцефалопатию с когнитивными расстройствами. Так, J.Fann и соавт. (2007 г.) отмечают, что у больных, перенесших делирий во время миелоаблативной трансплантации стволовых клеток крови (ТСКК), в течение 80 дней после перенесенного психоза сохраняются когнитивные расстройства [41]2.
В числе других расстройств сообщается о развитии у больного ОЛЛ параноидного психоза, при котором после этапа антипсихотической терапии, приведшей к злокачественной нейролепсии, в качестве лечебного метода была избрана электросудорожная терапия (ЭСТ) [21].
M.Jablonski и соавт. (2002 г.) описывают манифестацию соматогенно провоцированного депрессивно-параноидного психоза у пациентки с острым лейкозом, развившегося при проведении полихимиотерапии (ПХТ) и ТКМ и потребовавшего госпитализации в психиатрическую клинику [42].
Психотическую депрессию при эритремии (по 1 наблюдению) выявили D.Murray и R.Hodgson (1991 г.) [43], M.Mazzoli и F.Benazzi (1992 г.) [44], а также C.Fones и W.Tsoi (1995 г.) [45].
Два наблюдения, расцененные авторами публикаций в качестве психогенных психозов, позволяют (с учетом характеристики дебюта и клинической картины) усомниться в такой квалификации и предположить соматогенную природу страдания.
D.Moss (1980 г.) описывает случай развития параной-яльных расстройств у мужчины, страдающего ХМЛ (без манифестных психозов в анамнезе) [46]. На завершающей стадии курса ХТ (спустя 2 нед с момента стационирования) у пациента снизилось настроение, он отказывался от исследований и лечения, заявляя, что в последние 2 дня врачи пытаются его убить. В дальнейшем присоединились идеи способности самостоятельно контролировать такие проявления болезни, как температура тела и число лейкоцитов в крови. Был уверен, что сосредоточение на этих параметрах, сообщаемых врачу, предотвратит любое ухудшение. Такое состояние длилось менее недели и купировалось самостоятельно после завершения курса ХТ. Автор статьи трактует описанные бредовые симптомы в психодинамических терминах. С нашей точки зрения, на основании констатации у больного связи бредовых расстройств с гипотимическими проявлениями, а также спонтанного их купирования по завершении воздействия соматогенного фактора – ПХТ, состояние, наблюдавшееся у пациента, представляет собой транзиторный соматогенный психоз депрессивно-бредового содержания.
M.Irwin (1984 г.) описывает острый психотический эпизод у 13-летнего подростка, страдающего ОЛЛ. На фоне проведения ПХТ и массивной антибактериальной терапии мальчик в течение 2 сут испытывал выраженную тревогу и бессонницу. Он утверждал, что его мозг «переключился», превратился в кубик Рубика и правильное решение головоломки содержит ответы на вопросы его жизни и смерти. Казалось, что кубик позволяет ему читать мысли других людей, а те в свою очередь считывают информацию с его мозга. Периодически становился крайне возбужденным, кричал, что через его мозг протекает слизь и засоряет его. Схема терапии была дополнена антипсихотическими средствами (кветиапин в дозе 400 мг/сут) и рациональной психотерапией. Примерно через неделю состояние улучшилось, а через 2 мес антипсихотики были отменены. При катамнестическом обследовании (через год) больной остается в ремиссии без ПР. Автор утверждает, что в данном случае манифестации психоза способствовало не токсическое действие цитостатических препаратов (чему есть немало свидетельств в литературе), а психотическое состояние – «эмоциональная реакция» на болезнь крови [47]. Тем не менее на полном основании можно расценивать данное наблюдение в рамках соматогенно провоцированного (лимфобластный лейкоз, воздействие цитостатических препаратов и облучения) приступа шизофрении с элементами синдрома Кандинского–Клерамбо.
F.Stiefel и соавт. (1989 г.) [51] указывают, что, несмотря на безусловный положительный эффект, связанный с внедрением кортикостероидных гормонов при онкологических заболеваниях, их применение может сопровождаться формированием психопатологических расстройств (ятрогенные/фармакогенные эффекты). Тяжелые аффективные расстройства в результате применения кортикостероидов в настоящее время регистрируются все реже, но наблюдаются невыраженные изменения настроения (от эйфории в начале лечения до депрессивных расстройств при возобновлении симптомов основного заболевания)3.
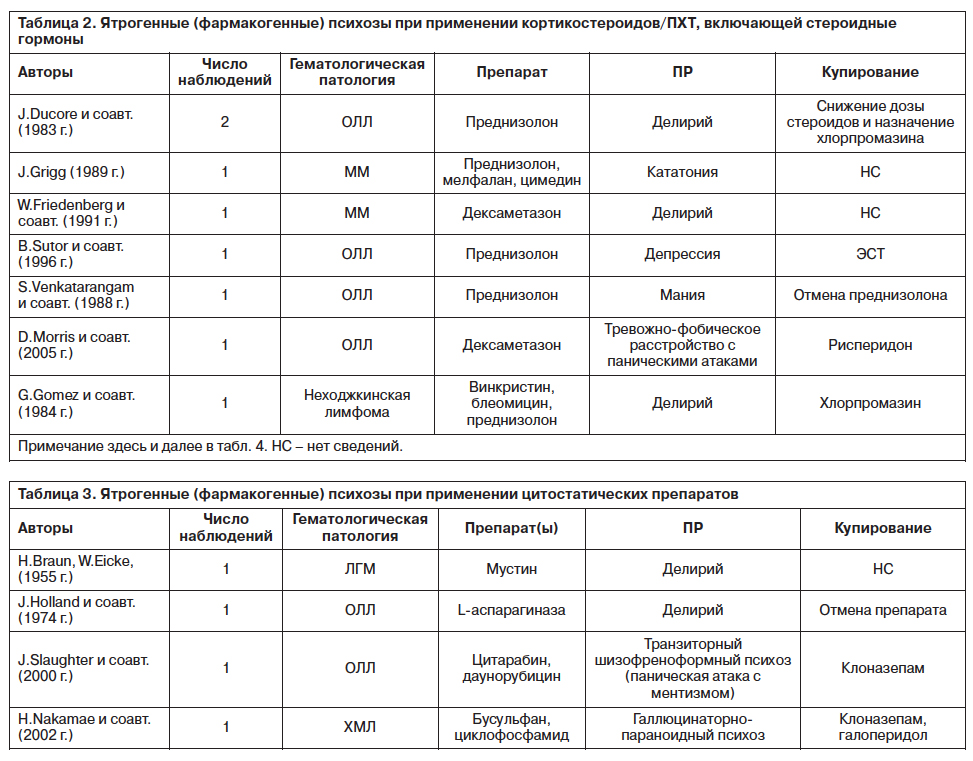
Авторы подчеркивают, что назначение кортикостероидов должно проводиться с учетом психиатрического анамнеза, соматического статуса, локализации онкологического процесса, лечения, наличия болевого синдрома, осложнений – особенно со стороны ЦНС. Сведения о наблюдениях, в которых выявлены психотические состояния, связанные с приемом кортикостероидных препаратов, представлены в табл. 2.
Приводятся также описания фармакогенных психозов, манифестация которых связана с использованием некортикостероидных цитостатических препаратов (табл. 3).
Интерферон a (ИФН-a), иммуномодуляторный цитокин используется для лечения некоторых заболеваний, включая хронический гепатит, меланому и ХМЛ. Во время терапии ИФН-a могут возникнуть тяжелые ПР, включающие депрессию с суицидальными мыслями и параноидные психозы [63].
При использовании ИФН-a описываются психотические состояния, протекающие с аффективными расстройствами как депрессивного [64–66], так и маниакального [67] полюса, а также биполярные [68].
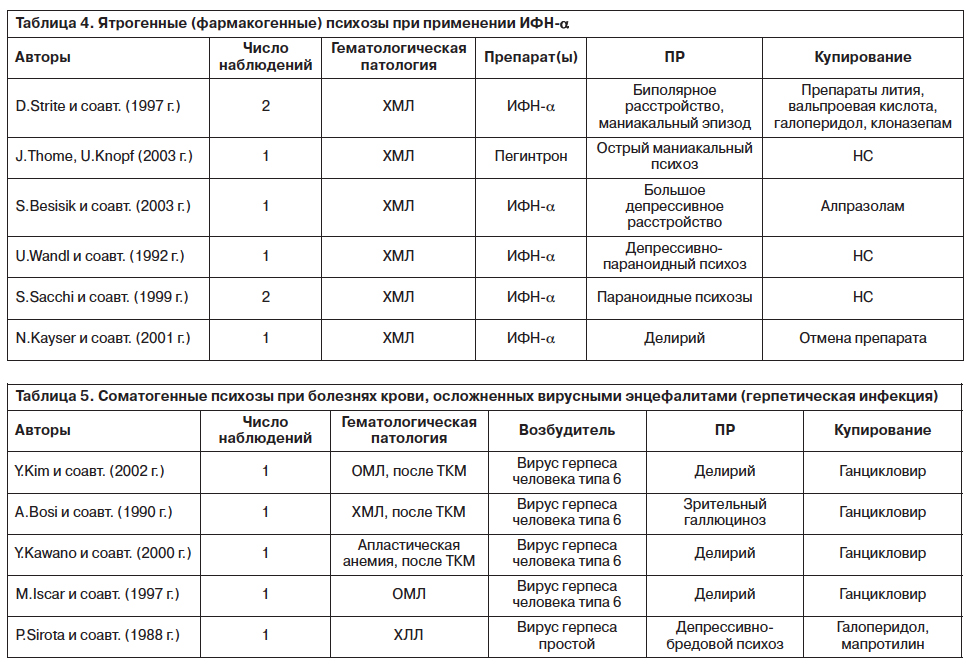
A. van Gool и соавт. (2003 г.) отмечают, что ИФН-a способен индуцировать депрессивную симптоматику, но вероятность возникновения при его приеме других ПР не столь очевидна. Приемлемой патофизиологической теории цитокин-индуцированных ПР не существует, однако эмпирически такая связь подтверждается некоторыми исследователями [69] (табл. 4).
Рассматривается также развитие ПР в связи с применением других медикаментозных средств. В частности, приводится случай развития «вторичной тревоги» при назначении противорвотного препарата ондансетрон (зофран) у пациентки, поступившей для проведения аллогенной ТКМ по поводу ХМЛ (Ph-позитивного) [82]. На 2-й день приема зофрана у больной развился (судя по клиническому описанию) эпизод острой генерализованной тревоги. Состояние обошлось после назначения лоразепама в дозе 1 мг/сут. Неврологических нарушений выявлено не было. Ондансетрон был временно отменен, однако при возобновлении приема препарата вновь развилась тревога: пациентка жаловалась, что «сама не своя» – не может из-за рассеянности четко мыслить. Состояние купировано при помощи лоразепама в той же дозе. J.Caplan (2006 г.) [83] приводит наблюдение, в котором пациент через 4 ч после 1-кратного приема препарата ATRA4, используемого для лечения острого промиелоцитарного лейкоза, стал жаловаться на выраженную тревогу, вслед за которой манифестировал делирий, купировавшийся через 48 ч внутривенными инфузиями галоперидола.
Казуистика, в которой описываются соматогенные психозы при ЗСК, осложненных вирусным энцефалитом (герпетическая инфекция), приводятся в отдельных работах (табл. 5), что не позволяет высказать окончательное суждение об особенностях психопатологических проявлений подобных расстройств.
Таким образом, можно констатировать, что основными факторами риска возникновения психотических расстройств у больных с ЗСК являются тяжелое течение основного заболевания, проведение ХТ, в том числе с использованием кортикостероидных препаратов, электролитные нарушения и пожилой возраст пациентов.
Нозогенные реакции
По данным разных авторов, психогенные расстройства, связанные с ситуацией соматического заболевания (нозогении, расстройства адаптации по Международной классификации болезней 10-го пересмотра – МКБ-10), относятся к наиболее частым формам ПР у пациентов стационаров общесоматического профиля и амбулаторных учреждений [84]. Наиболее высокие показатели распространенности нозогенных реакций отмечаются у пациентов, страдающих тяжелыми, угрожающими жизни соматическими заболеваниями, к числу которых относятся онкологические заболевания.
Распространенность нозогенных реакций у пациентов со злокачественными новообразованиями варьирует в достаточно широких пределах – от 20 до 100%, что зависит от методологических и диагностических подходов, используемых разными исследователями [85–93].
Анализ работ, посвященных нозогенным реакциям (расстройствам адаптации) у больных с ЗСК, затрудняется тем, что некоторые из них были выполнены на малых выборках и даже отдельных казуистических наблюдениях, а часть из них опирается исключительно на психометрические методики. По данным разных авторов [1, 3, 94], распространенность расстройств адаптации у данного контингента больных варьирует в пределах 22,6–53,3%.
По данным J.Prieto и соавт. (2002 г.) [1], расстройства адаптации, эквивалентные нозогениям в отечественной литературе, выявляются у 22,7% пациентов. T.Sasaki и соавт. (2000 г.) [3] среди 39 обследованных больных с ЗСК у 9 (23%) выявили расстройства адаптации. Сопоставивые расчеты приводит T.Hosaka и соавт. (1994 г.) [5]: 7 из 31 (22,6%) больного – с расстройствами адаптации. F.Hurtado и соавт. (1993 г.) [6] при обследовании 22 пациентов с острыми лейкозами у 17 (77%) выявили ПР, среди которых наиболее частыми оказались расстройства адаптации (82%) и психосоматические нарушения (59%).
Среди расстройств адаптации выделяют в основном тревожные расстройства, посттравматическое стрессовое расстройство (ПТСР) и депрессивные расстройства. Так, J.Devlen и соавт. (1987 г.) [95] оценивали 90 пациентов в среднем через 32 мес после установления диагноза лимфогранулематоза или неходжкинских лимфом.
В результате психиатрического обследования у 48 (53,3%) пациентов выявлено тревожное, депрессивное либо сочетанное тревожно-депрессивное расстройство адаптации, из них у 21 (23,3%) пациента – синдромально завершенное, у 27 (30%) – субсиндромального (пограничного) уровня.
M. dos Santos и соавт. (1991 г.) обобщили дланные, полученные в течение года в гематологическом отделении больницы. В течение 6-месячного периода авторы обследовали группу госпитализированных пациентов с лейкозами, лимфогранулематозом и неходжкинскими лимфомами с использованием полуструктурированного интервью. Распространенность расстройств адаптации (депрессивных и/или тревожных) была оценена
(с использованием диагностических критериев DSM-IIIR) в пределах 20–40% [94, 96].
Распространенность расстройств адаптации, протекающих с преобладанием тревоги, по данным разных авторов, составляет 6,5–33%. Так, D.Stark и соавт. (2002 г.) [2] при обследовании 178 пациентов выявили 18% пациентов, которые соответствовали критериям МКБ-10 для тревожных нозогений. Последние, согласно обзору литературы, выполненному T.Sasaki и соавт. (2000 г.), составляют 20–33% [99–101]. T.Hosaka и соавт. (1994 г.) из 31 пациента с ЗСК выявили 2 (6,5%) пациентов с тревожными нозогениями [5].
Некоторые авторы выделяют среди тревожных расстройств у пациентов с ЗСК состояния, расцениваемые ими как ПТСР. Так, в исследовании E.Black и C.White (2005 г.) [97] изучены 36 пациентов [использовались опросники: PTSD Checklist Civilian Version (PCL-C), the Impact of Events Scale-Revised (IES-R) и 2 опросника страха рецидива]. У 17% обследованных выявлялись признаки ПТСР, причем между страхом рецидива и ПТСР обнаружены статистически значимые корреляции.
В исследовании S.Smith (2008 г.) [98] у 7,9% пациентов с неходжкинскими лимфомами выявлено соответствие полным критериям ПТСР и еще у 9,1% – частичным. Факторами риска, независимо связанными с ПТСР, были отсутствие социальной поддержки, негативная оценка жизненных перспектив и интенсивность терапии, а положительно – трудовая занятость, наличие страховки. Кроме того, некоторые демографические характеристики (принадлежность к негроидной расе, низкий уровень образования, молодой возраст) и клинические факторы, связанные со здоровьем (активность заболевания, недавно установленный диагноз, высокая коморбидность), были независимо связаны с ПТСР.
При ЗСК выявляются депрессии, включая нозогенные. A.Frances и M.Popkin [99] приводят наблюдение, в котором депрессия сформировалась через 6 мес после установления диагноза острого лимфобластного лейкоза и проведения курса ХТ. В структуре депрессивного симптомокомплекса значительное место занимали ипохондрические расстройства. Авторами диагностирован органический депрессивный синдром, но мы рассматриваем данное состояние как нозогенную депрессию, поскольку она развилась вне непосредственного воздействия соматогенных факторов и вслед за психотравмирующими событиями (болезнь крови).
В другом клиническом наблюдении C.Fones и W.Tsoi (1995 г.) [105] описали пациентку с эритремией, у которой это заболевание манифестировало одновременно с депрессией, имеющей признаки как нозогенного, так и органического расстройства.
P.Davidson (1964 г.) [106] приводит наблюдение, иллюстрирующее развитие конверсионного расстройства (заикание) в рамках истеро-депрессивной нозогении у больного ЛГМ.
T.Sasaki и соавт. (2000 г.) [3] приводят собственные данные о частоте депрессивных нозогений на выборке из 39 (8%) пациентов с лейкозами и указывают, что, по данным разных авторов, распространенность таких расстройств составляет от 20 до 40% [100–103]. К сожалению, авторы не обсуждают различия в значениях соответствующих показателей, обнаруженные в цитируемом исследовании и работах других авторов (8% против 20–40%).
T.Hosaka и соавт. (1994 г.) [5] выявили нозогенные депрессии у 5 из 31 (16,1%) пациента с ЗСК. K.Malyszczak и соавт. (2005 г.) установили, что депрессивные расстройства адаптации встречаются в 29% случаев ЗСК (по сравнению с 11% у пациентов с другими соматическими заболеваниями) [104].
В литературе приводятся факты, свидетельствующие о возможности развития при ЗСК не только тревожных и депрессивных, но и других расстройств круга «малой» психиатрии.
H.Onishi и соавт. (2004 г.) [107] описали конверсионное расстройство с истерическими судорогами вплоть до «истерической дуги» у 21-летней пациентки с ОМЛ. Психотравмирующая ситуация, связанная с ТКМ, усугублялась тем обстоятельством, что рецидив болезни у пациентки совпал с обострением лейкоза у ее близкого друга, вследствие которого он погиб.
Некоторые авторы указывают на возможность развития соматоформных расстройств у больных лимфогранулематозом. W.Weddington (1982 г.) и D.Cella и соавт. (1986 г.) отмечают, что у больных с этой патологией, получающих ПХТ, нередко возникает психогенная тошнота, иногда с рвотой [108, 109].
R.Nesse и соавт. (1983 г.) приводят 6 наблюдений, в которых описывается развитие необычных и стойких вкусовых и обонятельных ощущений, повторяющих вкус и запах ранее вводимых химиотерапевтических препаратов у больных, страдающих ЛГМ и гистиоцитарной лимфомой. Такие ощущения возникали при выполнении действий, ассоциирующихся у больных с посещением клиники и ситуацией введения препаратов (выход из автомобиля, на котором приезжали в клинику, размышления о проведенном несколько месяцев тому назад лечении и его перспективах, необходимости посетить клинику, воспоминания о введении препарата). Описанные ощущения авторы расценивают как псевдогаллюцинации у непсихотических больных в состоянии ясного сознания и интерпретируют этот феномен в рамках стрессовых реакций или травматического невроза [110]. Мы рассматриваем такие состояния в рамках ПТСР.
Приводятся сообщения (3 из них описаны нами в разделе «Соматогенные психозы») о возможности манифестации у больных с ЗСК психогенных психозов. B.Wank (1982 г.) [111] приводит наблюдение, в котором у 59-летней женщины, никогда ранее не обращавшейся к психиатру, было заподозрено ЗСК (эритромиелоз), при дальнейшем обследовании выявлен лейкоз. Узнав о своей болезни, больная перенесла кратковременное бредовое расстройство с несистематизированными идеями преследования (бред приписанной болезни). Пациентка обнаружила тревогу, утверждала, что врачи скрывают от нее диагноз смертельного заболевания и тем самым хотят ее убить. В течение 3 дней на лечении галоперидолом (10 мг/сут) в сочетании с психотерапией состояние обошлось; психотических расстройств не наблюдалось. Пациентка заявляла, что почувствовала облегчение после установления точного диагноза. Обсуждение наблюдения проводится с психологических позиций: авторы утверждают, что ситуация двойственности (в приведенном случае – неясность диагноза) порождает тревогу, которую можно редуцировать путем внесения определенности в сообщаемую пациентке информацию.
Факторы риска нозогений у больных с ЗСК складываются из общих для всех соматических заболеваний, а также специфических для данного вида патологии. Среди первых – объективная выраженность проявлений болезни (тяжесть течения), особенности ее лечения и исхода. Так, нозогении чаще формируются при острых и тяжелых соматических страданиях, негативно влияющих на качество жизни (снижение работоспособности, высокая вероятность инвалидизации).
К числу этих факторов принадлежат также конституциональные (расстройства личности), социальные (уровень образования, материальной обеспеченности и т.д.), нозогенные (семантика диагноза, условия специализированного стационара в окружении тяжелобольных) [7].
Ко 2-й группе факторов риска (специфических для ЗСК) исследователи относят степень анемии и особенности течения конкретного ЗСК. Так, F.Hurtado и соавт. (1993 г.) [6] подчеркивают, что степень анемии коррелирует с частотой формирования депрессивных и прежде всего астено-депрессивных состояний; в свою очередь быстро прогрессирующее течение гематологического заболевания с развитием тяжелых рецидивов, поражением многих групп лимфоузлов также способствует манифестации тревожных и депрессивных расстройств и необходимости нахождения в специализированном стационаре.
Мнения по поводу участия гендерных факторов в формировании нозогенных реакций при ЗСК неоднозначны и даже противоречивы. Если одни авторы [2, 3, 9, 112] относят к факторам риска нозогений женский пол, то другие приводят противоположные результаты. Так, в исследовании B.Kawiecka-Dziembowska и соавт. (2005 г.) [113] показано, что более тяжелые депрессии чаще выявляются у мужчин. Приведенные расхождения могут быть связаны с гетерогенностью гематологических нозологий, включаемых в выборки исследований. Дело в том, что распределение по полу меняется в зависимости от конкретной формы гематологического заболевания (от 1,3:1 до 4:1) [114–119].
Отдельно выделяются побочные явления специфической терапии (формирование агранулоцитоза, сопровождающееся грибковым поражением слизистой ротоглотки, кишечника; тромбоцитопении с геморрагиями; сопутствующие инфекционные заболевания – пневмония и пр.). Так, по сведениям J.Devlen и соавт. (1987 г.), аффективные расстройства положительно коррелируют с подобными эффектами лечения [95].
В большинстве же случаев, как указывают не только авторы цитированной работы, но и другие исследователи [1, 6, 95, 98], при развитии нозогений наблюдается сочетание нескольких факторов риска (как общих, так и специфических).
ТКМ/ТСКК
Одной из ситуаций, в которых нозогении возникают особенно часто (более 50%), является ТКМ (ведущий метод лечения при злокачественных заболеваниях [123]) либо ТСКК [120–122]. Успешное проведение трансплантации требует изоляции пациентов в течение нескольких недель во избежание инфицирования, а также строгого соблюдения врачебных рекомендаций, поскольку предполагается возможность ухудшения физического состояния пациентов в ходе собственно вмешательства и приема лекарственных препаратов.
D.Wolcott (1993 г.) [124] выделяет следующие критические психиатрические проблемы, возникающие при ТКМ: 1 – разработка психиатрических/психосоциальных критериев отбора пациентов на трансплантацию,
2 – обеспечение оптимальных психосоциальных служб для пациентов, ожидающих трансплантацию, 3 – диагностика и лечение ПР, возникающих в процессе трансплантации, 4 – оказание помощи членам семей пациентов,
5 – предотвращение и купирование некомплаентности, 6 – участие в долговременной реабилитации пациентов после ТКМ, 7 – реабилитационная (психосоциальная) работа с пациентами, перенесшими трансплантацию.
Ситуация ТКМ на всех стадиях сопряжена с высоким риском развития психопатологических расстройств. Так, T.Sasaki и соавт. (2000 г.) среди 39 пациентов с различными формами лейкоза, перенесших трансплантацию, выявили 16 больных с ПР (12 – расстройства адаптации тревожного и/или депрессивного содержания,
2 – деперсонализационные расстройства и по одному наблюдению – кратковременное психотическое расстройство и делирий). Авторы не отметили различий в особенностях манифестации ПР в зависимости от типа ТКМ [3].
В обзоре, посвященном психиатрическим и психосоциальным аспектам ТКМ, M.Andrykowski (1994 г.) [125] в качестве наиболее значимых психотравмирующих факторов выделяет: изоляцию в стерильном боксе, быструю и непредсказуемую смену физического состояния, частые инвазивные медицинские процедуры, побочные эффекты терапии, зависимость от медицинского персонала, повторные инфекции, реакцию «трансплантат против хозяина». Ургентное вмешательство сопряжено с выявлением тревожных и депрессивных реакций, гнева и враждебности, «вины выжившего», инсомнии, анорексии, бредовых образований и «отыгрывания» в качестве одной из наиболее частых психологических защит; нередко наблюдается нарушение терапевтического сотрудничества (нонкомплаенс). Касаясь психиатрических аспектов выделенных проблем, M.Andrykowski отмечает важность своевременного (на дотрансплантационном этапе) выявления ПР, которые могут повлиять в дальнейшем на течение вмешательства. К таким состояниям автор относит депрессивные расстройства и расстройства личности, которые могут быть связаны с длительностью выживания после трансплантации. Важность распознавания ПР на всем протяжении трансплантации автор объясняет тем, что последние подавляют взаимодействие с персоналом, проводящим трансплантацию; ограничивают рациональное принятие решения относительно стоимости и пользы операции; снижают усвоение информации, получаемой в процессе проведения терапии. Среди таких расстройств выделяются депрессивные состояния, достигающие уровня большого депрессивного эпизода как на этапе «подготовительной» фазы ТКМ [126], так и в сочетании с коморбидной тревогой на этапе перед поступлением в стационар [127]. Среди симптомов, сопровождающих ранний посттрансплантационный период, выделяют симптомы тревоги и депрессии (от мягких до умеренных) [128], а в отдаленном посттрансплантационном периоде – симптомы депрессии и ПТСР. В качестве предикторов риска авторы выделяют избегающее совладание и отсутствие социальной поддержки [129].
В уже упоминавшемся исследовании J.Prieto и соавт. (2002 г.), целью которого была оценка распространенности ПР во время госпитализации в связи с ТСКК и ее влияния на длительность пребывания в стационаре (в днях после трансплантации – день 0) [1], показано, что после коррекции факторов риска, обусловленных госпитализацией и пребыванием в стационаре, расстройства настроения, тревога или нарушения адаптации (р=0,022), ХМЛ (р=0,003) и более высокая токсичность, связанная с лечением (р<0,001), с высокой степенью статистической достоверности ассоциированы с большей длительностью госпитализации (медиана этого показателя составила лдя аффективных, тревожных и расстройств адаптации 22, 24 и 23 дня соответственно, а медиана для делирия – 33 дня). В то же время этот показатель в отсутствие ПР составил 20 дней. Отсюда очевиден вывод о необходимости раннего распознавания и терапии психопатологических расстройств.
Высокая распространенность ПР у больных с ТКМ отмечается и в других сообщениях [130, 131]. В многоцентровом исследовании с участием 215 госпитализированных и амбулаторных больных, выживших после ТСКК и получающих активную терапию, у 47% выявлены психические нарушения: расстройства адаптации (32%), аффективные (6%) и тревожные (2%) расстройства [130].
J.Lavoie и соавт. (2005 г.) [132] выявили в 7 (13,2%) случаях из 53 выживших после аутологичной ТСКК по поводу первичной резистентности или рецидива ЛГМ тревожные либо депрессивные расстройства адаптации. Среди 39 пациентов, перенесших аллогенную (от донора) либо аутологичную (пересадка клеток самого больного, собранных до трансплантации) ТКМ, авторы выявили 9 (23,1%) наблюдений, в которых на дотрансплантационном этапе выявлялись расстройства адаптации с тревогой и/или депрессией. Среди других ПР, выявленных как на до-, так и на посттрансплантационном этапе, зарегистрированы аффективные (3 наблюдения; 7,7%), деперсонализационные (2 наблюдения; 5,1%), а также кратковременное психотическое расстройство (1 наблюдение; 2,6%) и делирий (1 наблюдение; 2,6%).
C.Meyers и соавт. (1994 г.) [133] изучали психогенные расстройства при ТКМ в условиях изоляции. До трансплантации у 40% пациентов выявлялось тревожное расстройство, при этом выраженность тревоги существенно снижается во время госпитализации и остается низкой на весь период катамнеза, а уровень депрессии, напротив, повышается во время госпитализации, но снижается в катамнестическом периоде.
Сопоставимые данные о соотношении тревоги и депрессии в зависимости от этапа трансплантации приводят M.Hjermstad и соавт. (1999, 2004 гг.) [134, 135] в проспективном исследовании (основная выборка – 131 пациент с ЗСК, по поводу которых назначалась ХТ в высоких дозах и алло- либо аутотрансплантация; контрольная – 123 пациента с лимфомами, получавших стандартную ХТ). Авторы отметили, что после аллогенной ТСКК уровень тревоги спустя год был выше, чем в остальных 2 группах (аутоТКМ, ХТ), хотя данные статистически недостоверны.
S.Lee и соавт. (2005 г.) [136] обследовали 80 пациентов с психиатрическими диагнозами или принимавших психотропные средства, перенесших ТСКК. Из них
38 пациентов обследованы с использованием батареи психометрических тестов в предтрансплантационный период; после трансплантации обследованы 55 пациентов. Превышение средних нормативных показателей по шкалам выявлено у 55% обследованных в предтрансплантационном периоде и у 44% после трансплантации.
Следует отметить, что обсуждению проблемы депрессий при ТКМ в литературе, начиная с 70-х годов прошлого века, уделяется особое внимание [137, 138]. A.Molassiotis и P.Morris (1997 г.) [139] отмечают в этих условиях высокую вероятность манифестации выраженной депрессии при ТКМ и приводят 2 наблюдения, в которых депрессия сопровождалась суицидальными попытками после трансплантации, и 1 случай – с суицидальными мыслями в период изоляции. Авторы выделяют факторы суицидального риска: использование высоких доз стероидов, нарушения метаболизма, астенизация, слабая семейная/социальная поддержка, плохой прогноз заболевания, побочные эффекты медикаментов, влияющие на ЦНС, нарушенный образ тела (особенно у подростков или молодых взрослых), бессонница, хронические соматические заболевания, органические поражения ЦНС, недиагностированное (коморбидное депрессии) психическое заболевание, злоупотребление алкоголем/медикаментами, ПР в анамнезе.
В исследовании F.Baker и соавт. (1997 г.) [140], проведенном с использованием опросника Центра эпидемиологических исследований депрессии – Center for Epidemiologic Studies Depression Scale (изучены 437 пациентов с разными онкогематологическими заболеваниями, перенесших ТКМ: аутологичную – 60,6% и аллогенную – 35,4%), депрессивные состояния (без уточнения синдромальной характеристики) выявлены у 1/3 (31%) пациентов.
В некоторых источниках приводятся данные о связи личностных расстройств с ЗСК. Так, J.Matias и соавт. (1995 г.) [145] обследовали 59 женщин (опросник MMPI и шкалы измерения агрессии Ledesma): у 35 диагностирован рак молочной железы (1-я группа) и у 24 – ЗСК (2-я группа), и обнаружили значимые различия личностных черт в сравниваемых группах. У пациенток 1-й группы выявлено достоверное повышение показателей по субшкале социальной интроверсии MMPI и по показателю аутоагрессии, тогда как во 2-й группе зарегистрировано повышение показателей по шкалам ипохондрии, депрессии, паранойи, а также гетероагрессии.
С проблемой ПР у больных, перенесших ТКМ, тесно связан и вопрос комплаенса [14, 141–144]. Повышение восприятия боли и другие субъективно непереносимые ощущения, возникающие при выполнении таких манипуляций у пациентов (и особенно при коморбидной депрессии [144]), могут нарушать комплаентность, что может стать причиной отказа от инвазивных, но необходимых диагностических и лечебных процедур. Особую значимость приобретает проблема комплаенса, когда речь идет о больных, страдающих шизофренией, поскольку в этих условиях наряду с вмешательством по поводу болезни крови необходима адекватная психофармакотерапия [142, 143].
Терапия ПР у больных с ЗСК
В одном из обзоров L.Derogatis и соавт., опубликованных в 1979 г. [146], проанализирована практика назначений психотропных препаратов пациентам 5 крупных онкологических центров (дифференциация онкопатологии не приводится). Из 1579 наблюдавшихся за период исследования в этих центрах психотропные препараты были назначены 51% больных. Наиболее часто назначаемыми препаратами были снотворные средства (48% всех назначений), а также антипсихотики (26%) и транквилизаторы (25%). Только в 1% наблюдений применялись антидепрессанты. При этом 44% психотропных препаратов были прописаны для лечения расстройств сна, 25% – для купирования тошноты и рвоты, около 17% назначено при нозогенных реакциях («психологическом дистрессе»), а назначение 12% препаратов было связано с диагностическими процедурами. Общее соотношение назначений было примерно
2 психотропных препарата на больного за одну госпитализацию. Наиболее часто назначаемыми препаратами (72% всех назначений) были флуразепам (33%), прохлорперазин (21%) и диазепам (17%).
По данным F.Stiefel и соавт. (1990 г.) [147], представивших анализ изменений в применении психотропных средств в онкологической практике (у 33% диагностировано ЗСК) в течение 10 лет, прошедших от публикации цитированной выше работы, назначение психофармакотерапии увеличилось на 30%; расширились также показания к их использованию (в частности, психотропные средства назначались при болевом расстройстве). Однако, несмотря на достаточную осведомленность врачей, психотропные препараты (и особенно антидепрессанты и антипсихотики при нозогениях) используются не в полной мере.
R.Cullivan и соавт. (1998 г.) [148] обследовали 63 пациента, поступивших за полгода под наблюдение психоонкологических служб. Более чем у 1/2 (62%) из них констатированы метастазирование или поздняя стадия заболевания. У 44,5% пациентов выявлены психотические расстройства, а у 40% – нозогении. Потребность в психофармакотерапии оценена в целом в 50–80%; 24% назначались антидепрессанты, 55% – транквилизаторы, 22% – антипсихотики. Авторы отмечают, что в деятельности онкологов психофармакотерапия стала повседневной стратегией, о чем свидетельствует анализ использования антидепрессантов при нозогениях; этот факт указывает и на оптимизацию диагностического процесса, однако психотропные средства (в частности, транквилизаторы) нередко применяются в соответствии с устаревшими рекомендациями.
В ряде работ приводятся результаты анализа эффективности отдельных психотропных препаратов при ПР, сопровождающих течение и лечение различных онкологических заболеваний. При исследовании антидепрессантов [149–156] подтвержден широкий спектр клинической эффективности препаратов разных групп, включая трициклические (амитриптилин, имипрамин), селективные ингибиторы обратного захвата серотонина – СИОЗС (пароксетин, флуоксетин, сертралин), норадренергические селективные серотонинергические антидепрессанты (миансерин), и препаратов двойного действия – ингибиторов обратного захвата серотонина и норадреналина – ИОЗСН (венлафаксин).
В исследовании М.Р.Шафигуллина (2009 г.) [169] изучалась эффективность применения 4 антидепрессантов (эсциталопрам, флувоксамин, сертралин, венлафаксин) при тревожно-депрессивных состояниях, формирующихся у больных раком желудка. Показано, что все применявшиеся препараты обладают высокой эффективностью при изученных состояниях. Использование тимоаналептиков, способных воздействовать на 2 и более нейротрансмиттерные системы (трициклические антидепрессанты, препараты двойного действия), позволяет успешно сочетать собственно антидепрессивное действие с положительными соматотропными эффектами. При этом регистрируется положительный эффект при купировании болевых синдромов и соматовегетативных расстройств в форме приливов [157], коррекции неврологических осложнений ХТ, включая нейропатическую боль [158], нейросенсорную токсичность [159, 160], постмастэктомический болевой синдром [161] и стойкую нейропатию [162]. В контексте переносимости и безопасности предпочтение отдается антидепрессантам новых поколений, значительно превосходящих по этим показателям традиционные тимоаналептики [163–168].
В литературе приводится несколько сообщений об успешной терапии психотических расстройств, коморбидных болезням системы крови. В казуистических описаниях I.Michopoulos и соавт. (2007 г.) [170] и P.Sirota и соавт. (1988 г.) [81] рассматриваются случаи эффективного и безопасного применения кветиапина у пациентки с биполярной депрессией, перенесшей ТКМ по поводу ОМЛ, и купирования бредовой депрессии (возникла после внутривенного введения ацикловира) при комбинированной терапии галоперидолом в сочетании с мапротилином у пациента с хроническим лимфолейкозом (ХЛЛ). По наблюдениям D.Dixon и J.Craven (1993 г.) [172], при делириозных расстройствах у больных с ЗСК эффективно длительное внутривенное введение галоперидола.
S.Passik и M.Cooper (1999 г.) [171] приводят рекомендации по терапии делириозных расстройств у больных с ЗСК: лечение основного заболевания с отменой препаратов, необязательных на данном этапе терапии и способных усугубить нарушения сознания, назначение антипсихотических средств для купирования возбуждения и продуктивных психопатологических расстройств. При этом предпочтительно применение атипичных антипсихотиков, реже вызывающих побочные экстрапирамидные эффекты.
Данные о терапии нозогенных реакций у больных с ЗСК ограничены описанием 2 казуистических случаев: купирование панической атаки у больного острым лейкозом клоназепамом в дозе 2 мг/сут [61] и клаустрофобии (больной ХМЛ, перенесший ТСКК) при назначении лоразепама в дозе 2 мг/сут [173].
Представленные данные литературы свидетельствуют о клинической гетерогенности и широком спектре (от астенических реакций до делириозных состояний) психопатологических расстройств, выявляемых при ЗСК. В качестве основных факторов риска являются тяжелое течение основного заболевания, проведение ХТ (и особенно кортикостероидов), пожилой возраст пациентов. В большинстве случаев нозогенных реакций наблюдается сочетание нескольких факторов риска (как общих, так и специфических). В контексте переносимости и безопасности предпочтение при проведении психофармакотерапии отдается атипичным антипсихотикам и антидепрессантам новых поколений (СИОЗС, ИОЗСН).
Сведения об авторе
Выборных Дмитрий Эдуардович – д-р мед. наук, врач-психиатр, рук. группы по изучению психических расстройств при заболеваниях системы крови ФГБУ ГНЦ Минздрава РФ. E-mail: dvyb@ya.ru
Сопоставимые показатели распространенности ПР при ЗСК (37,5–48%) представлены в работах J.Prieto и соавт. (2002 г.), D.Stark и соавт. (2002 г.), T.Sasaki и соавт. (2000 г.) и G.Lloyd и соавт. (1984 г.), проводивших исследования на выборках пациентов с разными гематологическими нозологиями.
Так, J.Prieto и соавт. (2002 г.) [1] в рамках проспективного исследования, проведенного с июля 1994 по август 1997 г., наблюдали 220 больных в возрасте от 16 до 65 лет с различными формами лейкозов, перенесших трансплантацию костного мозга (ТКМ). Авторы оценивали психическое состояние пациентов при поступлении и еженедельно во время госпитализации до выписки или смерти. Распространенность ПР в изученной выборке составила 44,1%. Расстройства настроения диагностированы в 14,1% (31 наблюдение) случаев, из них в 12,3% (27 наблюдений) – большой депрессивный эпизод, в 0,9% (2 наблюдения) – дистимическое расстройство, в 1,4% (3 наблюдения) – индуцированное кортикостероидами расстройство настроения. Тревожные расстройства выявлены у 8,2% (18 наблюдений) пациентов, из них фобическое расстройство – у 1,8% (4 наблюдения), генерализованное тревожное расстройство – у 1,8% (4 наблюдения), паническое расстройство – у 1,4% (3 наблюдения), индуцированное кортикостероидами тревожное расстройство – у 4,0% (9 наблюдений).
Распространенность расстройств адаптации составила 50 (22,7%) наблюдений, из них депрессивные реакции – 16 (7,3%), с тревогой – 15 (6,8%), смешанное (тревожно-депрессивное) расстройство – 19 (8,6%) наблюдений. Делирий зафиксирован у 16 (7,3%) пациентов. D.Stark и соавт. (2002 г.) [2] в исследовании с участием 178 пациентов с неходжкинскими лимфомами, лимфогранулематозом (ЛГМ), плазмоклеточными гемобластозами (включались также пациенты с меланомой) выявили тревожное расстройство в 48% наблюдений.
По данным T.Sasaki и соавт. (2000 г.) [3], ПР диагностированы у 16 из 39 (41%) пациентов, страдающих лейкозами. В исследовании G.Lloyd и соавт. (1984 г.) 15 из 40 (37,5%) пациентов со злокачественными лимфомами, относящимися к наиболее тяжелому полюсу ЗСК, имели значимую психическую патологию [4].
Данные еще 2 исследований несколько отличаются от предыдущих. Так, T.Hosaka и соавт. (1994 г.) провели исследование, в котором выделяли отдельные типы ПР у 31 пациента с ЗСК. Использование в работе более строгой методики (структурированное интервью, основанное на критериях DSM-IV) может объяснить тот факт, что ПР установлены у значительно меньшей доли (29%) больных в сравнении с данными цитированных выше работ [5].
С другой стороны, F.Hurtado и соавт. (1993 г.) [6] в результате обследования однородной группы из 22 пациентов с лейкозами выявили психические нарушения в 77% наблюдений. Хотя авторы не предлагают собственного объяснения столь высокого показателя, более чем в 2 раза превосходящего значения, полученные в большинстве других работ, можно предположить, что одной из причин такого расхождения является влияние фактора тяжести соматического состояния, традиционно рассматриваемого как значимый предиктор более высокой частоты и выраженности психической патологии, коморбидной соматическим заболеваниям [7].
Таким образом, несмотря на отмеченные расхождения в данных, ЗСК характеризуются высокой коморбидностью с ПР, что подтверждает актуальность дальнейшего их изучения.
Влияние ПР на течение ЗСК
Сведения о неблагоприятном влиянии коморбидных ПР на клинический исход и качество жизни больных с ЗСК представлены в табл. 1.

Соматогенные психозы
Типологическая дифференциация соматогенных психозов, несмотря на бесспорную научную и практическую актуальность, оставалась до последнего времени недостаточно разработанной. В большинстве исследований полиморфные проявления соматогенных психозов либо объединялись собирательным термином «психоз», либо квалифицировались в соответствии с этиопатогенетическим фактором, которому отводилась роль ведущего классифицирующего признака.
В рамках первого из этих направлений объединяются гетерогенные по своим клиническим проявлениям психозы – от абортивных (субсиндромальных) форм до клинически завершенных и затяжных. При обсуждении изучаемых психопатологических расстройств ряд авторов указывают, что такие нарушения при ЗСК ограничиваются формированием отдельных признаков расстройств восприятия (гипнагогические галлюцинации) и аффективных нарушений (растерянность и тревога) на фоне астении [15–17].
J.Haber (1952 г.), описывая соматогенные психозы при полицитемии [18], указывал, что психопатологическая картина ограничивается состояниями оглушенности, спутанности и зрительными галлюцинациями. Другие исследователи выделяют более сложные психопатологические расстройства (в основном в терминальном периоде ЗСК) – аментивное помрачение сознания, эпилептиформное возбуждение, делириозное помрачение сознания, бредовые расстройства [19–22, 25].
В отечественной литературе также приводятся основанные на казуистических наблюдениях указания на возможность развития соматогенных психозов у больных с ЗСК. Так, В.И.Максименко (1967 г.) наблюдал 2 случая соматогенных психозов у больных ЛГМ: фантастически-иллюзорный онейроид с тревогой и подавленностью на фоне соматогенной астении и «гипоактивный» делирий (астенические расстройства с присоединением явлений дезориентировки и гипнагогических галлюцинаций) [20].
К.В.Москети и К.С.Терновой (1970 г.) наблюдали развитие галлюцинаторно-бредового синдрома у больного эритремией [26] и выдвинули предположение о связи психопатологических расстройств с коагулологическими, ассоциированными с нарушениями трофики мозговой ткани, характерными для эндартериита. Целенаправленное изучение психической патологии при ЗСК представлено в работах Б.А.Целибеева, результаты которых обобщены в монографии «Психические нарушения при соматических заболеваниях» (1972 г.) [25]. Автор подчеркивает, что в терминальном периоде острых лейкозов психотические нарушения, которым предшествует тяжелая астения, а нередко и апатическая депрессия, встречаются довольно часто. При этом преобладают делириозные расстройства – от редуцированного до «гиперактивного» делирия.
В исследовании, датированном 1964 г. (выполнено в соавторстве), в период обострения хронического миелолейкоза (ХМЛ) выявлено формирование на фоне тяжелой астении и обнубиляции сознания депрессивного состояния с бредовыми идеями самообвинения и отравления. Авторы приводят 2 случая соматогенных психозов у больных ЛГМ (у одного из пациентов выявлен бред отравления, завершившийся в терминальной стадии заболевания присоединением расстройств сознания с аменцией; у другого – в периоды ухудшения соматического состояния – психомоторное возбуждение с отрывочными бредовыми идеями, слуховыми и зрительными галлюцинациями). При полицитемии (эритремии) авторы отметили у 4 больных манифестацию шизофреноподобного психоза с развитием обманов восприятия (угрожающие убийством «голоса» соседей внутри головы); редукция психотической симптоматики сопровождалась становлением астении. В другом случае развитию бреда преследования и самообвинения и затем синдрома Котара предшествовал дебют с тревогой и страхами. У 2 других пациентов выявлены острый параноидный психоз и органическая деменция [19].
Таким образом, психозы у больных с ЗСК чаще всего проекают в форме делириозных расстройств, распространенность которых, по данным J.Prieto и соавт. (2002 г.), составляет 7,3% [1], а по результатам других исследований [23, 24] этот показатель достигает 41–43%. Можно предположить, что приведенные расхождения связаны с различиями по признаку степени тяжести ЗСК в изученных выборках.
В этом контексте можно рассматривать результаты, полученные другими авторами. Так, J.Fann и соавт. (2002 г.) выявили признаки делириозного помрачения сознания более чем у 1/2 (54%) больных, перенесших ТКМ. Авторы выделяют факторы риска претрансплантационных делириев: низкое когнитивное функционирование, высокий уровень азота мочевины, щелочной фосфатазы, также солей магния крови, дефицит физической активности. Кроме того, развитию тяжелого делирия в период ТКМ, по мнению авторов, способствует высокий уровень креатинина крови, перенесенное тотальное облучение, предельно высокий показатель щелочной фосфатазы, женский пол, пожилой возраст и злоупотребление алкоголем либо наркотическими препаратами [28]. Высокие цифры распространенности, судя по данным, приводимым в статье, можно объяснить преобладанием пациентов с диагнозами тяжелой онкогематологической патологии (острые лейкозы, лимфосаркомы), а также значительной долей среди них лиц с медикаментозной/алкогольной зависимостью и делириозными расстройствами в анамнезе.
D.Ross и C.Alexander (2001 г.), описывая делириозное помрачение сознания у онкологических больных, акцентируют внимание на том факте, что в терминальной стадии таких заболеваний (включая болезни крови) распространенность делирия может достигать 85% [29]. В качестве факторов, способствующих развитию делирия, авторы выделяют гипоксию, наличие инфекции (например, банальная инфекция мочевых путей), лихорадку, обезвоживание, реакцию отмены опиоидов либо бензодиазепинов. Исследование показало, что делирий обратим приблизительно у 50% терминальных пациентов. Авторы отмечают и факторы, ассоциированные с повышенным риском делирия у пациентов старше 80 лет: нарушение зрения, тяжелые сопутствующие соматические заболевания, признаки дегидратации, когнитивные нарушения, а также соматогенную астению.
В ряде работ приводятся казуистические наблюдения. Так, S.Passik и M.Cooper (1999 г.) описывают 59-летнюю женщину с острым миелобластным лейкозом (ОМЛ) и болями неясной этиологии, у которой развился делирий, причем повышение дозы прохлорперазина осложнилось экстрапирамидным синдромом [30].
B.Meyers и R. van Ojen (2004 г.) выявили у пациента 21 года с В-клеточной лимфомой манифестировавший на фоне соматогенной астении гипоактивный делирий, ограниченный дезориентировкой в пространстве и времени и отрывочными «видениями»; состояние купировано психостимулятором метилфенидатом [31]. M.Chawla и J.Lindesay (1993 г.) приводят наблюдение 65-летней женщины с эритремией и делирием [33].
P.Silberfarb и G.Bates (1983 г.) приводят 5 наблюдений (больные среднего и пожилого возраста с множественной миеломой – ММ тяжелого течения, требующего применения высоких доз химиотерапевтических препаратов, в том числе кортикостероидов) [32]; у 4 пациентов зарегистрировано делириозное помрачение сознания, у 1 – делирий сменился депрессией.
Приводятся указания на вероятность возникновения делириозных расстройств при ММ и острых лейкозах, сопровождающихся характерной для этого заболевания гипераммониемической энцефалопатией [34–36].
В качестве еще одного фактора риска соматогенных психозов при злокачественных ЗСК рассматривается органическое поражение центральной нервной системы (ЦНС) с метастазированием в оболочки и ткань головного либо спинного мозга (нейролейкемия). Развитие психозов предпочтительно для острых лейкозов, протекающих с гиперлейкоцитозом (содержание лейкоцитов в периферической крови более 30¥109/л), хотя при нейролейкемии они наблюдаются достаточно редко [37].
В то же время нейролейкемия рассматривается в качестве значимого фактора развития психоза, завершающегося формированием слабоумия [38]. Вовлечение ЦНС в поражение лейкемическими клетками является хорошо распознаваемым осложнением острого лимфобластного лейкоза (ОЛЛ) у детей, но с улучшением результатов системной терапии и длительным выживанием распространенность этого осложнения повышается и у взрослых. Среди психопатологических расстройств, сопряженных с нейролейкемией, авторы упоминают психоорганические синдромы.
Среди поражений ЦНС, которые могут вызывать ПР у больных с ЗСК, упоминается «синдром Офелии» – паранеопластический лимбический энцефалит, описанный у больных ЛГМ [39], на фоне которого вероятно развитие делириозного помрачения сознания [40].
В исходе делириозного помрачения сознания у больных с ЗСК многие авторы наблюдают энцефалопатию с когнитивными расстройствами. Так, J.Fann и соавт. (2007 г.) отмечают, что у больных, перенесших делирий во время миелоаблативной трансплантации стволовых клеток крови (ТСКК), в течение 80 дней после перенесенного психоза сохраняются когнитивные расстройства [41]2.
В числе других расстройств сообщается о развитии у больного ОЛЛ параноидного психоза, при котором после этапа антипсихотической терапии, приведшей к злокачественной нейролепсии, в качестве лечебного метода была избрана электросудорожная терапия (ЭСТ) [21].
M.Jablonski и соавт. (2002 г.) описывают манифестацию соматогенно провоцированного депрессивно-параноидного психоза у пациентки с острым лейкозом, развившегося при проведении полихимиотерапии (ПХТ) и ТКМ и потребовавшего госпитализации в психиатрическую клинику [42].
Психотическую депрессию при эритремии (по 1 наблюдению) выявили D.Murray и R.Hodgson (1991 г.) [43], M.Mazzoli и F.Benazzi (1992 г.) [44], а также C.Fones и W.Tsoi (1995 г.) [45].
Два наблюдения, расцененные авторами публикаций в качестве психогенных психозов, позволяют (с учетом характеристики дебюта и клинической картины) усомниться в такой квалификации и предположить соматогенную природу страдания.
D.Moss (1980 г.) описывает случай развития параной-яльных расстройств у мужчины, страдающего ХМЛ (без манифестных психозов в анамнезе) [46]. На завершающей стадии курса ХТ (спустя 2 нед с момента стационирования) у пациента снизилось настроение, он отказывался от исследований и лечения, заявляя, что в последние 2 дня врачи пытаются его убить. В дальнейшем присоединились идеи способности самостоятельно контролировать такие проявления болезни, как температура тела и число лейкоцитов в крови. Был уверен, что сосредоточение на этих параметрах, сообщаемых врачу, предотвратит любое ухудшение. Такое состояние длилось менее недели и купировалось самостоятельно после завершения курса ХТ. Автор статьи трактует описанные бредовые симптомы в психодинамических терминах. С нашей точки зрения, на основании констатации у больного связи бредовых расстройств с гипотимическими проявлениями, а также спонтанного их купирования по завершении воздействия соматогенного фактора – ПХТ, состояние, наблюдавшееся у пациента, представляет собой транзиторный соматогенный психоз депрессивно-бредового содержания.
M.Irwin (1984 г.) описывает острый психотический эпизод у 13-летнего подростка, страдающего ОЛЛ. На фоне проведения ПХТ и массивной антибактериальной терапии мальчик в течение 2 сут испытывал выраженную тревогу и бессонницу. Он утверждал, что его мозг «переключился», превратился в кубик Рубика и правильное решение головоломки содержит ответы на вопросы его жизни и смерти. Казалось, что кубик позволяет ему читать мысли других людей, а те в свою очередь считывают информацию с его мозга. Периодически становился крайне возбужденным, кричал, что через его мозг протекает слизь и засоряет его. Схема терапии была дополнена антипсихотическими средствами (кветиапин в дозе 400 мг/сут) и рациональной психотерапией. Примерно через неделю состояние улучшилось, а через 2 мес антипсихотики были отменены. При катамнестическом обследовании (через год) больной остается в ремиссии без ПР. Автор утверждает, что в данном случае манифестации психоза способствовало не токсическое действие цитостатических препаратов (чему есть немало свидетельств в литературе), а психотическое состояние – «эмоциональная реакция» на болезнь крови [47]. Тем не менее на полном основании можно расценивать данное наблюдение в рамках соматогенно провоцированного (лимфобластный лейкоз, воздействие цитостатических препаратов и облучения) приступа шизофрении с элементами синдрома Кандинского–Клерамбо.
F.Stiefel и соавт. (1989 г.) [51] указывают, что, несмотря на безусловный положительный эффект, связанный с внедрением кортикостероидных гормонов при онкологических заболеваниях, их применение может сопровождаться формированием психопатологических расстройств (ятрогенные/фармакогенные эффекты). Тяжелые аффективные расстройства в результате применения кортикостероидов в настоящее время регистрируются все реже, но наблюдаются невыраженные изменения настроения (от эйфории в начале лечения до депрессивных расстройств при возобновлении симптомов основного заболевания)3.
Авторы подчеркивают, что назначение кортикостероидов должно проводиться с учетом психиатрического анамнеза, соматического статуса, локализации онкологического процесса, лечения, наличия болевого синдрома, осложнений – особенно со стороны ЦНС. Сведения о наблюдениях, в которых выявлены психотические состояния, связанные с приемом кортикостероидных препаратов, представлены в табл. 2.
Приводятся также описания фармакогенных психозов, манифестация которых связана с использованием некортикостероидных цитостатических препаратов (табл. 3).

Интерферон a (ИФН-a), иммуномодуляторный цитокин используется для лечения некоторых заболеваний, включая хронический гепатит, меланому и ХМЛ. Во время терапии ИФН-a могут возникнуть тяжелые ПР, включающие депрессию с суицидальными мыслями и параноидные психозы [63].
При использовании ИФН-a описываются психотические состояния, протекающие с аффективными расстройствами как депрессивного [64–66], так и маниакального [67] полюса, а также биполярные [68].
A. van Gool и соавт. (2003 г.) отмечают, что ИФН-a способен индуцировать депрессивную симптоматику, но вероятность возникновения при его приеме других ПР не столь очевидна. Приемлемой патофизиологической теории цитокин-индуцированных ПР не существует, однако эмпирически такая связь подтверждается некоторыми исследователями [69] (табл. 4).

Рассматривается также развитие ПР в связи с применением других медикаментозных средств. В частности, приводится случай развития «вторичной тревоги» при назначении противорвотного препарата ондансетрон (зофран) у пациентки, поступившей для проведения аллогенной ТКМ по поводу ХМЛ (Ph-позитивного) [82]. На 2-й день приема зофрана у больной развился (судя по клиническому описанию) эпизод острой генерализованной тревоги. Состояние обошлось после назначения лоразепама в дозе 1 мг/сут. Неврологических нарушений выявлено не было. Ондансетрон был временно отменен, однако при возобновлении приема препарата вновь развилась тревога: пациентка жаловалась, что «сама не своя» – не может из-за рассеянности четко мыслить. Состояние купировано при помощи лоразепама в той же дозе. J.Caplan (2006 г.) [83] приводит наблюдение, в котором пациент через 4 ч после 1-кратного приема препарата ATRA4, используемого для лечения острого промиелоцитарного лейкоза, стал жаловаться на выраженную тревогу, вслед за которой манифестировал делирий, купировавшийся через 48 ч внутривенными инфузиями галоперидола.
Казуистика, в которой описываются соматогенные психозы при ЗСК, осложненных вирусным энцефалитом (герпетическая инфекция), приводятся в отдельных работах (табл. 5), что не позволяет высказать окончательное суждение об особенностях психопатологических проявлений подобных расстройств.
Таким образом, можно констатировать, что основными факторами риска возникновения психотических расстройств у больных с ЗСК являются тяжелое течение основного заболевания, проведение ХТ, в том числе с использованием кортикостероидных препаратов, электролитные нарушения и пожилой возраст пациентов.
Нозогенные реакции
По данным разных авторов, психогенные расстройства, связанные с ситуацией соматического заболевания (нозогении, расстройства адаптации по Международной классификации болезней 10-го пересмотра – МКБ-10), относятся к наиболее частым формам ПР у пациентов стационаров общесоматического профиля и амбулаторных учреждений [84]. Наиболее высокие показатели распространенности нозогенных реакций отмечаются у пациентов, страдающих тяжелыми, угрожающими жизни соматическими заболеваниями, к числу которых относятся онкологические заболевания.
Распространенность нозогенных реакций у пациентов со злокачественными новообразованиями варьирует в достаточно широких пределах – от 20 до 100%, что зависит от методологических и диагностических подходов, используемых разными исследователями [85–93].
Анализ работ, посвященных нозогенным реакциям (расстройствам адаптации) у больных с ЗСК, затрудняется тем, что некоторые из них были выполнены на малых выборках и даже отдельных казуистических наблюдениях, а часть из них опирается исключительно на психометрические методики. По данным разных авторов [1, 3, 94], распространенность расстройств адаптации у данного контингента больных варьирует в пределах 22,6–53,3%.
По данным J.Prieto и соавт. (2002 г.) [1], расстройства адаптации, эквивалентные нозогениям в отечественной литературе, выявляются у 22,7% пациентов. T.Sasaki и соавт. (2000 г.) [3] среди 39 обследованных больных с ЗСК у 9 (23%) выявили расстройства адаптации. Сопоставивые расчеты приводит T.Hosaka и соавт. (1994 г.) [5]: 7 из 31 (22,6%) больного – с расстройствами адаптации. F.Hurtado и соавт. (1993 г.) [6] при обследовании 22 пациентов с острыми лейкозами у 17 (77%) выявили ПР, среди которых наиболее частыми оказались расстройства адаптации (82%) и психосоматические нарушения (59%).
Среди расстройств адаптации выделяют в основном тревожные расстройства, посттравматическое стрессовое расстройство (ПТСР) и депрессивные расстройства. Так, J.Devlen и соавт. (1987 г.) [95] оценивали 90 пациентов в среднем через 32 мес после установления диагноза лимфогранулематоза или неходжкинских лимфом.
В результате психиатрического обследования у 48 (53,3%) пациентов выявлено тревожное, депрессивное либо сочетанное тревожно-депрессивное расстройство адаптации, из них у 21 (23,3%) пациента – синдромально завершенное, у 27 (30%) – субсиндромального (пограничного) уровня.
M. dos Santos и соавт. (1991 г.) обобщили дланные, полученные в течение года в гематологическом отделении больницы. В течение 6-месячного периода авторы обследовали группу госпитализированных пациентов с лейкозами, лимфогранулематозом и неходжкинскими лимфомами с использованием полуструктурированного интервью. Распространенность расстройств адаптации (депрессивных и/или тревожных) была оценена
(с использованием диагностических критериев DSM-IIIR) в пределах 20–40% [94, 96].
Распространенность расстройств адаптации, протекающих с преобладанием тревоги, по данным разных авторов, составляет 6,5–33%. Так, D.Stark и соавт. (2002 г.) [2] при обследовании 178 пациентов выявили 18% пациентов, которые соответствовали критериям МКБ-10 для тревожных нозогений. Последние, согласно обзору литературы, выполненному T.Sasaki и соавт. (2000 г.), составляют 20–33% [99–101]. T.Hosaka и соавт. (1994 г.) из 31 пациента с ЗСК выявили 2 (6,5%) пациентов с тревожными нозогениями [5].
Некоторые авторы выделяют среди тревожных расстройств у пациентов с ЗСК состояния, расцениваемые ими как ПТСР. Так, в исследовании E.Black и C.White (2005 г.) [97] изучены 36 пациентов [использовались опросники: PTSD Checklist Civilian Version (PCL-C), the Impact of Events Scale-Revised (IES-R) и 2 опросника страха рецидива]. У 17% обследованных выявлялись признаки ПТСР, причем между страхом рецидива и ПТСР обнаружены статистически значимые корреляции.
В исследовании S.Smith (2008 г.) [98] у 7,9% пациентов с неходжкинскими лимфомами выявлено соответствие полным критериям ПТСР и еще у 9,1% – частичным. Факторами риска, независимо связанными с ПТСР, были отсутствие социальной поддержки, негативная оценка жизненных перспектив и интенсивность терапии, а положительно – трудовая занятость, наличие страховки. Кроме того, некоторые демографические характеристики (принадлежность к негроидной расе, низкий уровень образования, молодой возраст) и клинические факторы, связанные со здоровьем (активность заболевания, недавно установленный диагноз, высокая коморбидность), были независимо связаны с ПТСР.
При ЗСК выявляются депрессии, включая нозогенные. A.Frances и M.Popkin [99] приводят наблюдение, в котором депрессия сформировалась через 6 мес после установления диагноза острого лимфобластного лейкоза и проведения курса ХТ. В структуре депрессивного симптомокомплекса значительное место занимали ипохондрические расстройства. Авторами диагностирован органический депрессивный синдром, но мы рассматриваем данное состояние как нозогенную депрессию, поскольку она развилась вне непосредственного воздействия соматогенных факторов и вслед за психотравмирующими событиями (болезнь крови).
В другом клиническом наблюдении C.Fones и W.Tsoi (1995 г.) [105] описали пациентку с эритремией, у которой это заболевание манифестировало одновременно с депрессией, имеющей признаки как нозогенного, так и органического расстройства.
P.Davidson (1964 г.) [106] приводит наблюдение, иллюстрирующее развитие конверсионного расстройства (заикание) в рамках истеро-депрессивной нозогении у больного ЛГМ.
T.Sasaki и соавт. (2000 г.) [3] приводят собственные данные о частоте депрессивных нозогений на выборке из 39 (8%) пациентов с лейкозами и указывают, что, по данным разных авторов, распространенность таких расстройств составляет от 20 до 40% [100–103]. К сожалению, авторы не обсуждают различия в значениях соответствующих показателей, обнаруженные в цитируемом исследовании и работах других авторов (8% против 20–40%).
T.Hosaka и соавт. (1994 г.) [5] выявили нозогенные депрессии у 5 из 31 (16,1%) пациента с ЗСК. K.Malyszczak и соавт. (2005 г.) установили, что депрессивные расстройства адаптации встречаются в 29% случаев ЗСК (по сравнению с 11% у пациентов с другими соматическими заболеваниями) [104].
В литературе приводятся факты, свидетельствующие о возможности развития при ЗСК не только тревожных и депрессивных, но и других расстройств круга «малой» психиатрии.
H.Onishi и соавт. (2004 г.) [107] описали конверсионное расстройство с истерическими судорогами вплоть до «истерической дуги» у 21-летней пациентки с ОМЛ. Психотравмирующая ситуация, связанная с ТКМ, усугублялась тем обстоятельством, что рецидив болезни у пациентки совпал с обострением лейкоза у ее близкого друга, вследствие которого он погиб.
Некоторые авторы указывают на возможность развития соматоформных расстройств у больных лимфогранулематозом. W.Weddington (1982 г.) и D.Cella и соавт. (1986 г.) отмечают, что у больных с этой патологией, получающих ПХТ, нередко возникает психогенная тошнота, иногда с рвотой [108, 109].
R.Nesse и соавт. (1983 г.) приводят 6 наблюдений, в которых описывается развитие необычных и стойких вкусовых и обонятельных ощущений, повторяющих вкус и запах ранее вводимых химиотерапевтических препаратов у больных, страдающих ЛГМ и гистиоцитарной лимфомой. Такие ощущения возникали при выполнении действий, ассоциирующихся у больных с посещением клиники и ситуацией введения препаратов (выход из автомобиля, на котором приезжали в клинику, размышления о проведенном несколько месяцев тому назад лечении и его перспективах, необходимости посетить клинику, воспоминания о введении препарата). Описанные ощущения авторы расценивают как псевдогаллюцинации у непсихотических больных в состоянии ясного сознания и интерпретируют этот феномен в рамках стрессовых реакций или травматического невроза [110]. Мы рассматриваем такие состояния в рамках ПТСР.
Приводятся сообщения (3 из них описаны нами в разделе «Соматогенные психозы») о возможности манифестации у больных с ЗСК психогенных психозов. B.Wank (1982 г.) [111] приводит наблюдение, в котором у 59-летней женщины, никогда ранее не обращавшейся к психиатру, было заподозрено ЗСК (эритромиелоз), при дальнейшем обследовании выявлен лейкоз. Узнав о своей болезни, больная перенесла кратковременное бредовое расстройство с несистематизированными идеями преследования (бред приписанной болезни). Пациентка обнаружила тревогу, утверждала, что врачи скрывают от нее диагноз смертельного заболевания и тем самым хотят ее убить. В течение 3 дней на лечении галоперидолом (10 мг/сут) в сочетании с психотерапией состояние обошлось; психотических расстройств не наблюдалось. Пациентка заявляла, что почувствовала облегчение после установления точного диагноза. Обсуждение наблюдения проводится с психологических позиций: авторы утверждают, что ситуация двойственности (в приведенном случае – неясность диагноза) порождает тревогу, которую можно редуцировать путем внесения определенности в сообщаемую пациентке информацию.
Факторы риска нозогений у больных с ЗСК складываются из общих для всех соматических заболеваний, а также специфических для данного вида патологии. Среди первых – объективная выраженность проявлений болезни (тяжесть течения), особенности ее лечения и исхода. Так, нозогении чаще формируются при острых и тяжелых соматических страданиях, негативно влияющих на качество жизни (снижение работоспособности, высокая вероятность инвалидизации).
К числу этих факторов принадлежат также конституциональные (расстройства личности), социальные (уровень образования, материальной обеспеченности и т.д.), нозогенные (семантика диагноза, условия специализированного стационара в окружении тяжелобольных) [7].
Ко 2-й группе факторов риска (специфических для ЗСК) исследователи относят степень анемии и особенности течения конкретного ЗСК. Так, F.Hurtado и соавт. (1993 г.) [6] подчеркивают, что степень анемии коррелирует с частотой формирования депрессивных и прежде всего астено-депрессивных состояний; в свою очередь быстро прогрессирующее течение гематологического заболевания с развитием тяжелых рецидивов, поражением многих групп лимфоузлов также способствует манифестации тревожных и депрессивных расстройств и необходимости нахождения в специализированном стационаре.
Мнения по поводу участия гендерных факторов в формировании нозогенных реакций при ЗСК неоднозначны и даже противоречивы. Если одни авторы [2, 3, 9, 112] относят к факторам риска нозогений женский пол, то другие приводят противоположные результаты. Так, в исследовании B.Kawiecka-Dziembowska и соавт. (2005 г.) [113] показано, что более тяжелые депрессии чаще выявляются у мужчин. Приведенные расхождения могут быть связаны с гетерогенностью гематологических нозологий, включаемых в выборки исследований. Дело в том, что распределение по полу меняется в зависимости от конкретной формы гематологического заболевания (от 1,3:1 до 4:1) [114–119].
Отдельно выделяются побочные явления специфической терапии (формирование агранулоцитоза, сопровождающееся грибковым поражением слизистой ротоглотки, кишечника; тромбоцитопении с геморрагиями; сопутствующие инфекционные заболевания – пневмония и пр.). Так, по сведениям J.Devlen и соавт. (1987 г.), аффективные расстройства положительно коррелируют с подобными эффектами лечения [95].
В большинстве же случаев, как указывают не только авторы цитированной работы, но и другие исследователи [1, 6, 95, 98], при развитии нозогений наблюдается сочетание нескольких факторов риска (как общих, так и специфических).
ТКМ/ТСКК
Одной из ситуаций, в которых нозогении возникают особенно часто (более 50%), является ТКМ (ведущий метод лечения при злокачественных заболеваниях [123]) либо ТСКК [120–122]. Успешное проведение трансплантации требует изоляции пациентов в течение нескольких недель во избежание инфицирования, а также строгого соблюдения врачебных рекомендаций, поскольку предполагается возможность ухудшения физического состояния пациентов в ходе собственно вмешательства и приема лекарственных препаратов.
D.Wolcott (1993 г.) [124] выделяет следующие критические психиатрические проблемы, возникающие при ТКМ: 1 – разработка психиатрических/психосоциальных критериев отбора пациентов на трансплантацию,
2 – обеспечение оптимальных психосоциальных служб для пациентов, ожидающих трансплантацию, 3 – диагностика и лечение ПР, возникающих в процессе трансплантации, 4 – оказание помощи членам семей пациентов,
5 – предотвращение и купирование некомплаентности, 6 – участие в долговременной реабилитации пациентов после ТКМ, 7 – реабилитационная (психосоциальная) работа с пациентами, перенесшими трансплантацию.
Ситуация ТКМ на всех стадиях сопряжена с высоким риском развития психопатологических расстройств. Так, T.Sasaki и соавт. (2000 г.) среди 39 пациентов с различными формами лейкоза, перенесших трансплантацию, выявили 16 больных с ПР (12 – расстройства адаптации тревожного и/или депрессивного содержания,
2 – деперсонализационные расстройства и по одному наблюдению – кратковременное психотическое расстройство и делирий). Авторы не отметили различий в особенностях манифестации ПР в зависимости от типа ТКМ [3].
В обзоре, посвященном психиатрическим и психосоциальным аспектам ТКМ, M.Andrykowski (1994 г.) [125] в качестве наиболее значимых психотравмирующих факторов выделяет: изоляцию в стерильном боксе, быструю и непредсказуемую смену физического состояния, частые инвазивные медицинские процедуры, побочные эффекты терапии, зависимость от медицинского персонала, повторные инфекции, реакцию «трансплантат против хозяина». Ургентное вмешательство сопряжено с выявлением тревожных и депрессивных реакций, гнева и враждебности, «вины выжившего», инсомнии, анорексии, бредовых образований и «отыгрывания» в качестве одной из наиболее частых психологических защит; нередко наблюдается нарушение терапевтического сотрудничества (нонкомплаенс). Касаясь психиатрических аспектов выделенных проблем, M.Andrykowski отмечает важность своевременного (на дотрансплантационном этапе) выявления ПР, которые могут повлиять в дальнейшем на течение вмешательства. К таким состояниям автор относит депрессивные расстройства и расстройства личности, которые могут быть связаны с длительностью выживания после трансплантации. Важность распознавания ПР на всем протяжении трансплантации автор объясняет тем, что последние подавляют взаимодействие с персоналом, проводящим трансплантацию; ограничивают рациональное принятие решения относительно стоимости и пользы операции; снижают усвоение информации, получаемой в процессе проведения терапии. Среди таких расстройств выделяются депрессивные состояния, достигающие уровня большого депрессивного эпизода как на этапе «подготовительной» фазы ТКМ [126], так и в сочетании с коморбидной тревогой на этапе перед поступлением в стационар [127]. Среди симптомов, сопровождающих ранний посттрансплантационный период, выделяют симптомы тревоги и депрессии (от мягких до умеренных) [128], а в отдаленном посттрансплантационном периоде – симптомы депрессии и ПТСР. В качестве предикторов риска авторы выделяют избегающее совладание и отсутствие социальной поддержки [129].
В уже упоминавшемся исследовании J.Prieto и соавт. (2002 г.), целью которого была оценка распространенности ПР во время госпитализации в связи с ТСКК и ее влияния на длительность пребывания в стационаре (в днях после трансплантации – день 0) [1], показано, что после коррекции факторов риска, обусловленных госпитализацией и пребыванием в стационаре, расстройства настроения, тревога или нарушения адаптации (р=0,022), ХМЛ (р=0,003) и более высокая токсичность, связанная с лечением (р<0,001), с высокой степенью статистической достоверности ассоциированы с большей длительностью госпитализации (медиана этого показателя составила лдя аффективных, тревожных и расстройств адаптации 22, 24 и 23 дня соответственно, а медиана для делирия – 33 дня). В то же время этот показатель в отсутствие ПР составил 20 дней. Отсюда очевиден вывод о необходимости раннего распознавания и терапии психопатологических расстройств.
Высокая распространенность ПР у больных с ТКМ отмечается и в других сообщениях [130, 131]. В многоцентровом исследовании с участием 215 госпитализированных и амбулаторных больных, выживших после ТСКК и получающих активную терапию, у 47% выявлены психические нарушения: расстройства адаптации (32%), аффективные (6%) и тревожные (2%) расстройства [130].
J.Lavoie и соавт. (2005 г.) [132] выявили в 7 (13,2%) случаях из 53 выживших после аутологичной ТСКК по поводу первичной резистентности или рецидива ЛГМ тревожные либо депрессивные расстройства адаптации. Среди 39 пациентов, перенесших аллогенную (от донора) либо аутологичную (пересадка клеток самого больного, собранных до трансплантации) ТКМ, авторы выявили 9 (23,1%) наблюдений, в которых на дотрансплантационном этапе выявлялись расстройства адаптации с тревогой и/или депрессией. Среди других ПР, выявленных как на до-, так и на посттрансплантационном этапе, зарегистрированы аффективные (3 наблюдения; 7,7%), деперсонализационные (2 наблюдения; 5,1%), а также кратковременное психотическое расстройство (1 наблюдение; 2,6%) и делирий (1 наблюдение; 2,6%).
C.Meyers и соавт. (1994 г.) [133] изучали психогенные расстройства при ТКМ в условиях изоляции. До трансплантации у 40% пациентов выявлялось тревожное расстройство, при этом выраженность тревоги существенно снижается во время госпитализации и остается низкой на весь период катамнеза, а уровень депрессии, напротив, повышается во время госпитализации, но снижается в катамнестическом периоде.
Сопоставимые данные о соотношении тревоги и депрессии в зависимости от этапа трансплантации приводят M.Hjermstad и соавт. (1999, 2004 гг.) [134, 135] в проспективном исследовании (основная выборка – 131 пациент с ЗСК, по поводу которых назначалась ХТ в высоких дозах и алло- либо аутотрансплантация; контрольная – 123 пациента с лимфомами, получавших стандартную ХТ). Авторы отметили, что после аллогенной ТСКК уровень тревоги спустя год был выше, чем в остальных 2 группах (аутоТКМ, ХТ), хотя данные статистически недостоверны.
S.Lee и соавт. (2005 г.) [136] обследовали 80 пациентов с психиатрическими диагнозами или принимавших психотропные средства, перенесших ТСКК. Из них
38 пациентов обследованы с использованием батареи психометрических тестов в предтрансплантационный период; после трансплантации обследованы 55 пациентов. Превышение средних нормативных показателей по шкалам выявлено у 55% обследованных в предтрансплантационном периоде и у 44% после трансплантации.
Следует отметить, что обсуждению проблемы депрессий при ТКМ в литературе, начиная с 70-х годов прошлого века, уделяется особое внимание [137, 138]. A.Molassiotis и P.Morris (1997 г.) [139] отмечают в этих условиях высокую вероятность манифестации выраженной депрессии при ТКМ и приводят 2 наблюдения, в которых депрессия сопровождалась суицидальными попытками после трансплантации, и 1 случай – с суицидальными мыслями в период изоляции. Авторы выделяют факторы суицидального риска: использование высоких доз стероидов, нарушения метаболизма, астенизация, слабая семейная/социальная поддержка, плохой прогноз заболевания, побочные эффекты медикаментов, влияющие на ЦНС, нарушенный образ тела (особенно у подростков или молодых взрослых), бессонница, хронические соматические заболевания, органические поражения ЦНС, недиагностированное (коморбидное депрессии) психическое заболевание, злоупотребление алкоголем/медикаментами, ПР в анамнезе.
В исследовании F.Baker и соавт. (1997 г.) [140], проведенном с использованием опросника Центра эпидемиологических исследований депрессии – Center for Epidemiologic Studies Depression Scale (изучены 437 пациентов с разными онкогематологическими заболеваниями, перенесших ТКМ: аутологичную – 60,6% и аллогенную – 35,4%), депрессивные состояния (без уточнения синдромальной характеристики) выявлены у 1/3 (31%) пациентов.
В некоторых источниках приводятся данные о связи личностных расстройств с ЗСК. Так, J.Matias и соавт. (1995 г.) [145] обследовали 59 женщин (опросник MMPI и шкалы измерения агрессии Ledesma): у 35 диагностирован рак молочной железы (1-я группа) и у 24 – ЗСК (2-я группа), и обнаружили значимые различия личностных черт в сравниваемых группах. У пациенток 1-й группы выявлено достоверное повышение показателей по субшкале социальной интроверсии MMPI и по показателю аутоагрессии, тогда как во 2-й группе зарегистрировано повышение показателей по шкалам ипохондрии, депрессии, паранойи, а также гетероагрессии.
С проблемой ПР у больных, перенесших ТКМ, тесно связан и вопрос комплаенса [14, 141–144]. Повышение восприятия боли и другие субъективно непереносимые ощущения, возникающие при выполнении таких манипуляций у пациентов (и особенно при коморбидной депрессии [144]), могут нарушать комплаентность, что может стать причиной отказа от инвазивных, но необходимых диагностических и лечебных процедур. Особую значимость приобретает проблема комплаенса, когда речь идет о больных, страдающих шизофренией, поскольку в этих условиях наряду с вмешательством по поводу болезни крови необходима адекватная психофармакотерапия [142, 143].
Терапия ПР у больных с ЗСК
В одном из обзоров L.Derogatis и соавт., опубликованных в 1979 г. [146], проанализирована практика назначений психотропных препаратов пациентам 5 крупных онкологических центров (дифференциация онкопатологии не приводится). Из 1579 наблюдавшихся за период исследования в этих центрах психотропные препараты были назначены 51% больных. Наиболее часто назначаемыми препаратами были снотворные средства (48% всех назначений), а также антипсихотики (26%) и транквилизаторы (25%). Только в 1% наблюдений применялись антидепрессанты. При этом 44% психотропных препаратов были прописаны для лечения расстройств сна, 25% – для купирования тошноты и рвоты, около 17% назначено при нозогенных реакциях («психологическом дистрессе»), а назначение 12% препаратов было связано с диагностическими процедурами. Общее соотношение назначений было примерно
2 психотропных препарата на больного за одну госпитализацию. Наиболее часто назначаемыми препаратами (72% всех назначений) были флуразепам (33%), прохлорперазин (21%) и диазепам (17%).
По данным F.Stiefel и соавт. (1990 г.) [147], представивших анализ изменений в применении психотропных средств в онкологической практике (у 33% диагностировано ЗСК) в течение 10 лет, прошедших от публикации цитированной выше работы, назначение психофармакотерапии увеличилось на 30%; расширились также показания к их использованию (в частности, психотропные средства назначались при болевом расстройстве). Однако, несмотря на достаточную осведомленность врачей, психотропные препараты (и особенно антидепрессанты и антипсихотики при нозогениях) используются не в полной мере.
R.Cullivan и соавт. (1998 г.) [148] обследовали 63 пациента, поступивших за полгода под наблюдение психоонкологических служб. Более чем у 1/2 (62%) из них констатированы метастазирование или поздняя стадия заболевания. У 44,5% пациентов выявлены психотические расстройства, а у 40% – нозогении. Потребность в психофармакотерапии оценена в целом в 50–80%; 24% назначались антидепрессанты, 55% – транквилизаторы, 22% – антипсихотики. Авторы отмечают, что в деятельности онкологов психофармакотерапия стала повседневной стратегией, о чем свидетельствует анализ использования антидепрессантов при нозогениях; этот факт указывает и на оптимизацию диагностического процесса, однако психотропные средства (в частности, транквилизаторы) нередко применяются в соответствии с устаревшими рекомендациями.
В ряде работ приводятся результаты анализа эффективности отдельных психотропных препаратов при ПР, сопровождающих течение и лечение различных онкологических заболеваний. При исследовании антидепрессантов [149–156] подтвержден широкий спектр клинической эффективности препаратов разных групп, включая трициклические (амитриптилин, имипрамин), селективные ингибиторы обратного захвата серотонина – СИОЗС (пароксетин, флуоксетин, сертралин), норадренергические селективные серотонинергические антидепрессанты (миансерин), и препаратов двойного действия – ингибиторов обратного захвата серотонина и норадреналина – ИОЗСН (венлафаксин).
В исследовании М.Р.Шафигуллина (2009 г.) [169] изучалась эффективность применения 4 антидепрессантов (эсциталопрам, флувоксамин, сертралин, венлафаксин) при тревожно-депрессивных состояниях, формирующихся у больных раком желудка. Показано, что все применявшиеся препараты обладают высокой эффективностью при изученных состояниях. Использование тимоаналептиков, способных воздействовать на 2 и более нейротрансмиттерные системы (трициклические антидепрессанты, препараты двойного действия), позволяет успешно сочетать собственно антидепрессивное действие с положительными соматотропными эффектами. При этом регистрируется положительный эффект при купировании болевых синдромов и соматовегетативных расстройств в форме приливов [157], коррекции неврологических осложнений ХТ, включая нейропатическую боль [158], нейросенсорную токсичность [159, 160], постмастэктомический болевой синдром [161] и стойкую нейропатию [162]. В контексте переносимости и безопасности предпочтение отдается антидепрессантам новых поколений, значительно превосходящих по этим показателям традиционные тимоаналептики [163–168].
В литературе приводится несколько сообщений об успешной терапии психотических расстройств, коморбидных болезням системы крови. В казуистических описаниях I.Michopoulos и соавт. (2007 г.) [170] и P.Sirota и соавт. (1988 г.) [81] рассматриваются случаи эффективного и безопасного применения кветиапина у пациентки с биполярной депрессией, перенесшей ТКМ по поводу ОМЛ, и купирования бредовой депрессии (возникла после внутривенного введения ацикловира) при комбинированной терапии галоперидолом в сочетании с мапротилином у пациента с хроническим лимфолейкозом (ХЛЛ). По наблюдениям D.Dixon и J.Craven (1993 г.) [172], при делириозных расстройствах у больных с ЗСК эффективно длительное внутривенное введение галоперидола.
S.Passik и M.Cooper (1999 г.) [171] приводят рекомендации по терапии делириозных расстройств у больных с ЗСК: лечение основного заболевания с отменой препаратов, необязательных на данном этапе терапии и способных усугубить нарушения сознания, назначение антипсихотических средств для купирования возбуждения и продуктивных психопатологических расстройств. При этом предпочтительно применение атипичных антипсихотиков, реже вызывающих побочные экстрапирамидные эффекты.
Данные о терапии нозогенных реакций у больных с ЗСК ограничены описанием 2 казуистических случаев: купирование панической атаки у больного острым лейкозом клоназепамом в дозе 2 мг/сут [61] и клаустрофобии (больной ХМЛ, перенесший ТСКК) при назначении лоразепама в дозе 2 мг/сут [173].
Представленные данные литературы свидетельствуют о клинической гетерогенности и широком спектре (от астенических реакций до делириозных состояний) психопатологических расстройств, выявляемых при ЗСК. В качестве основных факторов риска являются тяжелое течение основного заболевания, проведение ХТ (и особенно кортикостероидов), пожилой возраст пациентов. В большинстве случаев нозогенных реакций наблюдается сочетание нескольких факторов риска (как общих, так и специфических). В контексте переносимости и безопасности предпочтение при проведении психофармакотерапии отдается атипичным антипсихотикам и антидепрессантам новых поколений (СИОЗС, ИОЗСН).
Сведения об авторе
Выборных Дмитрий Эдуардович – д-р мед. наук, врач-психиатр, рук. группы по изучению психических расстройств при заболеваниях системы крови ФГБУ ГНЦ Минздрава РФ. E-mail: dvyb@ya.ru
Список исп. литературыСкрыть список1. Prieto JM, Blanch J, Atala J et al. Psychiatric morbidity and impact on hospital length of stay among hematologic cancer patients receiving stem-cell transplantation. J Clin Oncol 2002; 20: 1907–17.
2. Stark D, Kiely M, Smith A et al. Anxiety disorders in cancer patients: their nature, associations, and relations to quality of life. J Clin Oncol 2002; 20: 3137–48.
3. Sasaki T, Akaho R, Sakamaki H et al. Mental disturbances during isolation in bone marrow transplant patients with leukemia. Bone Marrow Transplant 2000; 25: 315–8.
4. Lloyd GG, Parker AC, Ludlam CA, McGuire RJ. Emotional impact of diagnosis and early treatment of lymphomas. J Psychosom Res 1984; 28: 157–62.
5. Hosaka T, Aoki T, Ichikawa Y. Emotional states of patients with hematological malignancies: preliminary study. Jpn J Clin Oncol 1994; 24( 4): 186–90.
6. Hurtado F, Martin G, Sanz MA. Leukemia and mental health: psychological disturbances, predisposing factors, precipitating conditions and psychotherapeutic approach. Sangre (Barc) 1993; 38: 429–34.
7. Смулевич А.Б., Иванов С.В., Бескова Д.А., Шафигуллин М.Р. Нозогенные реакции у больных раком желудка. Психич. расстройства в общей медицине. 2007; 2 (3): 4–10.
8. Illescas-Rico R, Amaya-Ayala F, Jimenez-Lopez JL et al. Increased incidence of anxiety and depression during bone marrow transplantation. Arch Med Res 2002; 33 (2): 144–7.
9. Syrjala KL, Langer SL, Abrams JR et al. Recovery and long-term function after hematopoietic cell transplantation for leukemia or lymphoma. JAMA 2004; 19 (2916): 2335–43.
10. Prieto JM, Atala J, Blanch J et al. Role of depression as a predictor of mortality among cancer patients after stem-cell transplantation. J Clin Oncol 2005; 23 (25): 6063–71.
11. Grulke N, Larbig W, Kaechele H, Bailer H. Pre-transplant depression as risk factor for survival of patients undergoing allogeneic hematopoietic stem cell transplantation. Psycho-Oncol 2008; 17 (5): 480–7.
12. Gregurek R, Labar B, Mrsic M et al. Anxiety as a possible predictor of acute GVHD. Bone Marrow Transplant 1996; 18 (3): 585–9.
13. Colón EA, Callies AL, Popkin MK, McGlave PB. Depressed mood and other variables related to bone marrow transplantation survival in acute leukemia. Psychosomat 1991; 32 (4): 420–5.
14. Akaho R, Sasaki T, Mori S et al. Psychological factors and survival after bone marrow transplantation in patients with leukemia. Psychiat Clin Neurosci 2003; 57 (1): 91–6.
15. Тимофеева А.С., Сидорова Л.Д. К вопросу о нервно-психических нарушениях при острых лейкозах. Материалы 2-го Всероссийского съезда невропатологов и психиатров. М., 1967; с. 454–6.
16. Fetting JH. Identifying and treating psychiatric disorders in cancer patients. Geriatrics 1982; 37 (9): 95–7.
17. Restan A, Tangen JM, Bergheim J. Acute lymphatic leukemia. Acute psychosis during induction treatment Tidsskr. Nor Laegeforen 1987; 30 (107): 253–4.
18. Haber J. Psychosis in polycythemia vera. J Nerv Ment Dis 1952; 115 (6): 537–40.
19. Целибеев Б.А., Яшиш И.Л., Окунев В.Н. Психические нарушения при гематологических заболеваниях. Журн. неврол. и психиатр. им. С.С.Корсакова. 1964; 64 (8): 1192–7.
20. Максименко В.И. Психические и нервные изменения при лимфогранулематозе. Материалы 2-го Всероссийского съезда невропатологов и психиатров. М., 1967; с. 443–5.
21. Magen JG, D'Mello D. Acute lymphocytic leukemia and psychosis: treatment with electroconvulsive therapy. Ann Clin Psychiat 1995; 7 (3): 133–7.
22. Ross DD, Alexander CS. Management of common symptoms in terminally ill patients. Part II. Constipation, delirium and dispnea. Am Fam Physician 2001; 64 (6): 1019–26.
23. Fadul NA, El Osta B, Dalal S et al. Comparison of symptom burden among patients referred to palliative care with hematologic malignancies versus those with solid tumors. J Palliat Med 2008; 11 (3): 422–7.
24. Beglinger LJ, Duff K, Van Der Heiden S et al. Incidence of delirium and associated mortality in hematopoietic stem cell transplantation patients. Biol Blood Marrow Transplant 2006; 12 (9): 928–35.
25. Roth AJ, Breitbart W. Psychiatric emergencies in terminally ill cancer patients. Hematol Oncol Clin North Am 1996; 10: 235–59.
26. Москети К.В., Терновой К.С. К вопросу о патогенезе психических нарушений у больных эритремией. В кн.: Актуальные вопросы невропатологии, нейрохирургии и психиатрии. Материалы научно-практической конференции Одесского областного научного общества невропатологов и психиатров. Одесса, 1970;
с. 301–5.
27. Целибеев Б.А. Психические нарушения при соматических заболеваниях. М.: Медицина, 1972.
28. Fann JR, Roth-Roemer S, Burington BE et al. Delirium in patients undergoing hematopoietic stem cell transplantation. Cancer 2002; 1 (95): 1971–81.
29. Ross DD, Alexander CS. Management of common symptoms in terminally ill patients. Part II. Constipation, delirium and dispnea. Am Fam Physician 2001; 64 (6): 1019–26.
30. Passik SD, Cooper M. Complicated delirium in a cancer patient successfully treated with olanzapine. J Pain Symptom Manage 1999; 17 (3): 219–23.
31. Meyers BJ, van Ojen RL. The treatment with methylphenidate of demoralisation, apathy and hypoactive delirium in patients with somatic illness. Ned Tijdschr Geneeskd 2004; 28 (148): 1738–41.
32. Silberfarb PM, Bates GM Jr. Psychiatric complications of multiple myeloma. Am J Psychiat 1983; 140 (6): 788–9.
33. Chawla M, Lindesay J. Polycythaemia, delirium and mania. Br J Psychiat 1993; 162: 833–5.
34. Mitchell RB, Wagner JE, Karp JE et al. Syndrome of idiopathic hyperammonemia after high-dose chemotherapy: review of nine cases. Am J Med 1988; 85 (5): 662–7.
35. Keller DR, Keller K. Hyperammonemic encephalopathy in multiple myeloma. Am J Hematol 1998; 57 (3): 264–5.
26 августа 2013
Количество просмотров: 5405


