Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№03 2009
Диагностика и лечение нейролептических экстрапирамидных синдромов №03 2009
Номера страниц в выпуске:18-24
Рассматриваются вопросы диагностики и лечения ятрогенных – нейролептических экстрапирамидных синдромов, возникающих в результате повреждения базальных ганглиев и подкорково-таламических связей. Показано, что вследствие лечения нейролептиками может возникать широкий спектр экстрапирамидных расстройств – от паркинсонизма до стереотипий. Обсуждаются подходы к их адекватной терапевтической коррекции.
Резюме. Рассматриваются вопросы диагностики и лечения ятрогенных – нейролептических экстрапирамидных синдромов, возникающих в результате повреждения базальных ганглиев и подкорково-таламических связей. Показано, что вследствие лечения нейролептиками может возникать широкий спектр экстрапирамидных расстройств – от паркинсонизма до стереотипий. Обсуждаются подходы к их адекватной терапевтической коррекции.
Ключевые слова: нейролептические экстрапирамидные синдромы, типология, клиника, терапия, тригексифенидил (циклодол) и амантадина сульфат (ПК-Мерц).
Diagnosis and treatment of neuroleptic-induced extrapyramidal syndromes
N.V.Fedorova, T.N.Vetokhina
Department of Neurology, Russian Medical Academy for Advanced Studies, Center of extrapyramidal
diseases
Summary. Diagnostic and therapeutic aspects of iatrogenic conditions (neuroleptic-induced extrapyramidal syndromes) developing as a result of basal ganglia and subcortical-talamic tracts damage are considered. It is demonstrated that a wide range of drug-induced extrapyramidal disorders could arise (e.g. parkinsonism, stereotypy). Approaches to the relevant therapy strategies for the conditions are discussed.
Key words: neuroleptic-induced extrapyramidal syndromes, classification, clinical picture, therapy, Trihexiphenidil (Cyclodol) and Amantadine Sulfate (PK-Merz).
Экстрапирамидные синдромы – группа двигательных нарушений, возникающих в результате повреждения базальных ганглиев и подкорково-таламических связей [1].
Нейролептики могут вызывать практически весь спектр экстрапирамидных расстройств: паркинсонизм, дистонию, тремор, хорею, атетоз, акатизию, тики, миоклонии, стереотипии. В большинстве случаев экстрапирамидные синдромы, возникшие на фоне приема того или иного препарата, после его отмены постепенно регрессируют, но некоторые разновидности нейролептических дискинезий и дистоний носят стойкий характер и персистируют даже после отмены вызвавшего их препарата.
Вероятность развития ятрогенных экстрапирамидных симптомов зависит от фармакологических свойств нейролептика, его дозы и схемы приема, а также индивидуальной чувствительности больного.
Патогенез нейролептических экстрапирамидных расстройств
Патогенез экстрапирамидных нейролептических осложнений до настоящего времени до конца не ясен. В настоящее время накоплено много данных о влиянии антипсихотиков на дофаминергические, адренергические, серотонинергические, ГАМКергические, холинергические и другие нейромедиаторные процессы. Нейролептики разных групп блокируют дофаминовые рецепторы различных структур головного мозга, что обеспечивает не только антипсихотическую активность, но и появление побочных экстрапирамидных синдромов. Угнетение центральных норадренергических рецепторов (в ретикулярной формации) обусловливает седативное и гипотензивное действие.
Нейролептические гиперкинезы могут возникать в результате компенсаторного усиления синтеза и высвобождения дофамина в ответ на блокаду дофаминовых постсинаптических рецепторов стриатума, что приводит к активации незаблокированных D1-рецепторов или повышению чувствительности D2-рецепторов. Усиление высвобождения дофамина может быть связано и с блокадой пресинаптических D2-рецепторов [2].
Одна из важнейших ролей в патогенезе экстрапирамидных нейролептических синдромов принадлежит глутаматергической системе. Блокада дофаминовых рецепторов, регулирующих активность глутаматергических кортикостриарных терминалей, усиливает высвобождение возбуждающей аминокислоты – глутамата, который оказывает эксайтотоксическое действие на ГАМКергические нейроны. Повреждающее действие оказывает и избыточная активность глутаматергических субталамических нейронов. Развивается дисбаланс в нейротрансмиттерной системе и активируются процессы окислительного стресса. Нейролептики благодаря своей липофильности способны встраиваться в клеточные мембраны и нарушать энергетический метаболизм нейронов.
Побочные экстрапирамидные эффекты полностью не коррелируют с антипсихотической активностью нейролептиков, что свидетельствует о неодинаковой чувствительности различных дофаминергических структур мозга к разным препаратам. Меньшее побочное экстрапирамидное действие отмечено у нейролептиков, обладающих большей антихолинергической активностью. Установлено, что способность классических нейролептиков вызывать экстрапирамидные расстройства возрастает с известной закономерностью от алифатических к пиперазиновым производным фенотиазина и бутирофенонам. При этом, как правило, изменяется характер экстапирамидного побочного синдрома – от преобладания акинетико-ригидного к гиперкинетическому и дискинетическому синдромам [3].
Атипичные нейролептики обладают избирательностью действия по отношению к мезолимбической и мезокортикальной дофаминергической системе мозга и меньшим влиянием на нигростриарные структуры. Атипичные нейролептики одновременно блокируют 5НТ2-серотониновые рецепторы, что приводит к компенсаторному повышению концентрации дофамина в нигростриарной системе [4].
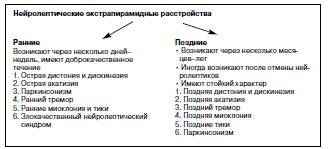
Экстрапирамидные синдромы, вызываемые нейролептиками, принято делить на две группы: ранние и поздние [5].
Ранние экстрапирамидные синдромы возникают в течение первых дней или недель после начала приема нейролептика или на фоне повышения его дозы и обычно регрессируют вскоре после отмены препарата или при переводе больного на атипичный антипсихотик.
Поздние экстрапираминые синдромы возникают вследствие длительного (в течение нескольких месяцев или лет) приема нейролептика, иногда вскоре после его отмены, имеют стойкий или часто необратимый характер.
Клинические проявления ранних и поздних экстрапирамидных синдромов весьма разнообразны (см. схему). На всех этапах нейролептической терапии могут появляться паркинсонизм, дистония и дискинезия, акатизия, миоклония, тики, изолированный тремор. При этом наиболее тяжелое экстрапирамидное расстройство – злокачественный нейролептический синдром – встречается лишь на ранних этапах терапии нейролептиками.
Разнообразие клинических проявлений и течения экстрапирамидных нейролептических синдромов вызывает трудности их диагностики и терапии, особенно у больных психиатрических клиник, когда в силу остроты психотических проявлений нет возможности отменить типичный нейролептик или снизить его дозу, а также назначить атипичный нейролептик, обладающий меньшей антипсихотической активностью. В этой ситуации обычно применяемые в качестве корректоров холинолитики порой неэффективны, а в ряде случаев они даже усиливают проявления нейролептических синдромов (при поздней дискинезии), вызывают появление побочных эффектов и приводят к нарастанию когнитивных нарушений.
Целью исследования явилось изучение спектра клинических проявлений экстрапирамидных нарушений, вызванных приемом нейролептиков, и подходов к их адекватной терапевтической коррекции.
Материал и методы
В исследовании участвовали 115 больных с диагнозом параноидной шизофрении, установленном специалистами психиатрических больниц №1, 13, 14 г. Москвы, у которых отмечены нейролептические экстрапирамидные синдромы. Средний возраст больных составил 45,7±15,5 года, средняя продолжительность нейролептической терапии – 11,9±10,1 года.
Из типичных нейролептиков, назначаемых в средних терапевтических суточных дозах, наиболее часто применяли алифатические производные фенотиазина (n=37), пиперазиновые производные фенотиазина (n=44), пиперидиновые производные фенотиазина (n=16), производные бутирофенона (n=49), производные тиоксантена (n=36), замещенные бензамиды (n=6). Каждый пациент получал комбинации этих препаратов между собой и с атипичными нейролептиками, из которых применяли производные бензизококсазола (n=17), производные дибензодиазепина (n=25), пролонгированные формы нейролептиков (n=35).
Некоторые пациенты получали нейролептики в комбинации с трициклическими антидепрессантами (n=21), транквилизаторами (n=16) и препаратами лития (n=3).
В настоящем исследовании степень тяжести нейролептического паркинсонизма определяли с помощью следующих оценочных шкал:
1) шкалы M.M.Hoehn, M.Yahr в модификации O.Lindvall и соавт. (1989 г.); Tetrud, Langstone (1989 г.);
2) унифицированной шкалы оценки болезни Паркинсона (УШОБП) (Unified Parkinson,s Disease Rating Scale – UPDRS), 3-я версия (S.Fahn и соавт., 1987).
Для оценки степени тяжести тремора использовали:
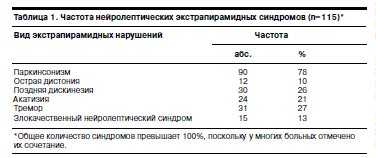
В результате исследования выявлены следующие нейролептические экстрапирамидные синдромы (табл. 1).
Нейролептический паркинсонизм. Нейролептический паркинсонизм является одним из самых частых вариантов вторичного паркинсонизма, встречающегося у 15–60% пациентов, принимающих нейролептики [6]. Этот синдром обусловлен блокадой постсинаптических дофаминовых рецепторов и возникающим нейрохимическим дисбалансом в виде увеличения глутамата, ацетилхолина и снижения дофамина; он проявляется гипокинезией и ригидностью, которые часто сопровождаются тремором покоя и постуральными расстройствами.
К факторам риска развития нейролептического паркинсонизма относятся пожилой возраст, женский пол, семейный анамнез болезни Паркинсона, предшествующие моторные нарушения (дистонии, дискинезии), а также ранний возраст начала шизофрении, когнитивные нарушения, тяжелая деменция.
Клиническая картина нейролептического паркинсонизма характеризуется подострым или острым развитием симметричных симптомов гипокинезии, ригидности, реже – тремора и постуральной нестабильности. Классический тремор покоя (по типу «скатывания пилюль») в изученной выборке встречался сравнительно редко. Более характерным был грубый постурально-кинетический тремор с частотой 5–8 Гц. В то же время типичные для болезни Паркинсона застывания, шаркающая, семенящая походка, затруднения инициации ходьбы для пациентов с нейролептическим паркинсонизмом были нехарактерны. Как правило, паркинсонизм сочетался с другими нейролептическими синдромами. Степень выраженности паркинсонизма зависела от дозы нейролептика и продолжительности нейролептической терапии. После отмены нейролептика или снижения его дозы симптомы паркинсонизма, как правило, регрессировали.
Острая дистония – синдром, характеризующийся непроизвольными медленными (тоническими) или повторяющимися быстрыми (клонико-тоническими) движениями, вызывающими вращение, сгибание или разгибание туловища и конечностей с формированием патологических поз. По распространенности гиперкинеза выделяют фокальные, cегментарные, мультифокальные, генерализованные дистонии [7]. Острая дистония – наиболее раннее экстрапирамидное осложнение нейролептической терапии, возникающее у 2–5% больных. К факторам риска развития острой дистонии относятся молодой возраст (до 30 лет), мужской пол, коморбидный основному заболеванию алкоголизм или органическое поражение головного мозга.
Нейролептическая акатизия – состояние, характеризующееся непреодолимой потребностью к движению и изменению позы для уменьшения чувства внутреннего беспокойства и дискомфорта. Острая акатизия возникает в среднем у 20% больных, принимающих нейролептики [8, 9]. Выделяют острую и позднюю акатизию. Острая акатизия развивается у 3–50% больных в течение 1-й недели после начала приема нейролептика или увеличения его дозы, зависит от дозы препарата и постепенно регрессирует при отмене или снижении дозы нейролептика. Поздняя акатизия развивается у 25–30% больных, принимающих нейролептики, после 3 мес лечения препаратом в стабильной дозе; иногда проявляется на фоне снижения дозы нейролептика или даже его отмены; уменьшается сразу после возобновления нейролептической терапии или увеличения дозы препарата. Поздняя акатизия длительно персистирует после отмены нейролептика.
Клиническая картина акатизии у больных изученной выборки включала сенсорный и моторный компоненты. Сенсорный компонент представлял собой неприятные внутренние ощущения, побуждающие больного совершать движения. Эти ощущения носили общий характер (тревога, внутреннее напряжение, раздражительность) или соматические симптомы (тяжесть или парестезии в ногах). Двигательный компонент акатизии был представлен движениями стереотипного характера. В положении сидя больные постоянно меняли позу, раскачивали туловище, закидывали ногу на ногу, покачивали и постукивали ногой, стучали пальцами рук, перебирали их, почесывали голову, поглаживали лицо, расстегивали и застегивали пуговицы. В положении стоя они часто переминались с ноги на ногу или маршировали на месте.
Поздняя нейролептическая дистония возникает у 2–20% больных через несколько лет после начала лечения нейролептиком, она длительно персистирует после его отмены [10]. В данном исследовании позднюю дистонию чаще отмечали у молодых людей. К факторам риска относили: органическое поражение мозга, наличие умственной отсталости, проведенную ранее электросудорожную терапию.
Клиническая картина поздней дистонии характеризовалась оромандибулярной дискинезией, спастической кривошеей (ретроколлис), торсионной дистонией. У 2 пациентов возникал боковой наклон туловища и головы, иногда с некоторой ротацией и отклонением туловища кзади (синдром «Пизанской башни»). Типичная дистоническая поза рук проявлялась ротацией внутрь, разгибанием предплечья и сгибанием кисти. Нижние конечности вовлекались в процесс редко. При поздней дистонии встречали окулогирные кризы, иногда сопровождаемые наплывом навязчивых мыслей, галлюцинаций или усилением тревожного аффекта.
Поздняя дискинезия (ПД). Под этим понятием понимают любой гиперкинез, если он удовлетворяет двум основным критериям: 1) возникает вследствие длительного (более 3 мес) приема нейролептика; 2) стойко сохраняется после отмены препарата (в течение нескольких месяцев или лет) [5]. Для ПД характерны следующие особенности: 1) симптомы становятся заметными после снижения дозы нейролептиков или их отмены; 2) симптомы уменьшаются или исчезают при возобновлении лечения нейролептиками или повышения их дозы; 3) холинолитические препараты не помогают больным и часто ухудшают проявления ПД [11].
В среднем ПД возникает у 20–25% больных, длительное время принимающих нейролептики [12, 13]. Отмена нейролептика может приводить к увеличению тяжести проявлений ПД или появлению новых дискинетических симптомов. У большей части больных ПД становится необратимой. В связи с этим ПД подразделяют на обратимую и необратимую, или персистирующую. По данным D.Jeste и R.Wyatt (1982 г.), через 3 мес после отмены препарата у 36,5% больных с дискинезией отмечается ремиссия гиперкинеза [14]. При этом отмена нейролептика сначала может приводить к усилению дискинезии, которая, достигнув пика интенсивности через 1–2 нед, обычно постепенно уменьшается вплоть до полного исчезновения. Авторы полагают, что наличие гиперкинеза через 3 мес после отмены нейролептика можно рассматривать как критерий персистирующей ПД.
Пациенты в возрасте старше 40 лет имеют в 3 раза больший риск приобрести ПД, чем более молодые больные [15]. В данной работе, как и в большинстве исследований, подтверждаются данные G.Muscettola и соавт. (1993 г.) о том, что ПД преобладает среди женщин. ПД чаще возникала при более высокой суммарной дозе нейролептика.
В ряде исследований показано, что с увеличением длительности нейролептической терапии риск ПД возрастает. С другой стороны, D.Jeste и R.Wyatt (1982 г.) указывали на то, что «лекарственные каникулы» (прерывистая терапия нейролептиком) приводила к большему риску появления ПД [14]. Согласно многочисленным наблюдениям длительное применение холинолитиков увеличивало риск появления ПД [16]. Особая роль принадлежит генетическим факторам. Они могут быть основой чувствительности к развитию ПД у некоторых пациентов [17]. В ряде исследований установлено, что ПД чаще развивалась на фоне органического поражения головного мозга при наличии выраженных когнитивных нарушений и злоупотреблении алкоголем [2].
Клинические проявления ПД обычно реализуются своеобразным гиперкинезом хореиформного характера, вовлекающим орофациальную область и язык (букко-лингво-мастикаторный синдром), иногда гиперкинез распространяется на туловище и конечности [10].
ПД у больных изученной выборки проявлялась разнообразными гиперкинезами: хореей, хореоатетозом, стереотипиями, дистонией, акатизией, тремором, миоклонией, тиками или их сочетанием. При вовлечении диафрагмы и дыхательных мышц возникали эпизоды тахипноэ, одышка, неритмичное прерывистое дыхание с периодическими форсированными вдохами. При вовлечении в гиперкинез мышц гортани и глотки развивались дизартрия, аэрофагия, дисфагия. Движения в конечностях были как двусторонними, так и односторонними. Иногда движения в конечностях имели хореоатетоидный или дистонический характер, реже напоминали тики или баллизм.
Злокачественный нейролептический синдром (ЗНС)1 – наиболее редкое и опасное из экстрапирамидных осложнений нейролептической терапии. Он возникает в среднем у 0,5–1% больных, принимающих нейролептики, обычно развивается в первые 2 нед после начала приема препарата или увеличения его дозы. Чаще всего ЗНС развивается при применении высоких доз сильнодействующих препаратов (особенно пролонгированного действия).
ЗСН чаще наблюдается у молодых мужчин (от 20 до 40 лет). Факторами риска являются интеркуррентная инфекция, физическое истощение, нарушения водно-электролитного баланса, дисфункция щитовидной железы, органическое заболевание ЦНС. Риск ЗНС выше у больных, страдающих алкоголизмом и дефицитом железа.
Клиническая картина ЗНС проявляется тетрадой симптомов: гипертермией, генерализованной мышечной ригидностью, спутанностью или угнетением сознания, вегетативными расстройствами. Дополнительно выявляются следующие синдромы: дистония, тремор, дыхательная недостаточность, рабдомиолиз, повышение креатинфосфокиназы, миоглобинурия, лейкоцитоз.
Осложнениями ЗНС могут быть аспирационная пневмония, инфаркт миокарда, сепсис, тромбоз глубоких вен голени, отек легких, некротизирующий колит, почечная и сердечная недостаточность. В 10–20% случаев ЗНС заканчивается летальным исходом.
В настоящем исследовании за 5-летний период наблюдения (1999–2004 гг.) ЗНС выявлен у 15 больных (13% от их общего числа). Чаще этот синдром наблюдали у молодых мужчин (средний возраст 32,5±13,9 года). У всех пациентов клиническая картина характеризовалась спутанностью сознания, гипертермией (до 39°С), дисфонией и дисфагией, выраженной акинезией и генерализованной мышечной ригидностью, а также вегетативными расстройствами (гиперсаливация, тахикардия, тахипноэ, гипотония, бледность кожных покровов, олигурия).
Проводили следующую терапию ЗНС:
Общие принципы терапии экстрапирамидных нейролептических синдромов. Коррекция осложнений нейролептической терапии предполагает отмену или снижение дозы типичных и назначение атипичных нейролептиков (рисполепт, зипрекса, сероквель и др.), в меньшей степени блокирующих дофаминовые D2-рецепторы, обладающие избирательностью действия по отношению к мезолимбической и мезокортикальной дофаминергической системе мозга и менее выраженным влиянием на нигростриарную систему. Атипичные нейролептики в терапевтических дозах связываются с D2-рецепторами нигростриарной области значительно слабее, чем в лимбических структурах, блокируют менее 50% D2-рецепторов, что не приводит к клинической манифестации экстрапирамидной симптоматики.
Для коррекции осложнений нейролептической терапии в настоящем исследовании использованы тригексифенидил (циклодол) и амантадина сульфат (ПК-Мерц).
Нейролептики блокируют дофаминовые D2-рецепторы в нигростриальной системе мозга, что сопровождается угнетением дофаминергической передачи, изменением чувствительности дофаминовых рецепторов. Развивается медиаторный нейрохимический дисбаланс, который проявляется повышением активности холинергической, серотонинергической систем, а также повышением активности глутаматергических субталамических нейронов. Это приводит к увеличению высвобождения глутамата, который является возбуждающим нейротрансмиттером. При этом увеличивается приток ионов кальция в нейроны, повышается уровень ацетилхолина в нейронах полосатого тела, активируются холинергические системы и появляются тремор, ригидность, гипокинезия. Повышение концентрации кальция в нигростриарных нейронах способствует дегенерации этих нейронов и активации окислительного стресса, который является одним из основных факторов, способствующих повреждению нейронов базальных ганглиев. Возбуждающее действие глутамата опосредуется через рецепторы N-метил-D-аспартата (NMDA-рецепторы).
Амантадина сульфат (ПК-Мерц) является антагонистом NMDA-рецепторов глутамата. Препарат снижает количество глутамата, уровень ацетилхолина в полосатом теле; увеличивает синтез дофамина в пресинаптических терминалях и его высвобождение в синаптическую щель, тормозит обратный захват дофамина в пресинаптическую терминаль, незначительно стимулирует ДА-рецепторы; уменьшает концентрацию ионов кальция в нигростриарных нейронах, в результате чего, возможно, обладает нейропротекторным действием [18, 19].
Механизм действия холинолитиков заключается в уменьшении функциональной активности холинергических систем и восстановлении нарушенного в связи с дефицитом дофамина равновесия дофаминергической и холинергической систем в базальных ганглиях, блокировании обратного захвата дофамина из синаптической щели [20].
В настоящее время в ряде работ зарубежных авторов широко обсуждается вопрос о сравнительной терапевтической эффективности препаратов амантадина, холинолитиков (тригексифенидил, бипериден) в купировании экстрапирамидных нейролептических синдромов. Одни исследователи указывают на больший фармакотерапевтический эффект амантадина [19], другие – об эквивалентной эффективности этого препарата и биперидена [21].
В двойном слепом контролируемом плацебо исследовании, проведенном W.Fann и C.Lake (1976 г.), выявлено, что при лечении нейролептического паркинсонизма амантадин в дозе 200 мг/сут терапевтически эквивалентен 8 мг/сут тригексифенидила [22]. Амантадин вызывал значительно менее тяжелые побочные эффекты, чем тригексифенидил. В то же время сообщается о ряде преимуществ амантадинов перед холинолитиками. По сравнению с антихолинергическими препаратами когнитивные функции у здоровых и больных шизофренией при лечении амантадином сохраняются более длительное время [23, 24]. Кроме того, применение антихолинергических препаратов, обладающих анксиолитическими свойствами и способностью вызывать эйфорию, может осложняться явлениями зависимости и злоупотребления и в этой связи высказывается предположение о том, что эти препараты снижают антипсихотический эффект нейролептиков [25]. Приводятся также данные о том, что антихолинергические средства могут продуцировать изменения в реполяризации сердца и провоцировать появление аритмий [18]. По данным некоторых исследователей [26], антихолинергические препараты индуцируют развитие поздней дискинезии.
В сообщении Американской психиатрической ассоциации (1992 г.) указывается, что амантадин эффективен при лечении поздней дискинезии. Улучшение состояния наблюдали у всех 6 пациентов, получавших амантадин и нейролептики. S.Angus, J.Sugars, R.Boltezar и соавт. (1995 г.) провели двойное слепое перекрестное контролируемое плацебо исследование амантадина при поздней дискинезии. В результате исследования у 10 из 16 пациентов выявлено улучшение на 20% и у 2 пациентов – на 40%. Это улучшение было достигнуто при отмене антихолинергических препаратов.
Для сравнительного изучения фармакотерапевтической эффективности препаратов в качестве корректоров нейролептических экстрапирамидных синдромов больные изученной выборки разделены на две группы:
У пациентов обеих групп диагностированы следующие экстрапирамидные синдромы: паркинсонизм (28 и 70 больных по группам соответственно), ранняя дистония (12 и 7 пациентов), поздняя дистония (по 18 больных соответственно).
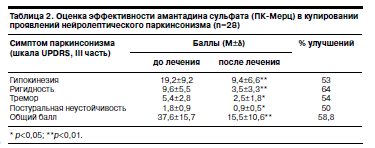
У всех обследованных больных на лечении экстрапирамидных нейролептических синдромов амантадином сульфатом в средней терапевтической дозе 300 мг/сут отмечена положительная динамика клинических показателей (табл. 2, 3).

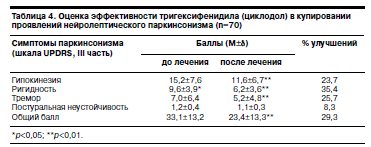
Как это видно из данных, представленных в табл. 4, 5, эффективность тригексифенидила (циклодола) существенно ниже.
Преимущество амантадина сульфата перед тригексифенидилом реализуется при лечении основных двигательных нарушений, вызванных нейролептическим паркинсонизмом.
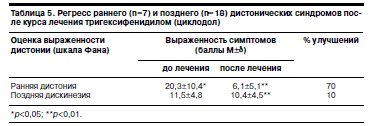
В отличие от тригексифенидила терапия амантадином сульфатом уменьшает выраженность расстройств позы и походки. Амантадина сульфат оказался более эффективным, чем тригексифенидил, и при коррекции дискинетических и дистонических синдромов.
Заключение
Полиморфизм клинических проявлений и разнообразие течения экстрапирамидных синдромов (они могут приобретать стойкий и даже необратимый характер), осложняющих нейролептическую терапию, а также их резистентность к традиционной корригирующей терапии холинолитиками диктует необходимость поиска альтернативного корригирующего лечения. Более эффективным средством является препарат амантадина сульфат (ПК-Мерц), обладающий рядом преимуществ перед тригексифенидилом. ПК-Мерц эффективен при поздней дискинезии, не вызывает когнитивных нарушений, оказывает нейропротекторный эффект, применение препарата редко сопровождается побочными эффектами. Все эти свойства обеспечивают амантадина сульфату предпочтительность при терапии экстрапирамидных нейролептических синдромов.
Ключевые слова: нейролептические экстрапирамидные синдромы, типология, клиника, терапия, тригексифенидил (циклодол) и амантадина сульфат (ПК-Мерц).
Diagnosis and treatment of neuroleptic-induced extrapyramidal syndromes
N.V.Fedorova, T.N.Vetokhina
Department of Neurology, Russian Medical Academy for Advanced Studies, Center of extrapyramidal
diseases
Summary. Diagnostic and therapeutic aspects of iatrogenic conditions (neuroleptic-induced extrapyramidal syndromes) developing as a result of basal ganglia and subcortical-talamic tracts damage are considered. It is demonstrated that a wide range of drug-induced extrapyramidal disorders could arise (e.g. parkinsonism, stereotypy). Approaches to the relevant therapy strategies for the conditions are discussed.
Key words: neuroleptic-induced extrapyramidal syndromes, classification, clinical picture, therapy, Trihexiphenidil (Cyclodol) and Amantadine Sulfate (PK-Merz).
Экстрапирамидные синдромы – группа двигательных нарушений, возникающих в результате повреждения базальных ганглиев и подкорково-таламических связей [1].
Нейролептики могут вызывать практически весь спектр экстрапирамидных расстройств: паркинсонизм, дистонию, тремор, хорею, атетоз, акатизию, тики, миоклонии, стереотипии. В большинстве случаев экстрапирамидные синдромы, возникшие на фоне приема того или иного препарата, после его отмены постепенно регрессируют, но некоторые разновидности нейролептических дискинезий и дистоний носят стойкий характер и персистируют даже после отмены вызвавшего их препарата.
Вероятность развития ятрогенных экстрапирамидных симптомов зависит от фармакологических свойств нейролептика, его дозы и схемы приема, а также индивидуальной чувствительности больного.
Патогенез нейролептических экстрапирамидных расстройств
Патогенез экстрапирамидных нейролептических осложнений до настоящего времени до конца не ясен. В настоящее время накоплено много данных о влиянии антипсихотиков на дофаминергические, адренергические, серотонинергические, ГАМКергические, холинергические и другие нейромедиаторные процессы. Нейролептики разных групп блокируют дофаминовые рецепторы различных структур головного мозга, что обеспечивает не только антипсихотическую активность, но и появление побочных экстрапирамидных синдромов. Угнетение центральных норадренергических рецепторов (в ретикулярной формации) обусловливает седативное и гипотензивное действие.
Нейролептические гиперкинезы могут возникать в результате компенсаторного усиления синтеза и высвобождения дофамина в ответ на блокаду дофаминовых постсинаптических рецепторов стриатума, что приводит к активации незаблокированных D1-рецепторов или повышению чувствительности D2-рецепторов. Усиление высвобождения дофамина может быть связано и с блокадой пресинаптических D2-рецепторов [2].

Одна из важнейших ролей в патогенезе экстрапирамидных нейролептических синдромов принадлежит глутаматергической системе. Блокада дофаминовых рецепторов, регулирующих активность глутаматергических кортикостриарных терминалей, усиливает высвобождение возбуждающей аминокислоты – глутамата, который оказывает эксайтотоксическое действие на ГАМКергические нейроны. Повреждающее действие оказывает и избыточная активность глутаматергических субталамических нейронов. Развивается дисбаланс в нейротрансмиттерной системе и активируются процессы окислительного стресса. Нейролептики благодаря своей липофильности способны встраиваться в клеточные мембраны и нарушать энергетический метаболизм нейронов.
Побочные экстрапирамидные эффекты полностью не коррелируют с антипсихотической активностью нейролептиков, что свидетельствует о неодинаковой чувствительности различных дофаминергических структур мозга к разным препаратам. Меньшее побочное экстрапирамидное действие отмечено у нейролептиков, обладающих большей антихолинергической активностью. Установлено, что способность классических нейролептиков вызывать экстрапирамидные расстройства возрастает с известной закономерностью от алифатических к пиперазиновым производным фенотиазина и бутирофенонам. При этом, как правило, изменяется характер экстапирамидного побочного синдрома – от преобладания акинетико-ригидного к гиперкинетическому и дискинетическому синдромам [3].
Атипичные нейролептики обладают избирательностью действия по отношению к мезолимбической и мезокортикальной дофаминергической системе мозга и меньшим влиянием на нигростриарные структуры. Атипичные нейролептики одновременно блокируют 5НТ2-серотониновые рецепторы, что приводит к компенсаторному повышению концентрации дофамина в нигростриарной системе [4].
Экстрапирамидные синдромы, вызываемые нейролептиками, принято делить на две группы: ранние и поздние [5].
Ранние экстрапирамидные синдромы возникают в течение первых дней или недель после начала приема нейролептика или на фоне повышения его дозы и обычно регрессируют вскоре после отмены препарата или при переводе больного на атипичный антипсихотик.
Поздние экстрапираминые синдромы возникают вследствие длительного (в течение нескольких месяцев или лет) приема нейролептика, иногда вскоре после его отмены, имеют стойкий или часто необратимый характер.
Клинические проявления ранних и поздних экстрапирамидных синдромов весьма разнообразны (см. схему). На всех этапах нейролептической терапии могут появляться паркинсонизм, дистония и дискинезия, акатизия, миоклония, тики, изолированный тремор. При этом наиболее тяжелое экстрапирамидное расстройство – злокачественный нейролептический синдром – встречается лишь на ранних этапах терапии нейролептиками.
Разнообразие клинических проявлений и течения экстрапирамидных нейролептических синдромов вызывает трудности их диагностики и терапии, особенно у больных психиатрических клиник, когда в силу остроты психотических проявлений нет возможности отменить типичный нейролептик или снизить его дозу, а также назначить атипичный нейролептик, обладающий меньшей антипсихотической активностью. В этой ситуации обычно применяемые в качестве корректоров холинолитики порой неэффективны, а в ряде случаев они даже усиливают проявления нейролептических синдромов (при поздней дискинезии), вызывают появление побочных эффектов и приводят к нарастанию когнитивных нарушений.
Целью исследования явилось изучение спектра клинических проявлений экстрапирамидных нарушений, вызванных приемом нейролептиков, и подходов к их адекватной терапевтической коррекции.
Материал и методы
В исследовании участвовали 115 больных с диагнозом параноидной шизофрении, установленном специалистами психиатрических больниц №1, 13, 14 г. Москвы, у которых отмечены нейролептические экстрапирамидные синдромы. Средний возраст больных составил 45,7±15,5 года, средняя продолжительность нейролептической терапии – 11,9±10,1 года.
Из типичных нейролептиков, назначаемых в средних терапевтических суточных дозах, наиболее часто применяли алифатические производные фенотиазина (n=37), пиперазиновые производные фенотиазина (n=44), пиперидиновые производные фенотиазина (n=16), производные бутирофенона (n=49), производные тиоксантена (n=36), замещенные бензамиды (n=6). Каждый пациент получал комбинации этих препаратов между собой и с атипичными нейролептиками, из которых применяли производные бензизококсазола (n=17), производные дибензодиазепина (n=25), пролонгированные формы нейролептиков (n=35).
Некоторые пациенты получали нейролептики в комбинации с трициклическими антидепрессантами (n=21), транквилизаторами (n=16) и препаратами лития (n=3).
В настоящем исследовании степень тяжести нейролептического паркинсонизма определяли с помощью следующих оценочных шкал:
1) шкалы M.M.Hoehn, M.Yahr в модификации O.Lindvall и соавт. (1989 г.); Tetrud, Langstone (1989 г.);
2) унифицированной шкалы оценки болезни Паркинсона (УШОБП) (Unified Parkinson,s Disease Rating Scale – UPDRS), 3-я версия (S.Fahn и соавт., 1987).
Для оценки степени тяжести тремора использовали:
1) шкалу клинической оценки тремора – ШКОТ (Clinical rating scalе for tremor – CRST, Fahn и соавт., 1993).Степень тяжести дистоний оценивали с помощью шкалы оценки тяжести дистоний (S.Fahn, C.Marsden, R.Burke, 1985).
2) унифицированную шкалу оценки болезни Паркинсона – III часть, пункты 20, 21.
В результате исследования выявлены следующие нейролептические экстрапирамидные синдромы (табл. 1).

Нейролептический паркинсонизм. Нейролептический паркинсонизм является одним из самых частых вариантов вторичного паркинсонизма, встречающегося у 15–60% пациентов, принимающих нейролептики [6]. Этот синдром обусловлен блокадой постсинаптических дофаминовых рецепторов и возникающим нейрохимическим дисбалансом в виде увеличения глутамата, ацетилхолина и снижения дофамина; он проявляется гипокинезией и ригидностью, которые часто сопровождаются тремором покоя и постуральными расстройствами.
К факторам риска развития нейролептического паркинсонизма относятся пожилой возраст, женский пол, семейный анамнез болезни Паркинсона, предшествующие моторные нарушения (дистонии, дискинезии), а также ранний возраст начала шизофрении, когнитивные нарушения, тяжелая деменция.
Клиническая картина нейролептического паркинсонизма характеризуется подострым или острым развитием симметричных симптомов гипокинезии, ригидности, реже – тремора и постуральной нестабильности. Классический тремор покоя (по типу «скатывания пилюль») в изученной выборке встречался сравнительно редко. Более характерным был грубый постурально-кинетический тремор с частотой 5–8 Гц. В то же время типичные для болезни Паркинсона застывания, шаркающая, семенящая походка, затруднения инициации ходьбы для пациентов с нейролептическим паркинсонизмом были нехарактерны. Как правило, паркинсонизм сочетался с другими нейролептическими синдромами. Степень выраженности паркинсонизма зависела от дозы нейролептика и продолжительности нейролептической терапии. После отмены нейролептика или снижения его дозы симптомы паркинсонизма, как правило, регрессировали.
Острая дистония – синдром, характеризующийся непроизвольными медленными (тоническими) или повторяющимися быстрыми (клонико-тоническими) движениями, вызывающими вращение, сгибание или разгибание туловища и конечностей с формированием патологических поз. По распространенности гиперкинеза выделяют фокальные, cегментарные, мультифокальные, генерализованные дистонии [7]. Острая дистония – наиболее раннее экстрапирамидное осложнение нейролептической терапии, возникающее у 2–5% больных. К факторам риска развития острой дистонии относятся молодой возраст (до 30 лет), мужской пол, коморбидный основному заболеванию алкоголизм или органическое поражение головного мозга.
Нейролептическая акатизия – состояние, характеризующееся непреодолимой потребностью к движению и изменению позы для уменьшения чувства внутреннего беспокойства и дискомфорта. Острая акатизия возникает в среднем у 20% больных, принимающих нейролептики [8, 9]. Выделяют острую и позднюю акатизию. Острая акатизия развивается у 3–50% больных в течение 1-й недели после начала приема нейролептика или увеличения его дозы, зависит от дозы препарата и постепенно регрессирует при отмене или снижении дозы нейролептика. Поздняя акатизия развивается у 25–30% больных, принимающих нейролептики, после 3 мес лечения препаратом в стабильной дозе; иногда проявляется на фоне снижения дозы нейролептика или даже его отмены; уменьшается сразу после возобновления нейролептической терапии или увеличения дозы препарата. Поздняя акатизия длительно персистирует после отмены нейролептика.
Клиническая картина акатизии у больных изученной выборки включала сенсорный и моторный компоненты. Сенсорный компонент представлял собой неприятные внутренние ощущения, побуждающие больного совершать движения. Эти ощущения носили общий характер (тревога, внутреннее напряжение, раздражительность) или соматические симптомы (тяжесть или парестезии в ногах). Двигательный компонент акатизии был представлен движениями стереотипного характера. В положении сидя больные постоянно меняли позу, раскачивали туловище, закидывали ногу на ногу, покачивали и постукивали ногой, стучали пальцами рук, перебирали их, почесывали голову, поглаживали лицо, расстегивали и застегивали пуговицы. В положении стоя они часто переминались с ноги на ногу или маршировали на месте.
Поздняя нейролептическая дистония возникает у 2–20% больных через несколько лет после начала лечения нейролептиком, она длительно персистирует после его отмены [10]. В данном исследовании позднюю дистонию чаще отмечали у молодых людей. К факторам риска относили: органическое поражение мозга, наличие умственной отсталости, проведенную ранее электросудорожную терапию.
Клиническая картина поздней дистонии характеризовалась оромандибулярной дискинезией, спастической кривошеей (ретроколлис), торсионной дистонией. У 2 пациентов возникал боковой наклон туловища и головы, иногда с некоторой ротацией и отклонением туловища кзади (синдром «Пизанской башни»). Типичная дистоническая поза рук проявлялась ротацией внутрь, разгибанием предплечья и сгибанием кисти. Нижние конечности вовлекались в процесс редко. При поздней дистонии встречали окулогирные кризы, иногда сопровождаемые наплывом навязчивых мыслей, галлюцинаций или усилением тревожного аффекта.
Поздняя дискинезия (ПД). Под этим понятием понимают любой гиперкинез, если он удовлетворяет двум основным критериям: 1) возникает вследствие длительного (более 3 мес) приема нейролептика; 2) стойко сохраняется после отмены препарата (в течение нескольких месяцев или лет) [5]. Для ПД характерны следующие особенности: 1) симптомы становятся заметными после снижения дозы нейролептиков или их отмены; 2) симптомы уменьшаются или исчезают при возобновлении лечения нейролептиками или повышения их дозы; 3) холинолитические препараты не помогают больным и часто ухудшают проявления ПД [11].
В среднем ПД возникает у 20–25% больных, длительное время принимающих нейролептики [12, 13]. Отмена нейролептика может приводить к увеличению тяжести проявлений ПД или появлению новых дискинетических симптомов. У большей части больных ПД становится необратимой. В связи с этим ПД подразделяют на обратимую и необратимую, или персистирующую. По данным D.Jeste и R.Wyatt (1982 г.), через 3 мес после отмены препарата у 36,5% больных с дискинезией отмечается ремиссия гиперкинеза [14]. При этом отмена нейролептика сначала может приводить к усилению дискинезии, которая, достигнув пика интенсивности через 1–2 нед, обычно постепенно уменьшается вплоть до полного исчезновения. Авторы полагают, что наличие гиперкинеза через 3 мес после отмены нейролептика можно рассматривать как критерий персистирующей ПД.
Пациенты в возрасте старше 40 лет имеют в 3 раза больший риск приобрести ПД, чем более молодые больные [15]. В данной работе, как и в большинстве исследований, подтверждаются данные G.Muscettola и соавт. (1993 г.) о том, что ПД преобладает среди женщин. ПД чаще возникала при более высокой суммарной дозе нейролептика.
В ряде исследований показано, что с увеличением длительности нейролептической терапии риск ПД возрастает. С другой стороны, D.Jeste и R.Wyatt (1982 г.) указывали на то, что «лекарственные каникулы» (прерывистая терапия нейролептиком) приводила к большему риску появления ПД [14]. Согласно многочисленным наблюдениям длительное применение холинолитиков увеличивало риск появления ПД [16]. Особая роль принадлежит генетическим факторам. Они могут быть основой чувствительности к развитию ПД у некоторых пациентов [17]. В ряде исследований установлено, что ПД чаще развивалась на фоне органического поражения головного мозга при наличии выраженных когнитивных нарушений и злоупотреблении алкоголем [2].
Клинические проявления ПД обычно реализуются своеобразным гиперкинезом хореиформного характера, вовлекающим орофациальную область и язык (букко-лингво-мастикаторный синдром), иногда гиперкинез распространяется на туловище и конечности [10].
ПД у больных изученной выборки проявлялась разнообразными гиперкинезами: хореей, хореоатетозом, стереотипиями, дистонией, акатизией, тремором, миоклонией, тиками или их сочетанием. При вовлечении диафрагмы и дыхательных мышц возникали эпизоды тахипноэ, одышка, неритмичное прерывистое дыхание с периодическими форсированными вдохами. При вовлечении в гиперкинез мышц гортани и глотки развивались дизартрия, аэрофагия, дисфагия. Движения в конечностях были как двусторонними, так и односторонними. Иногда движения в конечностях имели хореоатетоидный или дистонический характер, реже напоминали тики или баллизм.
Злокачественный нейролептический синдром (ЗНС)1 – наиболее редкое и опасное из экстрапирамидных осложнений нейролептической терапии. Он возникает в среднем у 0,5–1% больных, принимающих нейролептики, обычно развивается в первые 2 нед после начала приема препарата или увеличения его дозы. Чаще всего ЗНС развивается при применении высоких доз сильнодействующих препаратов (особенно пролонгированного действия).
ЗСН чаще наблюдается у молодых мужчин (от 20 до 40 лет). Факторами риска являются интеркуррентная инфекция, физическое истощение, нарушения водно-электролитного баланса, дисфункция щитовидной железы, органическое заболевание ЦНС. Риск ЗНС выше у больных, страдающих алкоголизмом и дефицитом железа.
Клиническая картина ЗНС проявляется тетрадой симптомов: гипертермией, генерализованной мышечной ригидностью, спутанностью или угнетением сознания, вегетативными расстройствами. Дополнительно выявляются следующие синдромы: дистония, тремор, дыхательная недостаточность, рабдомиолиз, повышение креатинфосфокиназы, миоглобинурия, лейкоцитоз.
Осложнениями ЗНС могут быть аспирационная пневмония, инфаркт миокарда, сепсис, тромбоз глубоких вен голени, отек легких, некротизирующий колит, почечная и сердечная недостаточность. В 10–20% случаев ЗНС заканчивается летальным исходом.
В настоящем исследовании за 5-летний период наблюдения (1999–2004 гг.) ЗНС выявлен у 15 больных (13% от их общего числа). Чаще этот синдром наблюдали у молодых мужчин (средний возраст 32,5±13,9 года). У всех пациентов клиническая картина характеризовалась спутанностью сознания, гипертермией (до 39°С), дисфонией и дисфагией, выраженной акинезией и генерализованной мышечной ригидностью, а также вегетативными расстройствами (гиперсаливация, тахикардия, тахипноэ, гипотония, бледность кожных покровов, олигурия).
Проводили следующую терапию ЗНС:
• Прекращение приема нейролептикаУ пациентов изученной выборки, получавших амантадина сульфат в дополнение к инфузионной терапии, был выявлен наиболее быстрый и наиболее значительный регресс клинических проявлений СНС; летальных исходов не отмечено. Регресс симптомов происходил в течение 1–2 нед, но некоторые симптомы (паркинсонизм, дискинезия, атаксия, когнитивные нарушения) сохранялись в течение 3–8 нед и более.
• Назначение антипиретиков
• Коррекция водно-электролитных расстройств
• Назначение амантадинов: ПК-Мерц внутривенно капельно 500 мл (200 мг) со скоростью 50 капель в 1 мин 2 раза в сутки на протяжении 10 дней с последующим переходом на пероральное введение – 300–600 мг/сут
• Назначение бензодиазепинов (диазепам 10 мг внутривенно, затем 5–10 мг перорально 3 раза в сутки)
• Коррекция гемодинамических нарушений
• Искусственная вентиляция легких при нарушениях дыхания
• Введение назогастрального зонда для обеспечения питания и введения жидкости при нарушении глотания
• Введение гепарина
• Профилактика вторичных инфекций
Общие принципы терапии экстрапирамидных нейролептических синдромов. Коррекция осложнений нейролептической терапии предполагает отмену или снижение дозы типичных и назначение атипичных нейролептиков (рисполепт, зипрекса, сероквель и др.), в меньшей степени блокирующих дофаминовые D2-рецепторы, обладающие избирательностью действия по отношению к мезолимбической и мезокортикальной дофаминергической системе мозга и менее выраженным влиянием на нигростриарную систему. Атипичные нейролептики в терапевтических дозах связываются с D2-рецепторами нигростриарной области значительно слабее, чем в лимбических структурах, блокируют менее 50% D2-рецепторов, что не приводит к клинической манифестации экстрапирамидной симптоматики.
Для коррекции осложнений нейролептической терапии в настоящем исследовании использованы тригексифенидил (циклодол) и амантадина сульфат (ПК-Мерц).
Нейролептики блокируют дофаминовые D2-рецепторы в нигростриальной системе мозга, что сопровождается угнетением дофаминергической передачи, изменением чувствительности дофаминовых рецепторов. Развивается медиаторный нейрохимический дисбаланс, который проявляется повышением активности холинергической, серотонинергической систем, а также повышением активности глутаматергических субталамических нейронов. Это приводит к увеличению высвобождения глутамата, который является возбуждающим нейротрансмиттером. При этом увеличивается приток ионов кальция в нейроны, повышается уровень ацетилхолина в нейронах полосатого тела, активируются холинергические системы и появляются тремор, ригидность, гипокинезия. Повышение концентрации кальция в нигростриарных нейронах способствует дегенерации этих нейронов и активации окислительного стресса, который является одним из основных факторов, способствующих повреждению нейронов базальных ганглиев. Возбуждающее действие глутамата опосредуется через рецепторы N-метил-D-аспартата (NMDA-рецепторы).
Амантадина сульфат (ПК-Мерц) является антагонистом NMDA-рецепторов глутамата. Препарат снижает количество глутамата, уровень ацетилхолина в полосатом теле; увеличивает синтез дофамина в пресинаптических терминалях и его высвобождение в синаптическую щель, тормозит обратный захват дофамина в пресинаптическую терминаль, незначительно стимулирует ДА-рецепторы; уменьшает концентрацию ионов кальция в нигростриарных нейронах, в результате чего, возможно, обладает нейропротекторным действием [18, 19].
Механизм действия холинолитиков заключается в уменьшении функциональной активности холинергических систем и восстановлении нарушенного в связи с дефицитом дофамина равновесия дофаминергической и холинергической систем в базальных ганглиях, блокировании обратного захвата дофамина из синаптической щели [20].
В настоящее время в ряде работ зарубежных авторов широко обсуждается вопрос о сравнительной терапевтической эффективности препаратов амантадина, холинолитиков (тригексифенидил, бипериден) в купировании экстрапирамидных нейролептических синдромов. Одни исследователи указывают на больший фармакотерапевтический эффект амантадина [19], другие – об эквивалентной эффективности этого препарата и биперидена [21].
В двойном слепом контролируемом плацебо исследовании, проведенном W.Fann и C.Lake (1976 г.), выявлено, что при лечении нейролептического паркинсонизма амантадин в дозе 200 мг/сут терапевтически эквивалентен 8 мг/сут тригексифенидила [22]. Амантадин вызывал значительно менее тяжелые побочные эффекты, чем тригексифенидил. В то же время сообщается о ряде преимуществ амантадинов перед холинолитиками. По сравнению с антихолинергическими препаратами когнитивные функции у здоровых и больных шизофренией при лечении амантадином сохраняются более длительное время [23, 24]. Кроме того, применение антихолинергических препаратов, обладающих анксиолитическими свойствами и способностью вызывать эйфорию, может осложняться явлениями зависимости и злоупотребления и в этой связи высказывается предположение о том, что эти препараты снижают антипсихотический эффект нейролептиков [25]. Приводятся также данные о том, что антихолинергические средства могут продуцировать изменения в реполяризации сердца и провоцировать появление аритмий [18]. По данным некоторых исследователей [26], антихолинергические препараты индуцируют развитие поздней дискинезии.
В сообщении Американской психиатрической ассоциации (1992 г.) указывается, что амантадин эффективен при лечении поздней дискинезии. Улучшение состояния наблюдали у всех 6 пациентов, получавших амантадин и нейролептики. S.Angus, J.Sugars, R.Boltezar и соавт. (1995 г.) провели двойное слепое перекрестное контролируемое плацебо исследование амантадина при поздней дискинезии. В результате исследования у 10 из 16 пациентов выявлено улучшение на 20% и у 2 пациентов – на 40%. Это улучшение было достигнуто при отмене антихолинергических препаратов.
Для сравнительного изучения фармакотерапевтической эффективности препаратов в качестве корректоров нейролептических экстрапирамидных синдромов больные изученной выборки разделены на две группы:
• группа 1 (n=70) – пациенты, получавшие в качестве корректора тригексифенидил (циклодол) в средней суточной дозе 7,5 мг в течение 1 мес терапии, с последующим переходом на поддерживающую терапию 6 мг/сут;Обе группы были сопоставимы по возрасту, полу, продолжительности и характеру нейролептической терапии.
• группа 2 (n=30) – пациенты, получавшие в качестве корректора амантадина сульфат (ПК-Мерц) в средней суточной дозе 300 мг в течение 1 мес терапии.
У пациентов обеих групп диагностированы следующие экстрапирамидные синдромы: паркинсонизм (28 и 70 больных по группам соответственно), ранняя дистония (12 и 7 пациентов), поздняя дистония (по 18 больных соответственно).
У всех обследованных больных на лечении экстрапирамидных нейролептических синдромов амантадином сульфатом в средней терапевтической дозе 300 мг/сут отмечена положительная динамика клинических показателей (табл. 2, 3).


Как это видно из данных, представленных в табл. 4, 5, эффективность тригексифенидила (циклодола) существенно ниже.
Преимущество амантадина сульфата перед тригексифенидилом реализуется при лечении основных двигательных нарушений, вызванных нейролептическим паркинсонизмом.


В отличие от тригексифенидила терапия амантадином сульфатом уменьшает выраженность расстройств позы и походки. Амантадина сульфат оказался более эффективным, чем тригексифенидил, и при коррекции дискинетических и дистонических синдромов.
Заключение
Полиморфизм клинических проявлений и разнообразие течения экстрапирамидных синдромов (они могут приобретать стойкий и даже необратимый характер), осложняющих нейролептическую терапию, а также их резистентность к традиционной корригирующей терапии холинолитиками диктует необходимость поиска альтернативного корригирующего лечения. Более эффективным средством является препарат амантадина сульфат (ПК-Мерц), обладающий рядом преимуществ перед тригексифенидилом. ПК-Мерц эффективен при поздней дискинезии, не вызывает когнитивных нарушений, оказывает нейропротекторный эффект, применение препарата редко сопровождается побочными эффектами. Все эти свойства обеспечивают амантадина сульфату предпочтительность при терапии экстрапирамидных нейролептических синдромов.
Список исп. литературыСкрыть список1. Victor M, Ropper AH. Adams and Victor’s principles of neurology. New York: McGraw-Hill, 2001.
2. Chakos M, Shirakawa O, Liebrman J et al. Striatal enlargement in rats chronically treated with neuroleptic. Biol Psychiat 1998; 44: 684–765.
3. Авруцкий Г.Я., Гурович И.Я., Громова В.В. Фармакотерапия психических заболеваний. М.: Медицина, 1974.
4. Saller C, Czupryna M, Salama A. J Pharmacol Exp Ther 1990; 253: 1162.
5. Marsden CD, Mindham RH, Mackay AV. Extrapyramidal movement disorders produced by antipsychotic drugs. In: P.B.Bradley (Ed.). Psychopharmacology and treatment of schizophrenia. Oxford: Univ. Pr., 1986.
6. Hardie RJ, Lees AJ. Neuroleptic-induced Parkinson\'s syndrome: clinical features and results of treatment with levodopa. J Neurol Neurosurg Psychiat 1988; 51 (6): 850–4.
7. Fahn S, Burke R. Tardive dyskinesias and other neuroleptic-induced syndromes. In: L.Rolwland (Ed.) Merrit’s textbook of neurology.-9th ed. Williams & Wilkins 1995; p. 733–6.
8. Rubey RN, Arana GW. Cognitive akathisia: clinical and theoretical aspects. In: A.B.Joseph, R.R.Young (Eds). Movement disorders in neurology and neuropsychiatry. Blackwell Science, 1999; p. 84–8.
9. Sachdev P. The epidemiology of drug-induced akathisia: part 1. Acute akathisia. Schizophr Bull 1996; 21: 431–49.
10. Burke R. Neuroleptic-induced tardive dyskinesia variants. In: A.E. Lang, W.J. Weiner (Eds). Drug-induced movement disorders. Mt. Kisco: Futura, 1992; p. 167–98.
11. Fahn WE. Tardive dyskinesia and other drug – induced movement disorders. Tardive dyskinesia. Research and Treatment. Ed. W.Fahr. New York, 1980; p. 215–31.
12. Klawans HL. Recognition and diagnosis of tardive dyskinesia. J Clin Psychiat 1985; 46 (4, Sec. 2): 3–7.
13. Lerner V, Kaptsan A, Miodownik С et al. Vitamin B6 in treatment of tardive dyskinesia: a preliminary case series study. Clin Neuropharmacol 1999; 22 (4): 241–3.
14. Jeste DV, Wyatt RJ. Therapeutic strategies against tardive dyskinesia: two decades of experience. Arch Gen Psychiat 1982; 39: 803–16.
15. Jimenez Jimenez FJ, Orti-Pareja M, Ayuso-Peralta L. Drug-induced parkinsonism in a movement disorders unit: a four-years survey. Parkinsonism Rel Disord 1996; 2: 145–9.
16. Khot V, Egan MF, Hyde TM, Wyatt RJ. Neuroleptics and classic tardive dyskinesia/In: A.E. Lang, W.J.Weiner (Eds). Drug-induced movement disorders. Mt. Kisco: Futura. 1992; p. 121–66.
17. Steen VM, Lovlie R, Mac Ewan T, McCreadie RG. Dopamine D3receptor gene variant and susceptibility to tardive dyskinesia in schizophrenic patients. Mol Psychiat 1997; 2: 86–8.
18. Decker BL, Davis JM, Janowsky DS et al. Amantadine hydrochloride treatment of tardive dyskinesia [letter]. New Engl J Med 1971; 285–680.
19. Janowsky DS, Sekerke HJ, Davis JM. Differential effects of amantadine on pseudo – Parkinsonism and tardive dyskinesia. Psychopharmacol Bull 1973; 9: 37–8.
20. Schreiber G, Avissar S, Umansky R et al. Implications of muscarinic receptor heterogeneity for research on tardive dyskinesia. In: Wolf ME, Mosnaim T, eds. Tardive Dyskinesia: Biological Mechanisms and Clinical Aspects. Washington, DC: American Psychiatric Association; 1988; 23–8.
21. McEvoy JP, McCue M, Freter S. Replacement of chronically administered anticholinergic drugs by amantadine in outpatient management of chronic schizophrenia. Clin Ther 1987; 9: 429–33.
22. Fann WE, Lake CR. Amantadine versus trihexyphenidyl in the treatment of neuroleptic induced parkinsonism. Am J Psychiat 1976; 133: 940–3.
23. McEvoy JP. A double – blind crossover comparison of antiparkinsonian drug therapy: amantadine versus anticholinergics in 90 normal volunteers, with an emphasis on differential effects on memory function. J Clin Psychiat 1987; 48 (9, suppl.): 20–3.
24. Patamianos G, Kellett JM. Anticholinergic drugs and memory: the effects of benzhexol on memory in a group of geriatric patients. Br J Psychiat 1982; 140: 470–2.
25. Pullen GP, Best NR, Maguire J. Anticholinergic drug use – A common problem? Br Med J 1984; 289: 612–3.
26. Greil W, Haag H et al. Effect of anticholinergics on tardive dyskinesia. A controlled discontinuation study. Br J Psychiat 1984; 145 (9): 304–10.


