Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№03 2013
Терапия нозогенных реакций и развитий личности у больных раком молочной железы №03 2013
Номера страниц в выпуске:21-27
Психические расстройства у больных раком молочной железы (РМЖ) значительно снижают эффективность проводимого лечения, реабилитационные способности и, соответственно, негативно сказываются на прогнозе онкологического заболевания (J.Haviland и соавт., 1999; M.Watson и соавт., 2005). Такая оценка распространяется в первую очередь на расстройства тревожно-депрессивного спектра (D.Spiegel, 1996; K.Hjerl и соавт., 2003; D.Spiegel, J.Gies-Davis, 2003; Chintamani, A.Gogne и соавт., 2011).
Резюме. Обоснование. Нозогенные реакции и развития характеризуются высокой распространенностью при раке молочной железы (РМЖ), однако методы их фармакологической коррекции разработаны недостаточно.
Цель исследования. Оценить потребность в лекарственной терапии и уточнить стратегии выбора препаратов для лечения нозогенных реакций и развитий при РМЖ.
Материал исследования. Психопатологическим методом обследованы 82 пациентки с РМЖ, из них 30 – с нозогенными реакциями и 52 – с развитиями личности (средний возраст 49,7±11,1 и 56,8±6,7 года, средний период после выявления РМЖ 6,8±1,2 мес и 6,5±2,9 года соответственно).
Результаты. Рассчитана потребность в психофармакотерапии, составляющая 67% для 1-й группы и 68% – для 2-й группы. Наиболее высокие показатели эффективности психофармакотерапии определяются при тревожно-депрессивных нозогенных реакциях и развитиях личности по типу ипохондрической дистимии. Значительным ограничением современных селективных серотонинергических антидепрессантов является терапия тамоксифеном в связи с высоким риском нежелательных фармакологических взаимодействий, опосредованных ферментом CYP2D6.
Заключение. Высокая потребность в фармакотерапии определяет актуальность лекарственного лечения нозогенных расстройств при РМЖ, в первую очередь антидепрессантов. Выбор препаратов должен осуществляться на основании баланса эффективности и безопасности с учетом риска неблагоприятных лекарственных взаимодействий.
Ключевые слова: рак молочной железы, нозогения, расстройство личности, психофармакотерапия.
Therapy of nozogenic reactions and personality disorders
in patients with breast cancer
O.V.Shushpanova
Mental Health Research Centre of Russian Academy of Medical Science, Moscow
Summary. Backgrounds. Nosogenic reactions (NR) and personality disorders (PD) are very common in patients with breast cancer (BC), however methods for psychopharmacological therapy for these patients require further clarification.
Aim. To assess the need of psychopharmacotherapy and strategy of drug choice for treatment of NR and PD in BC patients.
Patients. Structural clinical in terview was used for psychopathological assessment of 82 patients, including 30 patients with nosogenic reactionas and 52 patients with PD (mean age 49,7±11,1 and 56,8±6,7 years, mean time from first diagnosis of BC 6,8±1,2 months and 6,5±2,9 years respectively).
Results. 67 and 68% BC patients with NR and PD respectively display pschyopathological symptoms requiring pharmacological intervention. The highest levels of effectiveness of newer antidepressants in patients with anxious-depressive NR and dysthymic PD disorders. The main limitation in use of newer selective serotoninergic antidepressants (AD) is the risk of drug interactions with tamoxifen due to the potential of inhibitory effects of some AD on cytochrome CYP2D6.
Conclusions. High prevalence of NR and PD in BC patients determine the need for psychopharmacotherapy with AD. The choice of the AD should be carried out after the assessment of efficacy/safety proportion including the risk of drug interactions.
Key words: breast cancer, nosogenia, personality disorder, psychopharmacotherapy.
Введение
Психические расстройства у больных раком молочной железы (РМЖ) значительно снижают эффективность проводимого лечения, реабилитационные способности и, соответственно, негативно сказываются на прогнозе онкологического заболевания (J.Haviland и соавт., 1999; M.Watson и соавт., 2005). Такая оценка распространяется в первую очередь на расстройства тревожно-депрессивного спектра (D.Spiegel, 1996; K.Hjerl и соавт., 2003; D.Spiegel, J.Gies-Davis, 2003; Chintamani, A.Gogne и соавт., 2011).
В литературе представлены сведения об эффективности как психотерапевтических методов воздействия, так и фармакологической поддержки. Широко известны также данные об улучшении комплаентности больных и о значимо лучшей переносимости и эффективности химиотерапии (ХТ) при лечении психотропными средствами (D.Spiegel, 1996; D.Kissane, 2009).
Из всех доступных методов лечения психических расстройств психотерапевтическое воздействие безусловно является наиболее безопасным методом коррекции в условиях РМЖ (D.Kissane, M.Watson, 2011). Тем не менее широкий спектр возникающих психопатологических расстройств различной степени тяжести (тревожно-фобических, истерических, соматоформных, аффективных) требует применения психофармакотерапии. Приводятся данные о лучшем и более продолжительном эффекте терапии психотропными препаратами (P.Maguire и соавт., 1985).
Наиболее объемный и клинически важный раздел опыта применения психофармакотерапии относится к антидепрессантам как самым частым средствам терапии не только депрессивных расстройств, но и разных соматовегетативных симптомов, возникающих у больных РМЖ. Эффективность терапии антидепрессантами групп селективных ингибиторов обратного захвата серотонина (СИОЗС) и селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСН) расстройств тревожного и депрессивного спектра у больных РМЖ подтверждена в многочисленных исследованиях (M.Pasquini и соавт., 2006; J.Roscoe и соавт., 2005; R.Möslinger-Gehmayr и соавт., 2000).
Антидепрессанты, обладающие серотонинергической активностью, достаточно часто используются и для купирования посткастрационных соматовегетативных явлений у женщин, перенесших химиотерапевтическое/ хирургическое лечение по поводу РМЖ (N.Biglia и соавт., 2005; D.Pachman и соавт., 2010; N.Henry и соавт., 2011).
В основном речь идет о коррекции так называемых приливов и вегетативных «вспышек» на фоне антиэстрогенной терапии (C.Loprinzi, T.Pisansky, 1998; K.Yonkers, 2003; V.Stearns и соавт., 2005; A.Boekhout и соавт., 2011).
Однако тимоаналептическая терапия у больных РМЖ может сопровождаться нежелательными явлениями (НЯ). В частности, такого рода лекарственные взаимодействия зарегистрированы при использовании антидепрессантов с серотонинергической активностью. Подчеркивается антагонистическое взаимодействие препарата гормонотерапии тамоксифена с антидепрессантами группы СИОЗС. Дело в том, что активный метаболит тамоксифена – эндоксифен – образуется в результате преобразования исходной молекулы ферментом цитохрома P-450 субъединицей (CYP) 2D6. Поскольку большинство антидепрессантов группы СИОЗС являются ингибиторами (CYP) 2D6 субъединицы, противоопухолевый эффект тамоксифена сводится на нет (Y.Jin, Z.Desta, 2005; A.Zourkova, E.Hadasova, 2003; O.Irarrázaval, 2011; F.Caraci и соавт., 2011).
Особенно выраженный ингибирующий эффект обнаружен у пароксетина и флуоксетина, в связи с чем эти препараты отнесены к числу строго противопоказанных при терапии у больных, принимающих тамоксифен. В результате специальных исследований выявлены препараты с наименьшим ингибирующим влиянием либо отсутствием какого-либо действия на изофермент P-450 (CYP) 2D6, что делает их вполне приемлемыми для купирования тревожно-депрессивных и соматовегетативных расстройств.
J.Desmarais и K.Looper (2009 г.) провели анализ большого количества клинических исследований, из которых было отобрано семь наиболее важных работ по изучению ингибирующего влияния антидепрессантов на систему P-450 (CYP) 2D6. В результате среди наименее опасных с точки зрения фармакологических взаимодействий оказались препараты венлафаксин (оказывает минимальное влияние на метаболизм тамоксифена) и дезвенлафаксин (вообще не метаболизируется системой P-450).
Миртазапин – еще один препарат выбора с минимальным влиянием на изофермент (CYP) 2D6. В 2010 г. авторы подтвердили безопасность венлафаксина и дезвенлафаксина для купирования депрессий и вегетососудистых расстройств у больных, получающих гормонотерапию тамоксифеном. O.Irarrázaval (2011 г.), присоединяясь к этой позиции, включает в перечень рекомендуемых препаратов милнаципран, эсциталопрам и циталопрам как наименее опасные с точки зрения перекрестного взаимодействия.
Наряду с антидепрессантами у больных РМЖ широкое применение получили транквилизаторы бензодиазепинового ряда. Наиболее часто бензодиазепины в небольших дозировках (в сочетании с дексаметазоном) используются с целью купирования либо предупреждения тошноты и рвоты при ХТ (F.Tong и соавт., 1998; N.Tsavaris и соавт., 2001; M.Koga и соавт., 2008), а также при расстройствах адаптации с тревожной симптоматикой (D.Razavi и соавт., 1993; D.Razavi и соавт., 1999), делириозных состояниях (S.Ramani, A.Karnad, 1996) и нарушениях сна, связанных с ХТ (C.Costantini и соавт., 2011).
Антипсихотические средства применяются реже. Так, М.Pasquini и соавт. (2009 г.) использовали кветиапин в дозе 25–100 мг для устранения нарушений сна у больных РМЖ, индуцированных приемом тамоксифена.
Авторы сообщают о стойкости (более 6 нед после окончания терапии) лечебного эффекта кветиапина. Ограниченное применение антипсихотических средств у этого контингента связано с опасностью развития побочных эффектов (в частности, гиперпролактинемии1) – одного из факторов риска РМЖ (J.Bostwick и соавт., 2009; P.Harvey и соавт., 2008). Вместе с тем некоторые исследования опровергают высокий риск возникновения РМЖ у пациентов с выявленной гиперпролактинемией (K.Berinder и соавт., 2011).
По данным L.Azoulay и соавт. (2011 г.), полученным в ретроспективном исследовании влияния приема типичных и атипичных нейролептиков на возникновение РМЖ в популяции женщин, принимавших антипсихотические средства в период с 1988 по 2007 г., с последующим проспективным наблюдением по 2010 г., установлено следующее. Из общей когорты женщин, находящихся на лечении антипсихотиками (106 362 пациентки), РМЖ был зарегистрирован в 1237 случаях.
По результатам сравнительного исследования изолированное применение некоторых атипичных антипсихотиков не повышает риска возникновения РМЖ (относительный риск 0,81; 95% доверительный интервал 0,63–1,05). Авторы утверждают, что оланзапин, например, не обладает кумулятивным эффектом, а его использование сопряжено с наименьшим риском развития РМЖ сравнительно с типичными нейролептиками и рисперидоном.
Как об этом свидетельствуют изложенные данные, проблема потребности в психофармакотерапии и выбора оптимальных ее методов в психоонкологии остается актуальной, что определило цель настоящего исследования.
Материалы и методы
Исследование выполнено в отделении соматогенной психической патологии (руководитель – доктор медицинских наук, профессор С.В.Иванов) отдела по изучению пограничной психической патологии и психосоматических расстройств (заведующий – академик РАМН, профессор А.Б.Смулевич) ФГБУ НЦПЗ РАМН в сотрудничестве с отделениями ХТ и комбинированного лечения злокачественных опухолей (заведующий – член-корреспондент РАМН М.Р.Личиницер), клинической фармакологии и ХТ (заведующий – профессор С.А.Тюляндин) РОНЦ им. Н.Н.Блохина РАМН.
Критерии включения: соответствие психического состояния больных верифицированным РМЖ критериям нозогении (реакции, развития).
Исключались пациенты, состояние которых не позволяло выполнить психопатологическое обследование в необходимом объеме: тяжелое соматическое заболевание, умственная отсталость, грубое органическое поражение центральной нервной системы, прогредиентная шизофрения с выраженными изменениями личности, злоупотребление психоактивными веществами.
Изученную выборку составили 82 больных с нозогенными реакциями и развитиями личности, последовательно поступавшие и находящиеся на амбулаторном или стационарном лечении в отделениях ХТ РОНЦ
им. Н.Н.Блохина РАМН с диагнозом РМЖ. Все пациентки изученной выборки госпитализированы в РОНЦ в пред- либо послеоперационном периоде радикальной мастэктомии, либо проходили очередной курс химио- или лучевой терапии.
Психопатологическая оценка с квалификацией типологической (и нозологической) принадлежности наблюдаемого расстройства в соответствии с концепцией психосоматических соотношений проводилась в рамках клинических разборов с участием сотрудников НЦПЗ РАМН под руководством академика РАМН профессора А.Б.Смулевича и профессора С.В.Иванова.
Для формализованной оценки психического статуса и его динамики в процессе терапии использовалась: госпитальная шкала тревоги и депрессии – HADS (A.Zigmond, R.Snaith, 1983), включающая 14 утверждений, предназначенных для определения выраженности ситуативной тревоги и сниженного настроения, связанных с проявлением соматического заболевания (эмоциональная модальность реагирования); шкала тревоги Гамильтона – HAM-D (M.Hamilton, 1967); шкала общего клинического впечатления – CGI (W.McGuya, 1976) для оценки тяжести заболевания (CGI-тяжесть) и улучшения (CGI-улучшение).
В ходе клинической дифференциации пациентки разделены на 2 группы: 1-я группа – с нозогенными реакциями, 2-я группа – с развитиями личности.
В группе пациенток с нозогенными реакциями (30 наблюдений; от 28 до 71 года, средний возраст 49,7±11,1 года) преобладали больные с высшим образованием: высшее – 18 (60%) наблюдений; среднее специальное – 12 (40%), из них большая часть – 22 (73,3%) состояли в браке. При оценке трудоспособности больные продемонстрировали следующие показатели: работали в прежнем режиме без снижения нагрузки – 12 (40%), со снижением нагрузки/квалификации – 8 (26,6%), не работали в связи с заболеванием – 7 (23,3%), а еще
3 (10%) пациентки находились на пенсии. Средняя длительность онкологического заболевания на момент включения в выборку составила 6,8 мес (6,8±1,2 мес).
без снижения нагрузки/профессиональной квалификации – 8 (15,3%), со снижением нагрузки/квалификации – 17 (32,6%), не работали в связи с заболеванием (находились на инвалидности) – 20 (38,5%), находились на пенсии – 7 (13,4%) пациенток.
Лечение психических расстройств проводилось с применением методов психофармакологической терапии.
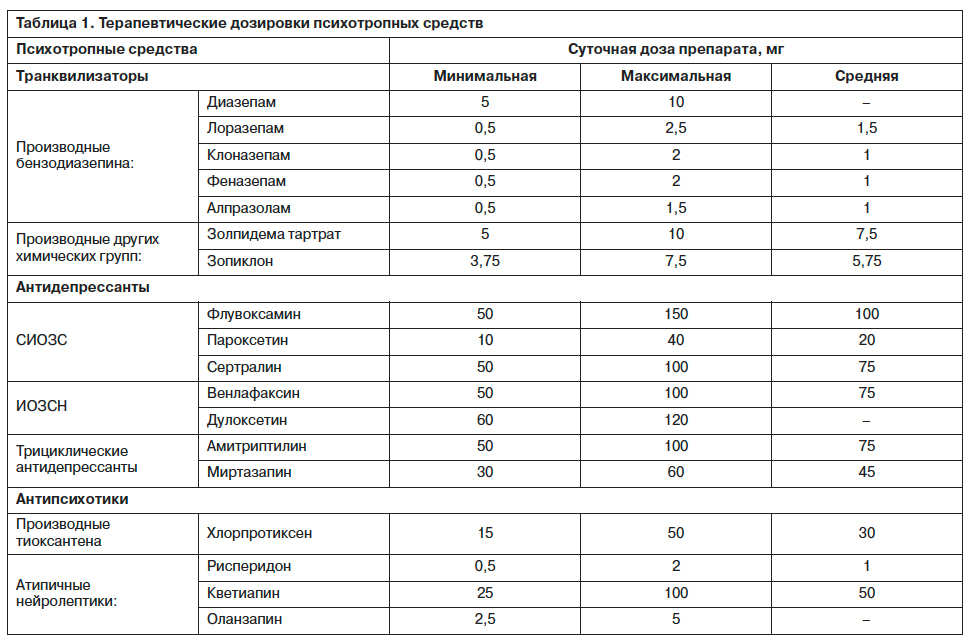
В соответствии со стандартными показаниями предусматривалась возможность применения психотропных средств основных классов. Схема терапии подбиралась эмпирически в зависимости от синдромальной структуры и динамики психических расстройств: препараты назначались в рекомендованных для больных с психосоматическими расстройствами (С.В.Иванов, 2011) дозах (табл. 1).
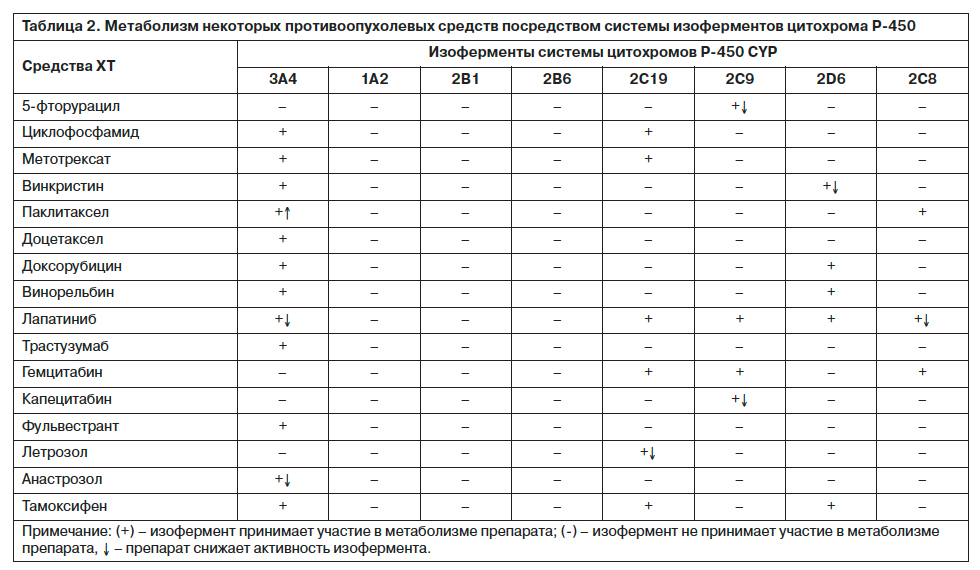
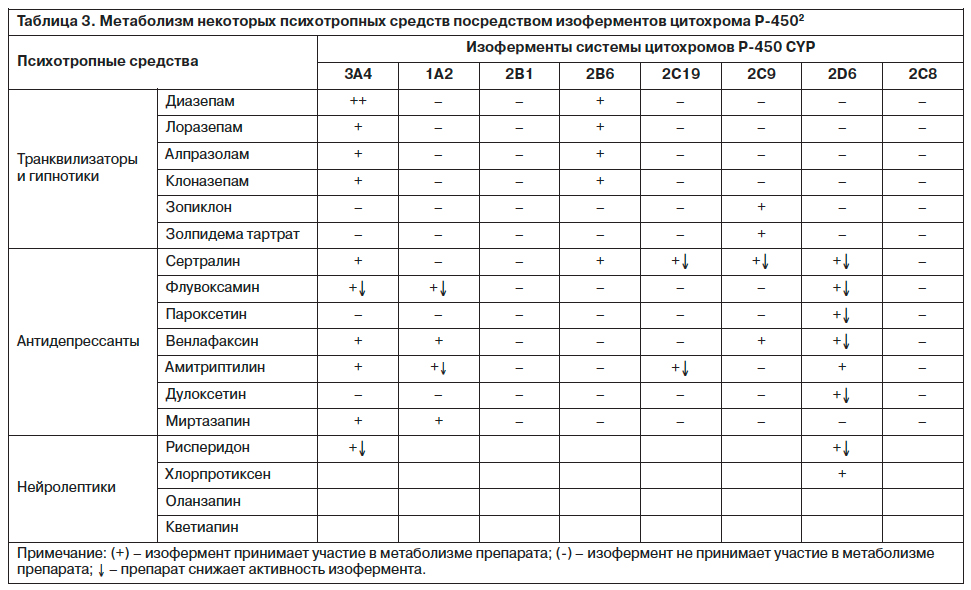
Возможные нежелательные перекрестные фармакологические эффекты оценивались по степени взаимодействия конкретных лекарственных веществ с системой ферментов цитохрома P-450 (табл. 2, 3).
Для купирования тревожной и депрессивной симптоматики использовались современные анксиолитики и антидепрессанты, для лекарственной коррекции гипоманиакальных состояний и паранойяльных реакций применялись атипичные антипсихотики.
Эффективность терапии оценивалась через 6 нед лечения (непосредственный эффект) и через 12 нед (отдаленный эффект). Длительность психофармакотерапии варьировала от 3 до 18 мес (в среднем 10±2 мес). При этом в случае прекращения терапии спустя несколько месяцев (от 6 до 12 мес) медикаментозного привыкания не формировалось, о чем свидетельствует отсутствие синдрома отмены препарата. Переносимость психофармакотерапии была хорошей. Первые признаки клинического улучшения наступали на 10–14-й день терапии антидепрессантами и достигали максимального уровня к 6–12-й неделе лечения. В настоящем исследовании не зафиксировано ни одного случая неблагоприятных лекарственных взаимодействий между психотропными средствами и препаратами, использующимися для ХТ РМЖ. НЯ (тошнота, сонливость, головокружения) носили кратковременный обратимый характер, отмечались в 5 (42,8%) случаях и не требовали отмены терапии.
Потребность в фармакотерапии выявлена у 20 из 30 (67%) пациенток 1-й группы, у которых диагностированы нозогенные реакции; из них при тревожно-депрессивных реакциях – 15 (88%) больных, при тревожно-диссоциативных – 9 (100%), при тревожно-гипоманиакальных – 3 (75%)3.
Терапия нозогенных реакций
При тревожно-депрессивной нозогенной реакции наблюдался хороший ответ на терапию антидепрессантами (13 больных; 86,6% респондеров с редукцией стартовых баллов тревоги и депрессии по HADS более 50%). Средний суммарный бал по шкале CGI на последнем визите составил 1,5, что является средним значением между оценками: 1 – «очень выраженное улучшение» и 2 – «выраженное улучшение». Следует отметить быстрое развитие антидепрессивного и анксиолитического эффекта с достоверной (р<0,05) редукцией стартовых суммарных баллов тревоги и депрессии по HADS через 7–10 дней у большинства (70%) пациентов.
Полная редукция тревожно-депрессивных расстройств отмечалась у 2 пациенток с начальными (I–II) стадиями РМЖ. В большинстве (75%) случаев значимый терапевтический эффект развивается уже при назначении невысоких стартовых дозировок, не достигающих рекомендуемых в литературе (А.Б.Смулевич, 2007, 2011). Выбор антидепрессантов осуществлялся в зависимости от преобладания в клинической картине той или иной симптоматики: в случае преобладания тревожных проявлений назначались средства с противотревожным и/или седативным эффектом: пароксетин (10–40 мг/сут), миртазапин (15–45 мг/сут), амитриптилин (50–100 мг/сут). В случае преобладания тоскливого аффекта с признаками апатии назначались препараты с психостимулирующим и/или «двойным» действием ингибиторов обратного захвата серотонина и норадреналина (ИОЗСН): сертралин (до 100 мг/сут), венлафаксин (до 150 мг/сут), дулоксетин (до 120 мг/сут). С целью купирования тревожных и инсомнических расстройств дополнительно к терапии антидепрессантами назначались анксиолитические препараты (диазепам, алпразолам, клоназепам) либо гипнотики (зопиклон, золпидема тартрат).
В ряду признаков улучшения отмечены значительная редукция тревожной симптоматики, нормализация сна, аппетита, снижение подавленности, восстановление аффективного фона к 6-й неделе лечения. Полная стабилизация клинического эффекта наблюдалась к 12-й неделе психофармакотерапии. У 85% пациенток в силу особенностей диагноза и прогноза основного заболевания и при последующем динамическом наблюдении сохранялись остаточные фоновые проявления тревоги. С целью закрепления достигнутой ремиссии проводилась поддерживающая терапия с частичным снижением дозировок (антидепрессанты) либо отменой (транквилизаторы) психотропных средств на протяжении 6–12 мес в зависимости от исходной степени тяжести и динамики тревожно-депрессивной симптоматики.
У больных с диссоциативной нозогенной реакцией (n=9) основной целью психофармакотерапии являлись коррекция отношения к болезни и повышение комплаентности.
Медикаментозная коррекция в той или иной степени потребовалась всем пациентам. В большинстве (n=7) случаев диссоциативная реакция протекала в легкой форме и сопровождалась неглубокими тревожными и инсомническими расстройствами (нарушения сна, беспокойство, неусидчивость, тревожно-дисфорические реакции). Препаратами выбора в этих случаях оказались анксиолитики (алпразолам 0,5–2 мг/сут, феназепам 0,5–1 мг/сут). В 2 наблюдениях, в которых диагностирована тяжелая форма диссоциативной реакции, потребовалась корригирующая терапия атипичными антипсихотиками (кветиапин 25–100 мг/сут, рисперидон 0,5–1 мг/сут).
По мере редукции диссоциативных расстройств в результате успешной терапии в клинической картине на первый план выступала тревожная симптоматика, которая купировалась применением анксиолитиков. У 2 пациенток с тяжелой формой диссоциации в процессе проводимой терапии отмечались остаточные явления диссоциативных расстройств легкой степени. В среднем через 2 нед лечения у всех пациенток отмечалось улучшение комплаентности.
Всем 3 пациенткам с тревожно-гипоманиакальной реакцией4 назначались атипичные антипсихотики с седативными свойствами (кветиапин 25–100 мг/сут, хлорпротиксен 25–100 мг/сут, оланзапин 2,5 мг/сут).
Во всех наблюдениях на 7-й день терапии отмечалась положительная динамика с выраженным тимоаналептическим эффектом, редукцией психомоторного возбуждения и раздражительности, нормализацией сна. Поведение пациентов приобретало уравновешенный, комплаентный характер.
Терапия нозогенных развитий
Потребность в психофармакотерапии у больных, отнесенных к этой группе, варьирует в зависимости от типа динамики патологического развития и выявляется у 68% (40 из 52 больных 2-й группы).
В случае патохарактерологического развития по типу ипохондрической дистимии доля пациентов с психопатологическими расстройствами, требующими медикаментозного воздействия, составила 93% (28 наблюдений). У больных с развитием по типу «паранойи борьбы» этот показатель значительно ниже – 66% (6 наблюдений), и еще ниже при развитии по типу «новой жизни» – 25% (1 наблюдение)5. Пациенты с посттравматическим нозогенным развитием обнаруживали необходимость в психофармакотерапии в случае редукции гипоманиакального аффекта с преобладанием депрессивной симптоматики на фоне прогрессирования РМЖ. Доля пациентов, требующих коррекции, в этой группе составила 87% (7 из 8 пациентов).
Как и при терапии нозогенных реакций, назначались психотропные средства 3 основных классов – транквилизаторы, антидепрессанты и нейролептики. Для купирования сопутствующих инсомнических расстройств применялись препараты бензодиазепинового ряда (клоназепам, феназепам) либо гипнотики (золпидема тартрат, зопиклон). Лечение аффективных, тревожно-фобических и других расстройств, лежащих в основе патологических развитий личности, проводилось в соответствии с их синдромальной структурой. Более сложные, стойкие и затяжные состояния, коморбидные личностным расстройствам, требовали индивидуального подхода и длительных курсов корригирующей терапии.
При развитии личности по типу ипохондрической дистимии установлена высокая эффективность психофармакотерапии. Доля пациентов с полной редукцией психопатологических симптомокомплексов (тревожно-фобические, астенические, соматовегетативные, аффективные расстройства) составила 46,6% (14 наблюдений). Установлена связь положительного эффекта терапии с комбинированным применением антидепрессантов и транквилизаторов. Использовались высокопотенциальные бензодиазепины и антидепрессанты с анксиолитической активностью: алпразолам/лоразепам 0,5–1 мг/сут + пароксетин 20–40 мг/сут, амитриптилин 50–75 мг/сут, флувоксамин 50–100 мг/сут, миртазапин 15–45 мг/сут.
При выявлении в клинической картине наряду с аффективными астенических нарушений эффективной оказалась монотерапия антидепрессантами группы ИОЗСН: венлафаксин 75 мг/сут, дулоксетин 60 мг/сут.
У 70% (n=21) больных в рамках ипохондрической дистимии усиливались соматовегетативные посткастрационные (климактерические) явления, связанные с применением антиэстрогенной гормонотерапии. Состояния гипоэстрогении (поливестибулопатия, приливы жара, повышение артериального давления, приступы сердцебиения, головокружения, потливости) купировались с помощью сочетанной терапии антидепрессантами группы СИОЗС и противотревожных средств.
В большинстве (53,5%; 16 наблюдений) случаев клиническое улучшение наступало на 10–14-й день с дальнейшей постепенной редукцией тревожной и депрессивной симптоматики до субсиндромального уровня. Нормализовался аффективный фон, отмечалось улучшение сна и аппетита, дезактуализировались страхи, связанные с онкологическим заболеванием. При этом сохранялись явления симптоматической и реактивной лабильности (экзацербация психопатологических расстройств под влиянием соматогенных и психогенных факторов). В этих случаях рекомендовалось длительное применение минимальных доз используемых психотропных средств.
При развитии по типу паранойи борьбы положительный терапевтический эффект достигается применением атипичных антипсихотиков: кветиапин 25–100 мг/сут, рисперидон 1–2 мг/сут, оланзапин 2,5 мг/сут.
В этих наблюдениях (n=6) отмечена положительная динамика с постепенной дезактуализацией сверхценных идей полного излечения онкологического заболевания, снижением раздражительности и подозрительности в адрес медицинского персонала. Максимальная редукция указанной симптоматики формируется к 6–12-й неделе приема препаратов. Наряду с редукцией психопатологических проявлений отмечается улучшение комплаентности.
При досрочной отмене препаратов по каким-либо причинам (необходимость операции, тяжелое соматическое состояние, участие пациентов в исследовании противоопухолевых средств по протоколу, самостоятельная отмена/отказ от терапии, как это отмечено у
3 из 9 пациенток с развитием по типу «паранойи борьбы») отмечалось возобновление психопатологической симптоматики в среднем через 2–5 дней после отмены.
Таким образом, полученные в настоящем исследовании данные подтверждают эффективность психофармакотерапии у больных РМЖ с выявленными психическими расстройствами, показанной 67% пациенток с нозогенными реакциями и 68% – с развитиями личности. Наиболее высокие показатели эффективности психофармакотерапии наблюдаются при тревожно-депрессивных нозогенных реакциях и развитиях личности по типу ипохондрической дистимии.
Пациенткам с расстройствами тревожно-депрессивного, астенического и соматовегетативного спектров целесообразно назначение современных селективных серотонин- и норадренергических антидепрессантов, обладающих хорошей переносимостью и безопасностью (включая минимальный риск лекарственных взаимодействий). С учетом достаточно высокого лечебного эффекта, установленного в ходе проведенного исследования, указанные расстройства требуют назначения малых и средних терапевтических доз психотропных средств. Для купирования диссоциативных, гипоманиакальных и паранойяльных расстройств может быть рекомендовано использование атипичных антипсихотиков. Препараты и их дозы подбираются индивидуально с учетом переносимости и лекарственных взаимодействий.
Результаты исследования могут в значительной степени способствовать оптимизации психиатрической помощи онкологическим пациентам на всех этапах лечебного процесса.
Примечания
1Гиперпролактинемия как побочный эффект наиболее характерна для поколения типичных нейролептиков и регистрируется лишь для отдельных атипических антипсихотиков, в частности рисперидона и палиперидона.
2Сертралин оказывает ингибирующее воздействие на изофермент цитохрома 2D6 в дозировке, превышающей 75 мг/сут.
3Терапия пациентов с тревожно-фобической нозогенной реакцией (реакция избегания, n=6) отдельно не проводилась, так как эта реакция являлась преходящей и формировалась на догоспитальном этапе с последующей трансформацией в другие виды нозогений, а именно в тревожно-депрессивную (n=3) и тревожно-диссоциативную (n=3).
4Реакция по типу эндоформной гипомании, представленная в единственном наблюдении, из приводимых расчетов исключена.
5С учетом субсиндромального уровня психопатологических расстройств объем терапевтического вмешательства при этом типе развития ограничивается назначением противотревожных средств (алпразолам 0,5 мг/сут). Однако поскольку речь идет о единственном случае, окончательные терапевтические рекомендации могут быть сформулированы при расширении объема клинического материала.
Сведения об авторе
Шушпанова Ольга Владимировна – мл. науч. сотр. ФГБУ НЦПЗ РАМН. E-mail: sertralline@list.ru
Цель исследования. Оценить потребность в лекарственной терапии и уточнить стратегии выбора препаратов для лечения нозогенных реакций и развитий при РМЖ.
Материал исследования. Психопатологическим методом обследованы 82 пациентки с РМЖ, из них 30 – с нозогенными реакциями и 52 – с развитиями личности (средний возраст 49,7±11,1 и 56,8±6,7 года, средний период после выявления РМЖ 6,8±1,2 мес и 6,5±2,9 года соответственно).
Результаты. Рассчитана потребность в психофармакотерапии, составляющая 67% для 1-й группы и 68% – для 2-й группы. Наиболее высокие показатели эффективности психофармакотерапии определяются при тревожно-депрессивных нозогенных реакциях и развитиях личности по типу ипохондрической дистимии. Значительным ограничением современных селективных серотонинергических антидепрессантов является терапия тамоксифеном в связи с высоким риском нежелательных фармакологических взаимодействий, опосредованных ферментом CYP2D6.
Заключение. Высокая потребность в фармакотерапии определяет актуальность лекарственного лечения нозогенных расстройств при РМЖ, в первую очередь антидепрессантов. Выбор препаратов должен осуществляться на основании баланса эффективности и безопасности с учетом риска неблагоприятных лекарственных взаимодействий.
Ключевые слова: рак молочной железы, нозогения, расстройство личности, психофармакотерапия.
Therapy of nozogenic reactions and personality disorders
in patients with breast cancer
O.V.Shushpanova
Mental Health Research Centre of Russian Academy of Medical Science, Moscow
Summary. Backgrounds. Nosogenic reactions (NR) and personality disorders (PD) are very common in patients with breast cancer (BC), however methods for psychopharmacological therapy for these patients require further clarification.
Aim. To assess the need of psychopharmacotherapy and strategy of drug choice for treatment of NR and PD in BC patients.
Patients. Structural clinical in terview was used for psychopathological assessment of 82 patients, including 30 patients with nosogenic reactionas and 52 patients with PD (mean age 49,7±11,1 and 56,8±6,7 years, mean time from first diagnosis of BC 6,8±1,2 months and 6,5±2,9 years respectively).
Results. 67 and 68% BC patients with NR and PD respectively display pschyopathological symptoms requiring pharmacological intervention. The highest levels of effectiveness of newer antidepressants in patients with anxious-depressive NR and dysthymic PD disorders. The main limitation in use of newer selective serotoninergic antidepressants (AD) is the risk of drug interactions with tamoxifen due to the potential of inhibitory effects of some AD on cytochrome CYP2D6.
Conclusions. High prevalence of NR and PD in BC patients determine the need for psychopharmacotherapy with AD. The choice of the AD should be carried out after the assessment of efficacy/safety proportion including the risk of drug interactions.
Key words: breast cancer, nosogenia, personality disorder, psychopharmacotherapy.
Введение
Психические расстройства у больных раком молочной железы (РМЖ) значительно снижают эффективность проводимого лечения, реабилитационные способности и, соответственно, негативно сказываются на прогнозе онкологического заболевания (J.Haviland и соавт., 1999; M.Watson и соавт., 2005). Такая оценка распространяется в первую очередь на расстройства тревожно-депрессивного спектра (D.Spiegel, 1996; K.Hjerl и соавт., 2003; D.Spiegel, J.Gies-Davis, 2003; Chintamani, A.Gogne и соавт., 2011).
В литературе представлены сведения об эффективности как психотерапевтических методов воздействия, так и фармакологической поддержки. Широко известны также данные об улучшении комплаентности больных и о значимо лучшей переносимости и эффективности химиотерапии (ХТ) при лечении психотропными средствами (D.Spiegel, 1996; D.Kissane, 2009).
Из всех доступных методов лечения психических расстройств психотерапевтическое воздействие безусловно является наиболее безопасным методом коррекции в условиях РМЖ (D.Kissane, M.Watson, 2011). Тем не менее широкий спектр возникающих психопатологических расстройств различной степени тяжести (тревожно-фобических, истерических, соматоформных, аффективных) требует применения психофармакотерапии. Приводятся данные о лучшем и более продолжительном эффекте терапии психотропными препаратами (P.Maguire и соавт., 1985).
Наиболее объемный и клинически важный раздел опыта применения психофармакотерапии относится к антидепрессантам как самым частым средствам терапии не только депрессивных расстройств, но и разных соматовегетативных симптомов, возникающих у больных РМЖ. Эффективность терапии антидепрессантами групп селективных ингибиторов обратного захвата серотонина (СИОЗС) и селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСН) расстройств тревожного и депрессивного спектра у больных РМЖ подтверждена в многочисленных исследованиях (M.Pasquini и соавт., 2006; J.Roscoe и соавт., 2005; R.Möslinger-Gehmayr и соавт., 2000).
Антидепрессанты, обладающие серотонинергической активностью, достаточно часто используются и для купирования посткастрационных соматовегетативных явлений у женщин, перенесших химиотерапевтическое/ хирургическое лечение по поводу РМЖ (N.Biglia и соавт., 2005; D.Pachman и соавт., 2010; N.Henry и соавт., 2011).
В основном речь идет о коррекции так называемых приливов и вегетативных «вспышек» на фоне антиэстрогенной терапии (C.Loprinzi, T.Pisansky, 1998; K.Yonkers, 2003; V.Stearns и соавт., 2005; A.Boekhout и соавт., 2011).
Однако тимоаналептическая терапия у больных РМЖ может сопровождаться нежелательными явлениями (НЯ). В частности, такого рода лекарственные взаимодействия зарегистрированы при использовании антидепрессантов с серотонинергической активностью. Подчеркивается антагонистическое взаимодействие препарата гормонотерапии тамоксифена с антидепрессантами группы СИОЗС. Дело в том, что активный метаболит тамоксифена – эндоксифен – образуется в результате преобразования исходной молекулы ферментом цитохрома P-450 субъединицей (CYP) 2D6. Поскольку большинство антидепрессантов группы СИОЗС являются ингибиторами (CYP) 2D6 субъединицы, противоопухолевый эффект тамоксифена сводится на нет (Y.Jin, Z.Desta, 2005; A.Zourkova, E.Hadasova, 2003; O.Irarrázaval, 2011; F.Caraci и соавт., 2011).
Особенно выраженный ингибирующий эффект обнаружен у пароксетина и флуоксетина, в связи с чем эти препараты отнесены к числу строго противопоказанных при терапии у больных, принимающих тамоксифен. В результате специальных исследований выявлены препараты с наименьшим ингибирующим влиянием либо отсутствием какого-либо действия на изофермент P-450 (CYP) 2D6, что делает их вполне приемлемыми для купирования тревожно-депрессивных и соматовегетативных расстройств.
J.Desmarais и K.Looper (2009 г.) провели анализ большого количества клинических исследований, из которых было отобрано семь наиболее важных работ по изучению ингибирующего влияния антидепрессантов на систему P-450 (CYP) 2D6. В результате среди наименее опасных с точки зрения фармакологических взаимодействий оказались препараты венлафаксин (оказывает минимальное влияние на метаболизм тамоксифена) и дезвенлафаксин (вообще не метаболизируется системой P-450).
Миртазапин – еще один препарат выбора с минимальным влиянием на изофермент (CYP) 2D6. В 2010 г. авторы подтвердили безопасность венлафаксина и дезвенлафаксина для купирования депрессий и вегетососудистых расстройств у больных, получающих гормонотерапию тамоксифеном. O.Irarrázaval (2011 г.), присоединяясь к этой позиции, включает в перечень рекомендуемых препаратов милнаципран, эсциталопрам и циталопрам как наименее опасные с точки зрения перекрестного взаимодействия.
Наряду с антидепрессантами у больных РМЖ широкое применение получили транквилизаторы бензодиазепинового ряда. Наиболее часто бензодиазепины в небольших дозировках (в сочетании с дексаметазоном) используются с целью купирования либо предупреждения тошноты и рвоты при ХТ (F.Tong и соавт., 1998; N.Tsavaris и соавт., 2001; M.Koga и соавт., 2008), а также при расстройствах адаптации с тревожной симптоматикой (D.Razavi и соавт., 1993; D.Razavi и соавт., 1999), делириозных состояниях (S.Ramani, A.Karnad, 1996) и нарушениях сна, связанных с ХТ (C.Costantini и соавт., 2011).
Антипсихотические средства применяются реже. Так, М.Pasquini и соавт. (2009 г.) использовали кветиапин в дозе 25–100 мг для устранения нарушений сна у больных РМЖ, индуцированных приемом тамоксифена.
Авторы сообщают о стойкости (более 6 нед после окончания терапии) лечебного эффекта кветиапина. Ограниченное применение антипсихотических средств у этого контингента связано с опасностью развития побочных эффектов (в частности, гиперпролактинемии1) – одного из факторов риска РМЖ (J.Bostwick и соавт., 2009; P.Harvey и соавт., 2008). Вместе с тем некоторые исследования опровергают высокий риск возникновения РМЖ у пациентов с выявленной гиперпролактинемией (K.Berinder и соавт., 2011).
По данным L.Azoulay и соавт. (2011 г.), полученным в ретроспективном исследовании влияния приема типичных и атипичных нейролептиков на возникновение РМЖ в популяции женщин, принимавших антипсихотические средства в период с 1988 по 2007 г., с последующим проспективным наблюдением по 2010 г., установлено следующее. Из общей когорты женщин, находящихся на лечении антипсихотиками (106 362 пациентки), РМЖ был зарегистрирован в 1237 случаях.
По результатам сравнительного исследования изолированное применение некоторых атипичных антипсихотиков не повышает риска возникновения РМЖ (относительный риск 0,81; 95% доверительный интервал 0,63–1,05). Авторы утверждают, что оланзапин, например, не обладает кумулятивным эффектом, а его использование сопряжено с наименьшим риском развития РМЖ сравнительно с типичными нейролептиками и рисперидоном.
Как об этом свидетельствуют изложенные данные, проблема потребности в психофармакотерапии и выбора оптимальных ее методов в психоонкологии остается актуальной, что определило цель настоящего исследования.
Материалы и методы
Исследование выполнено в отделении соматогенной психической патологии (руководитель – доктор медицинских наук, профессор С.В.Иванов) отдела по изучению пограничной психической патологии и психосоматических расстройств (заведующий – академик РАМН, профессор А.Б.Смулевич) ФГБУ НЦПЗ РАМН в сотрудничестве с отделениями ХТ и комбинированного лечения злокачественных опухолей (заведующий – член-корреспондент РАМН М.Р.Личиницер), клинической фармакологии и ХТ (заведующий – профессор С.А.Тюляндин) РОНЦ им. Н.Н.Блохина РАМН.
Критерии включения: соответствие психического состояния больных верифицированным РМЖ критериям нозогении (реакции, развития).
Исключались пациенты, состояние которых не позволяло выполнить психопатологическое обследование в необходимом объеме: тяжелое соматическое заболевание, умственная отсталость, грубое органическое поражение центральной нервной системы, прогредиентная шизофрения с выраженными изменениями личности, злоупотребление психоактивными веществами.
Изученную выборку составили 82 больных с нозогенными реакциями и развитиями личности, последовательно поступавшие и находящиеся на амбулаторном или стационарном лечении в отделениях ХТ РОНЦ
им. Н.Н.Блохина РАМН с диагнозом РМЖ. Все пациентки изученной выборки госпитализированы в РОНЦ в пред- либо послеоперационном периоде радикальной мастэктомии, либо проходили очередной курс химио- или лучевой терапии.
Психопатологическая оценка с квалификацией типологической (и нозологической) принадлежности наблюдаемого расстройства в соответствии с концепцией психосоматических соотношений проводилась в рамках клинических разборов с участием сотрудников НЦПЗ РАМН под руководством академика РАМН профессора А.Б.Смулевича и профессора С.В.Иванова.
Для формализованной оценки психического статуса и его динамики в процессе терапии использовалась: госпитальная шкала тревоги и депрессии – HADS (A.Zigmond, R.Snaith, 1983), включающая 14 утверждений, предназначенных для определения выраженности ситуативной тревоги и сниженного настроения, связанных с проявлением соматического заболевания (эмоциональная модальность реагирования); шкала тревоги Гамильтона – HAM-D (M.Hamilton, 1967); шкала общего клинического впечатления – CGI (W.McGuya, 1976) для оценки тяжести заболевания (CGI-тяжесть) и улучшения (CGI-улучшение).
В ходе клинической дифференциации пациентки разделены на 2 группы: 1-я группа – с нозогенными реакциями, 2-я группа – с развитиями личности.
В группе пациенток с нозогенными реакциями (30 наблюдений; от 28 до 71 года, средний возраст 49,7±11,1 года) преобладали больные с высшим образованием: высшее – 18 (60%) наблюдений; среднее специальное – 12 (40%), из них большая часть – 22 (73,3%) состояли в браке. При оценке трудоспособности больные продемонстрировали следующие показатели: работали в прежнем режиме без снижения нагрузки – 12 (40%), со снижением нагрузки/квалификации – 8 (26,6%), не работали в связи с заболеванием – 7 (23,3%), а еще
3 (10%) пациентки находились на пенсии. Средняя длительность онкологического заболевания на момент включения в выборку составила 6,8 мес (6,8±1,2 мес).
без снижения нагрузки/профессиональной квалификации – 8 (15,3%), со снижением нагрузки/квалификации – 17 (32,6%), не работали в связи с заболеванием (находились на инвалидности) – 20 (38,5%), находились на пенсии – 7 (13,4%) пациенток.
Лечение психических расстройств проводилось с применением методов психофармакологической терапии.
В соответствии со стандартными показаниями предусматривалась возможность применения психотропных средств основных классов. Схема терапии подбиралась эмпирически в зависимости от синдромальной структуры и динамики психических расстройств: препараты назначались в рекомендованных для больных с психосоматическими расстройствами (С.В.Иванов, 2011) дозах (табл. 1).

Возможные нежелательные перекрестные фармакологические эффекты оценивались по степени взаимодействия конкретных лекарственных веществ с системой ферментов цитохрома P-450 (табл. 2, 3).

Для купирования тревожной и депрессивной симптоматики использовались современные анксиолитики и антидепрессанты, для лекарственной коррекции гипоманиакальных состояний и паранойяльных реакций применялись атипичные антипсихотики.

Эффективность терапии оценивалась через 6 нед лечения (непосредственный эффект) и через 12 нед (отдаленный эффект). Длительность психофармакотерапии варьировала от 3 до 18 мес (в среднем 10±2 мес). При этом в случае прекращения терапии спустя несколько месяцев (от 6 до 12 мес) медикаментозного привыкания не формировалось, о чем свидетельствует отсутствие синдрома отмены препарата. Переносимость психофармакотерапии была хорошей. Первые признаки клинического улучшения наступали на 10–14-й день терапии антидепрессантами и достигали максимального уровня к 6–12-й неделе лечения. В настоящем исследовании не зафиксировано ни одного случая неблагоприятных лекарственных взаимодействий между психотропными средствами и препаратами, использующимися для ХТ РМЖ. НЯ (тошнота, сонливость, головокружения) носили кратковременный обратимый характер, отмечались в 5 (42,8%) случаях и не требовали отмены терапии.
Потребность в фармакотерапии выявлена у 20 из 30 (67%) пациенток 1-й группы, у которых диагностированы нозогенные реакции; из них при тревожно-депрессивных реакциях – 15 (88%) больных, при тревожно-диссоциативных – 9 (100%), при тревожно-гипоманиакальных – 3 (75%)3.
Терапия нозогенных реакций
При тревожно-депрессивной нозогенной реакции наблюдался хороший ответ на терапию антидепрессантами (13 больных; 86,6% респондеров с редукцией стартовых баллов тревоги и депрессии по HADS более 50%). Средний суммарный бал по шкале CGI на последнем визите составил 1,5, что является средним значением между оценками: 1 – «очень выраженное улучшение» и 2 – «выраженное улучшение». Следует отметить быстрое развитие антидепрессивного и анксиолитического эффекта с достоверной (р<0,05) редукцией стартовых суммарных баллов тревоги и депрессии по HADS через 7–10 дней у большинства (70%) пациентов.
Полная редукция тревожно-депрессивных расстройств отмечалась у 2 пациенток с начальными (I–II) стадиями РМЖ. В большинстве (75%) случаев значимый терапевтический эффект развивается уже при назначении невысоких стартовых дозировок, не достигающих рекомендуемых в литературе (А.Б.Смулевич, 2007, 2011). Выбор антидепрессантов осуществлялся в зависимости от преобладания в клинической картине той или иной симптоматики: в случае преобладания тревожных проявлений назначались средства с противотревожным и/или седативным эффектом: пароксетин (10–40 мг/сут), миртазапин (15–45 мг/сут), амитриптилин (50–100 мг/сут). В случае преобладания тоскливого аффекта с признаками апатии назначались препараты с психостимулирующим и/или «двойным» действием ингибиторов обратного захвата серотонина и норадреналина (ИОЗСН): сертралин (до 100 мг/сут), венлафаксин (до 150 мг/сут), дулоксетин (до 120 мг/сут). С целью купирования тревожных и инсомнических расстройств дополнительно к терапии антидепрессантами назначались анксиолитические препараты (диазепам, алпразолам, клоназепам) либо гипнотики (зопиклон, золпидема тартрат).
В ряду признаков улучшения отмечены значительная редукция тревожной симптоматики, нормализация сна, аппетита, снижение подавленности, восстановление аффективного фона к 6-й неделе лечения. Полная стабилизация клинического эффекта наблюдалась к 12-й неделе психофармакотерапии. У 85% пациенток в силу особенностей диагноза и прогноза основного заболевания и при последующем динамическом наблюдении сохранялись остаточные фоновые проявления тревоги. С целью закрепления достигнутой ремиссии проводилась поддерживающая терапия с частичным снижением дозировок (антидепрессанты) либо отменой (транквилизаторы) психотропных средств на протяжении 6–12 мес в зависимости от исходной степени тяжести и динамики тревожно-депрессивной симптоматики.
У больных с диссоциативной нозогенной реакцией (n=9) основной целью психофармакотерапии являлись коррекция отношения к болезни и повышение комплаентности.
Медикаментозная коррекция в той или иной степени потребовалась всем пациентам. В большинстве (n=7) случаев диссоциативная реакция протекала в легкой форме и сопровождалась неглубокими тревожными и инсомническими расстройствами (нарушения сна, беспокойство, неусидчивость, тревожно-дисфорические реакции). Препаратами выбора в этих случаях оказались анксиолитики (алпразолам 0,5–2 мг/сут, феназепам 0,5–1 мг/сут). В 2 наблюдениях, в которых диагностирована тяжелая форма диссоциативной реакции, потребовалась корригирующая терапия атипичными антипсихотиками (кветиапин 25–100 мг/сут, рисперидон 0,5–1 мг/сут).
По мере редукции диссоциативных расстройств в результате успешной терапии в клинической картине на первый план выступала тревожная симптоматика, которая купировалась применением анксиолитиков. У 2 пациенток с тяжелой формой диссоциации в процессе проводимой терапии отмечались остаточные явления диссоциативных расстройств легкой степени. В среднем через 2 нед лечения у всех пациенток отмечалось улучшение комплаентности.
Всем 3 пациенткам с тревожно-гипоманиакальной реакцией4 назначались атипичные антипсихотики с седативными свойствами (кветиапин 25–100 мг/сут, хлорпротиксен 25–100 мг/сут, оланзапин 2,5 мг/сут).
Во всех наблюдениях на 7-й день терапии отмечалась положительная динамика с выраженным тимоаналептическим эффектом, редукцией психомоторного возбуждения и раздражительности, нормализацией сна. Поведение пациентов приобретало уравновешенный, комплаентный характер.
Терапия нозогенных развитий
Потребность в психофармакотерапии у больных, отнесенных к этой группе, варьирует в зависимости от типа динамики патологического развития и выявляется у 68% (40 из 52 больных 2-й группы).
В случае патохарактерологического развития по типу ипохондрической дистимии доля пациентов с психопатологическими расстройствами, требующими медикаментозного воздействия, составила 93% (28 наблюдений). У больных с развитием по типу «паранойи борьбы» этот показатель значительно ниже – 66% (6 наблюдений), и еще ниже при развитии по типу «новой жизни» – 25% (1 наблюдение)5. Пациенты с посттравматическим нозогенным развитием обнаруживали необходимость в психофармакотерапии в случае редукции гипоманиакального аффекта с преобладанием депрессивной симптоматики на фоне прогрессирования РМЖ. Доля пациентов, требующих коррекции, в этой группе составила 87% (7 из 8 пациентов).
Как и при терапии нозогенных реакций, назначались психотропные средства 3 основных классов – транквилизаторы, антидепрессанты и нейролептики. Для купирования сопутствующих инсомнических расстройств применялись препараты бензодиазепинового ряда (клоназепам, феназепам) либо гипнотики (золпидема тартрат, зопиклон). Лечение аффективных, тревожно-фобических и других расстройств, лежащих в основе патологических развитий личности, проводилось в соответствии с их синдромальной структурой. Более сложные, стойкие и затяжные состояния, коморбидные личностным расстройствам, требовали индивидуального подхода и длительных курсов корригирующей терапии.
При развитии личности по типу ипохондрической дистимии установлена высокая эффективность психофармакотерапии. Доля пациентов с полной редукцией психопатологических симптомокомплексов (тревожно-фобические, астенические, соматовегетативные, аффективные расстройства) составила 46,6% (14 наблюдений). Установлена связь положительного эффекта терапии с комбинированным применением антидепрессантов и транквилизаторов. Использовались высокопотенциальные бензодиазепины и антидепрессанты с анксиолитической активностью: алпразолам/лоразепам 0,5–1 мг/сут + пароксетин 20–40 мг/сут, амитриптилин 50–75 мг/сут, флувоксамин 50–100 мг/сут, миртазапин 15–45 мг/сут.
При выявлении в клинической картине наряду с аффективными астенических нарушений эффективной оказалась монотерапия антидепрессантами группы ИОЗСН: венлафаксин 75 мг/сут, дулоксетин 60 мг/сут.
У 70% (n=21) больных в рамках ипохондрической дистимии усиливались соматовегетативные посткастрационные (климактерические) явления, связанные с применением антиэстрогенной гормонотерапии. Состояния гипоэстрогении (поливестибулопатия, приливы жара, повышение артериального давления, приступы сердцебиения, головокружения, потливости) купировались с помощью сочетанной терапии антидепрессантами группы СИОЗС и противотревожных средств.
В большинстве (53,5%; 16 наблюдений) случаев клиническое улучшение наступало на 10–14-й день с дальнейшей постепенной редукцией тревожной и депрессивной симптоматики до субсиндромального уровня. Нормализовался аффективный фон, отмечалось улучшение сна и аппетита, дезактуализировались страхи, связанные с онкологическим заболеванием. При этом сохранялись явления симптоматической и реактивной лабильности (экзацербация психопатологических расстройств под влиянием соматогенных и психогенных факторов). В этих случаях рекомендовалось длительное применение минимальных доз используемых психотропных средств.
При развитии по типу паранойи борьбы положительный терапевтический эффект достигается применением атипичных антипсихотиков: кветиапин 25–100 мг/сут, рисперидон 1–2 мг/сут, оланзапин 2,5 мг/сут.
В этих наблюдениях (n=6) отмечена положительная динамика с постепенной дезактуализацией сверхценных идей полного излечения онкологического заболевания, снижением раздражительности и подозрительности в адрес медицинского персонала. Максимальная редукция указанной симптоматики формируется к 6–12-й неделе приема препаратов. Наряду с редукцией психопатологических проявлений отмечается улучшение комплаентности.
При досрочной отмене препаратов по каким-либо причинам (необходимость операции, тяжелое соматическое состояние, участие пациентов в исследовании противоопухолевых средств по протоколу, самостоятельная отмена/отказ от терапии, как это отмечено у
3 из 9 пациенток с развитием по типу «паранойи борьбы») отмечалось возобновление психопатологической симптоматики в среднем через 2–5 дней после отмены.
Таким образом, полученные в настоящем исследовании данные подтверждают эффективность психофармакотерапии у больных РМЖ с выявленными психическими расстройствами, показанной 67% пациенток с нозогенными реакциями и 68% – с развитиями личности. Наиболее высокие показатели эффективности психофармакотерапии наблюдаются при тревожно-депрессивных нозогенных реакциях и развитиях личности по типу ипохондрической дистимии.
Пациенткам с расстройствами тревожно-депрессивного, астенического и соматовегетативного спектров целесообразно назначение современных селективных серотонин- и норадренергических антидепрессантов, обладающих хорошей переносимостью и безопасностью (включая минимальный риск лекарственных взаимодействий). С учетом достаточно высокого лечебного эффекта, установленного в ходе проведенного исследования, указанные расстройства требуют назначения малых и средних терапевтических доз психотропных средств. Для купирования диссоциативных, гипоманиакальных и паранойяльных расстройств может быть рекомендовано использование атипичных антипсихотиков. Препараты и их дозы подбираются индивидуально с учетом переносимости и лекарственных взаимодействий.
Результаты исследования могут в значительной степени способствовать оптимизации психиатрической помощи онкологическим пациентам на всех этапах лечебного процесса.
Примечания
1Гиперпролактинемия как побочный эффект наиболее характерна для поколения типичных нейролептиков и регистрируется лишь для отдельных атипических антипсихотиков, в частности рисперидона и палиперидона.
2Сертралин оказывает ингибирующее воздействие на изофермент цитохрома 2D6 в дозировке, превышающей 75 мг/сут.
3Терапия пациентов с тревожно-фобической нозогенной реакцией (реакция избегания, n=6) отдельно не проводилась, так как эта реакция являлась преходящей и формировалась на догоспитальном этапе с последующей трансформацией в другие виды нозогений, а именно в тревожно-депрессивную (n=3) и тревожно-диссоциативную (n=3).
4Реакция по типу эндоформной гипомании, представленная в единственном наблюдении, из приводимых расчетов исключена.
5С учетом субсиндромального уровня психопатологических расстройств объем терапевтического вмешательства при этом типе развития ограничивается назначением противотревожных средств (алпразолам 0,5 мг/сут). Однако поскольку речь идет о единственном случае, окончательные терапевтические рекомендации могут быть сформулированы при расширении объема клинического материала.
Сведения об авторе
Шушпанова Ольга Владимировна – мл. науч. сотр. ФГБУ НЦПЗ РАМН. E-mail: sertralline@list.ru
Список исп. литературыСкрыть список1. Иванов С.В. Терапия психосоматических расстройств. В кн.: Психические расстройства в клинической практике. Под ред. акад. РАМН А.Б.Смулевича. М., 2011; с. 441–607.
2. Смулевич А.Б. Депрессии при соматических и психических заболеваниях. М., 2007.
3. Azoulay L, Yin H, Renoux C, Suissa S. The use of atypical antipsychotics and the risk of breast cancer. Breast Cancer Res Treat 2011; 129 (2): 541–8.
4. Berinder K, Akre O, Granath F, Hulting AL. Cancer risk in hyperprolactinemia patients: a population-based cohort study. Eur J Endocrinol 2011; 165 (2): 209–15.
5. Biglia N, Torta R, Roagna R et al. Evaluation of low-dose venlafaxine hydrochloride for the therapy of hot flushes in breast cancer survivors. Maturitas 2005; 52 (1): 78–85.
6. Boekhout AH, Vincent AD, Dalesio OB et al. Management of hot flashes in patients who have breast cancer with venlafaxine and clonidine: a randomized, double-blind, placebo-controlled trial. J Clin Oncol 2011; 10 (29): 3862–8.
7. Bostwick JR, Guthrie SK, Ellingrod VL. Antipsychotic – induced hyperprolactinemia. Pharmacotherapy 2009; 29 (1): 64–73.
8. Caraci F, Crupi R, Drago F, Spina E. Metabolic drug interactions between antidepressants and anticancer drugs: focus on selective serotonin reuptake inhibitors and hypericum extract. Curr Drug Metab 2011; 12 (6): 570–7.
9. Chintamani C, Gogne A, Khandelwal R et al. The correlation of anxiety and depression levels with response to neoadjuvant chemotherapy in patients with breast cancer. JRSM Short Rep 2011; 2 (3): 15.
10. Costantini C, Ale-Ali A, Helsten T. Sleep aid prescribing practices during neoadjuvant or adjuvant chemotherapy for breast cancer.
J Palliat Med 2011; 14 (5): 563–6.
11. Desmarais JE, Looper KJ. Interactions between tamoxifen and antidepressants via cytochrome P-450 2D6. J Clin Psychiat 2009; 70 (12): 1688–97.
12. Hamilton M. Development of a rating scale for primary depressive illness. Br J Soc Clin Psychol 1967; 6 (4): 278–96.
13. Harvey PW, Everett DJ, Springall CJ. Adverse effects of prolactin in rodents and humans: breast and prostate cancer. J Psychopharmacol 2008; 22 (2): 20–7.
14. Haviland JS, Watson M, Greer S et al. Influence of psychological response on survival in breast cancer: a population-based cohort study. Lancet 1999; 354: 1331–6.
15. Henry NL, Banerjee M, Wicha M et al. Pilot study of duloxetine for treatment of aromatase inhibitor-associated musculoskeletal symptoms. Cancer 2011; 117 (24): 5469–75.
16. Irarrázaval OM. Antagonism of tamoxifen and antidepressants among women with breast cancer. Rev Med Chil 2011; 139 (1): 89–99.
17. Jin Y, Desta Z, Stearns V et al. CYP2D6 genotype, antidepressant use, and tamoxifen metabolism during adjuvant breast cancer treatment.
J Natl Cancer Inst 2005; 97 (1): 30–9.
18. Kissane D. Beyond the psychotherapy and survival debate: the challenge of social disparity, depression and treatment adherence in psychosocial cancer care. Psychooncol 2009; 18 (1): 1–5.
19. Koga M, Nakadozono M, Nukariya K et al. Clonazepam for chemotherapy-induced nausea and vomiting (CINV). Anticancer Res 2008; 28 (4C): 2433–6.
20. Loprinzi CL, Pisansky TM, Fonseca R et al. Pilot evaluation of venlafaxine hydrochloride for the therapy of hot flashes in cancer survivors. J Clin Oncol 1998; 16 (7): 2377–81.
21. Maguire P, Hopwood P, Tarrier N, Howell T. Treatment of depression in cancer patients. Acta Psychiat Scand (Suppl.) 1985; 320: 81–4.
22. McGuya W. Clinical Global Impression (CGI) In: ECDEU Assessment Manual for Psychopharmacol 1976; pp. 217–22.
23. Möslinger-Gehmayr R, Zaninelli R, Contu A. A double-blind comparative study of the effectiveness and tolerance of paroxetine and amitriptyline in treatment of breast cancer patients with clinically assessed depression. Zentralbl Gynakol 2000; 122 (4): 195–202.
24. Pachman DR, Jones JM, Loprinzi CL. Management of menopause-associated vasomotor symptoms: current treatment options, challenges and future directions. Int J Womens Health 2010; 9 (2): 123–35.
25. Pasquini M, Speca A, Biondi M. Quetiapine for tamoxifen-induced insomnia in women with breast cancer. Psychosomatics 2009; 50 (2): 159–61.
26. Ramani S, Karnad AB. Long-term subcutaneous infusion of midazolam for refractory delirium in terminal breast cancer. South Med J 1996; 89 (11): 1101–3.
27. Razavi D, Delvaux N, Farvacques C et al. Prevention of adjustment disorders and anticipatory nausea secondary to adjuvant chemotherapy: a double-blind, placebo-controlled study assessing the usefulness of alprazolam. J Clin Oncol 1993; 11 (7): 1384–90.
28. Razavi D, Kormoss N, Collard A et al. Comparative study of the efficacy and safety of trazodone vs clorazepate in the treatment of adjustment disorders in cancer patients: a pilot study. J Int Med Res 1999; 27 (6): 264–72.
29. Roscoe JA, Morrow GR, Hickok JT et al. Effect of paroxetine hydrochloride (Paxil) on fatigue and depression in breast cancer patients receiving chemotherapy. Breast Cancer Res Treat 2005; 89 (3): 243–9.
30. Spiegel D. Cancer and depression. Br J Psychiat Suppl 1996; 30: 109–16.
31. Spiegel D, Gies-Davis J. Depression and cancer: mechanisms and disease progression. Biol Psychiat 2003; 54 (3): 269–82.
32. Stearns V, Slack R, Greep N et al. Paroxetine is an effective treatment for hot flashes: results from a prospective randomized clinical trial. J Clin Oncol 2005; 1; 23 (28): 6919–30.
33. Tong FZ, Zhang JQ, Qiao XM et al. Effect of diazepam on delayed nausea and vomiting caused by anticancer agents. Gan To Kagaku Ryoho 1998; 25 (3): 391–5.
34. Tsavaris N, Kosmas C, Vadiaka M et al. Comparative study of tropisetron with the addition of dexamethasone or alprazolam in breast cancer patients receiving adjuvant chemotherapy with CEF (cyclophosphamide, epirubicin and 5-fluorouracil). J Chemother 2001; 13 (6): 641–7.
35. Watson M, Homewood J, Haviland J, Bliss JM. Influence of psychological response on breast cancer survival: 10-year follow-up of a population-based cohort. Eur J Cancer 2005; 41 (12): 1710–4.
36. Watson M, Kissane D. Handbook of psychotherapy in cancer care. UK: Wiley-Blackwell 2011.
37. Yonkers KA. Paroxetine treatment of mood disorders in women: premenstrual dysphoric disorder and hot flashes. Psychopharmacol Bull 2003; 37 (1): 135–47.
38. Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiat Scand 1983; 67 (6): 361–70.
39. Zourková A, Hadasová E. Paroxetine-induced conversion of cytochrome P-450 2D6 phenotype and occurence of adverse effects. Gen Physiol Biophys 2003; 22 (1): 103–13.
25 декабря 2013
Количество просмотров: 2596


