Клинический разбор в общей медицине №09 2021
Клинический разбор в общей медицине №09 2021
Проблема недержания мочи сквозь призму коморбидности
Аннотация
Проблема недержания мочи является междисциплинарной. Пациенты с этой проблемой попадают на прием к терапевтам, врачам общей практики, педиатрам, урологам, гинекологам, неврологам. Реальная клиническая практика в настоящее время характеризуется значимым ростом клинических ситуаций, когда сложно говорить о наличии у пациента лишь одного заболевания, в большинстве клинических случаев имеется сопутствующая или сочетанная патология.
Артериальная гипертензия и сахарный диабет относятся к наиболее распространенным соматическим заболеваниям. Для анализа влияния этих заболеваний на развитие недержания мочи нами проведен поиск в базах данных MEDLINE и elibrary.ru. Консолидированным проявлением коморбидности артериальной гипертензии, сахарного диабета и ожирения является метаболический синдром. Имеются лишь единичные сведения о возможном влиянии лекарственной терапии коморбидной патологии, в частности антигипертензивной терапии, на симптомы недержания мочи. Препараты, используемые для лечения недержания мочи, могут влиять на имеющуюся у пациентов коморбидную патологию.
У пациентов с недержанием мочи и наличием коморбидных состояний, которые одновременно являются и факторами риска недержания мочи, актуален выбор лекарственного препарата для лечения недержания мочи с минимальным влиянием на сопутствующую коморбидную патологию. Результаты многочисленных исследований демонстрируют, что применение троспия хлорида позволяет проводить эффективную и безопасную фармакотерапию недержания мочи, в том числе и у коморбидных пациентов.
Ключевые слова: недержание мочи, коморбидность, факторы риска, артериальная гипертензия, сахарный диабет, метаболический синдром, ожирение, лекарственная терапия, троспия хлорид.
Для цитирования: Трухан Д.И., Чуянова Ю.С., Макушин Д.Г. Проблема недержания мочи сквозь призму коморбидности. Клинический разбор в общей медицине. 2021; 9: 11–23. DOI: 10.47407/kr2021.2.9.00103
Проблема недержания мочи является междисциплинарной. Пациенты с этой проблемой попадают на прием к терапевтам, врачам общей практики, педиатрам, урологам, гинекологам, неврологам. Реальная клиническая практика в настоящее время характеризуется значимым ростом клинических ситуаций, когда сложно говорить о наличии у пациента лишь одного заболевания, в большинстве клинических случаев имеется сопутствующая или сочетанная патология.
Артериальная гипертензия и сахарный диабет относятся к наиболее распространенным соматическим заболеваниям. Для анализа влияния этих заболеваний на развитие недержания мочи нами проведен поиск в базах данных MEDLINE и elibrary.ru. Консолидированным проявлением коморбидности артериальной гипертензии, сахарного диабета и ожирения является метаболический синдром. Имеются лишь единичные сведения о возможном влиянии лекарственной терапии коморбидной патологии, в частности антигипертензивной терапии, на симптомы недержания мочи. Препараты, используемые для лечения недержания мочи, могут влиять на имеющуюся у пациентов коморбидную патологию.
У пациентов с недержанием мочи и наличием коморбидных состояний, которые одновременно являются и факторами риска недержания мочи, актуален выбор лекарственного препарата для лечения недержания мочи с минимальным влиянием на сопутствующую коморбидную патологию. Результаты многочисленных исследований демонстрируют, что применение троспия хлорида позволяет проводить эффективную и безопасную фармакотерапию недержания мочи, в том числе и у коморбидных пациентов.
Ключевые слова: недержание мочи, коморбидность, факторы риска, артериальная гипертензия, сахарный диабет, метаболический синдром, ожирение, лекарственная терапия, троспия хлорид.
Для цитирования: Трухан Д.И., Чуянова Ю.С., Макушин Д.Г. Проблема недержания мочи сквозь призму коморбидности. Клинический разбор в общей медицине. 2021; 9: 11–23. DOI: 10.47407/kr2021.2.9.00103
The problem of urinary incontinence through the prism of comorbidity
Dmitry I. Trukhan1, Yulia S. Chuyanova1,2, Dmitry G. Makushin3
dmitry_trukhan@mail.ru
Abstract
The problem of urinary incontinence is multidisciplinary. Patients with this problem get an appointment with therapists, general practitioners, pediatricians, urologists, gynecologists, neurologists. Real clinical practice is currently characterized by a significant increase in clinical situations, when it is difficult to talk about the presence of only one disease in a patient, and in most clinical cases the patient has a concomitant or combined pathology.
Arterial hypertension and diabetes mellitus are among the most common somatic diseases. To analyze the influence of these diseases on the development of urinary incontinence, we searched the MEDLINE and elibrary.ru databases. Metabolic syndrome is a consolidated manifestation of the comorbidity of hypertension, diabetes mellitus and obesity. There is only sporadic information on the possible effect of drug therapy for comorbid pathology, in particular antihypertensive therapy, on the symptoms of urinary incontinence. Drugs used to treat urinary incontinence can affect comorbid conditions in patients.
In patients with urinary incontinence and the presence of comorbid conditions, which are also risk factors for urinary incontinence, the choice of a drug for the treatment of urinary incontinence with minimal effect on comorbid comorbid pathology is relevant. The results of numerous studies demonstrate that the use of trospium chloride allows for effective and safe pharmacotherapy of urinary incontinence, including in comorbid patients.
Key words: urinary incontinence, comorbidity, risk factors, arterial hypertension, diabetes mellitus, metabolic syndrome, obesity, drug therapy, trospium chloride.
For citation: Trukhan D.I., Chuyanova Yu.S., Makushin D.G. The problem of urinary incontinence through the prism of comorbidity. Clinical review for general practice. 2021; 9: 11–23. DOI: 10.47407/kr2021.2.9.00103
Проблема недержания мочи является междисциплинарной. Пациенты с этой проблемой попадают на прием к терапевтам, врачам общей практики, педиатрам, урологам, гинекологам, неврологам. Под недержанием мочи (инконтиненцией) понимается объективно доказанная непроизвольная потеря мочи в результате нарушения функции мочевого пузыря и/или его сфинктеров. В работах ряда авторов разделяются термины «недержание» и «неудержание». Так, под недержанием мочи рассматривается выделение мочи без предварительного позыва к мочеиспусканию (отсутствует чувство переполнения мочевого пузыря), не поддающееся волевому контролю. А термин «неудержание» мочи предлагается рассматривать при выделении мочи после предварительного императивного позыва (появление непреодолимого желания помочиться с резким сокращением промежутка времени, до нескольких секунд, от возникновения позыва до обязательного опорожнения мочевого пузыря) к мочеиспусканию [1]. Выделяют 5 видов недержания мочи: ургентное, стрессовое, смешанное, недержание переполнения и транзиторное. Наибольшее значение имеют первые 2 вида и их комбинация.
Гиперактивный мочевой синдром (ГМП) – клинический синдром, определяющий ургентное мочеиспускание (в сочетании или без ургентного недержания мочи), основными симптомами которого являются поллакиурия и ноктурия, а также наличие сильных непроизвольных (неконтролируемых) позывов к мочеиспусканию [1]. Данный синдром, согласно рекомендациям Международного общества по удержанию мочи (International Continence Society – ICS), применим при отсутствии подтвержденной инфекции или какой-либо другой патологии [2, 3]. Ключевым симптомом ГМП является ургентность, которая определяется ICS как «жалоба пациента на непреодолимое желание опорожнить мочевой пузырь, которое трудно отложить» [2, 3]. Стрессовое недержание мочи (СНМ) – внезапное мочеиспускание из-за действий, в результате которых увеличивается внутрибрюшное давление. Физическая нагрузка, кашель, половой акт, резкое вставание и смех – типичные ситуации, способные вызвать стрессовое недержание мочи. Смешанная форма недержания мочи характеризуется как непроизвольная потеря мочи, сопровождающаяся непреодолимым позывом к мочеиспусканию, вызванная физическим напряжением, двигательной активностью, чиханием или кашлем [2, 3].
Факторы риска развития недержания мочи
Мочеиспускание является сложным рефлекторным актом, во время которого должно произойти синхронное расслабление внутреннего и наружного сфинктеров мочевого пузыря и координированное сокращение мышцы мочевого пузыря – детрузора.
В мочеиспускании принимают участие также мышцы брюшного пресса и промежности. Нормальное мочеиспускание возможно при анатомической и функциональной полноценности не только сфинктеров и детрузора, но и системы нервных структур, регулирующих этот сложный акт. Нарушения функционирования и взаимосвязей данных структур бывают функциональной и органической природы и встречаются при различных состояниях: незрелость в онтогенезе, неврозы, цереброваскулярные изменения, опухоли, черепно-мозговые травмы, демиелинизирующие заболевания, деменция, паркинсонизм, старческая инволюция.
К ведущим факторам риска развития ГМП относятся: генетический фактор, возраст, пол, культурологические особенности и особенности образа жизни, неврологический статус, роды, менопауза, мочевая инфекция, оперативные вмешательства, травма, облучение, гипертрофия предстательной железы, ожирение, сахарный диабет, пищевой фактор, функциональные гастроинтестинальные расстройства. Повышает вероятность появления синдрома ГМП употребление газированных напитков [4, 5]. Существует ряд лекарственных препаратов, используемых в терапии коморбидных заболеваний, которые способствуют учащенному мочеиспусканию. К ним относятся диуретики, α- и β-адреноблокаторы, статины, антидепрессанты, транквилизаторы, нейролептики, снотворные средства. Необходимо отметить и факторы, снижающие риск развития ГМП. К ним относятся повышенное потребление с пищей витамина D, калий-содержащих продуктов, белковой пищи, овощей, а также коррекция сопутствующей лекарственной терапии [6]. Факторы риска развития СНМ схожи с факторами риска ГМП. Так, выделяются 4 группы факторов риска развития СНМ:
1) предрасполагающие факторы (семейная предрасположенность, пол, раса, анатомические, неврологические и мышечные нарушения) увеличивают риск развития недержания мочи при наличии провоцирующих факторов;
2) стимулирующие факторы [беременность и роды, хирургические операции на органах малого таза (радикальная гистерэктомия, радикальные операции по поводу рака прямой кишки, влагалищные операции с широкой диссекцией тканей) и лучевая терапия этой области] приводят к значительным нарушениям механизма удержания мочи;
3) провоцирующие факторы [инфекция мочевых путей, ожирение, запоры, болезни органов дыхания и курение (хронический кашель), неврологические заболевания, функциональные гастроинтестинальные расстройства (синдром раздраженного кишечника и др.), профессиональные факторы и занятия спортом, менопауза, прием определенных лекарственных препаратов] способствуют развитию СНМ, как правило, после продолжительного воздействия;
4) декомпенсирующие факторы (возраст, деменция и психические нарушения, сопутствующие заболевания и нарушения двигательной функции, условия жизни), воздействующие в определенный период времени или постоянно, могут вызывать СНМ иногда даже без нарушений механизма удержания мочи. К наиболее изученным и доказанным факторам СНМ относятся возраст, беременность и роды, ожирение [6].
Реальная клиническая практика в настоящее время характеризуется значимым ростом клинических ситуаций, когда сложно говорить о наличии у пациента лишь одного заболевания, в большинстве клинических случаев имеется сопутствующая или сочетанная патология [7]. В эпидемиологических исследованиях используются термины «полиморбидность» (при отсутствии патогенетической связи) и «коморбидность» (при наличии патогенетической связи) между болезнями и патологическими состояниями. В последнее десятилетие все чаще используется термин «мультиморбидность», который, в отличие от клинического диагноза, включает не только сам диагноз, но и взаимосвязь между отдельными диагнозами, симптомами и синдромами [8].
Выделяется целый ряд факторов, способствующих развитию коморбидности/мультиморбидности: генетические, ятрогенные, социальные, экологические, сосудистые (атеросклероз), инфекционные (хроническая инфекция); инволютивные изменения. К фундаментальным базисным причинам коморбидности/мультиморбидности относятся не только единый/сходный патогенетический механизм нескольких болезней, но и анатомическая близость пораженных болезнями органов, временная причинно-следственная связь между болезнями, «одна болезнь как осложнение другой», а также побочные эффекты лекарственной терапии сопутствующих заболеваний – «болезнь как осложнение лекарственной терапии другой болезни» [9].
Артериальная гипертензия (АГ) и сахарный диабет (СД) относятся к наиболее распространенным соматическим заболеваниям. Для анализа влияния этих заболеваний на развитие недержания мочи нами проведен поиск в базах данных MEDLINE и elibrary.ru.
АГ и недержание мочи
Развитие ГМП может быть отражением более высокой симпатической активности и ассоциироваться с повышенным артериальным давлением (АД) [10].
В метаанализе 29 исследований [11], включавших 518 465 женщин в возрастном диапазоне 55–106 лет, частота недержания мочи составила 37,1% (95% доверительный интервал – ДИ 29,6–45,4). К наиболее важным факторам, влияющим на частоту недержания мочи, авторы отнесли АГ (p<0,001), СД (p<0,001), ожирение (p<0,001), возраст женщин (p<0,001), количество родов (p<0,001), курение (p<0,001), инфекцию мочевых путей (p<0,001). В китайском исследовании, включавшем 2790 женщин в возрасте 50–70 лет, в качестве ведущих факторов риска развития недержания мочи выявлены АГ и другие сердечно-сосудистые заболевания, а также возраст, гинекологические заболевания в анамнезе и проживание в сельской местности [12]. В другом китайском исследовании [13] среди 2408 женщин среднего возраста (56±15 лет) распространенность недержания мочи составила 27,70%. Результаты логистического регрессионного анализа факторов риска показали, что АГ, а также возраст, бронхолегочные заболевания, инфекции мочевыводящих путей, хроническая боль в пояснице, дисменорея, вагинит, аборты в анамнезе, способ родоразрешения, послеродовая инфекция были статистически значимыми (все p≤0,05). В совместном китайско-американском исследовании [14] женщин с недержанием мочи и хронической сердечной недостаточностью (ХСН) треть пациенток отметили, что симптомы недержания мочи появились еще до постановки диагноза ХСН, из сопутствующих заболеваний преобладали АГ (83%), СД (53%), вероятная (68%) и тяжелая депрессия (42%). В хорватском исследовании [15] более высокая частота недержания мочи отмечена у пациентов с АГ и ожирением, также в этом исследовании отмечена достоверная корреляция между общими результатами по опроснику ICIQ-OAB (International сonsultation on incontinence questionnaires (ICIQ) investigating symptoms of overactive bladder (OAB)) и АГ (r=0,32). В оманское исследование Muscat [16] были включены 1070 женщин в возрасте 20–50 лет, средний возраст составил 31,39±7,64 года. К значительным факторам риска развития недержания мочи исследователи отнесли АГ, а также возраст, повышенный индекс массы тела (ИМТ), наличие кашля и запоров, анамнез родов.
В турецком исследовании [17] 220 пациенток в возрасте 43–70 лет с ГМП и ургентным недержанием мочи были разделены на 3 группы в соответствии с оценкой сердечно-сосудистого риска по Фрамингемской шкале: низкий риск (n=90; 40,9%), средний риск (n=47; 21,3%) и высокий риск (n=83; 37,8%). В группе высокого сердечно-сосудистого риска у пациенток отмечены выраженное и тяжелое течение ургентного недержания мочи, а также более значимое влияние недержания мочи на снижение качества жизни (p<0,001). В этой же группе пациенток чаще отмечались АГ и СД, были выше ИМТ, уровень общего холестерина и курения и более низким – уровень холестерина липопротеидов высокой плотности (p<0,001)
В другое турецкое исследование [18], направленное на оценку распространенности и возможных факторов риска недержания мочи среди женщин в возрасте
18 лет и старше, были включены 719 женщин. Распространенность недержания мочи составила 50,3%. Ключевыми факторами риска ургентного недержания мочи были АГ и СД; стрессового недержания мочи – АГ и повышение ИМТ. Еще в одном турецком исследовании [19] коморбидность, в том числе и сопутствующая АГ, постменопауза, выпадение матки, эпизиотомия, макросомия плода, использование заместительной гормональной терапии (ЗГТ), курение, потребление кофеина, семейный анамнез инконтиненции были достоверными (p<0,05) факторами риска развития недержания мочи у женщин. В британском когортном исследовании [20] были обследованы 1762 пациента в возрасте 68 лет, частота ургентного недержания мочи составила 12% у мужчин и 19% у женщин. Методом логистической регрессии установлено, что женский пол, АГ, перенесенный инсульт или транзиторная ишемическая атака в анамнезе, повышенный ИМТ были независимыми факторами риска ургентного недержания мочи. В российском исследовании [21] был проведен сравнительный анализ данных анамнеза и клинического обследования 633 женщин 22–88 лет с жалобами на смешанное (n=356) и стрессовое (n=277) недержание мочи. По результатам рассчитанного коэффициента соотношения шансов клинико-анамнестическими факторами риска смешанного недержания мочи у женщин в сравнении с СНМ являются, наряду с возрастом старше 56 лет (относительный риск – ОР 1,67; 95% ДИ 1,2–2,36; p<0,05) и периодом постменопаузы (OР 1,59; 95% ДИ 1,15–2,22; p<0,05), сопутствующие соматические заболевания: АГ (OР 1,99; 95% ДИ 1,43–2,76; p<0,001), СД (OР 1,86; 95% ДИ 1,1–3,23; p<0,05), ишемическая болезнь сердца (OР 2,13; 95% ДИ 1,5–3,0; p<0,001), дисциркуляторная энцефалопатия (OР 3,62; 95% ДИ 1,7–7,6; p<0,001), неврологические заболевания (болезнь Паркинсона, рассеянный склероз, миастения) (OР 7,1; 95% ДИ 1,0–56,8; p<0,05), хронический цистит (OР 1,85; 95% ДИ 1,1–3,1; p<0,05), операции по поводу пролапса тазовых органов (OР 3,12; 95% ДИ 1,25–7,77; p<0,01). Результаты рассмотренных выше исследований демонстрируют, что АГ как фактор риска развития недержания мочи часто сочетается с другими факторами, прежде всего с СД [11, 14, 17, 18, 21] и ожирением [11, 15–18, 20]. Консолидированным проявлением коморбидности АГ, СД и ожирения является метаболический синдром.
Метаболический синдром и недержание мочи
Метаболический синдром (МС) характеризуется увеличением массы висцерального жира, снижением чувствительности периферических тканей к инсулину и гиперинсулинемией, которые вызывают нарушения углеводного, липидного, пуринового обменов и АГ [22].
Основной признак МС – центральное (абдоминальное) ожирение, при котором объем талии более 80 см у женщин и более 94 см у мужчин [22]. В рекомендациях ААСЕ/АСЕ, 2014 (American Association of Clinical Endocrinologists/American College of Endocrinology) [23] предлагается оценивать значение ожирения на основе наличия или отсутствия связанных с ожирением состояний, заболеваний или осложнений. Эксперты ААСЕ/АСЕ относят ургентное и СНМ к ассоциированным с ожирением состояниям и заболеваниям наряду с МС, нарушенной толерантностью к глюкозе, СД 2 типа, дислипидемией, АГ, неалкогольной жировой болезнью печени, гастроэзофагеальной рефлюксной болезнью, ночным апноэ, остеоартрозом, затруднением/неспособностью активно двигаться, синдромом поликистозных яичников и психологическими расстройствами/ стигматизацией [23].
В американском исследовании [24], включавшем 920 пациентов, продемонстрировано, что центральное и общее ожирение являются ключевыми метаболическими факторами, связанными с недержанием мочи, у мужчин и женщин, а также с ГМП у женщин. Вторичный анализ EpiLUTS – репрезентативного для населения поперечного интернет-опроса [25], проведенного для оценки распространенности и воздействия симптомов расстройства мочеиспускания на качество жизни у взрослых старше 40 лет из США, Великобритании и Швеции (10 070 мужчин и 13 178 женщин), показал, что ИМТ ≥30 (ожирение) был связан с более высоким риском недержания мочи. В бразильском поперечном популяционном исследовании [26], включавшем 749 женщин в возрасте от 45 до 60 лет, было выявлено, что у женщин с ожирением отмечаются более высокая распространенность СНМ (p<0,001) и ургентного недержания мочи (p=0,0006), АГ (p<0,001), СД (p=0,002) и меньшая физическая активность (p=0,019).
В британском одноцентровом проспективном исследовании [27] 308 (36,6%) из 840 женщин имели нормальный вес, 260 (31%) – избыточный и 272 (32,4%) – страдали ожирением. Среди обследованных женщин у 168 (20%) из сопутствующих заболеваний отмечена АГ, у 64 (7,6%) – СД и у 98 (11,7%) – дислипидемия. У 704 (83,8%) женщин был диагностирован ГМП, а у 305 (36,3%) при уродинамическом исследовании выявлена гиперреактивность детрузора. В данном исследовании ожирение (p<0,001) было единственным независимым прогностическим фактором для ГМП (OР 1,09; 95% ДИ 1,05–1,13) и уродинамической гиперреактивности детрузора (OР 1,06; 95% ДИI 1,03–1,08) соответственно [27]. Увеличение массы тела как фактор риска недержания мочи нередко может быть причиной неудач корригирующего оперативного лечения [28].
В хорватско-австрийском исследовании «случай-контроль» [29] показано, что ГМП значительно чаще встречается у пациентов, страдающих МС, чем у пациентов без МС. По мнению авторов, оценка наличия и мониторинг ГМП должны быть частью клинического ведения пациентов с МС [29].
В турецком исследовании [30] МС был диагностирован у 201 (64%) из 313 женщин с ГМП и у 73 (35%) из 208 женщин без ГМП. Различия между группами статистически достоверны (p=0,002). Объяснением такой взаимосвязи, по мнению исследователей, может являться наличие инсулинорезистентности у пациентов с МС. В этом исследовании в группе пациентов с ГМП выявили достоверное увеличение окружности талии и ИМТ по сравнению с пациентами без ГМП (98,73 и 91,55 см; 31,37 и 27,71 кг/м2 соответственно), а также достоверно более высокую частоту АГ (53 и 5%), более низкий уровень липопротеинов высокой плотности (52,75 и 57,25 мг/дл). При обсуждении возможных причин связи между МС и ГМП авторы отмечают, что противовоспалительные цитокины и «миопатия» мочевого пузыря могут провоцировать гиперактивность детрузора [30].
В другом исследовании [31] этих авторов, в котором измерялись уровни инсулина, глюкозы, липопротеидов высокой плотности и триглицеридов в сыворотке крови натощак, а инсулинорезистентность оценивали по величине индекса инсулинорезистентности (HOMA-IR), было отмечено, что уровень инсулина в сыворотке был выше (p=0,036) у женщин с ГМП (11,5±6,2 мкЕд/мл) по сравнению с контрольной группой (6,4±2,1 мкЕд/мл), индекс HOMA-IR был значительно выше (p=0,018) в группе ГМП, 2,86 по сравнению с контролем – 1,32, а уровни холестерина липопротеидов высокой плотности были значительно ниже у женщин с ГМП.
Выявляются новые взаимосвязи, в частности, установлена связь между МС и ГМП, осуществляемая через механизм гипоксии детрузора, – нарушение микроциркуляции в стенке мочевого пузыря. Противовоспалительные цитокины и миопатия мочевого пузыря также могут провоцировать гиперактивность детрузора при наличии МС [32].
В обзоре американских ученых [33] показано, что при умеренной потере веса (5–10%) наблюдается постепенное улучшение показателей качества жизни, депрессии, подвижности, сексуальной дисфункции и недержания мочи при стрессе, а при дальнейшей потере веса наблюдается дальнейшее улучшение. Соблюдение диетических рекомендаций также позитивно влияет на симптомы недержания мочи [34–38].
Недержание мочи – частая проблема при СД, хотя пациенты обычно не сообщают о ней. Это диктует требования, сформулированные Американским обществом гериатрии, согласно которым врачи должны всегда проводить ежегодный скрининг на недержание мочи, которое может быть важной причиной социальной изоляции, депрессии, падений и переломов [39].
При обследовании 818 японских пациентов с СД 2 типа распространенность ургентного недержания мочи составила 9,2%. С ургентным недержанием был независимо положительно связан инсульт со скорректированным отношением шансов (ОР 2,34; 95% ДИ 1,03–4,95). Связь между ишемической болезнью сердца или заболеваниями периферических артерий и распространенностью ургентного недержания мочи не была значимой [40, 41].
В российском исследовании [42], в котором было опрошено 1000 пациенток, частота недержания мочи возрастала среди женщин, страдающих СД, достигая 37,7% (p<0,001). При этом у женщин с СД существенно чаще (в 2,1 раза, p<0,05) наблюдался смешанный тип недержания мочи, а СНМ, наоборот, отмечалось реже (p<0,05).Симптомы недержания мочи при СД обусловлены диабетической цистопатией, ведущими патогенетическими факторами которой являются вегетативная (автономная) нейропатия, поражение детрузора и дисфункция уротелия. При этом появление этих нарушений связано с диабетической ангиопатией, являющейся по существу основой развития диабетической цистопатии [43]. Хронические осложнения СД, такие как полинейропатия, являются важными предикторами возникновения дисфункции мочевого пузыря [44, 45].
Таким образом, наличие АГ, МС, ожирения и СД следует рассматривать в качестве факторов риска развития недержания мочи. Вместе с тем следует отметить, что имеются лишь единичные сведения о возможном влиянии лекарственной терапии этой коморбидной патологии, в частности антигипертензивной терапии, на симптомы недержания мочи.
Антигипертензивная терапия (АГТ) и недержание мочи
В американском многоцентровом исследовании [46], в котором участвовали 1446 мужчин и 1628 женщин (средний возраст 73,7 года), ГМП присутствовал у 31,6% мужчин и 38,9% женщин по результатам применения опросника ICIQ. Среди 894 мужчин и 981 женщины, принимавших антигипертензивные препараты, наличие ГМП ассоциировалось с более высоким систолическим АД среди мужчин (4,04 мм рт. ст.; 95% ДИ 1,02–7,06), но не среди женщин (-0,67 мм рт. ст.; 95% ДИ -3,79–2,46), в то время как диастолическое АД не отличалось наличием ГМП у мужчин и женщин. Кроме того, наличие ГМП было также связано с более низкими шансами на контроль АД у мужчин (ОР 0,69; 95% ДИ 0,49–0,96), но не у женщин (OР 0,96; 95% ДИ 0,71- 1,30).
Американские исследователи [47] при обследовании 152 902 пожилых пациентов домов сестринского ухода, у которых недержание мочи встречалось в 76,6%, используя модель многомерной логистической регрессии, отметили, что использование тиазидных диуретиков не было значимо связано с недержанием мочи. Следует отметить, что в литературе часто используются обобщенные понятия «тиазидные диуретики» или «диуретик». Однако в последнее время отмечено значимое различие в их антигипертензивных эффектах и безопасности, поэтому целесообразно их подразделение на тиазидные и тиазидоподобные [48–50], так, в рекомендациях ESC/ESH (2018) [51] подчеркивается наличие у тиазидоподобных диуретиков более обширной доказательной базы в отношении их эффективности и прогностической значимости. В раннее проведенном нами исследовании [52], в которое были включены 32 женщины в возрасте от 41 до 55 лет (средний возраст составил 47,5±2,5 года) с симптомами ГМП и наличием сопутствующей АГ, АГТ включала гидрохлоротиазид 12,5–25 мг/сут в сочетании с ингибитором ангиотензинпревращающего фермента или блокатором рецепторов ангиотензина. Поскольку антигипертензивный эффект тиазидоподобного диуретика индапамида проявляется в дозах, меньших, чем необходимо для диуретического эффекта, пациенткам была проведена коррекция АГТ, заключающаяся в замене гидрохлоротиазида на Индап® (индапамид 2,5 мг в сутки). До начала исследования и спустя 2 мес приема Индапа оценивали частоту мочеиспусканий и ургентных позывов, определяли уровень калия, глюкозы и мочевой кислоты в крови, осуществляли контроль АД. Через 2 мес после коррекции АГТ нами было отмечено уменьшение числа мочеиспусканий за сутки с 12±3,4 до 10±2,1, количества ургентных позывов – с 4,2±2,4 до 2,9±1,9. Исходный уровень калия в сыворотке крови повысился на 2,3%, уровень глюкозы снизился на 1,9%, уровень мочевой кислоты снизился на 1,3%, при этом уровень АД по сравнению с исходным снизился соответственно на 6,26/7,63%. В следующем нашем пилотном исследовании проведен опрос 86 женщин с АГ без признаков мочевой инфекции в возрасте от 35 до 74 лет. На наличие эпизодов недержания мочи при напряжении и ГМП указали
39 (45,3%) пациенток. При дальнейшем сравнении 2 сформированных групп с АГ и недержанием мочи (1-я группа) и АГ без недержания мочи (2-я группа) нами отмечено, что в 1-й группе были выше средний возраст (64,1±1,9 и 59,9±2,1) и стаж АГ, чаще выявлялась сопутствующая гинекологическая и урологическая патология (соответственно 51,3 и 43,6% против 38,3 и 31,9%), а также коморбидная патология (СД, дислипидемия и другие сердечно-сосудистые заболевания) – соответственно 64,1 и 55,3%. Отмечено различие в АГТ – у пациенток с недержанием мочи чаще применялись дигидропиридоновые антагонисты кальция (30,8%), в то время как у пациенток без недержания мочи они использовались реже – 14,9%. В описании лекарственных препаратов этой группы в справочнике Видаль (https://www.vidal.ru/) указывается на возможные побочные эффекты препаратов этой группы со стороны мочевыделительной системы, в частности, на учащенное мочеиспускание. Также нами отмечены различия в частоте применения тиазидных и тиазидоподобных диуретиков, так, в 1-й группе чаще использовался гидрохлоротиазид (20,5%) и реже индапамид (10,3%), а во 2-й группе, напротив, гидрохлоротиазид применялся реже (8,5%) и чаще индапамид (15,2%). Безусловно, вопросы влияния АГТ на недержание мочи нуждаются в дальнейшем изучении и уточнении. В свою очередь, препараты, используемые для лечения недержания мочи, могут влиять на имеющуюся у пациентов коморбидную патологию. Так, в обзоре Кокрановской базы данных [53] отмечается, что адренергические препараты – α- и β- адреномиметики (фенилпропаноламин, мидодрин, норэпинефрин, кленбутерол, тербуталин, эскорнад) для лечения недержания мочи обладают редкими, но серьезными побочными эффектами, к которым авторы отнесли АГ и аритмию. В систематическом обзоре [54], включавшем 49 источников, в которых проводилось сравнение лечения ГМП β3-адренергическими агонистами (вибегроном и мирабегроном) и толтеродином, отмечено, что в краткосрочных и долгосрочных исследованиях АГ была наиболее частым нежелательным явлением при трех вариантах лечения. В исследовании EMPOWUR [55], в котором пациенты принимали вибегрон 75 мг и толтеродин 4 мг, отмечено, что наиболее частым нежелательным явлением при приеме вибегрона/толтеродина (>5% в каждой группе) была АГ (8,8 и 8,6% соответственно). В систематическом обзоре [56] проведен анализ 5 рандомизированных клинических исследований (РКИ), в которых проводилось сравнение солифенацина и мирабегрона, и отмечено, что тахикардия чаще отмечалась при использовании мирабегрона. В систематическом обзоре (491 статья) и метаанализе (8 РКИ с общим числом 10 248 пациентов) показано [57], что мирабегрон в дозе 100 мг увеличивает риск АГ (ОР 1,41; p=0,08) и аритмии (ОР 2,18; p=0,06). Таким образом, у пациентов с недержанием мочи и наличием коморбидных состояний, которые одновременно являются и факторами риска недержания мочи (АГ, СД, МС, ожирение и ряд других), актуален выбор лекарственного препарата для лечения недержания мочи с минимальным влиянием на сопутствующую коморбидную патологию.
Лечение недержания мочи у коморбидных пациентов
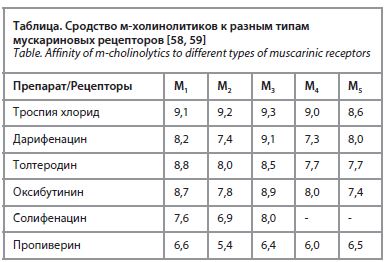
При ГМП основным методом лечения является медикаментозный. М-холинолитики являются на сегодняшний день золотым стандартом фармакотерапии инконтиненции, обусловленной гиперактивным детрузором. Они блокируют м-холинорецепторы, являясь конкурентными ингибиторами ацетилхолина на рецепторах постсинаптических мембран гладкой мускулатуры. При этом ингибируется ответ, вызванный постганглионарной парасимпатической активацией блуждающего нерва. В мочевом пузыре мускариновые рецепторы располагаются в гладкомышечной ткани детрузора, в уротелии и парасимпатических и симпатических нервных окончаниях. Существует 5 подтипов мускариновых рецепторов, получивших названия М1, М2, М3, М4, М5 (табл.). Ведущее значение в функции мочевого пузыря имеют подтипы М2 и М3. По современным данным, М3-рецепторы играют основную роль в сокращении гладкомышечной ткани детрузора, в то время как М2-рецепторы тормозят его симпатически-опосредованное расслабление. Таким образом, М2- и М3-рецепторы действуют содружественно, способствуя опорожнению мочевого пузыря [58, 59].
М-холинолитики являются базисными препаратами. Они используются как в качестве монотерапии, так и в сочетании с поведенческой терапией, биологической обратной связью, физиотерапией, другими лекарственными препаратами.
М-холинолитики для лечения ГМП подразделяются:
• на третичные аммониевые соединения: оксибутинин, дарифенацин, фезотеродин, толтеродин, солифенацин, еще один препарат этой группы (пропиверин) в РФ не зарегистрирован;
• четвертичные аммониевые соединения: троспия хлорид.
Начальный период приема м-холинолитиков составляет 12 нед. Применение м-холинолитиков приводит к уменьшению симптомов ГМП. Троспия хлорид обладает наивысшим среди М-холинолитиков сродством ко всем видам М-холинорецепторов (см. табл.) и наиболее специфичен в отношении связывания с М2- и М3-рецепторами, что позволяет предполагать его более высокую эффективность в ослаблении сокращений детрузора.
 Основным химическим отличием четвертичных аминов является наличие у них положительного заряда и, как следствие, гидрофильных свойств, в то время как третичные амины не имеют заряда и характеризуются липофильностью, что способствует более легкому проникновению через клеточные мембраны. В связи с этим троспия хлорид, благодаря гидрофильности, не проникает через гематоэнцефалический барьер [60–64] и практически не вызывает побочные эффекты со стороны центральной нервной системы, не способствует развитию и прогрессированию когнитивных нарушений [62, 63, 65–67]. Эти клинические данные нашли подтверждение и в экспериментальном исследовании, наглядно продемонстрировавшем, что проникновение троспия хлорида через гематоэнцефалический барьер не увеличивается при старении [68].
Основным химическим отличием четвертичных аминов является наличие у них положительного заряда и, как следствие, гидрофильных свойств, в то время как третичные амины не имеют заряда и характеризуются липофильностью, что способствует более легкому проникновению через клеточные мембраны. В связи с этим троспия хлорид, благодаря гидрофильности, не проникает через гематоэнцефалический барьер [60–64] и практически не вызывает побочные эффекты со стороны центральной нервной системы, не способствует развитию и прогрессированию когнитивных нарушений [62, 63, 65–67]. Эти клинические данные нашли подтверждение и в экспериментальном исследовании, наглядно продемонстрировавшем, что проникновение троспия хлорида через гематоэнцефалический барьер не увеличивается при старении [68].
Метаанализ эффективности и безопасности М-холинолитиков, в который для сравнения эффективности было включено 76 исследований (суммарно 38 662 пациента) и для выявления неблагоприятных событий – 90 исследований (39 919 пациентов), показал эффективность и безопасность троспия хлорида в дозе
40 мг/сут по сравнению с оксибутинином, пропиверином, фезотеродином [69]. Троспия хлорид значительно реже вызывал побочные эффекты в целом [69–71], например, сухость во рту [72, 73] или нарушения аккомодации [74, 75].
Безопасность применения троспия хлорида по сравнению с другими М-холинолитиками обусловлена еще и тем, что это единственный М-холинолитик, не метаболизирующийся в печени и не влияющий на ее функции (не участвует в метаболизме ферментов из группы цитохрома Р-450), что предполагает возможность его безопасного применения с другими лекарственными препаратами, а также у пациентов с нарушениями функциональных печеночных проб [65, 66, 76, 77].
Вышеперечисленное позволяет рассматривать троспия хлорид как препарат выбора у пожилых пациентов [62, 67, 78–80] и неврологических больных [81–86].
Накопление троспия хлорида в неизмененном виде происходит в мочевом пузыре. При этом троспия хлорид вторично оказывает воздействие на М-холинорецепторы слизистой и подслизистой оболочек мочевого пузыря. Благодаря этому двойному действию троспия хлорид обладает усиленным терапевтическим эффектом.
Изучение эффективности и безопасности различных доз препарата Спазмекс® для больных идиопатическим ГМП проведено в широкомасштабной наблюдательной программе «Ресурс» [84, 86], в которую были включены 669 пациентов с идиопатическим ГМП – 359 женщин и 310 мужчин. На первом визите всем пациентам назначали Спазмекс® в стандартной дозе 45 мг/сут. Результаты лечения оценивали на четырех последующих визитах через 3, 6, 9 и 12 нед. В зависимости от результатов обследования дозу препарата снижали при наличии нежелательных явлений или увеличивали при недостаточном эффекте лечения. Через 12 нед 102 больных принимали препарат в дозировке 30, 241–45, 257–60 и 22–75 мг/сут.
Таким образом, индивидуальный подход к выбору дозы препарата Спазмекс® для больных идиопатической формой ГМП может являться эффективной и довольно безопасной мерой в достижении оптимального клинического результата с хорошим профилем безопасности [84, 86]. У пациентов с почечной недостаточностью (клиренс креатинина 10–30 мл/мин/1,73 м2) суточная доза препарата не должна превышать 15 мг. Пациентам пожилого возраста Спазмекс® назначают по 5 мг 3 р/сут.
После исчезновения симптоматики рекомендуется продолжить лечение в качестве противорецидивной терапии в течение 2–4 нед (общая продолжительность лечения составляет 2–3 мес). При необходимости более длительного лечения вопрос о продолжении лечения пересматривается врачом каждые 3–6 мес.
Эффективность и безопасность троспия хлорида (Спазмекс®) у женщин в лечении ГМП, обусловленного различными причинами, продемонстрирована в целом ряде отечественных и зарубежных исследований [87–98].
В педиатрической практике применение препарата Спазмекс® способствует сокращению случаев энуреза, уменьшению числа императивных позывов к мочеиспусканию и императивного недержания мочи, повышению среднеэффективной емкости мочевого пузыря, при этом лечение препаратом Спазмекс® являлось безопасным, хорошо переносилось больными [99–102].
Троспия хлорид безопасен и эффективен у мужчин с ГМП [103]. Традиционно симптомы нижних мочевыводящих путей у мужчин урологи связывали с заболеваниями предстательной железы, и мало кто допускал в качестве их причины нарушение функции мочевого пузыря. С функциональной точки зрения сложно отделить мочевой пузырь и предстательную железу, и в связи с этим нельзя отрицать того, что развитие симптомов ГМП у мужчин, возможно, имеет патогенетическую взаимосвязь с доброкачественной гиперплазией предстательной железы (ДГПЖ). Установлено, что 70–75% больных ДГПЖ страдают именно от связанных с ГМП ирритативных симптомов, которые причиняют им большее беспокойство, чем жалобы, связанные с инфравезикальной обструкцией [104–106].
При расстройствах мочеиспускания у мужчин возможно комбинированное применение троспия хлорида (Спазмекс®) с α-адреноблокаторами (тамсулозин, доксазозин) или с α-адреноблокаторами и ингибиторами фосфодиэстеразы 5-го типа (силденафил, тадалафил) [105]. Так, эффективность комбинированной терапии «тамсулозин + троспия хлорид» у мужчин с ДГПЖ в сочетании с симптомами ГАМП отмечена в российском рандомизированном исследовании с участием 452 пациентов [107–109].
В многоцентровом проспективном рандомизированном контролируемом исследовании у мужчин после контактной лучевой терапии рака предстательной железы также было отмечено существенное улучшение симптомов со стороны нижних мочевых путей при комбинированной терапии тамсулозином и троспия хлоридом по сравнению с монотерапией тамсулозином [110]. Отмечена эффективность троспия хлорида в комплексной терапии лечения недержания мочи и после радикальной простатэктомии [111]. В проспективном рандомизированном плацебо-контролируемом исследовании, в котором участвовали 200 пациентов мужского пола с камнями мочеточника после стентирования мочеточника стентами JJ и наличием симптомов нижних мочевых путей, наиболее эффективным в купировании расстройств мочеиспускания были троспия хлорид в дозе 20 мг и солифенацин в дозе 5 мг, при этом в группе троспия хлорида был отмечен лучший контроль частоты мочеиспусканий при существенно меньшей частоте побочных эффектов [72].
При добавлении препарата Спазмекс® в стандартную этиопатогенетическую терапию по поводу хронического простатита через 1 мес комплексного лечения отмечено уменьшение частоты мочеиспусканий на 56,1%, число ургентных позывов на мочеиспускание сократилось более чем вдвое, функциональная емкость мочевого пузыря возросла на 82,8% [112].
При СНМ лекарственные средства позволяют затормозить сокращение стенок мочевого пузыря, вызвать сокращение сфинктера или снизить выработку мочи. Наибольшего эффекта можно достичь при сочетании с гормональной терапией. Необходимо подчеркнуть, что из большого количества лекарств, предложенных для лечения недержания мочи, лишь назначение препаратов с антихолинергической активностью (троспия хлорид и другие м-холинолитики) является патогенетически обоснованным [87, 92].
В случае наличия у пациенток смешанной формы недержания мочи крайне важно определить ведущий компонент в развитии недержания. У 55% женщин, обратившихся с симптомами смешанного недержания мочи, клинически преобладает ургентный компонент недержания мочи, а стрессовый – у 38% пациенток. От этого зависит определение дальнейшей тактики лечения больной. Назначение троспия хлорида позволяет выделить стрессовый компонент, устранив гиперактивный, и определить показания к возможному оперативному вмешательству [93–95], поскольку от 30 до 50% прооперированных пациенток со смешанной формой недержания мочи в послеоперационном периоде имеют симптомы ГМП, а у половины из них детрузорная гиперактивность подтверждена при цистометрии.
Эффективность препарата троспия хлорида отмечена у пациенток с симптомами ГМП с наличием пролапса гениталий [88, 89] и после операции троакарного синтетического слинга [96, 113].
Троспия хлорид может быть рекомендован пациенткам после родов, которые отказались от грудного вскармливания по тем или иным причинам, с симптомами ГМП и смешанным типом нарушения мочеиспускания. Применение препарата троспия хлорида значительно повышает качество жизни пациенток послеродового периода [114].
На российском фармацевтическом рынке более 15 лет присутствует представленный эксклюзивным дистрибьютором в РФ – компанией PRO.MED.CS Praha, a.s. (Чешская Республика) оригинальный препарат троспия хлорида – Спазмекс® компании Dr. R.Pfleger, Chemische Fabric, GmbH (Германия). Препарат выпускается в таблетках по 5, 15 и 30 мг. Благодаря своей безопасности – отсутствию воздействия на центральную нервную систему и отсутствию метаболизма в печени дозу препарата Спазмекс® возможно титровать, т.е. увеличивать дозу при слабом результате или его отсутствии.
Препарат назначают внутрь взрослым и детям старше 14 лет. Режим дозирования и длительность лечения устанавливают индивидуально в зависимости от клинической картины и тяжести заболевания. Таблетки следует принимать до еды, не разжевывая, запивая достаточным количеством воды. Таблетки 5 мг назначают по 2–3 таб. 3 р/сут (30–45 мг) с интервалом 8 ч; при суточной дозе 45 мг допустимо принимать по 30 мг утром и 15 мг вечером. Таблетки, покрытые пленочной оболочкой, 15 мг, назначают по 1 таб. 3 р/сут с интервалом 8 ч; суточная доза – 45 мг. Таблетки, покрытые пленочной оболочкой, 30 мг, назначают по 1/2 таб. 3 р/сут или 1 таб. утром и 1/2 таб. вечером; суточная доза – 45 мг. Основными показаниями к назначению препарата Спазмекс® являются:
1) ГМП, сопровождающийся недержанием мочи, императивными позывами к мочеиспусканию и увеличением частоты мочеиспусканий (при идиопатической гиперактивности детрузора негормональной и неорганической этиологии);
2) смешанные формы недержания мочи;
3) спастические нейрогенные нарушения функции мочевого пузыря (при нейрогенной гиперактивности/гиперрефлексии детрузора на фоне рассеянного склероза, спинальных травм, врожденных и приобретенных заболеваний спинного мозга, инсультов, паркинсонизма);
4) детрузор-сфинктер-диссинергия на фоне интермиттирующего катетеризма;
5) поллакиурия, никтурия;
6) ночной и дневной энурез;
7) комплексная терапия циститов, сопровождающихся императивной симптоматикой.
Опыт применения препарата Спазмекс® свидетельствует о его безопасности и эффективности в лечении недержания мочи у различных категорий пациентов [65, 66, 76, 78, 81, 83, 87–89, 90–96, 98–101, 104–109, 111–118].
Заключение
Наличие на российском фармацевтическом рынке четвертичного аммониевого соединения троспия хлорида (Спазмекс®) позволяет проводить эффективную и безопасную фармакотерапию недержания мочи, в том числе и у коморбидных пациентов, не ограничиваясь лишь гигиеническими рекомендациями.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
Трухан Дмитрий Иванович – д-р мед. наук, доцент, проф. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО «Омский ГМУ». E-mail: dmitry_trukhan@mail.ru; ORCID: 0000-0002-1597-1876
Dmitry I. Trukhan – D. Sci. (Med.), Prof., Omsk State Medical University. E-mail: dmitry_trukhan@mail.ru; ORCID: 0000-0002-1597-1876
Чуянова Юлия Сергеевна – врач общей практики БУЗОО ГБ №3 г. Омска. E-mail: ya.svistunova123@yandex.ru
Yulia S. Chuyanova – general practitioner, City Hospital №3, Omsk. E-mail: ya.svistunova123@yandex.ru
Макушин Дмитрий Геннадьевич – канд. мед. наук, зав. урологическим отд-нием Западно-Сибирского медицинского центра ФГБУЗ ФМБА России. E-mail: dmg1@mail.ru; ORCID 0000-0001-6401-0687
Dmitry G. Makushin – Cand. Sci. (Med.), West Siberian medical center FMBA of Russia. E-mail: dmg1@mail.ru; ORCID 0000-0001-6401-0687
Статья поступила в редакцию / The article received: 24.11.2021
Статья принята к печати / The article approved for publication: 25.11.2021
Dmitry I. Trukhan1, Yulia S. Chuyanova1,2, Dmitry G. Makushin3
dmitry_trukhan@mail.ru
Abstract
The problem of urinary incontinence is multidisciplinary. Patients with this problem get an appointment with therapists, general practitioners, pediatricians, urologists, gynecologists, neurologists. Real clinical practice is currently characterized by a significant increase in clinical situations, when it is difficult to talk about the presence of only one disease in a patient, and in most clinical cases the patient has a concomitant or combined pathology.
Arterial hypertension and diabetes mellitus are among the most common somatic diseases. To analyze the influence of these diseases on the development of urinary incontinence, we searched the MEDLINE and elibrary.ru databases. Metabolic syndrome is a consolidated manifestation of the comorbidity of hypertension, diabetes mellitus and obesity. There is only sporadic information on the possible effect of drug therapy for comorbid pathology, in particular antihypertensive therapy, on the symptoms of urinary incontinence. Drugs used to treat urinary incontinence can affect comorbid conditions in patients.
In patients with urinary incontinence and the presence of comorbid conditions, which are also risk factors for urinary incontinence, the choice of a drug for the treatment of urinary incontinence with minimal effect on comorbid comorbid pathology is relevant. The results of numerous studies demonstrate that the use of trospium chloride allows for effective and safe pharmacotherapy of urinary incontinence, including in comorbid patients.
Key words: urinary incontinence, comorbidity, risk factors, arterial hypertension, diabetes mellitus, metabolic syndrome, obesity, drug therapy, trospium chloride.
For citation: Trukhan D.I., Chuyanova Yu.S., Makushin D.G. The problem of urinary incontinence through the prism of comorbidity. Clinical review for general practice. 2021; 9: 11–23. DOI: 10.47407/kr2021.2.9.00103
Проблема недержания мочи является междисциплинарной. Пациенты с этой проблемой попадают на прием к терапевтам, врачам общей практики, педиатрам, урологам, гинекологам, неврологам. Под недержанием мочи (инконтиненцией) понимается объективно доказанная непроизвольная потеря мочи в результате нарушения функции мочевого пузыря и/или его сфинктеров. В работах ряда авторов разделяются термины «недержание» и «неудержание». Так, под недержанием мочи рассматривается выделение мочи без предварительного позыва к мочеиспусканию (отсутствует чувство переполнения мочевого пузыря), не поддающееся волевому контролю. А термин «неудержание» мочи предлагается рассматривать при выделении мочи после предварительного императивного позыва (появление непреодолимого желания помочиться с резким сокращением промежутка времени, до нескольких секунд, от возникновения позыва до обязательного опорожнения мочевого пузыря) к мочеиспусканию [1]. Выделяют 5 видов недержания мочи: ургентное, стрессовое, смешанное, недержание переполнения и транзиторное. Наибольшее значение имеют первые 2 вида и их комбинация.
Гиперактивный мочевой синдром (ГМП) – клинический синдром, определяющий ургентное мочеиспускание (в сочетании или без ургентного недержания мочи), основными симптомами которого являются поллакиурия и ноктурия, а также наличие сильных непроизвольных (неконтролируемых) позывов к мочеиспусканию [1]. Данный синдром, согласно рекомендациям Международного общества по удержанию мочи (International Continence Society – ICS), применим при отсутствии подтвержденной инфекции или какой-либо другой патологии [2, 3]. Ключевым симптомом ГМП является ургентность, которая определяется ICS как «жалоба пациента на непреодолимое желание опорожнить мочевой пузырь, которое трудно отложить» [2, 3]. Стрессовое недержание мочи (СНМ) – внезапное мочеиспускание из-за действий, в результате которых увеличивается внутрибрюшное давление. Физическая нагрузка, кашель, половой акт, резкое вставание и смех – типичные ситуации, способные вызвать стрессовое недержание мочи. Смешанная форма недержания мочи характеризуется как непроизвольная потеря мочи, сопровождающаяся непреодолимым позывом к мочеиспусканию, вызванная физическим напряжением, двигательной активностью, чиханием или кашлем [2, 3].
Факторы риска развития недержания мочи
Мочеиспускание является сложным рефлекторным актом, во время которого должно произойти синхронное расслабление внутреннего и наружного сфинктеров мочевого пузыря и координированное сокращение мышцы мочевого пузыря – детрузора.
В мочеиспускании принимают участие также мышцы брюшного пресса и промежности. Нормальное мочеиспускание возможно при анатомической и функциональной полноценности не только сфинктеров и детрузора, но и системы нервных структур, регулирующих этот сложный акт. Нарушения функционирования и взаимосвязей данных структур бывают функциональной и органической природы и встречаются при различных состояниях: незрелость в онтогенезе, неврозы, цереброваскулярные изменения, опухоли, черепно-мозговые травмы, демиелинизирующие заболевания, деменция, паркинсонизм, старческая инволюция.
К ведущим факторам риска развития ГМП относятся: генетический фактор, возраст, пол, культурологические особенности и особенности образа жизни, неврологический статус, роды, менопауза, мочевая инфекция, оперативные вмешательства, травма, облучение, гипертрофия предстательной железы, ожирение, сахарный диабет, пищевой фактор, функциональные гастроинтестинальные расстройства. Повышает вероятность появления синдрома ГМП употребление газированных напитков [4, 5]. Существует ряд лекарственных препаратов, используемых в терапии коморбидных заболеваний, которые способствуют учащенному мочеиспусканию. К ним относятся диуретики, α- и β-адреноблокаторы, статины, антидепрессанты, транквилизаторы, нейролептики, снотворные средства. Необходимо отметить и факторы, снижающие риск развития ГМП. К ним относятся повышенное потребление с пищей витамина D, калий-содержащих продуктов, белковой пищи, овощей, а также коррекция сопутствующей лекарственной терапии [6]. Факторы риска развития СНМ схожи с факторами риска ГМП. Так, выделяются 4 группы факторов риска развития СНМ:
1) предрасполагающие факторы (семейная предрасположенность, пол, раса, анатомические, неврологические и мышечные нарушения) увеличивают риск развития недержания мочи при наличии провоцирующих факторов;
2) стимулирующие факторы [беременность и роды, хирургические операции на органах малого таза (радикальная гистерэктомия, радикальные операции по поводу рака прямой кишки, влагалищные операции с широкой диссекцией тканей) и лучевая терапия этой области] приводят к значительным нарушениям механизма удержания мочи;
3) провоцирующие факторы [инфекция мочевых путей, ожирение, запоры, болезни органов дыхания и курение (хронический кашель), неврологические заболевания, функциональные гастроинтестинальные расстройства (синдром раздраженного кишечника и др.), профессиональные факторы и занятия спортом, менопауза, прием определенных лекарственных препаратов] способствуют развитию СНМ, как правило, после продолжительного воздействия;
4) декомпенсирующие факторы (возраст, деменция и психические нарушения, сопутствующие заболевания и нарушения двигательной функции, условия жизни), воздействующие в определенный период времени или постоянно, могут вызывать СНМ иногда даже без нарушений механизма удержания мочи. К наиболее изученным и доказанным факторам СНМ относятся возраст, беременность и роды, ожирение [6].
Реальная клиническая практика в настоящее время характеризуется значимым ростом клинических ситуаций, когда сложно говорить о наличии у пациента лишь одного заболевания, в большинстве клинических случаев имеется сопутствующая или сочетанная патология [7]. В эпидемиологических исследованиях используются термины «полиморбидность» (при отсутствии патогенетической связи) и «коморбидность» (при наличии патогенетической связи) между болезнями и патологическими состояниями. В последнее десятилетие все чаще используется термин «мультиморбидность», который, в отличие от клинического диагноза, включает не только сам диагноз, но и взаимосвязь между отдельными диагнозами, симптомами и синдромами [8].
Выделяется целый ряд факторов, способствующих развитию коморбидности/мультиморбидности: генетические, ятрогенные, социальные, экологические, сосудистые (атеросклероз), инфекционные (хроническая инфекция); инволютивные изменения. К фундаментальным базисным причинам коморбидности/мультиморбидности относятся не только единый/сходный патогенетический механизм нескольких болезней, но и анатомическая близость пораженных болезнями органов, временная причинно-следственная связь между болезнями, «одна болезнь как осложнение другой», а также побочные эффекты лекарственной терапии сопутствующих заболеваний – «болезнь как осложнение лекарственной терапии другой болезни» [9].
Артериальная гипертензия (АГ) и сахарный диабет (СД) относятся к наиболее распространенным соматическим заболеваниям. Для анализа влияния этих заболеваний на развитие недержания мочи нами проведен поиск в базах данных MEDLINE и elibrary.ru.
АГ и недержание мочи
Развитие ГМП может быть отражением более высокой симпатической активности и ассоциироваться с повышенным артериальным давлением (АД) [10].
В метаанализе 29 исследований [11], включавших 518 465 женщин в возрастном диапазоне 55–106 лет, частота недержания мочи составила 37,1% (95% доверительный интервал – ДИ 29,6–45,4). К наиболее важным факторам, влияющим на частоту недержания мочи, авторы отнесли АГ (p<0,001), СД (p<0,001), ожирение (p<0,001), возраст женщин (p<0,001), количество родов (p<0,001), курение (p<0,001), инфекцию мочевых путей (p<0,001). В китайском исследовании, включавшем 2790 женщин в возрасте 50–70 лет, в качестве ведущих факторов риска развития недержания мочи выявлены АГ и другие сердечно-сосудистые заболевания, а также возраст, гинекологические заболевания в анамнезе и проживание в сельской местности [12]. В другом китайском исследовании [13] среди 2408 женщин среднего возраста (56±15 лет) распространенность недержания мочи составила 27,70%. Результаты логистического регрессионного анализа факторов риска показали, что АГ, а также возраст, бронхолегочные заболевания, инфекции мочевыводящих путей, хроническая боль в пояснице, дисменорея, вагинит, аборты в анамнезе, способ родоразрешения, послеродовая инфекция были статистически значимыми (все p≤0,05). В совместном китайско-американском исследовании [14] женщин с недержанием мочи и хронической сердечной недостаточностью (ХСН) треть пациенток отметили, что симптомы недержания мочи появились еще до постановки диагноза ХСН, из сопутствующих заболеваний преобладали АГ (83%), СД (53%), вероятная (68%) и тяжелая депрессия (42%). В хорватском исследовании [15] более высокая частота недержания мочи отмечена у пациентов с АГ и ожирением, также в этом исследовании отмечена достоверная корреляция между общими результатами по опроснику ICIQ-OAB (International сonsultation on incontinence questionnaires (ICIQ) investigating symptoms of overactive bladder (OAB)) и АГ (r=0,32). В оманское исследование Muscat [16] были включены 1070 женщин в возрасте 20–50 лет, средний возраст составил 31,39±7,64 года. К значительным факторам риска развития недержания мочи исследователи отнесли АГ, а также возраст, повышенный индекс массы тела (ИМТ), наличие кашля и запоров, анамнез родов.
В турецком исследовании [17] 220 пациенток в возрасте 43–70 лет с ГМП и ургентным недержанием мочи были разделены на 3 группы в соответствии с оценкой сердечно-сосудистого риска по Фрамингемской шкале: низкий риск (n=90; 40,9%), средний риск (n=47; 21,3%) и высокий риск (n=83; 37,8%). В группе высокого сердечно-сосудистого риска у пациенток отмечены выраженное и тяжелое течение ургентного недержания мочи, а также более значимое влияние недержания мочи на снижение качества жизни (p<0,001). В этой же группе пациенток чаще отмечались АГ и СД, были выше ИМТ, уровень общего холестерина и курения и более низким – уровень холестерина липопротеидов высокой плотности (p<0,001)
В другое турецкое исследование [18], направленное на оценку распространенности и возможных факторов риска недержания мочи среди женщин в возрасте
18 лет и старше, были включены 719 женщин. Распространенность недержания мочи составила 50,3%. Ключевыми факторами риска ургентного недержания мочи были АГ и СД; стрессового недержания мочи – АГ и повышение ИМТ. Еще в одном турецком исследовании [19] коморбидность, в том числе и сопутствующая АГ, постменопауза, выпадение матки, эпизиотомия, макросомия плода, использование заместительной гормональной терапии (ЗГТ), курение, потребление кофеина, семейный анамнез инконтиненции были достоверными (p<0,05) факторами риска развития недержания мочи у женщин. В британском когортном исследовании [20] были обследованы 1762 пациента в возрасте 68 лет, частота ургентного недержания мочи составила 12% у мужчин и 19% у женщин. Методом логистической регрессии установлено, что женский пол, АГ, перенесенный инсульт или транзиторная ишемическая атака в анамнезе, повышенный ИМТ были независимыми факторами риска ургентного недержания мочи. В российском исследовании [21] был проведен сравнительный анализ данных анамнеза и клинического обследования 633 женщин 22–88 лет с жалобами на смешанное (n=356) и стрессовое (n=277) недержание мочи. По результатам рассчитанного коэффициента соотношения шансов клинико-анамнестическими факторами риска смешанного недержания мочи у женщин в сравнении с СНМ являются, наряду с возрастом старше 56 лет (относительный риск – ОР 1,67; 95% ДИ 1,2–2,36; p<0,05) и периодом постменопаузы (OР 1,59; 95% ДИ 1,15–2,22; p<0,05), сопутствующие соматические заболевания: АГ (OР 1,99; 95% ДИ 1,43–2,76; p<0,001), СД (OР 1,86; 95% ДИ 1,1–3,23; p<0,05), ишемическая болезнь сердца (OР 2,13; 95% ДИ 1,5–3,0; p<0,001), дисциркуляторная энцефалопатия (OР 3,62; 95% ДИ 1,7–7,6; p<0,001), неврологические заболевания (болезнь Паркинсона, рассеянный склероз, миастения) (OР 7,1; 95% ДИ 1,0–56,8; p<0,05), хронический цистит (OР 1,85; 95% ДИ 1,1–3,1; p<0,05), операции по поводу пролапса тазовых органов (OР 3,12; 95% ДИ 1,25–7,77; p<0,01). Результаты рассмотренных выше исследований демонстрируют, что АГ как фактор риска развития недержания мочи часто сочетается с другими факторами, прежде всего с СД [11, 14, 17, 18, 21] и ожирением [11, 15–18, 20]. Консолидированным проявлением коморбидности АГ, СД и ожирения является метаболический синдром.
Метаболический синдром и недержание мочи
Метаболический синдром (МС) характеризуется увеличением массы висцерального жира, снижением чувствительности периферических тканей к инсулину и гиперинсулинемией, которые вызывают нарушения углеводного, липидного, пуринового обменов и АГ [22].
Основной признак МС – центральное (абдоминальное) ожирение, при котором объем талии более 80 см у женщин и более 94 см у мужчин [22]. В рекомендациях ААСЕ/АСЕ, 2014 (American Association of Clinical Endocrinologists/American College of Endocrinology) [23] предлагается оценивать значение ожирения на основе наличия или отсутствия связанных с ожирением состояний, заболеваний или осложнений. Эксперты ААСЕ/АСЕ относят ургентное и СНМ к ассоциированным с ожирением состояниям и заболеваниям наряду с МС, нарушенной толерантностью к глюкозе, СД 2 типа, дислипидемией, АГ, неалкогольной жировой болезнью печени, гастроэзофагеальной рефлюксной болезнью, ночным апноэ, остеоартрозом, затруднением/неспособностью активно двигаться, синдромом поликистозных яичников и психологическими расстройствами/ стигматизацией [23].
В американском исследовании [24], включавшем 920 пациентов, продемонстрировано, что центральное и общее ожирение являются ключевыми метаболическими факторами, связанными с недержанием мочи, у мужчин и женщин, а также с ГМП у женщин. Вторичный анализ EpiLUTS – репрезентативного для населения поперечного интернет-опроса [25], проведенного для оценки распространенности и воздействия симптомов расстройства мочеиспускания на качество жизни у взрослых старше 40 лет из США, Великобритании и Швеции (10 070 мужчин и 13 178 женщин), показал, что ИМТ ≥30 (ожирение) был связан с более высоким риском недержания мочи. В бразильском поперечном популяционном исследовании [26], включавшем 749 женщин в возрасте от 45 до 60 лет, было выявлено, что у женщин с ожирением отмечаются более высокая распространенность СНМ (p<0,001) и ургентного недержания мочи (p=0,0006), АГ (p<0,001), СД (p=0,002) и меньшая физическая активность (p=0,019).
В британском одноцентровом проспективном исследовании [27] 308 (36,6%) из 840 женщин имели нормальный вес, 260 (31%) – избыточный и 272 (32,4%) – страдали ожирением. Среди обследованных женщин у 168 (20%) из сопутствующих заболеваний отмечена АГ, у 64 (7,6%) – СД и у 98 (11,7%) – дислипидемия. У 704 (83,8%) женщин был диагностирован ГМП, а у 305 (36,3%) при уродинамическом исследовании выявлена гиперреактивность детрузора. В данном исследовании ожирение (p<0,001) было единственным независимым прогностическим фактором для ГМП (OР 1,09; 95% ДИ 1,05–1,13) и уродинамической гиперреактивности детрузора (OР 1,06; 95% ДИI 1,03–1,08) соответственно [27]. Увеличение массы тела как фактор риска недержания мочи нередко может быть причиной неудач корригирующего оперативного лечения [28].
В хорватско-австрийском исследовании «случай-контроль» [29] показано, что ГМП значительно чаще встречается у пациентов, страдающих МС, чем у пациентов без МС. По мнению авторов, оценка наличия и мониторинг ГМП должны быть частью клинического ведения пациентов с МС [29].
В турецком исследовании [30] МС был диагностирован у 201 (64%) из 313 женщин с ГМП и у 73 (35%) из 208 женщин без ГМП. Различия между группами статистически достоверны (p=0,002). Объяснением такой взаимосвязи, по мнению исследователей, может являться наличие инсулинорезистентности у пациентов с МС. В этом исследовании в группе пациентов с ГМП выявили достоверное увеличение окружности талии и ИМТ по сравнению с пациентами без ГМП (98,73 и 91,55 см; 31,37 и 27,71 кг/м2 соответственно), а также достоверно более высокую частоту АГ (53 и 5%), более низкий уровень липопротеинов высокой плотности (52,75 и 57,25 мг/дл). При обсуждении возможных причин связи между МС и ГМП авторы отмечают, что противовоспалительные цитокины и «миопатия» мочевого пузыря могут провоцировать гиперактивность детрузора [30].
В другом исследовании [31] этих авторов, в котором измерялись уровни инсулина, глюкозы, липопротеидов высокой плотности и триглицеридов в сыворотке крови натощак, а инсулинорезистентность оценивали по величине индекса инсулинорезистентности (HOMA-IR), было отмечено, что уровень инсулина в сыворотке был выше (p=0,036) у женщин с ГМП (11,5±6,2 мкЕд/мл) по сравнению с контрольной группой (6,4±2,1 мкЕд/мл), индекс HOMA-IR был значительно выше (p=0,018) в группе ГМП, 2,86 по сравнению с контролем – 1,32, а уровни холестерина липопротеидов высокой плотности были значительно ниже у женщин с ГМП.
Выявляются новые взаимосвязи, в частности, установлена связь между МС и ГМП, осуществляемая через механизм гипоксии детрузора, – нарушение микроциркуляции в стенке мочевого пузыря. Противовоспалительные цитокины и миопатия мочевого пузыря также могут провоцировать гиперактивность детрузора при наличии МС [32].
В обзоре американских ученых [33] показано, что при умеренной потере веса (5–10%) наблюдается постепенное улучшение показателей качества жизни, депрессии, подвижности, сексуальной дисфункции и недержания мочи при стрессе, а при дальнейшей потере веса наблюдается дальнейшее улучшение. Соблюдение диетических рекомендаций также позитивно влияет на симптомы недержания мочи [34–38].
Недержание мочи – частая проблема при СД, хотя пациенты обычно не сообщают о ней. Это диктует требования, сформулированные Американским обществом гериатрии, согласно которым врачи должны всегда проводить ежегодный скрининг на недержание мочи, которое может быть важной причиной социальной изоляции, депрессии, падений и переломов [39].
При обследовании 818 японских пациентов с СД 2 типа распространенность ургентного недержания мочи составила 9,2%. С ургентным недержанием был независимо положительно связан инсульт со скорректированным отношением шансов (ОР 2,34; 95% ДИ 1,03–4,95). Связь между ишемической болезнью сердца или заболеваниями периферических артерий и распространенностью ургентного недержания мочи не была значимой [40, 41].
В российском исследовании [42], в котором было опрошено 1000 пациенток, частота недержания мочи возрастала среди женщин, страдающих СД, достигая 37,7% (p<0,001). При этом у женщин с СД существенно чаще (в 2,1 раза, p<0,05) наблюдался смешанный тип недержания мочи, а СНМ, наоборот, отмечалось реже (p<0,05).Симптомы недержания мочи при СД обусловлены диабетической цистопатией, ведущими патогенетическими факторами которой являются вегетативная (автономная) нейропатия, поражение детрузора и дисфункция уротелия. При этом появление этих нарушений связано с диабетической ангиопатией, являющейся по существу основой развития диабетической цистопатии [43]. Хронические осложнения СД, такие как полинейропатия, являются важными предикторами возникновения дисфункции мочевого пузыря [44, 45].
Таким образом, наличие АГ, МС, ожирения и СД следует рассматривать в качестве факторов риска развития недержания мочи. Вместе с тем следует отметить, что имеются лишь единичные сведения о возможном влиянии лекарственной терапии этой коморбидной патологии, в частности антигипертензивной терапии, на симптомы недержания мочи.
Антигипертензивная терапия (АГТ) и недержание мочи
В американском многоцентровом исследовании [46], в котором участвовали 1446 мужчин и 1628 женщин (средний возраст 73,7 года), ГМП присутствовал у 31,6% мужчин и 38,9% женщин по результатам применения опросника ICIQ. Среди 894 мужчин и 981 женщины, принимавших антигипертензивные препараты, наличие ГМП ассоциировалось с более высоким систолическим АД среди мужчин (4,04 мм рт. ст.; 95% ДИ 1,02–7,06), но не среди женщин (-0,67 мм рт. ст.; 95% ДИ -3,79–2,46), в то время как диастолическое АД не отличалось наличием ГМП у мужчин и женщин. Кроме того, наличие ГМП было также связано с более низкими шансами на контроль АД у мужчин (ОР 0,69; 95% ДИ 0,49–0,96), но не у женщин (OР 0,96; 95% ДИ 0,71- 1,30).
Американские исследователи [47] при обследовании 152 902 пожилых пациентов домов сестринского ухода, у которых недержание мочи встречалось в 76,6%, используя модель многомерной логистической регрессии, отметили, что использование тиазидных диуретиков не было значимо связано с недержанием мочи. Следует отметить, что в литературе часто используются обобщенные понятия «тиазидные диуретики» или «диуретик». Однако в последнее время отмечено значимое различие в их антигипертензивных эффектах и безопасности, поэтому целесообразно их подразделение на тиазидные и тиазидоподобные [48–50], так, в рекомендациях ESC/ESH (2018) [51] подчеркивается наличие у тиазидоподобных диуретиков более обширной доказательной базы в отношении их эффективности и прогностической значимости. В раннее проведенном нами исследовании [52], в которое были включены 32 женщины в возрасте от 41 до 55 лет (средний возраст составил 47,5±2,5 года) с симптомами ГМП и наличием сопутствующей АГ, АГТ включала гидрохлоротиазид 12,5–25 мг/сут в сочетании с ингибитором ангиотензинпревращающего фермента или блокатором рецепторов ангиотензина. Поскольку антигипертензивный эффект тиазидоподобного диуретика индапамида проявляется в дозах, меньших, чем необходимо для диуретического эффекта, пациенткам была проведена коррекция АГТ, заключающаяся в замене гидрохлоротиазида на Индап® (индапамид 2,5 мг в сутки). До начала исследования и спустя 2 мес приема Индапа оценивали частоту мочеиспусканий и ургентных позывов, определяли уровень калия, глюкозы и мочевой кислоты в крови, осуществляли контроль АД. Через 2 мес после коррекции АГТ нами было отмечено уменьшение числа мочеиспусканий за сутки с 12±3,4 до 10±2,1, количества ургентных позывов – с 4,2±2,4 до 2,9±1,9. Исходный уровень калия в сыворотке крови повысился на 2,3%, уровень глюкозы снизился на 1,9%, уровень мочевой кислоты снизился на 1,3%, при этом уровень АД по сравнению с исходным снизился соответственно на 6,26/7,63%. В следующем нашем пилотном исследовании проведен опрос 86 женщин с АГ без признаков мочевой инфекции в возрасте от 35 до 74 лет. На наличие эпизодов недержания мочи при напряжении и ГМП указали
39 (45,3%) пациенток. При дальнейшем сравнении 2 сформированных групп с АГ и недержанием мочи (1-я группа) и АГ без недержания мочи (2-я группа) нами отмечено, что в 1-й группе были выше средний возраст (64,1±1,9 и 59,9±2,1) и стаж АГ, чаще выявлялась сопутствующая гинекологическая и урологическая патология (соответственно 51,3 и 43,6% против 38,3 и 31,9%), а также коморбидная патология (СД, дислипидемия и другие сердечно-сосудистые заболевания) – соответственно 64,1 и 55,3%. Отмечено различие в АГТ – у пациенток с недержанием мочи чаще применялись дигидропиридоновые антагонисты кальция (30,8%), в то время как у пациенток без недержания мочи они использовались реже – 14,9%. В описании лекарственных препаратов этой группы в справочнике Видаль (https://www.vidal.ru/) указывается на возможные побочные эффекты препаратов этой группы со стороны мочевыделительной системы, в частности, на учащенное мочеиспускание. Также нами отмечены различия в частоте применения тиазидных и тиазидоподобных диуретиков, так, в 1-й группе чаще использовался гидрохлоротиазид (20,5%) и реже индапамид (10,3%), а во 2-й группе, напротив, гидрохлоротиазид применялся реже (8,5%) и чаще индапамид (15,2%). Безусловно, вопросы влияния АГТ на недержание мочи нуждаются в дальнейшем изучении и уточнении. В свою очередь, препараты, используемые для лечения недержания мочи, могут влиять на имеющуюся у пациентов коморбидную патологию. Так, в обзоре Кокрановской базы данных [53] отмечается, что адренергические препараты – α- и β- адреномиметики (фенилпропаноламин, мидодрин, норэпинефрин, кленбутерол, тербуталин, эскорнад) для лечения недержания мочи обладают редкими, но серьезными побочными эффектами, к которым авторы отнесли АГ и аритмию. В систематическом обзоре [54], включавшем 49 источников, в которых проводилось сравнение лечения ГМП β3-адренергическими агонистами (вибегроном и мирабегроном) и толтеродином, отмечено, что в краткосрочных и долгосрочных исследованиях АГ была наиболее частым нежелательным явлением при трех вариантах лечения. В исследовании EMPOWUR [55], в котором пациенты принимали вибегрон 75 мг и толтеродин 4 мг, отмечено, что наиболее частым нежелательным явлением при приеме вибегрона/толтеродина (>5% в каждой группе) была АГ (8,8 и 8,6% соответственно). В систематическом обзоре [56] проведен анализ 5 рандомизированных клинических исследований (РКИ), в которых проводилось сравнение солифенацина и мирабегрона, и отмечено, что тахикардия чаще отмечалась при использовании мирабегрона. В систематическом обзоре (491 статья) и метаанализе (8 РКИ с общим числом 10 248 пациентов) показано [57], что мирабегрон в дозе 100 мг увеличивает риск АГ (ОР 1,41; p=0,08) и аритмии (ОР 2,18; p=0,06). Таким образом, у пациентов с недержанием мочи и наличием коморбидных состояний, которые одновременно являются и факторами риска недержания мочи (АГ, СД, МС, ожирение и ряд других), актуален выбор лекарственного препарата для лечения недержания мочи с минимальным влиянием на сопутствующую коморбидную патологию.
Лечение недержания мочи у коморбидных пациентов
При ГМП основным методом лечения является медикаментозный. М-холинолитики являются на сегодняшний день золотым стандартом фармакотерапии инконтиненции, обусловленной гиперактивным детрузором. Они блокируют м-холинорецепторы, являясь конкурентными ингибиторами ацетилхолина на рецепторах постсинаптических мембран гладкой мускулатуры. При этом ингибируется ответ, вызванный постганглионарной парасимпатической активацией блуждающего нерва. В мочевом пузыре мускариновые рецепторы располагаются в гладкомышечной ткани детрузора, в уротелии и парасимпатических и симпатических нервных окончаниях. Существует 5 подтипов мускариновых рецепторов, получивших названия М1, М2, М3, М4, М5 (табл.). Ведущее значение в функции мочевого пузыря имеют подтипы М2 и М3. По современным данным, М3-рецепторы играют основную роль в сокращении гладкомышечной ткани детрузора, в то время как М2-рецепторы тормозят его симпатически-опосредованное расслабление. Таким образом, М2- и М3-рецепторы действуют содружественно, способствуя опорожнению мочевого пузыря [58, 59].
М-холинолитики являются базисными препаратами. Они используются как в качестве монотерапии, так и в сочетании с поведенческой терапией, биологической обратной связью, физиотерапией, другими лекарственными препаратами.
М-холинолитики для лечения ГМП подразделяются:
• на третичные аммониевые соединения: оксибутинин, дарифенацин, фезотеродин, толтеродин, солифенацин, еще один препарат этой группы (пропиверин) в РФ не зарегистрирован;
• четвертичные аммониевые соединения: троспия хлорид.
Начальный период приема м-холинолитиков составляет 12 нед. Применение м-холинолитиков приводит к уменьшению симптомов ГМП. Троспия хлорид обладает наивысшим среди М-холинолитиков сродством ко всем видам М-холинорецепторов (см. табл.) и наиболее специфичен в отношении связывания с М2- и М3-рецепторами, что позволяет предполагать его более высокую эффективность в ослаблении сокращений детрузора.
Метаанализ эффективности и безопасности М-холинолитиков, в который для сравнения эффективности было включено 76 исследований (суммарно 38 662 пациента) и для выявления неблагоприятных событий – 90 исследований (39 919 пациентов), показал эффективность и безопасность троспия хлорида в дозе
40 мг/сут по сравнению с оксибутинином, пропиверином, фезотеродином [69]. Троспия хлорид значительно реже вызывал побочные эффекты в целом [69–71], например, сухость во рту [72, 73] или нарушения аккомодации [74, 75].
Безопасность применения троспия хлорида по сравнению с другими М-холинолитиками обусловлена еще и тем, что это единственный М-холинолитик, не метаболизирующийся в печени и не влияющий на ее функции (не участвует в метаболизме ферментов из группы цитохрома Р-450), что предполагает возможность его безопасного применения с другими лекарственными препаратами, а также у пациентов с нарушениями функциональных печеночных проб [65, 66, 76, 77].
Вышеперечисленное позволяет рассматривать троспия хлорид как препарат выбора у пожилых пациентов [62, 67, 78–80] и неврологических больных [81–86].
Накопление троспия хлорида в неизмененном виде происходит в мочевом пузыре. При этом троспия хлорид вторично оказывает воздействие на М-холинорецепторы слизистой и подслизистой оболочек мочевого пузыря. Благодаря этому двойному действию троспия хлорид обладает усиленным терапевтическим эффектом.
Изучение эффективности и безопасности различных доз препарата Спазмекс® для больных идиопатическим ГМП проведено в широкомасштабной наблюдательной программе «Ресурс» [84, 86], в которую были включены 669 пациентов с идиопатическим ГМП – 359 женщин и 310 мужчин. На первом визите всем пациентам назначали Спазмекс® в стандартной дозе 45 мг/сут. Результаты лечения оценивали на четырех последующих визитах через 3, 6, 9 и 12 нед. В зависимости от результатов обследования дозу препарата снижали при наличии нежелательных явлений или увеличивали при недостаточном эффекте лечения. Через 12 нед 102 больных принимали препарат в дозировке 30, 241–45, 257–60 и 22–75 мг/сут.
Таким образом, индивидуальный подход к выбору дозы препарата Спазмекс® для больных идиопатической формой ГМП может являться эффективной и довольно безопасной мерой в достижении оптимального клинического результата с хорошим профилем безопасности [84, 86]. У пациентов с почечной недостаточностью (клиренс креатинина 10–30 мл/мин/1,73 м2) суточная доза препарата не должна превышать 15 мг. Пациентам пожилого возраста Спазмекс® назначают по 5 мг 3 р/сут.
После исчезновения симптоматики рекомендуется продолжить лечение в качестве противорецидивной терапии в течение 2–4 нед (общая продолжительность лечения составляет 2–3 мес). При необходимости более длительного лечения вопрос о продолжении лечения пересматривается врачом каждые 3–6 мес.
Эффективность и безопасность троспия хлорида (Спазмекс®) у женщин в лечении ГМП, обусловленного различными причинами, продемонстрирована в целом ряде отечественных и зарубежных исследований [87–98].
В педиатрической практике применение препарата Спазмекс® способствует сокращению случаев энуреза, уменьшению числа императивных позывов к мочеиспусканию и императивного недержания мочи, повышению среднеэффективной емкости мочевого пузыря, при этом лечение препаратом Спазмекс® являлось безопасным, хорошо переносилось больными [99–102].
Троспия хлорид безопасен и эффективен у мужчин с ГМП [103]. Традиционно симптомы нижних мочевыводящих путей у мужчин урологи связывали с заболеваниями предстательной железы, и мало кто допускал в качестве их причины нарушение функции мочевого пузыря. С функциональной точки зрения сложно отделить мочевой пузырь и предстательную железу, и в связи с этим нельзя отрицать того, что развитие симптомов ГМП у мужчин, возможно, имеет патогенетическую взаимосвязь с доброкачественной гиперплазией предстательной железы (ДГПЖ). Установлено, что 70–75% больных ДГПЖ страдают именно от связанных с ГМП ирритативных симптомов, которые причиняют им большее беспокойство, чем жалобы, связанные с инфравезикальной обструкцией [104–106].
При расстройствах мочеиспускания у мужчин возможно комбинированное применение троспия хлорида (Спазмекс®) с α-адреноблокаторами (тамсулозин, доксазозин) или с α-адреноблокаторами и ингибиторами фосфодиэстеразы 5-го типа (силденафил, тадалафил) [105]. Так, эффективность комбинированной терапии «тамсулозин + троспия хлорид» у мужчин с ДГПЖ в сочетании с симптомами ГАМП отмечена в российском рандомизированном исследовании с участием 452 пациентов [107–109].
В многоцентровом проспективном рандомизированном контролируемом исследовании у мужчин после контактной лучевой терапии рака предстательной железы также было отмечено существенное улучшение симптомов со стороны нижних мочевых путей при комбинированной терапии тамсулозином и троспия хлоридом по сравнению с монотерапией тамсулозином [110]. Отмечена эффективность троспия хлорида в комплексной терапии лечения недержания мочи и после радикальной простатэктомии [111]. В проспективном рандомизированном плацебо-контролируемом исследовании, в котором участвовали 200 пациентов мужского пола с камнями мочеточника после стентирования мочеточника стентами JJ и наличием симптомов нижних мочевых путей, наиболее эффективным в купировании расстройств мочеиспускания были троспия хлорид в дозе 20 мг и солифенацин в дозе 5 мг, при этом в группе троспия хлорида был отмечен лучший контроль частоты мочеиспусканий при существенно меньшей частоте побочных эффектов [72].
При добавлении препарата Спазмекс® в стандартную этиопатогенетическую терапию по поводу хронического простатита через 1 мес комплексного лечения отмечено уменьшение частоты мочеиспусканий на 56,1%, число ургентных позывов на мочеиспускание сократилось более чем вдвое, функциональная емкость мочевого пузыря возросла на 82,8% [112].
При СНМ лекарственные средства позволяют затормозить сокращение стенок мочевого пузыря, вызвать сокращение сфинктера или снизить выработку мочи. Наибольшего эффекта можно достичь при сочетании с гормональной терапией. Необходимо подчеркнуть, что из большого количества лекарств, предложенных для лечения недержания мочи, лишь назначение препаратов с антихолинергической активностью (троспия хлорид и другие м-холинолитики) является патогенетически обоснованным [87, 92].
В случае наличия у пациенток смешанной формы недержания мочи крайне важно определить ведущий компонент в развитии недержания. У 55% женщин, обратившихся с симптомами смешанного недержания мочи, клинически преобладает ургентный компонент недержания мочи, а стрессовый – у 38% пациенток. От этого зависит определение дальнейшей тактики лечения больной. Назначение троспия хлорида позволяет выделить стрессовый компонент, устранив гиперактивный, и определить показания к возможному оперативному вмешательству [93–95], поскольку от 30 до 50% прооперированных пациенток со смешанной формой недержания мочи в послеоперационном периоде имеют симптомы ГМП, а у половины из них детрузорная гиперактивность подтверждена при цистометрии.
Эффективность препарата троспия хлорида отмечена у пациенток с симптомами ГМП с наличием пролапса гениталий [88, 89] и после операции троакарного синтетического слинга [96, 113].
Троспия хлорид может быть рекомендован пациенткам после родов, которые отказались от грудного вскармливания по тем или иным причинам, с симптомами ГМП и смешанным типом нарушения мочеиспускания. Применение препарата троспия хлорида значительно повышает качество жизни пациенток послеродового периода [114].
На российском фармацевтическом рынке более 15 лет присутствует представленный эксклюзивным дистрибьютором в РФ – компанией PRO.MED.CS Praha, a.s. (Чешская Республика) оригинальный препарат троспия хлорида – Спазмекс® компании Dr. R.Pfleger, Chemische Fabric, GmbH (Германия). Препарат выпускается в таблетках по 5, 15 и 30 мг. Благодаря своей безопасности – отсутствию воздействия на центральную нервную систему и отсутствию метаболизма в печени дозу препарата Спазмекс® возможно титровать, т.е. увеличивать дозу при слабом результате или его отсутствии.
Препарат назначают внутрь взрослым и детям старше 14 лет. Режим дозирования и длительность лечения устанавливают индивидуально в зависимости от клинической картины и тяжести заболевания. Таблетки следует принимать до еды, не разжевывая, запивая достаточным количеством воды. Таблетки 5 мг назначают по 2–3 таб. 3 р/сут (30–45 мг) с интервалом 8 ч; при суточной дозе 45 мг допустимо принимать по 30 мг утром и 15 мг вечером. Таблетки, покрытые пленочной оболочкой, 15 мг, назначают по 1 таб. 3 р/сут с интервалом 8 ч; суточная доза – 45 мг. Таблетки, покрытые пленочной оболочкой, 30 мг, назначают по 1/2 таб. 3 р/сут или 1 таб. утром и 1/2 таб. вечером; суточная доза – 45 мг. Основными показаниями к назначению препарата Спазмекс® являются:
1) ГМП, сопровождающийся недержанием мочи, императивными позывами к мочеиспусканию и увеличением частоты мочеиспусканий (при идиопатической гиперактивности детрузора негормональной и неорганической этиологии);
2) смешанные формы недержания мочи;
3) спастические нейрогенные нарушения функции мочевого пузыря (при нейрогенной гиперактивности/гиперрефлексии детрузора на фоне рассеянного склероза, спинальных травм, врожденных и приобретенных заболеваний спинного мозга, инсультов, паркинсонизма);
4) детрузор-сфинктер-диссинергия на фоне интермиттирующего катетеризма;
5) поллакиурия, никтурия;
6) ночной и дневной энурез;
7) комплексная терапия циститов, сопровождающихся императивной симптоматикой.
Опыт применения препарата Спазмекс® свидетельствует о его безопасности и эффективности в лечении недержания мочи у различных категорий пациентов [65, 66, 76, 78, 81, 83, 87–89, 90–96, 98–101, 104–109, 111–118].
Заключение
Наличие на российском фармацевтическом рынке четвертичного аммониевого соединения троспия хлорида (Спазмекс®) позволяет проводить эффективную и безопасную фармакотерапию недержания мочи, в том числе и у коморбидных пациентов, не ограничиваясь лишь гигиеническими рекомендациями.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
Трухан Дмитрий Иванович – д-р мед. наук, доцент, проф. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО «Омский ГМУ». E-mail: dmitry_trukhan@mail.ru; ORCID: 0000-0002-1597-1876
Dmitry I. Trukhan – D. Sci. (Med.), Prof., Omsk State Medical University. E-mail: dmitry_trukhan@mail.ru; ORCID: 0000-0002-1597-1876
Чуянова Юлия Сергеевна – врач общей практики БУЗОО ГБ №3 г. Омска. E-mail: ya.svistunova123@yandex.ru
Yulia S. Chuyanova – general practitioner, City Hospital №3, Omsk. E-mail: ya.svistunova123@yandex.ru
Макушин Дмитрий Геннадьевич – канд. мед. наук, зав. урологическим отд-нием Западно-Сибирского медицинского центра ФГБУЗ ФМБА России. E-mail: dmg1@mail.ru; ORCID 0000-0001-6401-0687
Dmitry G. Makushin – Cand. Sci. (Med.), West Siberian medical center FMBA of Russia. E-mail: dmg1@mail.ru; ORCID 0000-0001-6401-0687
Статья поступила в редакцию / The article received: 24.11.2021
Статья принята к печати / The article approved for publication: 25.11.2021
28 октября 2021
Количество просмотров: 2441


