Клинический разбор в общей медицине №4 2023
Ulyanovsk State University, Ulyanovsk, Russia
lbely@yandex.ru
Abstract
One of the factors that can lead to the development of male infertility is an infection of the genitourinary tract. An infectious and inflammatory process affecting the male reproductive system can cause various disorders of reproductive function: a disorder of gametogenesis in the testicles, disorders of sperm maturation in the epididymis, and passage of sperm along the vas deferens, as well as a decrease in some parameters of the ejaculate due to inflammatory dysfunction of the male accessory glands. Prostatitis is one of the most common urological diseases in young men. Prostatitis accounts for 25% of all requests for medical help to a urologist, and from 2 to 10% of men suffer from prostatitis symptoms. The disease is polyethological, and infection, immunological reactions, urethro-prostatic reflux of urine, psychoemotional stress are mentioned as the main causes of its development today. It is obvious that a pathological process with complex pathogenetic mechanisms affecting the prostate gland can have a negative impact on male fertility. This review examines the key mechanisms of the development of male infertility in chronic prostatitis.
Key words: male infertility, spermogram, chronic prostatitis, leukocytospermia, male factor, male accessory gland infection.
For citation: Belyi L.E. Chronic prostatitis and male infertility. Clinical review for general practice. 2023; 4 (4): 89–93. DOI: 10.47407/kr2023.4.4.00261
Эксперты Всемирной организации здравоохранения (ВОЗ) указывают, что мужская фертильность может быть нарушена вследствие: врожденных аномалий или приобретенных дефектов мочеполовой системы; злокачественных новообразований; инфекции мочеполовых путей; повышенной температуры мошонки (например, как следствие варикоцеле); эндокринных нарушений; генетических отклонений; иммунологических факторов [4]. Современная цивилизация характеризуется негативной модификацией образа жизни среднестатистического молодого мужчины, часто приводящей к гиподинамии, избыточной массе тела, гипогонадизму, что в итоге становится причиной мужской инфертильности. Кроме этого, в эпоху растущей антибиотикорезистентности в качестве этиологического фактора мужского бесплодия все чаще выступает инфекция. Инфекционно-опосредованные нарушения репродуктивной функции определяются уровнем поражения мужской половой системы. Негативному влиянию могут подвергнуться секреция сперматозоидов в яичках, дозревание гамет в придатках яичек и их дальнейший пассаж по семявыносящим путям, капацитация и жизнеспособность сперматозоидов в простатовезикулярном комплексе [5].
 Простатит является одним из наиболее часто встречающихся урологических заболеваний у молодых мужчин. По данным F. Khan и соавт. [6], простатит составляет 25% всех обращений за медицинской помощью к урологу, а от симптомов простатита страдают от 2 до 10% мужчин [7]. Заболевание является полиэтиологическим, и в качестве основных причин сегодня упоминают инфекцию, иммунологические реакции, уретро-простатический рефлюкс мочи, психоэмоциональный стресс [8]. Это подтверждает концепцию, согласно которой под термином «хронический простатит» следует понимать целую группу болезней, отличающихся как по этиологии, так и патогенезу. Более 20 лет в клинической практике используется классификация простатита, разработанная National Institutes of Health (NIH) в 1995 г. Согласно данной классификации, традиционно выделяют следующие четыре категории простатита: I – острый бактериальный простатит; II – хронический бактериальный простатит; III – хронический простатит/синдром хронической тазовой боли; IV – бессимптомный воспалительный простатит [9]. По данным
Простатит является одним из наиболее часто встречающихся урологических заболеваний у молодых мужчин. По данным F. Khan и соавт. [6], простатит составляет 25% всех обращений за медицинской помощью к урологу, а от симптомов простатита страдают от 2 до 10% мужчин [7]. Заболевание является полиэтиологическим, и в качестве основных причин сегодня упоминают инфекцию, иммунологические реакции, уретро-простатический рефлюкс мочи, психоэмоциональный стресс [8]. Это подтверждает концепцию, согласно которой под термином «хронический простатит» следует понимать целую группу болезней, отличающихся как по этиологии, так и патогенезу. Более 20 лет в клинической практике используется классификация простатита, разработанная National Institutes of Health (NIH) в 1995 г. Согласно данной классификации, традиционно выделяют следующие четыре категории простатита: I – острый бактериальный простатит; II – хронический бактериальный простатит; III – хронический простатит/синдром хронической тазовой боли; IV – бессимптомный воспалительный простатит [9]. По данным
X. Hu [10], среди этих четырех типов хронический бактериальный простатит, по сути представляющий собой рецидивирующую инфекцию предстательной железы (ПЖ), составляет от 5 до 10% всех симптоматических случаев. Наряду с наличием характерных и специфических жалоб и обнаружением инфекции для постановки диагноза хронического простатита II категории необходимо обнаружение повышенного количества лейкоцитов в секрете ПЖ и/или моче, полученной после массажа ПЖ. Ю.Я. Кузнецкий указывает, что верхняя граница нормы, по данным различных исследований, варьирует от 2 до 20 лейкоцитов в большом поле зрения, однако общепринятой верхней границей нормы является обнаружение не более 10 лейкоцитов в поле зрения микроскопа [11].
Сложным вопросом, изучаемым на протяжении последних десятилетий, является влияние хронического воспаления в ПЖ на фертильность. Нельзя не согласиться с мнением A. Calogero и соавт. [12], который указывает, что классификация простатита NIH (1995 г.) не рассматривает спермограмму в качестве значимого инструмента диагностики простатита как нозологической единицы. Более того, нужно признать, что данная классификация стала базисом для системной недооценки распространенности патоспермии, ее тяжести и специфики у пациентов с простатитом. Индекс симптомов хронического простатита (NIH CPSI) – стандартизированный опросник, созданный NIH, состоит из доменов «Боль или дискомфорт», «Мочеиспускание», «Влияние симптомов на вашу жизнь», «Качество жизни» и не учитывает наличие сексуальной дисфункции или репродуктивных проблем [13].
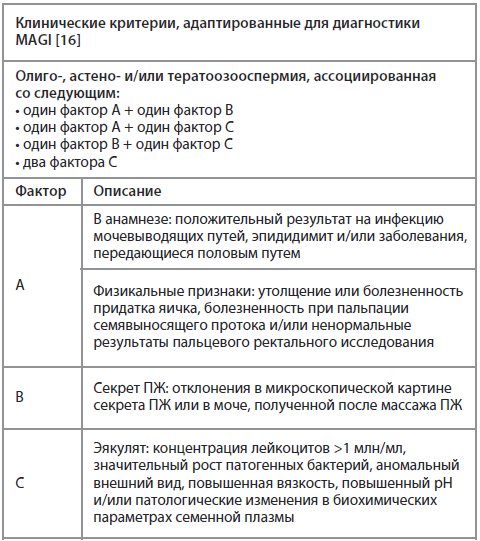
Обсуждая роль хронического простатита как этиопатогенетического фактора мужской инфертильности нельзя не коснуться дефиниции «инфекция добавочных мужских половых желез» (male accessory gland infection/inflammation – MAGI). Для постановки диагноза MAGI в 1993 г. экспертами ВОЗ предложены диагностические критерии, обнаружение комбинаторных сочетаний которых позволяет говорить о наличии инфекционно-воспалительного процесса в мужской половой системе у пациента с патоспермией. Клинические критерии, используемые для диагностики MAGI, представлены в таблице. Важным обстоятельством является тот факт, что предложенный ВОЗ диагностический алгоритм в отличие от классификации простатита NIH (1995 г.) рассматривает отклонения в спермограмме как ключевую предпосылку для поиска диагностических критериев и постановки диагноза MAGI.
Симптомы MAGI очевидны. Это расстройства мочеиспускания (ноктурия, поллакиурия, ослабление струи мочи и появление чувства неполного опорожнения мочевого пузыря). Это хроническая боль или дискомфорт в мошонке, половом члене, паховой, надлонной областях и промежности. Кроме этого, мужчин с MAGI беспокоят сексуальные дисфункции: нарушение эрекции, преждевременная эякуляция и снижение либидо, которые, по данным S. La Vignera и соавт. [14], имеют место в 1/2 случаев. Примечательно, что в мужской популяции частота встречаемости MAGI колеблется в диапазоне от 5 до 30% [15]. Такой диапазон, отличающийся своими широкими границами от того же хронического простатита, связан с клинической вариабельностью. Как видно из таблицы, диагноз MAGI может быть установлен мужчине с олиго-, астено- и/или тератозооспермией, сочетающейся с двумя факторами С (например, лейкоцитоспермией и повышенной вязкостью эякулята) [15]. Иными словами, можно говорить о возможности фактически бессимптомного течения MAGI. Несомненно, что достаточно часто такие латентные варианты течения диагностируются лишь в той ситуации, когда мужчина столкнется с репродуктивными проблемами.
Обсуждая хронический простатит и MAGI, мы сталкиваемся с терминологической коллизией, когда типовые патологические процессы (воспаление, расстройства кровообращения и др.), протекающие в ПЖ, семенных пузырьках и других органах мужской репродуктивной системы, рассматриваются с разных методологических позиций. Собственно, поэтому лейкоцитоспермия, оксидативный стресс, вискозипатия эякулята могут сопровождать хронический простатит, предопределяя его патогенетическую роль в развитии мужской инфертильности.
Насколько влияет лейкоцитоспермия на ключевые параметры спермограммы у мужчин с хроническим бактериальным простатитом? Согласно общепринятому мнению, лейкоцитоспермия, определяемая как наличие более 1 млн лейкоцитов в 1 мл спермы, фактически является индикатором инфекции и воспаления в мужской репродуктивной системе. По мнению B. Bachir и соавт. [20], эта связь остается спорной, так как многочисленные исследования не обнаружили связи между лейкоцитоспермией и подтвержденной инфекцией. Одновременно с этим есть более веские доводы в пользу того, что наличие лейкоцитоспермии является отрицательным прогностическим фактором для фертильного потенциала мужчины [21]. Лейкоцитоспермия часто связана с ухудшением ключевых качественных и количественных параметров сперматозоидов, таких как морфология, подвижность и количество сперматозоидов [23]. Есть данные, что лейкоцитоспермия присутствует у 30% мужчин с бесплодием [24].
Лейкоциты участвуют в организации воспалительного ответа посредством синтеза цитокинов и других провоспалительных медиаторов: оксида азота, простагландинов и хемокинов [24, 25].
Одна из целей данного воспалительного ответа заключается в попытке элиминации патогенов. W. Eggert-Kruse и соавт. (2001 г.) изучали концентрации интерлейкинов – ИЛ-8 и ИЛ-6 в образцах семенной плазмы у 137 случайно отобранных субфертильных мужчин без клинических признаков инфекции репродуктивной системы. Было установлено, что концентрация ИЛ-8 была обратно пропорциональна общему количеству подвижных сперматозоидов. Кроме этого, обнаружена корреляция концентрации ИЛ-8 с количеством лейкоцитов в эякуляте (p<0,0001). Концентрация ИЛ-6 была намного ниже, но значительно коррелировала с ИЛ-8 (р<0,0001). Важно, что концентрации обоих ИЛ в семенной плазме коррелировали с концентрацией ключевого компонента системы комплемента С3, в то время как связи концентраций ИЛ с бактериальной колонизацией образцов спермы обнаружено не было [24]. В другом исследовании [25] при анализе образцов спермы мужчин, обратившихся в андрологическую клинику, было установлено, что количество лейкоцитов в сперме достоверно коррелировало с повышением уровня ИЛ-6, ИЛ-8 и фактора некроза опухоли α (ФНО-α). Примечательно, что одновременное присутствие бактериальных патогенов и лейкоцитов ассоциировалось с высокими уровнями ИЛ-8 и ФНО-α, тогда как ИЛ-6 в большей степени был ассоциирован с лейкоцитоспермией.
Другая цель воспалительного ответа, инициируемого лейкоцитами, – создание условий для апоптоза незрелых или аномальных сперматозоидов путем их фагоцитоза и образования активных форм кислорода (АФК) [17]. Иными словами, речь идет о развитии опосредованного лейкоцитоспермией оксидативного стресса, речь о котором пойдет ниже.
Существует и альтернативное мнение о влиянии лейкоцитов простатического происхождения на качество спермы. Напомним, что семяизвержение, как физиологический процесс, состоит из двух последовательных фаз. В фазу эмиссии вследствие реализации симпатических спинальных рефлексов возникают сокращения придатка яичка, семявыносящего протока, семенных пузырьков, ПЖ, шейки мочевого пузыря и все компоненты семенной жидкости попадают в заднюю часть мочеиспускательного канала. В фазу экспульсии происходят ритмичные сокращения мышц тазового дна и расслабление сфинктера уретры, вследствие чего семенная жидкость выводится наружу из мочеиспускательного канала [26]. Поэтому высказывается мнение, что сперматозоиды контактируют с лейкоцитами простатического происхождения лишь в течение короткого временного интервала, находясь под защитой антиоксидантных систем спермы [27].
АФК могут ухудшать подвижность сперматозоидов путем активации перекисного окисления липидов (ПОЛ) в их мембранах, изменяя целостность этих мембран и состав белков [30]. Более того, чем интенсивнее ПОЛ, тем больше накапливается альдегидов, являющихся вторичными продуктами ПОЛ. Альдегиды могут легко диффундировать через плазматическую мембрану и вызвать модифицикацию цитоплазматических и ядерных белков [31]. Описанные процессы приведут к дисфункции митохондрий и нарушениям энергетического метаболизма в сперматозоидах.
Вискозипатия подавляет нормальное движение сперматозоидов по женскому репродуктивному тракту [37], вызывает астенозооспермию из-за развития биохимического дисбаланса семенной плазмы. Повышенная вязкость семенной жидкости требует большего количества энергии, необходимого сперматозоидам для прогрессивного движения [38]. В исследовании G. Gonzales и соавт. [37] в образцах спермы с повышенной вязкостью была снижена не только подвижность сперматозоидов, но и их жизнеспособность, а также концентрация фруктозы в семенной плазме.
2. Одновременное существование понятия MAGI и термина «хронический простатит», под которым подразумевают целую группу болезней, отличающихся как по этиологии, так и патогенезу, затрудняет создание единых лечебно-диагностических подходов к мужчине с хроническим инфекционно-воспалительным процессом в репродуктивной системе и патоспермией.
3. Анамнестическое указание на наличие простатических симптомов в прошлом заставляет обсуждать целесообразность комплексного обследования мужчины c репродуктивными планами, в рамках которого спермограмма должна быть главной предпосылкой для поиска диагностических критериев и постановки диагноза MAGI. Вместе с тем отсутствие в анамнезе хронического простатита не исключает возможности наличия астено-, олиго- и/или тератозооспермии на фоне бессимптомного течения MAGI.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Сonflict of interests. The author declares that there is not conflict of interests.
Информация об авторе / Information about the author
Белый Лев Евгеньевич – д-р мед. наук, проф. каф. госпитальной хирургии, анестезиологии, реаниматологии, урологии, травматологии, ортопедии, ФГБОУ ВО УлГУ. E-mail: lbely@yandex.ru
Lev E. Belyi – D. Sci. (Med.), Prof., Ulyanovsk State University. E-mail: lbely@yandex.ru
Поступила в редакцию / Received: 10.03.2023
Поступила после рецензирования / Revised: 22.03.2023
Принята к публикации / Accepted: 06.04.2023
Клинический разбор в общей медицине №4 2023
Хронический простатит и мужское бесплодие
Номера страниц в выпуске:89-93
Аннотация
Одним из факторов, которые могут привести к развитию мужского бесплодия, является инфекция мочеполовых путей. Инфекционно-воспалительный процесс, затрагивающий мужскую половую систему, может стать причиной различных нарушений репродуктивной функции: расстройства гаметогенеза в яичках, нарушений дозревания сперматозоидов в придатках яичек и пассажа сперматозоидов по семявыносящим путям, а также снижения некоторых параметров эякулята вследствие воспалительной дисфункции добавочных мужских половых желез. Простатит является одним из наиболее часто встречающихся урологических заболеваний у молодых мужчин. Простатит составляет 25% всех обращений за медицинской помощью к урологу, а от симптомов простатита страдают от 2 до 10% мужчин. Заболевание является полиэтиологическим, и в качестве основных причин его развития сегодня упоминают инфекцию, иммунологические реакции, уретро-простатический рефлюкс мочи, психоэмоциональный стресс. Очевидно, что патологический процесс со сложными патогенетическими механизмами, затрагивающий предстательную железу, может оказать негативное влияние на мужскую фертильность. В данном обзоре рассмотрены ключевые механизмы развития мужской инфертильности при хроническом простатите.
Ключевые слова: мужское бесплодие, спермограмма, хронический простатит, лейкоцитоспермия, мужской фактор, инфекция добавочных мужских половых желез.
Для цитирования: Белый Л.Е. Хронический простатит и мужское бесплодие. Клинический разбор в общей медицине. 2023; 4 (4): 89–93. DOI: 10.47407/kr2023.4.4.00261
Одним из факторов, которые могут привести к развитию мужского бесплодия, является инфекция мочеполовых путей. Инфекционно-воспалительный процесс, затрагивающий мужскую половую систему, может стать причиной различных нарушений репродуктивной функции: расстройства гаметогенеза в яичках, нарушений дозревания сперматозоидов в придатках яичек и пассажа сперматозоидов по семявыносящим путям, а также снижения некоторых параметров эякулята вследствие воспалительной дисфункции добавочных мужских половых желез. Простатит является одним из наиболее часто встречающихся урологических заболеваний у молодых мужчин. Простатит составляет 25% всех обращений за медицинской помощью к урологу, а от симптомов простатита страдают от 2 до 10% мужчин. Заболевание является полиэтиологическим, и в качестве основных причин его развития сегодня упоминают инфекцию, иммунологические реакции, уретро-простатический рефлюкс мочи, психоэмоциональный стресс. Очевидно, что патологический процесс со сложными патогенетическими механизмами, затрагивающий предстательную железу, может оказать негативное влияние на мужскую фертильность. В данном обзоре рассмотрены ключевые механизмы развития мужской инфертильности при хроническом простатите.
Ключевые слова: мужское бесплодие, спермограмма, хронический простатит, лейкоцитоспермия, мужской фактор, инфекция добавочных мужских половых желез.
Для цитирования: Белый Л.Е. Хронический простатит и мужское бесплодие. Клинический разбор в общей медицине. 2023; 4 (4): 89–93. DOI: 10.47407/kr2023.4.4.00261
Chronic prostatitis and male infertility
Lev E. BelyiUlyanovsk State University, Ulyanovsk, Russia
lbely@yandex.ru
Abstract
One of the factors that can lead to the development of male infertility is an infection of the genitourinary tract. An infectious and inflammatory process affecting the male reproductive system can cause various disorders of reproductive function: a disorder of gametogenesis in the testicles, disorders of sperm maturation in the epididymis, and passage of sperm along the vas deferens, as well as a decrease in some parameters of the ejaculate due to inflammatory dysfunction of the male accessory glands. Prostatitis is one of the most common urological diseases in young men. Prostatitis accounts for 25% of all requests for medical help to a urologist, and from 2 to 10% of men suffer from prostatitis symptoms. The disease is polyethological, and infection, immunological reactions, urethro-prostatic reflux of urine, psychoemotional stress are mentioned as the main causes of its development today. It is obvious that a pathological process with complex pathogenetic mechanisms affecting the prostate gland can have a negative impact on male fertility. This review examines the key mechanisms of the development of male infertility in chronic prostatitis.
Key words: male infertility, spermogram, chronic prostatitis, leukocytospermia, male factor, male accessory gland infection.
For citation: Belyi L.E. Chronic prostatitis and male infertility. Clinical review for general practice. 2023; 4 (4): 89–93. DOI: 10.47407/kr2023.4.4.00261
Введение
Специалисты в области репродукции из года в год приводят все более неутешительные данные, касающиеся растущего количества бесплодных пар. По мнению R. Cannarella и соавт. [1], объяснение этому заключается в следующем: средний возраст женщины, планирующей беременность, становится все больше, а качество спермы в мужской популяции неумолимо ухудшается. За последние 40 лет концентрация сперматозоидов и общее количество сперматозоидов в эякуляте сократились вдвое [2]. В условиях такого тренда существует острая потребность в создании новых, отвечающих времени диагностических алгоритмов мужского бесплодия, а для их построения необходимы новые научные знания, касающиеся этиологии и патогенеза мужской инфертильности. Это представляет определенные сложности, поскольку мужское бесплодие чаще всего не является самостоятельной нозологической формой, а представляет собой лишь отдельный симптом различных патологических состояний и заболеваний [3].Эксперты Всемирной организации здравоохранения (ВОЗ) указывают, что мужская фертильность может быть нарушена вследствие: врожденных аномалий или приобретенных дефектов мочеполовой системы; злокачественных новообразований; инфекции мочеполовых путей; повышенной температуры мошонки (например, как следствие варикоцеле); эндокринных нарушений; генетических отклонений; иммунологических факторов [4]. Современная цивилизация характеризуется негативной модификацией образа жизни среднестатистического молодого мужчины, часто приводящей к гиподинамии, избыточной массе тела, гипогонадизму, что в итоге становится причиной мужской инфертильности. Кроме этого, в эпоху растущей антибиотикорезистентности в качестве этиологического фактора мужского бесплодия все чаще выступает инфекция. Инфекционно-опосредованные нарушения репродуктивной функции определяются уровнем поражения мужской половой системы. Негативному влиянию могут подвергнуться секреция сперматозоидов в яичках, дозревание гамет в придатках яичек и их дальнейший пассаж по семявыносящим путям, капацитация и жизнеспособность сперматозоидов в простатовезикулярном комплексе [5].
«Простатит» и «инфекция добавочных мужских половых желез»: терминологическая коллизия?
 Простатит является одним из наиболее часто встречающихся урологических заболеваний у молодых мужчин. По данным F. Khan и соавт. [6], простатит составляет 25% всех обращений за медицинской помощью к урологу, а от симптомов простатита страдают от 2 до 10% мужчин [7]. Заболевание является полиэтиологическим, и в качестве основных причин сегодня упоминают инфекцию, иммунологические реакции, уретро-простатический рефлюкс мочи, психоэмоциональный стресс [8]. Это подтверждает концепцию, согласно которой под термином «хронический простатит» следует понимать целую группу болезней, отличающихся как по этиологии, так и патогенезу. Более 20 лет в клинической практике используется классификация простатита, разработанная National Institutes of Health (NIH) в 1995 г. Согласно данной классификации, традиционно выделяют следующие четыре категории простатита: I – острый бактериальный простатит; II – хронический бактериальный простатит; III – хронический простатит/синдром хронической тазовой боли; IV – бессимптомный воспалительный простатит [9]. По данным
Простатит является одним из наиболее часто встречающихся урологических заболеваний у молодых мужчин. По данным F. Khan и соавт. [6], простатит составляет 25% всех обращений за медицинской помощью к урологу, а от симптомов простатита страдают от 2 до 10% мужчин [7]. Заболевание является полиэтиологическим, и в качестве основных причин сегодня упоминают инфекцию, иммунологические реакции, уретро-простатический рефлюкс мочи, психоэмоциональный стресс [8]. Это подтверждает концепцию, согласно которой под термином «хронический простатит» следует понимать целую группу болезней, отличающихся как по этиологии, так и патогенезу. Более 20 лет в клинической практике используется классификация простатита, разработанная National Institutes of Health (NIH) в 1995 г. Согласно данной классификации, традиционно выделяют следующие четыре категории простатита: I – острый бактериальный простатит; II – хронический бактериальный простатит; III – хронический простатит/синдром хронической тазовой боли; IV – бессимптомный воспалительный простатит [9]. По данным X. Hu [10], среди этих четырех типов хронический бактериальный простатит, по сути представляющий собой рецидивирующую инфекцию предстательной железы (ПЖ), составляет от 5 до 10% всех симптоматических случаев. Наряду с наличием характерных и специфических жалоб и обнаружением инфекции для постановки диагноза хронического простатита II категории необходимо обнаружение повышенного количества лейкоцитов в секрете ПЖ и/или моче, полученной после массажа ПЖ. Ю.Я. Кузнецкий указывает, что верхняя граница нормы, по данным различных исследований, варьирует от 2 до 20 лейкоцитов в большом поле зрения, однако общепринятой верхней границей нормы является обнаружение не более 10 лейкоцитов в поле зрения микроскопа [11].
Сложным вопросом, изучаемым на протяжении последних десятилетий, является влияние хронического воспаления в ПЖ на фертильность. Нельзя не согласиться с мнением A. Calogero и соавт. [12], который указывает, что классификация простатита NIH (1995 г.) не рассматривает спермограмму в качестве значимого инструмента диагностики простатита как нозологической единицы. Более того, нужно признать, что данная классификация стала базисом для системной недооценки распространенности патоспермии, ее тяжести и специфики у пациентов с простатитом. Индекс симптомов хронического простатита (NIH CPSI) – стандартизированный опросник, созданный NIH, состоит из доменов «Боль или дискомфорт», «Мочеиспускание», «Влияние симптомов на вашу жизнь», «Качество жизни» и не учитывает наличие сексуальной дисфункции или репродуктивных проблем [13].
Обсуждая роль хронического простатита как этиопатогенетического фактора мужской инфертильности нельзя не коснуться дефиниции «инфекция добавочных мужских половых желез» (male accessory gland infection/inflammation – MAGI). Для постановки диагноза MAGI в 1993 г. экспертами ВОЗ предложены диагностические критерии, обнаружение комбинаторных сочетаний которых позволяет говорить о наличии инфекционно-воспалительного процесса в мужской половой системе у пациента с патоспермией. Клинические критерии, используемые для диагностики MAGI, представлены в таблице. Важным обстоятельством является тот факт, что предложенный ВОЗ диагностический алгоритм в отличие от классификации простатита NIH (1995 г.) рассматривает отклонения в спермограмме как ключевую предпосылку для поиска диагностических критериев и постановки диагноза MAGI.
Симптомы MAGI очевидны. Это расстройства мочеиспускания (ноктурия, поллакиурия, ослабление струи мочи и появление чувства неполного опорожнения мочевого пузыря). Это хроническая боль или дискомфорт в мошонке, половом члене, паховой, надлонной областях и промежности. Кроме этого, мужчин с MAGI беспокоят сексуальные дисфункции: нарушение эрекции, преждевременная эякуляция и снижение либидо, которые, по данным S. La Vignera и соавт. [14], имеют место в 1/2 случаев. Примечательно, что в мужской популяции частота встречаемости MAGI колеблется в диапазоне от 5 до 30% [15]. Такой диапазон, отличающийся своими широкими границами от того же хронического простатита, связан с клинической вариабельностью. Как видно из таблицы, диагноз MAGI может быть установлен мужчине с олиго-, астено- и/или тератозооспермией, сочетающейся с двумя факторами С (например, лейкоцитоспермией и повышенной вязкостью эякулята) [15]. Иными словами, можно говорить о возможности фактически бессимптомного течения MAGI. Несомненно, что достаточно часто такие латентные варианты течения диагностируются лишь в той ситуации, когда мужчина столкнется с репродуктивными проблемами.
Обсуждая хронический простатит и MAGI, мы сталкиваемся с терминологической коллизией, когда типовые патологические процессы (воспаление, расстройства кровообращения и др.), протекающие в ПЖ, семенных пузырьках и других органах мужской репродуктивной системы, рассматриваются с разных методологических позиций. Собственно, поэтому лейкоцитоспермия, оксидативный стресс, вискозипатия эякулята могут сопровождать хронический простатит, предопределяя его патогенетическую роль в развитии мужской инфертильности.
Лейкоцитоспермия
Лейкоциты составляют значительную долю клеток, обнаруживаемых в сперме и не имеющих непосредственного отношения к сперматогенезу как у фертильных, так и у бесплодных мужчин [17]. Половину из них составляют полиморфноядерные гранулоциты, источником происхождения которых являются ПЖ и семенные пузырьки [18, 19].Насколько влияет лейкоцитоспермия на ключевые параметры спермограммы у мужчин с хроническим бактериальным простатитом? Согласно общепринятому мнению, лейкоцитоспермия, определяемая как наличие более 1 млн лейкоцитов в 1 мл спермы, фактически является индикатором инфекции и воспаления в мужской репродуктивной системе. По мнению B. Bachir и соавт. [20], эта связь остается спорной, так как многочисленные исследования не обнаружили связи между лейкоцитоспермией и подтвержденной инфекцией. Одновременно с этим есть более веские доводы в пользу того, что наличие лейкоцитоспермии является отрицательным прогностическим фактором для фертильного потенциала мужчины [21]. Лейкоцитоспермия часто связана с ухудшением ключевых качественных и количественных параметров сперматозоидов, таких как морфология, подвижность и количество сперматозоидов [23]. Есть данные, что лейкоцитоспермия присутствует у 30% мужчин с бесплодием [24].
Лейкоциты участвуют в организации воспалительного ответа посредством синтеза цитокинов и других провоспалительных медиаторов: оксида азота, простагландинов и хемокинов [24, 25].
Одна из целей данного воспалительного ответа заключается в попытке элиминации патогенов. W. Eggert-Kruse и соавт. (2001 г.) изучали концентрации интерлейкинов – ИЛ-8 и ИЛ-6 в образцах семенной плазмы у 137 случайно отобранных субфертильных мужчин без клинических признаков инфекции репродуктивной системы. Было установлено, что концентрация ИЛ-8 была обратно пропорциональна общему количеству подвижных сперматозоидов. Кроме этого, обнаружена корреляция концентрации ИЛ-8 с количеством лейкоцитов в эякуляте (p<0,0001). Концентрация ИЛ-6 была намного ниже, но значительно коррелировала с ИЛ-8 (р<0,0001). Важно, что концентрации обоих ИЛ в семенной плазме коррелировали с концентрацией ключевого компонента системы комплемента С3, в то время как связи концентраций ИЛ с бактериальной колонизацией образцов спермы обнаружено не было [24]. В другом исследовании [25] при анализе образцов спермы мужчин, обратившихся в андрологическую клинику, было установлено, что количество лейкоцитов в сперме достоверно коррелировало с повышением уровня ИЛ-6, ИЛ-8 и фактора некроза опухоли α (ФНО-α). Примечательно, что одновременное присутствие бактериальных патогенов и лейкоцитов ассоциировалось с высокими уровнями ИЛ-8 и ФНО-α, тогда как ИЛ-6 в большей степени был ассоциирован с лейкоцитоспермией.
Другая цель воспалительного ответа, инициируемого лейкоцитами, – создание условий для апоптоза незрелых или аномальных сперматозоидов путем их фагоцитоза и образования активных форм кислорода (АФК) [17]. Иными словами, речь идет о развитии опосредованного лейкоцитоспермией оксидативного стресса, речь о котором пойдет ниже.
Существует и альтернативное мнение о влиянии лейкоцитов простатического происхождения на качество спермы. Напомним, что семяизвержение, как физиологический процесс, состоит из двух последовательных фаз. В фазу эмиссии вследствие реализации симпатических спинальных рефлексов возникают сокращения придатка яичка, семявыносящего протока, семенных пузырьков, ПЖ, шейки мочевого пузыря и все компоненты семенной жидкости попадают в заднюю часть мочеиспускательного канала. В фазу экспульсии происходят ритмичные сокращения мышц тазового дна и расслабление сфинктера уретры, вследствие чего семенная жидкость выводится наружу из мочеиспускательного канала [26]. Поэтому высказывается мнение, что сперматозоиды контактируют с лейкоцитами простатического происхождения лишь в течение короткого временного интервала, находясь под защитой антиоксидантных систем спермы [27].
Оксидативный стресс
Неудовлетворительное качество спермы у мужчин с лейкоцитоспермией может быть связано с развитием опосредованного лейкоцитами оксидативного стресса. Повышение концентрации лейкоцитов в семенной жидкости может привести к усиленной продукции АФК. Такая стимуляция может быть вызвана прямым межклеточным контактом или действием растворимых продуктов, выделяемыми лейкоцитами [28]. Известно, что минимальное количество АФК необходимо для обеспечения физиологической функции сперматозоидов, включая капацитацию, гиперактивацию и акросомальную реакцию. Активация лейкоцитов приводит к образованию в 1 тыс. раз большего количества АФК, чем количество, высвобождаемое сперматозоидами [29].АФК могут ухудшать подвижность сперматозоидов путем активации перекисного окисления липидов (ПОЛ) в их мембранах, изменяя целостность этих мембран и состав белков [30]. Более того, чем интенсивнее ПОЛ, тем больше накапливается альдегидов, являющихся вторичными продуктами ПОЛ. Альдегиды могут легко диффундировать через плазматическую мембрану и вызвать модифицикацию цитоплазматических и ядерных белков [31]. Описанные процессы приведут к дисфункции митохондрий и нарушениям энергетического метаболизма в сперматозоидах.
Вискозипатия
Существует мнение о существовании четкой патогенетической последовательности событий: инфекция, вызывая воспаление, приводит к развитию лейкоцитоспермии, которая, в свою очередь, вызывает дисфункцию добавочных мужских половых желез и вискозипатию эякулята [32, 33]. По мнению S. Du Plessis и соавт. [34], ключевыми факторами развития вискозипатии являются инфекция, оксидативный стресс, дисфункция добавочных мужских половых желез, лейкоцитоспермия и воспаление. Сегодня эта концепция в целом принимается в среде клиницистов, занимающихся проблемой мужской инфертильности, однако нельзя упомянуть и о противоречивости научных данных. Так, например, в исследовании M. Munuce и соавт. [35] не найдено связи между повышенной вязкостью спермы и положительными результатами микробного поиска, количеством обнаруженных видов микроорганизмов и их титром. Также не было обнаружено связи между лейкоцитоспермией, титром антиспермальных антител и наличием повышенной вязкости спермы. Авторы указывают, что повышенная вязкость не является очевидным признаком MAGI. В то же время в другом исследовании образцы спермы, в которых обнаружен рост бактериальной культуры, с большей вероятностью обладали повышенной вязкостью по сравнению с образцами с отрицательными результатами микробного поиска [36]. Очевидные причины этого – бактериальное воспаление, лейкоцитоспермия, накопление побочных продуктов метаболизма бактерий [34].Вискозипатия подавляет нормальное движение сперматозоидов по женскому репродуктивному тракту [37], вызывает астенозооспермию из-за развития биохимического дисбаланса семенной плазмы. Повышенная вязкость семенной жидкости требует большего количества энергии, необходимого сперматозоидам для прогрессивного движения [38]. В исследовании G. Gonzales и соавт. [37] в образцах спермы с повышенной вязкостью была снижена не только подвижность сперматозоидов, но и их жизнеспособность, а также концентрация фруктозы в семенной плазме.
Выводы
1. Лейкоцитоспермию, оксидативный стресс, вискозипатию эякулята, присущих хроническому воспалительному (инфекционно-воспалительному) процессу в ПЖ, очевидно, стоит расценивать в качестве патогенетических факторов мужского бесплодия.2. Одновременное существование понятия MAGI и термина «хронический простатит», под которым подразумевают целую группу болезней, отличающихся как по этиологии, так и патогенезу, затрудняет создание единых лечебно-диагностических подходов к мужчине с хроническим инфекционно-воспалительным процессом в репродуктивной системе и патоспермией.
3. Анамнестическое указание на наличие простатических симптомов в прошлом заставляет обсуждать целесообразность комплексного обследования мужчины c репродуктивными планами, в рамках которого спермограмма должна быть главной предпосылкой для поиска диагностических критериев и постановки диагноза MAGI. Вместе с тем отсутствие в анамнезе хронического простатита не исключает возможности наличия астено-, олиго- и/или тератозооспермии на фоне бессимптомного течения MAGI.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Сonflict of interests. The author declares that there is not conflict of interests.
Информация об авторе / Information about the author
Белый Лев Евгеньевич – д-р мед. наук, проф. каф. госпитальной хирургии, анестезиологии, реаниматологии, урологии, травматологии, ортопедии, ФГБОУ ВО УлГУ. E-mail: lbely@yandex.ru
Lev E. Belyi – D. Sci. (Med.), Prof., Ulyanovsk State University. E-mail: lbely@yandex.ru
Поступила в редакцию / Received: 10.03.2023
Поступила после рецензирования / Revised: 22.03.2023
Принята к публикации / Accepted: 06.04.2023
Список исп. литературыСкрыть список1. Cannarella R, Calogero AE. Male infertility: from etiology to management. Minerva Endocrinol (Torino) 2022; 47 (1): 1‒3.
2. Levine H, Jørgensen N, Martino-Andrade A et al. Temporal trends in sperm count: a systematic review and meta-regression analysis. Hum Reprod Update 2017; 23: 646–59.
3. Винник Ю.Ю., Борисов В.В. Мужское бессплодие: современное состояние проблемы. Клиническая лекция. Consilium Medicum. 2017; 19 (7): 65–9.
[Vinnik Yu.Yu., Borisov V.V. Muzhskoe bessplodie: sovremennoe sostoyanie problemy. Klinicheskaya lekciya. Consilium Medicum. 2017; 19 (7): 65–9. (in Russian).]
4. World Health Organization. WHO Manual for the Standardized Investigation and Diagnosis of the Infertile Couple. 2000, Cambridge University Press: Cambridge.
5. Коршунов М.Н. Инфекции и мужская фертильность. Бесплодный брак. Методическое пособие для акушеров-гинекологов, репродуктологов, урологов и врачей смежных специальностей. 2021. https://fertility-today.ru/metodicheskoe-posobie/Metod_A4_ Resolution.pdf
[Korshunov M.N. Infekcii i muzhskaya fertil'nost'. Besplodnyj brak. Metodicheskoe posobie dlya akusherov-ginekologov, reproduktologov, urologov i vrachej smezhnyh special'nostej. 2021. https://fertility-today.ru/metodicheskoe-posobie/Metod_A4_Resolution.pdf (in Russian).]
6. Khan FU, Ihsan AU, Khan HU et al. Comprehensive overview of prostatitis. Biomed Pharmacother. 2017; 94: 1064‒76.
7. Habermacher GM, Chason JT, Schaeffer AJ. Prostatitis/chronic pelvic pain syndrome. Annu Rev Med 2006; 57: 195–206.
8. Ejike CE, Ezeanyika LU. Prevalence of chronic prostatitis symptoms in a randomly surveyed adult population of urban-community-dwelling Nigerian males. Int J Urol 2008; 15 (4): 340–3.
9. Krieger JN, Nyberg LJr, Nickel JC. NIH consensus definition and classification of prostatitis. JAMA 1999; 282 (3): 236–7.
10. Hu XY, Xu YM, Qiao Y et al. Reduced semen quality in chronic prostatitis patients that induce the release of apoptotic protein Omi/HtrA2 from spermatozoa. Prostate Cancer Prostatic Dis 2007; 10 (1): 104–8.
11. Кузнецкий Ю.Я. Критический взгляд на проблему диагностики хронического простатита. Андрология и генитальная хирургия. 2005; 6 (2): 6–11.
[Kuzneckij Yu.Ya. Kriticheskij vzglyad na problemu diagnostiki hronicheskogo prostatita. Andrologiya i genital'naya hirurgiya. 2005; 6 (2): 6–11 (in Russian).]
12. Calogero AE, Duca Y, Condorelli RA et al. Male accessory gland inflammation, infertility, and sexual dysfunctions: a practical approach to diagnosis and therapy. Andrology 2017; 5 (6): 1064–72.
13. Litwin M, McNaughton-Collins M, Fowler FJ. The National Institutes of Health Chronic Prostatitis Symptom Index: development and validation of a new outcome measure. J Urol 1999; 162: 369–75.
14. La Vignera S, Condorelli R, Vicari E et al. High frequency of sexual dysfunction in patients with male accessory gland infections. Andrologia 2012; 44 (Suppl. 1): 438–46.
15. La Vignera S, Vicari E, Condorelli RA et al. Male accessory gland infection and sperm parameters (review). Int J Androl 2011; 34: 330–47.
16. Rowe PJ et al. WHO manual for the standardized investigation and diagnosis of the infertile couple. Press Syndicate of the University of Cambridge, Cambridge, 1993.
17. Henkel R, Offor U, Fisher D. The role of infections and leukocytes in male infertility. Andrologia 2021; 53: e13743.
18. Johanisson E, Campana A, Luthi R et al. Evaluation of ‘round cells’ in semen analysis: a comparative study. Hum Reprod Update 2000; 6: 404–12.
19. Wolff H. The biologic significance of white blood cells in semen. Fertil Steril 1995; 63: 1143–57.
20. Bachir BG, Jarvi K. Infectious, inflammatory, and immunologic conditions resulting in male infertility. Urol Clin North Am 2014; 41: 67–81.
21. Shy KK, Stenchever MA, Muller CH. Sperm penetration assay and subsequent pregnancy: a prospective study of 74 infertile men. Obstet Gynecol 1988; 71: 685–90.
22. Domes T, Lo KC, Grober ED et al. The incidence and effect of bacteriospermia and elevated seminal leukocytes on semen parameters. Fertil Steril 2012; 97: 1050–5.
23. Gambera L, Serafini F, Morgante G et al. Sperm quality and pregnancy rate after COX-2 inhibitor therapy of infertile males with abacterial leukocytospermia. Hum Reprod 2007; 22: 1047–51.
24. Eggert-Kruse W, Boit R, Rohr G et al. Relationship of seminal plasma interleukin (IL) -8 and IL-6 with semen quality. Hum Reprod 2001; 16 (3): 517‒28.
25. Martínez-Prado E, Camejo Bermúdez MI. Expression of IL-6, IL-8, TNF-alpha, IL-10, HSP-60, anti-HSP-60 antibodies, and anti-sperm antibodies, in semen of men with leukocytes and/or bacteria. Am J Reprod Immunol 2010; 63 (3): 233–43.
26. Ignjatović I. Fiziološki mehanizmi penilne erekcije i detumescencije. In: Bašić D, Hadži-Djokić J, Austoni E, editors. Muška seksualna funkcija i poremećaji. Niš: Medicinski fakultet Univerziteta u Nišu, 2012; p. 23–8.
27. Божедомов В.А., Семенов А.В., Конышев А.В. Репродуктивная функция мужчин при хроническом простатите: клинико-анамнестические и микробиологические аспекты. Урология 2015; 1: 70–8.
[Bozhedomov V.A., Semenov A.V., Konyshev A.V. Reproduktivnaya funkciya muzhchin pri hronicheskom prostatite: kliniko-anamnesticheskie i mikrobiologicheskie aspekty. Urologiya 2015; 1: 70–8 (in Russian).]
28. Saleh RA, Agarwal A, Kandirali E et al. Leukocytospermia is associated with increased reactive oxygen species production by human spermatozoa. Fertil Steril 2002; 78 (6): 1215–24.
29. Plante M, de Lamirande E, Gagnon C. Reactive oxygen species released by activated neutrophils, but not by deficient spermatozoa, are sufficient to affect normal sperm motility. Fertil Steril 1994; 62 (2): 387–93.
30. Aitken RJ, Buckingham DW, Brindle J et al. Analysis of sperm movement in relation to the oxidative stress created by leukocytes in washed sperm preparations and seminal plasma. Hum Reprod 1995; 10: 2061–71.
31. Negre-Salvayre A, Coatrieux C, Ingueneau C et al. Advanced lipid peroxidation end products in oxidative damage to proteins. Potential role in diseases and therapeutic prospects for the inhibitors. Br J Pharmacol 2008; 153: 6–20.
32. Elia J, Delfino M, Imbrogno N, et al. Human semen hyperviscosity: prevalence, pathogenesis and therapeutic aspects. Asian J Androl 2009; 11: 609–15.
33. Flint M, du Plessis SS, Menkveld R. Revisiting the assessment of semen viscosity and its relationship to leucocytospermia. Andrologia 2014; 46: 837–41.
34. Du Plessis SS, Gokul S, Agarwal A. Semen hyperviscosity: causes, consequences, and cures. Front Biosci (Elite Ed) 2013; 5 (1): 224–31.
35. Munuce MJ, Bregni C, Carizza C et al. Mendeluk: Semen culture, leukocytospermia, and the presence of sperm antibodies in seminal hyperviscosity. Arch Androl 1999; 42: 21–8.
36. Gopalkrishnan K, Hinduja IN, Latha P et al. Mehta: Role of microbial study in selection of subjects for in vitro fertilization & embryo transfer (IVF-ET). Indian J Med Res 1988; 88: 141–5
37. Gonzales GF, Kortebani G, Mazzolli AB. Hyperviscosity and hypofunction of the seminal vesicles. Arch Androl 1993; 30 (1): 63–8.
38. Emami N, Scorilas A, Soosaipillai A et al. Association between kallikrein-related peptidases (KLKs) and macroscopic indicators of semen analysis: their relation to sperm motility. Biol Chem 2009; 390 (9): 921–9.