Клинический разбор в общей медицине №5 2023
Omsk State Medical University, Omsk, Russia
dmitry_trukhan@mail.ru
Abstract
In 1984, Danish dermatologists described a skin eruption limited to the buttocks, with possible involvement of the intertriginous areas and flexion areas, and named this pattern the baboon syndrome. At the beginning of the 21st century, a new acronym SDRIFE (drug-associated symmetrical intertriginous and flexural exanthema) was proposed by Swiss dermatologists along with five characteristic diagnostic criteria. We searched the PubMed database for key terms: "baboon syndrome", "symmetrical drug-related intertriginous and flexural exanthema", "SDRIFE" from the time of the first publication (1984) to 04/30/2023. Found 120 descriptions of baboon syndrome or SDRIFE, which was slightly more common in men. An increase in the frequency of development with age was noted, 60% of cases were in patients older than 50 years. Geographically, more than half (52.4%) of cases are in Europe, predominantly in southern and western European countries, 20% in India and 16.2% in Asian countries. Attention is drawn to the variety of drugs that can cause the development of baboon/SDRIFE syndrome. Almost half – 59 cases (49.2%) of the 120 presented in the review are associated with antibiotics, 24 cases (20%) with antibiotics of the penicillin group. During the pandemic of a new coronavirus infection, SDRIFE cases have been described in patients with COVID-19 and after vaccination against COVID-19. The leading place in the diagnosis and treatment of SDRIFE belongs to the dermatologist. However, given the variety of culprit drugs, a doctor of any specialty can encounter SDRIFE in his practice.
Key words: baboon syndrome, drug-related symmetrical intertriginous and flexural exanthema, SDRIFE syndrome, drugs, culprit drugs, epidemiology.
For citation: Trukhan D.I. Baboon syndrome or symmetric intertriginal and flexible exanthemas associated with medicines. Review of clinical cases. Clinical review for general practice. 2023; 4 (5): 63–70 (In Russ.). DOI: 10.47407/kr2023.4.5.00236
Четыре десятилетия назад датские дерматологи [1] описали кожные высыпания, ограниченные ягодицами с возможным вовлечением интертригинозных зон и сгибательных областей. Этот паттерн был назван «синдром бабуина» (СБ) из-за характерных, ярко-красных, хорошо разграниченных высыпаний преимущественно на ягодицах и в области гениталий, напоминающих красные ягодицы самок бабуина. Авторы описали [1] три случая, спровоцированных ампициллином, никелем и ртутью. Они были убеждены, что СБ представляет собой особую форму гематогенного или системного дерматита контактного типа.
В начале ХХI в. швейцарскими дерматологами [2] была предложена новая аббревиатура SDRIFE (симметричная интертригинальная и изгибная экзантема, связанная с лекарственными средствами) вместе с пятью диагностическими критериями: 1) воздействие системно вводимого лекарственного средства либо в первой, либо в повторной дозе (исключая контактные аллергены); 2) резко отграниченная эритема ягодичной/перианальной области и/или V-образная эритема паховой/перигенитальной области; 3) вовлечение по меньшей мере еще одной интертригинальной/изгибной локализации; 4) симметричность пораженных участков; и 5) отсутствие системных симптомов и признаков.
Ряд авторов относят СБ к контактным дерматитам, при котором ранее происходит сенсибилизация кожи контактным аллергеном. А затем пациент подвергается воздействию того же аллергена или перекрестно реагирующей молекулы через системный путь. Системное воздействие аллергенов может включать чрескожные, трансмукозальные, пероральные, внутривенные, внутримышечные и ингаляционные пути [3]. SDRIFE возникает после системного воздействия препарата, в котором пациент ранее не был сенсибилизирован, либо при первом воздействии, либо после нескольких доз. Это бесконтактный аллергический вариант СБ [4, 5].
В настоящее время большинство авторов используют оба термина [6]. SDRIFE отличается от других кожных лекарственных реакций из-за его типичной морфологии, распределения и отсутствия системных результатов [7]. SDRIFE представляет собой доброкачественную и самоограничивающую реакцию гиперчувствительности IV типа, характеризующуюся симметричной эритемой с участием ягодичной и интертригинальной областей при отсутствии системного участия [8].
Диагностика SDRIFE зависит от распознавания клинической морфологии и распространения сыпи, а также ее временной связи с применением подозреваемого лекарственного препарата [8].
Дерматологи из Германии [9] отмечают, что SDRIFE характеризуется гистологически вакуолярным интерфейсным дерматитом, индуцированным цитотоксическими Т-лимфоцитами и нейтрофильными гранулоцитами. Эта картина может быть скрыта сопутствующими губчатыми, псориазообразными или пустулезными признаками в сочетании со смешанным поверхностным, а иногда и глубоким дермальным инфильтратом. Их американские коллеги в обзоре описали 19 соб-
ственных случаев и рассмотрели предыдущие сообщения о SDRIFE с гистопатологическими описаниями [10]. Они отметили, что наиболее распространенной гистопатологической находкой был поверхностный периваскулярный лимфоцитарный инфильтрат, за которым следовали дермальные эозинофилы, губкиоз и ортокератоз. Базальная вакуолизация и апоптотические кератиноциты были менее распространены. Интерстициальные гистиоциты присутствовали почти в половине наших случаев. Другие результаты включали атипичные лимфоциты и «фигуру пламени» [10].
Мы провели поиск в базе данных PubMed по ключевым терминам: «baboon syndrome», «symmetrical drug-related intertriginous and flexural exanthema», «SDRIFE» с момента первой публикации (1984 г.) по 30.04.2023.
К сожалению, не во всех случаях доступны полнотекстовые статьи, а представленные абстракты иногда не содержат указаний на пол и возраст пациента.
В первую очередь мы рассмотрели препараты-виновники (culprit drugs) и географию распространения SDRIFE.
Антибиотики и другие антибактериальные препараты. Ампициллин – первый лекарственный препарат, при использовании которого описано развитие СБ [1]. Безусловный «лидер» – антибиотик группы полусинтетических пенициллинов – амоксициллин. В обзоре швейцарских дерматологов 14 из 42 рассмотренных случаев были вызваны амоксициллином [2]. Турецкими дерматологами описаны 2 случая SDRIFE, в одном SDRIFE сочеталась с поражением слизистой полости рта [11], другой описан у мальчика 12 лет [12]. Опубликованы сообщения о развитии SDRIFE на фоне лечения амоксициллином у 30-летнего мужчины в Португалии [13] и у 50-летнего мужчины в Испании [14]. Амоксициллин-клавуланат был признан причиной SDRIFE в Турции у мужчины 65 лет [15] и мальчика 5 лет [16].
Антибиотик из группы пенициллинов в качестве препарата-кулприта у 45-летнего мужчины в Нидерландах [17], бензилпенициллин – у 40-летнего мужчины в Британии [18], феноксиметилпенициллин – у мужчины в Австрии [19], клоксациллин – у 45-летнего мужчины в Сингапуре [20]. В обзоре немецких ученых [21] упоминаются также ампициллин-сульбактам и пивампициллин.
Другие представители бета-лактамных антибиотиков, в частности цефалоспорины, реже были причиной развития SDRIFE. Нами найдено описание SDRIFE
у 64-летнего мужчины в Германии на фоне применения цефуроксима [22], в обзоре [21] указаны и другие цефалоспорины – цефиксим, цефтриаксон, цефалексин. Карбапенемы представлены одним описанием о развитии SDRIFE, индуцированной меропенемом, у женщины 36 лет в Испании [23].
Три случая развития SDRIFE описаны при использовании доксициклина во Франции [24], Англии (у женщины 51 года) [25] и Индии (у мужчины 38 лет) [26].
Кларитромицин был триггером SDRIFE у женщины 71 года в Румынии [27] и мужчины 43 лет в Португалии [28], отметились и другие макролиды: эритромицин у мальчика 1,5 года в Бельгии [29], пристинамицин во Франции [30], рокситромицин [21].
Среди других антибактериальных препаратов упоминались фторхинолоны: левофлоксацин (у женщины 50 лет из Тайваня) [31] и ципрофлоксацин (в Италии) [32], клиндамицин (у женщины 63 лет в Испании) [4], ванкомицин (у женщины 48 лет в Индии) [33], сульфаметаксазол/триметоприм (в Хорватии) [34], даптомицин [21].
Производные нитроимидазола были причиной развития SDRIFE в четырех случаях: секнидазол (во Франции) [30], метронидазол при приеме внутрь (у женщины 16 лет в Турции) [35], интравагинально (Япония) [36] и ректально (Китай) [37].
Противогрибковые препараты в качестве возможного триггера описаны в одном случае в Турции (кетокеназол у мужчины 27 лет) [38] и в Индии – флуканазол [39] и итраконазол (у женщины 43 лет) [40]. Дерматологи из Бхубанешвара (Индия) представили описание 12 случаев SDRIFE, связанной с итраконазолом [41], еще 1 случай описан дерматологами из Гувахати (Индия) [42]. В обзорах упомянуты также нистатин и тербинафин [21].
Анальгетики и нестероидные противовоспалительные препараты (НПВП). Парацетамол описан в качества вероятной причины SDRIFE в Японии [43], Италии [44], Хорватии (у мужчины 33 лет) [45], Турции (у женщины 60 лет при приеме комбинированного препарат парацетамол 500 мг / кодеин 30 мг) [46], а опиоидный анальгетик ремифентанил в Португалии [47]. Из группы НПВП «отметились» нефопам (во Франции) [30], мефенамовая кислота (в Австрии у женщины 37 лет) [48], целекоксиб в Южной Корее [49] и в Сингапуре (у женщины 61 года) [50], эторикоксиб в Испании [51]. В обзоре приведены и другие НПВП – ибупрофен, напроксен, пиритрамид, сальсалат, буфексамак [21].
Препараты, применяемые в неврологии и психиатрии. В качестве препарата-кулприта SDRIFE рассматривались лофлазепат (Япония) [52], клозапин
(1 случай в Индии) [53] и 2 случая в Британии (у мужчин 42 и 56 лет) [54], гидроксизин (в Тунисе у мужчины 60 лет) [55], ривастигмин (во Франции) [56], рисперидон в Турции (у мальчика 8 лет) [57].
Глюкортикостероиды (ГКС) и антигистаминные препараты. В качестве причины SDRIFE рассматриваются ГКС: мометазон фуроат, преднизолон, метилпреднизолон у женщины 50 лет (Германия) [58], бетаметазон у мужчины 58 лет (Франция) [59], дефлазакорт у мужчины 27 лет (Испания) [60] и антигистаминный препарат левоцетиризин у мужчины 30 лет (Индия) [61]. В обзорах упоминаются дексаметазон [21, 58] и гидрокортизон [21].
Биологические препараты, иммунодепрессанты и противоопухолевые препараты. Развитие SDRIFE отмечено при приеме голимумаба (Тайвань) [62], инфликсимаба у мужчины 50 лет (Турция) [63] и женщины 70 лет (Австралия) [64], эренумаба (женщина 48 лет, Германия) [65]. В качестве препарата-кулприта SDRIFE в литературе имеются указания на применение тамоксифена (женщина 44 лет, Иран) [66], 5-фторурацила (мужчина 56 лет, США) [67], ингибитора рецептора эпидермального фактора роста – EGFR (2 случая описаны в США) [68] и гефитиниба (женщина 72 лет, Канада) [69], энфортумаб ведотина (мужчина 64 лет, США) [70], бортезимиба (мужчина, Франция) [71], такролимуса (Бразилия) [72] и эверолимуса (США) [73]. В обзорах указаны применяемые в онкологии митомицин С, гидроксимочевина [58], брентуксимаб ведотин, цетуксимаб [21]. Швейцарские дерматологи [2] предлагают для описания кожных высыпаний, вызванных химиотерапией, термин «токсическая эритема химиотерапии». Эта группа токсических реакций характеризуется областями болезненной эритемы, часто сопровождающейся отеком, обычно затрагивающим руки и ноги, интертригинозные зоны (например, подмышечную впадину, пах) и реже локти, колени и уши [2].
Кардиологические и гастроэнтерологические препараты. В качестве триггера SDRIFE португальские дерматологи рассматривают комбинированный препарат телмисартан + гидрохлоротиазид (женщина 48 лет) [74], их болгарские коллеги – другой комбинированный препарат валсартан + гидрохлоротиазид (мужчина 57 лет) [75].
Препаратом-кулпритом SDRIFE может быть омепразол (Нидерланды, женщина 67 лет) [76], пантопразол (Индия) [77]. Итальянские дерматологи опубликовали 3 случая развития SDRIFE после применения ингибиторов протонной помпы [78], прием ранитидина был причиной развития SDRIFE в Индии (мальчик 8 лет) [79], комбинация ранитин + мозаприд под подозрением дерматологов Южной Кореи [80] у женщины 50 лет.
Противовирусные препараты. Развитие SDRIFE описано после применения валацикловира (у женщины 56 лет, Япония) [81], антиретровирусных постконтактных профилактических препаратов (тенофовир и эмтрицитабин) в Ирландии (мужчина 26 лет) [82], ремдесивира (мужчина 67 лет, Германия) [83] и фавипиравира (Турция, женщина 60 лет) [84].
Из других препаратов кулпритом SDRIFE являлись: золендроновая кислота – описано 2 случая в США у женщины 60 лет в Нью-Йорке [85] и женщины в Калифорнии [86], варениклин (мужчина 50 лет, Тайвань) [87], рентгеноконтрастные препараты – 1 случай в США [88] и 2 случая в Швейцарии (иомепрол, иопромид) [89], тиамина дисульфид (бистиамин) в Японии [90], этоноргестрел в Бельгии [91], противогеморроидальная мазь с аметокаином в Португалии [92]. В обзоре аллопуринол, амброксол, теразозин, псевдоэфедрин [21], 5-аминосалициловая кислота, аминофиллин, гепарин [58].
Не остались в стороне фитопрепараты. Описаны случаи SDRIFE после приема китайских травяных шариков (плющ) в Южной Корее (мужчина 67 лет) [80], капсул Xi-Huang (китайские травы) в Китае (мужчина 50 лет) [93], бусенника (Coix lacryma-jobi) в Южной Корее (женщина 53 лет) [94], берберина в США [95], мускусной антигеморроидальной мази в Тайване [96].
Таким образом, в приведенных источниках содержится описание 120 случаев синдрома бабуина, или SDRIFE (симметричной интертригинальной и изгибной экзантемы, связанной с лекарственными средствами).
Эпидемиология SDRIFE. Среди пациентов отмечено некоторое преобладание мужчин (56,1%). В педиатрической практике отмечено 5 случаев SDRIFE среди мальчиков (1,5 года, 5 лет, 8 лет, 8 лет, 12 лет) и 1 случай развития SDRIFE у девушки 16 лет. Соответственно во взрослом возрасте различия по полу были еще менее выражены (52,9% мужчины). Женщины были ненамного старше мужчин (средний возраст 52,8% против 48,3% у мужчин).
Отмечено увеличение частоты СБ/SDRIFE с возрастом: 8% – до 30 лет, 12% – в возрасте 30–40 лет, 20% – 40–50 лет, 26% – 50–60 лет, 34% – у пациентов старше 60 лет.
Географически более половины (52,4%) случаев зарегистрированы в Европе, 16,2% – в Азии (преимущественно Восточной), 20% – в Индии, 9,5% – в США и Канаде, лишь по 1 случаю описано в Латинской Америке, Австралии и Африке (Тунис). Европейские случаи распределились неравномерно: почти половина случаев зарегистрированы в Южной Европе (49,1%), несколько меньше в Западной Европе (36,4%), в Северной Европе (10,9%) и очень редко в Восточной Европе (3,6%). Датские дерматологи первые описали СБ [1], но затем в течение почти 40 лет публикаций о СБ/SDRIFE из скандинавских стран не найдено, все остальные публикации из региона Северной Европы относятся к Великобритании и Ирландии.
Этиология SDRIFE. Обращает на себя внимание многообразие лекарственных препаратов, которые могут быть причиной развития СБ/SDRIFE. Почти половина – 59 (49,2%) случаев из 120 представленных в обзоре, связаны с антибиотиками, 24 (20%) случая с антибиотиками группы пенициллина.
Временной промежуток до появления высыпаний на коже в большинстве случае составлял от нескольких часов до нескольких дней. Однако в редких случаях пациенты принимали препарат-кулприт длительно: 8 лет приема тамоксифена [66] и 6 лет приема комбинации валсартан + гидрохлоротиазид [75].
Новая коронавирусная инфекция (COVID-19) и SDRIFE. Для клинической картины COVID-19 характерно многообразие дерматозов и кожных сыпей. Среди них имеются описания SDRIFE, однако четко не выявлено, связано ли развитие SDRIFE непосредственно с инфекцией COVID-19 или с препаратами, используемыми для лечения инфекции [97].
Нами найдены 7 клинических случаев развития SDRIFE при подтвержденной инфекции COVID-19:
2 случая в Испании – у женщины 29 лет [98] и женщины 73 лет [99], 2 случая в Бразилии – у женщины 53 лет [100] и женщины 71 года [101], в Турции (у женщины 60 лет) [84], во Франции (у женщины 64 лет) [97], и в Германии (у мужчины 67 лет) [83]. В двух случаях авторами высказано предположение препарата-кулприта – под подозрение попали ремдесивир [83] и фавипиравир [84]. В остальных случаях большое количество назначенных препаратов не позволило авторам определиться с препаратом-кулпритом.
В литературе описано развитие SDRIFE после вакцинации от COVID-19 [102]. Нами найдено описание 11 случаев. Два случая зарегистрированы в Турции после введения вакцины Pfizer-BioNTech – через день после введения 1-й дозы у мужчины 25 лет и через 2 дня после введения 2-й дозы у женщины 51 года [84]. После вакцинации 3-й дозы вакциной Pfizer через 2 дня развитие SDRIFE отмечено у 59-летнего мужчины в Израиле [103], в Тунисе через 5 дней после второй инъекции вакцины Pfizer-BioNTech Comirnaty – у женщины 52 лет [104]. В США описаны 2 случая развития SDRIFE после вакцинации второй дозой Pfizer-BioNTech [105] у мужчины 23 лет и женщины 38 лет.
В Южной Корее у 53-летнего мужчины развитие SDRIFE [106] зарегистрировано через 10 дней после введения второй дозы ChAdOx1 nCoV-19 (AstraZeneca -Oxford). В Шотландии SDRIFE развился на следующий день после первой дозы ChAdOx1 nCoV-19 (AstraZeneca-Oxford) у 61 летнего мужчины [107], в Италии – через
5 дней после введения второй дозы Vaxzevria (ChAdOx1 nCoV-19; Oxford-AstraZeneca) у женщины 67 лет [108].
В двух случаях причиной развития SDRIFE авторы рассматривают вакцину CoronaVac биотехнологической корпорации SinoVac: через 4 дня после 1-й дозы у мужчины 87 лет в Турции [109], в Тунисе через 3 дня после 2-й инъекции у 57-летней женщины [104].
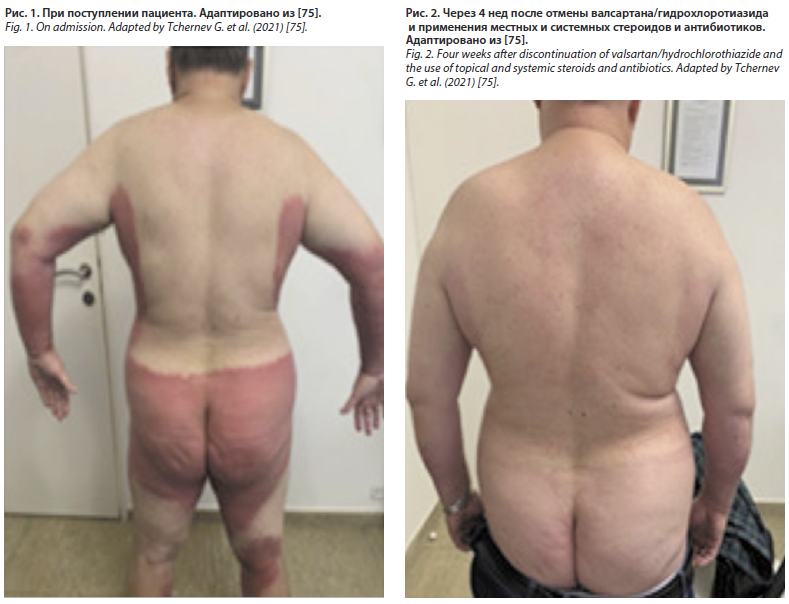
Побудительным мотивом написания данного обзора явилось знакомство с описанием клинического случая болгарскими дерматологами о развитии СБ/SDRIFE у пациента, получавшего терапию комбинацией валсартан + гидрохлоротиазид [75], в рамках поиска информации о побочных эффектах диуретиков, применяемых для лечения артериальной гипертензии. По данным двух фармакоэпидемиологических исследований, выполненных с использованием данных Датского национального регистра рака [110, 111], была продемонстрирована связь между приемом гидрохлоротиазида и повышенным риском развития немеланомного рака кожи (НМРК) – базально-клеточной карциномы и плоскоклеточного рака кожи. В последующем эти данные нашли подтверждения и в работах, опубликованных позже в разных странах [112–120]. Поэтому описание необычной кожной реакции вызвало интерес. Авторами приведены фото пациента, демонстрирующие необычность проявлений кожных высыпаний [75]. Приведем только адаптированный фрагмент из публикации. На рис. 1 – картина при поступлении пациента, на рис. 2 – через 4 нед после отмены валсартана/гидрохлоротиазида и применения местных и системных стероидов и антибиотиков.
Диагностика SDRIFE зависит от распознавания клинической морфологии, распространения локализации высыпаний, отсутствия системных проявлений, а также ее временной связи с применением препарата-кулприта.
Ведущее место в диагностике и лечении SDRIFE принадлежит дерматологу. Важно отметить, что после отмены препарата-кулприта и назначения местных и системных глюкокортикоидов отмечается исчезновение кожных высыпаний в течение нескольких недель.
С учетом многообразия препаратов-кулпритов с СБ/SDRIFE может столкнуться в своей практике врач любой специальности и знакомство с этим необычным проявлением лекарственной болезни представляется важным.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
Информация об авторе
Трухан Дмитрий Иванович – д-р мед. наук, доц., проф. каф. поликлинической терапии и внутренних болезней,
ФГБОУ ВО ОмГМУ. E-mail: dmitry_trukhan@mail.ru; ORCID: 0000-0002-1597-1876
Dmitry I. Trukhan – Dr. Sci. (Med.), Prof., Omsk State Medical University. E-mail: dmitry_trukhan@mail.ru;
ORCID: 0000-0002-1597-1876
Поступила в редакцию: 27.05.2023
Поступила после рецензирования: 08.06.2023
Принята к публикации: 15.06.2023
Received: 27.05.2023
Revised: 08.06.2023
Accepted: 15.06.2023
Клинический разбор в общей медицине №5 2023
Синдром бабуина или симметричная интертригинальная и изгибная экзантема, связанная с лекарственными средствами. Обзор клинических случаев
Номера страниц в выпуске:63-70
Аннотация
В 1984 г. датские дерматологи описали кожные высыпания, ограниченные ягодицами с возможным вовлечением интертригинозных зон и сгибательных областей, и назвали этот паттерн «синдром бабуина». В начале ХХI в. швейцарскими дерматологами была предложена новая аббревиатура SDRIFE (симметричная интертригинальная и изгибная экзантема, связанная с лекарственными средствами) вместе с пятью характерными диагностическими критериями. Мы провели поиск в базе данных PubMed по ключевым терминам: «baboon syndrome», «symmetrical drug-related intertriginous and flexural exanthema», «SDRIFE» с момента первой публикации (1984 г.) по 30.04.2023. Найдено 120 описаний синдрома бабуина или SDRIFE, который несколько чаще встречался у мужчин. Отмечено увеличение частоты развития с возрастом, 60% случаев приходилось на пациентов старше 50 лет. Географически более половины (52,4%) случаев зарегистрированы в Европе, преимущественно в южноевропейских и западноевропейских странах, 20% – в Индии и 16,2% – в азиатских странах. Обращает на себя внимание многообразие лекарственных препаратов, которые могут быть причиной развития синдрома бабуина/SDRIFE. Почти половина – 59 (49,2%) случаев из 120 представленных в обзоре, связаны с антибиотиками, 24 (20%) случая – с антибиотиками группы пенициллина. В период пандемии новой коронавирусной инфекции были описаны случаи развития SDRIFE у больных COVID-19 и после вакцинации от COVID-19. Ведущее место в диагностике и лечении SDRIFE принадлежит дерматологу. Однако с учетом многообразия препаратов-виновников с SDRIFE может столкнуться в своей практике врач любой специальности.
Ключевые слова: синдром бабуина, симметричная интертригинальная и изгибная экзантема, связанная с лекарственными средствами, синдром SDRIFE, лекарственные препараты, препараты-виновники, эпидемиология.
Для цитирования: Трухан Д.И. Синдром бабуина или симметричная интертригинальная и изгибная экзантема, связанная с лекарственными средствами. Обзор клинических случаев. Клинический разбор в общей медицине. 2023; 4 (5): 63–70. DOI: 10.47407/kr2023.4.5.00236
В 1984 г. датские дерматологи описали кожные высыпания, ограниченные ягодицами с возможным вовлечением интертригинозных зон и сгибательных областей, и назвали этот паттерн «синдром бабуина». В начале ХХI в. швейцарскими дерматологами была предложена новая аббревиатура SDRIFE (симметричная интертригинальная и изгибная экзантема, связанная с лекарственными средствами) вместе с пятью характерными диагностическими критериями. Мы провели поиск в базе данных PubMed по ключевым терминам: «baboon syndrome», «symmetrical drug-related intertriginous and flexural exanthema», «SDRIFE» с момента первой публикации (1984 г.) по 30.04.2023. Найдено 120 описаний синдрома бабуина или SDRIFE, который несколько чаще встречался у мужчин. Отмечено увеличение частоты развития с возрастом, 60% случаев приходилось на пациентов старше 50 лет. Географически более половины (52,4%) случаев зарегистрированы в Европе, преимущественно в южноевропейских и западноевропейских странах, 20% – в Индии и 16,2% – в азиатских странах. Обращает на себя внимание многообразие лекарственных препаратов, которые могут быть причиной развития синдрома бабуина/SDRIFE. Почти половина – 59 (49,2%) случаев из 120 представленных в обзоре, связаны с антибиотиками, 24 (20%) случая – с антибиотиками группы пенициллина. В период пандемии новой коронавирусной инфекции были описаны случаи развития SDRIFE у больных COVID-19 и после вакцинации от COVID-19. Ведущее место в диагностике и лечении SDRIFE принадлежит дерматологу. Однако с учетом многообразия препаратов-виновников с SDRIFE может столкнуться в своей практике врач любой специальности.
Ключевые слова: синдром бабуина, симметричная интертригинальная и изгибная экзантема, связанная с лекарственными средствами, синдром SDRIFE, лекарственные препараты, препараты-виновники, эпидемиология.
Для цитирования: Трухан Д.И. Синдром бабуина или симметричная интертригинальная и изгибная экзантема, связанная с лекарственными средствами. Обзор клинических случаев. Клинический разбор в общей медицине. 2023; 4 (5): 63–70. DOI: 10.47407/kr2023.4.5.00236
Baboon syndrome or symmetric intertriginal and flexible exanthemas associated with medicines. Review of clinical cases
Dmitry I. TrukhanOmsk State Medical University, Omsk, Russia
dmitry_trukhan@mail.ru
Abstract
In 1984, Danish dermatologists described a skin eruption limited to the buttocks, with possible involvement of the intertriginous areas and flexion areas, and named this pattern the baboon syndrome. At the beginning of the 21st century, a new acronym SDRIFE (drug-associated symmetrical intertriginous and flexural exanthema) was proposed by Swiss dermatologists along with five characteristic diagnostic criteria. We searched the PubMed database for key terms: "baboon syndrome", "symmetrical drug-related intertriginous and flexural exanthema", "SDRIFE" from the time of the first publication (1984) to 04/30/2023. Found 120 descriptions of baboon syndrome or SDRIFE, which was slightly more common in men. An increase in the frequency of development with age was noted, 60% of cases were in patients older than 50 years. Geographically, more than half (52.4%) of cases are in Europe, predominantly in southern and western European countries, 20% in India and 16.2% in Asian countries. Attention is drawn to the variety of drugs that can cause the development of baboon/SDRIFE syndrome. Almost half – 59 cases (49.2%) of the 120 presented in the review are associated with antibiotics, 24 cases (20%) with antibiotics of the penicillin group. During the pandemic of a new coronavirus infection, SDRIFE cases have been described in patients with COVID-19 and after vaccination against COVID-19. The leading place in the diagnosis and treatment of SDRIFE belongs to the dermatologist. However, given the variety of culprit drugs, a doctor of any specialty can encounter SDRIFE in his practice.
Key words: baboon syndrome, drug-related symmetrical intertriginous and flexural exanthema, SDRIFE syndrome, drugs, culprit drugs, epidemiology.
For citation: Trukhan D.I. Baboon syndrome or symmetric intertriginal and flexible exanthemas associated with medicines. Review of clinical cases. Clinical review for general practice. 2023; 4 (5): 63–70 (In Russ.). DOI: 10.47407/kr2023.4.5.00236
Четыре десятилетия назад датские дерматологи [1] описали кожные высыпания, ограниченные ягодицами с возможным вовлечением интертригинозных зон и сгибательных областей. Этот паттерн был назван «синдром бабуина» (СБ) из-за характерных, ярко-красных, хорошо разграниченных высыпаний преимущественно на ягодицах и в области гениталий, напоминающих красные ягодицы самок бабуина. Авторы описали [1] три случая, спровоцированных ампициллином, никелем и ртутью. Они были убеждены, что СБ представляет собой особую форму гематогенного или системного дерматита контактного типа.
В начале ХХI в. швейцарскими дерматологами [2] была предложена новая аббревиатура SDRIFE (симметричная интертригинальная и изгибная экзантема, связанная с лекарственными средствами) вместе с пятью диагностическими критериями: 1) воздействие системно вводимого лекарственного средства либо в первой, либо в повторной дозе (исключая контактные аллергены); 2) резко отграниченная эритема ягодичной/перианальной области и/или V-образная эритема паховой/перигенитальной области; 3) вовлечение по меньшей мере еще одной интертригинальной/изгибной локализации; 4) симметричность пораженных участков; и 5) отсутствие системных симптомов и признаков.
Ряд авторов относят СБ к контактным дерматитам, при котором ранее происходит сенсибилизация кожи контактным аллергеном. А затем пациент подвергается воздействию того же аллергена или перекрестно реагирующей молекулы через системный путь. Системное воздействие аллергенов может включать чрескожные, трансмукозальные, пероральные, внутривенные, внутримышечные и ингаляционные пути [3]. SDRIFE возникает после системного воздействия препарата, в котором пациент ранее не был сенсибилизирован, либо при первом воздействии, либо после нескольких доз. Это бесконтактный аллергический вариант СБ [4, 5].
В настоящее время большинство авторов используют оба термина [6]. SDRIFE отличается от других кожных лекарственных реакций из-за его типичной морфологии, распределения и отсутствия системных результатов [7]. SDRIFE представляет собой доброкачественную и самоограничивающую реакцию гиперчувствительности IV типа, характеризующуюся симметричной эритемой с участием ягодичной и интертригинальной областей при отсутствии системного участия [8].
Диагностика SDRIFE зависит от распознавания клинической морфологии и распространения сыпи, а также ее временной связи с применением подозреваемого лекарственного препарата [8].
Дерматологи из Германии [9] отмечают, что SDRIFE характеризуется гистологически вакуолярным интерфейсным дерматитом, индуцированным цитотоксическими Т-лимфоцитами и нейтрофильными гранулоцитами. Эта картина может быть скрыта сопутствующими губчатыми, псориазообразными или пустулезными признаками в сочетании со смешанным поверхностным, а иногда и глубоким дермальным инфильтратом. Их американские коллеги в обзоре описали 19 соб-
ственных случаев и рассмотрели предыдущие сообщения о SDRIFE с гистопатологическими описаниями [10]. Они отметили, что наиболее распространенной гистопатологической находкой был поверхностный периваскулярный лимфоцитарный инфильтрат, за которым следовали дермальные эозинофилы, губкиоз и ортокератоз. Базальная вакуолизация и апоптотические кератиноциты были менее распространены. Интерстициальные гистиоциты присутствовали почти в половине наших случаев. Другие результаты включали атипичные лимфоциты и «фигуру пламени» [10].
Мы провели поиск в базе данных PubMed по ключевым терминам: «baboon syndrome», «symmetrical drug-related intertriginous and flexural exanthema», «SDRIFE» с момента первой публикации (1984 г.) по 30.04.2023.
К сожалению, не во всех случаях доступны полнотекстовые статьи, а представленные абстракты иногда не содержат указаний на пол и возраст пациента.
В первую очередь мы рассмотрели препараты-виновники (culprit drugs) и географию распространения SDRIFE.
Антибиотики и другие антибактериальные препараты. Ампициллин – первый лекарственный препарат, при использовании которого описано развитие СБ [1]. Безусловный «лидер» – антибиотик группы полусинтетических пенициллинов – амоксициллин. В обзоре швейцарских дерматологов 14 из 42 рассмотренных случаев были вызваны амоксициллином [2]. Турецкими дерматологами описаны 2 случая SDRIFE, в одном SDRIFE сочеталась с поражением слизистой полости рта [11], другой описан у мальчика 12 лет [12]. Опубликованы сообщения о развитии SDRIFE на фоне лечения амоксициллином у 30-летнего мужчины в Португалии [13] и у 50-летнего мужчины в Испании [14]. Амоксициллин-клавуланат был признан причиной SDRIFE в Турции у мужчины 65 лет [15] и мальчика 5 лет [16].
Антибиотик из группы пенициллинов в качестве препарата-кулприта у 45-летнего мужчины в Нидерландах [17], бензилпенициллин – у 40-летнего мужчины в Британии [18], феноксиметилпенициллин – у мужчины в Австрии [19], клоксациллин – у 45-летнего мужчины в Сингапуре [20]. В обзоре немецких ученых [21] упоминаются также ампициллин-сульбактам и пивампициллин.
Другие представители бета-лактамных антибиотиков, в частности цефалоспорины, реже были причиной развития SDRIFE. Нами найдено описание SDRIFE
у 64-летнего мужчины в Германии на фоне применения цефуроксима [22], в обзоре [21] указаны и другие цефалоспорины – цефиксим, цефтриаксон, цефалексин. Карбапенемы представлены одним описанием о развитии SDRIFE, индуцированной меропенемом, у женщины 36 лет в Испании [23].
Три случая развития SDRIFE описаны при использовании доксициклина во Франции [24], Англии (у женщины 51 года) [25] и Индии (у мужчины 38 лет) [26].
Кларитромицин был триггером SDRIFE у женщины 71 года в Румынии [27] и мужчины 43 лет в Португалии [28], отметились и другие макролиды: эритромицин у мальчика 1,5 года в Бельгии [29], пристинамицин во Франции [30], рокситромицин [21].
Среди других антибактериальных препаратов упоминались фторхинолоны: левофлоксацин (у женщины 50 лет из Тайваня) [31] и ципрофлоксацин (в Италии) [32], клиндамицин (у женщины 63 лет в Испании) [4], ванкомицин (у женщины 48 лет в Индии) [33], сульфаметаксазол/триметоприм (в Хорватии) [34], даптомицин [21].
Производные нитроимидазола были причиной развития SDRIFE в четырех случаях: секнидазол (во Франции) [30], метронидазол при приеме внутрь (у женщины 16 лет в Турции) [35], интравагинально (Япония) [36] и ректально (Китай) [37].
Противогрибковые препараты в качестве возможного триггера описаны в одном случае в Турции (кетокеназол у мужчины 27 лет) [38] и в Индии – флуканазол [39] и итраконазол (у женщины 43 лет) [40]. Дерматологи из Бхубанешвара (Индия) представили описание 12 случаев SDRIFE, связанной с итраконазолом [41], еще 1 случай описан дерматологами из Гувахати (Индия) [42]. В обзорах упомянуты также нистатин и тербинафин [21].
Анальгетики и нестероидные противовоспалительные препараты (НПВП). Парацетамол описан в качества вероятной причины SDRIFE в Японии [43], Италии [44], Хорватии (у мужчины 33 лет) [45], Турции (у женщины 60 лет при приеме комбинированного препарат парацетамол 500 мг / кодеин 30 мг) [46], а опиоидный анальгетик ремифентанил в Португалии [47]. Из группы НПВП «отметились» нефопам (во Франции) [30], мефенамовая кислота (в Австрии у женщины 37 лет) [48], целекоксиб в Южной Корее [49] и в Сингапуре (у женщины 61 года) [50], эторикоксиб в Испании [51]. В обзоре приведены и другие НПВП – ибупрофен, напроксен, пиритрамид, сальсалат, буфексамак [21].
Препараты, применяемые в неврологии и психиатрии. В качестве препарата-кулприта SDRIFE рассматривались лофлазепат (Япония) [52], клозапин
(1 случай в Индии) [53] и 2 случая в Британии (у мужчин 42 и 56 лет) [54], гидроксизин (в Тунисе у мужчины 60 лет) [55], ривастигмин (во Франции) [56], рисперидон в Турции (у мальчика 8 лет) [57].
Глюкортикостероиды (ГКС) и антигистаминные препараты. В качестве причины SDRIFE рассматриваются ГКС: мометазон фуроат, преднизолон, метилпреднизолон у женщины 50 лет (Германия) [58], бетаметазон у мужчины 58 лет (Франция) [59], дефлазакорт у мужчины 27 лет (Испания) [60] и антигистаминный препарат левоцетиризин у мужчины 30 лет (Индия) [61]. В обзорах упоминаются дексаметазон [21, 58] и гидрокортизон [21].
Биологические препараты, иммунодепрессанты и противоопухолевые препараты. Развитие SDRIFE отмечено при приеме голимумаба (Тайвань) [62], инфликсимаба у мужчины 50 лет (Турция) [63] и женщины 70 лет (Австралия) [64], эренумаба (женщина 48 лет, Германия) [65]. В качестве препарата-кулприта SDRIFE в литературе имеются указания на применение тамоксифена (женщина 44 лет, Иран) [66], 5-фторурацила (мужчина 56 лет, США) [67], ингибитора рецептора эпидермального фактора роста – EGFR (2 случая описаны в США) [68] и гефитиниба (женщина 72 лет, Канада) [69], энфортумаб ведотина (мужчина 64 лет, США) [70], бортезимиба (мужчина, Франция) [71], такролимуса (Бразилия) [72] и эверолимуса (США) [73]. В обзорах указаны применяемые в онкологии митомицин С, гидроксимочевина [58], брентуксимаб ведотин, цетуксимаб [21]. Швейцарские дерматологи [2] предлагают для описания кожных высыпаний, вызванных химиотерапией, термин «токсическая эритема химиотерапии». Эта группа токсических реакций характеризуется областями болезненной эритемы, часто сопровождающейся отеком, обычно затрагивающим руки и ноги, интертригинозные зоны (например, подмышечную впадину, пах) и реже локти, колени и уши [2].
Кардиологические и гастроэнтерологические препараты. В качестве триггера SDRIFE португальские дерматологи рассматривают комбинированный препарат телмисартан + гидрохлоротиазид (женщина 48 лет) [74], их болгарские коллеги – другой комбинированный препарат валсартан + гидрохлоротиазид (мужчина 57 лет) [75].
Препаратом-кулпритом SDRIFE может быть омепразол (Нидерланды, женщина 67 лет) [76], пантопразол (Индия) [77]. Итальянские дерматологи опубликовали 3 случая развития SDRIFE после применения ингибиторов протонной помпы [78], прием ранитидина был причиной развития SDRIFE в Индии (мальчик 8 лет) [79], комбинация ранитин + мозаприд под подозрением дерматологов Южной Кореи [80] у женщины 50 лет.
Противовирусные препараты. Развитие SDRIFE описано после применения валацикловира (у женщины 56 лет, Япония) [81], антиретровирусных постконтактных профилактических препаратов (тенофовир и эмтрицитабин) в Ирландии (мужчина 26 лет) [82], ремдесивира (мужчина 67 лет, Германия) [83] и фавипиравира (Турция, женщина 60 лет) [84].
Из других препаратов кулпритом SDRIFE являлись: золендроновая кислота – описано 2 случая в США у женщины 60 лет в Нью-Йорке [85] и женщины в Калифорнии [86], варениклин (мужчина 50 лет, Тайвань) [87], рентгеноконтрастные препараты – 1 случай в США [88] и 2 случая в Швейцарии (иомепрол, иопромид) [89], тиамина дисульфид (бистиамин) в Японии [90], этоноргестрел в Бельгии [91], противогеморроидальная мазь с аметокаином в Португалии [92]. В обзоре аллопуринол, амброксол, теразозин, псевдоэфедрин [21], 5-аминосалициловая кислота, аминофиллин, гепарин [58].
Не остались в стороне фитопрепараты. Описаны случаи SDRIFE после приема китайских травяных шариков (плющ) в Южной Корее (мужчина 67 лет) [80], капсул Xi-Huang (китайские травы) в Китае (мужчина 50 лет) [93], бусенника (Coix lacryma-jobi) в Южной Корее (женщина 53 лет) [94], берберина в США [95], мускусной антигеморроидальной мази в Тайване [96].
Таким образом, в приведенных источниках содержится описание 120 случаев синдрома бабуина, или SDRIFE (симметричной интертригинальной и изгибной экзантемы, связанной с лекарственными средствами).
Эпидемиология SDRIFE. Среди пациентов отмечено некоторое преобладание мужчин (56,1%). В педиатрической практике отмечено 5 случаев SDRIFE среди мальчиков (1,5 года, 5 лет, 8 лет, 8 лет, 12 лет) и 1 случай развития SDRIFE у девушки 16 лет. Соответственно во взрослом возрасте различия по полу были еще менее выражены (52,9% мужчины). Женщины были ненамного старше мужчин (средний возраст 52,8% против 48,3% у мужчин).
Отмечено увеличение частоты СБ/SDRIFE с возрастом: 8% – до 30 лет, 12% – в возрасте 30–40 лет, 20% – 40–50 лет, 26% – 50–60 лет, 34% – у пациентов старше 60 лет.
Географически более половины (52,4%) случаев зарегистрированы в Европе, 16,2% – в Азии (преимущественно Восточной), 20% – в Индии, 9,5% – в США и Канаде, лишь по 1 случаю описано в Латинской Америке, Австралии и Африке (Тунис). Европейские случаи распределились неравномерно: почти половина случаев зарегистрированы в Южной Европе (49,1%), несколько меньше в Западной Европе (36,4%), в Северной Европе (10,9%) и очень редко в Восточной Европе (3,6%). Датские дерматологи первые описали СБ [1], но затем в течение почти 40 лет публикаций о СБ/SDRIFE из скандинавских стран не найдено, все остальные публикации из региона Северной Европы относятся к Великобритании и Ирландии.
Этиология SDRIFE. Обращает на себя внимание многообразие лекарственных препаратов, которые могут быть причиной развития СБ/SDRIFE. Почти половина – 59 (49,2%) случаев из 120 представленных в обзоре, связаны с антибиотиками, 24 (20%) случая с антибиотиками группы пенициллина.
Временной промежуток до появления высыпаний на коже в большинстве случае составлял от нескольких часов до нескольких дней. Однако в редких случаях пациенты принимали препарат-кулприт длительно: 8 лет приема тамоксифена [66] и 6 лет приема комбинации валсартан + гидрохлоротиазид [75].
Новая коронавирусная инфекция (COVID-19) и SDRIFE. Для клинической картины COVID-19 характерно многообразие дерматозов и кожных сыпей. Среди них имеются описания SDRIFE, однако четко не выявлено, связано ли развитие SDRIFE непосредственно с инфекцией COVID-19 или с препаратами, используемыми для лечения инфекции [97].
Нами найдены 7 клинических случаев развития SDRIFE при подтвержденной инфекции COVID-19:
2 случая в Испании – у женщины 29 лет [98] и женщины 73 лет [99], 2 случая в Бразилии – у женщины 53 лет [100] и женщины 71 года [101], в Турции (у женщины 60 лет) [84], во Франции (у женщины 64 лет) [97], и в Германии (у мужчины 67 лет) [83]. В двух случаях авторами высказано предположение препарата-кулприта – под подозрение попали ремдесивир [83] и фавипиравир [84]. В остальных случаях большое количество назначенных препаратов не позволило авторам определиться с препаратом-кулпритом.
В литературе описано развитие SDRIFE после вакцинации от COVID-19 [102]. Нами найдено описание 11 случаев. Два случая зарегистрированы в Турции после введения вакцины Pfizer-BioNTech – через день после введения 1-й дозы у мужчины 25 лет и через 2 дня после введения 2-й дозы у женщины 51 года [84]. После вакцинации 3-й дозы вакциной Pfizer через 2 дня развитие SDRIFE отмечено у 59-летнего мужчины в Израиле [103], в Тунисе через 5 дней после второй инъекции вакцины Pfizer-BioNTech Comirnaty – у женщины 52 лет [104]. В США описаны 2 случая развития SDRIFE после вакцинации второй дозой Pfizer-BioNTech [105] у мужчины 23 лет и женщины 38 лет.
В Южной Корее у 53-летнего мужчины развитие SDRIFE [106] зарегистрировано через 10 дней после введения второй дозы ChAdOx1 nCoV-19 (AstraZeneca -Oxford). В Шотландии SDRIFE развился на следующий день после первой дозы ChAdOx1 nCoV-19 (AstraZeneca-Oxford) у 61 летнего мужчины [107], в Италии – через
5 дней после введения второй дозы Vaxzevria (ChAdOx1 nCoV-19; Oxford-AstraZeneca) у женщины 67 лет [108].
В двух случаях причиной развития SDRIFE авторы рассматривают вакцину CoronaVac биотехнологической корпорации SinoVac: через 4 дня после 1-й дозы у мужчины 87 лет в Турции [109], в Тунисе через 3 дня после 2-й инъекции у 57-летней женщины [104].
Побудительным мотивом написания данного обзора явилось знакомство с описанием клинического случая болгарскими дерматологами о развитии СБ/SDRIFE у пациента, получавшего терапию комбинацией валсартан + гидрохлоротиазид [75], в рамках поиска информации о побочных эффектах диуретиков, применяемых для лечения артериальной гипертензии. По данным двух фармакоэпидемиологических исследований, выполненных с использованием данных Датского национального регистра рака [110, 111], была продемонстрирована связь между приемом гидрохлоротиазида и повышенным риском развития немеланомного рака кожи (НМРК) – базально-клеточной карциномы и плоскоклеточного рака кожи. В последующем эти данные нашли подтверждения и в работах, опубликованных позже в разных странах [112–120]. Поэтому описание необычной кожной реакции вызвало интерес. Авторами приведены фото пациента, демонстрирующие необычность проявлений кожных высыпаний [75]. Приведем только адаптированный фрагмент из публикации. На рис. 1 – картина при поступлении пациента, на рис. 2 – через 4 нед после отмены валсартана/гидрохлоротиазида и применения местных и системных стероидов и антибиотиков.

Заключение
Диагностика SDRIFE зависит от распознавания клинической морфологии, распространения локализации высыпаний, отсутствия системных проявлений, а также ее временной связи с применением препарата-кулприта.
Ведущее место в диагностике и лечении SDRIFE принадлежит дерматологу. Важно отметить, что после отмены препарата-кулприта и назначения местных и системных глюкокортикоидов отмечается исчезновение кожных высыпаний в течение нескольких недель.
С учетом многообразия препаратов-кулпритов с СБ/SDRIFE может столкнуться в своей практике врач любой специальности и знакомство с этим необычным проявлением лекарственной болезни представляется важным.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
Информация об авторе
Трухан Дмитрий Иванович – д-р мед. наук, доц., проф. каф. поликлинической терапии и внутренних болезней,
ФГБОУ ВО ОмГМУ. E-mail: dmitry_trukhan@mail.ru; ORCID: 0000-0002-1597-1876
Dmitry I. Trukhan – Dr. Sci. (Med.), Prof., Omsk State Medical University. E-mail: dmitry_trukhan@mail.ru;
ORCID: 0000-0002-1597-1876
Поступила в редакцию: 27.05.2023
Поступила после рецензирования: 08.06.2023
Принята к публикации: 15.06.2023
Received: 27.05.2023
Revised: 08.06.2023
Accepted: 15.06.2023
Список исп. литературыСкрыть список1. Andersen KE, Hjorth N, Menné T. The baboon syndrome: systemically-induced allergic contact dermatitis. Contact Dermatitis 1984; 10 (2): 97–100. DOI: 10.1111/j.1600-0536.1984.tb00343.x
2. Häusermann P, Harr T, Bircher AJ. Baboon syndrome resulting from systemic drugs: is there strife between SDRIFE and allergic contact dermatitis syndrome? Contact Dermatitis 2004; 51 (5–6): 297–310. DOI: 10.1111/j.0105-1873.2004.00445.x
3. Winnicki M, Shear NH. A systematic approach to systemic contact dermatitis and symmetric drug-related intertriginous and flexural exanthema (SDRIFE): a closer look at these conditions and an approach to intertriginous eruptions. Am J Clin Dermatol 2011; 12 (3): 171–80. DOI: 10.2165/11539080-000000000-00000
4. Cabrera Hernandez V, Gonzalez Afonso M, Callero Viera A, Martin-Fernandez Martin L. Symmetrical drug-related intertriginous and flexural exanthema due to clindamycin. BMJ Case Rep 2019; 12 (8): e230077. DOI: 10.1136/bcr-2019-230077
5. de Risi-Pugliese T, Barailler H, Hamelin A et al. Symmetrical drug-related intertriginous and flexural exanthema: A little-known drug allergy. J Allergy Clin Immunol Pract 2020; 8 (9): 3185–9.e4. DOI: 10.1016/j.jaip.2020.04.052
6. Wolf R, Tüzün Y. Baboon syndrome and toxic erythema of chemotherapy: Fold (intertriginous) dermatoses. Clin Dermatol 2015; 33 (4): 462–5. DOI: 10.1016/j.clindermatol.2015.04.008
7. Harbaoui S, Litaiem N. Symmetrical Drug-related Intertriginous and Flexural Exanthema.2022 Oct 3. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023. URL: https://pubmed.ncbi. nlm.nih.gov/30969572/
8. Tan SC, Tan JW. Symmetrical drug-related intertriginous and flexural exanthema. Symmetrical drug-related intertriginous and flexural exanthema. Curr Opin Allergy Clin Immunol 2011; 11 (4): 313–8. DOI: 10.1097/ACI.0b013e3283489d5f
9. Muresan AM, Metze D, Böer-Auer A, Braun SA. Histopathological Spectrum and Immunophenotypic Characterization of Symmetrical Drug-Related Intertriginous and Flexural Exanthema. Am J Dermatopathol 2021; 43 (2): 103–11. DOI: 10.1097/DAD. 0000000000001722
10. Schuler AM, Smith EH, Chaudet KM et al. Symmetric drug-related intertriginous and flexural exanthema: Clinicopathologic study of 19 cases and review of literature. J Cutan Pathol 2021; 48 (12): 1471–9. DOI: 10.1111/cup.14090
11. Karadag AS, Ozlu E, Akdeniz N et al. Oral mucosal involvement and petechial lesions: a SDRIFE case with unusual findings. Cutan Ocul Toxicol 2016; 35 (2): 157–9. DOI: 10.3109/15569527.2015.1067227
12. Özkaya E, Babuna G. A challenging case: Symmetrical drug related intertriginous and flexural exanthem, fixed drug eruption, or both? Pediatr Dermatol 2011; 28 (6): 711–4. DOI: 10.1111/j.1525-1470. 2011.01656.x
13. Lima Miranda O, Martins J, Almeida A et al. Symmetrical Drug-related Intertriginous and Flexural Exanthema (Baboon Syndrome). Eur J Case Rep Intern Med 2021; 8 (12): 003029. DOI: 10.12890/ 2021_003029
14. Cancela-Díez B, López-Delgado D, Aneiros-Fernandez J, Ruiz-Villaverde R. A Case of Intertriginous and Flexural Exanthema caused by Amoxicillin. Sultan Qaboos Univ Med J 2019; 19 (4): e369-e371. DOI: 10.18295/squmj.2019.19.04.014
15. Alpagat G, Baccioglu A, Dumanoglu B et al. Amoxicillin/Clavulanic Acid-Induced Symmetric Drug-Related Intertrigious and Flexural Exanthema. Cureus 2023; 15 (1): e33849. DOI: 10.7759/cureus.33849
16. Dogru M, Ozmen S, Ginis T et al. Symmetrical drug-related intertriginous and flexural exanthema (baboon syndrome) induced by amoxicillin-clavulanate. Pediatr Dermatol 2012; 29 (6): 770–1. DOI: 10.1111/j.1525-1470.2011.01577.x
17. Cox JAG. Symmetric, itching exanthema of the skin folds after penicillin use. Ned Tijdschr Geneeskd 2023 Jan 4; 167: D7005. URL: https://pubmed.ncbi.nlm.nih.gov/36633087/
18. Blackmur JP, Lammy S, Baring DE. Baboon syndrome: an unusual complication arising from antibiotic treatment of tonsillitis and review of the literature. BMJ Case Rep 2013; 2013: bcr2013201977. DOI: 10.1136/bcr-2013-201977
19. Handisurya A, Stingl G, Wöhrl S. SDRIFE (baboon syndrome) induced by penicillin. Clin Exp Dermatol 2009; 34 (3): 355–7. DOI: 10.1111/j.1365-2230.2008.02911.x
20. Chong WS, Lim HL. Symmetrical drug-related intertriginous and flexural exanthema (baboon syndrome) with fever induced by oral cloxacillin: does fever confound the diagnosis? J Dermatol 2010; 37 (9): 830–2. DOI: 10.1111/j.1346-8138.2010.00890.x
21. Heck J, Stichtenoth DO, Mettin R et al. Remdesivir-induced symmetrical drug-related intertriginous and flexural exanthema (SDRIFE)? A case report with review of the literature. Eur J Clin Pharmacol 2021; 77 (1): 141–4. DOI: 10.1007/s00228-020-02955-4
22. Magnolo N, Metze D, Ständer S. Pustulobullous variant of SDRIFE (symmetrical drug-related intertriginous and flexural exanthema). J Dtsch Dermatol Ges 2017; 15 (6): 657–9. DOI: 10.1111/ddg.13031
23. Blanco Garcia-Granero D, Barranco R, García-Moguel I et al. First Case of Symmetric Drug-Related Intertriginous and Flexural Exanthema Induced by Meropenem. J Investig Allergol Clin Immunol 2021; 31 (6): 516-–7. DOI: 10.18176/jiaci.0685
24. Favrelière S, Hosteing S, Jazeron JF et al. A case of fixed drug eruption induced by doxycycline, mimicking a symmetrical drug-related intertriginous and flexural exanthema (SDRIFE). Therapie 2020t; 75 (5): 511–3. DOI: 10.1016/j.therap.2019.10.002
25. Li DG, Thomas C, Weintraub GS, Mostaghimi A. Symmetrical Drug-related Intertriginous and Flexural Exanthema Induced by Doxycycline. Cureus 2017; 9 (11): e1836. DOI: 10.7759/cureus.1836
26. Sahu K, Sirka CS, Pradhan S, Rout AN. Co-occurrence of Symmetrical Drug-Related Intertriginous and Flexural Exanthema (SDRIFE) and Pigmented Fixed Drug Eruption (FDE) in a Single Patient Due to Doxycycline: A Case Report. Indian Dermatol Online J 2020; 11 (1): 62–4. DOI: 10.4103/idoj.IDOJ_104_19
27. Bumbacea RS, Ali S, Ogneva DO et al. Drug Provocation Testing in the Diagnosis of Symmetrical Drug-Related Intertriginous and Flexural Exanthema (SDRIFE) Induced by Clarithromycin. Maedica (Bucur) 2021; 16 (2): 297–301. DOI: 10.26574/maedica.2020.16.2.297
28. Moreira C, Cruz MJ, Cunha AP, Azevedo F. Symmetrical drug-related intertriginous and flexural exanthema induced by clarithromycin. An Bras Dermatol 2017; 92 (4): 587–8. DOI: 10.1590/abd1806-4841. 20176125
29. Goossens C, Sass U, Song M. Baboon syndrome. Dermatology 1997; 194 (4): 421–2. DOI: 10.1159/000246167
30. Nespoulous L, Matei I, Charissoux A et al. Symmetrical drug-related intertriginous and flexural exanthema (SDRIFE) associated with pristinamycin, secnidazole, and nefopam, with a review of the literature. Contact Dermatitis 2018; 79 (6): 378–80. DOI: 10.1111/cod. 13084
31. Tsai YW, Chung WH, Wang CW, Cheng CY. Levofloxacin-induced symmetric drug-related intertriginous and flexural exanthema. Contact Dermatitis 2022; 86 (1): 64–6. DOI: 10.1111/cod.13979
32. Megna M, Camela E, Ocampo Garza SS et al. Ciprofloxacin-induced symmetrical drug-related intertriginous and flexural exanthema (SDRIFE) in a psoriasis patient. Contact Dermatitis 2021; 85 (4): 467–9. DOI: 10.1111/cod.13882
33. Kothari R, Mannu A, Vashisht D et al. Vancomycin Associated Purpuric Symmetrical Drug-Related Intertriginous and Flexural Exanthema: A Rare Association and an Uncommon Presentation. J Clin Pharmacol 2022; 62 (10): 1325–7. DOI: 10.1002/jcph.2069
34. Culav I, Ljubojevic S, Buzina DS. Baboon syndrome/SDRIFE due to sulfamethoxazole-trimethoprim. Int J Dermatol 2013; 52 (9): 1159–60. DOI: 10.1111/j.1365-4632.2011.05107.x
35. Şikar Aktürk A, Bayramgürler D, Salman S et al. Symmetrical drug-related intertriginous and flexural exanthema (SDRIFE) induced by oral metronidazole. Cutan Ocul Toxicol 2014; 33 (4): 337–8. DOI: 10.3109/15569527.2013.823981
36. Kumagai J, Nakamura A, Ogawa S, Washio K. Intravaginal metronidazole ovule-related allergic contact dermatitis. Contact Dermatitis 2021; 85 (1): 85–6. DOI: 10.1111/cod.13782
37. Zhang H, Xie Z. Symmetrical drug-related intertriginous and flexural exanthema induced by metronidazole suppository. Contact Dermatitis 2021; 84 (6): 486–8. DOI: 10.1111/cod.13780
38. Gulec AI, Uslu E, Başkan E et al. Baboon syndrome induced by ketoconazole. Cutan Ocul Toxicol 2014; 33 (4): 339–41. DOI: 10.3109/15569527.2013.870187
39. Kumar S, Bhale G, Brar BK. Symmetrical drug related intertriginous and flexural exanthema (SDRIFE) induced by fluconazole: An uncommon side effect of a commonly used drug. Dermatol Ther 2019; 32 (6): e13130. DOI: 10.1111/dth.13130
40. Mohapatra M, Panda M, Kar BR, Raj C. Symmetric Drug-related Intertriginous and Flexural Exanthema due to Itraconazole: An Uncommon Side Effect of a Commonly Used Drug. Indian Dermatol Online J 2017; 8 (6): 501–3. DOI: 10.4103/idoj.IDOJ_179_17
41. Hassanandani T, Panda M, Agarwal A, Das A. Rising trends of symmetrical drug related intertriginous and flexural exanthem due to Itraconazole in patients with superficial dermatophytosis: A case series of 12 patients from eastern part of India. Dermatol Ther 2020; 33 (6): e13911. DOI: 10.1111/dth.13911
42. Kalita BJ, Das S, Dutta B. Itraconazole-induced symmetrical drug-related intertriginous and flexural exanthema (SDRIFE): a rare occurrence. Int J Dermatol 2020; 59 (11): e419–e421. DOI: 10.1111/ijd.15049
43. Obara K, Maejima H, Katayama C et al. A case of symmetrical drug-related intertriginous and flexural exanthema induced by acetaminophen. J Dermatol 2014; 41 (12): 1132–3. DOI: 10.1111/1346-8138. 12666
44. Megna M, Cinelli E, Napolitano M et al. Paracetamol-induced symmetrical drug-related intertriginous and flexural exanthema (SDRIFE) in a psoriasis patient receiving apremilast therapy. Contact Dermatitis 2019; 81 (6): 451–4. DOI: 10.1111/cod.13358
45. Lugović-Mihić L, Duvančić T, Vučić M et al. SDRIFE (baboon syndrome) due to paracetamol: case report. Acta Dermatovenerol Croat 2013; 21 (2): 113–7. URL:https://pubmed.ncbi.nlm.nih.gov/ 24001419/
46. Erfan G, Yanik ME, Kaya S et al. Symmetrical drug-related intertriginous and flexural exanthema due to codeine. Indian J Dermatol Venereol Leprol 2015; 81 (4): 405–6. DOI: 10.4103/0378-6323.158665
47. Martins JF, Alen Coutinho I, Castro M et al. Remifentanil-Induced Symmetric Drug-Related Intertriginous and Flexural Exanthema: A Diagnostic Challenge in an Intensive Care Patient. J Investig Allergol Clin Immunol 2022; 32 (5): 399–401. DOI: 10.18176/jiaci.0764
48. Weiss D, Kinaciyan T. Symmetrical drug-related intertriginous and flexural exanthema (SDRIFE) induced by mefenamic acid. JAAD Case Rep 2018; 5 (1): 89–90. DOI: 10.1016/j.jdcr.2018.10.015
49. Kim BJ, Kim HS, Lee JY et al. Symmetrical drug-related intertriginous and flexural exanthema caused by celecoxib. Int J Dermatol 2014; 53 (1): e1-3. DOI: 10.1111/j.1365-4632.2011.05243.x
50. Ding R, Cheo FF, Lee HY. Celecoxib and Bullous Symmetrical Drug-Related Intertriginous and Flexural Exanthem (SDRIFE). J Allergy Clin Immunol Pract 2023; 11 (2): 629–31. DOI: 10.1016/j.jaip. 2022.11.028
51. Caralli ME, Seoane Rodríguez M, Rojas Pérez-Ezquerra P et al. Symmetrical Drug-Related Intertriginous and Flexural Exanthema (SDRIFE) Caused by Etoricoxib. J Investig Allergol Clin Immunol 2016; 26 (2): 128–9. DOI: 10.18176/jiaci.0029
52. Watanabe T, Yamada N, Yoshida Y, Yamamoto O. A case of symmetrical drug-related intertriginous and flexural exanthema induced by loflazepate ethyl. J Eur Acad Dermatol Venereol 2010; 24 (3): 357–8. DOI: 10.1111/j.1468-3083.2009.03405.x
53. Suvarna P, Kayarkatte MN, Shenoi SD, Jaiprakash P. A rare case of clozapine-induced symmetrical drug-related intertriginous and flexural exanthema with vasculitis-like lesions. Contact Dermatitis 2020; 82 (5): 318–20. DOI: 10.1111/cod.13468
54. Rao A, Francis N, Morar N. Clozapine-induced symmetrical drug-related intertriginous and flexural exanthema: first reported cases. Br J Dermatol 2012; 166 (5): 1142–3. DOI: 10.1111/j.1365-2133.2011. 10758.x
55. Akkari H, Belhadjali H, Youssef M et al. Baboon syndrome induced by hydroxyzine.Indian J Dermatol 2013; 58 (3): 244. DOI: 10.4103/ 0019-5154.110871
56. Allain-Veyrac G, Lebreton A, Collonnier C, Jolliet P. First case of symmetric drug-related intertriginous and flexural exanthema (SDRIFE) due to rivastigmine? Am J Clin Dermatol 2011; 12 (3): 210–3. DOI: 10.2165/11318350-000000000-00000
57. Akay BN, Sanli H. Symmetrical drug-related intertriginous and flexural exanthem due to oral risperidone. Pediatr Dermatol 2009; 26 (2): 214–6. DOI: 10.1111/j.1525-1470.2009.00882.x
58. Treudler R, Simon JC. Symmetric, drug-related, intertriginous, and flexural exanthema in a patient with polyvalent intolerance to corticosteroids. J Allergy Clin Immunol 2006; 118 (4): 965–7. DOI: 10.1016/j.jaci.2006.07.023
59. Armingaud P, Martin L, Wierzbicka E, Esteve E. Baboon syndrome due to a polysensitization with corticosteroids. Ann Dermatol Venereol 2005; 132 (8–9 Pt. 1): 675–7. DOI: 10.1016/s0151-9638(05)79415-1
60. Garcia-Bravo B, Repiso JB, Camacho F. Systemic contact dermatitis due to deflazacort. Contact Dermatitis 2000; 43 (6): 359–60. DOI: 10.1034/j.1600-0536.2000.043006359.x
61. Virath R, Gupta LK, Balai M. A probable association of symmetrical drug-related intertriginous and flexural exanthema with levocetirizine. Indian J Dermatol Venereol Leprol 2020; 86 (6): 696–9. DOI: 10.4103/ijdvl.IJDVL_416_19
62. Yang SY, Lan CC, Hu SC. Symmetrical drug-related intertriginous and flexural exanthema (SDRIFE) induced by golimumab. Int J Dermatol 2017; 56 (5): 571–2. DOI: 10.1111/ijd.13565
63. Bulur I, Keseroglu HO, Saracoglu ZN, Gönül M. Symmetrical drug-related intertriginous and flexural exanthema (Baboon syndrome) associated with infliximab. J Dermatol Case Rep 2015; 9 (1): 12–4. DOI: 10.3315/jdcr.2015.1190
64. Keshavamurthy C, Fibeger E, Virata A, Bansal P. Symmetrical drug-related intertriginous and flexural exanthema (Baboon syndrome) associated with Infliximab: a case-based review. ARP Rheumatol 2022; 1 (4): 322–7. URL: https://pubmed.ncbi.nlm.nih.gov/36617314/
65. Göbel CH, Heinze A, Karstedt S et al. First Report of Symmetrical Drug-related Intertriginous and Flexural Exanthema (SDRIFE or Baboon Syndrome) After Erenumab Application for Migraine Prevention. Pain Ther 2022; 11 (4): 1483–91. DOI: 10.1007/s40122-022-00417-6
66. Mofarrah R, Mofarrah R, Kränke B et al. First report of tamoxifen-induced baboon syndrome. J Cosmet Dermatol 2021; 20 (8): 2574–78. DOI: 10.1111/jocd.13863
67. Powers R, Gordon R, Roberts K, Kovach R. Symmetrical drug-related intertriginous and flexural exanthema secondary to topical 5-fluorouracil. Cutis 2012; 89 (5): 225-8. URL: https://pubmed.ncbi.nlm. nih.gov/22768435/#affiliation-1
68. Lewis W, Forrestel A, Baumrin E. Epidermal Growth Factor Receptor Inhibitor-Induced Symmetrical Drug-Related Intertriginous and Flexural Exanthema: Should You Discontinue the Offending Agent? Cutis 2023; 111 (1): 18–21. DOI: 10.12788/cutis.0681
69. Copps B, Lacroix JP, Sasseville D. Symmetrical drug-related intertriginous and flexural exanthema secondary to epidermal growth factor receptor inhibitor gefitinib. JAAD Case Rep 2020; 6 (3): 172–5. DOI: 10.1016/j.jdcr.2017.03.003
70. Keerty D, Graham L, Haynes E, Hembree TN. Flexural Exanthema From Enfortumab Vedotin. Cureus 2020; 12 (5): e8102. DOI: 10.7759/ cureus.8102
71. Malissen N, Bourrain J-L, Chiriac A et al. Symmetrical Intertriginous and Flexural Exanthema due to Bortezomib (a Proteasome Inhibitor) Given for Myeloma. Acta Derm Venereol 2016; 96: 995–6. DOI: 10.2340/00015555-241
72. Scherrer M, Araujo MG, Farah K. Tacrolimus-induced symmetric drug-related intertriginous and flexural exanthema (SDRIFE). Contact Dermatitis 2018; 78 (6): 414–6. DOI: 10.1111/cod.12954
73. Kurtzman DJ, Oulton J, Erickson C, Curiel-Lewandrowski C. Everolimus-Induced Symmetrical Drug-Related Intertriginous and Flexural Exanthema (SDRIFE). Dermatitis 2016; 27 (2): 76–7. DOI: 10.1097/DER.0000000000000164
74. Ferreira O, Mota A, Morais P et al. Symmetrical drug-related intertriginous and flexural exanthema (SDRIFE) induced by telmisartan-hydrochlorothiazide. Cutan Ocul Toxicol 2010; 29 (4): 293–5. DOI: 10.3109/15569527.2010.491103
75. Tchernev G, Oliveira N, Kandathil LJ. Baboon syndrome (SDRIFE) after valsartan/hydrochlorothiazide intake for several years. Dermatol Reports 2021; 14 (2): 9412. DOI: 10.4081/dr.2022.9412
76. Kardaun SH, Tupker RA. Symmetrical drug-related intertriginous and flexural exanthema (Baboon syndrome) induced by omeprazole. Int J Dermatol 2012; 51 (9): 1134–7. DOI: 10.1111/j.1365-4632.2010.04689.x
77. Kothari R, Pal R, Bhatnagar A et al. A rare case of symmetrical drug-related intertriginous and flexural exanthema due to pantoprazole. Int J Dermatol 2022; 61 (9): e330–e331. DOI: 10.1111/ijd.16155
78. Spigariolo CB, Barei F, Maronese CA, Barberi F, Cattaneo A, Violetti SA. Three cases of symmetrical drug-related intertriginous and flexural exanthema (SDRIFE) induced by proton-pump inhibitors. Australas J Dermatol 2022; 63 (4): 509–12. DOI: 10.1111/ajd.13905
79. Binitha MP, Sasidharanpillai S, John R, Sherjeena PV. Symmetrical drug-related intertriginous and flexural exanthema due to ranitidine. Indian J Pharmacol 2014; 46 (5): 551-2. DOI: 10.4103/0253-7613.140595
80. Seok J, Kim JM, Park KY, Seo SJ. Symmetrical Drug-Related Intertriginous and Flexural Exanthema: Two Cases and Brief Literature Review. Ann Dermatol 2018; 30 (5): 606–9. DOI: 10.5021/ad.2018.30.5.606
81. Daito J, Hanada K, Katoh N et al. Symmetrical drug-related intertriginous and flexural exanthema caused by valacyclovir. Dermatology 2009; 218 (1): 60–2. DOI: 10.1159/000167829
82. Roche D, Murray G, Hackett C, Tobin AM. A flexural exanthem following postexposure prophylaxis. Clin Exp Dermatol 2022; 47 (6): 1204–6. DOI: 10.1111/ced.15131
83. Heck J, Stichtenoth DO, Mettin R et al. Remdesivir-induced symmetrical drug-related intertriginous and flexural exanthema (SDRIFE)? A case report with review of the literature. Eur J Clin Pharmacol 2021; 77 (1): 141–4. DOI: 10.1007/s00228-020-02955-4
84. Çakıcı ÖA, Güder S, Salman A, Ergun T. Symmetrical drug-related intertriginous and flexural exanthema-like eruption: An addition to the spectrum of coronavirus disease 2019-related cutaneous findings. Indian J Dermatol Venereol Leprol 2022; 88 (6): 814–6. DOI: 10.25259/IJDVL_165_2022
85. Kandala H, Gonzalez-Mosquera LF, Barua P, Podrumar A. Zoledronic acid-induced symmetrical drug-related intertriginous and flexural exanthema (SDRIFE). BMJ Case Rep 2021; 14 (9): e245326. DOI: 10.1136/bcr-2021-245326
86. Cohen PR. Zoledronic acid-associated symmetrical drug-related intertriginous and flexural exanthema (SDRIFE): report of baboon syndrome in a woman with recurrent metastatic breast cancer after receiving zoledronic acid. Dermatol Online J 2015; 21 (8): 13030/qt5kk0g864. URL: https://pubmed.ncbi.nlm.nih.gov/26437156/
87. Cheng CY, Wang CW, Wang FY, Chung WH. Varenicline-induced symmetrical drug-related intertriginous and flexural exanthema. Indian J Dermatol Venereol Leprol 2019; 85 (2): 209–11. DOI: 10.4103/ijdvl.IJDVL_768_17
88. Thierman S, Chinthraja RS. Symmetrical drug-related intertriginous and flexural exanthema after coronary artery angiography. J Hosp Med 2009; 4 (3): 203. DOI: 10.1002/jhm.420
89. Arnold AW, Hausermann P, Bach S, Bircher AJ. Recurrent flexural exanthema (SDRIFE or baboon syndrome) after administration of two different iodinated radio contrast media. Dermatology 2007; 214 (1): 89–93. DOI: 10.1159/000096920
90. Hattori Y, Matsuyama K, Shu E et al. Symmetrical drug-related intertriginous and flexural exanthema possibly due to thiamine disulfide.
J Dermatol 2017; 44 (6): e115-e116. DOI: 10.1111/1346-8138.13776
91. Peeters D, Baeck M, Dewulf V et al. A case of SDRIFE induced by Nuvaring®. Contact Dermatitis 2012; 66 (2): 110–1. DOI: 10.1111/j.1600-0536.2011.01990.x
92. Matos-Pires E, Pina-Trincão D, Brás S, Lobo L. Baboon syndrome caused by anti-haemorrhoidal ointment. Contact Dermatitis 2018; 78 (2): 170–1. DOI: 10.1111/cod.12880
93. Liu J, Li LF. Symmetrical drug-related intertriginous and flexural exanthema/baboon syndrome induced by traditional Chinese medicine. J Cosmet Dermatol 2022; 21 (5): 2200–4. DOI: 10.1111/jocd.
14343
94. Choi MJ, Oh SH, Cho SB. Coix lacryma-jobi associated symmetrical drug-related intertriginous and flexural exanthema. Int J Dermatol 2014; 53 (4): e301-3. DOI: 10.1111/ijd.12258
95. Labadie JG, Florek AG, Croitoru A et al. First case of symmetrical drug-related intertriginous and flexural exanthema (SDRIFE) due to Berberine, an over-the-counter herbal glycemic control agent. Int J Dermatol 2018; 57 (9): e68-e70. DOI: 10.1111/ijd.14059
96. Chen B, Jiang X, Chen W et al. A rare case of musk antihemorrhoids ointment-induced symmetrical drug-related intertriginous and flexural exanthema. Contact Dermatitis 2020; 83 (5): 409–11. DOI: 10.1111/cod.1357
97. Mahé A, Birckel E, Krieger S et al. A distinctive skin rash associated with coronavirus disease 2019? J Eur Acad Dermatol Venereol 2020; 34 (6): e246–e247. DOI: 10.1111/jdv.16471
98. Escolà H, March-Rodriguez A, Pujol RM. Symmetrical drug-related intertriginous and flexural exanthema-like rash related to severe acute respiratory syndrome coronavirus 2 infection. Indian J Dermatol Venereol Leprol 2023; 89 (1): 119–21. DOI: 10.25259/IJDVL_355_2022
99. Chicharro P, Rodríguez-Jiménez P, Muñoz-Aceituno E et al. SDRIFE-like rash associated with COVID-19, clinicopathological correlation. Australas J Dermatol 2021; 62: 88–9. DOI: 10.1111/ajd.13444
100. Bonamigo RR, Bottega GB, Staub FL et al. Bullous SDRIFE and Covid-19. Int J Dermatol 2022; 6: 372–4. DOI: 10.1111/ijd.16012
101. Bevilaqua M, Ribolli GB, Luzzatto L et al. SDRIFE-like rash in COVID-19 patient: drug reaction or another cutaneous manifestation of SARS-CoV-2? Int J Dermatol 2021; 60: 884–5. DOI: 10.1111/ijd.15537
102. Bellinato F, Maurelli M, Gisondi P, Girolomoni G. Cutaneous Adverse Reactions Associated with SARS-CoV-2 Vaccines. J Clin Med 2021;
10 (22): 5344. DOI: 10.3390/jcm10225344
103. Manaa A, Ziv M, Krausz J, Dodiuk-Gad RP. A case of symmetrical drug-related intertriginous and flexural exanthema-like eruption associated with Pfizer COVID-19 vaccination. Dermatol Ther 2022; 35 (7): e15546. DOI: 10.1111/dth.15546
104. Lahouel I, Ben Salah N, Ben Fadhel N et al. Symmetrical drug-related intertriginous and flexural exanthema-like eruption after COVID-19 vaccine. J Eur Acad Dermatol Venereol 2022; 36 (8): e597–e599. DOI: 10.1111/jdv.18108
105. Hai J, Shawa H, Kim-Lim P et al. Systemic drug-related intertriginous and flexural exanthema induced by the Pfizer-BioNTech COVID-19 vaccine: A report of 2 cases. JAAD Case Rep 2021; 18: 57–60. DOI: 10.1016/j.jdcr.2021.10.016
106. Hong JK, Shin SH, Yoo KH et al. Symmetric drug-related intertriginous and flexural exanthema-like eruption related to coronavirus disease 2019 vaccine. Contact Dermatitis 2022; 87 (1): 91–3. DOI: 10.1111/cod.14092
107. Lim PN, Wylie G. Symmetrical drug-related intertriginous and flexural exanthema like eruption associated with COVID-19 vaccination. Clin Exp Dermatol 2022; 47 (1): 175–6. DOI: 10.1111/ced.14898
108. Di Bona D, Miniello A, Nettis E. Systemic drug-related intertriginous and flexural exanthema-like eruption after Oxford-AstraZeneca COVID-19 vaccine. Clin Mol Allergy 2022; 20 (1): 13. DOI: 10.1186/s12948-022-00179-8
109. Orenay OM, Balta I, Yigit D, Eksioglu M. Systemic drug‐related intertriginous and flexural exanthema like eruption after CoronaVac vaccine. J Eur Acad Dermatol Venereol 2021; 35 (10): e634‐e635. DOI: 10.1111/jdv.17454
110. Pottegård A, Hallas J, Olesen M et. al. Hydrochlorothiazide use is strongly associated with risk of lip cancer. J Intern Med 2017; 282 (4): 322–31. DOI: 10.1111/joim.12629
111. Pedersen SA, Gaist D, Schmidt SAJ et al. Hydrochlorothiazide use and risk of nonmelanoma skin cancer: A nationwide case-control study from Denmark. J Am Acad Dermatol 2018; 78 (4): 673–81.e9. DOI: 10.1016/j.jaad.2017.11.042
112. Garrido PM, Borges-Costa J. Hydrochlorothiazide treatment and risk of non-melanoma skin cancer: Review of the literature. Rev Port Cardiol (Engl Ed) 2020; 39 (3): 163–70. DOI: 10.1016/j.repc.2019. 07.008
113. Lecaros-Astorga DA, Molina-Guarneros JA, Rodríguez-Jiménez P et al. Hydrochlorothiazide use and risk of non-melanoma skin cancer in Spain: A case/non-case study. Int J Clin Pharmacol Ther 2021; 59 (4): 280–8. DOI: 10.5414/CP203769
114. Becquart O, Guillot B, Bourrain J-L et al. Hydrochlorothiazide use and risk of skin cancers: A systematic review. Rev Med Interne 2019; 40 (9): 617–22. DOI: 10.1016/j.revmed.2019.04.008
114. Letellier T, Le Borgne F, Kerleau C et al; Divat Consortium. Association between Use of Hydrochlorothiazide and Risk of Keratinocyte Cancers in Kidney Transplant Recipients. Clin J Am Soc Nephrol 2020; 15 (12): 1804–13. DOI: 10.2215/CJN.02560220
115. Carney K, Cousins M. Does hydrochlorothiazide increase the incidence of skin, lip and oral cancer in a UK population? Evid Based Dent 2022; 23 (1): 38–9. DOI: 10.1038/s41432-022-0255-x
116. Eworuke E, Haug N, Bradley M et al. Risk of Nonmelanoma Skin Cancer in Association With Use of Hydrochlorothiazide-Containing Products in the United States. JNCI Cancer Spectr 2021; 5 (2): pkab009. DOI: 10.1093/jncics/pkab009
116. Rouette J, Yin H, Pottegård A et.al. Use of Hydrochlorothiazide and Risk of Melanoma and Nonmelanoma Skin Cancer. Drug Saf 2021; 44 (2): 245–54. DOI: 10.1007/s40264-020-01015-1
117. de Macedo Andrade AC, Felix FA, França GM et al. Hydrochlorothiazide use is associated with the risk of cutaneous and lip squamous cell carcinoma: A systematic review and meta-analysis. Eur J Clin Pharmacol 2022; 78 (6): 919–30. DOI: 10.1007/s00228-022-03299-x
118. Shao SC, Lai CC, Chen YH et al. Associations of thiazide use with skin cancers: a systematic review and meta-analysis. BMC Med 2022; 20 (1): 228. DOI: 10.1186/s12916-022-02419-9
119. Habel LA, Achacoso N, Fireman B et.al. Hydrochlorothiazide and risk of melanoma subtypes. Pharmacoepidemiol Drug Saf 2021; 30 (10): 1396–401. DOI: 10.1002/pds.5266
120. Adalsteinsson JA, Muzumdar S, Waldman R et al. Association between hydrochlorothiazide and the risk of in situ and invasive squamous cell skin carcinoma and basal cell carcinoma: A population-based case-control study. J Am Acad Dermatol 2021; 84 (3): 669–75. DOI: 10.1016/j.jaad.2020.08.025

