Клинический разбор в общей медицине №3 2024
Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia
omekan@mail.ru
Abstract
Chronic endometritis "from pathogenesis to therapy" still remains the most contrarian issue of modern gynaecology. The lack of a unified pathogenetic concept as well as diagnostic and therapeutic algorithms continue to support a multitude of scientific discussions around this unique nosology. Latent subclinical endometrial inflammatory changes are associated with the realization of reproductive failures, including repeated implantation failures and early reproductive losses. To date, a sufficient amount of scientific data has been accumulated demonstrating high efficacy and safety of antifibrotic therapy with the use of azoximer bovgialuronidase (Longidaza) in the complex treatment of chronic endometritis.
Keywords: chronic endometritis, plasmocytes, hysteroscopy, physiotherapy, enzyme therapy, antifibrotic therapy.
For citation: Orazov M.R., Radzinsky V.E., Dolgov E.D. Chronic endometritis at present: focus on overcoming implantation failures. Clinical review for general practice. 2024; 5 (3): 18–26. (In Russ.). DOI: 10.47407/kr2023.5.3.00370
Но вместе с тем одним из неизученных до конца заболеваний современности остается хронический эндометрит (ХЭ). В современном понимании ХЭ – это латентное/малосимптомное воспалительное заболевание эндометрия чаще инфекционной этиологии, ассоциированное с нарушением ее архитектоники и рецептивности/селективности [1]. Безусловно, в самом определении ХЭ заключаются важные диагностические критерии, а именно клинический и хронологический. Но при этом все мировое гинекологическое сообщество задается вопросом: что значит латентное? Прежде всего, это связано с весьма нередким отсутствием классических признаков воспаления у пациенток данной когорты. И в таком случае единственной/частой проблемой, с которой женщина может обратиться к специалисту, становится маточный фактор бесплодия или неудачи имплантации в анамнезе.
Однако наиболее интересными остаются данные о распространенности ХЭ в популяции. На настоящий момент отсутствует современная информация о частоте диагностирования ХЭ. При этом результаты исследования начала XXI в. свидетельствуют о том, что распространенность ХЭ в общей популяции достигает 10–11% [7]. Вместе с тем отмечается, что ХЭ верифицируется у 3–10% пациенток с аномальными маточными кровотечениями и до 72% женщин с воспалительными заболеваниями органов малого таза, вызванными инфекциями, передающимися половым путем [8].
Таким образом, важно резюмировать, что ХЭ – весьма «скрытный/недооцененный диагноз» с точки зрения эпидемиологических данных, что связано с рядом диагностических контраверсий, о которых мы упомянем несколько ниже. Однако наиболее интересным с научной точки зрения остается «нерешенный» вопрос этиопатогенетических основ заболевания. В этой связи необходимо отметить доказанные триггеры и механизмы развития ХЭ.
На сегодняшний день точка зрения относительно бактериальной колонизации полости матки кардинально изменилась. Если раньше исследователи полагали, что полость матки стерильна и данный факт является жесткой физиологической константой, то сегодня благодаря внедрению технологий секвенирования стало совершенно очевидно, что микробиом – необходимое звено в поддержании тканевого гомеостаза матки и ее защиты от внедрения патогенных микроорганизмов [9]. Безусловно, основным предполагаемым источником мигрирующих микроорганизмов в полости матки является влагалище. Эта гипотеза подтверждается в ходе сравнения качественного состава микробиома обоих локусов, которое демонстрирует значительные сходства. Согласно имеющимся данным, основным микробным представителем полости матки являются «полезные» лактобактерии (Lactobacillus iners и Lactobacillus crispatus), составляющие основу маточного биоценоза [10]. Однако кроме лактобацилл микробный пейзаж богат и другими представителями, такими как Bifidobacterium, Streptococcus, Prevotella, Gardnerella и др. [11, 12]. Вместе с тем, несмотря на наличие других микроорганизмов, абсолютное преобладание лактобактерий играет важную роль в поддержании колонизационной резистентности и стабильности микробиома. Продуцируемые лактобациллами локально-действующие факторы агрессии (молочная кислота, перекись водорода) угнетают избыточный рост патогенной и условно-патогенной микрофлоры и, соответственно, предотвращают развитие воспалительных изменений эндометрия (включая ХЭ). Однако революционная роль лактобактерий полости матки была продемонстрирована результатами международного исследования, согласно которым абсолютное численное преобладание (более 90%) лактобацилл в полости матки напрямую коррелировало с успешной имплантацией [13]. При этом в случае превалирования условно-патогенной микрофлоры, включая стрептококки и гарднереллы, вероятно ассоциировано с неудачами имплантации и более низкими показателями живорождения [11].
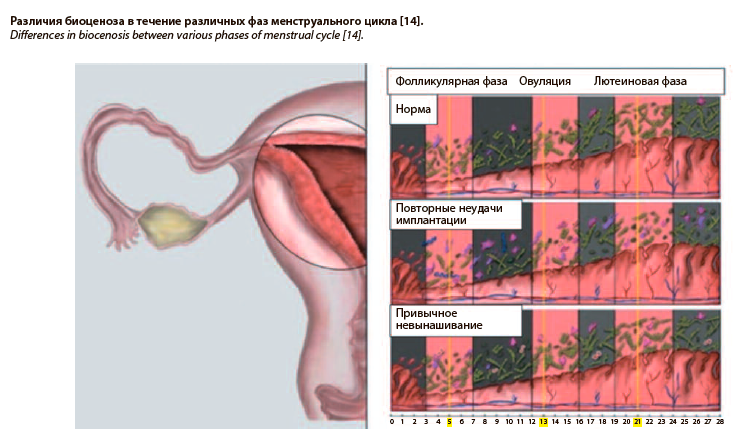
В связи со всем сказанным необходимо отметить результаты уникального исследования K. Vomstein и соавт. (2022 г.), «пролившего свет» на динамическую характеристику нормального микробиома полости матки (контрольная группа) и его сравнения с биоценозом у пациенток с повторными неудачами имплантации и привычным невынашиванием. Было доказано, что у пациенток контрольной группы отмечалось абсолютное преобладание лактобациллярной флоры на протяжении всего менструального цикла (фолликулярная фаза – 78,48%; овуляция и лютеиновая фаза – 66,67%). Кроме того, у пациенток без репродуктивных неудач в анамнезе отмечалось динамическое снижение численности пула лактобактерий, а также «пестроты» микробного пейзажа к лютеиновой фазе цикла (что вероятно ассоциировано с адекватной имплантацией бластоцисты). При этом у пациенток с повторными неудачами имплантации и привычным невынашиванием отмечался микробиологический «портрет», характеризующийся наоборот увеличением численности пула лактобактерий и пестроты видового состава микробиома к моменту овуляции и лютеиновой фазе (см. рисунок) [14]. Таким образом, авторы доказали существенную роль биоценоза в полости матки в реализации репродуктивных потерь. Однако в ходе исследования не проводилась оценка гистологической картины эндометрия, но, несмотря на это, можно предположить наличие признаков ХЭ у пациенток изучаемой когорты, поскольку ключевым морфологическим субстратом дисбиоза часто является именно воспалительная, пусть и клинически-латентная (субклиническое течение), инфильтрация ткани.
На сегодняшний день мировое медицинское сообщество в вопросе ХЭ разделилось на два основных «лагеря»: одни считают, что этиологической основой заболевания является прямое воздействие инфекта на эндометрий, а другие полагают, что ХЭ – результат персистирующего аномального воспалительного ответа, однажды спровоцированного инфекционным агентом. И здесь необходимо отметить всю важность данной полемики, поскольку принятие той или иной стороны клиницистом играет ведущую роль в определении тактики ведения пациенток данной когорты. Однако вторая точка зрения является наиболее патогенетически оправданной, поскольку воспалительный процесс, индуцированный «сиюминутно» в ходе прямого воздействия инфекта, «не терпит полумер» и по сути является острым эндометритом с характерной клинической симптоматикой. Вместе с тем острый эпизод может стать отправной точкой для ХЭ, поскольку он служит началом для «порочного круга» аномального персистирующего воспаления, постепенно «набирающего обороты», что на настоящий момент уже доказано [15, 16, 20].
Основным морфологическим субстратом ХЭ является воспалительная инфильтрация ткани и гиперпродукция провоспалительных цитокинов. Так, у пациенток с ХЭ отмечается значительное повышение содержания цитотоксических Т-лимфоцитов (CD-8), В-лимфоцитов (CD-20) и плазмоцитов (CD-138), гиперэкспрессия интерлейкина (ИЛ) 6, ИЛ-1β и фактора некроза опухоли (ФНО) α, а также дисбаланс Т-хелперов 1-го и 2-го типов [17–19]. Кроме того, у пациенток данной когорты отмечается снижение экспрессии противовоспалительного цитокина – ИЛ-11, способствующего «адекватной» или полноценной имплантации плодного яйца. Супрессия данного медиатора нарушает ключевые процессы децидуализации эндометрия и, как следствие, способствует реализации ряда репродуктивных неудач, включая повторные неудачи имплантации и привычное невынашивание [21].
Таким образом, необходимо резюмировать, что ХЭ по своей сути является типичным примером персистирующего аномального воспаления, которое реализуется после взаимодействия инфекта (или группы микроорганизмов) с toll-подобными рецепторами эндометрия. И в этой связи становится очевидно, что борьба с причинным микроорганизмом не является состоятельной с точки зрения эффективности. Наша ключевая цель – прерывание этой порочной цепочки. Однако об этом несколько позже.
И здесь мы подошли к обсуждению самого спорного вопроса, к консенсусу, в котором медицинское сообщество до сих пор не пришло к единому мнению: какое количество обнаруженных клеток CD-138+ необходимо для верификации болезни? В данном контексте необходимо отметить результаты метаанализа A. Santoro и соавт. (2023 г.), в котором авторам удалось установить взаимосвязь между репродуктивными неудачами и определенным числом плазмоцитов в исследуемых образцах эндометрия. Так, было доказано, что обнаружение 5 и более плазмоцитов в 10 полях зрения при максимальном увеличении ассоциировано с развитием имплантационных неудач у пациенток, страдающих ХЭ (p=0,007). При этом обнаружение менее 5 клеток в образце ткани не имело клинической значимости [23]. Исходя из этого, важно отметить, что на сегодняшний день определено число плазмоцитов, свидетельствующих о наличии ХЭ. Однако по-прежнему мы рекомендуем проводить комплексный диагностический алгоритм, объединяющий оценку клинико-анамнестических данных и гистологическую верификацию.
Как мы отметили, клиническая картина у пациенток с ХЭ может и вовсе отсутствовать, или иметь малосимптомное течение. Однако, согласно имеющимся данным, ХЭ может манифестировать аномальными маточными кровотечениями, диспареунией, тазовой болью, а также обильными выделениями из половых путей. При этом ключевыми анамнестическими уточнениями, способными «повернуть» диагностический поиск в правильную/нужную сторону, является наличие репродуктивных неудач, а именно повторных неудач имплантации или привычного невынашивания беременности [21]. В этой связи важно отметить, что у пациенток с перечисленными жалобами следует морфологически верифицировать ХЭ.
Вместе с тем, кроме перечисленных подходов к верификации ХЭ, большое внимание уделяется визуализационным методам, а именно гистероскопии. На сегодняшний день сформулированы ключевые гистероскопические признаки ХЭ [24, 25]:
• микрополипы эндометрия (до 1–2 мм);
• локальная или диффузная гиперемия эндометрия;
• стромальный отек, вызывающий утолщение и побледнение эндометрия в фолликулярной фазе менструального цикла вместо секреторной.
Согласно имеющимся результатам, наличие микрополипов эндометрия является патогномоничным диагностическим критерием ХЭ. Обнаружение данных структур в ходе гистероскопии позволяет повышать диагностику ХЭ с точностью до 93,4% [25].
Исходя из всего сказанного, необходимо отметить, что диагностический поиск ХЭ должен осуществляться комплексно и включать оценку клинико-анамнестических данных, визуализационный/гистероскопический контроль, а также гистологическое исследование с определением числа плазматических клеток.
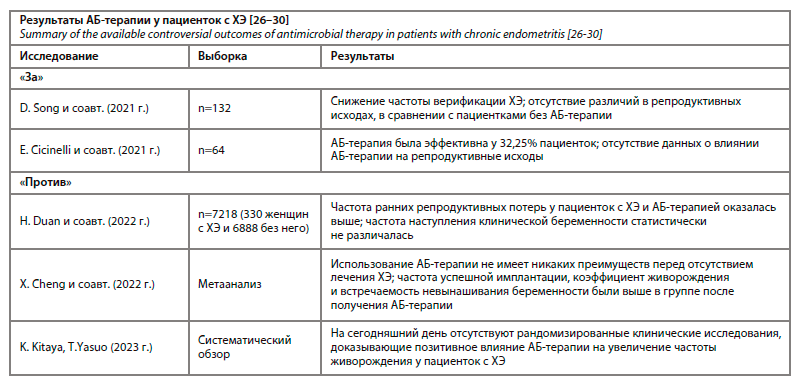
Таким образом, необходимо отметить, что антибактериальная терапия в рамках лечения ХЭ (при отсутствии доказанного или потенциально значимого возбудителя) не является оправданной как с клинической, так и с патогенетической точки зрения. Имеющиеся результаты научных исследований демонстрируют выраженную гетерогенность полученных данных и не позволяют сделать конкретных клинических выводов. В этой связи важно резюмировать, что АБ-терапия ХЭ актуальна лишь при условии обнаружения конкретного (доказанного или потенциально значимого) инфекта. Исходя из этого, важно рассмотреть другие патогенетически оправданные методы терапии ХЭ.
На сегодняшний день в арсенале клинициста имеются альтернативные и патогенетически оправданные методы лечения ХЭ, к которым относят физиотерапию и ферментную/антифиброзную терапию.
К современным методам физиотерапии ХЭ относят ультразвуковую, внутриполостную фотодинамическую терапию, а также электромагнитное лечение и импульсную электротерапию. Так, УЗ-кавитация полости матки позволяет достичь противовоспалительного и иммуномодулирующего эффектов, тем самым блокируя ключевые патогенетические звенья развития ХЭ [31]. Инфракрасное лазерное ремоделирование за счет своего термального воздействия и локального «прогревания» тканей стимулирует процессы ангиогенеза и регенерации эндометрия, способствуя восстановлению его гистоархитектоники и имплантационной состоятельности [32]. Аналогичным эффектом обладает электроимпульсная терапия (ЭИТ), стимулирующая ангиогенез и улучшающая перфузионные показатели в ткани. Кроме того, ЭИТ стимулирует пролиферативные и регенераторные показатели эндометрия за счет повышения экспрессии трансформирующего и эпидермального факторов роста, что было доказано результатами исследования отечественных коллег [31].
Таким образом, физиотерапия демонстрирует ряд клинически и патогенетически оправданных саногенетических эффектов в контексте терапии ХЭ. Бережное и контролируемое воздействие физических факторов способствует восстановлению гистоархитектоники эндометрия и одновременно предотвращает развитие ряда негативных побочных эффектов, ассоциированных с фибропластическими изменениями.
Однако наиболее интересной и консервативной методикой лечения ХЭ является использование антифиброзной ферментной терапии. Ключевое обоснование актуальности антифиброзной терапии ХЭ кроется в патогенезе самого заболевания. Ключевые паттерны воспалительного процесса стимулируют дифференцировку фибробластов и, соответственно, избыточную продукцию коллагеновых волокон в строме, что приводит к фиброзным изменениям эндометрия и развитию его имплантационной несостоятельности [33, 34]. Более того, длительно существующие фиброзные изменения тканей постепенно становятся необратимыми, что может стать причиной резистентного к любым воздействиям «гипопластичного эндометрия» и способствовать формированию стойкого маточного фактора инфертильности и невынашивания беременности. Именно поэтому антифиброзная и противовоспалительная терапия является патогенетически оправданной и может использоваться в рамках комбинированного лечения ХЭ. В РФ зарегистрирован препарат бовгиалуронидазы азоксимера (Лонгидаза), обладающий выраженным антифиброзным эффектом за счет деполимеризации коллагеновых волокон, который может легитимно использоваться в рамках действующей инструкции по применению для комплексной терапии ХЭ. Кроме того, данный препарат обладает выраженным противовоспалительным эффектом за счет снижения выработки ключевых провоспалительных цитокинов (ИЛ-1, ФНО-α) [39].
Исходя из всего сказанного, необходимо рассмотреть имеющиеся результаты клинического использования антифиброзной терапии бовгиалуронидазой азоксимером (Лонгидаза) в рамках комплексного лечения ХЭ.
• По данным Н.И. Тапильской и др. (2020 г.), использование бовгиалуронидазы азоксимера в комплексной терапии ХЭ способствует купированию интенсивного воспалительного процесса (элиминация плазматических клеток) и фиброзных изменений в эндометрии. Исследователями было установлено, что после антибактериальной терапии ХЭ с использованием трех курсов Лонгидазы частота выявления микроорганизмов в полости матки существенно снизилась: Staphyloсoccus spp. – на 25%, Ente-robacteriaceae spp. – на 18%, Streptococcus spp. – на 40%, Gardenerella vaginalis – на 22% и Bacteroides spp. – на 17% (p<0,05). Вместе с тем авторами был доказан позитивный клинический эффект, связанный с успешным наступлением беременности у трех пациенток изучаемой когорты. Таким образом, следует подчеркнуть, что использование бовгиалуронидазы азоксимера в комплексе с антибактериальными препаратами способствовало снижению частоты бактериальной контаминации полости матки и повышению эффективности терапии ХЭ [35].
• По данным Э.В. Вартанян и соавт. (2018 г.), использование бовгиалуронидазы азоксимера в рамках комплексной терапии ХЭ способствовало значимому увеличению толщины эндометрия, а также нормализации перфузионных показателей и рецептивного профиля ткани. После проведенного лечения у 50% пациенток полностью купировались клинико-морфологические паттерны ХЭ, а у 57,1% женщин отмечалось наступление спонтанной беременности [36].
• По данным В.Е. Балан и соавт. (2014 г.), использование бовгиалуронидазы азоксимера в составе комплексной терапии ХЭ способствует повышению эффективности сопутствующих методов лечения в связи с ремоделированием эндометрия и нормализацией его гистоархитектоники [37].
• По данным исследования E. Trizna и соавт. (2021 г.), бовгиалуронидаза азоксимер разрушает как моно-, так и двухвидовые биопленки, образуемые различными бактериями. После 4-часовой обработки 750 ME фермента остаточные биопленки Staphylococcus aureus, Enterococcus faecalis, Escherichia coli, Klebsiella pneumonie сохранили около 50% от их первоначальной массы. Биомасса двухвидовых биопленок, образованных этими четырьмя видами, была уменьшена в 1,5 раза после 24-часовой обработки, в то время как значительное разрушение S. aureus – P. aeruginosa и S. aureus – K. pneumoniae также наблюдалась и после 4 ч воздействия бовгиалуронидазой азоксимер. Кроме того, при применении бовгиалуронидазы азоксимер повышалась эффективность различных противомикробных препаратов против бактерий, внедренных в биопленку. Эти данные указывают на то, что бовгиалуронидаза азоксимер разрушает структуру биопленки, облегчая проникновение противомикробных препаратов через биопленку, повышая их эффективность [38]. Эти свойства бовгиалуронидазы азоксимер в рамках комплексной терапии ХЭ позволят существенно увеличить биодоступность и эффективность других методов лечения (в частности АБ-терапии).
• Согласно результатам исследования В.Н. Локшина и соавт. (2023 г.), использование бовгиалуронидазы азоксимера в качестве компонента комплексной терапии ХЭ у женщин с повторными неудачами имплантации способствовало значимому редуцированию локальной воспалительной реакции с уменьшением среднего содержания CD138+ плазмоцитов в группе женщин, получавших бовгиалуронидазу азоксимер c клинически значимых 13 клеток на 10 hpf до 0,88 клетки на 10 hpf, что в сравнении с группой контроля (уменьшение с 16,4 до 6,48 клетки на 10 hpf) оказалось статистически достоверным (p<0,001). Кроме того, после проведенной терапии у пациенток отмечалось значимое повышение частоты наступления беременности после криопереноса (p<0,001) и частоты живорождения (p=0,008) [40].
Особую актуальность приобретают альтернативные методы коррекции ХЭ, включая физиотерапию и ферментную/антифиброзную терапию бовгиалуронидазой азоксимером (Лонгидаза). Оба метода лечения обладают патогенетически оправданным действием (за счет индукции механизмов саногенеза и снижения интенсивности фиброза) и способствуют эффективной регенерации эндометрия и восстановлению его гистоархитектоники.
Таким образом, на сегодняшний день антифиброзная терапия с использованием бовгиалуронидазы азоксимера (Лонгидаза) в комплексном лечении ХЭ является крайне актуальной, демонстрирует высокую клиническую эффективность в преодолении неудач имплантации у пациенток изучаемой когорты.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Радзинский Виктор Евсеевич – заслуженный деятель науки РФ, чл.-корр. РАН, д-р мед. наук, проф., зав. каф. акушерства
и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Viktor E. Radzinsky – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Долгов Евгений Денисович – клинический ординатор каф. акушерства и гинекологии с курсом перинатологии, Медицинского института, ФГАОУ ВО РУДН. E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Evgeny D. Dolgov – Clinical Resident, Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Поступила в редакцию: 19.03.2024
Поступила после рецензирования: 26.03.2024
Принята к публикации: 28.03.2024
Received: 19.03.2024
Revised: 26.03.2024
Accepted: 28.03.2024
Клинический разбор в общей медицине №3 2024
Хронический эндометрит на современном этапе: в фокусе внимания преодоление неудач имплантации
Номера страниц в выпуске:18-26
Аннотация
Хронический эндометрит «от патогенеза до терапии» по-прежнему остается самым контраверсионным вопросом современной гинекологии. Отсутствие единой патогенетической концепции, а также диагностических и лечебных алгоритмов продолжают поддерживать множество научных дискуссий вокруг этой уникальной нозологии. Латентные субклинические воспалительные изменения эндометрия ассоциированы с реализацией репродуктивных неудач, включая повторные неудачи имплантации и ранние репродуктивные потери. На сегодняшний день накоплено достаточное количество научных данных, демонстрирующих высокую эффективность и безопасность антифиброзной терапии с использованием бовгиалуронидазы азоксимера (Лонгидаза) в комплексном лечении хронического эндометрита.
Ключевые слова: хронический эндометрит, плазмоциты, гистероскопия, физиотерапия, ферментная терапия, антифиброзная терапия.
Для цитирования: Оразов М.Р., Радзинский В.Е., Долгов Е.Д. Хронический эндометрит на современном этапе: в фокусе внимания преодоление неудач имплантации. Клинический разбор в общей медицине. 2024; 5 (3): 18–26. DOI: 10.47407/kr2023.5.3.00370
Хронический эндометрит «от патогенеза до терапии» по-прежнему остается самым контраверсионным вопросом современной гинекологии. Отсутствие единой патогенетической концепции, а также диагностических и лечебных алгоритмов продолжают поддерживать множество научных дискуссий вокруг этой уникальной нозологии. Латентные субклинические воспалительные изменения эндометрия ассоциированы с реализацией репродуктивных неудач, включая повторные неудачи имплантации и ранние репродуктивные потери. На сегодняшний день накоплено достаточное количество научных данных, демонстрирующих высокую эффективность и безопасность антифиброзной терапии с использованием бовгиалуронидазы азоксимера (Лонгидаза) в комплексном лечении хронического эндометрита.
Ключевые слова: хронический эндометрит, плазмоциты, гистероскопия, физиотерапия, ферментная терапия, антифиброзная терапия.
Для цитирования: Оразов М.Р., Радзинский В.Е., Долгов Е.Д. Хронический эндометрит на современном этапе: в фокусе внимания преодоление неудач имплантации. Клинический разбор в общей медицине. 2024; 5 (3): 18–26. DOI: 10.47407/kr2023.5.3.00370
Chronic endometritis at present: focus on overcoming implantation failures
Mekan R. Orazov, Viktor E. Radzinsky, Evgeny D. DolgovPatrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia
omekan@mail.ru
Abstract
Chronic endometritis "from pathogenesis to therapy" still remains the most contrarian issue of modern gynaecology. The lack of a unified pathogenetic concept as well as diagnostic and therapeutic algorithms continue to support a multitude of scientific discussions around this unique nosology. Latent subclinical endometrial inflammatory changes are associated with the realization of reproductive failures, including repeated implantation failures and early reproductive losses. To date, a sufficient amount of scientific data has been accumulated demonstrating high efficacy and safety of antifibrotic therapy with the use of azoximer bovgialuronidase (Longidaza) in the complex treatment of chronic endometritis.
Keywords: chronic endometritis, plasmocytes, hysteroscopy, physiotherapy, enzyme therapy, antifibrotic therapy.
For citation: Orazov M.R., Radzinsky V.E., Dolgov E.D. Chronic endometritis at present: focus on overcoming implantation failures. Clinical review for general practice. 2024; 5 (3): 18–26. (In Russ.). DOI: 10.47407/kr2023.5.3.00370
Хронический эндометрит – нозология «без границ»
Репродуктивная медицина как наука на современном этапе демонстрирует чрезвычайно высокие темпы развития. Буквально за последние несколько лет продемонстрирован существенный скачок в понимании патогенеза многих нозологий, что позволило клиницистам более осознанно подходить к ведению пациенток с различными репродуктивными нарушениями. Однако нерушимым «столпом», покрытым невообразимым количеством тайн, остается «гинекологическое трио XXI в.»: эндометриоз, синдром поликистозных яичников и хронический эндометрит. В контексте данных нозологий следует акцентировать внимание на том, что «каждый новый шаг на пути к разгадке создает еще большее количество развилок».Но вместе с тем одним из неизученных до конца заболеваний современности остается хронический эндометрит (ХЭ). В современном понимании ХЭ – это латентное/малосимптомное воспалительное заболевание эндометрия чаще инфекционной этиологии, ассоциированное с нарушением ее архитектоники и рецептивности/селективности [1]. Безусловно, в самом определении ХЭ заключаются важные диагностические критерии, а именно клинический и хронологический. Но при этом все мировое гинекологическое сообщество задается вопросом: что значит латентное? Прежде всего, это связано с весьма нередким отсутствием классических признаков воспаления у пациенток данной когорты. И в таком случае единственной/частой проблемой, с которой женщина может обратиться к специалисту, становится маточный фактор бесплодия или неудачи имплантации в анамнезе.
Хронический эндометрит – «эпидемиологический ребус, патогенетическая тайна» неудач имплантации
На сегодняшний день отсутствуют унифицированные эпидемиологические данные о распространенности ХЭ. Согласно имеющимся данным, ХЭ диагностируется у 1/3 (30%) пациенток с привычным невынашиванием беременности. Однако, согласно данным других авторов, распространенность ХЭ в когорте пациенток с привычным невынашиванием и повторными неудачами имплантации достигает 67,5%. Важно отметить, что «от исследования к исследованию» данные существенно разнятся, что можно объяснить нечетко сформулированными диагностическими критериями, а также условиями взятия биоптата эндометрия [2–4]. Весьма неоднородными остаются данные о распространенности ХЭ у пациенток с бесплодием, согласно которым она варьирует от 2,8 до 30% [5]. При этом, согласно результатам исследования A. Vitagliano и соавт. (2022 г.), было доказано, что морфологически верифицированный ХЭ слабой выраженности не влияет на исходы ЭКО, но вместе с тем у пациенток с тяжелым/выраженным воспалительным поражением эндометрия отмечалось снижение частоты наступления клинической беременности (ОШ 0,4, p=0,0007) и живорождения (ОШ 0,43, p=0,003) [6].Однако наиболее интересными остаются данные о распространенности ХЭ в популяции. На настоящий момент отсутствует современная информация о частоте диагностирования ХЭ. При этом результаты исследования начала XXI в. свидетельствуют о том, что распространенность ХЭ в общей популяции достигает 10–11% [7]. Вместе с тем отмечается, что ХЭ верифицируется у 3–10% пациенток с аномальными маточными кровотечениями и до 72% женщин с воспалительными заболеваниями органов малого таза, вызванными инфекциями, передающимися половым путем [8].
Таким образом, важно резюмировать, что ХЭ – весьма «скрытный/недооцененный диагноз» с точки зрения эпидемиологических данных, что связано с рядом диагностических контраверсий, о которых мы упомянем несколько ниже. Однако наиболее интересным с научной точки зрения остается «нерешенный» вопрос этиопатогенетических основ заболевания. В этой связи необходимо отметить доказанные триггеры и механизмы развития ХЭ.
На сегодняшний день точка зрения относительно бактериальной колонизации полости матки кардинально изменилась. Если раньше исследователи полагали, что полость матки стерильна и данный факт является жесткой физиологической константой, то сегодня благодаря внедрению технологий секвенирования стало совершенно очевидно, что микробиом – необходимое звено в поддержании тканевого гомеостаза матки и ее защиты от внедрения патогенных микроорганизмов [9]. Безусловно, основным предполагаемым источником мигрирующих микроорганизмов в полости матки является влагалище. Эта гипотеза подтверждается в ходе сравнения качественного состава микробиома обоих локусов, которое демонстрирует значительные сходства. Согласно имеющимся данным, основным микробным представителем полости матки являются «полезные» лактобактерии (Lactobacillus iners и Lactobacillus crispatus), составляющие основу маточного биоценоза [10]. Однако кроме лактобацилл микробный пейзаж богат и другими представителями, такими как Bifidobacterium, Streptococcus, Prevotella, Gardnerella и др. [11, 12]. Вместе с тем, несмотря на наличие других микроорганизмов, абсолютное преобладание лактобактерий играет важную роль в поддержании колонизационной резистентности и стабильности микробиома. Продуцируемые лактобациллами локально-действующие факторы агрессии (молочная кислота, перекись водорода) угнетают избыточный рост патогенной и условно-патогенной микрофлоры и, соответственно, предотвращают развитие воспалительных изменений эндометрия (включая ХЭ). Однако революционная роль лактобактерий полости матки была продемонстрирована результатами международного исследования, согласно которым абсолютное численное преобладание (более 90%) лактобацилл в полости матки напрямую коррелировало с успешной имплантацией [13]. При этом в случае превалирования условно-патогенной микрофлоры, включая стрептококки и гарднереллы, вероятно ассоциировано с неудачами имплантации и более низкими показателями живорождения [11].
В связи со всем сказанным необходимо отметить результаты уникального исследования K. Vomstein и соавт. (2022 г.), «пролившего свет» на динамическую характеристику нормального микробиома полости матки (контрольная группа) и его сравнения с биоценозом у пациенток с повторными неудачами имплантации и привычным невынашиванием. Было доказано, что у пациенток контрольной группы отмечалось абсолютное преобладание лактобациллярной флоры на протяжении всего менструального цикла (фолликулярная фаза – 78,48%; овуляция и лютеиновая фаза – 66,67%). Кроме того, у пациенток без репродуктивных неудач в анамнезе отмечалось динамическое снижение численности пула лактобактерий, а также «пестроты» микробного пейзажа к лютеиновой фазе цикла (что вероятно ассоциировано с адекватной имплантацией бластоцисты). При этом у пациенток с повторными неудачами имплантации и привычным невынашиванием отмечался микробиологический «портрет», характеризующийся наоборот увеличением численности пула лактобактерий и пестроты видового состава микробиома к моменту овуляции и лютеиновой фазе (см. рисунок) [14]. Таким образом, авторы доказали существенную роль биоценоза в полости матки в реализации репродуктивных потерь. Однако в ходе исследования не проводилась оценка гистологической картины эндометрия, но, несмотря на это, можно предположить наличие признаков ХЭ у пациенток изучаемой когорты, поскольку ключевым морфологическим субстратом дисбиоза часто является именно воспалительная, пусть и клинически-латентная (субклиническое течение), инфильтрация ткани.

На сегодняшний день мировое медицинское сообщество в вопросе ХЭ разделилось на два основных «лагеря»: одни считают, что этиологической основой заболевания является прямое воздействие инфекта на эндометрий, а другие полагают, что ХЭ – результат персистирующего аномального воспалительного ответа, однажды спровоцированного инфекционным агентом. И здесь необходимо отметить всю важность данной полемики, поскольку принятие той или иной стороны клиницистом играет ведущую роль в определении тактики ведения пациенток данной когорты. Однако вторая точка зрения является наиболее патогенетически оправданной, поскольку воспалительный процесс, индуцированный «сиюминутно» в ходе прямого воздействия инфекта, «не терпит полумер» и по сути является острым эндометритом с характерной клинической симптоматикой. Вместе с тем острый эпизод может стать отправной точкой для ХЭ, поскольку он служит началом для «порочного круга» аномального персистирующего воспаления, постепенно «набирающего обороты», что на настоящий момент уже доказано [15, 16, 20].
Основным морфологическим субстратом ХЭ является воспалительная инфильтрация ткани и гиперпродукция провоспалительных цитокинов. Так, у пациенток с ХЭ отмечается значительное повышение содержания цитотоксических Т-лимфоцитов (CD-8), В-лимфоцитов (CD-20) и плазмоцитов (CD-138), гиперэкспрессия интерлейкина (ИЛ) 6, ИЛ-1β и фактора некроза опухоли (ФНО) α, а также дисбаланс Т-хелперов 1-го и 2-го типов [17–19]. Кроме того, у пациенток данной когорты отмечается снижение экспрессии противовоспалительного цитокина – ИЛ-11, способствующего «адекватной» или полноценной имплантации плодного яйца. Супрессия данного медиатора нарушает ключевые процессы децидуализации эндометрия и, как следствие, способствует реализации ряда репродуктивных неудач, включая повторные неудачи имплантации и привычное невынашивание [21].
Таким образом, необходимо резюмировать, что ХЭ по своей сути является типичным примером персистирующего аномального воспаления, которое реализуется после взаимодействия инфекта (или группы микроорганизмов) с toll-подобными рецепторами эндометрия. И в этой связи становится очевидно, что борьба с причинным микроорганизмом не является состоятельной с точки зрения эффективности. Наша ключевая цель – прерывание этой порочной цепочки. Однако об этом несколько позже.
Диагностика хронического эндометрита: на ринге контраверсий
Одним из наиболее контраверсионных вопросов в рамках обсуждаемой нозологии является его диагностический алгоритм, который до сих пор разнится от исследования к исследованию. Несмотря на это, на настоящий момент «золотым стандартом» диагностики ХЭ является морфологическое исследование с обнаружением плазматических клеток (CD-138+) в материалах, полученных в ходе гистероскопии и прицельной биопсии эндометрия [22].И здесь мы подошли к обсуждению самого спорного вопроса, к консенсусу, в котором медицинское сообщество до сих пор не пришло к единому мнению: какое количество обнаруженных клеток CD-138+ необходимо для верификации болезни? В данном контексте необходимо отметить результаты метаанализа A. Santoro и соавт. (2023 г.), в котором авторам удалось установить взаимосвязь между репродуктивными неудачами и определенным числом плазмоцитов в исследуемых образцах эндометрия. Так, было доказано, что обнаружение 5 и более плазмоцитов в 10 полях зрения при максимальном увеличении ассоциировано с развитием имплантационных неудач у пациенток, страдающих ХЭ (p=0,007). При этом обнаружение менее 5 клеток в образце ткани не имело клинической значимости [23]. Исходя из этого, важно отметить, что на сегодняшний день определено число плазмоцитов, свидетельствующих о наличии ХЭ. Однако по-прежнему мы рекомендуем проводить комплексный диагностический алгоритм, объединяющий оценку клинико-анамнестических данных и гистологическую верификацию.
Как мы отметили, клиническая картина у пациенток с ХЭ может и вовсе отсутствовать, или иметь малосимптомное течение. Однако, согласно имеющимся данным, ХЭ может манифестировать аномальными маточными кровотечениями, диспареунией, тазовой болью, а также обильными выделениями из половых путей. При этом ключевыми анамнестическими уточнениями, способными «повернуть» диагностический поиск в правильную/нужную сторону, является наличие репродуктивных неудач, а именно повторных неудач имплантации или привычного невынашивания беременности [21]. В этой связи важно отметить, что у пациенток с перечисленными жалобами следует морфологически верифицировать ХЭ.
Вместе с тем, кроме перечисленных подходов к верификации ХЭ, большое внимание уделяется визуализационным методам, а именно гистероскопии. На сегодняшний день сформулированы ключевые гистероскопические признаки ХЭ [24, 25]:
• микрополипы эндометрия (до 1–2 мм);
• локальная или диффузная гиперемия эндометрия;
• стромальный отек, вызывающий утолщение и побледнение эндометрия в фолликулярной фазе менструального цикла вместо секреторной.
Согласно имеющимся результатам, наличие микрополипов эндометрия является патогномоничным диагностическим критерием ХЭ. Обнаружение данных структур в ходе гистероскопии позволяет повышать диагностику ХЭ с точностью до 93,4% [25].
Исходя из всего сказанного, необходимо отметить, что диагностический поиск ХЭ должен осуществляться комплексно и включать оценку клинико-анамнестических данных, визуализационный/гистероскопический контроль, а также гистологическое исследование с определением числа плазматических клеток.
Современные возможности терапии хронического эндометрита
На сегодняшний день, согласно международным рекомендациям, основой терапии ХЭ остается антибактериальная терапия, что, конечно же, является весьма контраверсионным [24]. Как мы отметили, ХЭ – это персистирующий аномальный воспалительный процесс в базальном эндометриальном компартменте. И данная точка зрения принята большинством исследователей. Необходимо отметить, что этиотропная терапия является оптимальной в контексте доказанного или потенциально значимого возбудителя. В контексте использования антибактериальной терапии в лечении ХЭ при отсутствии доказанного или потенциально значимого возбудителя можно применить весьма колкую и вместе с тем актуальную пословицу: «после драки кулаками не машут». Действительно, когда патогенный микроорганизм или их ассоциация «прореагировали» с рецепторами на поверхности клеток эндометрия, порочный круг патогенеза уже запущен и его не остановить. Более того, логические размышления об актуальности АБ-терапии ХЭ могут привести к весьма интересной мысли о том, что нередко ХЭ является прямым продолжением острого эпизода, лечение которого без антибиотиков не обходится. И в этой связи становится совершенно очевидно, что дополнительная АБ-терапия латентного персистирующего аномального воспаления, уже никак не связанного с динамическим воздействием инфекта, не приведет ни к чему, кроме негативных иммуносупрессивных побочных эффектов и антибиотикорезистентности. Но, несмотря на все сказанное, на просторах международных научных баз данных фигурирует немало исследований, доказывающих высокую эффективность антибактериальной терапии в лечении ХЭ. Но здесь возникает большой вопрос: а хронический эндометрит ли это вовсе? с доказанным или потенциально значимым инфектом? Наличие клинической симптоматики и положительный эффект от использования антибиотиков может направлять лишь на мысль о наличии абортивной или латентной формы острого эндометрита. И, конечно же, данный факт является прямым результатом отсутствия четко сформулированных диагностических критериев ХЭ, а обнаружение плазмоцитов в биоптате, в свою очередь, может отмечаться при острой форме заболевания. Использование описанного комплексного алгоритма позволит разграничить две такие похожие и одновременное такие разные с патогенетической точки зрения нозологии и выбрать верный терапевтический алгоритм. В качестве демонстрации контраверсионности АБ-терапии у пациенток с ХЭ мы представляем сводку имеющихся противоречивых результатов данного метода лечения (см. таблицу).Таким образом, необходимо отметить, что антибактериальная терапия в рамках лечения ХЭ (при отсутствии доказанного или потенциально значимого возбудителя) не является оправданной как с клинической, так и с патогенетической точки зрения. Имеющиеся результаты научных исследований демонстрируют выраженную гетерогенность полученных данных и не позволяют сделать конкретных клинических выводов. В этой связи важно резюмировать, что АБ-терапия ХЭ актуальна лишь при условии обнаружения конкретного (доказанного или потенциально значимого) инфекта. Исходя из этого, важно рассмотреть другие патогенетически оправданные методы терапии ХЭ.

На сегодняшний день в арсенале клинициста имеются альтернативные и патогенетически оправданные методы лечения ХЭ, к которым относят физиотерапию и ферментную/антифиброзную терапию.
К современным методам физиотерапии ХЭ относят ультразвуковую, внутриполостную фотодинамическую терапию, а также электромагнитное лечение и импульсную электротерапию. Так, УЗ-кавитация полости матки позволяет достичь противовоспалительного и иммуномодулирующего эффектов, тем самым блокируя ключевые патогенетические звенья развития ХЭ [31]. Инфракрасное лазерное ремоделирование за счет своего термального воздействия и локального «прогревания» тканей стимулирует процессы ангиогенеза и регенерации эндометрия, способствуя восстановлению его гистоархитектоники и имплантационной состоятельности [32]. Аналогичным эффектом обладает электроимпульсная терапия (ЭИТ), стимулирующая ангиогенез и улучшающая перфузионные показатели в ткани. Кроме того, ЭИТ стимулирует пролиферативные и регенераторные показатели эндометрия за счет повышения экспрессии трансформирующего и эпидермального факторов роста, что было доказано результатами исследования отечественных коллег [31].
Таким образом, физиотерапия демонстрирует ряд клинически и патогенетически оправданных саногенетических эффектов в контексте терапии ХЭ. Бережное и контролируемое воздействие физических факторов способствует восстановлению гистоархитектоники эндометрия и одновременно предотвращает развитие ряда негативных побочных эффектов, ассоциированных с фибропластическими изменениями.
Однако наиболее интересной и консервативной методикой лечения ХЭ является использование антифиброзной ферментной терапии. Ключевое обоснование актуальности антифиброзной терапии ХЭ кроется в патогенезе самого заболевания. Ключевые паттерны воспалительного процесса стимулируют дифференцировку фибробластов и, соответственно, избыточную продукцию коллагеновых волокон в строме, что приводит к фиброзным изменениям эндометрия и развитию его имплантационной несостоятельности [33, 34]. Более того, длительно существующие фиброзные изменения тканей постепенно становятся необратимыми, что может стать причиной резистентного к любым воздействиям «гипопластичного эндометрия» и способствовать формированию стойкого маточного фактора инфертильности и невынашивания беременности. Именно поэтому антифиброзная и противовоспалительная терапия является патогенетически оправданной и может использоваться в рамках комбинированного лечения ХЭ. В РФ зарегистрирован препарат бовгиалуронидазы азоксимера (Лонгидаза), обладающий выраженным антифиброзным эффектом за счет деполимеризации коллагеновых волокон, который может легитимно использоваться в рамках действующей инструкции по применению для комплексной терапии ХЭ. Кроме того, данный препарат обладает выраженным противовоспалительным эффектом за счет снижения выработки ключевых провоспалительных цитокинов (ИЛ-1, ФНО-α) [39].
Исходя из всего сказанного, необходимо рассмотреть имеющиеся результаты клинического использования антифиброзной терапии бовгиалуронидазой азоксимером (Лонгидаза) в рамках комплексного лечения ХЭ.
• По данным Н.И. Тапильской и др. (2020 г.), использование бовгиалуронидазы азоксимера в комплексной терапии ХЭ способствует купированию интенсивного воспалительного процесса (элиминация плазматических клеток) и фиброзных изменений в эндометрии. Исследователями было установлено, что после антибактериальной терапии ХЭ с использованием трех курсов Лонгидазы частота выявления микроорганизмов в полости матки существенно снизилась: Staphyloсoccus spp. – на 25%, Ente-robacteriaceae spp. – на 18%, Streptococcus spp. – на 40%, Gardenerella vaginalis – на 22% и Bacteroides spp. – на 17% (p<0,05). Вместе с тем авторами был доказан позитивный клинический эффект, связанный с успешным наступлением беременности у трех пациенток изучаемой когорты. Таким образом, следует подчеркнуть, что использование бовгиалуронидазы азоксимера в комплексе с антибактериальными препаратами способствовало снижению частоты бактериальной контаминации полости матки и повышению эффективности терапии ХЭ [35].
• По данным Э.В. Вартанян и соавт. (2018 г.), использование бовгиалуронидазы азоксимера в рамках комплексной терапии ХЭ способствовало значимому увеличению толщины эндометрия, а также нормализации перфузионных показателей и рецептивного профиля ткани. После проведенного лечения у 50% пациенток полностью купировались клинико-морфологические паттерны ХЭ, а у 57,1% женщин отмечалось наступление спонтанной беременности [36].
• По данным В.Е. Балан и соавт. (2014 г.), использование бовгиалуронидазы азоксимера в составе комплексной терапии ХЭ способствует повышению эффективности сопутствующих методов лечения в связи с ремоделированием эндометрия и нормализацией его гистоархитектоники [37].
• По данным исследования E. Trizna и соавт. (2021 г.), бовгиалуронидаза азоксимер разрушает как моно-, так и двухвидовые биопленки, образуемые различными бактериями. После 4-часовой обработки 750 ME фермента остаточные биопленки Staphylococcus aureus, Enterococcus faecalis, Escherichia coli, Klebsiella pneumonie сохранили около 50% от их первоначальной массы. Биомасса двухвидовых биопленок, образованных этими четырьмя видами, была уменьшена в 1,5 раза после 24-часовой обработки, в то время как значительное разрушение S. aureus – P. aeruginosa и S. aureus – K. pneumoniae также наблюдалась и после 4 ч воздействия бовгиалуронидазой азоксимер. Кроме того, при применении бовгиалуронидазы азоксимер повышалась эффективность различных противомикробных препаратов против бактерий, внедренных в биопленку. Эти данные указывают на то, что бовгиалуронидаза азоксимер разрушает структуру биопленки, облегчая проникновение противомикробных препаратов через биопленку, повышая их эффективность [38]. Эти свойства бовгиалуронидазы азоксимер в рамках комплексной терапии ХЭ позволят существенно увеличить биодоступность и эффективность других методов лечения (в частности АБ-терапии).
• Согласно результатам исследования В.Н. Локшина и соавт. (2023 г.), использование бовгиалуронидазы азоксимера в качестве компонента комплексной терапии ХЭ у женщин с повторными неудачами имплантации способствовало значимому редуцированию локальной воспалительной реакции с уменьшением среднего содержания CD138+ плазмоцитов в группе женщин, получавших бовгиалуронидазу азоксимер c клинически значимых 13 клеток на 10 hpf до 0,88 клетки на 10 hpf, что в сравнении с группой контроля (уменьшение с 16,4 до 6,48 клетки на 10 hpf) оказалось статистически достоверным (p<0,001). Кроме того, после проведенной терапии у пациенток отмечалось значимое повышение частоты наступления беременности после криопереноса (p<0,001) и частоты живорождения (p=0,008) [40].
Заключение
Таким образом, важно резюмировать, что ХЭ «от патогенеза до терапии» по-прежнему остается наиболее контраверсионным вопросом современной гинекологии. В основе патогенеза ХЭ лежит дисбиоз полости матки с последующей реализацией ключевых воспалительных каскадов. Не менее важным является отсутствие унифицированного диагностического алгоритма ХЭ. При этом следует помнить о том, что гистероскопия с прицельной биопсией и последующим морфологическим исследованием эндометрия повышает диагностическую информативность ХЭ.Особую актуальность приобретают альтернативные методы коррекции ХЭ, включая физиотерапию и ферментную/антифиброзную терапию бовгиалуронидазой азоксимером (Лонгидаза). Оба метода лечения обладают патогенетически оправданным действием (за счет индукции механизмов саногенеза и снижения интенсивности фиброза) и способствуют эффективной регенерации эндометрия и восстановлению его гистоархитектоники.
Таким образом, на сегодняшний день антифиброзная терапия с использованием бовгиалуронидазы азоксимера (Лонгидаза) в комплексном лечении ХЭ является крайне актуальной, демонстрирует высокую клиническую эффективность в преодолении неудач имплантации у пациенток изучаемой когорты.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Оразов Мекан Рахимбердыевич – д-р мед. наук, проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: omekan@mail.ru;
ORCID: 0000-0002-5342-8129
Mekan R. Orazov – Dr. Sci. (Med.), Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: omekan@mail.ru; ORCID: 0000-0002-5342-8129
Радзинский Виктор Евсеевич – заслуженный деятель науки РФ, чл.-корр. РАН, д-р мед. наук, проф., зав. каф. акушерства
и гинекологии с курсом перинатологии Медицинского института, ФГАОУ ВО РУДН. E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Viktor E. Radzinsky – Honored Scientist of the Russian Federation, Corr. Memb. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University). E-mail: radzinsky@mail.ru;
ORCID: 0000-0002-7428-0469
Долгов Евгений Денисович – клинический ординатор каф. акушерства и гинекологии с курсом перинатологии, Медицинского института, ФГАОУ ВО РУДН. E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Evgeny D. Dolgov – Clinical Resident, Patrice Lumumba People’s Friendship University of Russia (RUDN University).
E-mail: 1586dolgde@gmail.com;
ORCID: 0000-0001-6709-5209
Поступила в редакцию: 19.03.2024
Поступила после рецензирования: 26.03.2024
Принята к публикации: 28.03.2024
Received: 19.03.2024
Revised: 26.03.2024
Accepted: 28.03.2024
Список исп. литературыСкрыть список1. Ravel J, Moreno I, Simón C. Bacterial vaginosis and its association with infertility, endometritis, and pelvic inflammatory disease. Am J Obstet Gynecol. 2021;224(3):251-57.
2. Pirtea P, Cicinelli E, De Nola R et al. Endometrial causes of recurrent pregnancy losses: endometriosis, adenomyosis, and chronic endometritis. Fertil Steril. 2021;115(3):546-60.
3. Song D, Feng X, Zhang Q et al. Prevalence and confounders of chronic endometritis in premenopausal women with abnormal bleeding or reproductive failure. Reprod Biomed Online. 2018;36(1):78-83.
4. Kimura F, Takebayashi A, Ishida M et al. Review: Chronic endometritis and its effect on reproduction [J]. J Obstet Gynaecol Res. 2019;45(5):951–60.
5. Kitaya K, Takeuchi T, Mizuta S et al. Endometritis: new time, new concepts [J]. Fertil Steril. 2018;110(3):344–50.
6. Vitagliano A, Laganà AS, De Ziegler D et al. Chronic Endometritis in Infertile Women: Impact of Untreated Disease, Plasma Cell Count and Antibiotic Therapy on IVF Outcome-A Systematic Review and Meta-Analysis. Diagnostics (Basel). 2022;12(9):2250.
7. Polisseni F, Bambirra EA, Camargos AF. Detection of chronic endometritis by diagnostic hysteroscopy in asymptomatic infertile patients. Gynecol Obstet Invest. 2003;55(4):205-10.
8. Puente E, Alonso L, Laganà AS, et al. Chronic endometritis: old problem, novel insights and future challenges. Int J Fertil Steril. 2020;13(4):250.
9. Moreno I, Franasiak JM. Endometrial microbiota – new player in town. Fertil Steril. 2017;108(1):32-9.
10. Mitchell CM, Haick A, Nkwopara E et al. Colonization of the upper genital tract by vaginal bacterial species in nonpregnant women. Am J Obstetric Gynecol. 2015;212(5):611-e1.
11. Moreno I, Codoñer FM, Vilella F et al. Evidence that the endometrial microbiota has an effect on implantation success or failure. Am J Obstetric Gynecol. 2016;215(6):684-703.
12. Carosso A, Revelli A, Gennarelli G et al. Controlled ovarian stimulation and progesterone supplementation affect vaginal and endometrial microbiota in IVF cycles: a pilot study. J Assisted Reproduc Genetic. 2020;37:2315-26.
13. Petrova MI, Lievens E, Malik S et al. Lactobacillus species as biomarkers and agents that can promote various aspects of vaginal health. Frontiers in Physiology. 2015;(6):129628.
14. Vomstein K, Reider S, Böttcher B et al. Uterine microbiota plasticity during the menstrual cycle: Differences between healthy controls and patients with recurrent miscarriage or implantation failure. Journal of Reproductive Immunology. 2022;151:103634.
15. Gkrozou F, Tsonis O, Dimitriou E, Paschopoulos M. In women with chronic or subclinical endometritis is hysteroscopy suitable for setting the diagnosis? A systematic review. J Obstet Gynaecol Res. 2020;46(9):1639-50. DOI: 10.1111/jog.14360
16. Wiesenfeld HC, Sweet RL, Ness RB et al. Comparison of acute and subclinical pelvis inflammatory disease. Sex Trasm Dis. 2005;32(7):400-5. DOI: 10.1097/01.olq.0000154508.26532.6a
17. Дикке Г.Б., Остроменский В.В. Нарушение иммунного статуса при хроническом эндометрите и опыт его коррекции посредством локальной цитокинотерапии. Акушерство и гинекология. 2019;(9):139-46. DOI: 10.18565/aig.2019.9.139-146
Dicke G.B., Ostromensky V.V. Violation of the immune status in chronic endometritis and the experience of its correction through local cytokinotherapy. Obstetrics and gynecology. 2019;(9):139-46. DOI: 10.18565/aig.2019.9.139-46 (in Russian).
18. Толибова Г.Х., Траль Т.Г, Клещев М.А. и др. Эндометриальная дисфункция: алгоритм гистологического и иммуногистохимического исследования. Журнал акушерства и женских болезней. 2015;64(4):69-77.
Tolibova G.H., Tral T.G., Kleshchev M.A. et al. Endometrial dysfunction: an algorithm for histological and immunohistochemical examination. Journal of Obstetrics and Women’s Diseases. 2015;64(4):69-7 (in Russian).
19. Li Y, Yu S, Huang C et al. Evaluation of peripheral and uterine immune status of chronic endometritis in patients with recurrent reproductive failure. Fertil Steril. 2020;113(1):187-96.e1. DOI: 10.1016/j. fertnstert. 2019.09.001
20. Галкина Д.Е., Макаренко Т.А. Современные представления об этиологии патогенетических механизмов хронического эндометрита. Акушерство, Гинекология и Репродукция. 2023;17(1):115-26. DOI: 10.17749/2313- 7347/ob.gyn.rep.2023.362
Galkina D.E., Makarenko T.A. Modern ideas about the etiology of pathogenetic mechanisms of chronic endometritis. Obstetrics, Gynecology and Reproduction. 2023;17(1):115-26. DOI: 10.17749/2313- 7347/ob.gyn.rep.2023.362 (in Russian).
21. Buzzaccarini G, Vitagliano A, Andrisani A et al. Chronic endometritis and altered embryo implantation: a unified pathophysiological theory from a literature systematic review. J Assist Reprod Genet. 2020;37(12)2897-911. DOI: 10.1007/s10815-020-01955-8
22. Huang W, Liu B, He Y et al. Variation of diagnostic criteria in women with chronic endometritis and its effect on reproductive outcomes: A systematic review and meta-analysis. J Reprod Immunol. 2020;140:103146. DOI: 10.1016/j.jri.2020.103146
23. Santoro A, Travaglino A, Inzani F et al. The role of plasma cells as a marker of chronic endometritis: a systematic review and meta-analysis. Biomedicines.2023;11(6):1714.
24. Taylor M, Jenkins SM, Pillarisetty LS. Endometritis. [Updated 2023 Oct 26]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-.
25. Puente E, Alonso L, Laganà AS et al. Chronic endometritis: old problem, novel insights and future challenges. Int J Fertil Steril. 2020;13(4):250.
26. Song D, He Y, Wang Y et al. Impact of antibiotic therapy on the rate of negative test results for chronic endometritis: a prospective randomized control trial. Fertil Steril. 2021;115(6):1549-56. DOI: 10.1016/j.fertnstert.2020.12.019
27. Cicinelli E, Resta L, Loizzi V et al. Antibiotic therapy versus no treatment for chronic endometritis: a case-control study. Fertil Steril. 2021;115(6):1541-8. DOI: 10.1016/j.fertnstert.2021.01.018
28. Duan H, Li X, Hao Y et al. Risk of spontaneous abortion after antibiotic therapy for chronic endometritis before in vitro fertilization and intracytoplasmic sperm injection stimulation. Fertil Steril. 2022;118(2):337-46. DOI: 10.1016/j.fertnstert.2022.04.026
29. Cheng X, Huang Z, Xiao Z, Bai Y. Does antibiotic therapy for chronic endometritis improve clinical outcomes of patients with recurrent implantation failure in subsequent IVF cycles? A systematic review and meta-analysis. J Assist Reprod Genet. 2022;39(8):1797-813. DOI: 10.1007/s10815-022-02558-1
30. Kitaya K, Yasuo T. Commonalities and Disparities between Endometriosis and Chronic Endometritis: Therapeutic Potential of Novel Antibiotic Treatment Strategy against Ectopic Endometrium. International Journal of Molecular Sciences. 2023;24(3):2059.
31. Оразов М.Р., Силантьева Е.С., Орехов Р.Е. и др. Повторные неудачи имплантации: этиология и возможности физиотерапии. Трудный пациент. 2020;18(8-9):20-4. DOI:10. 24411/2074-1995-2020-10055
Orazov M.R., Silantieva E.S., Orekhov R.E. et al. Repeated Implantation Failures: Etiology And Physiotherapy Possibilities. Difficult Patient. 2020;18(8-9):20-4. DOI:10. 24411/2074-1995-2020-10055 (in Russian).
32. Зиновьева О.С., Мотовилова Т.М., Качалина Т.С. и др. Влияние сочетанной плацентарной терапии и инфракрасного спектра лазера на гемодинамические нарушения в гипопластичном эндометрии. Медицинский альманах. 2018;6(57):94-7. DOI: 10.21145/2499-9954-2018-6-94-97
Zinovieva O.S., Motovilova T.M., Kachalina T.S. et al. The effect of combined placental therapy and infrared laser spectrum on hemodynamic disorders in hypoplastic endometrium. Medical Almanac. 2018;6(57):94-7. DOI:10.21145/2499-9954-2018-6-94-97 (in Russian).
33. Liu L, Yang H, Guo Y et al. The impact of chronic endometritis on endometrial fibrosis and reproductive prognosis in patients with moderate and severe intrauterine adhesions: a prospective cohort study. Fertil Steril. 2019;111(5):1002-10.e2. DOI: 10.1016/j.fertnstert.2019. 01.006
34. de Ziegler D, Pirtea P, Ayoubi JM. Inflammation and uterine fibrosis: the possible role of chronic endometritis. Fertil Steril. 2019;111(5):890-1. DOI: 10.1016/j.fertnstert.2019.02.005
35. Тапильская Н.И., Савичева А.М., Шалепо К.В., Копылова А.А. Опыт леченияхронического эндометрита. Гинекология. 2020;22(4):68-70. DOI: 10.26442/20795696.2020.4.200312
Tapilskaya NI, Savicheva AM, Shalepo KV, Kopylova A.A. Experience in the treatment of chronic endometritis. Gynecology. 2020;22(4):68-70. DOI: 10.26442/20795696.2020.4.200312 (in Russian).
36. Вартанян Э.В., Девятова Е.А., Цатурова К.А., Аглямова Д.Р. Роль системной терапии при бесплодии и неудачах реализации репродуктивной функции. Акушерство, гинекологияи репродукция. 2018;12(1):5-16. DOI: 10.17749/2313-7347.2018.12.1. 005-015
Vartanyan E.V., Devyatova E.A., Tsaturova K.A., Aglyamova D.R. Role of combined therapy in the treatment of patients with infertility and reproductive failures. Obstetrics, Gynecology and Reproduction. 2018;12(1):5-16. DOI: 10.17749/2313-7347.2018.12.1.005-015 (in Russian).
37. Балан В.Е., Журавель А.С. Возможности применения препаратов, содержащих гиалуроновую кислоту, в гинекологии. Эффективная фармакотерапия. 2014 (23):50-4.
Balan V.E., Zhuravel A.S. The possibilities of using drugs containing hyaluronic acid in gynecology. Effective pharmacotherapy. 2014 (23):50-4 (in Russian).
38. Trizna E et al. Improving the efficacy of antimicrobials against biofilm-embedded bacteria using bovine hyaluronidase azoximer (Longidaza®). Pharmaceutics. 2021;13(11):1740.
39. Оразов М.Р., Михалева Л.М., Исмаилзаде С.Я. и др. Внутриматочные синехии и хронический эндометрит – есть ли причинно-следственная связь? Гинекология. 2022;24(2):144-9. DOI: 10.26442/20795696.2022.2.201417
Orazov M.R., Mikhaleva L.M., Ismailzade S.Ya. et al. Intrauterine synechiae and chronic endometritis – is there a causal relationship? Gynecology. 2022;24(2):144-9. DOI: 10.26442/20795696.2022.2. 201417 (in Russian).
40. Локшин В.Н., Аскар Е., Рыбина А.Н. и др. Опыт применения бовгиалуронидазы азоксимера в комплексном лечении хронического эндометрита у женщин с повторными неудачами имплантации. Акушерство и гинекология. 2023. DOI: 10.18565/aig.2023.119
Lokshin V.N., Askar E., Rybina A.N. et al. The experience of using azoximer hyaluronidase in the complex treatment of chronic endometritis in women with repeated implantation failures. Obstetrics and Gynecology. 2023. DOI: 10.18565/aig.2023.119 (in Russian).


