Клинический разбор в общей медицине №3 2024
Клинический разбор в общей медицине №3 2024
Троспия хлорид у детей: динамика симптома остаточной мочи при коррекции расстройств мочеиспускания
Номера страниц в выпуске:99-104
Аннотация
Введение. Среди нарушений мочеиспусканий у детей значительное место занимает гиперактивный мочевой пузырь. Лечение направлено на угнетение гиперактивных сокращений детрузора, для этих целей используют препараты группы м-холинолитиков. К побочным эффектам лечения относят затрудненное мочеиспускание, неполное опорожнение мочевого пузыря (остаточная моча) и острая задержка мочи.
Материалы и методы. Под нашим наблюдением находились 20 детей от 5 до 15 лет, из них 12 мальчиков и 8 девочек. Средний возраст составил (М±δ) 8,47±3,46. При проведении двухсуточного урофлоуметрического мониторинга у 9 пациентов выявлена остаточная моча (от 1 до 15 раз за мониторинг). Показатели объемов и скоростей мочеиспускания, а также остаточную мочу оценивали методом урофлоуметрического мониторинга на домашнем приборе урофлоуметр УФМ «СИГМА», вариант F (регистрационное удостоверение РЗН №2020/11522 от 05.08.2020). Одним из компонентов комплексной терапии был троспия хлорид (Спазмекс®) в дозировке от 10 до 15 мг/сут, в зависимости от возраста и патологии. Статистическая обработка материалов производилась с помощью программного обеспечения Statistica 10 (StatSoft, Inc., США) и Excel (Microsoft Office 2016). Различия считали статистически значимыми при p<0,05. Дескриптивные статистики в тексте представлены как М±δ (где М – среднее, δ – стандартное отклонение).
Результаты. Среднеэффективный объем мочеиспусканий в группе, по сравнению с возрастной нормой, был снижен от 10% до 86,5%. Кроме того, у 9 пациентов отмечено неполное опорожнение мочевого пузыря. После проведенной терапии существенно увеличились показатели минимального объема мочеиспусканий и максимальной скорости потока мочи, а также снизился показатель частоты мочеиспусканий. Объемы мочеиспускания (средний и максимальный) значимо не изменились, но имела место тенденция к их увеличению. При назначении троспия хлорида не выявлено увеличения случаев остаточной мочи. Мало того, зафиксировано их снижение.
Заключение. Расстройства микционного цикла у детей, кроме прочих, включает симптом остаточной мочи. Препарат из группы
м-холинолитиков троспия хлорид (Спазмекс®), в суточной дозировке 10–15 мг, является безопасным эффективными вариантом лекарственного воздействия. Терапия длительностью до 2 мес статистически значимо приводит к увеличению показателей минимального объема мочевого пузыря и максимальной скорости потока мочи, уменьшению выраженности поллакиурии, но при этом не меняет частоту и количество остаточной мочи.
Ключевые слова: дисфункции мочеиспускания, дети, урофлоуметрия, урофлоумониторинг, троспия хлорид, остаточная моча.
Для цитирования: Данилов В.В., Головина О.Б., Данилов В.В. Троспия хлорид у детей: динамика симптома остаточной мочи при коррекции расстройств мочеиспускания. Клинический разбор в общей медицине. 2024; 5 (3): 99–104. DOI: 10.47407/kr2023.5.3.00367
Введение. Среди нарушений мочеиспусканий у детей значительное место занимает гиперактивный мочевой пузырь. Лечение направлено на угнетение гиперактивных сокращений детрузора, для этих целей используют препараты группы м-холинолитиков. К побочным эффектам лечения относят затрудненное мочеиспускание, неполное опорожнение мочевого пузыря (остаточная моча) и острая задержка мочи.
Материалы и методы. Под нашим наблюдением находились 20 детей от 5 до 15 лет, из них 12 мальчиков и 8 девочек. Средний возраст составил (М±δ) 8,47±3,46. При проведении двухсуточного урофлоуметрического мониторинга у 9 пациентов выявлена остаточная моча (от 1 до 15 раз за мониторинг). Показатели объемов и скоростей мочеиспускания, а также остаточную мочу оценивали методом урофлоуметрического мониторинга на домашнем приборе урофлоуметр УФМ «СИГМА», вариант F (регистрационное удостоверение РЗН №2020/11522 от 05.08.2020). Одним из компонентов комплексной терапии был троспия хлорид (Спазмекс®) в дозировке от 10 до 15 мг/сут, в зависимости от возраста и патологии. Статистическая обработка материалов производилась с помощью программного обеспечения Statistica 10 (StatSoft, Inc., США) и Excel (Microsoft Office 2016). Различия считали статистически значимыми при p<0,05. Дескриптивные статистики в тексте представлены как М±δ (где М – среднее, δ – стандартное отклонение).
Результаты. Среднеэффективный объем мочеиспусканий в группе, по сравнению с возрастной нормой, был снижен от 10% до 86,5%. Кроме того, у 9 пациентов отмечено неполное опорожнение мочевого пузыря. После проведенной терапии существенно увеличились показатели минимального объема мочеиспусканий и максимальной скорости потока мочи, а также снизился показатель частоты мочеиспусканий. Объемы мочеиспускания (средний и максимальный) значимо не изменились, но имела место тенденция к их увеличению. При назначении троспия хлорида не выявлено увеличения случаев остаточной мочи. Мало того, зафиксировано их снижение.
Заключение. Расстройства микционного цикла у детей, кроме прочих, включает симптом остаточной мочи. Препарат из группы
м-холинолитиков троспия хлорид (Спазмекс®), в суточной дозировке 10–15 мг, является безопасным эффективными вариантом лекарственного воздействия. Терапия длительностью до 2 мес статистически значимо приводит к увеличению показателей минимального объема мочевого пузыря и максимальной скорости потока мочи, уменьшению выраженности поллакиурии, но при этом не меняет частоту и количество остаточной мочи.
Ключевые слова: дисфункции мочеиспускания, дети, урофлоуметрия, урофлоумониторинг, троспия хлорид, остаточная моча.
Для цитирования: Данилов В.В., Головина О.Б., Данилов В.В. Троспия хлорид у детей: динамика симптома остаточной мочи при коррекции расстройств мочеиспускания. Клинический разбор в общей медицине. 2024; 5 (3): 99–104. DOI: 10.47407/kr2023.5.3.00367
Original article
1 Pacific State Medical University, Vladivostok, Russia;
2 “Alenka” Medical Center, Vladivostok, Russia;
3 Far Eastern Federal University, Vladivostok, Russia
olesya_golovina@mail.ru
Abstract
Background. A significant place among pediatric urination disorders is occupied by overactive bladder (OAB). Treatment involving the use of M-anticholinergics is aimed to suppress detrusor overactivity. The side effects of treatment include urination problems, incomplete bladder emptying (residual urine), and acute urinary retention. Methods. We monitored 20 children aged 5–15 years, among them 12 boys and 8 girls. The average age (М±δ) was 8.47 ± 3.46 years. The 2-day uroflow monitoring revealed residual urine (RU) in 9 patients (1–15 times per monitoring period). The urination volume and rate, as well as RU, were assessed by uroflow monitoring conducted at home using the SIGMA F uroflowmeter (RZN registration certificate No. 2020/11522 of 5.08.2020). One of the components of combination therapy was trospium chloride (Spasmex) in a dose of 10–15 mg per day, depending on the age and disorder. Statistical data processing was performed using the Statistica 10 (StatSoft, Inc., USA) and Excel (Microsoft Office 2016) software packages. The differences were considered significant at p<0.05. The descriptive statistics were presented as М±δ (where М was median, δ was standard deviation).
Results. The average effective volume (AEV) of urination in the group was reduced by 10–86.5% relative to the age norm. Furthermore, incomplete bladder emptying was reported in 9 patients. After treatment, the minimum urine output volume and the maximum urine flow rate increased significantly, while the urination rate decreased. There were no significant changes in the urine output volume (average and maximum), however, an upward trend of the urine output volume was observed. No increase in the number of RU cases following prescription of trospium chloride was reported. In fact, the decrease in their number was recorded. Conclusion. Pediatric micturition cycle abnormalities also include the RU symptom. The M-anticholinergic drug, trospium chloride (Spasmex), in a daily dose of 10-15 mg represents a safe and effective medication option. Therapy lasting up to 2 months results in the significant increase in minimum bladder volume and maximum urine flow rate, the decrease in pollakiuria severity, but never changes the rate and amount of residual urine.
Keywords: urination disorders, children, uroflowmetry, uroflow monitoring, trospium chloride, residual urine.
For citation: Danilov V.V., Golovina O.B., Danilov V.V. Trospium chloride in children: dynamic changes of the residual urine symptom during treatment of urination disorders. Clinical review for general practice. 2024; 5 (3): 99–104. DOI: 10.47407/kr2023.5.3.00367
На сегодняшний день остаются актуальными и осложнения ГАМП: инфекции мочевыводящих путей, повышение давления в мочевых путях и ретенция собирательных систем почки, несостоятельность уретеровезикального соустья и пузырно-мочеточниковый рефлюкс, нефросклероз и мочекаменная болезнь [3, 4]. ГАМП в ряде случаев сочетается с детрузорной гиперактивностью [6]. Известно, что коррекция внутрипузырной гипертензии является необходимым условием для сохранения функции почек из-за опасности активации пузырно-почечного рефлекса, а кроме того, из-за вероятности возникновения пузырно-мочеточникового рефлюкса. При достижении внутрипузырного давления уровня 40 см вод. ст. и выше нарушается поступление мочи из почки в мочевой пузырь [7].
Лечение ГАМП направлено на снижение внутрипузырного давления, угнетение гиперактивных сокращений детрузора в фазу накопления мочи, в свою очередь, это позволяет увеличить резервуарную функцию мочевого пузыря. Для этих целей используют препараты группы м-холинолитиков [2]. В детской практике распространены два препарата – оксибутинин и троспия хлорид с возраста 5 лет [3]. Троспия хлорид с 5 до 12 лет назначается после получения информированного согласия у родителей ребенка, так как в аннотации к препарату рекомендовано ограничение назначения у детей до 12 лет. Эффективное снижение внутрипузырного давления [8], при отсутствии центрального действия (являясь четвертичным амином, препарат не проникает через гематоэнцефалический барьер), делает троспия хлорид востребованным в детской практике [6, 9]. При сочетании ГАМП с гиперактивностью сфинктера или детрузорно-сфинктерной диссинергией – м-холинолитик сочетают с кратными катетеризациями для выведения остаточной мочи и тренировки мочевого пузыря [10]. Ученые обеспокоены неблагоприятными системными эффектами оксибутинина на центральную нервную систему у детей, такими как когнитивные нарушения, в связи с чем рекомендуют назначение холинолитиков из других групп: солифенацила сукцината, фезотеродина [10–12], троспия хлорида [3], которые не обладают нейротоксичными эффектами, а значит возможно их длительное применение [8]. К одному из побочных эффектов м-холинолитиков относится затрудненное мочеиспускание, неполное опорожнение мочевого пузыря (остаточная моча) и острая задержка мочи [13]. Оценить остаточную мочу возможно методом урофлоуметрического мониторинга на домашнем приборе урофлоуметр (УФМ) модель «СИГМА», вариант F (регистрационное удостоверение РЗН №2020/11522 от 05.08.2020) [14]. Кроме того, прибор дает возможность отследить динамику роста показателей объема мочевого пузыря (минимального, среднего, максимального), а также изменение скоростных показателей микции в течение суток до и после лечения [14].
Цели и задачи
Изучить расстройства микционного цикла у детей с ГАМП, в том числе оценить наличие остаточной мочи, используя мониторинг в течение суток при помощи прибора УФМ «СИГМА». Оценить эффект от лечения и динамику остаточной мочи на фоне лечения м-холинолитиком – троспия хлорид.
Критерии включения: наличие функциональных нарушений уродинамики нижних мочевых путей, протекающих в форме синдрома императивного мочеиспускания, возраст от 5 до 15 лет. Критерии исключения: острые инфекционно-воспалительные заболевания мочевых путей. Два мальчика имели в анамнезе пузырно-мочеточниковый рефлюкс, у одного в раннем возрасте была выполнена операция по Политано–Леадбеттеру, у второго – эндоскопическая коррекция рефлюкса. Нефроптоз справа 1-й степени – у 2, и слева 1-й степени – у 1. Другие пороки развития мочевыделительной системы: мультикистозная дисплазия правой почки и состояние после оперативного лечения по поводу гидронефроза слева – пластики пиелоуретерального сегмента по Андерсену–Хайнсу – у 1; парауретеральный дивертикул мочевого пузыря – у 1.
Всем пациентам исходно выполнен урофлоуметрический 2–3-суточный домашний мониторинг без назначения фармакологических препаратов. Далее назначалась комплексная терапия, одним их компонентов которой был троспия хлорид (Спазмекс®) в дозировке от 10 до 15 мг/сут, в зависимости от возраста и патологии (1–3 таблетки по 5 мг 2–3 раза в день). Повторно урофлоумониторинг проводился через 2 нед терапии и затем по окончании курса лечения троспия хлоридом. При этом общая длительность назначения составляла от 2 нед до 2 мес. Оценку клинической симптоматики проводили по таблицам оценки функции мочевого пузыря при опросе пациентов и их родителей. Перед диагностикой и назначением терапии родители каждого ребенка заполняли информированное согласие после подробных разъяснений о диагностике и лечении.
В работе использовано отечественное уродинамическое оборудование: урофлоуметр УФМ «СИГМА», вариант F (регистрационное удостоверение РЗН №2020/11522 от 05.08.2020). Двухсуточный урофлоумониторинг позволяет оценить как резервуарную, так и эвакуаторную функции мочевого пузыря. Записи всех мочеиспусканий в течение двух суток позволяют оценивать минимальный, максимальный и среднеэффективный объемы мочевого пузыря; то же касается и скорости потоков мочи. Далее программа проводит анализ показателей, сравнивает их с нормативными данными: скоростным и объемными профилями и делает заключение об отклонении от нормальных возрастных значений.
Статистическая обработка материалов производилась с помощью программного обеспечения Statistica 10 (StatSoft, Inc., США) и Excel (Microsoft Office 2016). Проверку гипотезы нормальности распределения количественных признаков в группах оценивали с помощью критериев Колмогорова–Смирнова, Лиллиефорса, Шапиро–Уилка и критерия согласия Пирсона χ². Сравнение средних значений количественных признаков в зависимых и независимых группах с распределением, соответствующим нормальному закону, и при соблюдении условия равенства (гомоскедастичности) дисперсий, проводили с помощью параметрического t-критерия Стьюдента. В противном случае статистическую значимость различий оценивали с помощью непараметрических критериев: для зависимых выборок применяли критерии Вилкоксона и знаков. Различия считали статистически значимыми при p<0,05. Дескриптивные статистики в тексте представлены как М±δ (где М – среднее, δ – стандартное отклонение).
Оценку расстройств мочеиспускания обычно выполняют, используя таблицы симптомов, суммируя балл и сравнивая исходные и итоговые значения. Но, как показывает клиническая практика, этот способ интерпретации эффективности лечения не всегда оказывается надежным, особенно в случае детской практики при относительно небольшом числе наблюдений. Связано это с высокой вариабельностью таких показателей, как минимальные, максимальные и средние емкости, показатели потоков мочи и т.д. Мало того, те симптомы, которые оцениваются исходя из ощущений, вообще могут приводить к ложному восприятию уродинамической ситуации в каждом конкретном случае. Мы отметили, что проведение курса лечения троспия хлоридом привело к уменьшению симптомов расстройств мочеиспускания у отдельных пациентов, в том числе снижению проявлений недержания мочи. Но все эти изменения носят характер тенденции, и если опираться строго на результаты статистической обработки, то оказываются недостоверными. Точность измерения урофлоуметра, работающего в режиме мониторинга, позволяет весьма определенно и точно, а главное объективно, оценить изменения в функциональном состоянии нижних мочевых путей при назначении троспия хлорида.
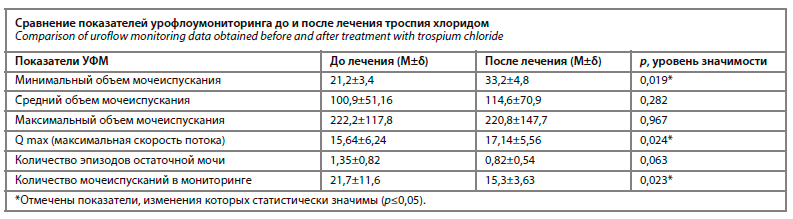
Среднеэффективный объем мочеиспусканий за мониторинг, в сравнении с возрастной нормой, был снижен у всех 20 детей (от 10% до 86,5% от возрастной нормы). После проведенной терапии существенно изменились показатели минимального объема мочеиспускания, частоты мочеиспусканий и скорости максимального потока мочи (см. таблицу). Объемы мочеиспускания (средний и максимальный) значимо не изменились, но имела место тенденция к их увеличению. Считаем очень важным отметить, что при назначении м-холинолитика не зафиксировано увеличения случаев остаточной мочи. Мало того, зафиксировано снижение случаев неполного опорожнения мочевого пузыря.
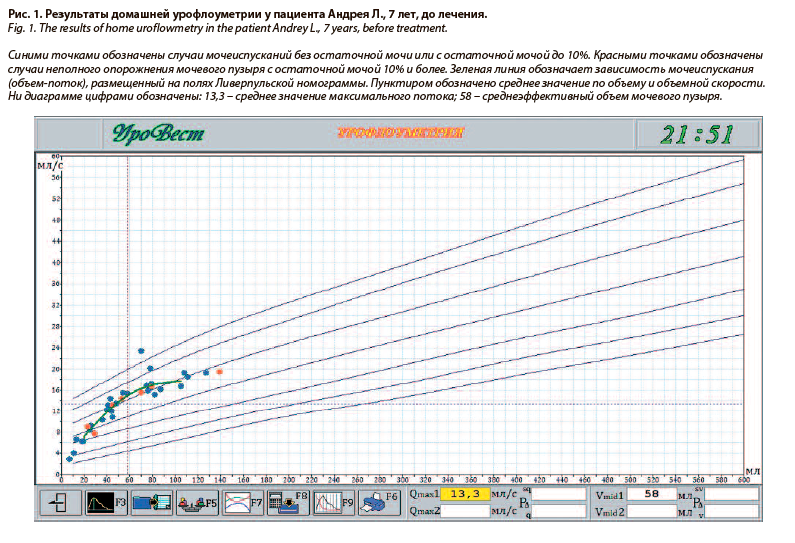
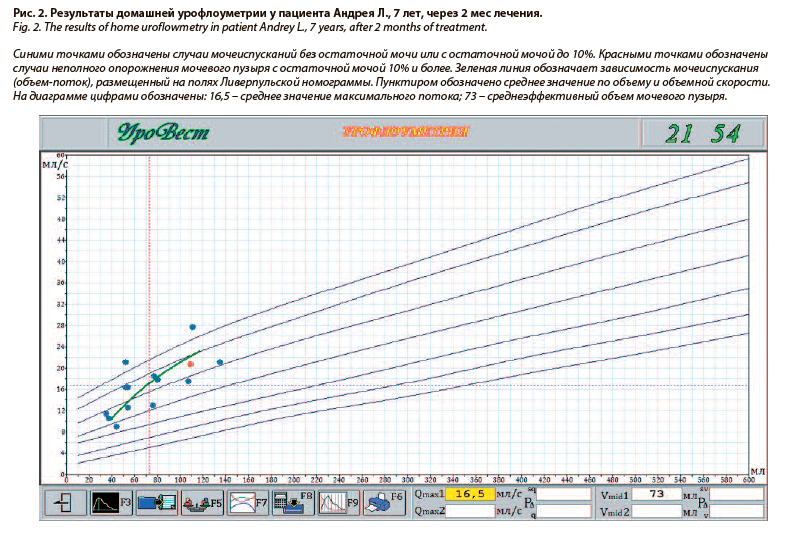
На рис. 1 и 2 приведены данные двух мониторингов (исходно и после лечения у пациента Андрея Л., 7 лет). Как видно из представленных данных, после лечения среднеэффективный объем мочевого пузыря вырос, а количество остаточной мочи (красных точек) на диаграмме снизилось.
Получение характеристики мочеиспускания, своего рода суточной функции опорожнения, оказывается важным для оценки эффекта м-холинолитиков. Известно, что назначение лекарственных средств этой группы имеет неприятную особенность, которая заключается в снижении сократительной способности детрузора. Это приводит, с одной стороны, к устранению детрузорной гиперактивности, но с другой – создает условия для формирования остаточной мочи. Поэтому проведение урофлоуметрии у детей в домашних условиях является наиболее физиологичным и простым способом оценки неполного опорожнения при назначении м-холинолитиков.
Что весьма интересно, так это тот факт, что назначение троспия хлорида не выявило увеличения случаев остаточной мочи. Исследование показало, что наоборот, число случаев неполного опорожнения уменьшилось. Этот факт объясним с позиции нейрофизиологической модели. У детей, в отличие от пациентов взрослого возраста и тем более пожилого, резервные возможности мышцы детрузора весьма высоки, и даже при незначительном росте среднеэффективного объема, наоборот, улучшается скорость опорожнения, а следовательно, и активация 10 и 11 микционных рефлексов происходит лучше.
Троспия хлорид (Спазмекс®) является четвертичным амином и, в отличие от третичных аминов, не проникает через гематоэнцефалический барьер и не имеет побочных эффектов со стороны центральной нервной системы, что обусловливает его преимущество по безопасности прежде всего над оксибутинином при применении у детей [15].
Описанный способ оценки остаточной мочи с помощью урофлоуметрии позволяет сделать обнадеживающие выводы о перспективности назначения м-холинолитика троспия хлорида в дозировках 10–15 мг 2–3 раза в сутки, абсолютно безопасным вариантом терапии у детей в возрастной группе 5–12 лет.
в суточной дозировке 10–15 мг является безопасным
эффективными вариантом лекарственного воздействия. Терапия длительностью от 2 нед до 2 мес достоверно приводит к уменьшению выраженности поллакиурии, увеличению минимального объема мочеиспускания, увеличению показателя максимальной скорости мочеиспускания, но при этом не увеличивает и даже снижает количество эпизодов остаточной мочи.
Информация о финансировании. Финансирование исследования не проводилось.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Данилов Вадим Валериевич – д-р мед. наук, проф. каф. факультетской хирургии и урологии, ФГБОУ ВО ТГМУ.
ORCID: 0000-0001-6119-6439; e-Library SPIN-код: 6807-3267; AuthorID: 817925
Vadim. V. Danilov – Dr. Sci. (Med.), Prof., Pacific State Medical University. ORCID: 0000-0001-6119-6439,
e-Library SPIN-код: 6807-3267, AuthorID: 817925
Головина Олеся Борисовна – канд. мед. наук, доц. института хирургии, ФГБОУ ВО ТГМУ. E-mail: olesya_golovina@mail.ru;
ORCID: 0009-0001-3622-2735; e-Library SPIN-код: 5247-6943; AuthorID: 624079
Olesya B. Golovina – Cand. Sci. (Med.), assistant professor at the Institute of Surgery, Pacific State Medical University.
E-mail: olesya_golovina@mail.ru;
ORCID: 0009-0001-3622-2735;
e-Library SPIN-код: 5247-6943; AuthorID: 624079
Данилов Валерий Вадимович – канд. мед. наук, доц. школы биомедицины, ФГАОУ ВО ДВФУ.ORCID: 0000-0003-2320-1406
Valeriy V. Danilov – Cand. Sci. (Med.), Far Eastern Federal University. ORCID: 0000-0003-2320-1406
Поступила в редакцию: 19.03.2024
Поступила после рецензирования: 25.03.2024
Принята к публикации: 28.03.2024
Received: 19.03.2024
Revised: 25.03.2024
Accepted: 28.03.2024
Trospium chloride in children: dynamic changes of the residual urine symptom during treatment of urination disorders
Vadim. V. Danilov1, Olesya B. Golovina1,2, Valeriy V. Danilov31 Pacific State Medical University, Vladivostok, Russia;
2 “Alenka” Medical Center, Vladivostok, Russia;
3 Far Eastern Federal University, Vladivostok, Russia
olesya_golovina@mail.ru
Abstract
Background. A significant place among pediatric urination disorders is occupied by overactive bladder (OAB). Treatment involving the use of M-anticholinergics is aimed to suppress detrusor overactivity. The side effects of treatment include urination problems, incomplete bladder emptying (residual urine), and acute urinary retention. Methods. We monitored 20 children aged 5–15 years, among them 12 boys and 8 girls. The average age (М±δ) was 8.47 ± 3.46 years. The 2-day uroflow monitoring revealed residual urine (RU) in 9 patients (1–15 times per monitoring period). The urination volume and rate, as well as RU, were assessed by uroflow monitoring conducted at home using the SIGMA F uroflowmeter (RZN registration certificate No. 2020/11522 of 5.08.2020). One of the components of combination therapy was trospium chloride (Spasmex) in a dose of 10–15 mg per day, depending on the age and disorder. Statistical data processing was performed using the Statistica 10 (StatSoft, Inc., USA) and Excel (Microsoft Office 2016) software packages. The differences were considered significant at p<0.05. The descriptive statistics were presented as М±δ (where М was median, δ was standard deviation).
Results. The average effective volume (AEV) of urination in the group was reduced by 10–86.5% relative to the age norm. Furthermore, incomplete bladder emptying was reported in 9 patients. After treatment, the minimum urine output volume and the maximum urine flow rate increased significantly, while the urination rate decreased. There were no significant changes in the urine output volume (average and maximum), however, an upward trend of the urine output volume was observed. No increase in the number of RU cases following prescription of trospium chloride was reported. In fact, the decrease in their number was recorded. Conclusion. Pediatric micturition cycle abnormalities also include the RU symptom. The M-anticholinergic drug, trospium chloride (Spasmex), in a daily dose of 10-15 mg represents a safe and effective medication option. Therapy lasting up to 2 months results in the significant increase in minimum bladder volume and maximum urine flow rate, the decrease in pollakiuria severity, but never changes the rate and amount of residual urine.
Keywords: urination disorders, children, uroflowmetry, uroflow monitoring, trospium chloride, residual urine.
For citation: Danilov V.V., Golovina O.B., Danilov V.V. Trospium chloride in children: dynamic changes of the residual urine symptom during treatment of urination disorders. Clinical review for general practice. 2024; 5 (3): 99–104. DOI: 10.47407/kr2023.5.3.00367
Введение
Среди нарушений мочеиспусканий у детей значительное место занимает гиперактивный мочевой пузырь (ГАМП) [1]. Полный синдром включает в себя поллакиурию, императивные позывы, императивное недержание мочи и энурез [2]. Актуальность рассматриваемой проблемы определяется частотой встречаемости данной патологии и постоянным ростом количества данных пациентов. В среднем, каждый пятый ребенок в той или иной степени страдает расстройствами мочеиспускания [1, 3]. Причины формирования связаны с неравномерностью темпов созревания и развития систем регуляции мочеиспускания [1], а также могут быть вызваны как пороками развития органов мочевой системы, так и различными формами ее патологии, сочетающимися с поражением структур центральной нервной системы, регулирующей акт мочеиспускания [2]. Синдром ГАМП проявляется социальной дезадаптацией ребенка, снижением уровня самооценки, конфликтами в семье, детском саду, школе, что отрицательно влияет на развитие и может вызвать психологические нарушения в будущем [4]. Для оценки нарушений рекомендуют обязательные исследования: дневник мочеиспусканий, оценку симптоматики при помощи таблиц, ультразвуковое исследование (с определением остаточной мочи после микции), исследование мочи и исследование уродинамики (урофлоуметрию, цистометрию и электромиографию) [2]. К избирательным методам относят микционную цистографию, урографию, цистоскопию и оценку выделительной и концентрационной функций почек [3, 5].На сегодняшний день остаются актуальными и осложнения ГАМП: инфекции мочевыводящих путей, повышение давления в мочевых путях и ретенция собирательных систем почки, несостоятельность уретеровезикального соустья и пузырно-мочеточниковый рефлюкс, нефросклероз и мочекаменная болезнь [3, 4]. ГАМП в ряде случаев сочетается с детрузорной гиперактивностью [6]. Известно, что коррекция внутрипузырной гипертензии является необходимым условием для сохранения функции почек из-за опасности активации пузырно-почечного рефлекса, а кроме того, из-за вероятности возникновения пузырно-мочеточникового рефлюкса. При достижении внутрипузырного давления уровня 40 см вод. ст. и выше нарушается поступление мочи из почки в мочевой пузырь [7].
Лечение ГАМП направлено на снижение внутрипузырного давления, угнетение гиперактивных сокращений детрузора в фазу накопления мочи, в свою очередь, это позволяет увеличить резервуарную функцию мочевого пузыря. Для этих целей используют препараты группы м-холинолитиков [2]. В детской практике распространены два препарата – оксибутинин и троспия хлорид с возраста 5 лет [3]. Троспия хлорид с 5 до 12 лет назначается после получения информированного согласия у родителей ребенка, так как в аннотации к препарату рекомендовано ограничение назначения у детей до 12 лет. Эффективное снижение внутрипузырного давления [8], при отсутствии центрального действия (являясь четвертичным амином, препарат не проникает через гематоэнцефалический барьер), делает троспия хлорид востребованным в детской практике [6, 9]. При сочетании ГАМП с гиперактивностью сфинктера или детрузорно-сфинктерной диссинергией – м-холинолитик сочетают с кратными катетеризациями для выведения остаточной мочи и тренировки мочевого пузыря [10]. Ученые обеспокоены неблагоприятными системными эффектами оксибутинина на центральную нервную систему у детей, такими как когнитивные нарушения, в связи с чем рекомендуют назначение холинолитиков из других групп: солифенацила сукцината, фезотеродина [10–12], троспия хлорида [3], которые не обладают нейротоксичными эффектами, а значит возможно их длительное применение [8]. К одному из побочных эффектов м-холинолитиков относится затрудненное мочеиспускание, неполное опорожнение мочевого пузыря (остаточная моча) и острая задержка мочи [13]. Оценить остаточную мочу возможно методом урофлоуметрического мониторинга на домашнем приборе урофлоуметр (УФМ) модель «СИГМА», вариант F (регистрационное удостоверение РЗН №2020/11522 от 05.08.2020) [14]. Кроме того, прибор дает возможность отследить динамику роста показателей объема мочевого пузыря (минимального, среднего, максимального), а также изменение скоростных показателей микции в течение суток до и после лечения [14].
Цели и задачи
Изучить расстройства микционного цикла у детей с ГАМП, в том числе оценить наличие остаточной мочи, используя мониторинг в течение суток при помощи прибора УФМ «СИГМА». Оценить эффект от лечения и динамику остаточной мочи на фоне лечения м-холинолитиком – троспия хлорид.
Материалы и методы
Под нашим наблюдением находились 20 детей от 5 до 15 лет, из них 12 мальчиков и 8 девочек. Пациенты проходили лечение в «Центре детского здоровья» в 2022–2023 гг. и в лаборатории уродинамики Краевой детской клинической больницы с 2009 по 2015 г. Средний возраст составил (М±δ) 8,47±3,46. Следует отметить, что расстройства мочеиспускания у всех детей в группе были основной причиной обращения за специализированной медицинской помощью.Критерии включения: наличие функциональных нарушений уродинамики нижних мочевых путей, протекающих в форме синдрома императивного мочеиспускания, возраст от 5 до 15 лет. Критерии исключения: острые инфекционно-воспалительные заболевания мочевых путей. Два мальчика имели в анамнезе пузырно-мочеточниковый рефлюкс, у одного в раннем возрасте была выполнена операция по Политано–Леадбеттеру, у второго – эндоскопическая коррекция рефлюкса. Нефроптоз справа 1-й степени – у 2, и слева 1-й степени – у 1. Другие пороки развития мочевыделительной системы: мультикистозная дисплазия правой почки и состояние после оперативного лечения по поводу гидронефроза слева – пластики пиелоуретерального сегмента по Андерсену–Хайнсу – у 1; парауретеральный дивертикул мочевого пузыря – у 1.
Всем пациентам исходно выполнен урофлоуметрический 2–3-суточный домашний мониторинг без назначения фармакологических препаратов. Далее назначалась комплексная терапия, одним их компонентов которой был троспия хлорид (Спазмекс®) в дозировке от 10 до 15 мг/сут, в зависимости от возраста и патологии (1–3 таблетки по 5 мг 2–3 раза в день). Повторно урофлоумониторинг проводился через 2 нед терапии и затем по окончании курса лечения троспия хлоридом. При этом общая длительность назначения составляла от 2 нед до 2 мес. Оценку клинической симптоматики проводили по таблицам оценки функции мочевого пузыря при опросе пациентов и их родителей. Перед диагностикой и назначением терапии родители каждого ребенка заполняли информированное согласие после подробных разъяснений о диагностике и лечении.
В работе использовано отечественное уродинамическое оборудование: урофлоуметр УФМ «СИГМА», вариант F (регистрационное удостоверение РЗН №2020/11522 от 05.08.2020). Двухсуточный урофлоумониторинг позволяет оценить как резервуарную, так и эвакуаторную функции мочевого пузыря. Записи всех мочеиспусканий в течение двух суток позволяют оценивать минимальный, максимальный и среднеэффективный объемы мочевого пузыря; то же касается и скорости потоков мочи. Далее программа проводит анализ показателей, сравнивает их с нормативными данными: скоростным и объемными профилями и делает заключение об отклонении от нормальных возрастных значений.
Статистическая обработка материалов производилась с помощью программного обеспечения Statistica 10 (StatSoft, Inc., США) и Excel (Microsoft Office 2016). Проверку гипотезы нормальности распределения количественных признаков в группах оценивали с помощью критериев Колмогорова–Смирнова, Лиллиефорса, Шапиро–Уилка и критерия согласия Пирсона χ². Сравнение средних значений количественных признаков в зависимых и независимых группах с распределением, соответствующим нормальному закону, и при соблюдении условия равенства (гомоскедастичности) дисперсий, проводили с помощью параметрического t-критерия Стьюдента. В противном случае статистическую значимость различий оценивали с помощью непараметрических критериев: для зависимых выборок применяли критерии Вилкоксона и знаков. Различия считали статистически значимыми при p<0,05. Дескриптивные статистики в тексте представлены как М±δ (где М – среднее, δ – стандартное отклонение).
Результаты
При анализе жалоб и клинической картины у 8 детей отмечалось императивное недержание мочи; у одного дополнительно фиксировались изменения в анализах мочи. Ночное недержание мочи (энурез) – у 11 пациентов. Комбинированные расстройства мочеиспускания – у 7 больных, проявляющиеся императивными позывами к мочеиспусканию, императивным недержанием мочи в сочетании с энурезом. При проведении двухсуточного урофлоуметрического мониторинга у 9 пациентов выявлена остаточная моча от 1 до 15 раз за мониторинг (среднее значение 1,35±0,82).Оценку расстройств мочеиспускания обычно выполняют, используя таблицы симптомов, суммируя балл и сравнивая исходные и итоговые значения. Но, как показывает клиническая практика, этот способ интерпретации эффективности лечения не всегда оказывается надежным, особенно в случае детской практики при относительно небольшом числе наблюдений. Связано это с высокой вариабельностью таких показателей, как минимальные, максимальные и средние емкости, показатели потоков мочи и т.д. Мало того, те симптомы, которые оцениваются исходя из ощущений, вообще могут приводить к ложному восприятию уродинамической ситуации в каждом конкретном случае. Мы отметили, что проведение курса лечения троспия хлоридом привело к уменьшению симптомов расстройств мочеиспускания у отдельных пациентов, в том числе снижению проявлений недержания мочи. Но все эти изменения носят характер тенденции, и если опираться строго на результаты статистической обработки, то оказываются недостоверными. Точность измерения урофлоуметра, работающего в режиме мониторинга, позволяет весьма определенно и точно, а главное объективно, оценить изменения в функциональном состоянии нижних мочевых путей при назначении троспия хлорида.

Среднеэффективный объем мочеиспусканий за мониторинг, в сравнении с возрастной нормой, был снижен у всех 20 детей (от 10% до 86,5% от возрастной нормы). После проведенной терапии существенно изменились показатели минимального объема мочеиспускания, частоты мочеиспусканий и скорости максимального потока мочи (см. таблицу). Объемы мочеиспускания (средний и максимальный) значимо не изменились, но имела место тенденция к их увеличению. Считаем очень важным отметить, что при назначении м-холинолитика не зафиксировано увеличения случаев остаточной мочи. Мало того, зафиксировано снижение случаев неполного опорожнения мочевого пузыря.
На рис. 1 и 2 приведены данные двух мониторингов (исходно и после лечения у пациента Андрея Л., 7 лет). Как видно из представленных данных, после лечения среднеэффективный объем мочевого пузыря вырос, а количество остаточной мочи (красных точек) на диаграмме снизилось.


Обсуждение
Нарушения уродинамики нижних мочевых путей в детском возрасте не относятся к редким явлениям. Практически до 5-летнего возраста эти нарушения носят системный характер и постепенно становятся менее яркими, а к 8–9-летнему возрасту происходит полная нормализация мочеиспускания в подавляющем большинстве случаев. Но вместе с этим остаются субклинические формы расстройств мочеиспускания, которые создают негативный фон и способствуют формированию условий для развития инфекции мочевой системы. Одним из таких условий является неполное опорожнение мочевого пузыря, или остаточная моча. Особенностью этого состояния является то, что пациент зачастую не отмечает ощущений неполного опорожнения, а кроме того, остаточная моча может формироваться в вечерние часы или утром, когда зафиксировать это состояние практически невозможно ввиду необходимости наличия специального оборудования для ультразвуковой диагностики. Но даже при наличии такой аппаратуры сложно объективно оценить этот симптом, объективно его зафиксировав. Поэтому при выполнении урофлоуметрии в домашних условиях, когда никакая другая медицинская техника не требуется, автоматическая и простая регистрация неполного опорожнения с представлением отчета по количеству остаточной мочи оказывается очень важным диагностическим тестом. Создание специализированной аппаратуры измерения потоков мочи, в которой задействованы не один датчик, как обычно в любом урофлоуметре, а два, причем каждый из которых работает независимо, позволяет очень точно измерить динамику потоков. Исключаются влияния помехи, так называемого WAG-эффекта, возникающего при смещении струи мочи по воронке, а также любые артефакты вследствие касания датчика при измерении или при транспортировке. УФМ «СИГМА» имеет абсолютно уникальные свойства, в частности обеспечивает распознавание появления артефакта непосредственно при его возникновении, и, соответственно, встроенный процессор с программой коррекции данных вносит исправления в измерение, не допуская сохранения помехи. Это свойство как раз и обеспечивает высокую точность измерения. Известно, что даже такой превосходный урофлоуметр, как URODYN1000, имеет ошибку измерения 45–53%, а DaCapo на низких потоках ошибается на 240%. Аналогичные устройства имеют ошибки этого же порядка, и поэтому в результате как единичной записи, так и в серии, ошибки не позволяют получить точные значения зависимости мочеиспускания «объем-поток», не говоря уже об определении остаточной мочи. Считаем важным, что именно в детской урологии, как нигде более, необходимо использовать именно такой высокоточный инструмент для оценки функционального состояния нижних мочевых путей.Получение характеристики мочеиспускания, своего рода суточной функции опорожнения, оказывается важным для оценки эффекта м-холинолитиков. Известно, что назначение лекарственных средств этой группы имеет неприятную особенность, которая заключается в снижении сократительной способности детрузора. Это приводит, с одной стороны, к устранению детрузорной гиперактивности, но с другой – создает условия для формирования остаточной мочи. Поэтому проведение урофлоуметрии у детей в домашних условиях является наиболее физиологичным и простым способом оценки неполного опорожнения при назначении м-холинолитиков.
Что весьма интересно, так это тот факт, что назначение троспия хлорида не выявило увеличения случаев остаточной мочи. Исследование показало, что наоборот, число случаев неполного опорожнения уменьшилось. Этот факт объясним с позиции нейрофизиологической модели. У детей, в отличие от пациентов взрослого возраста и тем более пожилого, резервные возможности мышцы детрузора весьма высоки, и даже при незначительном росте среднеэффективного объема, наоборот, улучшается скорость опорожнения, а следовательно, и активация 10 и 11 микционных рефлексов происходит лучше.
Троспия хлорид (Спазмекс®) является четвертичным амином и, в отличие от третичных аминов, не проникает через гематоэнцефалический барьер и не имеет побочных эффектов со стороны центральной нервной системы, что обусловливает его преимущество по безопасности прежде всего над оксибутинином при применении у детей [15].
Описанный способ оценки остаточной мочи с помощью урофлоуметрии позволяет сделать обнадеживающие выводы о перспективности назначения м-холинолитика троспия хлорида в дозировках 10–15 мг 2–3 раза в сутки, абсолютно безопасным вариантом терапии у детей в возрастной группе 5–12 лет.
Заключение
Расстройства микционного цикла у детей с ГАМП включают в себя снижение среднеэффективного объема, учащение мочеиспусканий, проявлений симптомов недержания мочи. Немаловажным в этом списке симптомов оказывается и симптом неполного опорожнения. Препарат из группы м-холинолитиков троспия хлорид (Спазмекс®)в суточной дозировке 10–15 мг является безопасным
эффективными вариантом лекарственного воздействия. Терапия длительностью от 2 нед до 2 мес достоверно приводит к уменьшению выраженности поллакиурии, увеличению минимального объема мочеиспускания, увеличению показателя максимальной скорости мочеиспускания, но при этом не увеличивает и даже снижает количество эпизодов остаточной мочи.
Информация о финансировании. Финансирование исследования не проводилось.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Данилов Вадим Валериевич – д-р мед. наук, проф. каф. факультетской хирургии и урологии, ФГБОУ ВО ТГМУ.
ORCID: 0000-0001-6119-6439; e-Library SPIN-код: 6807-3267; AuthorID: 817925
Vadim. V. Danilov – Dr. Sci. (Med.), Prof., Pacific State Medical University. ORCID: 0000-0001-6119-6439,
e-Library SPIN-код: 6807-3267, AuthorID: 817925
Головина Олеся Борисовна – канд. мед. наук, доц. института хирургии, ФГБОУ ВО ТГМУ. E-mail: olesya_golovina@mail.ru;
ORCID: 0009-0001-3622-2735; e-Library SPIN-код: 5247-6943; AuthorID: 624079
Olesya B. Golovina – Cand. Sci. (Med.), assistant professor at the Institute of Surgery, Pacific State Medical University.
E-mail: olesya_golovina@mail.ru;
ORCID: 0009-0001-3622-2735;
e-Library SPIN-код: 5247-6943; AuthorID: 624079
Данилов Валерий Вадимович – канд. мед. наук, доц. школы биомедицины, ФГАОУ ВО ДВФУ.ORCID: 0000-0003-2320-1406
Valeriy V. Danilov – Cand. Sci. (Med.), Far Eastern Federal University. ORCID: 0000-0003-2320-1406
Поступила в редакцию: 19.03.2024
Поступила после рецензирования: 25.03.2024
Принята к публикации: 28.03.2024
Received: 19.03.2024
Revised: 25.03.2024
Accepted: 28.03.2024
Список исп. литературыСкрыть список1. Бурлуцкая А.В., Мартыненко В.В. Гиперактивный мочевой пузырь у детей: клинические и параклинические особенности. Глобальные проблемы современности. 2021;2(1):48-51.
Burlutskaya A.V., Martynenko V.V. Hyperactive bladder in children: clinical and paraclinical features. Globalnye problemy sovremennosti. 2021;2(1):48-51 (in Russian).
2. Воробьева Ю.Д., Сытьков В.В., Зокиров Н.З. и др. Гиперактивный мочевой пузырь у детей: новое в диагностике и лечении. Российский педиатрический журнал. 2020;23(5):330-4.
Vorobyova Yu.D., Sytkovo V.V., Zokirov N.Z. et al. Hyperactive bladder in children: new in diagnosis and treatment. Russian Pediatric Journal. 2020;23(5):330-4 (in Russian).
3. Шапошникова Н.Ф., Давыдова А.Н. Нейрогенная дисфункция мочевого пузыря у детей и методы ее ранней диагностики и лечения. Лекарственный вестник. 2017;11(4):19-23.
Shaposhnikova N.F., Davydova A.N. Neurogenic bladder dysfunction in children and methods of its early diagnosis and treatment. Medicinal bulletin. 2017;11(4):19-23 (in Russian).
4. Fuentes M, Magalhгes J, Barroso U. Diagnosis and management of bladder dysfunction in neurologically normal children. Front Pediatr. 2019;7:298. DOI: 10.3389/fped.2019.00298
5. Kopiczko N, Dzik-Sawczuk A, Szwarc K et al. Analysis of Indications for Voiding Cystography in Children. J Clin Med. 2021;10(24):5809. DOI: 10.3390/jcm10245809
6. Данилов В.В. Феномен детрузорной гиперактивности как проявление патологического вегетативного рефлекса. Фарматека. 2021;28(3):113-9. DOI: 10.18565/pharmateca.2021.3.113-119
Danilov V.V. The phenomenon of detrusor hyperactivity as a manifestation of a pathological vegetative reflex. Pharmateca. 2021;28(3):113-9. DOI: 10.18565/pharmateca.2021.3.113-119 (in Russian).
7. Данилов В.В., Вольных И.Ю., Данилов В.В., Данилов В.В. Коррекция расстройств мочеиспускания в раннем послеоперационном периоде после троакарного синтетического слинга. Фарматека. 2023;30(9-10):208-12. DOI: 10.18565/pharmateca.2023.9-10.208-212
Danilov V.V., Volnykh I.Yu., Danilov V.V., Danilov V.V. Correction of urination disorders in the early postoperative period after trocar synthetic sling. Pharmateca. 2023;30(9-10):208-12. DOI: 10.18565/pharmateca.2023.9-10.208-212 (in Russian).
8. Данилов В.В., Вольных И.Ю., Данилов В.В., Данилов В.В. Изменение уровня детрузорной гиперактивности при длительном назначении М-холинолитика. Фарматека. 2023;30(4-5):79-83. DOI: 10.18565/pharmateca.2023.4-5.79-83
Danilov V.V., Volnykh I.Yu., Danilov V.V., Danilov V.V. Changes in the level of detrusor hyperactivity during prolonged administration of M-cholinolytic. Pharmateca. 2023;30(4-5):79-83. DOI: 10.18565/pharmateca.2023.4-5.79-83 (in Russian).
9. Данилов В.В., Вольных И.Ю. Обоснование назначения троспия хлорида в первой линии терапии при гиперактивном мочевом пузыре. Фарматека. 2023;30(1-2):226-31. DOI: 10.18565/pharmateca.2023.1-2.226-230
Danilov V.V., Volnykh I.Yu. Justification of the appointment of trospium chloride in the first line of therapy for overactive bladder. Pharmateca. 2023;30(1-2):226-31. DOI: 10.18565/pharmateca.2023.1-2.226-230 (in Russian).
10. Franco I, Hoebeke P, Baka-Ostrowska M et al. Long-term efficacy and safety of solifenacin in pediatric patients aged 6 months to 18 years with neurogenic detrusor overactivity: results from two phase 3 prospective open-label studies. J Pediatric Urology. 2020;16:180.e1-180e8.
11. Snijder R, Bosman B, Stroosma O, Agema M. Relationship between mean volume voided and incontinence in children with overactive bladder treated with solifenacin: post hoc analysis of a phase 3 randomised clinical trial. Eur J Pediatr. 2020;179(10):1523-8. DOI: 10.1007/s00431-020-03635-2
12. Yamato Sano, Satoshi Shoji, Mohamed Shahin et al. Population Pharmacokinetic and Pharmacodynamic Modeling of Fesoterodine in Pediatric Patients with Neurogenic Detrusor Overactivity. Eur J Drug Metabol Pharmacokinetics. 2023;48:257-69.
13. Vidal – справочник лекарственных средств.
Vidal – directory of medicines. (in Russian).
14. Данилов В.В., Данилов В.В. Нейроурология. Том 1. Владивосток, 2019.
Danilov V.V., Danilov V.V. Neurology. Volume 1. Vladivostok, 2019 (in Russian).
15. Petzinger E, Gavrilova O, Geyer J, Schwantes U. The role of the MDR1 transporter in body distribution and brain penetration of the trospium chloride and oxybutynin. Eur Urol Suppl. 2008;7(3):675. DOI: 10.1016/s1569-9056(08)60673-9
4 июня 2024
Количество просмотров: 405

