Клинический разбор в общей медицине №11 2024
Omsk State Medical University, Omsk, Russia
ozamakhina@yandex.ru
Annotation
The article presents a clinical case of a patient with an atypical combined cause of pulmonary embolism (PE), which resulted from activation of the blood coagulation system against the background of hereditary genetic polymorphism, hormonal contraceptives and COVID-19; in the absence of deep vein thrombosis, which is considered the main cause of the development of PE.
Materials and methods: physical research methods, the PE – Wells probability scale, general clinical laboratory parameters, D-dimer and homocysteine levels in blood plasma, coagulogram, PCR test for SARS-CoV-2 in a nasopharyngeal smear, electrocardiography, echocardiography, MSCT of the chest organs with intravenous contrast enhancement of the pulmonary artery. The genetic polymorphisms associated with the risk of hypercoagulation are analyzed. The example of this clinical case shows the combined effects of thrombosis factors as causes of PE (hereditary predisposition, overweight, hypertension, taking combined oral contraceptives, carrying polymorphisms of folate cycle genes, increased blood coagulation factor VIII, fibrinogen levels, hyperhomocysteinemia). These changes should be taken into account when prescribing treatment of acute PE and secondary prevention of venous thromboembolic complications. The identified risk factors need to be corrected and should be taken into account when choosing a method of contraception. The increased risk of thrombosis in COVID-19 conditions determines the need to expand the indications for the search for PE by all possible methods.
Keywords: pulmonary embolism, hypercoagulation, combined oral contraceptives, genetic polymorphism, hyperhomocysteinemia, COVID-19.
For citation: Zamahina O.V., Slepcova J.O., Usacheva E.V., Sultan-Muratova E.G. A clinical case of pulmonary embolism against the background of activation of the blood coagulation system. Clinical review for general practice. 2024; 5 (10): 19–24 (In Russ.). DOI: 10.47407/kr2024. 5.11.00512
ТЭЛА – самая частая нераспознаваемая причина смерти госпитализированных больных. Смертность от нее, по разным данным, составляет до 30%. При этом точной статистики ТЭЛА в России нет. Установить количество бессимптомных нефатальных ТЭЛА не представляется возможным. По результатам российской части реестра ENDORSE факторы риска тромбозов и ТЭЛА выявлены у 52% хирургических и 40% терапевтических больных. При аутопсии частота верифицированной ТЭЛА составила более 14%, преимущественно у пациентов с сердечно-сосудистыми заболеваниями. При жизни она не была распознана у каждого 10-го пациента. Это может быть связано как с быстрым ухудшением состояния больного, так и с длительным ожиданием результатов дополнительных методов исследования. Основной причиной развития ТЭЛА считается наличие ТГВ нижних конечностей [2]. Около трети больных с клиникой ТЭЛА не имеют признаков ТГВ [3, 4]. Массивные ТЭЛА, вероятно, в большинстве случаев определяются наличием ТГВ, тогда как малосимптомные или субклинические случаи могут иметь и другую этиологию. Такая разновидность подтверждается и тем, что данные по летальности и частоте рецидивов при ТЭЛА и ТГВ различны. При ТЭЛА выше как летальность, так и частота рецидивов. Иначе говоря, ТГВ может быть единичным эпизодом, поддающимся излечению и не имеющим дальнейших последствий. Напротив, более высокая распространенность рецидивов ТЭЛА указывает на то, что успешное лечение одного эпизода легочной тромбоэмболии не всегда устраняет причину ее возникновения, которая часто проявляет себя в дальнейшем в виде повторных эпизодов ТЭЛА. Если в случаях сочетания ТЭЛА с ТГВ риск рецидива ТЭЛА может быть устранен инвазивными методами, то в случаях ТЭЛА без ТГВ (а это каждый третий пациент) этиологический фактор остается неизвестен и целенаправленно воздействовать на него невозможно [5].
Цель исследования – представить клинический случай пациентки с нетипичной комбинированной причиной ТЭЛА, ставшей следствием активации свертывающей системы крови на фоне наследственного генетического полиморфизма, приема контрацептивов и COVID-19, а также продемонстрировать значимость гиперкоагуляционных факторов риска развития ТЭЛА.
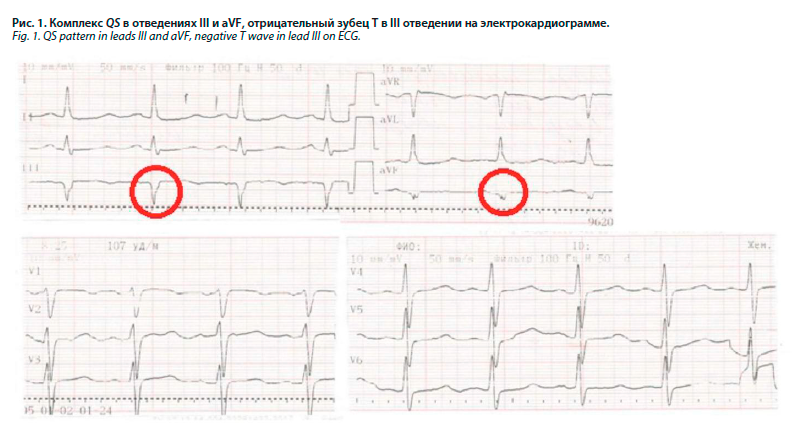
Из объективных данных: сознание ясное, бледность кожных покровов, избыточное развитие подкожно-жировой клетчатки, индекс массы тела – 34,6 кг/м2, тахипноэ – частота дыхательных движений 22 в минуту, сатурация кислорода 94%, температура тела – 36,4 0С, периферические лимфатические узлы не пальпируются, частота сердечных сокращений – 102 уд/мин, артериальное давление 90/60 мм рт. ст., отеков нет. Дыхание жесткое, без побочных дыхательных шумов. Живот при пальпации мягкий, безболезненный. Печень у края реберной дуги. Поколачивание по поясничной области безболезненное. На электрокардиограмме патологический зубец Q в III и AVF, там же отрицательный Т (рис. 1).
Вероятность ТЭЛА по шкале Wels умеренная (4,5 балла). Проведен комплекс исследований для исключения острого коронарного синдрома (тропонин Т 0,46 нг/мл, МВ-фракция креатинфосфокиназы 23 нг/мл), в том числе коронароангиография. Острый коронарный синдром исключен. Показатели общего анализа крови: гемоглобин 123 г/л, эритроциты 4,32×1012/л, тромбоциты 246×109/л, лейкоциты 6,46×109/л, СОЭ 17 ммоль/л. Коагулограмма: VIII факторы свертывания крови 172%, активированное частичное тромбопластиновое время 35,7 с, фибриноген 4,58 г/л, тромбопластиновое время
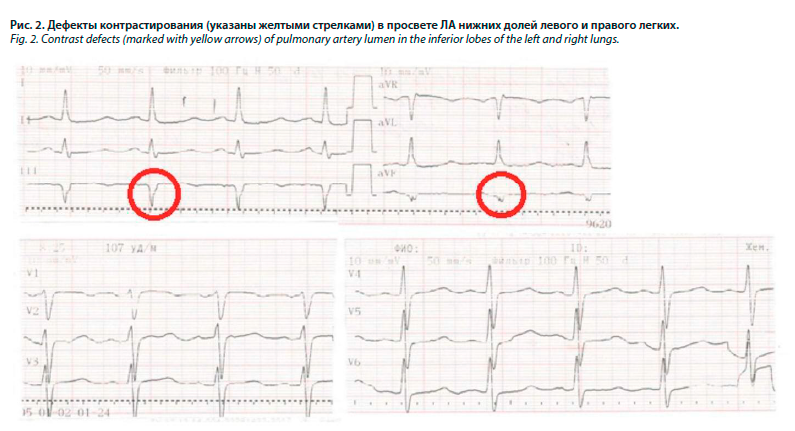
18 с, D-димер 1854 нг/мл. Уровень ферритина 33,17 мкг/л. В липидном спектре крови – гиперхолестеринемия общего холестерина 5,47 ммоль/л, ЛПНП 3,52 ммоль/л. На ЭхоКГ среднее давление в ЛА (СДЛА) – 40 мм рт. ст., трикуспидальная регургитация 1-й степени, полости сердца не расширены, фракция выброса 58% по Симпсону, зон гипокинеза не выявлено. На МСКТ органов грудной клетки с контрастированием ЛА обнаружены признаки субмассивной ТЭЛА: в просвете ЛА нижней доли правого легкого определяется тромб, сужающий просвет артерии на 100%, распространяющийся в сегментарные и субсегментарные ветви S7-8-9; в просвете ЛА верхней доли правого легкого – тромб, суживающий просвет артерии на 50% и распространенный на передний сегмент; в просвете ЛА нижней доли легкого – тромб, суживающий просвет сосудов до 50%, с распространением на язычковые и передне-базальные сегменты (рис. 2).
При этом архитектоника ЛА не нарушена. На МСКТ также были обнаружены признаки образования верхней доли правого легкого, внутригрудной лимфаденопатии; правостороннего гидроторакса, малого объема. Поставлен диагноз «ТЭЛА субмассивная, острое течение». Так как поступление в стационар пришлось на период пандемии COVID-19, было проведено исследование мазка из носоглотки на SARS-CoV-2 методом ПЦР, и он был положительным. Пациентке проведена системная тромболитическая терапия препаратом Актилизе, назначена антикоагулянтная терапия гепарином с дальнейшим переводом на Эликвис 5 мг – 2 раза в день, также проводилась патогенетическая терапия COVID-19. Таким образом, от появления первых симптомов до проведения системного тромболизиса прошло 2 нед. Диагностический поиск первопричины ТЭЛА включал: исключение онкопатологии (фиброэзофагогастроскопия, колоноскопия, МСКТ органов брюшной полости, ультразвуковое исследование молочных желез и щитовидной железы), исключение тромбоза глубоких вен нижней конечностей (дуплексное сканирование вен нижней конечностей) [6]. Признаков онкопатологии и периферического венозного тромбоза не было выявлено. При осмотре глазного дна офтальмологом: гипертонический ангиосклероз. Интересен, на наш взгляд, наследственный анамнез, который не был собран подробно при поступлении пациентки в стационар. Из него стало известно о наследственной предрасположенности: у матери пациентки в таком же возрасте был эпизод ТЭЛА. В связи этим ее направили амбулаторно на консультацию гемостазиолога для исключения тромбофилии. Через 3 мес после выписки динамика положительная, одышка инспираторная при значительной физической нагрузке, снизилось СДЛА до 28 мм рт.ст. по ЭхоКГ; на МСКТ органов грудной клетки с контрастированием ЛА признаков тромбоза не обнаружено. В июле 2022 г. пациентка была проконсультирована гемостазиологом, назначено расширенное коагулогическое исследование, выявлены полиморфизмы генов фолатного цикла, гипергомоцистеинемия (16,23 ммоль/л.), гиперагрегация тромбоцитов, спонтанная и с аденозиндифосфатом.
К лечению добавлены Тромбо АСС, Ангиовит. При контроле через 1 мес достигнута фактическая нормокоагуляция с тенденцией к гиперкоагуляции, снизился уровень гомоцистеина до 9,33 мкмоль/л.
Диагноз. Активация свертывающей системы крови, обусловленная гиперагрегацией тромбоцитов, повышением VIII фактора свертывания крови, уровня фибриногена, гипергомоцистеинемией. Носительство ДНК-полиморфизмов генов фолатного цикла. Состояние после острой субмассивной ТЭЛА (25.04.2022). Тромболизис Актилизе 25.04.2022. Факторы тромбогенного риска (ожирение, отягощенная наследственность).
Сопутствующие заболевания. Гипертоническая болезнь 2-й ст., риск 3. Гиперхолестеринемия. Хроническая железодефицитная анемия на фоне полименореи, компенсация. Остеоартроз коленных и голеностопных суставов. Стеатоз печени. Липоматоз поджелудочной железы. Полип сигмовидной кишки. Хронический эриматозный пангастрит.
У пациентки не было факторов высокого риска, поэтому диагноз ТЭЛА мог оказаться неочевидным, особенно учитывая изменения на ЭКГ, имитирующие очаговый процесс на нижней стенке левого желудочка.
В ходе обследования были выявлены слабые (избыточная масса тела, артериальная гипертензия) и умеренные (прием КОК, отягощенный наследственный анамнез по тромбоэмболизму) факторы риска, сочетание которых оказало потенцирующее действие, что привело к образованию дефекта в системе гемостаза и развитию ТЭЛА. Перенесенная инфекция COVID-19 у нашей пациентки также могла выступать еще одним фактором риска активации свертывающей системы крови. Показано, что за год среди лиц с ТГВ доля пациентов, у которых по МСКТ диагностировали ТЭЛА, выросла с 11,9% в доковидный период до 24% в первый год пандемии COVID-19 [8]. Данные А.А. Плешко свидетельствует о наличии у пациентов с подтвержденной инфекцией SARS-CoV-2 и повышенным уровнем D-димера на момент госпитализации COVID-19-ассоциированной коагулопатии. Патогенетические основы и факторы тромбогенного риска у пациентов с COVID-19 требуют дальнейшего уточнения [9].
Выявлено, что частота регистрации генетических нарушений свертывающей и противосвертывающей систем крови у лиц, перенесших ТЭЛА, очень высока и составляет 95,97%, по данным Е.В. Мяленка и соавт., больные ТЭЛА при этом чаще имеют две мутации. Исследователи отметили тенденцию к более частой регистрации у женщин сочетания полиморфизмов в генах PAI-I, MTHFR и фактора I [10]. По данным Е.А. Филатовой и соавт., ТЭЛА наблюдалась в дебюте 60% пациентов с наследственной гематогенной тромбофилией [11]. У пациентки из представленного клинического случая как раз присутствовал генетический полиморфизм генов фолатного цикла – MTHFR, MTRR, MTR. Эти гены кодируют ферменты, участвующие на разных этапах реакции восстановления фолатов, к которым относятся, например, витамины B9 и B12. Главная цель этой реакции – получить от фолатов как можно больше метильных групп и обезвредить гомоцистеин. Это промежуточный продукт обмена фолатов и метионина – исходного материала для реакций метилирования или переноса метильной группы. Метилирование ДНК регулирует работу генов, а фолатный цикл как бы расставляет «выключатели» в нужных местах генома [12]. Однако нет четкого определения, когда именно у пациента начнут проявляться первые симптомы генетического полиморфизма. Гиперкоагуляция является многофакторной и может зависеть как от наследственных, так и от приобретенных факторов. Наследственная тромбофилия встречается реже и связана с определенными мутациями в белках, связанных с каскадом свертывания крови [13]. Приобретенная гиперкоагуляция встречается гораздо чаще и может быть результатом приема лекарств (например, эстрогенсодержащих контрацептивов, заместительной гормональной терапии, тамоксифена или ралоксифена), злокачественных новообразований, воспалительного состояния, вызванного беременностью, травмой, хирургическим вмешательством, инфекцией и хроническими воспалительными состояниями, такими, например, как патологическое ожирение, аутоиммунные заболевания, тяжелое курение, антифосфолипидный синдром, гепарининдуцированная тромбоцитопения и тромбоз [14]. Из причин приобретенной гиперкоагуляции у нашей пациентки присутствовали прием КОК, ожирение и инфекция COVID-19.
Фактор (F) VIII представляет собой прокоагулянтный фактор, который хранится в эндотелиальных клетках и высвобождается во время воспаления. Он играет решающую роль в коагуляции, поскольку является кофактором теназного комплекса, который превращает фактор X в активированный фактор X. Белок С представляет собой эндогенный белок-антикоагулянт, который при активации расщепляет FVIII в его неактивную форму. Когда FVIII подавляется активированной протеин С, может произойти длительное образование тромбина, приводящее к гиперкоагуляции. Дисбаланс в системе FVIII – белок С также способствует гиперкоагуляции. Этот механизм дисбаланса концентраций прокоагулянтов и антикоагулянтов может способствовать гиперкоагуляции и у пациентов с COVID-19 [15]. У нашей пациентки также наблюдалось повышение FVIII на фоне COVID-19. Инфекция COVID-19 связана с глубокой воспалительной реакцией у многих пациентов, которая характеризуется высокими концентрациями интерлейкина-6, фибриногена и ферритина. Также COVID-19 связан с высоким уровнем D-димера, что указывает на обширное образование тромбина и фибринолиз. Эта картина может отражать гиперкоагуляцию, связанную с тяжелым воспалением [16].
Известно, что существуют 3 фактора, предрасполагающих к тромбозу, – триада Вирхова: повреждение эндотелия сосудов, застой крови и гиперкоагуляция [17]. К замедлению кровотока у нашей пациентки привели гиподинамия, ожирение, наследственные нарушения свертывания крови. COVID-19 мог привести как к гиперкоагуляции, так и к повреждению эндотелия сосудов. Гиперкоагуляция была обусловлена также гипергомоцистеинемией, гиперфибриногенемией, гиперпротромбинемией, приемом гормональных контрацептивов. У пациентки диагностирована комбинированная форма наследственной гематогенной гиперкоагуляции. Кроме значимых мутаций генов фолатного цикла отмечался приобретенный фактор – гипергомоцистеинемия, что в совокупности привело к развитию ТЭЛА.
2. При назначении КОК важен индивидуальный подход. Выявленные факторы риска нуждаются в коррекции и могут рассматриваться как противопоказание к данному методу контрацепции. При подозрении на тромбофилию или наследственную гиперкоагуляцию необходимо исследовать систему гемостаза.
3. Повышенный риск тромбоза в условиях COVID-19 определяет необходимость расширения показаний для поиска ТЭЛА всеми возможными инструментальными методами, среди которых наиболее информативным являются МСКТ органов грудной клетки с контрастированием ЛА.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Замахина Ольга Владимировна – канд. мед. наук, доц., доц. каф. пропедевтики внутренних болезней ФГБОУ ВО ОмГМУ. Е-mail: ozamakhina@yandex.ru; ORCID: 0000-0003-0748-2324; Scopus Author ID: 57194465397, SPIN-код: 6080-3216, Author ID: 745819
Olga V. Zamahina – Cand. Sci. (Med.), Associate Professor, Omsk State Medical University. Е-mail: ozamakhina@yandex.ru; ORCID: 0000-0003-0748-2324; Scopus Author ID: 57194465397, SPIN code: 6080-3216; Author ID: 745819
Слепцова Юлия Олеговна – студентка IV курса педиатрического фак-та ФГБОУ ВО ОмГМУ. E-mail: sleptsov4yu@yandex.ru; ORCID: 0009-0000-0860-3867
Julia O. Slepcova – student, Omsk State Medical University.
E-mail: sleptsov4yu@yandex.ru; ORCID: 0009-0000-0860-3867
Усачева Елена Владимировна – канд. мед. наук, доц., доц. каф. внутренних болезней и семейной медицины ФДПО ФГБОУ ВО ОмГМУ. E-mail: elenav.usacheva@yandex.ru; ORCID: 0000-0002-6134-1533; Researcher ID: I-4077-2017; Scopus Author ID: 56380398700
Elena V. Usacheva – Cand. Sci. (Med.), Associate Professor, Omsk State Medical University. E-mail: elenav.usacheva@yandex.ru;
ORCID: 0000-0002-6134-1533; Researcher ID: I-4077-2017; Scopus Author ID: 56380398700
Султан-Муратова Эльвира Гильфановна – ассистент каф. пропедевтики внутренних болезней ФГБОУ ВО ОмГМУ. ORCID: 0009-0008-5859-1700
Elvira G. Sultan-Muratova – Assistant, Omsk State Medical University. ORCID: 0009-0008-5859-1700
Поступила в редакцию: 27.09.2024
Поступила после рецензирования: 04.10.2024
Принята к публикации: 10.10.2024
Received: 27.09.2024
Revised: 04.10.2024
Accepted: 10.10.2024
Клинический разбор в общей медицине №11 2024
Клинический случай тромбоэмболии легочной артерии на фоне активации свертывающей системы крови
Номера страниц в выпуске:19-24
Аннотация
Представлен клинический случай пациентки с нетипичной комбинированной причиной тромбоэмболии легочной артерии (ТЭЛА), ставшей следствием активации свертывающей системы крови на фоне наследственного генетического полиморфизма, приема гормональных контрацептивов и COVID-19, при отсутствии тромбоза глубоких вен, который считается основной причиной развития ТЭЛА.
Материалы и методы. Физикальные методы исследования, шкала вероятности ТЭЛА – Wels, общеклинические лабораторные показатели, уровень D-димера и гомоцистеина в плазме крови, коагулограмма, ПЦР-тест на SARS-CoV-2 в мазке из носоглотки, электрокардиография, эхокардиография, мультиспиральная компьютерная томография органов грудной клетки с внутривенным контрастным усилением легочной артерии. Проанализированы генетические полиморфизмы, ассоциированные с риском гиперкоагуляции. На примере данного клинического случая показано комбинированное воздействие факторов тромбоза как причины ТЭЛА (наследственная предрасположенность, избыточная масса тела, артериальная гипертензия, прием комбинированных оральных контрацептивов, носительство полиморфизмов генов фолатного цикла, повышение VIII фактора свертывания крови, уровня фибриногена, гипергомоцистеинемия). Данные изменения необходимо учитывать, назначая лечение острой ТЭЛА и вторичную профилактику венозных тромбоэмболических осложнений. Выявленные факторы риска нуждаются в коррекции и должны учитываться при выборе метода контрацепции. Повышенный риск тромбоза в условиях COVID-19 определяет необходимость расширения показаний для поиска ТЭЛА всеми возможными методами.
Ключевые слова: тромбоэмболия легочной артерии, гиперкоагуляция, комбинированные оральные контрацептивы, генетический полиморфизм, гипергомоцистеинемия, COVID-19.
Для цитирования: Замахина О.В., Слепцова Ю.О., Усачева Е.В., Султан-Муратова Э.Г. Клинический случай тромбоэмболии легочной артерии на фоне активации свертывающей системы крови. Клинический разбор в общей медицине. 2024; 5 (10): 19–24. DOI: 10.47407/ kr2024.5.11.00512
Представлен клинический случай пациентки с нетипичной комбинированной причиной тромбоэмболии легочной артерии (ТЭЛА), ставшей следствием активации свертывающей системы крови на фоне наследственного генетического полиморфизма, приема гормональных контрацептивов и COVID-19, при отсутствии тромбоза глубоких вен, который считается основной причиной развития ТЭЛА.
Материалы и методы. Физикальные методы исследования, шкала вероятности ТЭЛА – Wels, общеклинические лабораторные показатели, уровень D-димера и гомоцистеина в плазме крови, коагулограмма, ПЦР-тест на SARS-CoV-2 в мазке из носоглотки, электрокардиография, эхокардиография, мультиспиральная компьютерная томография органов грудной клетки с внутривенным контрастным усилением легочной артерии. Проанализированы генетические полиморфизмы, ассоциированные с риском гиперкоагуляции. На примере данного клинического случая показано комбинированное воздействие факторов тромбоза как причины ТЭЛА (наследственная предрасположенность, избыточная масса тела, артериальная гипертензия, прием комбинированных оральных контрацептивов, носительство полиморфизмов генов фолатного цикла, повышение VIII фактора свертывания крови, уровня фибриногена, гипергомоцистеинемия). Данные изменения необходимо учитывать, назначая лечение острой ТЭЛА и вторичную профилактику венозных тромбоэмболических осложнений. Выявленные факторы риска нуждаются в коррекции и должны учитываться при выборе метода контрацепции. Повышенный риск тромбоза в условиях COVID-19 определяет необходимость расширения показаний для поиска ТЭЛА всеми возможными методами.
Ключевые слова: тромбоэмболия легочной артерии, гиперкоагуляция, комбинированные оральные контрацептивы, генетический полиморфизм, гипергомоцистеинемия, COVID-19.
Для цитирования: Замахина О.В., Слепцова Ю.О., Усачева Е.В., Султан-Муратова Э.Г. Клинический случай тромбоэмболии легочной артерии на фоне активации свертывающей системы крови. Клинический разбор в общей медицине. 2024; 5 (10): 19–24. DOI: 10.47407/ kr2024.5.11.00512
Clinical case of pulmonary embolism secondary to coagulation
Olga V. Zamahina, Julia O. Slepcova, Elena V. Usacheva, Elvira G. Sultan-MuratovaOmsk State Medical University, Omsk, Russia
ozamakhina@yandex.ru
Annotation
The article presents a clinical case of a patient with an atypical combined cause of pulmonary embolism (PE), which resulted from activation of the blood coagulation system against the background of hereditary genetic polymorphism, hormonal contraceptives and COVID-19; in the absence of deep vein thrombosis, which is considered the main cause of the development of PE.
Materials and methods: physical research methods, the PE – Wells probability scale, general clinical laboratory parameters, D-dimer and homocysteine levels in blood plasma, coagulogram, PCR test for SARS-CoV-2 in a nasopharyngeal smear, electrocardiography, echocardiography, MSCT of the chest organs with intravenous contrast enhancement of the pulmonary artery. The genetic polymorphisms associated with the risk of hypercoagulation are analyzed. The example of this clinical case shows the combined effects of thrombosis factors as causes of PE (hereditary predisposition, overweight, hypertension, taking combined oral contraceptives, carrying polymorphisms of folate cycle genes, increased blood coagulation factor VIII, fibrinogen levels, hyperhomocysteinemia). These changes should be taken into account when prescribing treatment of acute PE and secondary prevention of venous thromboembolic complications. The identified risk factors need to be corrected and should be taken into account when choosing a method of contraception. The increased risk of thrombosis in COVID-19 conditions determines the need to expand the indications for the search for PE by all possible methods.
Keywords: pulmonary embolism, hypercoagulation, combined oral contraceptives, genetic polymorphism, hyperhomocysteinemia, COVID-19.
For citation: Zamahina O.V., Slepcova J.O., Usacheva E.V., Sultan-Muratova E.G. A clinical case of pulmonary embolism against the background of activation of the blood coagulation system. Clinical review for general practice. 2024; 5 (10): 19–24 (In Russ.). DOI: 10.47407/kr2024. 5.11.00512
Введение
Тромбоэмболия легочной артерии (ТЭЛА) занимает третье место по частоте среди неотложных сердечно-сосудистых заболеваний после инфаркта миокарда и мозгового инсульта. Она выявляется у 35–40 человек на 100 тыс. населения, а тридцатидневная летальность от ТЭЛА у пациентов с тромбозом глубоких вен (ТГВ) достигает 6%. 10–15% пациентов с массивной ТЭЛА умирают в течение 5 лет вследствие хронической тромбоэмболической легочной гипертензии. В одной трети случаев ТЭЛА имеет место внезапная смерть, лечебные мероприятия безуспешны. В случаях ранней летальности диагноз ТЭЛА ставят посмертно более чем в половине эпизодов и лишь в 7% случаев – при жизни пациента [1].ТЭЛА – самая частая нераспознаваемая причина смерти госпитализированных больных. Смертность от нее, по разным данным, составляет до 30%. При этом точной статистики ТЭЛА в России нет. Установить количество бессимптомных нефатальных ТЭЛА не представляется возможным. По результатам российской части реестра ENDORSE факторы риска тромбозов и ТЭЛА выявлены у 52% хирургических и 40% терапевтических больных. При аутопсии частота верифицированной ТЭЛА составила более 14%, преимущественно у пациентов с сердечно-сосудистыми заболеваниями. При жизни она не была распознана у каждого 10-го пациента. Это может быть связано как с быстрым ухудшением состояния больного, так и с длительным ожиданием результатов дополнительных методов исследования. Основной причиной развития ТЭЛА считается наличие ТГВ нижних конечностей [2]. Около трети больных с клиникой ТЭЛА не имеют признаков ТГВ [3, 4]. Массивные ТЭЛА, вероятно, в большинстве случаев определяются наличием ТГВ, тогда как малосимптомные или субклинические случаи могут иметь и другую этиологию. Такая разновидность подтверждается и тем, что данные по летальности и частоте рецидивов при ТЭЛА и ТГВ различны. При ТЭЛА выше как летальность, так и частота рецидивов. Иначе говоря, ТГВ может быть единичным эпизодом, поддающимся излечению и не имеющим дальнейших последствий. Напротив, более высокая распространенность рецидивов ТЭЛА указывает на то, что успешное лечение одного эпизода легочной тромбоэмболии не всегда устраняет причину ее возникновения, которая часто проявляет себя в дальнейшем в виде повторных эпизодов ТЭЛА. Если в случаях сочетания ТЭЛА с ТГВ риск рецидива ТЭЛА может быть устранен инвазивными методами, то в случаях ТЭЛА без ТГВ (а это каждый третий пациент) этиологический фактор остается неизвестен и целенаправленно воздействовать на него невозможно [5].
Цель исследования – представить клинический случай пациентки с нетипичной комбинированной причиной ТЭЛА, ставшей следствием активации свертывающей системы крови на фоне наследственного генетического полиморфизма, приема контрацептивов и COVID-19, а также продемонстрировать значимость гиперкоагуляционных факторов риска развития ТЭЛА.
Материалы и методы
Методы исследования включали анализ медицинской документации, физикальные методы исследования, шкалу вероятности ТЭЛА – Wels, общеклинические лабораторные показатели, уровень D-димера и гомоцистеина в плазме крови, коагулограмму и агрегатограмму, ПЦР-тест на SARS-CoV-2 в мазке из носоглотки, электрокардиографию, экокардиографию (ЭхоКГ), мультиспиральную компьютерную томографию (МСКТ) органов грудной клетки на 64-срезовом компьютерном томографе Philips Ingenuity с внутривенном контрастным усилением легочной артерии (ЛА) Омнипак-350 60 мл. Исследованы генетические полиморфизмы, ассоциированные с риском гиперкоагуляции и венозных тромбоэмболических осложнений.Результаты
Пациентка И., 46 лет, которая длительно принимала комбинированные оральные контрацептивы, в марте 2022 г. перенесла острое респираторное заболевание, во время которого появилась инспираторная одышка при умеренных физических нагрузках, снизилась толерантность к нагрузке, исследование на SARS-CoV-2 не проводилось. 25 апреля этого же года внезапно кратковременно потеряла сознание, была госпитализирована в БСМП №1 с подозрением на инфаркт миокарда.Из объективных данных: сознание ясное, бледность кожных покровов, избыточное развитие подкожно-жировой клетчатки, индекс массы тела – 34,6 кг/м2, тахипноэ – частота дыхательных движений 22 в минуту, сатурация кислорода 94%, температура тела – 36,4 0С, периферические лимфатические узлы не пальпируются, частота сердечных сокращений – 102 уд/мин, артериальное давление 90/60 мм рт. ст., отеков нет. Дыхание жесткое, без побочных дыхательных шумов. Живот при пальпации мягкий, безболезненный. Печень у края реберной дуги. Поколачивание по поясничной области безболезненное. На электрокардиограмме патологический зубец Q в III и AVF, там же отрицательный Т (рис. 1).

Вероятность ТЭЛА по шкале Wels умеренная (4,5 балла). Проведен комплекс исследований для исключения острого коронарного синдрома (тропонин Т 0,46 нг/мл, МВ-фракция креатинфосфокиназы 23 нг/мл), в том числе коронароангиография. Острый коронарный синдром исключен. Показатели общего анализа крови: гемоглобин 123 г/л, эритроциты 4,32×1012/л, тромбоциты 246×109/л, лейкоциты 6,46×109/л, СОЭ 17 ммоль/л. Коагулограмма: VIII факторы свертывания крови 172%, активированное частичное тромбопластиновое время 35,7 с, фибриноген 4,58 г/л, тромбопластиновое время
18 с, D-димер 1854 нг/мл. Уровень ферритина 33,17 мкг/л. В липидном спектре крови – гиперхолестеринемия общего холестерина 5,47 ммоль/л, ЛПНП 3,52 ммоль/л. На ЭхоКГ среднее давление в ЛА (СДЛА) – 40 мм рт. ст., трикуспидальная регургитация 1-й степени, полости сердца не расширены, фракция выброса 58% по Симпсону, зон гипокинеза не выявлено. На МСКТ органов грудной клетки с контрастированием ЛА обнаружены признаки субмассивной ТЭЛА: в просвете ЛА нижней доли правого легкого определяется тромб, сужающий просвет артерии на 100%, распространяющийся в сегментарные и субсегментарные ветви S7-8-9; в просвете ЛА верхней доли правого легкого – тромб, суживающий просвет артерии на 50% и распространенный на передний сегмент; в просвете ЛА нижней доли легкого – тромб, суживающий просвет сосудов до 50%, с распространением на язычковые и передне-базальные сегменты (рис. 2).

При этом архитектоника ЛА не нарушена. На МСКТ также были обнаружены признаки образования верхней доли правого легкого, внутригрудной лимфаденопатии; правостороннего гидроторакса, малого объема. Поставлен диагноз «ТЭЛА субмассивная, острое течение». Так как поступление в стационар пришлось на период пандемии COVID-19, было проведено исследование мазка из носоглотки на SARS-CoV-2 методом ПЦР, и он был положительным. Пациентке проведена системная тромболитическая терапия препаратом Актилизе, назначена антикоагулянтная терапия гепарином с дальнейшим переводом на Эликвис 5 мг – 2 раза в день, также проводилась патогенетическая терапия COVID-19. Таким образом, от появления первых симптомов до проведения системного тромболизиса прошло 2 нед. Диагностический поиск первопричины ТЭЛА включал: исключение онкопатологии (фиброэзофагогастроскопия, колоноскопия, МСКТ органов брюшной полости, ультразвуковое исследование молочных желез и щитовидной железы), исключение тромбоза глубоких вен нижней конечностей (дуплексное сканирование вен нижней конечностей) [6]. Признаков онкопатологии и периферического венозного тромбоза не было выявлено. При осмотре глазного дна офтальмологом: гипертонический ангиосклероз. Интересен, на наш взгляд, наследственный анамнез, который не был собран подробно при поступлении пациентки в стационар. Из него стало известно о наследственной предрасположенности: у матери пациентки в таком же возрасте был эпизод ТЭЛА. В связи этим ее направили амбулаторно на консультацию гемостазиолога для исключения тромбофилии. Через 3 мес после выписки динамика положительная, одышка инспираторная при значительной физической нагрузке, снизилось СДЛА до 28 мм рт.ст. по ЭхоКГ; на МСКТ органов грудной клетки с контрастированием ЛА признаков тромбоза не обнаружено. В июле 2022 г. пациентка была проконсультирована гемостазиологом, назначено расширенное коагулогическое исследование, выявлены полиморфизмы генов фолатного цикла, гипергомоцистеинемия (16,23 ммоль/л.), гиперагрегация тромбоцитов, спонтанная и с аденозиндифосфатом.
К лечению добавлены Тромбо АСС, Ангиовит. При контроле через 1 мес достигнута фактическая нормокоагуляция с тенденцией к гиперкоагуляции, снизился уровень гомоцистеина до 9,33 мкмоль/л.
Диагноз. Активация свертывающей системы крови, обусловленная гиперагрегацией тромбоцитов, повышением VIII фактора свертывания крови, уровня фибриногена, гипергомоцистеинемией. Носительство ДНК-полиморфизмов генов фолатного цикла. Состояние после острой субмассивной ТЭЛА (25.04.2022). Тромболизис Актилизе 25.04.2022. Факторы тромбогенного риска (ожирение, отягощенная наследственность).
Сопутствующие заболевания. Гипертоническая болезнь 2-й ст., риск 3. Гиперхолестеринемия. Хроническая железодефицитная анемия на фоне полименореи, компенсация. Остеоартроз коленных и голеностопных суставов. Стеатоз печени. Липоматоз поджелудочной железы. Полип сигмовидной кишки. Хронический эриматозный пангастрит.
Обсуждение
Типичная клиническая картина, характерные изменения в лабораторных анализах (повышение D-димера), отсутствие зон гипокинеза и повышение СДЛА на ЭхоКГ, а также доступность МСКТ позволили своевременно диагностировать, начать лечение ТЭЛА и получить хороший результат. Современная тромболитическая терапия довольно эффективна у данной категории больных при своевременной диагностике. Но в некоторых случаях, когда ТЭЛА происходит на фоне полного благополучия, появляются сложности в своевременной диагностике. О.В. Фисенко и соавт. показали при анализе факторов риса ТЭЛА у молодых пациентов до 50 лет, что источником ТЭЛА у всех был ТГВ голеней; у части из них провели исследование на тромбофилии, и тромбофилические состояния выявлены у 9% (мутация генов протромбина G20210А, гена активатора плазмогена G4/G5 и гипергомоцистеинемия). У 9% пациентов не был найден первичный источник тромбоза при вскрытии. Также учеными было показано, что потеря сознания не частая, но клинически важная манифестация ТЭЛА, так как отражает критическое падение гемодинамики; реже единственным проявлением может быть появление нарастающей в течение нескольких недель одышки [7]. У нашей пациентки одышка появилась за 2 нед до потери сознания, но так как она расценивалась амбулаторно в рамках проявлений острого респираторного заболевания, вероятно, SARS-CoV-2 этиологии, невозможно однозначно отнести ее к симптому ТЭЛА.У пациентки не было факторов высокого риска, поэтому диагноз ТЭЛА мог оказаться неочевидным, особенно учитывая изменения на ЭКГ, имитирующие очаговый процесс на нижней стенке левого желудочка.
В ходе обследования были выявлены слабые (избыточная масса тела, артериальная гипертензия) и умеренные (прием КОК, отягощенный наследственный анамнез по тромбоэмболизму) факторы риска, сочетание которых оказало потенцирующее действие, что привело к образованию дефекта в системе гемостаза и развитию ТЭЛА. Перенесенная инфекция COVID-19 у нашей пациентки также могла выступать еще одним фактором риска активации свертывающей системы крови. Показано, что за год среди лиц с ТГВ доля пациентов, у которых по МСКТ диагностировали ТЭЛА, выросла с 11,9% в доковидный период до 24% в первый год пандемии COVID-19 [8]. Данные А.А. Плешко свидетельствует о наличии у пациентов с подтвержденной инфекцией SARS-CoV-2 и повышенным уровнем D-димера на момент госпитализации COVID-19-ассоциированной коагулопатии. Патогенетические основы и факторы тромбогенного риска у пациентов с COVID-19 требуют дальнейшего уточнения [9].
Выявлено, что частота регистрации генетических нарушений свертывающей и противосвертывающей систем крови у лиц, перенесших ТЭЛА, очень высока и составляет 95,97%, по данным Е.В. Мяленка и соавт., больные ТЭЛА при этом чаще имеют две мутации. Исследователи отметили тенденцию к более частой регистрации у женщин сочетания полиморфизмов в генах PAI-I, MTHFR и фактора I [10]. По данным Е.А. Филатовой и соавт., ТЭЛА наблюдалась в дебюте 60% пациентов с наследственной гематогенной тромбофилией [11]. У пациентки из представленного клинического случая как раз присутствовал генетический полиморфизм генов фолатного цикла – MTHFR, MTRR, MTR. Эти гены кодируют ферменты, участвующие на разных этапах реакции восстановления фолатов, к которым относятся, например, витамины B9 и B12. Главная цель этой реакции – получить от фолатов как можно больше метильных групп и обезвредить гомоцистеин. Это промежуточный продукт обмена фолатов и метионина – исходного материала для реакций метилирования или переноса метильной группы. Метилирование ДНК регулирует работу генов, а фолатный цикл как бы расставляет «выключатели» в нужных местах генома [12]. Однако нет четкого определения, когда именно у пациента начнут проявляться первые симптомы генетического полиморфизма. Гиперкоагуляция является многофакторной и может зависеть как от наследственных, так и от приобретенных факторов. Наследственная тромбофилия встречается реже и связана с определенными мутациями в белках, связанных с каскадом свертывания крови [13]. Приобретенная гиперкоагуляция встречается гораздо чаще и может быть результатом приема лекарств (например, эстрогенсодержащих контрацептивов, заместительной гормональной терапии, тамоксифена или ралоксифена), злокачественных новообразований, воспалительного состояния, вызванного беременностью, травмой, хирургическим вмешательством, инфекцией и хроническими воспалительными состояниями, такими, например, как патологическое ожирение, аутоиммунные заболевания, тяжелое курение, антифосфолипидный синдром, гепарининдуцированная тромбоцитопения и тромбоз [14]. Из причин приобретенной гиперкоагуляции у нашей пациентки присутствовали прием КОК, ожирение и инфекция COVID-19.
Фактор (F) VIII представляет собой прокоагулянтный фактор, который хранится в эндотелиальных клетках и высвобождается во время воспаления. Он играет решающую роль в коагуляции, поскольку является кофактором теназного комплекса, который превращает фактор X в активированный фактор X. Белок С представляет собой эндогенный белок-антикоагулянт, который при активации расщепляет FVIII в его неактивную форму. Когда FVIII подавляется активированной протеин С, может произойти длительное образование тромбина, приводящее к гиперкоагуляции. Дисбаланс в системе FVIII – белок С также способствует гиперкоагуляции. Этот механизм дисбаланса концентраций прокоагулянтов и антикоагулянтов может способствовать гиперкоагуляции и у пациентов с COVID-19 [15]. У нашей пациентки также наблюдалось повышение FVIII на фоне COVID-19. Инфекция COVID-19 связана с глубокой воспалительной реакцией у многих пациентов, которая характеризуется высокими концентрациями интерлейкина-6, фибриногена и ферритина. Также COVID-19 связан с высоким уровнем D-димера, что указывает на обширное образование тромбина и фибринолиз. Эта картина может отражать гиперкоагуляцию, связанную с тяжелым воспалением [16].
Известно, что существуют 3 фактора, предрасполагающих к тромбозу, – триада Вирхова: повреждение эндотелия сосудов, застой крови и гиперкоагуляция [17]. К замедлению кровотока у нашей пациентки привели гиподинамия, ожирение, наследственные нарушения свертывания крови. COVID-19 мог привести как к гиперкоагуляции, так и к повреждению эндотелия сосудов. Гиперкоагуляция была обусловлена также гипергомоцистеинемией, гиперфибриногенемией, гиперпротромбинемией, приемом гормональных контрацептивов. У пациентки диагностирована комбинированная форма наследственной гематогенной гиперкоагуляции. Кроме значимых мутаций генов фолатного цикла отмечался приобретенный фактор – гипергомоцистеинемия, что в совокупности привело к развитию ТЭЛА.
Выводы
1. На примере данного клинического случая показано комбинированное воздействие факторов тромбоза как причина ТЭЛА без ТГВ (наследственная предрасположенность, избыточная масса, артериальная гипертензия, прием КОК, носительство полиморфизмов генов фолатного цикла, повышение VIII фактора свертывания крови, уровня фибриногена, гипергомоцистеинемия), что затрудняло постановку окончательного диагноза. Данные изменения необходимо учитывать, назначая лечение острой ТЭЛА и вторичную профилактику венозных тромбоэмболических осложнений. Терапия должна быть длительной и включать препараты, воздействующие на различные звенья свертывающей системы исходя не только из данных лабораторных показателей нарушения гомеостаза, но и из данных молекулярно-генетических исследований.2. При назначении КОК важен индивидуальный подход. Выявленные факторы риска нуждаются в коррекции и могут рассматриваться как противопоказание к данному методу контрацепции. При подозрении на тромбофилию или наследственную гиперкоагуляцию необходимо исследовать систему гемостаза.
3. Повышенный риск тромбоза в условиях COVID-19 определяет необходимость расширения показаний для поиска ТЭЛА всеми возможными инструментальными методами, среди которых наиболее информативным являются МСКТ органов грудной клетки с контрастированием ЛА.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Замахина Ольга Владимировна – канд. мед. наук, доц., доц. каф. пропедевтики внутренних болезней ФГБОУ ВО ОмГМУ. Е-mail: ozamakhina@yandex.ru; ORCID: 0000-0003-0748-2324; Scopus Author ID: 57194465397, SPIN-код: 6080-3216, Author ID: 745819
Olga V. Zamahina – Cand. Sci. (Med.), Associate Professor, Omsk State Medical University. Е-mail: ozamakhina@yandex.ru; ORCID: 0000-0003-0748-2324; Scopus Author ID: 57194465397, SPIN code: 6080-3216; Author ID: 745819
Слепцова Юлия Олеговна – студентка IV курса педиатрического фак-та ФГБОУ ВО ОмГМУ. E-mail: sleptsov4yu@yandex.ru; ORCID: 0009-0000-0860-3867
Julia O. Slepcova – student, Omsk State Medical University.
E-mail: sleptsov4yu@yandex.ru; ORCID: 0009-0000-0860-3867
Усачева Елена Владимировна – канд. мед. наук, доц., доц. каф. внутренних болезней и семейной медицины ФДПО ФГБОУ ВО ОмГМУ. E-mail: elenav.usacheva@yandex.ru; ORCID: 0000-0002-6134-1533; Researcher ID: I-4077-2017; Scopus Author ID: 56380398700
Elena V. Usacheva – Cand. Sci. (Med.), Associate Professor, Omsk State Medical University. E-mail: elenav.usacheva@yandex.ru;
ORCID: 0000-0002-6134-1533; Researcher ID: I-4077-2017; Scopus Author ID: 56380398700
Султан-Муратова Эльвира Гильфановна – ассистент каф. пропедевтики внутренних болезней ФГБОУ ВО ОмГМУ. ORCID: 0009-0008-5859-1700
Elvira G. Sultan-Muratova – Assistant, Omsk State Medical University. ORCID: 0009-0008-5859-1700
Поступила в редакцию: 27.09.2024
Поступила после рецензирования: 04.10.2024
Принята к публикации: 10.10.2024
Received: 27.09.2024
Revised: 04.10.2024
Accepted: 10.10.2024
Список исп. литературыСкрыть список1. Cohen A, Agnelli G, Anderson F et al. Venous thromboembolism (VTE) in Europe. The number of VTE events and associated morbidity and mortality. Thromb Haemost 2007;98(4):756-64. DOI: 10.1160/TH07-03-0212. PMID: 17938798.
2. Верткин А.Л., Грицанчук А.М. Тромбоэмболия легочной артерии: эпидемия, о которой все молчат. Архивъ внутренней медицины. 2014;1(15):33-9.
Vertkin A.L., Gricanchuk A.M. Pulmonary embolism: an epidemic that everyone is silent about. The Russian Archives of Internal Medicine. 2014;1(15):33-9. DOI: 10.20514/2226-6704-2014-0-1-33-39 (in Russian).
3. Kearon C. Natural history of venous thromboembolism. Circulation 2003;23(107):122-30. DOI: 10.1161/01.CIR.0000078464.82671.78
4. Moser K, Fedullo P, Litte JJ, Crawford R. Frequent asymptomatic pulmonary embolism in patients with deep venous thrombosis. JAMA 1994;271(3):223-5. PMID: 8277550.
5. Цибулькин Н.А., Фролова Э.Б., Абдрахманова А.И., Тухватуллина Г.В. Современные проблемы патогенеза и диагностики тромбоэмболии легочной артерии. Практическая медицина. 2020;1(18):8-12. DOI: 10.32000/2072-1757-2020-1-8-12.
Tsibulkin N.A., Frolova E.B., Abdrakhmanova A.I., Tukhvatullina G.V. Current issues of pathogenesis and diagnostics of pulmonary embolism. Practical medicine. 2020;1(18):8-12. DOI: 10.32000/2072-1757-2020-1-8-12 (in Russian).
6. Konstantinides SV. Рекомендации ESC по диагностике и лечению острой легочной эмболии, разработанные в сотрудничестве с Европейским респираторным обществом (ERS), 2019. Рос. кардиол. журн. 2020;25(8):3848. DOI: 10.15829/1560-4071-2020-38487
Konstantinides SV. 2019 ESC Guidelines for the diagnosis and management of acute pulmonaryembolism developed in collaboration with the European Respiratory Society (ERS). Russian Journal of Cardiology. 2020;25(8):3848. DOI: 10.15829/1560-4071-2020-38487 (in Russian).
7. Фесенко О.В., Синопальников А.И., Глечиков А.В. Анализ летальных исходов при тромбоэмболии легочной артерии у лиц молодого возраста. Терапевтический архив. 2013;3(85):44-50.
Fesenko O.V., Sinopal’nikov A.I., Glechikov A.V. Analysis of fatal outcomes from pulmonary thromboembolism in young subjects. Terapevticheskii arkhiv. 2013;3(85):44-50 (in Russian).
8. Капустина Е.П., Акрамова Э.Г., Гайфуллина Р.Ф. Распространенность ТЭЛА у пациентов с тромбозом глубоких вен в условиях COVID-19 (по материалам МСЧ КФУ). IV Международный конгресс, посвященный А.Ф. Самойлову «Фундаментальная и клиническая электрофизиология. Актуальные вопросы аритмологии». Рос. кардиол. журн. 2021;26(5S):3-67. DOI: 10.15829/1560-4071-2021-5S
Kapustina EP, Akramova JeG, Gajfullina RF. Prevalence of PE in patients with deep vein thrombosis in COVID-19 settings (based on MSC KFU) IV International congress dedicated to A.F. Samoilov «Fundamental and clinical electrophysiology. Topical issues of arhythmology». Russian Journal of Cardiology. 2021;26(5S):3-67. DOI: 10.15829/1560-4071-2021-5S (in Russian).
9. Плешко А.А. Клинико-лабораторные особенности течения тромбоэмболии легочной артерии у пациентов с COVID-19 и повышенным уровнем D-димера на момент госпитализации. Медицинский журнал. 2022;3(81):99-104. DOI: 10.51922/1818-426X.2022.3.99
Pleshko A.A. Clinical and laboratory features of the course of pulmonary embolism in patients with COVID-19 and elevated D-dimer levels at the time of hospitalization. Medical journal. 2022;3(81):99-104. DOI: 10.51922/1818-426X.2022.3.99 (in Russian).
10. Мяленка Е.В., Чурилов Л.П., Яблонский П.К. Оценка частоты регистрации основных наследственных форм тромбофилии при тромбоэмболии легочной артерии с учетом пола больных. Крымский журнал экспериментальной и клинической медицины. 2016;6(4):27-35.
Myalenka E.V., Churilov L.P., Yablonsky P.K. Assessment of the frequency of registration of major hereditary forms of thrombophilia in pulmonary embolism according to gender of patients. Crimean Journal of Experimental and Clinical Medicine. 2016;6(4):27-35 (in Russian).
11. Войцеховский В.В., Ландышев Ю.С., Гоборов Н.Д., Филатова Е.А. Тромбоэмболия легочной артерии в дебюте наследственной гематогенной тромбофилии. Бюллетень физиологии и патологии дыхания. 2016;62:89-100. DOI: 10.12737/23259
Voytsekhovskiy V.V., Landyshev Yu.S., Goborov N.D., Filatova E.A. Pulmonary embolism in the onset of genetic hematogenical thrombophilia. Bulletin Physiology and Pathology of Respiration. 2016;62:89-100. DOI: 10.12737/23259 (in Russian).
12. Panigada M, Bottino N, Tagliabue P et al. Hypercoagulability of COVID-19 patients in intensive care unit: A report of thromboelastography findings and other parameters of hemostasis. J Thromb Haemost 2020;18(7):1738-42. DOI: 10.1111/jth.14850
13. Lowe GD. Venous and arterial thrombosis: epidemiology and risk factors at various ages. Maturitas 2004;47(4):259-63. DOI: 10.1016/j.maturitas.2003.12.009
14. Heit JA, Spencer FA, White RH. The epidemiology of venous thromboembolism. J Thromb Thrombolysis 2016;41(1):3-14. DOI: 10.1007/s11239-015-1311-6
15. Moll S. Thrombophilia: clinical-practical aspects. J Thromb Thrombolysis 2015;39(3):367-78. DOI: 10.1007/s11239-015-1197-3
16. Tabatabai A, Rabin J, Menaker J et al. Factor VIII and Functional Protein C Activity in critically Ill Patients With Coronavirus Disease 2019: A Case Series. Pract 2020;14(7):e01236. DOI: 10.1213/XAA. 0000000000001236
17. Lurie JM, Png CYM, Subramaniam S et al. Virchow’s triad in “silent” deep vein thrombosis. J Vasc Surg Venous Lymphat Disord 2019;7(5):640-5. DOI: org/10.1016/j.jvsv.2019.02.011
18 декабря 2024
Количество просмотров: 722

