Клинический разбор в общей медицине №01 2020
Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia dvoretski@mail.ru
Abstract
Comorbidities are an important factor of the various infectious respiratory diseases emergence, complications development and prognosis. The most frequent comorbidities affecting the course and outcome of respiratory infections are the following: cardiovascular disease (heart failure, various types of coronary artery disease, cerebrovascular disease), chronic obstructive pulmonary disease, diabetes mellitus, obesity. The paper reports data on the discussed comorbidities impact on the course and outcome of bacterial and viral respiratory infections, inter alia in patients with COVID-19.
Key words: comorbidity, lower respiratory tract infections, pneumonia, СОVID-19.
For citation: Dvoretsky L.I. Lower respiratory tract infections in patients with comorbidities. Clinical review for general practice. 2020; 1: 29–34. DOI: 10.47407/kr2020.1.1.00005
Клиническая практика свидетельствует о том, что бактериальные и вирусные инфекции нижних дыхательных путей (ИНДП) возникают в большинстве случаев у лиц с наличием различной патологии (коморбидность, полиморбидность), определяющей во многом течение, прогноз и исход заболевания.
По современным представлениям, коморбидностью обозначают состояния (заболевания, осложнения), патогенетически связанные с основным заболеванием. Полиморбидность определяется как заболевание/заболевания, не имеющие патогенетической связи с основной нозологической формой. В то же время понимание современного уровня механизмов развития различных патологических процессов и взаимоотношения двух или нескольких заболеваний между собой вскрывает все больше и больше патогенетических связей на разных уровнях между двумя (или более) сосуществующими заболеваниями, казалось бы, не имеющих ничего общего между собой. Иллюстрацией этого может служить наличие у больного ишемической болезни сердца (ИБС) и хронической обструктивной болезни легких (ХОБЛ), которые в настоящее время не могут рассматриваться лишь как сопутствующие, поскольку выявлено немало общих патогенетических механизмов, влияющих на течение, осложнения, прогноз [1]. С учетом влияния существующих у больных заболеваний на развитие, течение и исход ИНДП, т.е. наличия патогенетических связей между имеющимися патологическими процессами, кажется, более оправданным при обсуждении данной проблемы использовать термин коморбидность.
Основными особенностями «патологического содружества» ИНДП с коморбидной патологией, вырастающими в особые клинические проблемы, являются следующие:
• диагностика ИНДП;
• этиологическая структура ИНДП;
• течение и прогноз ИНДП (тяжесть, ответ на лечение, частота и характер осложнений, летальность);
• течение коморбидных заболеваний;
• лечение ИНДП и коморбидной патологии.
Уже на этапах диагностики ИНДП у коморбидных пациентов могут возникать диагностические сложности в распознавании инфекционного процесса (пневмонии, инфекционного обострения ХОБЛ), который может манифестироваться декомпенсацией коморбидной патологии. Так, первыми проявлениями респираторной инфекции нередко являются усугубление признаков хронической сердечной недостаточности (ХСН), цереброваскулярной патологии, когнитивных нарушений, декомпенсация сахарного диабета (СД), усиление выраженности бронхиальной обструкции. Этим может объясняться сложность своевременного распознавания ИНДП в подобных клинических ситуациях.
Характер коморбидной патологии в известной степени определяет этиологические особенности ИНДП, т.е. имеется определенная «привязанность» типа коморбидности к определенным этиологически значимым микроорганизмам (Haemophilus influenzae при инфекционном обострении ХОБЛ, Staphylococcus aureus при хронической алкогольной интоксикации, анаэробная флора у лиц с риском аспираций).
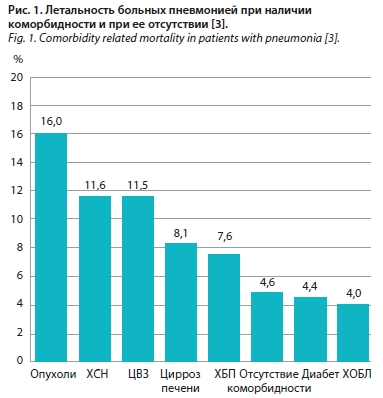 Большинство исследований свидетельствуют о более тяжелом характере течения заболевания и повышенной летальности от ИНДП у больных различной коморбидностью. Показано, что у больных гриппом A с наличием любой коморбидности тяжелый дистресс-синдром развивается в 3–4 раза чаще [2], а летальность от пневмонии значительно выше у больных различным типом коморбидности (рис. 1).
Большинство исследований свидетельствуют о более тяжелом характере течения заболевания и повышенной летальности от ИНДП у больных различной коморбидностью. Показано, что у больных гриппом A с наличием любой коморбидности тяжелый дистресс-синдром развивается в 3–4 раза чаще [2], а летальность от пневмонии значительно выше у больных различным типом коморбидности (рис. 1).
При анализе течения и прогноза коронавирусной инфекции (COVID-19) показано влияние наличия коморбидности на течение инфекционного заболевания: время достижения конечных точек – госпитализация в отделение реанимации и интенсивной терапии (ОРИТ), искусственная вентиляция легких (ИВЛ), смерть, причем выявлена отчетливая зависимость достижения конечных точек от числа коморбидных заболеваний [4]. Неизбежны и терапевтические проблемы ведения коморбидных пациентов с ИНДП (выбор антибиотика, особенности фармакокинетики в зависимости от характера коморбидности, риск лекарственных взаимодействия, лечение коморбидной патологии).
Наиболее частыми коморбидными заболеваниями, влияющими на течение и исход ИНДП, являются:
• сердечно-сосудистые заболевания: сердечная недостаточность, ИБС в различных проявлениях, цереброваскулярные заболевания (ЦВЗ);
• ХОБЛ;
• СД;
• ожирение (ОЖ).
ХСН относится к одной из частых коморбидностей, влияющих на развитие, течение и исход ИНДП, в частности внебольничной пневмонии (ВП).
По данным разных авторов, ХСН регистрируется у 9,5–34,0% больных ВП и достоверно повышает риск развития ВП, а также является предиктором более тяжелого его течения [5, 6] и независимым фактором повышенной летальности при ВП [7–9]. Известно, что ХСН входит в шкалу PORT (Pneumonia Outcomes Research Team), применяющуюся с целью оценки класса риска и прогноза ВП, а также выбора места лечения пациента (амбулаторно или стационарно).
Не менее важной особенностью коморбидности ВП и сердечно-сосудистых заболеваний является декомпенсация кардиальной патологии и развитие различных осложнений (нарушение ритма, острый коронарный синдром, тромбоэмболия легочной артерии), что определяет тактику ведения данной категории пациентов. По данным ряда исследований, у пациентов с ВП частота выявления декомпенсированной недостаточности кровообращения достигает 9,1–14,7%, нарушений сердечного ритма – 2,8–9,3%, инфаркта миокарда – от 1,2 до 7,9%. Возникновение у больных ВП различных сердечно-сосудистых нарушений значительно ухудшает прогноз и достоверно повышает показатели госпитальной летальности [10, 11].
В одном исследовании проанализирована роль различных инфекций, ставших поводом для госпитализации больных с ХСН. Среди 9335 больных с ХСН, госпитализированных за 10-летний период, 38% госпитализировались в связи с наличием инфекции. Наиболее часто (52,6%) диагностировались респираторные и генерализованные (сепсис, бактериемия) инфекции (52,6 и 23,6% соответственно). Госпитализация пациентов с ХСН с инфекцией ассоциировалась с более высокой 30-дневной летальностью по сравнению с другими причинами госпитализации (13 и 8% соответственно; р<0,0001), причем высокие показатели летальности наблюдались преимущественно среди больных с респираторной инфекцией и сепсисом). Факторами риска инфекций у больных c ХСН являлись женский пол, наличие ХОБЛ, перенесенный инфаркт миокарда, ЭхоКГ-признаки правожелудочковой дисфункции [12].
COVID-19 и хронические сердечно-сосудистые заболевания. В одном из последних метаанализов о влиянии коморбидности на течение и исходы инфекции SARS-CoV-2 показано, что у больных с кардиоваскулярными заболеваниями (КВЗ) наблюдается более тяжелое течение инфекции, чаще возникают необходимость госпитализации в ОРИТ и показания к ИВЛ, отмечается более высокая летальность [13]. По данным регрессионного анализа другого исследования, независимыми факторами внутрибольничной летальности больных CОVID-19 были артериальная гипертензия (АГ) [отношение рисков (ОР) 2,50, 95% доверительный интервал (ДИ) 1,30–4,78], КВЗ (ОР 2,24, 95% ДИ 1,19–4,23) и ХОБЛ (ОР 2,51, 95% ДИ 1,07–5,90) [14]. По данным Китайского центра контроля и профилактики заболеваний, летальность от COVID-19 среди 44 672 больных составила в общей группе 2,3%, в то время как у лиц с сердечно-сосудистыми заболеваниями достигала 10,5% [15].
Высокая распространенность ВП у больных с обострением ХОБЛ, составившая за трехлетний период 78,5 на 1000 человеко-лет, показана в обстоятельном исследовании на основании ретроспективного анализа больных [19]. Риск развития ВП увеличивался с возрастом, при низком индексе массы тела, наличии рака легкого, бронхоэктазов, а также у больных, получавших лечение ингаляционными глюкокортикостероидами – ИГКС (только при отсутствии другой коморбидности) [20].
Этиология ВП у больных ХОБЛ, в сравнении с инфекционными обострениями ХОБЛ без легочной инфильтрации, чаще ассоциируется с S. pneumoniae, атипичными возбудителями, реже – с грамотрицательными энтеробактериями и сопоставима в отношении H. influenzae [21, 22]. У больных ХОБЛ с развитием ВП выше вероятность выделения Pseudomonas aeruginosa (соответственно в 5,6 и 1,3% случаев), чем у не страдающих ХОБЛ [23].
Инфекционное обострение ХОБЛ или ВП? Среди различных клинических ситуаций в практике интерниста и пульмонолога существует диагностическая альтернатива – «пневмония или инфекционное обострение ХОБЛ?». Диагностические ошибки в подобных ситуациях происходят как в сторону гипер-, так и гиподиагностики ВП. Верификация пневмонии у больных с обострением ХОБЛ является практически важной не только с точки зрения конструкции диагноза, но и тактики ведения больных. О низком уровне диагностики ВП у больных ХОБЛ свидетельствуют патологоанатомические исследования, по данным которых прижизненная диагностика ВП в стационаре отсутствовала в 34,7% случаев, а среди больных, наблюдавшихся врачами поликлиники, ВП не была выявлена в 82,1% [24]. Подчеркивается, что уровень диагностики пневмонии при ХОБЛ оказывается наиболее низким среди всех видов пневмоний, выявленных на аутопсии. По современным представлениям, инфекция играет важную роль в течении и прогрессировании ХОБЛ, в связи с чем взаимоотношения между ХОБЛ и респираторной инфекцией правомочно рассматривать как сложную коморбидность, оказывающую взаимное влияние [25]. С одной стороны, инфекция является одной из частых причин обострений ХОБЛ, каждое из которых вносит свой вклад в прогрессирование легочного процесса. С другой стороны, наличие ХОБЛ с морфофункциональными особенностями, ремоделированием бронхов, нарушением мукоцилиарного клиренса приводит к колонизации бронхиальной слизистой микроорганизмами и ухудшению их элиминации.
В попытках выявить предикторы исходов ИНДП при коморбидности изучали прогностическое значение индекса коморбидности Чарльсона у больных тяжелой острой респираторной инфекцией [26]. Среди 219 больных коморбидная патология выявлялась у 72,8%, а летальные исходы наблюдались в 24% случаев. Наиболее частой коморбидностью являлись ХОБЛ и ВИЧ-инфекция (36 и 23,6% соответственно). Скорректированный по возрасту индекс Чарльсона имел предсказательную ценность у больных с госпитальной летальностью при наличии ХОБЛ и ВИЧ (p=0,04 и р=0,032 соответственно).
ИГКС как фактор риска пневмонии у больных ХОБЛ. Особой формой коморбидности является прием различных лекарственных препаратов, вызывающих нежелательные побочные эффекты, которые становятся факторами риска развития, течения и прогноза ряда заболеваний, в частности ИНДП. Иллюстрацией подобной «ятрогенной коморбидности» является повышенная склонность к развитию инфекций у больных, леченных глюкокортикоидами, иммунодепрессантами, цитостатическими препаратами. Особенно неблагоприятную роль в отношении повышенного риска инфекций (бактериальные и грибковые инфекции, туберкулез) снискали глюкокортикоиды. С введением в клиническую практику ИГКС обсуждается их взаимоотношение с ИНДП (ятрогенная коморбидность).
В крупном исследовании «случай-контроль» частота приема ИГКС у пациентов, заболевших ВП, составила 48,2% (в контрольной группе – 30,1%). После учета влияния прочих факторов риска, риск госпитализации по поводу ВП на фоне приема ИГКС составил 70% (ОШ 1,70, 95% ДИ 1,63–1,77). Отмечено дозозависимое возрастание риска госпитализации и летального исхода при ВП. Максимальный риск был при высоких дозах ИГКС (>1000 мкг в пересчете на флутиказон; ОШ 2,25). Риск развития ВП с летальным исходом в течение 30 дней при использовании ИГКС увеличивался на 53% (ОШ 1,53), а при применении высоких доз ИГКС – на 78% (ОШ 1,78) [27].
В текущем исследовании ученые рассмотрели 18 рандомизированных клинических исследований, некоторые из которых были опубликованы, с участием около 17 тыс. пациентов в общей сложности. Они сравнили заболеваемость пневмонией у пациентов, принимавших ИГКС в течение 24 нед, по сравнению с пациентами, которые принимали плацебо или комбинацию ИГКС + длительно действующие β-антагонисты по сравнению с пациентами, которые принимали только длительного действия бронходилататоры.
Анализ результатов показал, что применение ИГКС, по крайней мере, 24 нед в одиночку или в сочетании с бронхолитиками связано со значительным увеличением риска развития пневмонии и серьезных пневмоний (на 60–70%), однако это не было связано с повышенным риском смерти. В абсолютном выражении исследование показало, что у одного из 47 пациентов с ХОБЛ при использовании ИГКС в течение 1 года развивается пневмония, связанная с применением препарата. Среди больных ХОБЛ с развитием пневмонии и при ее отсутствии число лиц, принимавших ИГКС, составило 74 и 48% соответственно, что позволяет считать лечение ИГКС одним из факторов риска развития ВП у больных ХОБЛ [28].
По подсчетам установлено, что у одного из 47 пациентов, получавших ИГКС в течение 1 года, возникала пневмония [28]. Повышение риска развития ИНДП на фоне лечения ИГКС наблюдается не только среди больных ХОБЛ, у которых и без того повышенная микробная колонизация бронхиальной слизистой [29], но также и у больных бронхиальной астмой [30].
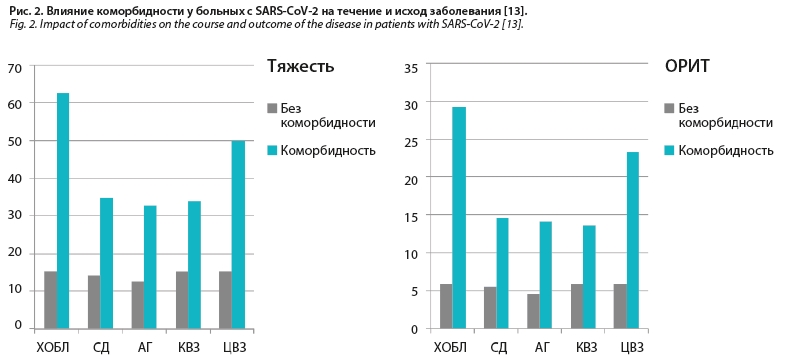
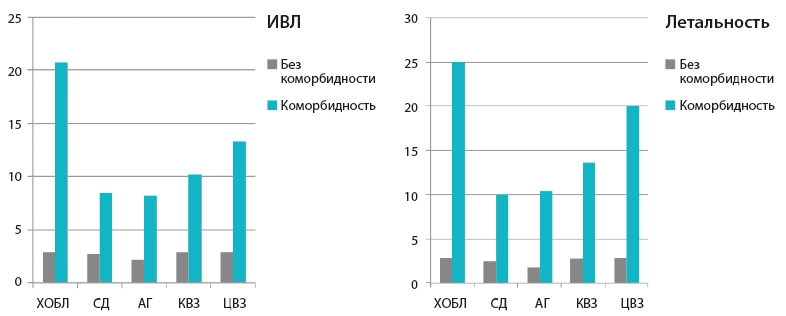
COVID-19 у больных ХОБЛ. Клинический опыт в период пандемии COVID-19 показал, что ХОБЛ является одним из типов коморбидности, прогнозирующих тяжелое течение инфекции COVID-19. Так, при анализе влияния различных типов коморбидности на течение заболевания у 1590 больных COVID-19 показано более раннее достижение сроков конечных точек (госпитализация в ОРИТ, ИВЛ, смерть) среди больных с наличием ХОБЛ [2,681 (1,424–5,058) р<0,002; 95% ДИ] [4]. В другом исследовании [13] показано, что при наличии такой коморбидности, как ХОБЛ, наблюдается более тяжелое течение инфекции SARS-CoV-2, более частая госпитализация в ОРИТ и необходимость ИВЛ, а также повышенная летальность (рис. 2).
• высокая частота инфекций, вызываемых S. aureus, грамнегативными микроорганизмами и M. tuberculosis;
• более частая (трехкратное увеличение) колонизация носоглотки S. aureus;
• более частая бактериемия при пневмококковой пневмонии и смертность от нее;
• более частое развитие бактериальной пневмонии и смертность от нее во время эпидемий гриппа.
Показатели 30-дневной летальности от пневмонии среди больных СД 2-го типа были выше, чем у пациентов без диабета [19,9 и 15,1% соответственно, р<0,01 при 95% ДИ 1,16 (1,07–1,27)]. Более того, достоверное повышение летальности от пневмонии у больных СД наблюдалось также в течение 90 дней (27,0 и 21,6% соответственно; р<0,02) при 95% ДИ 1,10 (1,02–1,18). В данном исследовании выявлена также зависимость показателей летальности от тяжести коморбидности, оцениваемой по индексу Чарльсона [31].
Среди больных COVID-19 с наличием СД чаще возникали показания к госпитализации в ОРИТ по сравнению с пациентами без СД (17,6 и 7,8% соответственно; р<0,01) и регистрировалась более высокая летальность (20,3 и 10,5% соответственно; р<0,017) по сравнению с пациентами без СД аналогичного возраста. Данные метаанализа о роли коморбидности при инфекции SARS-CoV-2 свидетельствуют о более тяжелом ее течении, частой госпитализации в ОРИТ и использования ИВЛ, а также повышенной летальности у больных с наличием СД [13].
Наряду с хорошо известными при ОЖ коморбидными состояниями, такими как СД, метаболический синдром, артериальная гипертония, синдром ночного апноэ, остеоартроз, некоторые злокачественные опухоли [32], за последние два десятилетия накапливается все больше данных о более высокой частоте различных инфекций среди больных морбидным ОЖ. При этом речь идет, по-видимому, не столько о формальном сочетании двух патологических состояний, сколько о возможной патогенетической роли ОЖ в развитии инфекций у данной категории пациентов [33]. Более того, ассоциация ОЖ и инфекций породила новую концепцию о возможной роли инфекции в развитии ОЖ, что послужило поводом для экспериментальных исследований [34], в которых получены интересные данные о роли аденовируса 36 (Аdv36) в развитии ОЖ у животных [35].
Респираторные инфекции. При наличии ОЖ нарушается механика дыхания (рестриктивные нарушения), уменьшаются легочные объемы, увеличивается работа дыхательных мышц, ухудшаются показатели объема форсированного выдоха за 1 с и вентиляционно-перфузионные отношения, чаще развиваются синдром ночного апноэ и тромбоэмболии легочной артерии [36]. Часто регистрирующийся у больных морбидным ОЖ синдром ночного апноэ ассоциируется с аспирацией [37, 38], являющейся фактором риска аспирационной пневмонии, особенно в послеоперационном периоде. Это может быть обусловлено большим объемом и низким рН аспирированного желудочного содержимого натощак, повышением внутрибрюшного давления, более высокой частотой гастроэзофагеального рефлюкса у больных ОЖ [39]. Избыточная масса тела оказалась фактором риска респираторных инфекций у лиц разных возрастных групп. Так, у детей с индексом массы тела (ИМТ) ≥20 кг/м2 отмечено двукратное повышение частоты острых респираторных инфекций по сравнению с детьми, имеющими более низкие показатели ИМТ (отношение шансов – OШ 2,02, 95% ДИ 1,13–3,59) [40].
В эпидемиологическом исследовании, охватившем 26 429 мужчин и 78 062 женщин, показана прямая связь между ИМТ и риском заболевания ВП у женщин, причем как женщины, так и мужчины, прибавившие в массе тела 18 кг и более, заболевали пневмонией в 2 раза чаще по сравнению с лицами, поддерживающими свою массу тела на нормальном уровне [41]. В проведенном метаанализе связи между ИМТ и пневмонией была получена «J-образная связь» ИМТ с риском развития ВП и «U-образная связь» между ИМТ и риском развития гриппозной пневмонии [42].
ОЖ фигурирует как один из факторов риска госпитальной летальности больных гриппом А (Н3N2) и В наряду с хронической болезнью почек (ХБП) и сердечно-сосудистыми заболеваниями [43].
Таким образом, наличие коморбидной патологии у больных ИНДП оказывает существенное влияние на течение, развитие и тяжесть осложнений, а также прогноз заболевания. Клиническое значение коморбидности в развитии, течении и исходе ИНДП убедительно продемонстрировано у больных COVID-19 (см. рис. 2) [13].
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
им. И.М. Сеченова» (Сеченовский Университет). E-mail: dvoretski@mail.ru; ORCID: https://orcid.org/0000-0003-3186-0102
Leonid I. Dvoretsky – D. Sci. (Med.), Full Prof., Sechenov First Moscow State Medical University (Sechenov University).
E-mail: dvoretski@mail.ru; ORCID: https://orcid.org/0000-0003-3186-0102
Статья поступила в редакцию / The article received: 28.06.2020
Статья принята к печати / The article approved for publication: 15.07.2020
Клинический разбор в общей медицине №01 2020
Инфекции нижних дыхательных путей у коморбидных пациентов
Номера страниц в выпуске:29-34
Аннотация
Коморбидная патология – важный фактор возникновения и развития осложнений, а также прогноза различных инфекционных респираторных заболеваний. Наиболее частыми коморбидными заболеваниями, влияющими на течение и исход респираторных инфекций, являются сердечно-сосудистые заболевания (сердечная недостаточность, ишемическая болезнь сердца в различных проявлениях, цереброваскулярные заболевания), хроническая обструктивная болезнь легких, сахарный диабет, ожирение. В статье приводятся данные о влиянии указанных коморбидных заболеваний на течение и исходы бактериальных и вирусных респираторных инфекций, в том числе у больных COVID-19.
Ключевые слова: коморбидность, инфекции нижних дыхательных путей, пневмония, СОVID-19.
Для цитирования: Дворецкий Л.И. Инфекции нижних дыхательных путей у коморбидных пациентов. Клинический разбор в общей медицине. 2020; 1: 29–34. DOI: 10.47407/kr2020.1.1.00005
Коморбидная патология – важный фактор возникновения и развития осложнений, а также прогноза различных инфекционных респираторных заболеваний. Наиболее частыми коморбидными заболеваниями, влияющими на течение и исход респираторных инфекций, являются сердечно-сосудистые заболевания (сердечная недостаточность, ишемическая болезнь сердца в различных проявлениях, цереброваскулярные заболевания), хроническая обструктивная болезнь легких, сахарный диабет, ожирение. В статье приводятся данные о влиянии указанных коморбидных заболеваний на течение и исходы бактериальных и вирусных респираторных инфекций, в том числе у больных COVID-19.
Ключевые слова: коморбидность, инфекции нижних дыхательных путей, пневмония, СОVID-19.
Для цитирования: Дворецкий Л.И. Инфекции нижних дыхательных путей у коморбидных пациентов. Клинический разбор в общей медицине. 2020; 1: 29–34. DOI: 10.47407/kr2020.1.1.00005
Lower respiratory tract infections in patients with comorbidities
Leonid I. DvoretskySechenov First Moscow State Medical University (Sechenov University), Moscow, Russia dvoretski@mail.ru
Abstract
Comorbidities are an important factor of the various infectious respiratory diseases emergence, complications development and prognosis. The most frequent comorbidities affecting the course and outcome of respiratory infections are the following: cardiovascular disease (heart failure, various types of coronary artery disease, cerebrovascular disease), chronic obstructive pulmonary disease, diabetes mellitus, obesity. The paper reports data on the discussed comorbidities impact on the course and outcome of bacterial and viral respiratory infections, inter alia in patients with COVID-19.
Key words: comorbidity, lower respiratory tract infections, pneumonia, СОVID-19.
For citation: Dvoretsky L.I. Lower respiratory tract infections in patients with comorbidities. Clinical review for general practice. 2020; 1: 29–34. DOI: 10.47407/kr2020.1.1.00005
Клиническая практика свидетельствует о том, что бактериальные и вирусные инфекции нижних дыхательных путей (ИНДП) возникают в большинстве случаев у лиц с наличием различной патологии (коморбидность, полиморбидность), определяющей во многом течение, прогноз и исход заболевания.
По современным представлениям, коморбидностью обозначают состояния (заболевания, осложнения), патогенетически связанные с основным заболеванием. Полиморбидность определяется как заболевание/заболевания, не имеющие патогенетической связи с основной нозологической формой. В то же время понимание современного уровня механизмов развития различных патологических процессов и взаимоотношения двух или нескольких заболеваний между собой вскрывает все больше и больше патогенетических связей на разных уровнях между двумя (или более) сосуществующими заболеваниями, казалось бы, не имеющих ничего общего между собой. Иллюстрацией этого может служить наличие у больного ишемической болезни сердца (ИБС) и хронической обструктивной болезни легких (ХОБЛ), которые в настоящее время не могут рассматриваться лишь как сопутствующие, поскольку выявлено немало общих патогенетических механизмов, влияющих на течение, осложнения, прогноз [1]. С учетом влияния существующих у больных заболеваний на развитие, течение и исход ИНДП, т.е. наличия патогенетических связей между имеющимися патологическими процессами, кажется, более оправданным при обсуждении данной проблемы использовать термин коморбидность.
Основными особенностями «патологического содружества» ИНДП с коморбидной патологией, вырастающими в особые клинические проблемы, являются следующие:
• диагностика ИНДП;
• этиологическая структура ИНДП;
• течение и прогноз ИНДП (тяжесть, ответ на лечение, частота и характер осложнений, летальность);
• течение коморбидных заболеваний;
• лечение ИНДП и коморбидной патологии.
Уже на этапах диагностики ИНДП у коморбидных пациентов могут возникать диагностические сложности в распознавании инфекционного процесса (пневмонии, инфекционного обострения ХОБЛ), который может манифестироваться декомпенсацией коморбидной патологии. Так, первыми проявлениями респираторной инфекции нередко являются усугубление признаков хронической сердечной недостаточности (ХСН), цереброваскулярной патологии, когнитивных нарушений, декомпенсация сахарного диабета (СД), усиление выраженности бронхиальной обструкции. Этим может объясняться сложность своевременного распознавания ИНДП в подобных клинических ситуациях.
Характер коморбидной патологии в известной степени определяет этиологические особенности ИНДП, т.е. имеется определенная «привязанность» типа коморбидности к определенным этиологически значимым микроорганизмам (Haemophilus influenzae при инфекционном обострении ХОБЛ, Staphylococcus aureus при хронической алкогольной интоксикации, анаэробная флора у лиц с риском аспираций).
 Большинство исследований свидетельствуют о более тяжелом характере течения заболевания и повышенной летальности от ИНДП у больных различной коморбидностью. Показано, что у больных гриппом A с наличием любой коморбидности тяжелый дистресс-синдром развивается в 3–4 раза чаще [2], а летальность от пневмонии значительно выше у больных различным типом коморбидности (рис. 1).
Большинство исследований свидетельствуют о более тяжелом характере течения заболевания и повышенной летальности от ИНДП у больных различной коморбидностью. Показано, что у больных гриппом A с наличием любой коморбидности тяжелый дистресс-синдром развивается в 3–4 раза чаще [2], а летальность от пневмонии значительно выше у больных различным типом коморбидности (рис. 1).При анализе течения и прогноза коронавирусной инфекции (COVID-19) показано влияние наличия коморбидности на течение инфекционного заболевания: время достижения конечных точек – госпитализация в отделение реанимации и интенсивной терапии (ОРИТ), искусственная вентиляция легких (ИВЛ), смерть, причем выявлена отчетливая зависимость достижения конечных точек от числа коморбидных заболеваний [4]. Неизбежны и терапевтические проблемы ведения коморбидных пациентов с ИНДП (выбор антибиотика, особенности фармакокинетики в зависимости от характера коморбидности, риск лекарственных взаимодействия, лечение коморбидной патологии).
Наиболее частыми коморбидными заболеваниями, влияющими на течение и исход ИНДП, являются:
• сердечно-сосудистые заболевания: сердечная недостаточность, ИБС в различных проявлениях, цереброваскулярные заболевания (ЦВЗ);
• ХОБЛ;
• СД;
• ожирение (ОЖ).
ХСН относится к одной из частых коморбидностей, влияющих на развитие, течение и исход ИНДП, в частности внебольничной пневмонии (ВП).
По данным разных авторов, ХСН регистрируется у 9,5–34,0% больных ВП и достоверно повышает риск развития ВП, а также является предиктором более тяжелого его течения [5, 6] и независимым фактором повышенной летальности при ВП [7–9]. Известно, что ХСН входит в шкалу PORT (Pneumonia Outcomes Research Team), применяющуюся с целью оценки класса риска и прогноза ВП, а также выбора места лечения пациента (амбулаторно или стационарно).
Не менее важной особенностью коморбидности ВП и сердечно-сосудистых заболеваний является декомпенсация кардиальной патологии и развитие различных осложнений (нарушение ритма, острый коронарный синдром, тромбоэмболия легочной артерии), что определяет тактику ведения данной категории пациентов. По данным ряда исследований, у пациентов с ВП частота выявления декомпенсированной недостаточности кровообращения достигает 9,1–14,7%, нарушений сердечного ритма – 2,8–9,3%, инфаркта миокарда – от 1,2 до 7,9%. Возникновение у больных ВП различных сердечно-сосудистых нарушений значительно ухудшает прогноз и достоверно повышает показатели госпитальной летальности [10, 11].
В одном исследовании проанализирована роль различных инфекций, ставших поводом для госпитализации больных с ХСН. Среди 9335 больных с ХСН, госпитализированных за 10-летний период, 38% госпитализировались в связи с наличием инфекции. Наиболее часто (52,6%) диагностировались респираторные и генерализованные (сепсис, бактериемия) инфекции (52,6 и 23,6% соответственно). Госпитализация пациентов с ХСН с инфекцией ассоциировалась с более высокой 30-дневной летальностью по сравнению с другими причинами госпитализации (13 и 8% соответственно; р<0,0001), причем высокие показатели летальности наблюдались преимущественно среди больных с респираторной инфекцией и сепсисом). Факторами риска инфекций у больных c ХСН являлись женский пол, наличие ХОБЛ, перенесенный инфаркт миокарда, ЭхоКГ-признаки правожелудочковой дисфункции [12].
COVID-19 и хронические сердечно-сосудистые заболевания. В одном из последних метаанализов о влиянии коморбидности на течение и исходы инфекции SARS-CoV-2 показано, что у больных с кардиоваскулярными заболеваниями (КВЗ) наблюдается более тяжелое течение инфекции, чаще возникают необходимость госпитализации в ОРИТ и показания к ИВЛ, отмечается более высокая летальность [13]. По данным регрессионного анализа другого исследования, независимыми факторами внутрибольничной летальности больных CОVID-19 были артериальная гипертензия (АГ) [отношение рисков (ОР) 2,50, 95% доверительный интервал (ДИ) 1,30–4,78], КВЗ (ОР 2,24, 95% ДИ 1,19–4,23) и ХОБЛ (ОР 2,51, 95% ДИ 1,07–5,90) [14]. По данным Китайского центра контроля и профилактики заболеваний, летальность от COVID-19 среди 44 672 больных составила в общей группе 2,3%, в то время как у лиц с сердечно-сосудистыми заболеваниями достигала 10,5% [15].
Хроническая обструктивная болезнь легких
Важное место среди коморбидной патологии при развитии ИНДП занимает ХОБЛ, которая, по данным эпидемиологических исследований, наиболее часто ассоциируется с ВП [16]. Риск развития ВП у больных ХОБЛ возрастает по мере увеличения тяжести заболевания. Так, по результатам наблюдения за 20 375 пациентами в возрасте 45 лет и старше, вероятность госпитализации по поводу ВП у лиц с нормальными показателями функции внешнего дыхания составляла 1,5 случая на 1000 человеко-лет, в то время как при наличии ХОБЛ III–IV стадий эта величина достигала уже 22,7 случая [17]. При наблюдении за большой группой больных ХОБЛ (40 414 пациентов 45 лет и старше) показано, что частота развития ВП составляла 22,4 случая на 1000 человеко-лет, существенно возрастая у лиц старше 65 лет [18]. К независимым факторам риска развития ВП у пациентов с ХОБЛ авторы относят возраст старше 65 лет, тяжесть течения ХОБЛ, предшествующие госпитализации по поводу обострений заболевания, хроническую дыхательную недостаточность, требующую проведения длительной кислородотерапии на дому, застойную сердечную недостаточность, деменцию.Высокая распространенность ВП у больных с обострением ХОБЛ, составившая за трехлетний период 78,5 на 1000 человеко-лет, показана в обстоятельном исследовании на основании ретроспективного анализа больных [19]. Риск развития ВП увеличивался с возрастом, при низком индексе массы тела, наличии рака легкого, бронхоэктазов, а также у больных, получавших лечение ингаляционными глюкокортикостероидами – ИГКС (только при отсутствии другой коморбидности) [20].
Этиология ВП у больных ХОБЛ, в сравнении с инфекционными обострениями ХОБЛ без легочной инфильтрации, чаще ассоциируется с S. pneumoniae, атипичными возбудителями, реже – с грамотрицательными энтеробактериями и сопоставима в отношении H. influenzae [21, 22]. У больных ХОБЛ с развитием ВП выше вероятность выделения Pseudomonas aeruginosa (соответственно в 5,6 и 1,3% случаев), чем у не страдающих ХОБЛ [23].
Инфекционное обострение ХОБЛ или ВП? Среди различных клинических ситуаций в практике интерниста и пульмонолога существует диагностическая альтернатива – «пневмония или инфекционное обострение ХОБЛ?». Диагностические ошибки в подобных ситуациях происходят как в сторону гипер-, так и гиподиагностики ВП. Верификация пневмонии у больных с обострением ХОБЛ является практически важной не только с точки зрения конструкции диагноза, но и тактики ведения больных. О низком уровне диагностики ВП у больных ХОБЛ свидетельствуют патологоанатомические исследования, по данным которых прижизненная диагностика ВП в стационаре отсутствовала в 34,7% случаев, а среди больных, наблюдавшихся врачами поликлиники, ВП не была выявлена в 82,1% [24]. Подчеркивается, что уровень диагностики пневмонии при ХОБЛ оказывается наиболее низким среди всех видов пневмоний, выявленных на аутопсии. По современным представлениям, инфекция играет важную роль в течении и прогрессировании ХОБЛ, в связи с чем взаимоотношения между ХОБЛ и респираторной инфекцией правомочно рассматривать как сложную коморбидность, оказывающую взаимное влияние [25]. С одной стороны, инфекция является одной из частых причин обострений ХОБЛ, каждое из которых вносит свой вклад в прогрессирование легочного процесса. С другой стороны, наличие ХОБЛ с морфофункциональными особенностями, ремоделированием бронхов, нарушением мукоцилиарного клиренса приводит к колонизации бронхиальной слизистой микроорганизмами и ухудшению их элиминации.
В попытках выявить предикторы исходов ИНДП при коморбидности изучали прогностическое значение индекса коморбидности Чарльсона у больных тяжелой острой респираторной инфекцией [26]. Среди 219 больных коморбидная патология выявлялась у 72,8%, а летальные исходы наблюдались в 24% случаев. Наиболее частой коморбидностью являлись ХОБЛ и ВИЧ-инфекция (36 и 23,6% соответственно). Скорректированный по возрасту индекс Чарльсона имел предсказательную ценность у больных с госпитальной летальностью при наличии ХОБЛ и ВИЧ (p=0,04 и р=0,032 соответственно).
ИГКС как фактор риска пневмонии у больных ХОБЛ. Особой формой коморбидности является прием различных лекарственных препаратов, вызывающих нежелательные побочные эффекты, которые становятся факторами риска развития, течения и прогноза ряда заболеваний, в частности ИНДП. Иллюстрацией подобной «ятрогенной коморбидности» является повышенная склонность к развитию инфекций у больных, леченных глюкокортикоидами, иммунодепрессантами, цитостатическими препаратами. Особенно неблагоприятную роль в отношении повышенного риска инфекций (бактериальные и грибковые инфекции, туберкулез) снискали глюкокортикоиды. С введением в клиническую практику ИГКС обсуждается их взаимоотношение с ИНДП (ятрогенная коморбидность).
В крупном исследовании «случай-контроль» частота приема ИГКС у пациентов, заболевших ВП, составила 48,2% (в контрольной группе – 30,1%). После учета влияния прочих факторов риска, риск госпитализации по поводу ВП на фоне приема ИГКС составил 70% (ОШ 1,70, 95% ДИ 1,63–1,77). Отмечено дозозависимое возрастание риска госпитализации и летального исхода при ВП. Максимальный риск был при высоких дозах ИГКС (>1000 мкг в пересчете на флутиказон; ОШ 2,25). Риск развития ВП с летальным исходом в течение 30 дней при использовании ИГКС увеличивался на 53% (ОШ 1,53), а при применении высоких доз ИГКС – на 78% (ОШ 1,78) [27].
В текущем исследовании ученые рассмотрели 18 рандомизированных клинических исследований, некоторые из которых были опубликованы, с участием около 17 тыс. пациентов в общей сложности. Они сравнили заболеваемость пневмонией у пациентов, принимавших ИГКС в течение 24 нед, по сравнению с пациентами, которые принимали плацебо или комбинацию ИГКС + длительно действующие β-антагонисты по сравнению с пациентами, которые принимали только длительного действия бронходилататоры.
Анализ результатов показал, что применение ИГКС, по крайней мере, 24 нед в одиночку или в сочетании с бронхолитиками связано со значительным увеличением риска развития пневмонии и серьезных пневмоний (на 60–70%), однако это не было связано с повышенным риском смерти. В абсолютном выражении исследование показало, что у одного из 47 пациентов с ХОБЛ при использовании ИГКС в течение 1 года развивается пневмония, связанная с применением препарата. Среди больных ХОБЛ с развитием пневмонии и при ее отсутствии число лиц, принимавших ИГКС, составило 74 и 48% соответственно, что позволяет считать лечение ИГКС одним из факторов риска развития ВП у больных ХОБЛ [28].
По подсчетам установлено, что у одного из 47 пациентов, получавших ИГКС в течение 1 года, возникала пневмония [28]. Повышение риска развития ИНДП на фоне лечения ИГКС наблюдается не только среди больных ХОБЛ, у которых и без того повышенная микробная колонизация бронхиальной слизистой [29], но также и у больных бронхиальной астмой [30].
COVID-19 у больных ХОБЛ. Клинический опыт в период пандемии COVID-19 показал, что ХОБЛ является одним из типов коморбидности, прогнозирующих тяжелое течение инфекции COVID-19. Так, при анализе влияния различных типов коморбидности на течение заболевания у 1590 больных COVID-19 показано более раннее достижение сроков конечных точек (госпитализация в ОРИТ, ИВЛ, смерть) среди больных с наличием ХОБЛ [2,681 (1,424–5,058) р<0,002; 95% ДИ] [4]. В другом исследовании [13] показано, что при наличии такой коморбидности, как ХОБЛ, наблюдается более тяжелое течение инфекции SARS-CoV-2, более частая госпитализация в ОРИТ и необходимость ИВЛ, а также повышенная летальность (рис. 2).


Сахарный диабет
Особенности респираторных инфекций у больных СД:• высокая частота инфекций, вызываемых S. aureus, грамнегативными микроорганизмами и M. tuberculosis;
• более частая (трехкратное увеличение) колонизация носоглотки S. aureus;
• более частая бактериемия при пневмококковой пневмонии и смертность от нее;
• более частое развитие бактериальной пневмонии и смертность от нее во время эпидемий гриппа.
Показатели 30-дневной летальности от пневмонии среди больных СД 2-го типа были выше, чем у пациентов без диабета [19,9 и 15,1% соответственно, р<0,01 при 95% ДИ 1,16 (1,07–1,27)]. Более того, достоверное повышение летальности от пневмонии у больных СД наблюдалось также в течение 90 дней (27,0 и 21,6% соответственно; р<0,02) при 95% ДИ 1,10 (1,02–1,18). В данном исследовании выявлена также зависимость показателей летальности от тяжести коморбидности, оцениваемой по индексу Чарльсона [31].
Среди больных COVID-19 с наличием СД чаще возникали показания к госпитализации в ОРИТ по сравнению с пациентами без СД (17,6 и 7,8% соответственно; р<0,01) и регистрировалась более высокая летальность (20,3 и 10,5% соответственно; р<0,017) по сравнению с пациентами без СД аналогичного возраста. Данные метаанализа о роли коморбидности при инфекции SARS-CoV-2 свидетельствуют о более тяжелом ее течении, частой госпитализации в ОРИТ и использования ИВЛ, а также повышенной летальности у больных с наличием СД [13].
Ожирение
Наряду с хорошо известными при ОЖ коморбидными состояниями, такими как СД, метаболический синдром, артериальная гипертония, синдром ночного апноэ, остеоартроз, некоторые злокачественные опухоли [32], за последние два десятилетия накапливается все больше данных о более высокой частоте различных инфекций среди больных морбидным ОЖ. При этом речь идет, по-видимому, не столько о формальном сочетании двух патологических состояний, сколько о возможной патогенетической роли ОЖ в развитии инфекций у данной категории пациентов [33]. Более того, ассоциация ОЖ и инфекций породила новую концепцию о возможной роли инфекции в развитии ОЖ, что послужило поводом для экспериментальных исследований [34], в которых получены интересные данные о роли аденовируса 36 (Аdv36) в развитии ОЖ у животных [35].
Респираторные инфекции. При наличии ОЖ нарушается механика дыхания (рестриктивные нарушения), уменьшаются легочные объемы, увеличивается работа дыхательных мышц, ухудшаются показатели объема форсированного выдоха за 1 с и вентиляционно-перфузионные отношения, чаще развиваются синдром ночного апноэ и тромбоэмболии легочной артерии [36]. Часто регистрирующийся у больных морбидным ОЖ синдром ночного апноэ ассоциируется с аспирацией [37, 38], являющейся фактором риска аспирационной пневмонии, особенно в послеоперационном периоде. Это может быть обусловлено большим объемом и низким рН аспирированного желудочного содержимого натощак, повышением внутрибрюшного давления, более высокой частотой гастроэзофагеального рефлюкса у больных ОЖ [39]. Избыточная масса тела оказалась фактором риска респираторных инфекций у лиц разных возрастных групп. Так, у детей с индексом массы тела (ИМТ) ≥20 кг/м2 отмечено двукратное повышение частоты острых респираторных инфекций по сравнению с детьми, имеющими более низкие показатели ИМТ (отношение шансов – OШ 2,02, 95% ДИ 1,13–3,59) [40].
В эпидемиологическом исследовании, охватившем 26 429 мужчин и 78 062 женщин, показана прямая связь между ИМТ и риском заболевания ВП у женщин, причем как женщины, так и мужчины, прибавившие в массе тела 18 кг и более, заболевали пневмонией в 2 раза чаще по сравнению с лицами, поддерживающими свою массу тела на нормальном уровне [41]. В проведенном метаанализе связи между ИМТ и пневмонией была получена «J-образная связь» ИМТ с риском развития ВП и «U-образная связь» между ИМТ и риском развития гриппозной пневмонии [42].
ОЖ фигурирует как один из факторов риска госпитальной летальности больных гриппом А (Н3N2) и В наряду с хронической болезнью почек (ХБП) и сердечно-сосудистыми заболеваниями [43].
Таким образом, наличие коморбидной патологии у больных ИНДП оказывает существенное влияние на течение, развитие и тяжесть осложнений, а также прогноз заболевания. Клиническое значение коморбидности в развитии, течении и исходе ИНДП убедительно продемонстрировано у больных COVID-19 (см. рис. 2) [13].
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
Информация об авторе / Information about the author
Дворецкий Леонид Иванович – д-р мед. наук, проф., зав. каф. госпитальной терапии №2 ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: dvoretski@mail.ru; ORCID: https://orcid.org/0000-0003-3186-0102
Leonid I. Dvoretsky – D. Sci. (Med.), Full Prof., Sechenov First Moscow State Medical University (Sechenov University).
E-mail: dvoretski@mail.ru; ORCID: https://orcid.org/0000-0003-3186-0102
Статья поступила в редакцию / The article received: 28.06.2020
Статья принята к печати / The article approved for publication: 15.07.2020
Список исп. литературыСкрыть список1. Чучалин А.Г. Хроническая обструктивная болезнь легких и сопутствующие заболевания. Часть I. ХОБЛ и поражения сердечно-сосудистой системы. РМЖ. 2008; 2: 58.
[Chuchalin A.G. Khronicheskaia obstruktivnaia bolezn' legkikh i soputstvuiushchie zabolevaniia. Chast' I. KhOBL i porazheniia serdechno-sosudistoi sistemy. RMZh. 2008; 2: 58 (in Russian).]
2. Gao HN, Lu HZ, Cao B et al. Clinical findings in 111 cases of influenza A (H7N9) virus infection. N Engl J Med 2013; 368: 2277–85.
3. Luna СМ, Palma I, Niederman М et al. The Impact of Age and Comorbidities on the Mortality of Patients of Different Age Groups Admitted with Community-acquired Pneumonia. Ann Am Thorac Soc 2016; 13 (9): 1519–26. DOI: 10.1513/AnnalsATS.201512-848OC
4. Guan W, Liang W, Zhao Y et al. Comorbidity and its impact on 1590 patients with COVID-19 in China: a nationwide analysis. Eur Respir J 2020; 55: 200.
5. Xiao K, Su LX, Han BC et al. Analysis of the severity and prognosis assessment of aged patients with community-acquired pneumonia: a retrospective study. J Thorac Dis 2013; 5 (5): 626–33.
6. Ishiguro T, Takayanagi N, Yamaguchi S et al. Etiology and factors contributing to the severity and mortality of community-acquired pneumonia. Intern Med 2013; 52 (3): 317–24.
7. Corrales-Medina VF, Musher DM, Wells GA. Cardiac complications in patients with community-acquired pneumonia: incidence, timing, risk factors, and association with short-term mortality. Circulation 2012; 125 (6): 773–81.
8. Welte T. Community-acquired pneumonia. Internist (Berl) 2009; 50 (3): 331–9.
9. Fujiki R, Kawayama T, Ueyama T et al. The risk factors for mortality of community-acquired pneumonia in Japan. J Infect Chemother 2007; 13 (3): 157–65.
10. Ramirez J, Aliberti S, Mirsaeidi M et al. Acute myocardial infarction in hospitalized patients with community-acquired pneumonia. Clin Infect Dis 2008; 47: 182–7.
11. Perry TW, Pugh MJ, Waterer GW et al. Incidence of cardiovascular events after hospital admission for pneumonia. Am J Med 2011; 124: 244–51.
12. Alon D, Stein G, Korenfeld R, Fuchs S. Predictors and Outcomes of Infection-Related Hospital Admissions of Heart Failure Patients. PLoS ONE 2013; 8 (8): e72476. DOI: 10.1371/journal.pone.0072476
13. Yang J, Zhenga Y Gou Х et al. Prevalence of comorbidities and its effects in patients infected with SARS-CoV-2: a systematic review and meta-analysis. Int J Infect Dis 2020; 94: 91–5.
14. Shi О, Zhang Х, Jiang F et al. Clinical Characteristics and Risk Factors for Mortality of COVID-19 Patients With Diabetes in Wuhan, China: A Two-Center. Retrospective Study. Diabetes Care 2020; 43 (7): 1382–91.
15. Wu Z, McGoogan JM. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72314 cases from the Chinese center for disease Control and prevention. J Am Med Assoc 2020 (in press). Bansal М. Cardiovascular disease and COVID-19. Diabetes & Metabolic Syndrome: Clin Res Rev 2020; 14: 247e250.
16. Falguera M, Martin M, Ruiz A et al. Community-acquired pneumonia as the initial manifestation of serious underlying diseases. Am J Med 2005; 118 (4): 378–83.
17. Mannino DM, Davis KJ, Kiri VA. Chronic obstructive pulmonary disease and hospitalizations for pneumonia in a US cohort. Respir Med 2009; 103 (2): 224–9.
18. Müllerova H, Chigbo C, Hagan GW et al. The natural history of community-acquired pneumonia in COPD patients: a population database analysis. Respir Med 2012; 106 (8): 1124–33.
19. Баймаканова Г.Е., Зубаирова П.А., Авдеев С.Н., Чучалин А.Г. Особенности клинической картины и течения внебольничной пневмонии у пациентов с хронической обструктивной болезнью легких. Пульмонология. 2009; 2, 33–41.
[Baimakanova G.E., Zubairova P.A., Avdeev S.N., Chuchalin A.G. Osobennosti klinicheskoi kartiny i techeniia vnebol'nichnoi pnevmonii u patsientov s khronicheskoi obstruktivnoi bolezn'iu legkikh. Pul'monologiia. 2009; 2, 33–41 (in Russian).]
20. Lin S, Ji B, Shih Y et al. Comorbid pulmonary disease and risk of community-acquired pneumonia in COPD patients. Int J Tuberc Lung Dis 2013; 17 (12): 1638–44.
21. Li X, Li Q, Si L, Yuan Q. Bacteriological differences between COPD exacerbation and community-acquired pneumonia. Respir Care 2011; 56 (11): 1818–24.
22. Reissig A, Mempel C, Schumacher U et al. Microbiological diagnosis and antibiotic therapy in patients with community-acquired pneumonia and acute COPD exacerbation in daily clinical practice: comparison to current guidelines. Lung 2013; 191 (3): 239–46.
23. Restrepo MI, Mortensen EM, Pugh JA, Anzueto A. COPD is associated with increased mortality in patients with community acquired pneumonia. Eur Respir J 2006; 28: 346–51.
24. Черняев А.Л. Диагностические ошибки в пульмонологии. Пульмонология 2005; 3: 5–11.
[Cherniaev A.L. Diagnosticheskie oshibki v pul'monologii. Pul'monologiia 2005; 3: 5–11 (in Russian).]
25. Sethi S. Infection as a comorbidity of COPD. Eur Respir J 2010; 35: 1209–15.
26. Setter N, Peres M, de Almeida B et al. Charlson comorbidity index scores and in‐hospital prognosis of patients with severe acute respiratory infections. Intern Med J; 2020; 50: 691–7. DOI: 10.1111/imj.14398
27. Ernst Р, Gonzalez А, Brassard Р, Suissa S. Inhaled Corticosteroid Use in Chronic Obstructive Pulmonary Disease and the Risk of Hospitalization for Pneumonia. Am J Respir Crit Care Med 2007; 176 (2): 162–6. DOI: 10.1164/rccm.200611-1630OC
28. Long-term Use Of Popular Inhalers Increases Risk Of Pneumonia For COPD Patients 12, 2009, Wake Forest University Baptist Medical Center. http://www.sciencedaily.com
29. Von Baum H, Welte T, Marre R et al; for the Capnetz Study Group. Community-acquired pneumonia through enterobacteriaceae and Pseudomonas aeruginosa: diagnosis, incidence and predictors. Eur Respir J 2010; 35: 598–615.
30. McKeever Т, Harrison Т, Hubbard R, Shaw D. Inhaled Corticosteroids and the Risk of Pneumonia in People With Asthma A Case-Control Study. CHEST 2013; 144 (6): 1788–94.
31. Kornum JB, Thomsen RW, Riis A et al. Type 2 diabetes and pneumonia outcomes: a population-based cohort study. Diabetes Care 2007; 30 (9): 2251–7. DOI: 10.2337/dc06-2417
32. Mokdad AH, Ford ES, Bowman BA et al. Prevalence of obesity, diabetes, and obesity-related health risk factors. JAMA 2003; 289: 76–9.
33. Hainer V, Zanrazilova Н, Kunesova М et al. Obesity and Infection: Reciprocal Causality. Physiol Res 2015; 64 (Suppl. 2): S105–S119.
34. Dhurandhar NV, Israel BA, Kolesar JM et al. Adiposity in animals due to a human virus. Int J Obes 2000; 24: 989–96.
35. Dhurandhar NV, Whigham LD, Abbott DH, Schulz-Darken NJ. Human adenovirus Ad-36 promotes weight gain in male rhesus and marmoset monkeys. J Nutr 2002; 132: (10): 3155–60.
36. Ashburn DD, DeAntonio A, Reed MJ. Pulmonary system and obesity. Crit Care Clin 2010; 26: 597–602.
37. Koenig SM. Pulmonary complications of obesity. Am J Med Sci 2001; 321: 249–79. DOI: 10.1097/00000441-200104000-00006
38. Beal M, Chesson A, Garcia T et al. A pilot study of quantitative aspiration in patients with symptoms of obstructive sleep apnea: comparison to a historic control group. Laryngoscope 2004; 114: 965–68. DOI: 10.1097/00005537-200406000-00002
40. Jedrychowski W, Maugeri U, Flak E et al. Predisposition to acute respiratory infections among overweight preadolescent children: an epidemiologic study in Poland. Public Health 1998; 112: 189–95. DOI: 10.1038/sj.ph.1900438
41. Baik I, Curhan GC, Rimm EB. A prospective study of age and lifestyle factors in relation to community-acquired pneumonia in US men and women. Arch Intern Med 2000; 160: 3082–88.
42. Phung DT, Wang GZ, Rutgerford S et al. Body mass index and risk of pneumonia: a systematic review and meta-analysis. Obes Rev 2013; 14: 839–57. DOI: 10.1111/obr.12055
43. Martínez A, Soldevila N, Romero-Tamarit A et al. Risk factors associated with severe outcomes in adult hospitalized patients according to influenza type and subtype. PLOS ONE 2019; 14 (1): e0210353
