Клинический разбор в общей медицине №01 2021
Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
ela12@yandex.ru
Abstract
Complex of medicine that increases the body's resistance to the damaging effects of viruses during a pandemic in the long term will be an important tool not only to reduce the overall incidence of diseases, but also to improve the prognosis of those who have been ill due to the reduction of residual fibrotic changes in the lungs.
Key words: COVID-19, pulmonary fibrosis, antiviral agents.
For citation: Popova E.N., Ponomarev A.B. Progressive pulmonary fibrosis during a pandemic: assessment of risk factors and modern approaches to treatment. Clinical review for general practice. 2021; 1: 6–11. DOI: 10.47407/kr2021.2.1.00026
Вирусные инфекции остаются актуальной проблемой в современной клинической практике по причине распространенности в популяции и высокой частоты осложнений особенно в группах риска, выделяемых по возрасту и наличию сердечно-сосудистых заболеваний [1]. За период пандемии появляется все больше данных о факторах, негативно влияющих на тяжесть поражения легких при коронавирусной инфекции. По данным анализа летальных исходов, у пациентов с острым респираторным дистресс-синдромом (ОРДС), вызванным SARS-CoV-2, смертность в целом достигает 60–70%. При этом выраженность респираторных симптомов, потребность в проведении мероприятий по респираторной поддержке увеличиваются среди лиц с избыточной массой тела, сахарным диабетом 2-го типа, ишемической болезнью сердца [2].
Курение относится к одному из наиболее мощных индукторов повреждения легких, что облегчает проникновение вирусного материала в организм и усугубляет тяжесть остаточных изменений в легких в исходе вирусной инфекции [3]. Под действием табачного дыма увеличивается продукция хемотаксических факторов альвеолярными макрофагами, что стимулирует приток нейтрофилов в нижние отделы респираторного тракта, нарушает баланс эластаз-антиэластаз с последующим разрушением эластического каркаса легких. У курильщиков за счет ослабления иммунной системы почти вдвое увеличивается риск заражения туберкулезом, усугубляется контаминация условно-патогенной флорой. Известно, что курильщики в 5 раз чаще заболевают гриппом, чем некурящие. Аналогично инфекции, вызванные пневмококком, легионеллой и микоплазмой, у курильщиков наблюдаются в 3–5 раз чаще. Вне зависимости от состава вдыхаемого дыма – табак или электронные сигареты – усиливаются адгезивные свойства пневмококков и их колонизация посредством высвобождения фактора, активирующего тромбоциты, относящегося к медиаторам адгезии [4].
Особенности COVID-19 у курильщиков мало изучены. В одном из метаанализов сообщалось о повышенном риске тяжелого заболевания (относительный риск – ОР 1,4, 95% доверительный интервал – ДИ 0,98–2,00) и необходимости искусственной вентиляции легких при коронавирусной инфекции для курильщиков. При этом не обнаружено взаимосвязи между актуальным курением и тяжестью заболевания. С другой стороны, исследование в Великобритании сообщает о повышенном риске смерти у курильщиков по сравнению с никогда не курившими – 1,25 (95% ДИ 1,12–1,40) [5].
Ожирение относится к патологии с доказанным отрицательным влиянием на исходы COVID-19. По данным Национального исследовательского центра (ICNARC) [2, 6] в Великобритании, показано, что из 196 пациентов с ожирением (большинство из которых составляли мужчины старше 60 лет) с индексом массы тела >35 кг/м2 большинству проводились реанимационные мероприятия, более чем половине требовалась респираторная поддержка уже на момент поступления в клинику. Сахарный диабет в совокупности с метаболическими нарушениями вызывает нарушения в системе врожденного и адаптивного иммунитета, более высокую восприимчивость больных к инфекциям. Установлено, что диабет, как и мужской пол, сердечно-сосудистые/цереброваскулярные болезни, хроническая обструктивная болезнь легких (ХОБЛ), злокачественные новообразования, хроническая болезнь почек, гепатит В и заболевания пищеварительной системы, достоверно связан с тяжестью коронавирусной инфекции (все p<0,05), включая основные конечные точки: смерть, ОРДС, госпитализацию в отделение интенсивной терапии, инвазивную вентиляцию легких и острый коронарный синдром [7, 8].
При ХОБЛ повышенная восприимчивость к вирусам может быть связана с активацией рецептора ангиотензинпревращающего фермента 2 (АПФ2), используемого SARS-CoV-2 для внедрения в слизистые оболочки хозяина. Установлено, что у курильщиков экспрессия генов в АПФ2 повышена, но по-прежнему остается открытым вопрос, влияет ли изменение частоты или доступности рецепторов АПФ2 на смертность при COVID-19 [9]. В некоторых работах появились неоднозначные выводы о потенциальной резистентности курильщиков, в том числе использующих электронные устройства для курения, к коронавирусу. Данные утверждения, как правило, не имеют достаточной доказательной базы. Кроме того, не вызывает сомнений, что табак в сочетании с вирусной инфекцией оказывает более выраженное негативное влияние на прогноз при коморбидных состояниях – гипертонии, диабете, ожирении, ХОБЛ [9, 10].
Хотя у большинства больных COVID-19 наблюдается в малосимптомной форме, но у 5–10% вирусная инфекция осложняется пневмонией, сопровождающейся острой дыхательной недостаточностью вследствие ОРДС. Особенностью ОРДС при SARS-CoV-2-инфекции является так называемый цитокиновый шторм, представленный избыточным накоплением различных провоспалительных медиаторов, в том числе интерлейкинов (ИЛ) – ИЛ-1β, ИЛ-6, ИЛ-18, интерферона, фактора некроза опухолей. Критерии ранней диагностики синдрома выброса цитокинов не разработаны. Предполагать его следует при быстром ухудшении функции легких в сочетании с нарастающими концентрациями С-реактивного белка (СРБ) и ферритина, цитопенией (тромбоцитопенией и лимфопенией), коагулопатией (низкое число тромбоцитов и повышение фибриногена, повышенное содержание D-димера), признаками повреждения печени. Клинически у таких пациентов наблюдается быстрое прогрессирование изменений в легких в виде КТ-феномена «матового стекла», лихорадки, снижения сатурации, в том числе в виде эпизодов спонтанно возникающей гипоксии [11].
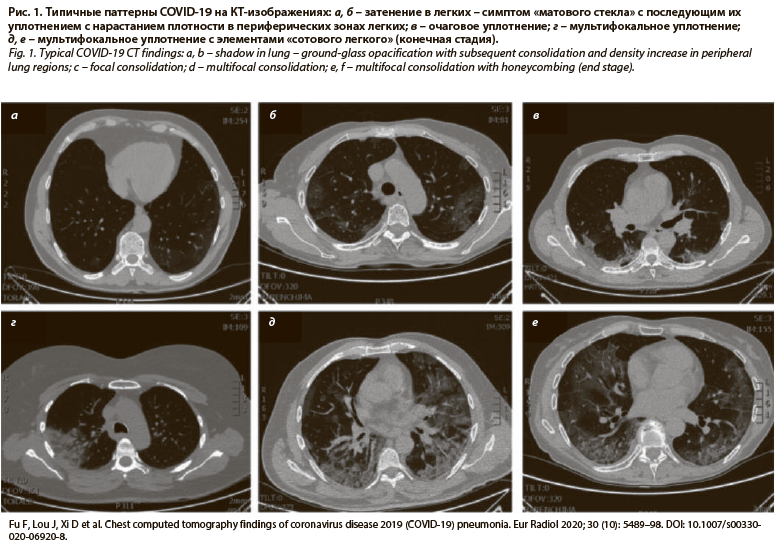
Быстрая потеря функций аэрогематического барьера, проявляющаяся снижением оксигенации крови, связана не только с острым повреждением аэрогематического барьера, но и нарастающим содружественно с воспалением процессами тромбообразования – тромботическая микроангиопатия, формирование гиалиновых мембран, фиброз (рис. 1). Остаточные фиброзные изменения в легких при COVID-19 могут быть обширными и, как следствие, снижают качество жизни по причине сохраняющейся дыхательной недостаточности. Состояния, связанные с «цитокиновым штормом», описаны при первичном и вторичном гемофагоцитарном лимфогистиоцитозе, синдроме активации макрофагов. Подобные события в легких возможны как ответ на введение противоопухолевых препаратов [11, 12].
Легочный фиброз, инициируемый коронавирусной инфекцией, остается мало изученной проблемой. По аналогии с другими распространенными в популяции вирусами, например вирусом Эпштейна–Барр, ключевой мишенью при коронавирусной инфекции становится эпителий дыхательных путей. Генетический материал EBV при легочном фиброзе выявлялся в 2 раза чаще, чем в сохранной ткани легкого от больных, оперированных по поводу опухоли легкого. Показано в эксперименте, что под влиянием EBV эпителиальная клетка становится источником факторов, активирующих иммунопатологические реакции с участием макрофагов, фибробластов, Т-лимфоцитов, усиливаются воспалительные и фибропролиферативные процессы в стенке альвеол. Доказательством тому стало обнаружение отложений коллагена 1-го типа в участках альвеолярного эпителия, содержащего вирусные включения [13].
Особенностью патогенеза COVID-19 является лавинообразное накопление в интерстиции легких медиаторов, ассоциированных с тем или иным типом смерти клеток эпителия дыхательных путей. Наряду с некрозом, апоптозом, вирус инициирует реакции железо-зависимой смерти клетки, так называемым ферроптозом. Показано также, что ферроптоз инициируется у больных, контаминированных синегнойной палочкой, наблюдаемых в отделениях реанимации и интенсивной терапии [14].
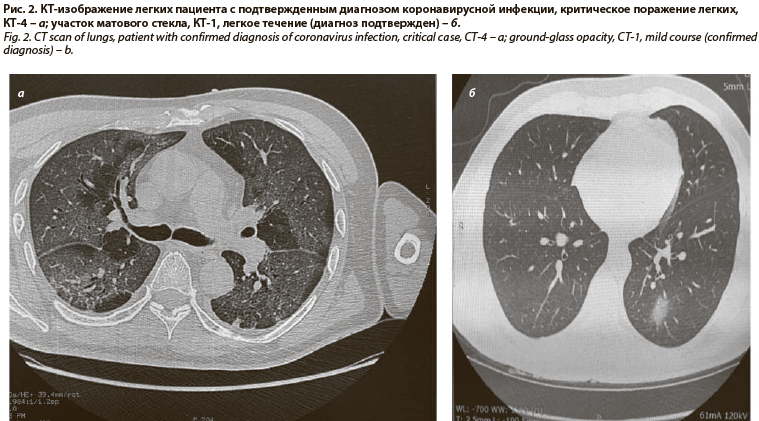
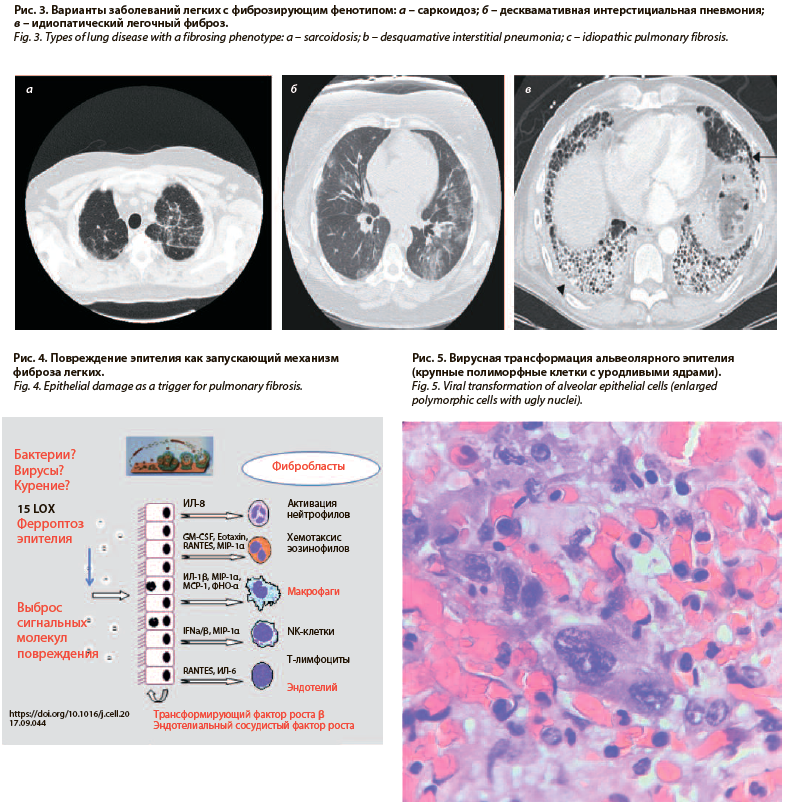
Ключевым компьютернотомографическим эквивалентом повреждения интерстиция легких при коронавирусной инфекции считается симптом «матового стекла» (рис. 1, 2). Данный феномен, в том числе в сочетании с кистозной трансформацией в виде «сотового легкого», описан также при идиопатических интерстициальных пневмониях, поражении легких при ревматоидном артрите, гиперчувствительном пневмоните, саркоидозе (рис. 3) [15, 16]. У больных наблюдается плохо контролируемая дыхательная недостаточность, морфологически регистрируются изменения, воспроизводящие по некоторым признакам COVID-19 [17, 18]. Можно также предполагать, что описанные ранее варианты легочного фиброза, например идиопатический легочный фиброз, первоначально известный как болезнь Хаммана–Рича, вероятно имеет вирусную природу, где вирус или бактериальные агенты выступают триггерами реакций повреждения (рис. 4) эпителия дыхательных путей (рис. 5), сосудов легких. В результате аэрогематический барьер замещается фиброзной тканью, и как следствие развивается быстропрогрессирующая дыхательная недостаточность (см. рис. 5) [19].
Лечение коронавирусной инфекции по-прежнему не получило достаточной доказательности. Не вызывает сомнений, что воздействие на этиологический фактор при вирусной инфекции и применение в рамках профилактики и лечения противовирусных средств может улучшить исход за счет уменьшения выраженности фиброза легких как отдаленного исхода заболевания.
Противовирусные средства – лекарственные препараты, оказывающие специфическое угнетающее действие на патогенные вирусы. Во-первых, организм проявляет резистентность к вирусным агентам, которая может быть генетической, постинфекционной, поствакцинальной, а также вызванной действием противовирусных препаратов. Если организм имеет факторы резистентности, вырабатываются интерфероны первого и третьего типов, устанавливается своеобразный санитарный барьер вокруг очага инфекции, и вирус не распространяется от первой зараженной клетки по всему организму. Вторым способом защиты организма от вирусной инфекции является механизм возникновения толерантности – частичная или полная утрата организмом способности вступать в иммунологическую реакцию со специфическим антигеном. При этом важен баланс факторов резистентности и толерантности в организме человека при ответе на вирусную инфекцию.
Некоторые противовирусные средства входят в состав комбинированных препаратов для устранения симптомов ОРЗ и «простуды». Так, в лечении ОРВИ и гриппа хорошо зарекомендовал себя препарат АнвиМакс, обладающий противовирусным, интерфероногенным, жаропонижающим, аналгезирующим, антигистаминным и ангиопротекторным действием в сочетании с благоприятным профилем безопасности [20, 21]. Входящий в его состав римантадин представляет собой солянокислую соль а-метил-1-адамантил-метиламина и используется в настоящее время при лечении гриппа. Препарат оказывает угнетающее действие на вирус гриппа типа А: блокируя М2-каналы вируса гриппа А, римантадин нарушает его способность проникать в клетки и высвобождать рибонуклеопротеид, ингибируя тем самым важнейшую стадию репликации вирусов. При гриппе, вызванном вирусом В, препарат оказывает антитоксическое действие. Влияние римантадина на течение респираторной инфекции представлено не только реакциями прямой противовирусной активности в отношении вируса гриппа А и антитоксическим действием при гриппе В, но и способностью индуцировать выработку интерферонов альфа и гамма, необходимых для формирования иммунного ответа.
Входящий в состав препарата парацетамол обладает аналгезирующим и жаропонижающим действием, что благоприятно влияет на качество жизни больных с симптомами острого респираторного заболевания. Аскорбиновая кислота участвует в регуляции окислительно-восстановительных процессов, способствует нормальной проницаемости капилляров, свертываемости крови, регенерации тканей, играет положительную роль в развитии иммунных реакций организма, восполняет дефицит витамина С, который может наблюдаться у пациента с ОРВИ [22].
Кальция глюконат как источник ионов кальция предотвращает развитие повышенной проницаемости и ломкости сосудов, обуславливающих геморрагические процессы при гриппе и ОРВИ, оказывает противоаллергическое действие.
Рутозид является ангиопротектором. Уменьшает проницаемость капилляров, отечность и воспаление, укрепляет сосудистую стенку, тормозит агрегацию и увеличивает степень деформации эритроцитов. Кроме того, согласно имеющимся экспериментальным данным, рутозид может способствовать торможению острого и хронического воспаления, в том числе в дыхательных путях [23, 24]. Рутозид также проявляет синергизм с аскорбиновой кислотой, усиливает ее активность [25].
Таким образом, в состав препарата АнвиМакс входит целый комплекс действующих веществ, позволяющий оказывать разнонаправленное действие при ОРВИ и гриппе: симптоматическое, этиотропное и патогенетическое.
Основные цели использования комбинированных противопростудных препаратов в лечении острых респираторных инфекций состоят в уменьшении продолжительности симптомов интоксикации (головной боли, головокружения и слабости), лихорадки, проявлений катарального синдрома и, соответственно, в улучшении качества жизни пациентов.
Таким образом, применение препаратов, обладающих комплексными эффектами, повышающими резистентность организма к повреждающему действию вирусов в период пандемии, в долговременной перспективе станет важным инструментом не только для снижения заболеваемости в целом, но и улучшения прогноза у переболевших за счет уменьшения остаточных фиброзных изменений в легких.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Попова Елена Николаевна – д-р мед. наук, проф. каф. ревматологии, внутренних профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru; ORCID: 0000-0001-5164-4621
Elena N. Popova – D. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru; ORCID: 0000-0001-5164-4621
Пономарев Андрей Борисович – канд. мед. наук, доц. каф. патологической анатомии им. А.И. Струкова, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Andrei B. Ponomarev – Cand. Sci. (Med.), Assoc. Prof., Sechenov First Moscow State Medical University (Sechenov University)
Статья поступила в редакцию / The article received: 28.12.2020
Статья принята к печати / The article approved for publication: 29.12.2020
Клинический разбор в общей медицине №01 2021
Прогрессирующий фиброз легких в период пандемии: оценка факторов риска и современные подходы к лечению
Номера страниц в выпуске:06-11
Аннотация
Комплекс лекарственных средств, повышающих сопротивляемость организма к повреждающему воздействию вирусов во время пандемии, в долгосрочной перспективе станет важным инструментом не только снижения общей заболеваемости, но и улучшения прогноза заболевших за счет уменьшения остаточных фиброзных изменений в легких.
Ключевые слова: COVID-19, легочный фиброз, противовирусные препараты.
Для цитирования: Попова Е.Н., Пономарев А.Б. Прогрессирующий фиброз легких в период пандемии: оценка факторов риска и современные подходы к лечению. Клинический разбор в общей медицине. 2021; 1: 6–11. DOI: 10.47407/kr2021.2.1.00026
Комплекс лекарственных средств, повышающих сопротивляемость организма к повреждающему воздействию вирусов во время пандемии, в долгосрочной перспективе станет важным инструментом не только снижения общей заболеваемости, но и улучшения прогноза заболевших за счет уменьшения остаточных фиброзных изменений в легких.
Ключевые слова: COVID-19, легочный фиброз, противовирусные препараты.
Для цитирования: Попова Е.Н., Пономарев А.Б. Прогрессирующий фиброз легких в период пандемии: оценка факторов риска и современные подходы к лечению. Клинический разбор в общей медицине. 2021; 1: 6–11. DOI: 10.47407/kr2021.2.1.00026
Progressive pulmonary fibrosis during a pandemic: assessment of risk factors and modern approaches to treatment
Elena N. Popova, Andrei B. PonomarevSechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
ela12@yandex.ru
Abstract
Complex of medicine that increases the body's resistance to the damaging effects of viruses during a pandemic in the long term will be an important tool not only to reduce the overall incidence of diseases, but also to improve the prognosis of those who have been ill due to the reduction of residual fibrotic changes in the lungs.
Key words: COVID-19, pulmonary fibrosis, antiviral agents.
For citation: Popova E.N., Ponomarev A.B. Progressive pulmonary fibrosis during a pandemic: assessment of risk factors and modern approaches to treatment. Clinical review for general practice. 2021; 1: 6–11. DOI: 10.47407/kr2021.2.1.00026
Вирусные инфекции остаются актуальной проблемой в современной клинической практике по причине распространенности в популяции и высокой частоты осложнений особенно в группах риска, выделяемых по возрасту и наличию сердечно-сосудистых заболеваний [1]. За период пандемии появляется все больше данных о факторах, негативно влияющих на тяжесть поражения легких при коронавирусной инфекции. По данным анализа летальных исходов, у пациентов с острым респираторным дистресс-синдромом (ОРДС), вызванным SARS-CoV-2, смертность в целом достигает 60–70%. При этом выраженность респираторных симптомов, потребность в проведении мероприятий по респираторной поддержке увеличиваются среди лиц с избыточной массой тела, сахарным диабетом 2-го типа, ишемической болезнью сердца [2].
Курение относится к одному из наиболее мощных индукторов повреждения легких, что облегчает проникновение вирусного материала в организм и усугубляет тяжесть остаточных изменений в легких в исходе вирусной инфекции [3]. Под действием табачного дыма увеличивается продукция хемотаксических факторов альвеолярными макрофагами, что стимулирует приток нейтрофилов в нижние отделы респираторного тракта, нарушает баланс эластаз-антиэластаз с последующим разрушением эластического каркаса легких. У курильщиков за счет ослабления иммунной системы почти вдвое увеличивается риск заражения туберкулезом, усугубляется контаминация условно-патогенной флорой. Известно, что курильщики в 5 раз чаще заболевают гриппом, чем некурящие. Аналогично инфекции, вызванные пневмококком, легионеллой и микоплазмой, у курильщиков наблюдаются в 3–5 раз чаще. Вне зависимости от состава вдыхаемого дыма – табак или электронные сигареты – усиливаются адгезивные свойства пневмококков и их колонизация посредством высвобождения фактора, активирующего тромбоциты, относящегося к медиаторам адгезии [4].
Особенности COVID-19 у курильщиков мало изучены. В одном из метаанализов сообщалось о повышенном риске тяжелого заболевания (относительный риск – ОР 1,4, 95% доверительный интервал – ДИ 0,98–2,00) и необходимости искусственной вентиляции легких при коронавирусной инфекции для курильщиков. При этом не обнаружено взаимосвязи между актуальным курением и тяжестью заболевания. С другой стороны, исследование в Великобритании сообщает о повышенном риске смерти у курильщиков по сравнению с никогда не курившими – 1,25 (95% ДИ 1,12–1,40) [5].
Ожирение относится к патологии с доказанным отрицательным влиянием на исходы COVID-19. По данным Национального исследовательского центра (ICNARC) [2, 6] в Великобритании, показано, что из 196 пациентов с ожирением (большинство из которых составляли мужчины старше 60 лет) с индексом массы тела >35 кг/м2 большинству проводились реанимационные мероприятия, более чем половине требовалась респираторная поддержка уже на момент поступления в клинику. Сахарный диабет в совокупности с метаболическими нарушениями вызывает нарушения в системе врожденного и адаптивного иммунитета, более высокую восприимчивость больных к инфекциям. Установлено, что диабет, как и мужской пол, сердечно-сосудистые/цереброваскулярные болезни, хроническая обструктивная болезнь легких (ХОБЛ), злокачественные новообразования, хроническая болезнь почек, гепатит В и заболевания пищеварительной системы, достоверно связан с тяжестью коронавирусной инфекции (все p<0,05), включая основные конечные точки: смерть, ОРДС, госпитализацию в отделение интенсивной терапии, инвазивную вентиляцию легких и острый коронарный синдром [7, 8].
При ХОБЛ повышенная восприимчивость к вирусам может быть связана с активацией рецептора ангиотензинпревращающего фермента 2 (АПФ2), используемого SARS-CoV-2 для внедрения в слизистые оболочки хозяина. Установлено, что у курильщиков экспрессия генов в АПФ2 повышена, но по-прежнему остается открытым вопрос, влияет ли изменение частоты или доступности рецепторов АПФ2 на смертность при COVID-19 [9]. В некоторых работах появились неоднозначные выводы о потенциальной резистентности курильщиков, в том числе использующих электронные устройства для курения, к коронавирусу. Данные утверждения, как правило, не имеют достаточной доказательной базы. Кроме того, не вызывает сомнений, что табак в сочетании с вирусной инфекцией оказывает более выраженное негативное влияние на прогноз при коморбидных состояниях – гипертонии, диабете, ожирении, ХОБЛ [9, 10].
Хотя у большинства больных COVID-19 наблюдается в малосимптомной форме, но у 5–10% вирусная инфекция осложняется пневмонией, сопровождающейся острой дыхательной недостаточностью вследствие ОРДС. Особенностью ОРДС при SARS-CoV-2-инфекции является так называемый цитокиновый шторм, представленный избыточным накоплением различных провоспалительных медиаторов, в том числе интерлейкинов (ИЛ) – ИЛ-1β, ИЛ-6, ИЛ-18, интерферона, фактора некроза опухолей. Критерии ранней диагностики синдрома выброса цитокинов не разработаны. Предполагать его следует при быстром ухудшении функции легких в сочетании с нарастающими концентрациями С-реактивного белка (СРБ) и ферритина, цитопенией (тромбоцитопенией и лимфопенией), коагулопатией (низкое число тромбоцитов и повышение фибриногена, повышенное содержание D-димера), признаками повреждения печени. Клинически у таких пациентов наблюдается быстрое прогрессирование изменений в легких в виде КТ-феномена «матового стекла», лихорадки, снижения сатурации, в том числе в виде эпизодов спонтанно возникающей гипоксии [11].
Быстрая потеря функций аэрогематического барьера, проявляющаяся снижением оксигенации крови, связана не только с острым повреждением аэрогематического барьера, но и нарастающим содружественно с воспалением процессами тромбообразования – тромботическая микроангиопатия, формирование гиалиновых мембран, фиброз (рис. 1). Остаточные фиброзные изменения в легких при COVID-19 могут быть обширными и, как следствие, снижают качество жизни по причине сохраняющейся дыхательной недостаточности. Состояния, связанные с «цитокиновым штормом», описаны при первичном и вторичном гемофагоцитарном лимфогистиоцитозе, синдроме активации макрофагов. Подобные события в легких возможны как ответ на введение противоопухолевых препаратов [11, 12].
Легочный фиброз, инициируемый коронавирусной инфекцией, остается мало изученной проблемой. По аналогии с другими распространенными в популяции вирусами, например вирусом Эпштейна–Барр, ключевой мишенью при коронавирусной инфекции становится эпителий дыхательных путей. Генетический материал EBV при легочном фиброзе выявлялся в 2 раза чаще, чем в сохранной ткани легкого от больных, оперированных по поводу опухоли легкого. Показано в эксперименте, что под влиянием EBV эпителиальная клетка становится источником факторов, активирующих иммунопатологические реакции с участием макрофагов, фибробластов, Т-лимфоцитов, усиливаются воспалительные и фибропролиферативные процессы в стенке альвеол. Доказательством тому стало обнаружение отложений коллагена 1-го типа в участках альвеолярного эпителия, содержащего вирусные включения [13].
Особенностью патогенеза COVID-19 является лавинообразное накопление в интерстиции легких медиаторов, ассоциированных с тем или иным типом смерти клеток эпителия дыхательных путей. Наряду с некрозом, апоптозом, вирус инициирует реакции железо-зависимой смерти клетки, так называемым ферроптозом. Показано также, что ферроптоз инициируется у больных, контаминированных синегнойной палочкой, наблюдаемых в отделениях реанимации и интенсивной терапии [14].
Ключевым компьютернотомографическим эквивалентом повреждения интерстиция легких при коронавирусной инфекции считается симптом «матового стекла» (рис. 1, 2). Данный феномен, в том числе в сочетании с кистозной трансформацией в виде «сотового легкого», описан также при идиопатических интерстициальных пневмониях, поражении легких при ревматоидном артрите, гиперчувствительном пневмоните, саркоидозе (рис. 3) [15, 16]. У больных наблюдается плохо контролируемая дыхательная недостаточность, морфологически регистрируются изменения, воспроизводящие по некоторым признакам COVID-19 [17, 18]. Можно также предполагать, что описанные ранее варианты легочного фиброза, например идиопатический легочный фиброз, первоначально известный как болезнь Хаммана–Рича, вероятно имеет вирусную природу, где вирус или бактериальные агенты выступают триггерами реакций повреждения (рис. 4) эпителия дыхательных путей (рис. 5), сосудов легких. В результате аэрогематический барьер замещается фиброзной тканью, и как следствие развивается быстропрогрессирующая дыхательная недостаточность (см. рис. 5) [19].



Лечение коронавирусной инфекции по-прежнему не получило достаточной доказательности. Не вызывает сомнений, что воздействие на этиологический фактор при вирусной инфекции и применение в рамках профилактики и лечения противовирусных средств может улучшить исход за счет уменьшения выраженности фиброза легких как отдаленного исхода заболевания.
Противовирусные средства – лекарственные препараты, оказывающие специфическое угнетающее действие на патогенные вирусы. Во-первых, организм проявляет резистентность к вирусным агентам, которая может быть генетической, постинфекционной, поствакцинальной, а также вызванной действием противовирусных препаратов. Если организм имеет факторы резистентности, вырабатываются интерфероны первого и третьего типов, устанавливается своеобразный санитарный барьер вокруг очага инфекции, и вирус не распространяется от первой зараженной клетки по всему организму. Вторым способом защиты организма от вирусной инфекции является механизм возникновения толерантности – частичная или полная утрата организмом способности вступать в иммунологическую реакцию со специфическим антигеном. При этом важен баланс факторов резистентности и толерантности в организме человека при ответе на вирусную инфекцию.
Некоторые противовирусные средства входят в состав комбинированных препаратов для устранения симптомов ОРЗ и «простуды». Так, в лечении ОРВИ и гриппа хорошо зарекомендовал себя препарат АнвиМакс, обладающий противовирусным, интерфероногенным, жаропонижающим, аналгезирующим, антигистаминным и ангиопротекторным действием в сочетании с благоприятным профилем безопасности [20, 21]. Входящий в его состав римантадин представляет собой солянокислую соль а-метил-1-адамантил-метиламина и используется в настоящее время при лечении гриппа. Препарат оказывает угнетающее действие на вирус гриппа типа А: блокируя М2-каналы вируса гриппа А, римантадин нарушает его способность проникать в клетки и высвобождать рибонуклеопротеид, ингибируя тем самым важнейшую стадию репликации вирусов. При гриппе, вызванном вирусом В, препарат оказывает антитоксическое действие. Влияние римантадина на течение респираторной инфекции представлено не только реакциями прямой противовирусной активности в отношении вируса гриппа А и антитоксическим действием при гриппе В, но и способностью индуцировать выработку интерферонов альфа и гамма, необходимых для формирования иммунного ответа.
Входящий в состав препарата парацетамол обладает аналгезирующим и жаропонижающим действием, что благоприятно влияет на качество жизни больных с симптомами острого респираторного заболевания. Аскорбиновая кислота участвует в регуляции окислительно-восстановительных процессов, способствует нормальной проницаемости капилляров, свертываемости крови, регенерации тканей, играет положительную роль в развитии иммунных реакций организма, восполняет дефицит витамина С, который может наблюдаться у пациента с ОРВИ [22].
Кальция глюконат как источник ионов кальция предотвращает развитие повышенной проницаемости и ломкости сосудов, обуславливающих геморрагические процессы при гриппе и ОРВИ, оказывает противоаллергическое действие.
Рутозид является ангиопротектором. Уменьшает проницаемость капилляров, отечность и воспаление, укрепляет сосудистую стенку, тормозит агрегацию и увеличивает степень деформации эритроцитов. Кроме того, согласно имеющимся экспериментальным данным, рутозид может способствовать торможению острого и хронического воспаления, в том числе в дыхательных путях [23, 24]. Рутозид также проявляет синергизм с аскорбиновой кислотой, усиливает ее активность [25].
Таким образом, в состав препарата АнвиМакс входит целый комплекс действующих веществ, позволяющий оказывать разнонаправленное действие при ОРВИ и гриппе: симптоматическое, этиотропное и патогенетическое.
Основные цели использования комбинированных противопростудных препаратов в лечении острых респираторных инфекций состоят в уменьшении продолжительности симптомов интоксикации (головной боли, головокружения и слабости), лихорадки, проявлений катарального синдрома и, соответственно, в улучшении качества жизни пациентов.
Таким образом, применение препаратов, обладающих комплексными эффектами, повышающими резистентность организма к повреждающему действию вирусов в период пандемии, в долговременной перспективе станет важным инструментом не только для снижения заболеваемости в целом, но и улучшения прогноза у переболевших за счет уменьшения остаточных фиброзных изменений в легких.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Попова Елена Николаевна – д-р мед. наук, проф. каф. ревматологии, внутренних профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru; ORCID: 0000-0001-5164-4621
Elena N. Popova – D. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru; ORCID: 0000-0001-5164-4621
Пономарев Андрей Борисович – канд. мед. наук, доц. каф. патологической анатомии им. А.И. Струкова, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Andrei B. Ponomarev – Cand. Sci. (Med.), Assoc. Prof., Sechenov First Moscow State Medical University (Sechenov University)
Статья поступила в редакцию / The article received: 28.12.2020
Статья принята к печати / The article approved for publication: 29.12.2020
Список исп. литературыСкрыть список1. Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)». Версия 9 (утв. Минздравом России 26 октября 2020 г.).
[Vremennye metodicheskie rekomendatsii "Profilaktika, diagnostika i lechenie novoi koronavirusnoi infektsii (COVID-19)". Versiia 9 (utv. Minzdravom Rossii 26 oktiabria 2020 g.) (in Russian).]
2. Simonnet A, Chetboun M, Poissy J et al. High prevalence of obesity in severe acute respiratory syndrome coronavirus-2 (SARS-CoV-2) requiring invasive mechanical ventilation. Obesity 2020; 28 (7): 1195–9. DOI: 10.1002/oby.22831
3. Leung JM, Niikura M, Tony Yang Ch W, Sin DD. COVID-19 and COPD. Eur Respir J 2020; 56 (2): 2002108. DOI: 10.1183/13993003. 02108-2020
4. An Zyl-Smit RN, Richards G, Leone FT. Tobacco smoking and COVID-19 infection. Lancet Respir Med 2020; 8 (7): 664–5. DOI: 10.1016/S2213-2600(20)30239-3. PMID: 32464099; PMCID: PMC7247798.
5. Lippi G, Sanchis-Gomar F, Henry BM. Active smoking and COVID-19: a double-edged sword. Eur J Intern Med 2020; 77: 123–4. DOI: 10.1016/j.ejim.2020.04.060. PMID: 32439289; PMCID: PMC7252038.
6. Shi Y, Wang G, Cai XP, et al. An overview of COVID-19. J Zhejiang Univ Sci B 2020; 21 (5): 343–60. DOI: 10.1631/jzus.B2000083. PMID: 32425000; PMCID: PMC7205601.
7. Feng Y, Ling Y, Bai T et al. COVID-19 with different severity: a multi-center study of clinical features. Am J Respir Crit Care Med 2020; 201: 1380–8. DOI: 10.1164/rccm.202002-0445OC
8. Cai Q, Chen F, Wang T et al. Obesity and COVID-19 severity in a designated hospital in Shenzhen, China. Diabetes Care 2020; 43: 1392–8.
9. Leung JM, Yang CX, Tam A et al. ACE-2 expression in the small airway epithelia of smokers and COPD patients: implications for COVID-19. Eur Respir J 2020; 55 (5): 2000688. DOI: 10.1183/ 13993003.00688-2020
10. Zhang H, Rostami MR, Leopold PL et al. Expression of the SARS-CoV-2 ACE2 receptor in the human airway epithelium. Am J Respir Crit Care Med 2020; 202: 219–29.
11. Ahmed H, Sayed A, Munir M et al. A Clinical Review of COVID-19; Pathogenesis, Diagnosis, and Management. Curr Pharm Des 2020.
E-pub Ahead of Print. DOI: 10.2174/1381612826666201222162509
12. Ojo AS, Balogun SA, Williams OT, Ojo OS. Pulmonary Fibrosis in COVID-19 Survivors: Predictive Factors and Risk Reduction Strategies. Pulm Med 2020: 6175964. E-pub Ahead of Print. DOI: 10.1155/2020/6175964. PMID: 32850151; PMCID: PMC7439160.
13. Lagi F, Piccica M, Graziani L et al. Early experience of an infectious and tropical diseases unit during the coronavirus disease (COVID-19) pandemic, Florence, Italy, February to March 2020. Euro Surveill 2020; 25: 2000556. DOI: 10.2807/1560-7917.ES.2020.25.17.2000556
14. Tyurina YY, Mikulska-Ruminska K et al. Pseudomonas aeruginosa utilizes host polyunsaturated phosphatidylethanolamines to trigger theft-ferroptosis in bronchial epithelium. J Clin Invest 2018; 128 (10): 4639–53. DOI: 10.1172/JCI99490
15. Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res 2019; 20 (1): 57. DOI: 10.1186/s12931-019-1022-1
16. Raghu G, Remy-Jardin M, Myers JL et al. Diagnosis of idiopathic pulmonary fibrosis. An official ATS/ERS/JRS/ALAT clinical practice guideline. Am J Respir Crit Care Med 2018; 198: e44–e68. DOI: 10.1164/rccm.201807-1255ST
17. Sheng G, Chen P, Wei Y et al. Viral Infection Increases the Risk of Idiopathic Pulmonary Fibrosis: A Meta-Analysis. Chest 2020; 157 (5): 1175–87. DOI: 10.1016/j.chest.2019.10.032
18. Anand Devaraj. Imaging: how to recognise idiopathic pulmonary fibrosis. European Respiratory Review 2014; 23: 215–9; DOI: 10.1183/09059180.00001514
19. Rai DK, Sharma P, Kumar R. Post Covid-19 pulmonary fibrosis- Is it reversible? Indian J Tuberc 2020; 10. E-pub Ahead of Print. DOI: 10.1016/j.ijtb.2020.11.003
20. Громова O.A., Торшин И.Ю. Сочетанная терапия для лечения ОРВИ: анализ комбинированного комплекса АнвиМакс. Медицинский алфавит. 2020; 21: 33–48.
[Gromova O.A., Torshin I.Yu. Combined therapy for treatment of acute respiratory viral infections: analysis of combined complex AnviMax. Medical alphabet. 2020; 21: 33–48. DOI: 10.33667/2078-5631-2020-21-33-48 (in Russian).]
21. Кузин В.Б., Ловцова Л.В., Барсук А.Л. Исследование клинической эффективности и переносимости препарата Антигриппин-Максимум при лечении ОРВИ (гриппа). Справочник поликлинического врача. 2010; 1: 3–7.
[Kuzin V.B., Lovtsova L.V., Barsuk A.L. Issledovanie klinicheskoi effektivnosti i perenosimosti preparata Antigrippin-Maksimum pri lechenii ORVI (grippa). Spravochnik poliklinicheskogo vracha. 2010; 1: 3–7 (in Russian).]
22. Hemila H, Chalker E. Vitamin C for preventing and treating the common cold. Cochrane Database SystRev 2013; 1: CD 000980.
23. Bai L, Li A, Gong C et al. Protective effect of rutin against bleomycin induced lung fibrosis: Involvement of TGF-beta1/alpha-SMA/Col I and III pathway. Biofactors 2020. DOI: 10,1002/biof.1629. PubMed ID: 32233122.
24. Ortolani O, Conti A, De Gaudio AR et al. Protective effects of N-acetylcysteine and rutin on the lipid peroxidation of the lung epithelium during the adult respiratory distress syndrome. Shock 2000; 13 (1): 14–8. DOI: 10.1097/00024382-200013010-00003. PMID: 10638663.
25. Ragheb SR et al. Impact of Rutin and Vitamin C combination on oxidative stress and glycemic control in patients with type 2 diabetes. Clinical Nutrition ESPEN 2020; 35: 128–35. DOI: 10.1016/j.clnesp.2019.10.015
3 марта 2021
Количество просмотров: 8311