Клинический разбор в общей медицине №01 2021
1City Clinical Hospital №11, Barnaul, Russia;
2Altai State Medical University, Barnaul, Russia
yulya.samchuk14@mail.ru
Abstract
Aim. To assess alterations of immune status and blood microcirculation in patients with purulent pyelonephritis during treatment.
Methods. The prospective cohort multiple randomized controlled trial was carried out at the Department of Urology and Andrology at the Municipal Hospital No. 11 (Barnaul) in 2016-2019. A total of 94 patients aged 20–60 diagnosed with purulent pyelonephritis were treated during this period. The study was approved by the Ethics Committee of the Altai State Medical University (protocol No. 14 dated November 18, 2016). The informed consent was submitted by all participants. During the study, two groups were formed, which included patients already diagnosed with purulent pyelonephritis and patients with a suspicion on purulent process based on clinical, laboratory and functional tests data. The patients were randomized and divided into two groups in accordance with the methods used. The first group, showing no clinical and laboratory response to therapy, underwent surgery (n=47), the second group received cryoprcipitate together with standard conservative treatment for purulent pyelonephritis (n=47). All the cohorts were similar in age, gender and ethnicity. The patients’ immune status was estimated: IgM, IgG and IgA-based enzyme immunoassay tests were performed using the Immunoscreen-G, M, A-EIA-BEST kit by Vector-Best (Novosibirsk); serum interleukin-1β, interleukin-6, TNF-α and urine interleukin-8 levels were assayed using the Interleukin-8-EIA-BEST, Interleukin-1β-EIA-BEST, Alpha-TNF-EIA-BEST and Interleukin-6-EIA-BEST kits (Vector-Best, Russia, 2011). In addition to a number of instrumental tests, blood microcirculation in the zone of inflammation was assessed using the LAKK-2 analyzer in the projections of kidneys. The immune status markers were assessed upon admission and on day 6–7 of hospital stay. Each and every patient received complex conservative treatment. The patients received antibacterial therapy during an average of 3–4 days after their body temperature was back to normal.
Results. Immune status assessment in group 1 patients revealed multidirectional alterations in immunoglobulin levels: significantly increased level serum Ig G and Ig M and decreased level of Ig A indicated the impaired humoral immunity. On day 9 of treatment the patients of group 1 still showed decreased level of Ig A. Their Ig G became even higher, and the level Ig M showed a decreasing trend. Upon admission, the serum levels of proinflammatory cytokines in patients of group 1 were more than twice as high as the control level, which could be considered the natural consequence of the observed infectious process in the urinary tract. On day 9 of treatment serum levels of proinflammatory cytokines became significantly lower: urine IL-8 level declined to 10.01±0.86 pg/mL, blood IL-6 level declined to 12.04±0.81 pg/mL, IL-1 level declined to 10.67±1.07 pg/mL, and TNF-α level declined to 4.75±0.40 pg/mL. However, the latter failed to reach the physiologically normal level, which indicated the incomplete reversal of inflammation in the urinary tract against the background of using the selected treatment approach. Blood microcirculation assessment using Laser Doppler flowmetry (LDF) prior to prescribing therapy to patients of group 1 revealed the following basal blood flow indicators: decreased shunt blood flow, reduced average blood flow, index of microcirculation efficiency, myogenic tone and fluctuations in erythrocyte flow, as well as elevated coefficient of variation and neurogenic tone compared to control and comparison groups. After surgery used as an adjunct to the complex treatment the significantly increased index of microcirculation efficiency, elevated average blood flow, increased neurogenic tone, reduced shunt blood flow and myogenic tone were observed. The listed indicators showed a positive trend, but failed to reach the physiologically normal level. Kidney inflammation persisted despite surgical and antibacterial treatment. Group 2. Assessment of group 2 patients prior to prescribing drug therapy revealed the pronounced serum immunoglobulin level alterations. Serum Ig G and Ig M levels were increased compared to control group, and the Ig A level was decreased, which indicated the humoral immunity impairment. Assessment of immunoglobulin levels after treatment showed they were back to normal, which indicated complete restoration of humoral immune response.
In patients of group 2, cytokine profile analysis was performed prior to prescribing drug therapy supplemented by cryoprcipitate, and on day 9 of treatment. Thus, prior to complex treatment, the patients’ serum and urine levels of proinflammatory cytokines were more than twice as high as the control level, which was due to ongoing inflammatory process, and the urine IL-8 level was twice as high as the control level. Drug therapy with the use of cryoprcipitate resulted in recovery of IL-1β, TNF-α, IL-6 and IL-8 levels to physiologically normal levels obtained by examination of healthy individuals. This indicates complete reversal of inflammation in the urinary tract against the background of using the selected treatment approach. Assessment of microcirculation in the surface projections of kidneys by LDF revealed alterations in basal blood flow similar to those observed in patients of group 1. The average blood flow, shunt blood flow, neurogenic tone and index of microcirculation efficiency decreased significantly, and the myogenic tone increased. On day 9 of treatment the significantly increased average blood flow, index of microcirculation efficiency, neurogenic tone and shunt blood flow were observed. Myogenic tone dropped to physiologically normal level. Based on the alterations observed, the improved blood circulation in the ischemic zone and reduced hypoxia in the affected area of the kidneys can be reported.
Key words: purulent pyelonephritis, ischemia, immunity.
For citation: Chernova Yu.G., Neimark A.I., Tarasova I.N., Nitievskaia G.A. Kidney immune status and blood microcirculation alterations under treatment of purulent pyelonephritis. Clinical review for general practice. 2021; 1: 36–43. DOI: 10.47407/kr2021.2.1.00030
При проникновении и распространении инфекционного агента, макроорганизм немедленно включает множество механизмов защиты, мобилизации органов и систем. Наиболее важными являются система мононуклеарных фагоцитов, иммунная система и система гемостаза. J. Fine (1964 г.) выдвинул гипотезу о влиянии септицемии – если она длится достаточно долго, то наряду с другими функциями организма нарушает дезинтоксикационную функцию ретикулоэндотелиальной системы (систему мононуклеарных фагоцитов) [3].
Иммуноглобулины имеют множество функций, основными из которых являются:
1. Нейтрализация токсинов вырабатываемых бактериями (IgG).
2. Активация комплемента (терминальные компоненты комплемента пробивают дыры на поверхности клеточной стенки и приводят к «осмотической» смерти, IgM и IgG), защита слизистых оболочек (подавление адгезии патогенов к поверхности слизистой оболочки, IgA).
3. Изменение формы бактерий и другого поглощаемого материала (IgM).
4. Иммобилизация бактерий (нарушение подвижности).
5. Опсонизация бактерий (напрямую или опосредованно путем активации комплемента, IgG).
6. Антителозависимая клеточная опосредованная цитотоксичность, вызванная разрушением микроорганизмов за счет высвобождения токсических субстанций – порферинов [4].
Дефицит иммуноглобулинов может быть связан с гипоглобулинемией и подавлением выработки В-клеток в костном мозге [5].
Исследование уровня и баланса цитокинов является важным моментом для раскрытия механизмов активации иммунного реагирования в патогенезе инфекционно-воспалительных заболеваний.
Увеличение продукции таких провоспалительных цитокинов, как интерлейкин (ИЛ)-1, ИЛ-6 и фактор некроза опухоли (ФНО)-α, у больных пиелонефритом выступает критерием активности воспалительного процесса [6].
J.F. Bermejo-Martin, М.С. Garcia-Arevalo, R.O. deLejarazu (2007 г.) [7] выразили свое мнение о необходимости оценки уровня цитокинов в крови у больных с воспалительными заболеваниями, тем более что продукция некоторых, к примеру ФНО-α, возрастает лишь при остром воспалительном процессе. Показано, что уровень ИЛ-8 в моче прямо пропорционально зависит от активности воспалительного процесса в мочевыделительной системе [8].
Достаточно большую роль в развитии и поддержании воспаления в почках играет расстройство кровообращения. При уменьшении скорости кровотока происходит задержка и внедрение бактерий в ткань почки, поражая, в первую очередь, интерстиций мозгового вещества почек, формируя благоприятный фон (высокая концентрация аммония и осмолярность) для инвазии бактериальной флоры [9]. При гистологическом анализе тканей с нарушенной микроциркуляцией определяются тромбы в венозных сосудах, стаз в капиллярах, нарушение проницаемости стенок сосудов, что приводит к усиленному проникновению и размножению бактерий в интерстициальной ткани почек [10].
Нарушение микроциркуляции приводит также к формированию гипоксии и метаболическому ацидозу в тканях почки с последующим угнетением обменных процессов, накоплением и циркуляции в крови протеолитических ферментов и биологически активных веществ, образованных при гибели бактерий, разрушении лейкоцитов и тучных клеток [11].
Цель исследования: изучить изменения иммунного статуса и микроциркуляции на фоне развития гнойного пиелонефрита и его лечения.
Все исследуемые пациенты поступали в приемный покой дежурного урологического стационара по службе скорой медицинской помощи или в экстренном порядке при направлении из поликлиники по месту жительства.
После обследования пациенты рандомно были разделены на группы в соответствии с тактикой терапии.
В 1-ю группу вошли 47 пациентов (7 мужчин, 40 женщин) с тяжелым течением пиелонефрита. Пациенты этой группы получали традиционную консервативную терапию, но на фоне ее неэффективности были прооперированы. Во 2-ю группу вошли 47 больных (6 мужчин, 41 женщина) с тяжелым течением пиелонефрита, в комплекс терапии которых был добавлен криопреципитат. Пациенты 1 и 2-й групп не отличались друг от друга по тяжести течения заболевания, проведенной антибактериальной и дезинтоксикационной терапии.
Помимо стандартного комплекса лабораторного обследования, пациентам проводилось исследование системы иммунитета.
Анализ показателей иммунного статуса проводился в лаборатории КГБУЗ «Городская больница №11»,
г. Барнаула. Определялось содержание основных иммуноглобулинов, таких как IgM, IgG и IgA, ИФА-методом с помощью набора реактивов «Иммуноскрин-M, A, G – ИФА-Бест» ЗАО «Вектор-Бест» (г. Новосибирск).
Анализ содержания ИЛ-1β, ИЛ-6, ФНО-α в сыворотке крови и ИЛ-8 в моче происходил при помощи тест-системы иммуноферментного анализа «Интерлейкин-8-ИФА»; «Интерлейкин-1β-ИФА»; «Альфа-ФНО-ИФА»; «Интерлейкин-6-ИФА» (ЗАО «Вектор-Бест», Россия, 2011). Основой метода анализа является твердофазная иммуноферментная реакция в «сэндвич»-варианте с использованием моно- и поликлональных антител к ИЛ-1β, ИЛ-6, ИЛ-8, ФНО-α.
В дополнение к инструментальным методам диагностики выполнялась лазерная допплеровская флоуметрия (ЛДФ), которая является непрямым (косвенным) методом определения уровня микроциркуляции крови в органах. Она неинвазивна и абсолютно безопасна, но при этом обладает высокой чувствительностью к гемодинамическим отклонениям в сосудистом русле [12].
Для оценки уровня микроциркуляции в тканях почек применялся аппарат ЛАКК-02 (НПП «ЛАЗМА», Россия) с программным обеспечением ЛДФ. Анализ производился с биологически активных точек проекции почек на коже в поясничной области, имеющих точную локализацию и интенсивное кровоснабжение [13].
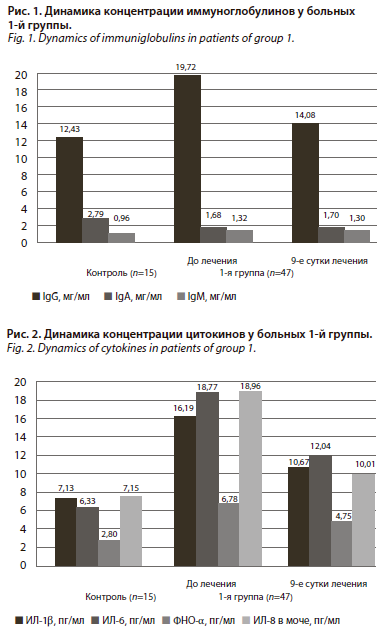 1-я группа. При анализе состояния иммунной системы больных 1-й группы определено разнонаправленное нарушение уровня иммуноглобулинов (рис. 1): статистически достоверное повышение IgG, IgM и снижение концентрации IgA в сыворотке крови говорит о нарушении гуморального звена иммунного ответа.
1-я группа. При анализе состояния иммунной системы больных 1-й группы определено разнонаправленное нарушение уровня иммуноглобулинов (рис. 1): статистически достоверное повышение IgG, IgM и снижение концентрации IgA в сыворотке крови говорит о нарушении гуморального звена иммунного ответа.
На 9-е сутки проводимого лечения у больных 1-й группы сохранялся сниженный уровень IgA, еще более повышался IgG, в то же время IgM имел тенденцию к снижению.
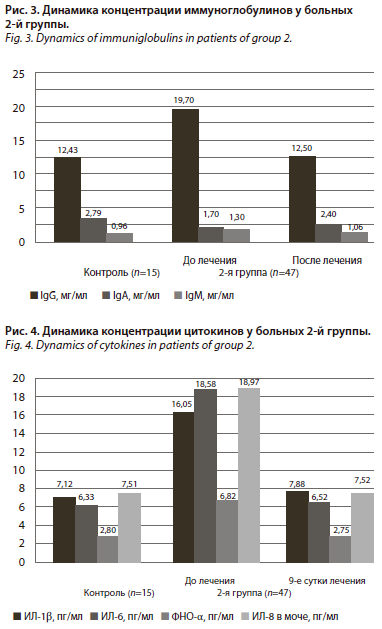
При поступлении содержание провоспалительных цитокинов у пациентов 1-й группы в сыворотке крови более чем в 2 раза превышало уровень контрольных значений, что являлось естественным следствием наблюдаемого инфекционного процесса в мочевыделительной системе (рис. 2).
На 9-е сутки проводимого лечения уровень провоспалительных цитокинов в сыворотке крови и моче достоверно уменьшился: содержание ИЛ-8 в моче понизилось до 10,01±0,86 пг/мл, в крови ИЛ-6 снизился до 12,04±0,81 пг/мл, ИЛ-1 – до 10,67±1,07 пг/мл, ФНО-α – до 4,75±0,40 пг/мл, но так и не достиг показателей физиологической нормы, что указывает на неполное купирование воспалительного процесса в мочевыделительной системе при использованных подходах к лечению.
Во время проведения исследования показателей микроциркуляции методом ЛДФ до назначения терапии в 1-й группе больных по точкам проекции почек на коже (табл. 1) выявлялись уровни базального кровотока в понижении показателя шунтирования, снижении среднего потока крови, индекса эффективности микроциркуляции, миогенного тонуса и колебания скорости эритроцитов, повышении коэффициента вариации и нейрогенного тонуса в отличие от групп контроля и сравнения.
Вследствие проведенной комплексной терапии, дополненной оперативным лечением, отмечалось статистически значимое повышение индекса эффективности микроциркуляции, повышение уровня среднего потока крови, усиление нейрогенного тонуса, снижение показателя шунтирования и миогенного тонуса. Данные показатели имели положительную динамику, но не достигли уровня значений здоровых людей. Несмотря на проведенное оперативное и антибактериальное лечение, воспалительный процесс в почках сохранялся.
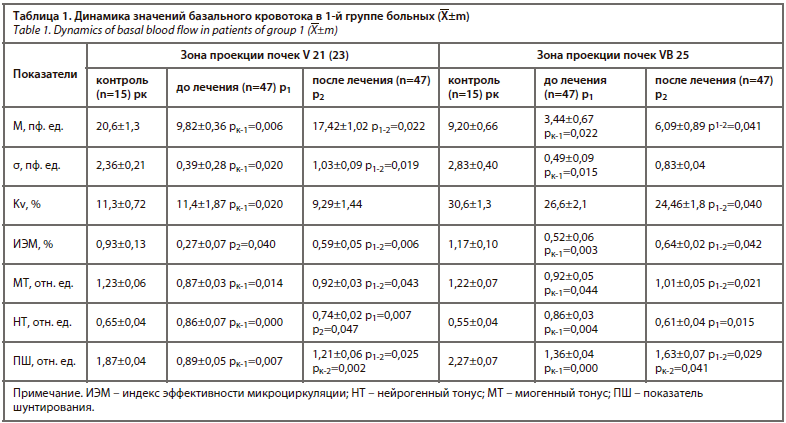
2-я группа. Анализ данных во 2-й группе до назначения медикаментозной терапии выявлял выраженные изменения концентрации иммуноглобулинов в сыворотке крови. IgG и IgM в сыворотке крови повышались в сравнении с контрольной группой, а уровень IgA снижался (рис. 3), что указывало по повреждение гуморального звена иммунитета.
При анализе концентрации иммуноглобулинов после проведенной терапии отмечалась нормализация их уровня, что указывало на полное восстановление гуморального звена иммунитета.
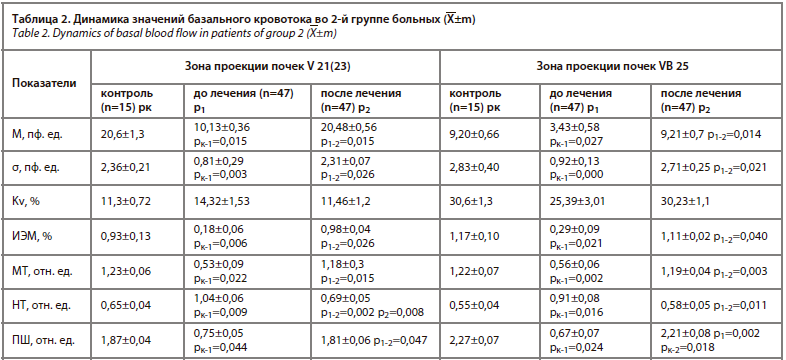
У пациентов 2-й группы проводился анализ цитокинового профиля до назначения медикаментозной терапии, дополненной криопреципитатом, и на 9-е сутки лечения. Таким образом, до начала комплексной терапии обнаруживалось повышенное содержание провоспалительных цитокинов в сыворотке крови и моче больных более чем в 2 раза в сравнении с контрольными значениями, что являлось следствием развивающегося воспалительного процесса, и повышение ИЛ-8 в моче в 2 раза выше контрольных значений (рис. 4).
Вследствие проведенной медикаментозной терапии с применением криопреципитата восстановился уровень ИЛ-1β, ФНО-α, ИЛ-6 и ИЛ-8 до показателей физиологической нормы, полученных при обследовании группы здоровых людей, это указывает на полное купирование воспалительного процесса в мочевыделительной системе при использованных подходах к лечению.
Анализ общего уровня микроциркуляции в точках проекции почек на коже методом ЛДФ выявил изменение базального кровотока схожее с данными в 1-й группе больных. Существенно снизился уровень среднего потока крови, показатель шунтирования, нейрогенного тонуса, эффективности микроциркуляции (табл. 2), а миогенный тонус напротив усилился.
 На 9-е сутки терапии отмечалось статистически достоверное повышение уровня среднего потока крови, индекса эффективности микроциркуляции, нейрогенного тонуса и показателя шунтирования. Миогенный тонус понизился до значений физиологической нормы. На основании этих изменений можно говорить об улучшении кровообращения в зоне ишемии и уменьшении гипоксии в пораженной области почек.
На 9-е сутки терапии отмечалось статистически достоверное повышение уровня среднего потока крови, индекса эффективности микроциркуляции, нейрогенного тонуса и показателя шунтирования. Миогенный тонус понизился до значений физиологической нормы. На основании этих изменений можно говорить об улучшении кровообращения в зоне ишемии и уменьшении гипоксии в пораженной области почек.
В области ранее лоцируемого гипоэхогенного участка определяется умеренное утолщение коркового слоя до 15 мм, скорость кровотока практически не отличается от нормы. Из этого следует, что добавление криопреципитата к комплексу терапии способствовало улучшению общего состояния, нормализации кровотока и толщины коркового слоя почки. Следовательно, по данным клинико-лабораторного обследования, у больных острым гнойным пиелонефритом, получавших комплексную терапию с применением криопреципитата, удалось ликвидировать признаки гнойного воспаления в почках, что подтверждалось положительной динамикой снижения температуры тела, уменьшением болевых ощущений, нормализацией показателей крови, а именно уровня иммуноглобулинов и цитокинов. Также стоит отметить, что на фоне терапии полностью восстановился сниженный до начала терапии уровень базального кровотока.
Анализ данных, полученных при изучении иммунного статуса с острым пиелонефритом, путем оценки уровня иммуноглобулинов сыворотки крови свидетельствовал о дисбалансе гуморального звена иммунной системы и, как следствие, об ухудшении противоинфекционной резистентности и повышении степени воспаления в мочевыделительной системе.
На фоне проводимой терапии наилучшие результаты проведенного исследования показали, что терапия, дополненная оперативным лечением, не способствует значительным изменениям в иммунной системе. В то время как терапия, дополненная использованием криопреципитата, способна стимулировать иммунную систему и способствовать быстрому выздоровлению больных.
При оценке цитокинового профиля больных с острым гнойным пиелонефритом эти показатели повышались значительно. Вследствие проведенной терапии в 1-й группе отмечалась тенденция к нормализации измененных показателей, но не до контрольных значений, что указывало на сохраняющийся воспалительный процесс в мочевыводящей системе. Полная нормализация показателей цитокинов происходила только в группе с использованием криопреципитата, что свидетельствовало о купировании воспалительного процесса.
В 1 и 2-й группах пациентов при поступлении изменения базального кровотока были более значительными. На фоне терапии эти показатели улучшились, но в 1-й группе они были далеки от контрольных значений, а во 2-й группе происходила их нормализация.
Таким образом, применение криопреципитата в комплексном лечении острого пиелонефрита более эффективно, на фоне его применения купировались ишемия, гипоксия, улучшилась микроциркуляции в области почек. Методика лечения с применением криопреципитата восстанавливала кровоток в системе микроциркуляции, устраняла ишемизацию почечной паренхимы, что значительно улучшало результаты терапии острого гнойного пиелонефрита.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Чернова Юлия Геннадьевна – врач-уролог, КГБУЗ «Городская больница №11», ООО «ПКДЦ Здоровье». E-mail: yulya.samchuk14@mail.ru, SPIN-код: 9335-5220, Author ID: 1074897
Yuliia G. Chernova – Urologist, City Clinical Hospital №11. E-mail: yulya.samchuk14@mail.ru, SPIN-код: 9335-5220, Author ID: 1074897
Неймарк Александр Израилевич – д-р мед. наук, проф., зав. каф. урологии и андрологии с курсом ДПО, ФГБОУ ВО АГМУ. ORCID: 0000-0002-5741-6408, Scopus Author ID: 7102411541
Aleksandr I. Neimark – D. Sci. (Med.), Prof., Altai State Medical University. ORCID: 0000-0002-5741-6408, Scopus Author ID: 7102411541
Тарасова Ирина Николаевна – зав. иммунологической лабораторией, КГБУЗ «Городская больница №11»
Irina N. Tarasova – Head of the Immunological Laboratory, City Clinical Hospital №11
Нитиевская Галина Александровна – врач-лаборант иммунологической лаборатории, КГБУЗ «Городская больница №11»
Galina A. Nitievskaia – doctor-laboratory assistant of the immunological laboratory, City Clinical Hospital №11
Статья поступила в редакцию / The article received: 25.01.2021
Статья принята к печати / The article approved for publication: 29.01.2021
Клинический разбор в общей медицине №01 2021
Изменения иммунитета и микроциркуляции в почках на фоне лечения гнойного пиелонефрита
Номера страниц в выпуске:36-43
Аннотация
Цель исследования. Изучить изменения иммунного статуса и микроциркуляции на фоне развития гнойного пиелонефрита и его лечения.
Материалы и методы. В период с 2016 по 2019 г. на базе кафедры урологии и андрологии в КГБУЗ «Городская больница №11» (г. Барнаул) проведено проспективное когортное контролируемое рандомизированное исследование. За этот период были пролечены 94 пациента в возрасте от 20 до 60 лет с диагнозом «Острый гнойный пиелонефрит». Работа была одобрена локальным этическим комитетом ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России (протокол №14 от 18.11.2016), все участники подписали информированное согласие. В рамках исследования были сформированы две группы, в состав которых вошли пациенты с уже диагностированным гнойным пиелонефритом или подозрением на гнойный процесс на основании клинических, лабораторных и данных функциональных методов диагностики. Пациенты были рандомизированы и разделены на две группы в зависимости от использованных методов лечения. В 1-й группе, на фоне клинической и лабораторной неэффективности терапии, проводилось оперативное лечение (n=47), во 2-й группе помимо стандартной консервативной терапии гнойного пиелонефрита применялся криопреципитат (n=47). Все выделенные когорты были сопоставимы по возрасту, полу и этнической принадлежности. Пациентам проводился анализ иммунного статуса: IgM, IgG и IgA ИФА-методом с помощью набора реактивов «Иммуноскрин-M, A, G – ИФА-Бест» ЗАО «Вектор-Бест» (г. Новосибирск), также определялось содержание интерлейкина (ИЛ)-1β, ИЛ-6, фактора некроза опухоли (ФНО)-α в сыворотке крови и ИЛ-8 в моче при помощи тест-системы иммуноферментного анализа «Интерлейкин-8-ИФА»; «Интерлейкин-1β-ИФА»; «Альфа-ФНО-ИФА»; «Интерлейкин-6-ИФА» (ЗАО «Вектор-Бест», Россия, 2011). Дополнительно к комплексу инструментальных исследований выполнялась оценка уровня микроциркуляции в области воспаления на аппарате Лакк-2 в зонах проекции почек. Исследование маркеров иммунного статуса осуществлялось у пациентов при поступлении и на 6–7-е сутки пребывания в стационаре. Лечение всех без исключения больных предусматривало проведение комплексной консервативной терапии. Антибактериальную терапию продолжали в среднем в течение 3–4 дней после нормализации температуры тела.
Результаты. При анализе состояния иммунной системы больных 1-й группы определено разнонаправленное нарушение уровня иммуноглобулинов: статистически достоверное повышение IgG, и IgM и снижение концентрации IgA в сыворотке крови говорит о нарушении гуморального звена иммунного ответа. На 9-е сутки проводимого лечения у больных 1-й группы сохранялся сниженный уровень IgA, еще более повышался IgG, в то же время IgM имел тенденцию к снижению. При поступлении содержание провоспалительных цитокинов у пациентов 1-й группы в сыворотке крови более чем в 2 раза превышало уровень контрольных значений, что являлось естественным следствием наблюдаемого инфекционного процесса в мочевыделительной системе. На 9-е сутки проводимого лечения уровень провоспалительных цитокинов в сыворотке крови и моче достоверно уменьшился: содержание ИЛ-8 в моче понизилось до 10,01±0,86 пг/мл, в крови ИЛ-6 снизился до 12,04±0,81 пг/мл, ИЛ-1 – до 10,67±1,07 пг/мл, ФНО-α – до 4,75±0,40 пг/мл, но так и не достиг показателей физиологической нормы, что указывает на неполное купирование воспалительного процесса в мочевыделительной системе при использованных подходах к лечению. Во время проведения исследования показателей микроциркуляции ЛДФ-методом, до назначения терапии в 1-й группе больных, выявлялись уровни базального кровотока в понижении показателя шунтирования, снижении среднего потока крови, индекса эффективности микроциркуляции, миогенного тонуса и колебания скорости эритроцитов, повышении коэффициента вариации и нейрогенного тонуса в отличие от групп контроля и сравнения. Вследствие проведенной комплексной терапии, дополненной оперативным лечением, отмечалось статистически значимое повышение индекса эффективности микроциркуляции, повышение уровня среднего потока крови, усиление нейрогенного тонуса, снижение показателя шунтирования и миогенного тонуса. Данные показатели имели положительную динамику, но не достигли уровня значений здоровых людей. Несмотря на проведенное оперативное и антибактериальное лечение воспалительный процесс в почках сохранялся. 2-я группа. Анализ данных во второй группе до назначения медикаментозной терапии выявлял выраженные изменения концентрации иммуноглобулинов в сыворотке крови. IgG и IgM в сыворотке крови повышались в сравнении с контрольной группой, а уровень IgA снижался, что указывало на повреждение гуморального звена иммунитета. При анализе концентрации иммуноглобулинов после проведенной терапии отмечалась нормализация их уровня, что указывало на полное восстановление гуморального звена иммунитета. У пациентов 2-й группы проводился анализ цитокинового профиля до назначения медикаментозной терапии, дополненной криопреципитатом, и на 9-е сутки лечения. Таким образом, до начала комплексной терапии обнаруживалось повышенное содержание провоспалительных цитокинов в сыворотке крови и моче больных более чем в 2 раза в сравнении с контрольными значениями, что являлось следствием развивающегося воспалительного процесса, и повышение ИЛ-8 в моче в 2 раза выше контрольных значений. Вследствие проведенной медикаментозной терапии с применением криопреципитата восстановился уровень ИЛ-1β, ФНО-α, ИЛ-6 и ИЛ-8 до показателей физиологической нормы, полученных при обследовании группы здоровых людей, это указывает на полное купирование воспалительного процесса в мочевыделительной системе при использованных подходах к лечению. Анализ общего уровня микроциркуляции в точках проекции почек на коже ЛДФ-методом выявил изменение базального кровотока схожее с данными в 1-й группе больных. Существенно снизился уровень среднего потока крови, показатель шунтирования, нейрогенного тонуса, эффективности микроциркуляции, а миогенный тонус напротив усилился. На 9-е сутки терапии отмечалось статистически достоверное повышение уровня среднего потока крови, индекса эффективности микроциркуляции, нейрогенного тонуса и показателя шунтирования. Миогенный тонус понизился до значений физиологической нормы. На основании этих изменений можно говорить об улучшении кровообращения в зоне ишемии и уменьшении гипоксии в пораженной области почек.
Ключевые слова: гнойный пиелонефрит, ишемия, иммунитет.
Для цитирования: Чернова Ю.Г., Неймарк А.И., Тарасова И.Н., Нитиевская Г.А. Изменения иммунитета и микроциркуляции в почках на фоне лечения гнойного пиелонефрита. Клинический разбор в общей медицине. 2021; 1: 36–43. DOI: 10.47407/kr2021.2.1.00030
Цель исследования. Изучить изменения иммунного статуса и микроциркуляции на фоне развития гнойного пиелонефрита и его лечения.
Материалы и методы. В период с 2016 по 2019 г. на базе кафедры урологии и андрологии в КГБУЗ «Городская больница №11» (г. Барнаул) проведено проспективное когортное контролируемое рандомизированное исследование. За этот период были пролечены 94 пациента в возрасте от 20 до 60 лет с диагнозом «Острый гнойный пиелонефрит». Работа была одобрена локальным этическим комитетом ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России (протокол №14 от 18.11.2016), все участники подписали информированное согласие. В рамках исследования были сформированы две группы, в состав которых вошли пациенты с уже диагностированным гнойным пиелонефритом или подозрением на гнойный процесс на основании клинических, лабораторных и данных функциональных методов диагностики. Пациенты были рандомизированы и разделены на две группы в зависимости от использованных методов лечения. В 1-й группе, на фоне клинической и лабораторной неэффективности терапии, проводилось оперативное лечение (n=47), во 2-й группе помимо стандартной консервативной терапии гнойного пиелонефрита применялся криопреципитат (n=47). Все выделенные когорты были сопоставимы по возрасту, полу и этнической принадлежности. Пациентам проводился анализ иммунного статуса: IgM, IgG и IgA ИФА-методом с помощью набора реактивов «Иммуноскрин-M, A, G – ИФА-Бест» ЗАО «Вектор-Бест» (г. Новосибирск), также определялось содержание интерлейкина (ИЛ)-1β, ИЛ-6, фактора некроза опухоли (ФНО)-α в сыворотке крови и ИЛ-8 в моче при помощи тест-системы иммуноферментного анализа «Интерлейкин-8-ИФА»; «Интерлейкин-1β-ИФА»; «Альфа-ФНО-ИФА»; «Интерлейкин-6-ИФА» (ЗАО «Вектор-Бест», Россия, 2011). Дополнительно к комплексу инструментальных исследований выполнялась оценка уровня микроциркуляции в области воспаления на аппарате Лакк-2 в зонах проекции почек. Исследование маркеров иммунного статуса осуществлялось у пациентов при поступлении и на 6–7-е сутки пребывания в стационаре. Лечение всех без исключения больных предусматривало проведение комплексной консервативной терапии. Антибактериальную терапию продолжали в среднем в течение 3–4 дней после нормализации температуры тела.
Результаты. При анализе состояния иммунной системы больных 1-й группы определено разнонаправленное нарушение уровня иммуноглобулинов: статистически достоверное повышение IgG, и IgM и снижение концентрации IgA в сыворотке крови говорит о нарушении гуморального звена иммунного ответа. На 9-е сутки проводимого лечения у больных 1-й группы сохранялся сниженный уровень IgA, еще более повышался IgG, в то же время IgM имел тенденцию к снижению. При поступлении содержание провоспалительных цитокинов у пациентов 1-й группы в сыворотке крови более чем в 2 раза превышало уровень контрольных значений, что являлось естественным следствием наблюдаемого инфекционного процесса в мочевыделительной системе. На 9-е сутки проводимого лечения уровень провоспалительных цитокинов в сыворотке крови и моче достоверно уменьшился: содержание ИЛ-8 в моче понизилось до 10,01±0,86 пг/мл, в крови ИЛ-6 снизился до 12,04±0,81 пг/мл, ИЛ-1 – до 10,67±1,07 пг/мл, ФНО-α – до 4,75±0,40 пг/мл, но так и не достиг показателей физиологической нормы, что указывает на неполное купирование воспалительного процесса в мочевыделительной системе при использованных подходах к лечению. Во время проведения исследования показателей микроциркуляции ЛДФ-методом, до назначения терапии в 1-й группе больных, выявлялись уровни базального кровотока в понижении показателя шунтирования, снижении среднего потока крови, индекса эффективности микроциркуляции, миогенного тонуса и колебания скорости эритроцитов, повышении коэффициента вариации и нейрогенного тонуса в отличие от групп контроля и сравнения. Вследствие проведенной комплексной терапии, дополненной оперативным лечением, отмечалось статистически значимое повышение индекса эффективности микроциркуляции, повышение уровня среднего потока крови, усиление нейрогенного тонуса, снижение показателя шунтирования и миогенного тонуса. Данные показатели имели положительную динамику, но не достигли уровня значений здоровых людей. Несмотря на проведенное оперативное и антибактериальное лечение воспалительный процесс в почках сохранялся. 2-я группа. Анализ данных во второй группе до назначения медикаментозной терапии выявлял выраженные изменения концентрации иммуноглобулинов в сыворотке крови. IgG и IgM в сыворотке крови повышались в сравнении с контрольной группой, а уровень IgA снижался, что указывало на повреждение гуморального звена иммунитета. При анализе концентрации иммуноглобулинов после проведенной терапии отмечалась нормализация их уровня, что указывало на полное восстановление гуморального звена иммунитета. У пациентов 2-й группы проводился анализ цитокинового профиля до назначения медикаментозной терапии, дополненной криопреципитатом, и на 9-е сутки лечения. Таким образом, до начала комплексной терапии обнаруживалось повышенное содержание провоспалительных цитокинов в сыворотке крови и моче больных более чем в 2 раза в сравнении с контрольными значениями, что являлось следствием развивающегося воспалительного процесса, и повышение ИЛ-8 в моче в 2 раза выше контрольных значений. Вследствие проведенной медикаментозной терапии с применением криопреципитата восстановился уровень ИЛ-1β, ФНО-α, ИЛ-6 и ИЛ-8 до показателей физиологической нормы, полученных при обследовании группы здоровых людей, это указывает на полное купирование воспалительного процесса в мочевыделительной системе при использованных подходах к лечению. Анализ общего уровня микроциркуляции в точках проекции почек на коже ЛДФ-методом выявил изменение базального кровотока схожее с данными в 1-й группе больных. Существенно снизился уровень среднего потока крови, показатель шунтирования, нейрогенного тонуса, эффективности микроциркуляции, а миогенный тонус напротив усилился. На 9-е сутки терапии отмечалось статистически достоверное повышение уровня среднего потока крови, индекса эффективности микроциркуляции, нейрогенного тонуса и показателя шунтирования. Миогенный тонус понизился до значений физиологической нормы. На основании этих изменений можно говорить об улучшении кровообращения в зоне ишемии и уменьшении гипоксии в пораженной области почек.
Ключевые слова: гнойный пиелонефрит, ишемия, иммунитет.
Для цитирования: Чернова Ю.Г., Неймарк А.И., Тарасова И.Н., Нитиевская Г.А. Изменения иммунитета и микроциркуляции в почках на фоне лечения гнойного пиелонефрита. Клинический разбор в общей медицине. 2021; 1: 36–43. DOI: 10.47407/kr2021.2.1.00030
Kidney immune status and blood microcirculation alterations under treatment of purulent pyelonephritis
Yuliia G. Chernova, Aleksandr I. Neimark, Irina N. Tarasova, Galina A. Nitievskaia1City Clinical Hospital №11, Barnaul, Russia;
2Altai State Medical University, Barnaul, Russia
yulya.samchuk14@mail.ru
Abstract
Aim. To assess alterations of immune status and blood microcirculation in patients with purulent pyelonephritis during treatment.
Methods. The prospective cohort multiple randomized controlled trial was carried out at the Department of Urology and Andrology at the Municipal Hospital No. 11 (Barnaul) in 2016-2019. A total of 94 patients aged 20–60 diagnosed with purulent pyelonephritis were treated during this period. The study was approved by the Ethics Committee of the Altai State Medical University (protocol No. 14 dated November 18, 2016). The informed consent was submitted by all participants. During the study, two groups were formed, which included patients already diagnosed with purulent pyelonephritis and patients with a suspicion on purulent process based on clinical, laboratory and functional tests data. The patients were randomized and divided into two groups in accordance with the methods used. The first group, showing no clinical and laboratory response to therapy, underwent surgery (n=47), the second group received cryoprcipitate together with standard conservative treatment for purulent pyelonephritis (n=47). All the cohorts were similar in age, gender and ethnicity. The patients’ immune status was estimated: IgM, IgG and IgA-based enzyme immunoassay tests were performed using the Immunoscreen-G, M, A-EIA-BEST kit by Vector-Best (Novosibirsk); serum interleukin-1β, interleukin-6, TNF-α and urine interleukin-8 levels were assayed using the Interleukin-8-EIA-BEST, Interleukin-1β-EIA-BEST, Alpha-TNF-EIA-BEST and Interleukin-6-EIA-BEST kits (Vector-Best, Russia, 2011). In addition to a number of instrumental tests, blood microcirculation in the zone of inflammation was assessed using the LAKK-2 analyzer in the projections of kidneys. The immune status markers were assessed upon admission and on day 6–7 of hospital stay. Each and every patient received complex conservative treatment. The patients received antibacterial therapy during an average of 3–4 days after their body temperature was back to normal.
Results. Immune status assessment in group 1 patients revealed multidirectional alterations in immunoglobulin levels: significantly increased level serum Ig G and Ig M and decreased level of Ig A indicated the impaired humoral immunity. On day 9 of treatment the patients of group 1 still showed decreased level of Ig A. Their Ig G became even higher, and the level Ig M showed a decreasing trend. Upon admission, the serum levels of proinflammatory cytokines in patients of group 1 were more than twice as high as the control level, which could be considered the natural consequence of the observed infectious process in the urinary tract. On day 9 of treatment serum levels of proinflammatory cytokines became significantly lower: urine IL-8 level declined to 10.01±0.86 pg/mL, blood IL-6 level declined to 12.04±0.81 pg/mL, IL-1 level declined to 10.67±1.07 pg/mL, and TNF-α level declined to 4.75±0.40 pg/mL. However, the latter failed to reach the physiologically normal level, which indicated the incomplete reversal of inflammation in the urinary tract against the background of using the selected treatment approach. Blood microcirculation assessment using Laser Doppler flowmetry (LDF) prior to prescribing therapy to patients of group 1 revealed the following basal blood flow indicators: decreased shunt blood flow, reduced average blood flow, index of microcirculation efficiency, myogenic tone and fluctuations in erythrocyte flow, as well as elevated coefficient of variation and neurogenic tone compared to control and comparison groups. After surgery used as an adjunct to the complex treatment the significantly increased index of microcirculation efficiency, elevated average blood flow, increased neurogenic tone, reduced shunt blood flow and myogenic tone were observed. The listed indicators showed a positive trend, but failed to reach the physiologically normal level. Kidney inflammation persisted despite surgical and antibacterial treatment. Group 2. Assessment of group 2 patients prior to prescribing drug therapy revealed the pronounced serum immunoglobulin level alterations. Serum Ig G and Ig M levels were increased compared to control group, and the Ig A level was decreased, which indicated the humoral immunity impairment. Assessment of immunoglobulin levels after treatment showed they were back to normal, which indicated complete restoration of humoral immune response.
In patients of group 2, cytokine profile analysis was performed prior to prescribing drug therapy supplemented by cryoprcipitate, and on day 9 of treatment. Thus, prior to complex treatment, the patients’ serum and urine levels of proinflammatory cytokines were more than twice as high as the control level, which was due to ongoing inflammatory process, and the urine IL-8 level was twice as high as the control level. Drug therapy with the use of cryoprcipitate resulted in recovery of IL-1β, TNF-α, IL-6 and IL-8 levels to physiologically normal levels obtained by examination of healthy individuals. This indicates complete reversal of inflammation in the urinary tract against the background of using the selected treatment approach. Assessment of microcirculation in the surface projections of kidneys by LDF revealed alterations in basal blood flow similar to those observed in patients of group 1. The average blood flow, shunt blood flow, neurogenic tone and index of microcirculation efficiency decreased significantly, and the myogenic tone increased. On day 9 of treatment the significantly increased average blood flow, index of microcirculation efficiency, neurogenic tone and shunt blood flow were observed. Myogenic tone dropped to physiologically normal level. Based on the alterations observed, the improved blood circulation in the ischemic zone and reduced hypoxia in the affected area of the kidneys can be reported.
Key words: purulent pyelonephritis, ischemia, immunity.
For citation: Chernova Yu.G., Neimark A.I., Tarasova I.N., Nitievskaia G.A. Kidney immune status and blood microcirculation alterations under treatment of purulent pyelonephritis. Clinical review for general practice. 2021; 1: 36–43. DOI: 10.47407/kr2021.2.1.00030
Введение
В течение последних лет неуклонно продолжает увеличиваться число больных гнойными формами острого пиелонефрита, преимущественно за счет карбункулов почки. Наиболее значимыми факторами, провоцирующими рост заболеваемости, являются: увеличение числа резистентных бактериальных штаммов бактерий к наиболее применяемым антибактериальным препаратам, биологическая трансформация микробов [1], анатомические и функциональные особенности почек, снижение активности гуморальных факторов иммунитета [2].При проникновении и распространении инфекционного агента, макроорганизм немедленно включает множество механизмов защиты, мобилизации органов и систем. Наиболее важными являются система мононуклеарных фагоцитов, иммунная система и система гемостаза. J. Fine (1964 г.) выдвинул гипотезу о влиянии септицемии – если она длится достаточно долго, то наряду с другими функциями организма нарушает дезинтоксикационную функцию ретикулоэндотелиальной системы (систему мононуклеарных фагоцитов) [3].
Иммуноглобулины имеют множество функций, основными из которых являются:
1. Нейтрализация токсинов вырабатываемых бактериями (IgG).
2. Активация комплемента (терминальные компоненты комплемента пробивают дыры на поверхности клеточной стенки и приводят к «осмотической» смерти, IgM и IgG), защита слизистых оболочек (подавление адгезии патогенов к поверхности слизистой оболочки, IgA).
3. Изменение формы бактерий и другого поглощаемого материала (IgM).
4. Иммобилизация бактерий (нарушение подвижности).
5. Опсонизация бактерий (напрямую или опосредованно путем активации комплемента, IgG).
6. Антителозависимая клеточная опосредованная цитотоксичность, вызванная разрушением микроорганизмов за счет высвобождения токсических субстанций – порферинов [4].
Дефицит иммуноглобулинов может быть связан с гипоглобулинемией и подавлением выработки В-клеток в костном мозге [5].
Исследование уровня и баланса цитокинов является важным моментом для раскрытия механизмов активации иммунного реагирования в патогенезе инфекционно-воспалительных заболеваний.
Увеличение продукции таких провоспалительных цитокинов, как интерлейкин (ИЛ)-1, ИЛ-6 и фактор некроза опухоли (ФНО)-α, у больных пиелонефритом выступает критерием активности воспалительного процесса [6].
J.F. Bermejo-Martin, М.С. Garcia-Arevalo, R.O. deLejarazu (2007 г.) [7] выразили свое мнение о необходимости оценки уровня цитокинов в крови у больных с воспалительными заболеваниями, тем более что продукция некоторых, к примеру ФНО-α, возрастает лишь при остром воспалительном процессе. Показано, что уровень ИЛ-8 в моче прямо пропорционально зависит от активности воспалительного процесса в мочевыделительной системе [8].
Достаточно большую роль в развитии и поддержании воспаления в почках играет расстройство кровообращения. При уменьшении скорости кровотока происходит задержка и внедрение бактерий в ткань почки, поражая, в первую очередь, интерстиций мозгового вещества почек, формируя благоприятный фон (высокая концентрация аммония и осмолярность) для инвазии бактериальной флоры [9]. При гистологическом анализе тканей с нарушенной микроциркуляцией определяются тромбы в венозных сосудах, стаз в капиллярах, нарушение проницаемости стенок сосудов, что приводит к усиленному проникновению и размножению бактерий в интерстициальной ткани почек [10].
Нарушение микроциркуляции приводит также к формированию гипоксии и метаболическому ацидозу в тканях почки с последующим угнетением обменных процессов, накоплением и циркуляции в крови протеолитических ферментов и биологически активных веществ, образованных при гибели бактерий, разрушении лейкоцитов и тучных клеток [11].
Цель исследования: изучить изменения иммунного статуса и микроциркуляции на фоне развития гнойного пиелонефрита и его лечения.
Материалы и методы
За этот период были обследованы и пролечены 94 пациента в возрасте от 20 до 60 лет (13 мужчин, 81 женщина) с диагнозом «Острый гнойный пиелонефрит». Работа одобрена локальным этическим комитетом ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России (протокол №14 от 18.11.2016), все участники подписали информированное согласие.Все исследуемые пациенты поступали в приемный покой дежурного урологического стационара по службе скорой медицинской помощи или в экстренном порядке при направлении из поликлиники по месту жительства.
После обследования пациенты рандомно были разделены на группы в соответствии с тактикой терапии.
В 1-ю группу вошли 47 пациентов (7 мужчин, 40 женщин) с тяжелым течением пиелонефрита. Пациенты этой группы получали традиционную консервативную терапию, но на фоне ее неэффективности были прооперированы. Во 2-ю группу вошли 47 больных (6 мужчин, 41 женщина) с тяжелым течением пиелонефрита, в комплекс терапии которых был добавлен криопреципитат. Пациенты 1 и 2-й групп не отличались друг от друга по тяжести течения заболевания, проведенной антибактериальной и дезинтоксикационной терапии.
Помимо стандартного комплекса лабораторного обследования, пациентам проводилось исследование системы иммунитета.
Анализ показателей иммунного статуса проводился в лаборатории КГБУЗ «Городская больница №11»,
г. Барнаула. Определялось содержание основных иммуноглобулинов, таких как IgM, IgG и IgA, ИФА-методом с помощью набора реактивов «Иммуноскрин-M, A, G – ИФА-Бест» ЗАО «Вектор-Бест» (г. Новосибирск).
Анализ содержания ИЛ-1β, ИЛ-6, ФНО-α в сыворотке крови и ИЛ-8 в моче происходил при помощи тест-системы иммуноферментного анализа «Интерлейкин-8-ИФА»; «Интерлейкин-1β-ИФА»; «Альфа-ФНО-ИФА»; «Интерлейкин-6-ИФА» (ЗАО «Вектор-Бест», Россия, 2011). Основой метода анализа является твердофазная иммуноферментная реакция в «сэндвич»-варианте с использованием моно- и поликлональных антител к ИЛ-1β, ИЛ-6, ИЛ-8, ФНО-α.
В дополнение к инструментальным методам диагностики выполнялась лазерная допплеровская флоуметрия (ЛДФ), которая является непрямым (косвенным) методом определения уровня микроциркуляции крови в органах. Она неинвазивна и абсолютно безопасна, но при этом обладает высокой чувствительностью к гемодинамическим отклонениям в сосудистом русле [12].
Для оценки уровня микроциркуляции в тканях почек применялся аппарат ЛАКК-02 (НПП «ЛАЗМА», Россия) с программным обеспечением ЛДФ. Анализ производился с биологически активных точек проекции почек на коже в поясничной области, имеющих точную локализацию и интенсивное кровоснабжение [13].
Результаты
 1-я группа. При анализе состояния иммунной системы больных 1-й группы определено разнонаправленное нарушение уровня иммуноглобулинов (рис. 1): статистически достоверное повышение IgG, IgM и снижение концентрации IgA в сыворотке крови говорит о нарушении гуморального звена иммунного ответа.
1-я группа. При анализе состояния иммунной системы больных 1-й группы определено разнонаправленное нарушение уровня иммуноглобулинов (рис. 1): статистически достоверное повышение IgG, IgM и снижение концентрации IgA в сыворотке крови говорит о нарушении гуморального звена иммунного ответа. На 9-е сутки проводимого лечения у больных 1-й группы сохранялся сниженный уровень IgA, еще более повышался IgG, в то же время IgM имел тенденцию к снижению.
При поступлении содержание провоспалительных цитокинов у пациентов 1-й группы в сыворотке крови более чем в 2 раза превышало уровень контрольных значений, что являлось естественным следствием наблюдаемого инфекционного процесса в мочевыделительной системе (рис. 2).
На 9-е сутки проводимого лечения уровень провоспалительных цитокинов в сыворотке крови и моче достоверно уменьшился: содержание ИЛ-8 в моче понизилось до 10,01±0,86 пг/мл, в крови ИЛ-6 снизился до 12,04±0,81 пг/мл, ИЛ-1 – до 10,67±1,07 пг/мл, ФНО-α – до 4,75±0,40 пг/мл, но так и не достиг показателей физиологической нормы, что указывает на неполное купирование воспалительного процесса в мочевыделительной системе при использованных подходах к лечению.
Во время проведения исследования показателей микроциркуляции методом ЛДФ до назначения терапии в 1-й группе больных по точкам проекции почек на коже (табл. 1) выявлялись уровни базального кровотока в понижении показателя шунтирования, снижении среднего потока крови, индекса эффективности микроциркуляции, миогенного тонуса и колебания скорости эритроцитов, повышении коэффициента вариации и нейрогенного тонуса в отличие от групп контроля и сравнения.
Вследствие проведенной комплексной терапии, дополненной оперативным лечением, отмечалось статистически значимое повышение индекса эффективности микроциркуляции, повышение уровня среднего потока крови, усиление нейрогенного тонуса, снижение показателя шунтирования и миогенного тонуса. Данные показатели имели положительную динамику, но не достигли уровня значений здоровых людей. Несмотря на проведенное оперативное и антибактериальное лечение, воспалительный процесс в почках сохранялся.
2-я группа. Анализ данных во 2-й группе до назначения медикаментозной терапии выявлял выраженные изменения концентрации иммуноглобулинов в сыворотке крови. IgG и IgM в сыворотке крови повышались в сравнении с контрольной группой, а уровень IgA снижался (рис. 3), что указывало по повреждение гуморального звена иммунитета.
При анализе концентрации иммуноглобулинов после проведенной терапии отмечалась нормализация их уровня, что указывало на полное восстановление гуморального звена иммунитета.
У пациентов 2-й группы проводился анализ цитокинового профиля до назначения медикаментозной терапии, дополненной криопреципитатом, и на 9-е сутки лечения. Таким образом, до начала комплексной терапии обнаруживалось повышенное содержание провоспалительных цитокинов в сыворотке крови и моче больных более чем в 2 раза в сравнении с контрольными значениями, что являлось следствием развивающегося воспалительного процесса, и повышение ИЛ-8 в моче в 2 раза выше контрольных значений (рис. 4).
Вследствие проведенной медикаментозной терапии с применением криопреципитата восстановился уровень ИЛ-1β, ФНО-α, ИЛ-6 и ИЛ-8 до показателей физиологической нормы, полученных при обследовании группы здоровых людей, это указывает на полное купирование воспалительного процесса в мочевыделительной системе при использованных подходах к лечению.
Анализ общего уровня микроциркуляции в точках проекции почек на коже методом ЛДФ выявил изменение базального кровотока схожее с данными в 1-й группе больных. Существенно снизился уровень среднего потока крови, показатель шунтирования, нейрогенного тонуса, эффективности микроциркуляции (табл. 2), а миогенный тонус напротив усилился.
 На 9-е сутки терапии отмечалось статистически достоверное повышение уровня среднего потока крови, индекса эффективности микроциркуляции, нейрогенного тонуса и показателя шунтирования. Миогенный тонус понизился до значений физиологической нормы. На основании этих изменений можно говорить об улучшении кровообращения в зоне ишемии и уменьшении гипоксии в пораженной области почек.
На 9-е сутки терапии отмечалось статистически достоверное повышение уровня среднего потока крови, индекса эффективности микроциркуляции, нейрогенного тонуса и показателя шунтирования. Миогенный тонус понизился до значений физиологической нормы. На основании этих изменений можно говорить об улучшении кровообращения в зоне ишемии и уменьшении гипоксии в пораженной области почек.Обсуждение
Пациентка К., 37 лет, поступила в урологическое отделение КГБУЗ «Городская больница №11» 18.10.2019 по скорой помощи с жалобами на интенсивные боли в поясничной области справа, повышение температуры тела до 40,4 °С, учащенное мочеиспускание с резью. Из анамнеза: больна в течение 4 сут, когда появилась болезненность в поясничной области справа, частое мочеиспускание с резью, повышение температуры тела до 39,8 °С. Обратилась в поликлинику, направлена в дежурный урологический стационар. Хронические заболевания: отрицает. При поступлении состояние тяжелое. Сознание ясное. Поведение адекватное. Питание нормальное. Кожные покровы чистые, обычной окраски. Периферические лимфоузлы не увеличены. Живот не вздут, мягкий, участвует в акте дыхания, отмечается резкая болезненность в проекции правой почки. Симптомы раздражения брюшины отрицательные. Селезенка, печень не увеличены. Пальпация правой почки болезненна. Симптом поколачивания положительный справа. Общий анализ крови: эритроциты – 4,5×1012/л, Hb – 116 г/л, лейкоциты – 23,2 г/л, эозинофилы – 1%, палочкоядерные – 18%, сегментоядерные – 87%, лимфоциты – 7%, моноциты – 4%, СОЭ – 54 мм/ч. Биохимический анализ крови без отклонений. Общий анализ мочи: белок – 0,220, лейкоциты сплошь покрывают все поля зрения. Бактериальный посев мочи от 18.10.2019: Escherichia coli – 10×7, Enterococcus faecalis – 10×6. Ультразвуковое исследование (УЗИ) почек от 18.10.2019: увеличение размеров правой почки с отеком паранефральной клетчатки. Нарушение кортико-медуллярной дифференцировки с неоднородным снижением эхогенности. В проекции нижнего полюса правой почки лоцируется гипоэхогенный участок с неровными, размытыми контурами диаметром 36 мм (септический очаг?). При допплерографии отмечается резкое снижение кровотока в области очага. Данные мультиспиральной компьютерной томографии от 19.10.2019: формирующийся карбункул правой почки. При поступлении назначено лечение: ципрофлоксацин (500 мг) 2 раза в день внутривенно капельно, цефотаксим (2 г) 2 раза в день внутривенно, эуфиллин (24 мг/мл) 10 мл на 100 мл 0,9% раствора натрия хлорида, ревалгин 5 мл внутривенно при болях, анальгин 50% 2 мл + димедрол 1% 1 мл внутримышечно при повышении температуры тела более 38 °С. При повторном повышении температуры до 39,5 °С вечером того же дня в состав терапии был добавлен криопреципитат 5 доз внутривенно капельно. На следующий день температура тела снизилась и не превышала 38 °С. Было назначено еще 4 дозы криопреципитата. Вечером 20.10.2019 температура тела нормализовалась. В данном случае инфузия криопреципитата проводилась 4 дня. Контроль УЗИ от 22.10.2019: размер почки в норме, отек паранефральной клетчатки не определяется, очаговое изменение не визуализируется. Кортико-медуллярная дифференцировка не изменена.В области ранее лоцируемого гипоэхогенного участка определяется умеренное утолщение коркового слоя до 15 мм, скорость кровотока практически не отличается от нормы. Из этого следует, что добавление криопреципитата к комплексу терапии способствовало улучшению общего состояния, нормализации кровотока и толщины коркового слоя почки. Следовательно, по данным клинико-лабораторного обследования, у больных острым гнойным пиелонефритом, получавших комплексную терапию с применением криопреципитата, удалось ликвидировать признаки гнойного воспаления в почках, что подтверждалось положительной динамикой снижения температуры тела, уменьшением болевых ощущений, нормализацией показателей крови, а именно уровня иммуноглобулинов и цитокинов. Также стоит отметить, что на фоне терапии полностью восстановился сниженный до начала терапии уровень базального кровотока.
Анализ данных, полученных при изучении иммунного статуса с острым пиелонефритом, путем оценки уровня иммуноглобулинов сыворотки крови свидетельствовал о дисбалансе гуморального звена иммунной системы и, как следствие, об ухудшении противоинфекционной резистентности и повышении степени воспаления в мочевыделительной системе.
На фоне проводимой терапии наилучшие результаты проведенного исследования показали, что терапия, дополненная оперативным лечением, не способствует значительным изменениям в иммунной системе. В то время как терапия, дополненная использованием криопреципитата, способна стимулировать иммунную систему и способствовать быстрому выздоровлению больных.


При оценке цитокинового профиля больных с острым гнойным пиелонефритом эти показатели повышались значительно. Вследствие проведенной терапии в 1-й группе отмечалась тенденция к нормализации измененных показателей, но не до контрольных значений, что указывало на сохраняющийся воспалительный процесс в мочевыводящей системе. Полная нормализация показателей цитокинов происходила только в группе с использованием криопреципитата, что свидетельствовало о купировании воспалительного процесса.
В 1 и 2-й группах пациентов при поступлении изменения базального кровотока были более значительными. На фоне терапии эти показатели улучшились, но в 1-й группе они были далеки от контрольных значений, а во 2-й группе происходила их нормализация.
Таким образом, применение криопреципитата в комплексном лечении острого пиелонефрита более эффективно, на фоне его применения купировались ишемия, гипоксия, улучшилась микроциркуляции в области почек. Методика лечения с применением криопреципитата восстанавливала кровоток в системе микроциркуляции, устраняла ишемизацию почечной паренхимы, что значительно улучшало результаты терапии острого гнойного пиелонефрита.
Выводы
У пациентов с острым гнойным пиелонефритом наблюдались выраженные нарушения иммунитета, по данным уровня иммуноглобулинов и цитокинов. Вследствие проводимой терапии у больных 1-й группы происходила частичная нормализация данных показателей, в то время как во 2-й группе на фоне применения криопреципитата происходило полное восстановление уровня иммуноглобулинов и цитокинов, что указывало на купирование воспалительного процесса. При оценке микроциркуляции до начала терапии определялось снижение уровня базального кровотока, ишемизация пораженной области. После проводимой терапии в 1-й группе микроциркуляция частично восстанавливалась, а во 2-й группе происходило полное восстановление микроциркуляции, что также подтверждало купирование воспалительного процесса и ишемии в пораженной области. Применение криопреципитата в составе консервативной терапии гнойного пиелонефрита оказывает иммунопротективное действие и улучшает микроциркуляцию в зоне ишемии, вызванной воспалительным процессом.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Чернова Юлия Геннадьевна – врач-уролог, КГБУЗ «Городская больница №11», ООО «ПКДЦ Здоровье». E-mail: yulya.samchuk14@mail.ru, SPIN-код: 9335-5220, Author ID: 1074897
Yuliia G. Chernova – Urologist, City Clinical Hospital №11. E-mail: yulya.samchuk14@mail.ru, SPIN-код: 9335-5220, Author ID: 1074897
Неймарк Александр Израилевич – д-р мед. наук, проф., зав. каф. урологии и андрологии с курсом ДПО, ФГБОУ ВО АГМУ. ORCID: 0000-0002-5741-6408, Scopus Author ID: 7102411541
Aleksandr I. Neimark – D. Sci. (Med.), Prof., Altai State Medical University. ORCID: 0000-0002-5741-6408, Scopus Author ID: 7102411541
Тарасова Ирина Николаевна – зав. иммунологической лабораторией, КГБУЗ «Городская больница №11»
Irina N. Tarasova – Head of the Immunological Laboratory, City Clinical Hospital №11
Нитиевская Галина Александровна – врач-лаборант иммунологической лаборатории, КГБУЗ «Городская больница №11»
Galina A. Nitievskaia – doctor-laboratory assistant of the immunological laboratory, City Clinical Hospital №11
Статья поступила в редакцию / The article received: 25.01.2021
Статья принята к печати / The article approved for publication: 29.01.2021
Список исп. литературыСкрыть список1. Неймарк А.И., Гаткин М.Я., Самчук Ю.Г. Комплексная консервативная терапия больных с использованием криопреципитата у больных острым гнойным пиелонефритом. Урология. 2017; 2: 42–8.
[Neimark A.I., Gatkin M.Ia., Samchuk Iu.G. Kompleksnaia konservativnaia terapiia bol'nykh s ispol'zovaniem kriopretsipitata u bol'nykh ostrym gnoinym pielonefritom. Urologiia. 2017; 2: 42–8 (in Russian).]
2. Лоран О.Б., Синякова Л.А. Воспалительные заболевания органов мочевой системы. Актуальные вопросы. Пособие для врачей. М.: МИА, 2015. С. 67–74.
[Loran O.B., Siniakova L.A. Vospalitel'nye zabolevaniia organov mochevoi sistemy. Aktual'nye voprosy. Posobie dlia vrachei. Moscow: MIA, 2015. S. 67–74 (in Russian).]
3. Zetterstrom BE, Palmerio C, Fine J. Protection of Functional and Vascular Integrity of the Spleen in Traumatic Shock by Denervation. Proc Soc Exp Biol Med 1964; 117: 373–6.
4. Raúl V, Romána G, Murrayb JC et al. Antibody-Dependent Cellular Cytotoxicity (ADCC). Chapter 1. Linking Adaptive and Innate Immunity 2014; p. 1–27.
5. Hunter ZR, Manning RJ, Hanzis C et al. IgA And Ig GHypogammaglobulinemia In Waldenström’s Macro globulinemia. Haematologica 2010; 95: 470–5.
6. Sinjuhin VN, Kovalchuk LV, Chirun NV. Immunologicheskie aspekty ostrogo pielonefrita. Urologija 2002; 1.
7. Bermejo-Martin JF, Garcia-Arevalo МС, de Lejarazu RO et al. Predominance of Th2cytokines, CXC chemokinesandinnate immunity mediators at the mucosal level during severe respiratory syncytialvirus infection in children. Eur Cytokine Netw 2007; 18 (3): 162–7.
8. Попков В.М., Долгов А.Б., Захарова Н.Б. и др. Мочевые биомаркеры при остром пиелонефрите. Саратовский научно-медицинский журнал. 2013; 9 (1): 110–15.
[Popkov V.M., Dolgov A.B., Zakharova N.B. et al. Mochevye biomarkery pri ostrom pielonefrite. Saratovskii nauchno-meditsinskii zhurnal. 2013; 9 (1): 110–15 (in Russian).]
9. Сульдина А.П. Комплексное лечение больных хроническим пиелонефритом с использованием пелоидотерапии: автореф. дис. … канд. мед. наук. Саратов, 2016.
[Sul'dina A.P. Kompleksnoe lechenie bol'nykh khronicheskim pielonefritom s ispol'zovaniem peloidoterapii: avtoref. dis. … kand. med. nauk. Saratov, 2016 (in Russian).]
10. Лопаткин Н.А., Даренков А.Ф., Горюнов В.Г. и др. Урология. Под ред. Н.А. Лопаткина. 4-е изд., стереотипное. М.: Медицина, 1995.
[Lopatkin N.A., Darenkov A.F., Goriunov V.G. et al. Urologiia. Pod red. N.A. Lopatkina. 4-e izd., stereotipnoe. Moscow: Meditsina, 1995 (in Russian).]
11. Полунин А.А., Воронина Л.П., Полунин А.И., Мирошников В.М. Дыхательная проба в оценке реакции микрососудов у больных хроническим простатитом на фоне ишемической болезни сердца. Международный журнал прикладных и фундаментальных исследований. 2012; 12: 101–2.
[Polunin A.A., Voronina L.P., Polunin A.I., Miroshnikov V.M. Dykhatel'naia proba v otsenke reaktsii mikrososudov u bol'nykh khronicheskim prostatitom na fone ishemicheskoi bolezni serdtsa. Mezhdunarodnyi zhurnal prikladnykh i fundamental'nykh issledovanii. 2012; 12: 101–2 (in Russian).]
12. Minkley N, Schröder TP, Wolf OT, Kirchner WH. The socially evaluated cold-pressor test (SECPT) for groups: Effects of repeated administration of a combined physiological and psychological stressor. Psychoneuroendocrinology 2014; 45: 119–27.
13. Пишель Я.В. Анатомо-клинический атлас рефлексотерапии. М.: Медицина, 1991.
[Pishel' Ia.V. Anatomo-klinicheskii atlas refleksoterapii. Moscow: Meditsina, 1991 (in Russian).]