Клинический разбор в общей медицине №02 2021
National Medical Research Center of Cardiology of the Ministry of Healthcare of the Russian Federation, Moscow, Russia
e.a.butorova@mail.ru
Abstract
Purpose. The aim of this work is to show the capabilities of late gadolinium enhancement cardiac magnetic resonance imaging (MRI) in the diagnosis of a rare disease such as cardiac amyloidosis.
Materials and methods. Demonstration of clinical cases detecting cardiac amyloidosis using MRI.
Results. Contrast-enhanced cardiac MRI revealed patterns characteristic of cardiac amyloidosis.
Conclusion. Cardiac MRI with late gadloinium enhancement is the method of choice in the diagnosis of cardiac amyloidosis.
Key words: amyloidosis, heart, MRI, late gadloinium enhancement.
For citation: Butorova E.A., Stukalova O.V. Role of cardiac MRI in the diagnosis of cardiac amyloidosis. Clinical cases. Clinical review for general practice. 2021; 2: 16–20. DOI: 10.47407/kr2021.2.2.00037
Диагностика сердечного амилоидоза является сложной задачей. «Золотым стандартом» для диагностики амилоидоза сердца является биопсия миокарда, однако данная процедура инвазивна и сопряжена с рисками осложнений, доступна малому количеству клиник [6]. Комбинация таких методов, как электрокардиография (ЭКГ), эхокардиография (ЭхоКГ) и диагностическая биопсия из периферических тканей (слизистые, подкожный жир и др.) имеют свои ограничения. На ЭКГ нет надежных признаков для дифференциального диагноза с другими поражениями сердца, считают, что низковольтажная ЭКГ является характерным проявлением амилоидоза сердца, однако она наблюдается не у всех пациентов [7]. С помощью ЭхоКГ нельзя выявить признаки амилоидоза на ранних стадиях заболевания и дифференцировать с другими формами гипертрофии миокарда [8]. Сцинтиграфия миокарда с 99mТс-пирофосфатом и 99mТс-дифосфатом имеет высокую чувствительность в обнаружении ATTR-типа амилоидоза, однако менее чувствительна к другим типам заболевания [9]. Кроме того, данный метод не дает никакой информации о функции и морфологии поражения сердца, что является ограничением для определения тактики лечения [10].
За последнее десятилетие магнитно-резонансная томография (МРТ) стала надежным методом визуализации сердца, предоставляя подробную информацию о морфологии, тканевых характеристиках и функциональных показателей работы сердца. С помощью МРТ можно точно определить наличие, локализацию и распространенность гипертрофии миокарда желудочков. Использование МРТ с отсроченным контрастированием позволяет обнаружить амилоидную инфильтрацию. Отложение амилоида в сердце увеличивает объем внеклеточной жидкости в миокарде и приводит к накоплению контрастного препарата (гадолиния), применяемого в МРТ [11, 12]. В позднюю фазу контрастного усиления на МР-изображениях определяется негомогенное диффузное трансмуральное или субэндокардиальное накопление контрастного препарата в миокарде желудочков [13–15], отличающееся от контрастирования при других причинах поражения миокарда (ишемическое, воспалительное, другие болезни накопления).
Больной Д., 45 лет, поступил в клиническое отделение НМИЦ кардиологии с жалобами на отеки нижних конечностей, одышку при ходьбе, при разговоре во время ходьбы, которые купируются в покое, плохую переносимость физической нагрузки (головокружение при подъеме по лестнице выше 2-го этажа). Два года назад после острой вирусной инфекции впервые появилась одышка, а потом и отеки нижних конечностей до голеностопных суставов. При госпитализации по месту жительства был выставлен диагноз «острый миокардит». На рентгенограмме органов грудной клетки (ОГК) значимой патологии не выявлено. На ЭКГ – ритм синусовый, частота сердечных сокращений (ЧСС) 110 уд/мин, снижен вольтаж ЭКГ, отмечается замедление проведения по левой ножке пучка Гиса (ЛНПГ) и диффузные нарушения процессов реполяризации.
По данным ЭхоКГ полости сердца не увеличены (конечный диастолический размер левого желудочка – КДРЛЖ – 47 мм), сократимость не снижена (фракция выброса – ФВ –57%). Определялась легочная гипертензия (систолическое давление в легочной артерии – СДЛА – 51,7 мм рт. ст.), а также диастолическая дисфункция левого желудочка (ЛЖ) рестриктивного типа. В полости перикарда было небольшое количество жидкости, а также жидкость находилась в обеих плевральных полостях и брюшной полости. На фоне терапии сердечной недостаточности состояние пациента улучшилось, уменьшилась одышка, сохранялись отеки слабой степени.
После выписки из стационара проходил обследование у эндокринолога, ревматолога, онколога, проводилось исследование маркеров системных аутоиммунных заболеваний – патологии не выявлено.
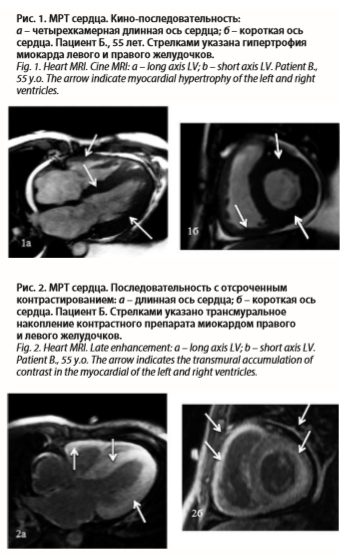
Для оценки структурных изменений миокарда желудочков была назначена МРТ с отсроченным контрастированием гадолинием. По данным МРТ выявлена концентрическая гипертрофия миокарда ЛЖ (толщина стенок – 14–18 мм) и правого желудочка (ПЖ; толщина стенок – 8 мм), расширение левого предсердия, гидроперикард и гидроторакс (рис. 1). При проведении кино-МРТ данных за нарушение локальной сократимости миокарда желудочков не получено, определялось снижение глобальной сократимости миокарда ЛЖ (ФВЛЖ – 33%) и ПЖ (ФВПЖ – 34%). После введения контрастного препарата отмечалось его диффузное, трансмуральное, распространенное (во всех сегментах) накопление миокардом ЛЖ и ПЖ (рис. 2). Характер накопления контрастного препарата соответствует амилоидозу сердца.
Для подтверждения диагноза амилоидоза проведена биопсия прямой кишки, выявлены отложения амилоида в сосудах всех отделов, в мышечном слое кишки, проведено типирование, поставлен диагноз AL-амилоидоза.
Таким образом, на основании комплексного обследования поставлен диагноз: рестриктивная кардиомиопатия, системный амилоидоз с преимущественным поражением сердца. Хроническая сердечная недостаточность IIБ, функциональный класс (ФК) III. Асцит. Гидроторакс. Трикуспидальная недостаточность IV степени. Митральная недостаточность II степени.
В НМИЦ кардиологии обследован амбулаторно: по данным сцинтиграфии – признаков очаговых перфузионных изменений легких не выявлено; на ЭхоКГ выявлена гипертрофия ЛЖ, расширение предсердий, сократимость миокарда удовлетворительная; по данным кардиореспираторного мониторирования – фибрилляция-трепетание предсердий, желудочковая экстрасистолия.
В ходе обследования в стационаре НМИЦ кардиологии на ЭКГ сохранялось трепетание предсердий; по данным ЭхоКГ – выраженная концентрическая гипертрофия миокарда ЛЖ, обращала на себя внимание гиперэхогенность миокарда ЛЖ (с яркими включениями), дилатация полостей предсердий и ПЖ, зон нарушения локальной сократимости не выявлено, глобальная сократимость ЛЖ удовлетворительная, выявлено нарушение диастолической функции миокарда ЛЖ.
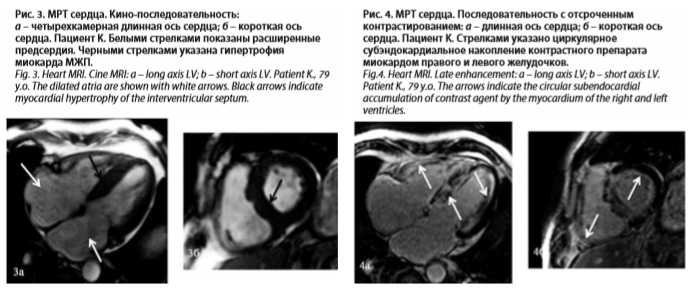
Данные анамнеза, ЭКГ и ЭхоКГ требовали в первую очередь исключения амилоидоза. Для этого была проведена МРТ с отсроченным контрастированием. На МРТ выявлена асимметричная гипертрофия миокарда ЛЖ: утолщение миокарда межжелудочковой перегородки (МЖП) до 18 мм, нижней стенки до 13 мм, толщина остальных стенок была в пределах 10–11 мм (рис. 3).
Данных за гипертрофию миокарда ПЖ не получено. Отмечалось расширение предсердий и ПЖ. При оценке кино-МРТ определялось умеренное снижение сократимости миокарда ЛЖ (ФВ – 48%), зон нарушений локальной сократимости не отмечалось. После введения контрастного препарата визуализировалось его циркулярное субэндокардиальное накопление всеми стенками миокарда ЛЖ и ПЖ (рис. 4). Характер накопления контрастного препарата в миокарде желудочков не типичен для ишемического или воспалительного поражения миокарда, также не типичен для накопления в очагах фиброза на фоне гипертрофии. В первую очередь следует думать об амилоидозе.
По данным однофотонной эмиссионной компьютерной томографии (КТ) с 99mTc-пирофосфатом сцинтиграфическая картина также соответствовала амилоидозу сердца. Учитывая высокое значение коэффициента дифференциального накопления сердце/коллатеральная область, поставлен диагноз транстиретинового амилоидоза.
Таким образом, на основании анамнеза и инструментального обследования (МРТ сердца с контрастированием и однофотонная эмиссионная КТ с 99mTc-пирофосфатом) больному был поставлен следующий диагноз: Транстиретиновый амилоидоз сердца (ATTR). Недостаточность трикуспидального клапана IV степени. Хроническая сердечная недостаточность IIБ стадии, III ФК.
В обоих случаях диагноз амилоидоза сердца был поставлен с помощью МРТ сердца и подтвержден без выполнения биопсии миокарда.
МРТ сердца помимо анатомической и функциональной оценки камер сердца может предоставить информацию о тканевой характеристике миокарда, используя отсроченное контрастирование и Т1-картирование миокарда. У ряда пациентов с почечной недостаточностью введение контрастного препарата противопоказано и бесконтрастная методика Т1-картирования может помочь в постановке диагноза амилоидоза сердца. Martinez-Naharro и соавт. использовали МРТ сердца с отсроченным контрастированием и Т1-картирование для оценки 263 пациентов с ATTR-амилоидозом и 50 пациентов с Al-амилоидозом. В группе больных с ATTR-амилоидозом сердца асимметричная гипертрофия миокарда ЛЖ встречалась в 79% случаев по сравнению с 14% при AL-амилоидозе сердца. У всех пациентов выявлено накопление контрастного препарата, причем чаще встречалось трансмуральное распределение контраста в миокарде ЛЖ (у 71%), чем субэдокардиальное (у 29%). Накопление контраста в миокарде ПЖ встречалось в 96% случаев. После анализа карт Т1 выявлено, что у группы пациентов с субэндокардиальным накоплением контраста в миокарде значения Т1 были пограничными (1021±62 мс, при норме <1010 мс) и высокие значения объема внеклеточной жидкости (ECV; >35%, при норме ECV 25–28%), а у группы с трансмуральным распределением контраста оба показателя были значительно превышены (1180±54 мс и ECV>50%). При сравнении показателя ECV между группой с ATTR-амилоидозом и Al-амилоидозом значимых различий не выявлено (59±13% против 53±8%). В каждой группе повышение значений Т1-картирования сопровождалось характерным паттерном контрастного усиления в миокарде желудочков. Между показателем объема внеклеточной жидкости и поглощением контраста 99mTc-DPD при сцинтиграфии выявили положительную корреляцию в группе с ATTR-амилоидозом (r=0,533; р<0,05) [19]. Определение ECV с помощью бесконтрастной МРТ сердца – это первый неинвазивный метод количественной оценки сердечного интерстиция, значения которого увеличиваются в зависимости от распространенности амилоидной инфильтрации. Определение ECV с помощью бесконтрастной МРТ помогает в оценке тяжести амилоидной инфильтрации миокарда и влияет на прогноз заболевания [20].
МРТ сердца обладает набором интрументов (кино-последовательность, отсроченное контрастирование, нативное и постконтрастное Т1-картирование с оценкой ECV миокарда), которые показывают высокую диагностическую точность в выявлении амилоидоза сердца.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Буторова Екатерина Александровна – канд. мед. наук, врач-рентгенолог отдела томографии, ФГБУ «НМИЦ кардиологии».
E-mail: e.a.butorova@mail.ru; ORCID: 0000-0001-9706-7049
Ekaterina A. Butorova – Cand. Sci. (Med.), Radiologist of the department tomography, National Medical Research Center of Cardiology.
E-mail: e.a.butorova@mail.ru; ORCID: 0000-0001-9706-7049
Стукалова Ольга Владимировна – канд. мед. наук, ст. науч. сотр. отдела томографии, ФГБУ «НМИЦ кардиологии». E-mail: olgastukalova@mail.ru; ORCID: 0000-0001-8377-2388
Olga V. Stukalova – Cand. Sci. (Med.), Scientific researtcher department of tomography, National Medical Research Center of Cardiology.
E-mail: olgastukalova@mail.ru; ORCID: 0000-0001-8377-2388
Статья поступила в редакцию / The article received: 04.03.2021
Статья принята к печати / The article approved for publication: 17.03.2021
Клинический разбор в общей медицине №02 2021
Возможности магнитно-резонансной томографии сердца в диагностике амилоидоза сердца. Клинические примеры
Номера страниц в выпуске:16-20
Аннотация
Цель исследования. Целью данной работы является демонстрация возможности магнитно-резонансной томографии (МРТ) сердца с контрастированием в диагностике редко встречающейся патологии – амилоидоза сердца.
Материалы и методы. Демонстрация клинических случаев диагностики амилоидоза сердца с помощью МРТ.
Результаты. С помощью МРТ сердца с контрастным усилением были выявлены изменения, указывающие на наличие амилоидоза сердца.
Заключение. МРТ сердца с внутривенным введением контрастного препарата является высокоинформативным методом неинвазивной диагностики амилоидоза сердца.
Ключевые слова: амилоидоз, сердце, магнитно-резонансная томография, отсроченное контрастирование.
Для цитирования: Буторова Е.А., Стукалова О.В. Возможности магнитно-резонансной томографии сердца в диагностике амилоидоза сердца. Клинические примеры. Клинический разбор в общей медицине. 2021; 2: 16–20. DOI: 10.47407/kr2021.2.2.00037
Цель исследования. Целью данной работы является демонстрация возможности магнитно-резонансной томографии (МРТ) сердца с контрастированием в диагностике редко встречающейся патологии – амилоидоза сердца.
Материалы и методы. Демонстрация клинических случаев диагностики амилоидоза сердца с помощью МРТ.
Результаты. С помощью МРТ сердца с контрастным усилением были выявлены изменения, указывающие на наличие амилоидоза сердца.
Заключение. МРТ сердца с внутривенным введением контрастного препарата является высокоинформативным методом неинвазивной диагностики амилоидоза сердца.
Ключевые слова: амилоидоз, сердце, магнитно-резонансная томография, отсроченное контрастирование.
Для цитирования: Буторова Е.А., Стукалова О.В. Возможности магнитно-резонансной томографии сердца в диагностике амилоидоза сердца. Клинические примеры. Клинический разбор в общей медицине. 2021; 2: 16–20. DOI: 10.47407/kr2021.2.2.00037
Role of cardiac MRI in the diagnosis of cardiac amyloidosis. Clinical cases
Ekaterina A. Butorova, Olga V. StukalovaNational Medical Research Center of Cardiology of the Ministry of Healthcare of the Russian Federation, Moscow, Russia
e.a.butorova@mail.ru
Abstract
Purpose. The aim of this work is to show the capabilities of late gadolinium enhancement cardiac magnetic resonance imaging (MRI) in the diagnosis of a rare disease such as cardiac amyloidosis.
Materials and methods. Demonstration of clinical cases detecting cardiac amyloidosis using MRI.
Results. Contrast-enhanced cardiac MRI revealed patterns characteristic of cardiac amyloidosis.
Conclusion. Cardiac MRI with late gadloinium enhancement is the method of choice in the diagnosis of cardiac amyloidosis.
Key words: amyloidosis, heart, MRI, late gadloinium enhancement.
For citation: Butorova E.A., Stukalova O.V. Role of cardiac MRI in the diagnosis of cardiac amyloidosis. Clinical cases. Clinical review for general practice. 2021; 2: 16–20. DOI: 10.47407/kr2021.2.2.00037
Введение
Амилоидоз – заболевание, при котором в межклеточном пространстве тканей происходит отложение нерастворимого белка-амилоида [1]. Известно более 30 амилоидогенных белков. Сердце чаще всего поражается при AL-амилоидозе (идиопатическая В-клеточная дискразия или миеломная болезнь, болезнь Вальденстрема), транстиретиновом (ATTR, мутантный и дикий типы) и изолированном амилоидозе предсердий (AANF), белком-предшественником при котором является предсердный натрийуретический фактор [2–4]. Причиной смерти у пациентов с AL- и ATTR-типами амилоидоза является поражение сердца [5]. Раннее обнаружение поражения сердца крайне важно для оценки прогноза и тактики лечения.Диагностика сердечного амилоидоза является сложной задачей. «Золотым стандартом» для диагностики амилоидоза сердца является биопсия миокарда, однако данная процедура инвазивна и сопряжена с рисками осложнений, доступна малому количеству клиник [6]. Комбинация таких методов, как электрокардиография (ЭКГ), эхокардиография (ЭхоКГ) и диагностическая биопсия из периферических тканей (слизистые, подкожный жир и др.) имеют свои ограничения. На ЭКГ нет надежных признаков для дифференциального диагноза с другими поражениями сердца, считают, что низковольтажная ЭКГ является характерным проявлением амилоидоза сердца, однако она наблюдается не у всех пациентов [7]. С помощью ЭхоКГ нельзя выявить признаки амилоидоза на ранних стадиях заболевания и дифференцировать с другими формами гипертрофии миокарда [8]. Сцинтиграфия миокарда с 99mТс-пирофосфатом и 99mТс-дифосфатом имеет высокую чувствительность в обнаружении ATTR-типа амилоидоза, однако менее чувствительна к другим типам заболевания [9]. Кроме того, данный метод не дает никакой информации о функции и морфологии поражения сердца, что является ограничением для определения тактики лечения [10].
За последнее десятилетие магнитно-резонансная томография (МРТ) стала надежным методом визуализации сердца, предоставляя подробную информацию о морфологии, тканевых характеристиках и функциональных показателей работы сердца. С помощью МРТ можно точно определить наличие, локализацию и распространенность гипертрофии миокарда желудочков. Использование МРТ с отсроченным контрастированием позволяет обнаружить амилоидную инфильтрацию. Отложение амилоида в сердце увеличивает объем внеклеточной жидкости в миокарде и приводит к накоплению контрастного препарата (гадолиния), применяемого в МРТ [11, 12]. В позднюю фазу контрастного усиления на МР-изображениях определяется негомогенное диффузное трансмуральное или субэндокардиальное накопление контрастного препарата в миокарде желудочков [13–15], отличающееся от контрастирования при других причинах поражения миокарда (ишемическое, воспалительное, другие болезни накопления).
 Клинический пример 1
Клинический пример 1
Больной Д., 45 лет, поступил в клиническое отделение НМИЦ кардиологии с жалобами на отеки нижних конечностей, одышку при ходьбе, при разговоре во время ходьбы, которые купируются в покое, плохую переносимость физической нагрузки (головокружение при подъеме по лестнице выше 2-го этажа). Два года назад после острой вирусной инфекции впервые появилась одышка, а потом и отеки нижних конечностей до голеностопных суставов. При госпитализации по месту жительства был выставлен диагноз «острый миокардит». На рентгенограмме органов грудной клетки (ОГК) значимой патологии не выявлено. На ЭКГ – ритм синусовый, частота сердечных сокращений (ЧСС) 110 уд/мин, снижен вольтаж ЭКГ, отмечается замедление проведения по левой ножке пучка Гиса (ЛНПГ) и диффузные нарушения процессов реполяризации. По данным ЭхоКГ полости сердца не увеличены (конечный диастолический размер левого желудочка – КДРЛЖ – 47 мм), сократимость не снижена (фракция выброса – ФВ –57%). Определялась легочная гипертензия (систолическое давление в легочной артерии – СДЛА – 51,7 мм рт. ст.), а также диастолическая дисфункция левого желудочка (ЛЖ) рестриктивного типа. В полости перикарда было небольшое количество жидкости, а также жидкость находилась в обеих плевральных полостях и брюшной полости. На фоне терапии сердечной недостаточности состояние пациента улучшилось, уменьшилась одышка, сохранялись отеки слабой степени.
После выписки из стационара проходил обследование у эндокринолога, ревматолога, онколога, проводилось исследование маркеров системных аутоиммунных заболеваний – патологии не выявлено.
Для оценки структурных изменений миокарда желудочков была назначена МРТ с отсроченным контрастированием гадолинием. По данным МРТ выявлена концентрическая гипертрофия миокарда ЛЖ (толщина стенок – 14–18 мм) и правого желудочка (ПЖ; толщина стенок – 8 мм), расширение левого предсердия, гидроперикард и гидроторакс (рис. 1). При проведении кино-МРТ данных за нарушение локальной сократимости миокарда желудочков не получено, определялось снижение глобальной сократимости миокарда ЛЖ (ФВЛЖ – 33%) и ПЖ (ФВПЖ – 34%). После введения контрастного препарата отмечалось его диффузное, трансмуральное, распространенное (во всех сегментах) накопление миокардом ЛЖ и ПЖ (рис. 2). Характер накопления контрастного препарата соответствует амилоидозу сердца.
Для подтверждения диагноза амилоидоза проведена биопсия прямой кишки, выявлены отложения амилоида в сосудах всех отделов, в мышечном слое кишки, проведено типирование, поставлен диагноз AL-амилоидоза.
Таким образом, на основании комплексного обследования поставлен диагноз: рестриктивная кардиомиопатия, системный амилоидоз с преимущественным поражением сердца. Хроническая сердечная недостаточность IIБ, функциональный класс (ФК) III. Асцит. Гидроторакс. Трикуспидальная недостаточность IV степени. Митральная недостаточность II степени.
Клинический пример 2
Пациент К., 79 лет, поступил в НМИЦ кардиологии с клинической картиной декомпенсации хронической сердечной недостаточности, жалобы на одышку при незначительной физической нагрузке (ходьба на расстояние до 50 м), головокружение, перебои в работе сердца, отеки нижних конечностей, общую слабость, быструю утомляемость.В НМИЦ кардиологии обследован амбулаторно: по данным сцинтиграфии – признаков очаговых перфузионных изменений легких не выявлено; на ЭхоКГ выявлена гипертрофия ЛЖ, расширение предсердий, сократимость миокарда удовлетворительная; по данным кардиореспираторного мониторирования – фибрилляция-трепетание предсердий, желудочковая экстрасистолия.
В ходе обследования в стационаре НМИЦ кардиологии на ЭКГ сохранялось трепетание предсердий; по данным ЭхоКГ – выраженная концентрическая гипертрофия миокарда ЛЖ, обращала на себя внимание гиперэхогенность миокарда ЛЖ (с яркими включениями), дилатация полостей предсердий и ПЖ, зон нарушения локальной сократимости не выявлено, глобальная сократимость ЛЖ удовлетворительная, выявлено нарушение диастолической функции миокарда ЛЖ.
Данные анамнеза, ЭКГ и ЭхоКГ требовали в первую очередь исключения амилоидоза. Для этого была проведена МРТ с отсроченным контрастированием. На МРТ выявлена асимметричная гипертрофия миокарда ЛЖ: утолщение миокарда межжелудочковой перегородки (МЖП) до 18 мм, нижней стенки до 13 мм, толщина остальных стенок была в пределах 10–11 мм (рис. 3).
Данных за гипертрофию миокарда ПЖ не получено. Отмечалось расширение предсердий и ПЖ. При оценке кино-МРТ определялось умеренное снижение сократимости миокарда ЛЖ (ФВ – 48%), зон нарушений локальной сократимости не отмечалось. После введения контрастного препарата визуализировалось его циркулярное субэндокардиальное накопление всеми стенками миокарда ЛЖ и ПЖ (рис. 4). Характер накопления контрастного препарата в миокарде желудочков не типичен для ишемического или воспалительного поражения миокарда, также не типичен для накопления в очагах фиброза на фоне гипертрофии. В первую очередь следует думать об амилоидозе.

По данным однофотонной эмиссионной компьютерной томографии (КТ) с 99mTc-пирофосфатом сцинтиграфическая картина также соответствовала амилоидозу сердца. Учитывая высокое значение коэффициента дифференциального накопления сердце/коллатеральная область, поставлен диагноз транстиретинового амилоидоза.
Таким образом, на основании анамнеза и инструментального обследования (МРТ сердца с контрастированием и однофотонная эмиссионная КТ с 99mTc-пирофосфатом) больному был поставлен следующий диагноз: Транстиретиновый амилоидоз сердца (ATTR). Недостаточность трикуспидального клапана IV степени. Хроническая сердечная недостаточность IIБ стадии, III ФК.
В обоих случаях диагноз амилоидоза сердца был поставлен с помощью МРТ сердца и подтвержден без выполнения биопсии миокарда.
Обсуждение
Большую значимость в неинвазивной диагностике амилоидоза сердца приобретает МРТ с отсроченным контрастированием, использование которой основано на способности амилоида связываться и задерживаться внутривенным введением гадолиния. Характер накопления контрастного препарата при МРТ отличается от такового при всех остальных заболеваниях сердца: имеет типичную картину диффузного трансмурального или субэндокардиального накопления контраста в миокарде желудочков [13–16]. Преимуществами МРТ сердца над эндомиокардиальной биопсией (ЭМБ) и другими неивазивными методами визуализации – возможность оценки распространенности и глубины амилоидной инфильтрации в миокарде, а также выявление заболевания на ранних стадиях, когда еще нет значительного увеличения толщины стенки желудочков и выраженных нарушений рестрикции. При ЭМБ сердца возможны ошибки места забора материала и неверные суждения о диагнозе. Grigorios Chatzantonis и соавт. провели многоцентровое исследование, в котором сравнили данные ЭМБ и МРТ сердца в выявлении амилоидоза сердца [17]. Авторы исследования провели ЭМБ у 160 пациентов с признаками сердечной недостаточности и наличия гипертрофии миокарда (толщина миокарда ЛЖ >12 мм). У 120 пациентов по данным ЭМБ был выявлен амилоидоз, у остальных 40 пациентов ообнаружены другие заболевания сердечно-сосудистой системы. Всем пациентам с амилоидозом провели МРТ сердца с отсроченным контрастированием и у 114 пациентов были обнаружены типичные паттерны контрастного усиления для амилоидоза сердца (диффузное накопление контрастного препарата от субэндокардиального к трансмуральному). Общая частота осложнений биопсии миокарда встречалась в 3,13% случаев и заключались в перфорации миокарда у 4 пациентов с перикардиальным выпотом, у одного пациента была индуцированная неустойчивая желудочковая тахикардия. Для диагностики амилоидоза сердца чувствительность МРТ сердца составила 95%, а специфичность – 98% [17]. В более ранней работе H. Vogelsberg и соавт. по данным ЭМБ выявили амилоидоз сердца у 15 больных из 33 пациентов с заболеваниями сердечно-сосудистой системы, в том числе 24 пациента с гипертрофией миокарда, у 4 пациентов был изначально диагноз системного амилоидоза. У больных с подтвержденным амилоидозом сердца была проведена МРТ и обнаружена типичная картина отсроченного накопления контрастного препарата миокардом желудочков (циркулярное распространенное субэндокардиальное накопление). По результатам исследования авторы сделали вывод, используя паттерн отсроченного контрастного усиления миокарда желудочков, чувствительность МРТ сердца составила 80%, а специфичность – 94%. Кроме того, в данной работе были выявлены больные с амилоидозом сердца без клинических признаков системного амилоидоза, что указывает о частоте встречаемости изолированного поражения сердца [18]. Таким образом, ранняя диагностика изолированного амилоидоза сердца с помощью МРТ с использованием отсроченного контрастирования приобретает важное клиническое значение для планирования тактики лечения, что значительно улучшит прогноз заболевания.МРТ сердца помимо анатомической и функциональной оценки камер сердца может предоставить информацию о тканевой характеристике миокарда, используя отсроченное контрастирование и Т1-картирование миокарда. У ряда пациентов с почечной недостаточностью введение контрастного препарата противопоказано и бесконтрастная методика Т1-картирования может помочь в постановке диагноза амилоидоза сердца. Martinez-Naharro и соавт. использовали МРТ сердца с отсроченным контрастированием и Т1-картирование для оценки 263 пациентов с ATTR-амилоидозом и 50 пациентов с Al-амилоидозом. В группе больных с ATTR-амилоидозом сердца асимметричная гипертрофия миокарда ЛЖ встречалась в 79% случаев по сравнению с 14% при AL-амилоидозе сердца. У всех пациентов выявлено накопление контрастного препарата, причем чаще встречалось трансмуральное распределение контраста в миокарде ЛЖ (у 71%), чем субэдокардиальное (у 29%). Накопление контраста в миокарде ПЖ встречалось в 96% случаев. После анализа карт Т1 выявлено, что у группы пациентов с субэндокардиальным накоплением контраста в миокарде значения Т1 были пограничными (1021±62 мс, при норме <1010 мс) и высокие значения объема внеклеточной жидкости (ECV; >35%, при норме ECV 25–28%), а у группы с трансмуральным распределением контраста оба показателя были значительно превышены (1180±54 мс и ECV>50%). При сравнении показателя ECV между группой с ATTR-амилоидозом и Al-амилоидозом значимых различий не выявлено (59±13% против 53±8%). В каждой группе повышение значений Т1-картирования сопровождалось характерным паттерном контрастного усиления в миокарде желудочков. Между показателем объема внеклеточной жидкости и поглощением контраста 99mTc-DPD при сцинтиграфии выявили положительную корреляцию в группе с ATTR-амилоидозом (r=0,533; р<0,05) [19]. Определение ECV с помощью бесконтрастной МРТ сердца – это первый неинвазивный метод количественной оценки сердечного интерстиция, значения которого увеличиваются в зависимости от распространенности амилоидной инфильтрации. Определение ECV с помощью бесконтрастной МРТ помогает в оценке тяжести амилоидной инфильтрации миокарда и влияет на прогноз заболевания [20].
МРТ сердца обладает набором интрументов (кино-последовательность, отсроченное контрастирование, нативное и постконтрастное Т1-картирование с оценкой ECV миокарда), которые показывают высокую диагностическую точность в выявлении амилоидоза сердца.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Буторова Екатерина Александровна – канд. мед. наук, врач-рентгенолог отдела томографии, ФГБУ «НМИЦ кардиологии».
E-mail: e.a.butorova@mail.ru; ORCID: 0000-0001-9706-7049
Ekaterina A. Butorova – Cand. Sci. (Med.), Radiologist of the department tomography, National Medical Research Center of Cardiology.
E-mail: e.a.butorova@mail.ru; ORCID: 0000-0001-9706-7049
Стукалова Ольга Владимировна – канд. мед. наук, ст. науч. сотр. отдела томографии, ФГБУ «НМИЦ кардиологии». E-mail: olgastukalova@mail.ru; ORCID: 0000-0001-8377-2388
Olga V. Stukalova – Cand. Sci. (Med.), Scientific researtcher department of tomography, National Medical Research Center of Cardiology.
E-mail: olgastukalova@mail.ru; ORCID: 0000-0001-8377-2388
Статья поступила в редакцию / The article received: 04.03.2021
Статья принята к печати / The article approved for publication: 17.03.2021
Список исп. литературыСкрыть список1. Merlini G, Westermark P. The systemic: clearer understanding of the molecular mechanisms offers hope for more effective therapies. J Intern Med 2004; 255: 159–78.
2. Wechalekar AD, Gillmore JD, Hawkins PN. Systemicamyloidosis. Lancet 2016; 387 (10038): 2641–54.
3. Dungu JN, Anderson LJ, Whelan CJ, Hawkins PN. Cardiac transthyretin amyloidosis. Heart 2012; 98: 1546–54.
4. Rapezzi C, Quarta CC, Riva L et al. Transthyretin-related amyloidoses and the heart: a clinical overview. Nat Rev Cardiol 2010; 7: 398–408.
5. Falk RH, Skinner M. The systemic amyloidoses: an overview. Adv Intern Med 2000; 45: 107–37.
6. Duston MA, Skinner M, Shirahama T, Cohen AS. Diagnosis of amyloidosis by abdominal fat aspiration: analysis of four years’ experience. Am J Med. 1987; 82: 412–4.
7. Garcia-Pavia P, Comin-Colet J, Barriales-Villa R et al. Comments on the 2014 ESC Guidelines on the diagnosis and management of hypertrophic cardiomyopathy. A critical view from the perspective of Spanish cardiology. Rev Esp Cardiol 2015; 68: 4–9.
8. Mavrogeni SI, Vartela V, Ntalianis A et al. Cardiac amyloidosis: in search of the ideal diagnostic tool. Herz 2019.
9. González-López E, Gallego-Delgado M, Guzzo-Merello G et al. Wild-type transthyretin amyloidosis as a cause of heart failure with preserved ejection fraction. Eur Heart J 2015; 36 (38): 2585–94.
10. Gillmore JD, Maurer MS, Falk RH et al. Nonbiopsydiagnosis of cardiac transthyretin amyloidosis. Circulation 2016; 133: 2404–12.
11. Ruberg FL, Appelbaum E, Davidoff R et al. Diagnostic and prognostic utility of cardiovascular magnetic resonance imaging in light-chain cardiac amyloidosis. Amer J Cardiol 2009; 103 (4): 544–9.
12. White SK, Sado DM, Flett AS, Moon J. Characterising the myocardial interstitial space: the clinical relevance non-invasive imaging. Heart 2012; 98: 773–9.
13. Aquaro GD, Pugliese NR, Perfetto F et al. Myocardial signal intensity decay after gadolinium injection: a fast and effective method for the diagnosis of cardiac amyloidosis. Int J Cardiovasc Imaging 2014; 30 (6): 1105–15.
14. Syed IS, Glockner JF, Feng D, et al. Role of cardiac magnetic resonance imaging in the detection of cardiac amyloidosis. JACC Cardiovasc Imaging 2010; 3: 155–64.
15. Стукалова О.В. Магнитно-резонансная томография сердца с отсроченным контрастированием – новый метод диагностики заболеваний сердца. Российский электронный журнал лучевой диагностики. 2013; 3: 7–18.
[Stukalova OV. Magnetic resonance imaging of the heart with delayed contrast is a new method for diagnosing heart diseas-es. Russian Electronic Journal of Radiation Diagnostics. 2013; 3: 7–18 (in Russian)].
16. Sipe JD, Benson MD, Buxbaum JN et al; Nomenclature Committee of the International Society of Amyloidosis. Amyloid fi bril protein nomenclature: 2012 recommendations from the Nomenclature Committee of the International Society of Amyloidosis. Amyloid 2012; 19: 167–70.
17. Chatzantonis G, Bietenbeck M, Elsanhoury A et al. Diagnostic value of cardiovascular magnetic resonance in comparison to endomyocardial biopsy in cardiac amyloidosis: a multi-centre study. Clin Res Cardiol 2020. DOI: 10.1007/s00392-020-01771-1
18. Vogelsberg H, Mahrholdt H, Deluigi CC et al. Cardiovascular magnetic resonance in clinically suspected cardiac amyloidosis: noninvasive imaging compared to endomyocardial biopsy. J Am Coll Cardiol 2008; 51: 1022–30.
19. Ana Martinez-Naharro, Thomas A. Treibel, Amna Abdel-Gadir et al. Magnetic Resonance in Transthyretin Cardiac Amyloidosis. J Am Coll Cardiol 2017; 70 (4): 466–77.
20. Fontana M, Banypersad SM, Treibel TA et al. Differential myocyte responses in patients with cardiac transthyretin amyloidosis and lightchain amyloidosis: a cardiac MR imaging study. Radiology 2015; 277: 388–97.


