Клинический разбор в общей медицине №04 2021
Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
ela12@yandex.ru
Abstract
The idiopathic inflammatory myopathies are a group of rare, heterogeneous connective tissue disorders characterized by skeletal muscle inflammation. The four main forms of idiopathic inflammatory myopathies are dermatomyositis, polymyositis, inclusion body myositis, and necrotizing immune-mediated myopathy. Each form of myositis, other than inclusion body myositis, can be associated with damage to many organs, including the lungs, heart, joints, and skin. The most often observed damage to the lung tissue with the development of interstitial lung disease, which occurs with or without myositis. The severity of the course varies from mild to severe, with rapid development of respiratory failure. Interstitial lung disease can be fatal in patients with myositis, therefore, it is necessary to assess the damage to the lung tissue in the early stages of the disease.
Key words: dermatomyositis, polymyositis, interstitial lung disease.
For citation: Bondarenko I.B., Ponomareva L.A., Popova E.N. Clinical types of lung disease in polymyositis and dermatomyositis. Clinical review for general practice. 2021; 4: 34–39. DOI: 10.47407/kr2021.2.4.00058
 Полимиозит (ПМ) и дерматомиозит (ДМ) относятся к системным заболеваниям, связанным с поражением кожи и скелетных мышц в виде воспалительной, преимущественно лимфоцитарной, инфильтрации [1]. Повреждение мышц приводит к потере нормальной структурно-функциональной организации мышечных волокон, при присоединении к миопатии кожных поражений заболевание приобретает признаки ДМ.
Полимиозит (ПМ) и дерматомиозит (ДМ) относятся к системным заболеваниям, связанным с поражением кожи и скелетных мышц в виде воспалительной, преимущественно лимфоцитарной, инфильтрации [1]. Повреждение мышц приводит к потере нормальной структурно-функциональной организации мышечных волокон, при присоединении к миопатии кожных поражений заболевание приобретает признаки ДМ.
Заболевание нередко не диагностируется вследствие многообразия клинических проявлений и частоты субклинических вариантов течения [2]. Чаще заболевают женщины в среднем и пожилом возрасте. Известны семейные случаи болезни [1].
Патогенез ПМ/ДМ связывают с появлением антисинтетазных антител. Антисинтетазный синдром – это аутоиммунное заболевание, характеризующееся аутоантителами против одной из многих синтетаз РНК-трансмиссии аминоацила (тРНК) с клиническими признаками, которые могут включать интерстициальное заболевание легких (ИБЛ), неэрозивный артрит, миозит, феномен Рейно, необъяснимую лихорадку и/или «руки механика». У пациентов с ПМ/ДМ были описаны различные миозит-специфические и ассоциированные аутоантитела, которые часто тестируются при оценке идиопатических ИБЛ [3]. Отличительной чертой антисинтетазного синдрома является наличие антисинтетазных антител, специфичных для миозита. Из антител против синтетазы чаще всего идентифицируют анти-Jo-1, анти-гистидил-тРНК-синтетазу. Менее распространенные антисинтетазные антитела включают анти-треонил (анти-PL7), анти-аланил (анти-PL12), анти-изолейцил (анти-OJ) и анти-гилцил (анти-EJ), а также другие, которые нечасто тестируют в клинических условиях, но о них сообщается в литературе [4].
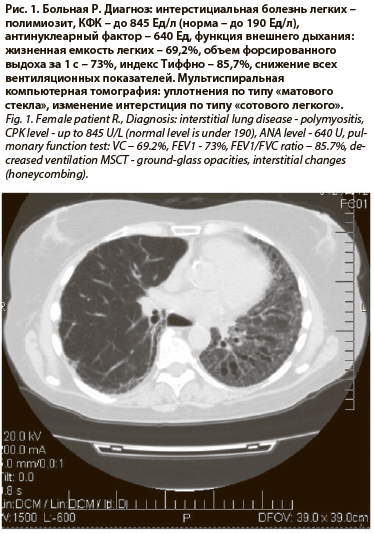
Поражение легких при антисинтетазном синдроме представлено прежде всего интерстициальным воспалением в виде МСКТ-паттерна «матового стекла» и тракционных бронхоэктазов (рис. 1) [5].
В типичных случаях болезни появляется слабость в мышцах тазового и плечевого пояса. Жалобы, возникающие у больных, прежде всего обусловлены трудностями при подъеме по лестнице, причесывании, одевании, больным трудно выбраться из ванны, присесть и встать с согнутых колен, подняться со стула. У части пациентов возникает слабость передних мышц шеи, дисфункция орофарингеальных мышц, что приводит к аспирации, дисфагии и дистонии [6], возможно нарушение моторики пищевода. Кроме того, иногда наблюдаются нарушения ритма сердца, свидетельствующие о поражении миокарда [7].
При тяжелой форме болезни быстро развивается массивная деструкция мышц, миоглобинопатия, миоглобинурия, тяжелые нарушения функции почек. Гибель возможна в течение нескольких недель [8].
При легких вариантах заболевания клинические проявления выражены настолько слабо, что не воспринимаются как болезнь и расцениваются как последствия недостаточной физической активности. С другой стороны, при амиопатической форме ПМ/ДМ может быть и тяжелое течение за счет висцеральных поражений.
Из лабораторных проявлений следует отметить повышение СОЭ, достигающее у 1/2 больных значений более 60–70 мм/ч. Повышение сывороточной креатининфосфокиназы (КФК) относится к ключевым признакам заболевания и вместе с увеличением СОЭ коррелирует с активностью болезни. Определение других ферментов – альдолазы, лактатдегидрогеназы, трансаминазы – используется для динамического наблюдения за больными. Уровень КФК порою превышает нормальные показатели в 80–100 раз. Низкие показатели КФК встречаются при вялотекущих вариантах болезни, но существует мнение, что отсутствие энзимопатии при выраженных клинических проявлениях сопряжено с неблагоприятным прогнозом [9]. Электромиография позволяет дифференцировать ПМ от слабости, обусловленной поражением периферических мотонейронов, или мышечной дистрофии. Важную информацию позволяет получить биопсия мышц.
Пусковой этиологический фактор ПМ/ДМ остается неизвестным. Определенным аргументом в пользу инфекции служит частое обнаружение антител к токсоплазме при ПМ [12]. ПМ/ДМ-подобные реакции встречаются у больных с вирусным гепатитом. При вирусном гепатите С внепеченочные проявления с миопатией, кожными поражениями, фиброзирующим альвеолитом (ФА) развиваются на почве васкулита, обусловленного криоглобулинами [13].
Вирус гепатита С стимулирует моно- или олигоклональную пролиферацию В-лимфоцитов и различные лимфопролиферативные состояния, обозначаемые как «монотипические лимфопролиферативные нарушения неуточненного значения» (lymphoproliferative disorders of undetermined significance – MLDUS), в рамках которых происходит образование иммунных комплексов, содержащих криоглобулины, ревматоидный фактор и органоспецифические и неспецифические антитела. Проявления, укладывающиеся в картину ПМ/ДМ, диагностируются у больных, инфицированных вирусами группы герпеса, аденовирусами, вирусом иммунодефицита человека [14]. Замечено, что миопатический синдром и легочный фиброз могут наблюдаться после операций трансплантации органов [15]. Иммунокомплексное поражение при ПМ/ДМ нередко затрагивает сосудистое русло [16]. Особенно часто признаки ассоциированного с ПМ/ДМ васкулита обнаруживаются у детей [17].
Появление мышечной слабости в сочетании с системными проявлениями может быть и осложнением лекарственной терапии иммуносупрессивными препаратами. Эти расстройства, приводящие к тяжелым нарушениям легочных функций с трудно купируемой дыхательной недостаточностью, порою и определяют прогноз болезни [18].
У 48-летнего мужчины, ведущего малоподвижный образ жизни, резкая мышечная слабость, мышечные боли, многократный подъем КФК, лихорадка, множественные инфильтраты в легких появились после интенсивной игры в футбол и посещения сауны. При морфологическом исследовании в легких обнаружены
инфильтраты, располагающиеся в интерстиции, гранулемы, содержащие клетки инородных тел, а в мышцах – лимфоцитарная инфильтрация, подобная ПМ. Разрешение внутригрудных изменений и обратное развитие миопатии произошло в результате интенсивного лечения кортикостероидами в режиме высоких доз.
ИБЛ при ИБЛ-ПМ/ДМ клинически имеет некоторые особенности. Многие больные поначалу указывают, что им тяжело дышать из-за физических усилий, связанных с появлением болей в грудной клетке на вдохе («ощущение панциря»), в дальнейшем появляется одышка, связанная с затруднением вдоха при глубоком дыхании, но без мышечной слабости. Кроме миопатии у больных ФА-ПМ/ДМ также наблюдаются изменения на коже («рука механика», пятна Готтрона). Параорбитальные отеки хотя и относят к типичному проявлению ДМ, но при ИБЛ наблюдаются не у всех больных.
Большое значение в респираторных расстройствах имеет дисфункция мышц грудной клетки и диафрагмы. У 80% больных из общей группы ПМ/ДМ, прослеженных в нашей клинике, наблюдалась ригидность грудной клетки, высокое стояние диафрагмы, а у 7 пациентов – симптомы сдавленного легкого (shrinking-lung). Аускультативные изменения характеризовались жестким дыханием, множественными хрипами, часто маскирующими крепитацию. Звуковые феномены в легких при ПМ/ДМ во многом определялись присоединением бронхолегочной инфекции вследствие аспирации.
Цианоз наблюдается чаще при остром течении болезни, когда возникают тяжелые мышечные расстройства. Это объясняется и тем, что фибропластическая форма интерстициальной пневмонии, наблюдаемая например при системной склеродермии, обнаруживается при ПМ/ДМ крайне редко.
Поражения легких при ПМ/ДМ включают организующуюся пневмонию, диффузные альвеолярные геморрагии, неспецифическую интерстициальную пневмонию, аспирационную и гипостатическую пневмонию, легочную гипертонию, лекарственный пневмонит.
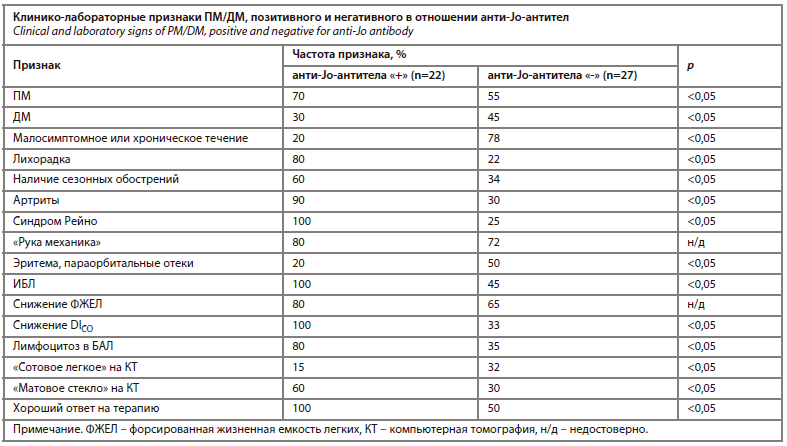
Пневмопатия, обнаруживаемая при ПМ/ДМ, имеет свои особенности, связанные с развитием иммунокомплексного повреждения легких, обусловленного появлением анти-Jo-антител [20]. У большинства больных, положительных по анти-Jo-антителам, наблюдаются изменения в легких. Кроме того, ПМ/ДМ с анти-Jo-антителами в отличие от иммунонегативного ПМ/ДМ характеризуется острым началом с лихорадкой, мышечной слабостью, артритами, синдромом Рейно. Для этой формы также характерно поражение кожи в виде «руки механика», тогда как эритема на коже шеи, декольте, параорбитальные отеки встречаются реже (см. таблицу). У всех больных регистрируются выраженное падение диффузионной способности легких и КТ-проявления интерстициальной пневмонии. Редкое при ИБЛ-ПМ/ДМ осложнение в виде респираторного дистресс-синдрома встречается в основном у больных с анти-Jo-антителами. Вместе с тем больные ПМ/ДМ, ассоциированным с анти-Jo-антителами, лучше отвечают на кортикостероидную терапию.
В ряде случаев в иммунологическом спектре антисинтетазные антитела присутствуют вместе с антинуклеарными факторами. Причем колебание уровня антинуклеарного фактора коррелирует с распространенностью рентгенологических и клинических проявлений.
Рентгенологические находки при ПМ/ДМ достаточно скудные. Изменения располагаются в базальных отделах легких и представлены в основном сетчатой деформацией легочного рисунка, множественными мелкими очаговыми затемнениями, возможно появление феномена «матового стекла». «Сотовое легкое» развивается у больных с длительным анамнезом болезни, встречается редко и не связано с иммунологической активностью [11].
В течение 5 лет мы наблюдаем больную ИБЛ-ПМ/ДМ с типичными проявлениями антисинтетазного синдрома в дебюте болезни (см. рис. 1) . Начатое лечение кортикостероидами быстро привело к стойкой ремиссии системных заболеваний соединительной ткани. Однако в настоящее время у больной наблюдаются постепенное прогрессирование фиброзных изменений в легких в виде участков кистозной деформации, умеренное снижение DlСО. Электромиографические показатели сохраняются в пределах нормы.
Подтверждение диагноза становится возможным только в результате сопоставления клинических и инструментальных данных, цитоморфологические изменения в легких при ИБЛ-ПМ/ДМ во многом неспецифичны. Морфологические признаки организующейся интерстициальной пневмонии (ОрИП) выявляются достаточно часто, идиопатическая, или криптогенная, форма острой интерстициальной пневмонии относится к редким состояниям. С другой стороны, ОрИП может развиваться при вирусных и бактериальных инфекциях. S. Prahalad в 2005 г. описал ребенка с ювенильной формой ДМ с длительно неразрешавшейся пневмонической инфильтрацией в легких. При морфологическом исследовании изменения в легких имели признаки ОрИП с элементами фибринозного воспаления.
ОрИП встречается как внепеченочное проявление хронических заболеваний печени [21], обнаруживается также при хронических воспалительных заболеваниях кишечника (язвенном колите, болезни Крона), миелопролиферативных заболеваниях, опухолях, болезни Шегрена, системных гранулематозах [22]. Много диагностических затруднений возникает при лекарственно-обусловленной ОрИП (вызванной приемом блеомицина, противовирусных препаратов, антибиотиков и т.д.), поскольку в этих случаях заболевание может имитировать опухолевое поражение легких, среднедолевой синдром [23]. Вместе с тем при ПМ/ДМ рентгенологические изменения в легких часто ошибочно трактуются как банальная пневмония, что влечет за собой избыточное назначение антибиотиков. Повышенный риск бактериальных осложнений вследствие аспирации при ПМ/ДМ как аргумент в пользу длительной терапии антибиотиками представляется несомненным, но показания для антибактериальной терапии, в особенности ex juvantbus, должны быть тщательно продуманы.
При ПМ/ДМ морфологические изменения типа ОрИП обнаруживаются у 30% больных и сочетаются с васкулитами и признаками выраженного ангиогенеза, склеротическими изменениями в стенках сосудов. Ремоделирование сосудистого русла легких во многом идентично наблюдаемому при других системных заболеваниях соединительной ткани, сопровождающихся легочной гипертензией, структурно-функциональные признаки которой представлены повреждением эндотелия легочных сосудов, усилением экспрессии адгезивных молекул, в культуре легочных фибробластов, полученных от таких больных, отмечается повышенная продукция факторов роста [24].
В жидкости бронхоальвеолярного лаважа (БАЛ) у больных ПМ/ДМ даже в отсутствие рентгенологических изменений в легких наблюдается некоторое увеличение уровня лимфоцитов. Для морфологически активного ИБЛ-ПМ/ДМ типичен нейтрофильно-лимфоцитарный состав БАЛ [25]. При типировании лимфоцитов выявляется гетерогенность лимфоцитарной популяции с преобладанием СД8+-фенотипов (I. Yamadori и соавт., 2001).
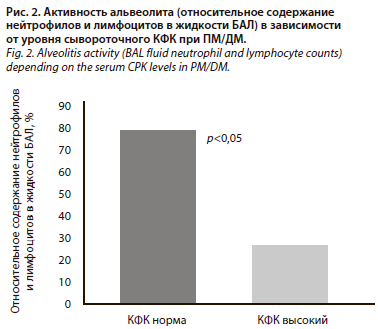 Присоединение ИБЛ, несомненно, усугубляет прогноз больных с ПМ/ДМ. Продолжительность заболевания составляет в среднем 6 лет [21]. По данным госпиталя Mayo, 5-летняя выживаемость достигает 60% [26]. У больных с высокой активностью иммуновоспалительных реакций в легких, лабораторными признаками миопатии (повышение активности КФК, миоглобинурия) ответ на терапию и прогноз более благоприятные. Показано, что в наибольшей степени признаки морфологической активности воспаления в интерстиции легких (альвеолита) представлены у больных с низкой активностью КФК; рис. 2 (И.Б. Бондаренко, 2007).
Присоединение ИБЛ, несомненно, усугубляет прогноз больных с ПМ/ДМ. Продолжительность заболевания составляет в среднем 6 лет [21]. По данным госпиталя Mayo, 5-летняя выживаемость достигает 60% [26]. У больных с высокой активностью иммуновоспалительных реакций в легких, лабораторными признаками миопатии (повышение активности КФК, миоглобинурия) ответ на терапию и прогноз более благоприятные. Показано, что в наибольшей степени признаки морфологической активности воспаления в интерстиции легких (альвеолита) представлены у больных с низкой активностью КФК; рис. 2 (И.Б. Бондаренко, 2007).
Среди новых прогностически значимых факторов следует отметить и сывороточный уровень цитокератинов 19, отражающий степень деструктивных изменений в эпителии бронхов.
По прогностической значимости при ИБЛ-ПМ/ДМ с интерстициальными поражениями легких конкурируют инфекционные осложнения [21]. Уточнить риск аспирации можно при помощи эндоскопических методов исследования или путем рентгеноконтрастных исследований пищевода. Следует отметить, что при ПМ/ДМ так же, как и при CREST-синдроме, наблюдаются рентгенологические признаки ахалазии пищевода и регургитация бариевой взвеси.
К терапии ИБЛ-ПМ/ДМ необходим комплексный подход с назначением препаратов, восстанавливающих дренажную функцию бронхов, разжижающих мокроту, а также физиотерапевтических процедур, направленных на восстановление подвижности грудной клетки [27].
Наибольший опыт в лечении ПМ/ДМ касается кортикостероидов. Убедительного подтверждения эффективности цитостатиков нет. Показанием к их назначению является тяжелое прогрессирующее течение болезни. Появление признаков пневмопатии при ПМ/ДМ также служит показанием к назначению цитостатиков. Развернутая картина легочного фиброза с формированием «сотового легкого» при ПМ/ДМ наблюдается редко.
В последние годы убедительный эффект получен от ингибиторов T-лимфоцитов [28]. Недавно небольшое рандомизированное открытое исследование показало возможное влияние внутривенных инфузий ингибиторов T-лимфоцитов на мышечную слабость у резистентных к лечению пациентов с ПМ или ДМ [29].
Хотя фактор некроза опухоли (ФНО) α может играть роль в патогенезе ПМ/ДМ, лечение пациентов анти-ФНО-α дало противоречивые результаты. Даже если некоторые авторы сообщили о возможной роли данных препаратов при ДМ [30], то другие исследования не подтвердили это наблюдение, и у некоторых пациентов состояние ухудшилось. Более того, некоторые авторы сообщили, что терапия анти-ФНО-α может вызывать миозит у пациентов с ревматоидным артритом, псориатическим артритом и псориазом. Таким образом, блокаторы ФНО-α обычно не рекомендуются взрослым пациентам с ПM, и их следует использовать только тогда, когда другие методы лечения неэффективны [31].
Отдельную проблему составляют формы ПМ/ДМ, развивающиеся при злокачественных опухолях. Как ДМ, так и ПМ связаны с повышенным риском злокачественных новообразований, но ДМ больше связан с любым типом рака, чем полимиозит. Несмотря на противоопухолевую терапию, выживаемость пациентов с онкоассоциированными злокачественными образованиями была очень низкой. Выживаемость в группе первичных ПМ и ДМ через 5 лет была значительно выше (100% и 100%) по сравнению с группой пациентов с онкоассоциированным миозитом, где выживаемость составила 15,4% для ПМ и 27,5% для ДМ. Хотя риск рака у пациентов с ПМ ниже, вероятность длительного выживания меньше. Что касается противомиозитной терапии, иммунодепрессанты у пациентов с онкоассоциированным миозитом применялись реже, чем у пациентов с простым миозитом. Несмотря на широко изученную связь между миозитом и раком, лучшая стратегия диагностики и лечения рака у пациентов с ПM отсутствует [32]
Тяжесть паранеопластического ПМ/ДМ не всегда определяется активностью опухолевого процесса. Опухоли, даже небольшие, могут становиться причиной яркой картины миопатии и кожных изменений. Высокая частота паранеопластических реакций с вовлечением легких и ПМ/ДМ наблюдается при опухолях
молочной железы, желудочно-кишечного тракта (B.B. Forster, 1990; H. Kondo, 2005). K.M. Kee и соавт. (2004 г.) наблюдали HCV-инфицированного больного с поражением кожи, миопатическим синдромом и изменениями в легких, очаговыми образованиями в печени. При обследовании выявлен высокий уровень альфа-фетопротеина, циркулирующих иммунных комплексов. Частота поражения легких ПМ/ДМ при опухолях молочной железы достигает 30% и во многих случаях предшествует развернутой стадии опухолевого процесса. Паранеопластический вариант поражения легких и ПМ/ДМ устойчиво сочетаются друг с другом, так что у больных в первую очередь следует предпринимать диагностические мероприятия, имеющие целью выявление наиболее часто встречающихся опухолей.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Бондаренко Инна Борисовна – канд. мед. наук, ассистент каф. внутренних, профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Inna B. Bondarenko – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University)
Пономарева Любовь Андреевна – студент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail:
liubaponomareva18@yandex.ru
Liubov A. Ponomareva – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: liubaponomareva18 @yandex.ru
Попова Елена Николаевна – д-р мед. наук, проф. каф. внутренних, профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru
Elena N. Popova – D. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru
Статья поступила в редакцию / The article received: 24.05.2021
Статья принята к печати / The article approved for publication: 27.05.2021
Клинический разбор в общей медицине №04 2021
Клинические варианты поражения легких при поли- и дерматомиозите
Номера страниц в выпуске:34-39
Аннотация
Идиопатические воспалительные миопатии представляют собой группу редких гетерогенных заболеваний соединительной ткани, характеризующихся воспалением скелетных мышц. Четыре основные формы идиопатических воспалительных миопатий – это дерматомиозит, полимиозит, миозит с включенными тельцами и некротизирующая иммуноопосредованная миопатия. Каждая форма миозита, кроме миозита с включенными тельцами, может быть связана с поражением многих органов, включая легкие, сердце, суставы и кожу. Наиболее часто наблюдается поражение легочной ткани с развитием интерстициальной болезни легких, возникающей на фоне миозита или без него. Тяжесть течения варьирует от легкой до тяжелой, с быстрым развитием дыхательной недостаточности. Интерстициальные болезни легких могут стать причиной смерти у пациентов с миозитом, поэтому необходимо проводить оценку поражения легочной ткани на ранних стадиях развития заболевания.
Ключевые слова: полимиозит, дерматомиозит, интерстициальные болезни легких.
Для цитирования: Бондаренко И.В., Пономарева Л.А., Попова Е.Н. Клинические варианты поражения легких при поли- и дерматомиозите. Клинический разбор в общей медицине. 2021; 4: 34–39. DOI: 10.47407/kr2021.2.4.00058
Идиопатические воспалительные миопатии представляют собой группу редких гетерогенных заболеваний соединительной ткани, характеризующихся воспалением скелетных мышц. Четыре основные формы идиопатических воспалительных миопатий – это дерматомиозит, полимиозит, миозит с включенными тельцами и некротизирующая иммуноопосредованная миопатия. Каждая форма миозита, кроме миозита с включенными тельцами, может быть связана с поражением многих органов, включая легкие, сердце, суставы и кожу. Наиболее часто наблюдается поражение легочной ткани с развитием интерстициальной болезни легких, возникающей на фоне миозита или без него. Тяжесть течения варьирует от легкой до тяжелой, с быстрым развитием дыхательной недостаточности. Интерстициальные болезни легких могут стать причиной смерти у пациентов с миозитом, поэтому необходимо проводить оценку поражения легочной ткани на ранних стадиях развития заболевания.
Ключевые слова: полимиозит, дерматомиозит, интерстициальные болезни легких.
Для цитирования: Бондаренко И.В., Пономарева Л.А., Попова Е.Н. Клинические варианты поражения легких при поли- и дерматомиозите. Клинический разбор в общей медицине. 2021; 4: 34–39. DOI: 10.47407/kr2021.2.4.00058
Clinical types of lung disease in polymyositis and dermatomyositis
Inna B. Bondarenko, Liubov A. Ponomareva, Elena N. PopovaSechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
ela12@yandex.ru
Abstract
The idiopathic inflammatory myopathies are a group of rare, heterogeneous connective tissue disorders characterized by skeletal muscle inflammation. The four main forms of idiopathic inflammatory myopathies are dermatomyositis, polymyositis, inclusion body myositis, and necrotizing immune-mediated myopathy. Each form of myositis, other than inclusion body myositis, can be associated with damage to many organs, including the lungs, heart, joints, and skin. The most often observed damage to the lung tissue with the development of interstitial lung disease, which occurs with or without myositis. The severity of the course varies from mild to severe, with rapid development of respiratory failure. Interstitial lung disease can be fatal in patients with myositis, therefore, it is necessary to assess the damage to the lung tissue in the early stages of the disease.
Key words: dermatomyositis, polymyositis, interstitial lung disease.
For citation: Bondarenko I.B., Ponomareva L.A., Popova E.N. Clinical types of lung disease in polymyositis and dermatomyositis. Clinical review for general practice. 2021; 4: 34–39. DOI: 10.47407/kr2021.2.4.00058
 Полимиозит (ПМ) и дерматомиозит (ДМ) относятся к системным заболеваниям, связанным с поражением кожи и скелетных мышц в виде воспалительной, преимущественно лимфоцитарной, инфильтрации [1]. Повреждение мышц приводит к потере нормальной структурно-функциональной организации мышечных волокон, при присоединении к миопатии кожных поражений заболевание приобретает признаки ДМ.
Полимиозит (ПМ) и дерматомиозит (ДМ) относятся к системным заболеваниям, связанным с поражением кожи и скелетных мышц в виде воспалительной, преимущественно лимфоцитарной, инфильтрации [1]. Повреждение мышц приводит к потере нормальной структурно-функциональной организации мышечных волокон, при присоединении к миопатии кожных поражений заболевание приобретает признаки ДМ. Заболевание нередко не диагностируется вследствие многообразия клинических проявлений и частоты субклинических вариантов течения [2]. Чаще заболевают женщины в среднем и пожилом возрасте. Известны семейные случаи болезни [1].
Патогенез ПМ/ДМ связывают с появлением антисинтетазных антител. Антисинтетазный синдром – это аутоиммунное заболевание, характеризующееся аутоантителами против одной из многих синтетаз РНК-трансмиссии аминоацила (тРНК) с клиническими признаками, которые могут включать интерстициальное заболевание легких (ИБЛ), неэрозивный артрит, миозит, феномен Рейно, необъяснимую лихорадку и/или «руки механика». У пациентов с ПМ/ДМ были описаны различные миозит-специфические и ассоциированные аутоантитела, которые часто тестируются при оценке идиопатических ИБЛ [3]. Отличительной чертой антисинтетазного синдрома является наличие антисинтетазных антител, специфичных для миозита. Из антител против синтетазы чаще всего идентифицируют анти-Jo-1, анти-гистидил-тРНК-синтетазу. Менее распространенные антисинтетазные антитела включают анти-треонил (анти-PL7), анти-аланил (анти-PL12), анти-изолейцил (анти-OJ) и анти-гилцил (анти-EJ), а также другие, которые нечасто тестируют в клинических условиях, но о них сообщается в литературе [4].
Поражение легких при антисинтетазном синдроме представлено прежде всего интерстициальным воспалением в виде МСКТ-паттерна «матового стекла» и тракционных бронхоэктазов (рис. 1) [5].
В типичных случаях болезни появляется слабость в мышцах тазового и плечевого пояса. Жалобы, возникающие у больных, прежде всего обусловлены трудностями при подъеме по лестнице, причесывании, одевании, больным трудно выбраться из ванны, присесть и встать с согнутых колен, подняться со стула. У части пациентов возникает слабость передних мышц шеи, дисфункция орофарингеальных мышц, что приводит к аспирации, дисфагии и дистонии [6], возможно нарушение моторики пищевода. Кроме того, иногда наблюдаются нарушения ритма сердца, свидетельствующие о поражении миокарда [7].
При тяжелой форме болезни быстро развивается массивная деструкция мышц, миоглобинопатия, миоглобинурия, тяжелые нарушения функции почек. Гибель возможна в течение нескольких недель [8].
При легких вариантах заболевания клинические проявления выражены настолько слабо, что не воспринимаются как болезнь и расцениваются как последствия недостаточной физической активности. С другой стороны, при амиопатической форме ПМ/ДМ может быть и тяжелое течение за счет висцеральных поражений.
Из лабораторных проявлений следует отметить повышение СОЭ, достигающее у 1/2 больных значений более 60–70 мм/ч. Повышение сывороточной креатининфосфокиназы (КФК) относится к ключевым признакам заболевания и вместе с увеличением СОЭ коррелирует с активностью болезни. Определение других ферментов – альдолазы, лактатдегидрогеназы, трансаминазы – используется для динамического наблюдения за больными. Уровень КФК порою превышает нормальные показатели в 80–100 раз. Низкие показатели КФК встречаются при вялотекущих вариантах болезни, но существует мнение, что отсутствие энзимопатии при выраженных клинических проявлениях сопряжено с неблагоприятным прогнозом [9]. Электромиография позволяет дифференцировать ПМ от слабости, обусловленной поражением периферических мотонейронов, или мышечной дистрофии. Важную информацию позволяет получить биопсия мышц.
Поражения легких при ПМ/ДМ
Одними из первых тяжелую мышечную слабость у больного с небактериальной пневмонией описали E.S. Mills и W.H. Mathews в 1956 г. В клинических исследованиях, проведенных в конце прошлого века с привлечением больших групп больных ПМ/ДМ и использованием рутинных рентгенологических методов, изменения в легких обнаруживались у 10–15% больных [10]. По более поздним данным, функциональные нарушения и КТВР-признаки воспаления и фиброза в интерстиции легких выявлялись более чем у половины больных ПМ/ДМ [11].Пусковой этиологический фактор ПМ/ДМ остается неизвестным. Определенным аргументом в пользу инфекции служит частое обнаружение антител к токсоплазме при ПМ [12]. ПМ/ДМ-подобные реакции встречаются у больных с вирусным гепатитом. При вирусном гепатите С внепеченочные проявления с миопатией, кожными поражениями, фиброзирующим альвеолитом (ФА) развиваются на почве васкулита, обусловленного криоглобулинами [13].
Вирус гепатита С стимулирует моно- или олигоклональную пролиферацию В-лимфоцитов и различные лимфопролиферативные состояния, обозначаемые как «монотипические лимфопролиферативные нарушения неуточненного значения» (lymphoproliferative disorders of undetermined significance – MLDUS), в рамках которых происходит образование иммунных комплексов, содержащих криоглобулины, ревматоидный фактор и органоспецифические и неспецифические антитела. Проявления, укладывающиеся в картину ПМ/ДМ, диагностируются у больных, инфицированных вирусами группы герпеса, аденовирусами, вирусом иммунодефицита человека [14]. Замечено, что миопатический синдром и легочный фиброз могут наблюдаться после операций трансплантации органов [15]. Иммунокомплексное поражение при ПМ/ДМ нередко затрагивает сосудистое русло [16]. Особенно часто признаки ассоциированного с ПМ/ДМ васкулита обнаруживаются у детей [17].
Появление мышечной слабости в сочетании с системными проявлениями может быть и осложнением лекарственной терапии иммуносупрессивными препаратами. Эти расстройства, приводящие к тяжелым нарушениям легочных функций с трудно купируемой дыхательной недостаточностью, порою и определяют прогноз болезни [18].
Клиническая картина
При обследовании больных ПМ/ДМ выявляется симптомокомплекс, свидетельствующий о поражении легочного интерстиция. У больных наблюдаются кашель, одышка. Тяжесть дыхательных расстройств часто определяется нарастающей мышечной слабостью, которая может сама по себе приводить к усилению одышки. Вовлечение легких при ПМ/ДМ в большинстве случаев становится ведущим клиническим проявлением болезни. Среди 70 больных ПМ/ДМ, наблюдавшихся в клинике им. Е.М. Тареева, у 55% было зарегистрировано поражение легких при ПМ/ДМ, причем у 48% альвеолит был ведущим и единственным проявлением болезни, опережающим мышечную слабость [19]. У многих больных заболеванию предшествовали вирусные инфекции, две молодые девушки связывали заболевание с мышечной нагрузкой во время танцев.У 48-летнего мужчины, ведущего малоподвижный образ жизни, резкая мышечная слабость, мышечные боли, многократный подъем КФК, лихорадка, множественные инфильтраты в легких появились после интенсивной игры в футбол и посещения сауны. При морфологическом исследовании в легких обнаружены
инфильтраты, располагающиеся в интерстиции, гранулемы, содержащие клетки инородных тел, а в мышцах – лимфоцитарная инфильтрация, подобная ПМ. Разрешение внутригрудных изменений и обратное развитие миопатии произошло в результате интенсивного лечения кортикостероидами в режиме высоких доз.
ИБЛ при ИБЛ-ПМ/ДМ клинически имеет некоторые особенности. Многие больные поначалу указывают, что им тяжело дышать из-за физических усилий, связанных с появлением болей в грудной клетке на вдохе («ощущение панциря»), в дальнейшем появляется одышка, связанная с затруднением вдоха при глубоком дыхании, но без мышечной слабости. Кроме миопатии у больных ФА-ПМ/ДМ также наблюдаются изменения на коже («рука механика», пятна Готтрона). Параорбитальные отеки хотя и относят к типичному проявлению ДМ, но при ИБЛ наблюдаются не у всех больных.
Большое значение в респираторных расстройствах имеет дисфункция мышц грудной клетки и диафрагмы. У 80% больных из общей группы ПМ/ДМ, прослеженных в нашей клинике, наблюдалась ригидность грудной клетки, высокое стояние диафрагмы, а у 7 пациентов – симптомы сдавленного легкого (shrinking-lung). Аускультативные изменения характеризовались жестким дыханием, множественными хрипами, часто маскирующими крепитацию. Звуковые феномены в легких при ПМ/ДМ во многом определялись присоединением бронхолегочной инфекции вследствие аспирации.
Цианоз наблюдается чаще при остром течении болезни, когда возникают тяжелые мышечные расстройства. Это объясняется и тем, что фибропластическая форма интерстициальной пневмонии, наблюдаемая например при системной склеродермии, обнаруживается при ПМ/ДМ крайне редко.
Поражения легких при ПМ/ДМ включают организующуюся пневмонию, диффузные альвеолярные геморрагии, неспецифическую интерстициальную пневмонию, аспирационную и гипостатическую пневмонию, легочную гипертонию, лекарственный пневмонит.
Пневмопатия, обнаруживаемая при ПМ/ДМ, имеет свои особенности, связанные с развитием иммунокомплексного повреждения легких, обусловленного появлением анти-Jo-антител [20]. У большинства больных, положительных по анти-Jo-антителам, наблюдаются изменения в легких. Кроме того, ПМ/ДМ с анти-Jo-антителами в отличие от иммунонегативного ПМ/ДМ характеризуется острым началом с лихорадкой, мышечной слабостью, артритами, синдромом Рейно. Для этой формы также характерно поражение кожи в виде «руки механика», тогда как эритема на коже шеи, декольте, параорбитальные отеки встречаются реже (см. таблицу). У всех больных регистрируются выраженное падение диффузионной способности легких и КТ-проявления интерстициальной пневмонии. Редкое при ИБЛ-ПМ/ДМ осложнение в виде респираторного дистресс-синдрома встречается в основном у больных с анти-Jo-антителами. Вместе с тем больные ПМ/ДМ, ассоциированным с анти-Jo-антителами, лучше отвечают на кортикостероидную терапию.
В ряде случаев в иммунологическом спектре антисинтетазные антитела присутствуют вместе с антинуклеарными факторами. Причем колебание уровня антинуклеарного фактора коррелирует с распространенностью рентгенологических и клинических проявлений.
Рентгенологические находки при ПМ/ДМ достаточно скудные. Изменения располагаются в базальных отделах легких и представлены в основном сетчатой деформацией легочного рисунка, множественными мелкими очаговыми затемнениями, возможно появление феномена «матового стекла». «Сотовое легкое» развивается у больных с длительным анамнезом болезни, встречается редко и не связано с иммунологической активностью [11].
В течение 5 лет мы наблюдаем больную ИБЛ-ПМ/ДМ с типичными проявлениями антисинтетазного синдрома в дебюте болезни (см. рис. 1) . Начатое лечение кортикостероидами быстро привело к стойкой ремиссии системных заболеваний соединительной ткани. Однако в настоящее время у больной наблюдаются постепенное прогрессирование фиброзных изменений в легких в виде участков кистозной деформации, умеренное снижение DlСО. Электромиографические показатели сохраняются в пределах нормы.

Подтверждение диагноза становится возможным только в результате сопоставления клинических и инструментальных данных, цитоморфологические изменения в легких при ИБЛ-ПМ/ДМ во многом неспецифичны. Морфологические признаки организующейся интерстициальной пневмонии (ОрИП) выявляются достаточно часто, идиопатическая, или криптогенная, форма острой интерстициальной пневмонии относится к редким состояниям. С другой стороны, ОрИП может развиваться при вирусных и бактериальных инфекциях. S. Prahalad в 2005 г. описал ребенка с ювенильной формой ДМ с длительно неразрешавшейся пневмонической инфильтрацией в легких. При морфологическом исследовании изменения в легких имели признаки ОрИП с элементами фибринозного воспаления.
ОрИП встречается как внепеченочное проявление хронических заболеваний печени [21], обнаруживается также при хронических воспалительных заболеваниях кишечника (язвенном колите, болезни Крона), миелопролиферативных заболеваниях, опухолях, болезни Шегрена, системных гранулематозах [22]. Много диагностических затруднений возникает при лекарственно-обусловленной ОрИП (вызванной приемом блеомицина, противовирусных препаратов, антибиотиков и т.д.), поскольку в этих случаях заболевание может имитировать опухолевое поражение легких, среднедолевой синдром [23]. Вместе с тем при ПМ/ДМ рентгенологические изменения в легких часто ошибочно трактуются как банальная пневмония, что влечет за собой избыточное назначение антибиотиков. Повышенный риск бактериальных осложнений вследствие аспирации при ПМ/ДМ как аргумент в пользу длительной терапии антибиотиками представляется несомненным, но показания для антибактериальной терапии, в особенности ex juvantbus, должны быть тщательно продуманы.
При ПМ/ДМ морфологические изменения типа ОрИП обнаруживаются у 30% больных и сочетаются с васкулитами и признаками выраженного ангиогенеза, склеротическими изменениями в стенках сосудов. Ремоделирование сосудистого русла легких во многом идентично наблюдаемому при других системных заболеваниях соединительной ткани, сопровождающихся легочной гипертензией, структурно-функциональные признаки которой представлены повреждением эндотелия легочных сосудов, усилением экспрессии адгезивных молекул, в культуре легочных фибробластов, полученных от таких больных, отмечается повышенная продукция факторов роста [24].
В жидкости бронхоальвеолярного лаважа (БАЛ) у больных ПМ/ДМ даже в отсутствие рентгенологических изменений в легких наблюдается некоторое увеличение уровня лимфоцитов. Для морфологически активного ИБЛ-ПМ/ДМ типичен нейтрофильно-лимфоцитарный состав БАЛ [25]. При типировании лимфоцитов выявляется гетерогенность лимфоцитарной популяции с преобладанием СД8+-фенотипов (I. Yamadori и соавт., 2001).
Прогноз больных ИБЛ-ПМ/ДМ
 Присоединение ИБЛ, несомненно, усугубляет прогноз больных с ПМ/ДМ. Продолжительность заболевания составляет в среднем 6 лет [21]. По данным госпиталя Mayo, 5-летняя выживаемость достигает 60% [26]. У больных с высокой активностью иммуновоспалительных реакций в легких, лабораторными признаками миопатии (повышение активности КФК, миоглобинурия) ответ на терапию и прогноз более благоприятные. Показано, что в наибольшей степени признаки морфологической активности воспаления в интерстиции легких (альвеолита) представлены у больных с низкой активностью КФК; рис. 2 (И.Б. Бондаренко, 2007).
Присоединение ИБЛ, несомненно, усугубляет прогноз больных с ПМ/ДМ. Продолжительность заболевания составляет в среднем 6 лет [21]. По данным госпиталя Mayo, 5-летняя выживаемость достигает 60% [26]. У больных с высокой активностью иммуновоспалительных реакций в легких, лабораторными признаками миопатии (повышение активности КФК, миоглобинурия) ответ на терапию и прогноз более благоприятные. Показано, что в наибольшей степени признаки морфологической активности воспаления в интерстиции легких (альвеолита) представлены у больных с низкой активностью КФК; рис. 2 (И.Б. Бондаренко, 2007).Среди новых прогностически значимых факторов следует отметить и сывороточный уровень цитокератинов 19, отражающий степень деструктивных изменений в эпителии бронхов.
По прогностической значимости при ИБЛ-ПМ/ДМ с интерстициальными поражениями легких конкурируют инфекционные осложнения [21]. Уточнить риск аспирации можно при помощи эндоскопических методов исследования или путем рентгеноконтрастных исследований пищевода. Следует отметить, что при ПМ/ДМ так же, как и при CREST-синдроме, наблюдаются рентгенологические признаки ахалазии пищевода и регургитация бариевой взвеси.
К терапии ИБЛ-ПМ/ДМ необходим комплексный подход с назначением препаратов, восстанавливающих дренажную функцию бронхов, разжижающих мокроту, а также физиотерапевтических процедур, направленных на восстановление подвижности грудной клетки [27].
Наибольший опыт в лечении ПМ/ДМ касается кортикостероидов. Убедительного подтверждения эффективности цитостатиков нет. Показанием к их назначению является тяжелое прогрессирующее течение болезни. Появление признаков пневмопатии при ПМ/ДМ также служит показанием к назначению цитостатиков. Развернутая картина легочного фиброза с формированием «сотового легкого» при ПМ/ДМ наблюдается редко.
В последние годы убедительный эффект получен от ингибиторов T-лимфоцитов [28]. Недавно небольшое рандомизированное открытое исследование показало возможное влияние внутривенных инфузий ингибиторов T-лимфоцитов на мышечную слабость у резистентных к лечению пациентов с ПМ или ДМ [29].
Хотя фактор некроза опухоли (ФНО) α может играть роль в патогенезе ПМ/ДМ, лечение пациентов анти-ФНО-α дало противоречивые результаты. Даже если некоторые авторы сообщили о возможной роли данных препаратов при ДМ [30], то другие исследования не подтвердили это наблюдение, и у некоторых пациентов состояние ухудшилось. Более того, некоторые авторы сообщили, что терапия анти-ФНО-α может вызывать миозит у пациентов с ревматоидным артритом, псориатическим артритом и псориазом. Таким образом, блокаторы ФНО-α обычно не рекомендуются взрослым пациентам с ПM, и их следует использовать только тогда, когда другие методы лечения неэффективны [31].
Отдельную проблему составляют формы ПМ/ДМ, развивающиеся при злокачественных опухолях. Как ДМ, так и ПМ связаны с повышенным риском злокачественных новообразований, но ДМ больше связан с любым типом рака, чем полимиозит. Несмотря на противоопухолевую терапию, выживаемость пациентов с онкоассоциированными злокачественными образованиями была очень низкой. Выживаемость в группе первичных ПМ и ДМ через 5 лет была значительно выше (100% и 100%) по сравнению с группой пациентов с онкоассоциированным миозитом, где выживаемость составила 15,4% для ПМ и 27,5% для ДМ. Хотя риск рака у пациентов с ПМ ниже, вероятность длительного выживания меньше. Что касается противомиозитной терапии, иммунодепрессанты у пациентов с онкоассоциированным миозитом применялись реже, чем у пациентов с простым миозитом. Несмотря на широко изученную связь между миозитом и раком, лучшая стратегия диагностики и лечения рака у пациентов с ПM отсутствует [32]
Тяжесть паранеопластического ПМ/ДМ не всегда определяется активностью опухолевого процесса. Опухоли, даже небольшие, могут становиться причиной яркой картины миопатии и кожных изменений. Высокая частота паранеопластических реакций с вовлечением легких и ПМ/ДМ наблюдается при опухолях
молочной железы, желудочно-кишечного тракта (B.B. Forster, 1990; H. Kondo, 2005). K.M. Kee и соавт. (2004 г.) наблюдали HCV-инфицированного больного с поражением кожи, миопатическим синдромом и изменениями в легких, очаговыми образованиями в печени. При обследовании выявлен высокий уровень альфа-фетопротеина, циркулирующих иммунных комплексов. Частота поражения легких ПМ/ДМ при опухолях молочной железы достигает 30% и во многих случаях предшествует развернутой стадии опухолевого процесса. Паранеопластический вариант поражения легких и ПМ/ДМ устойчиво сочетаются друг с другом, так что у больных в первую очередь следует предпринимать диагностические мероприятия, имеющие целью выявление наиболее часто встречающихся опухолей.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Бондаренко Инна Борисовна – канд. мед. наук, ассистент каф. внутренних, профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Inna B. Bondarenko – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University)
Пономарева Любовь Андреевна – студент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail:
liubaponomareva18@yandex.ru
Liubov A. Ponomareva – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: liubaponomareva18 @yandex.ru
Попова Елена Николаевна – д-р мед. наук, проф. каф. внутренних, профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru
Elena N. Popova – D. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru
Статья поступила в редакцию / The article received: 24.05.2021
Статья принята к печати / The article approved for publication: 27.05.2021
Список исп. литературыСкрыть список1. Shappley C, Paik JJ, Saketkoo LA. Myositis-Related Interstitial Lung Diseases: Diagnostic Features, Treatment, and Complications. Curr Treatm Opt Rheumatol 2019; 5 (1): 56–83. DOI: 10.1007/s40674-018-0110-6
2. Rosai J. GIST: An Update. Int J Surg Pathol 2003; 11 (3): 177–86. DOI: 10.1177/106689690301100304
3. Bahmer T, Romagnoli M, Girelli F et al. The use of auto-antibody testing in the evaluation of interstitial lung disease (ILD) – A practical approach for the pulmonologist. Respir Med 2016; 113: 80–92. DOI: 10.1016/j.rmed.2016.01.019
4. Witt LJ, Curran JJ, Strek ME. The Diagnosis and Treatment of Antisynthetase Syndrome. Clin Pulm Med 2016; 23 (5): 218–26. DOI: 10.1097/CPM.0000000000000171
5. Debray M-P, Borie R, Revel M-P et al. Interstitial lung disease in anti-synthetase syndrome: Initial and follow-up CT findings. Eur J Radiol 2015; 84: 516–23.
6. Noguchi E, Uruha A, Suzuki S et al. Skeletal Muscle involvement in Antisynthetase Syndrome. JAMA Neurol 2017; 74: 992–9. DOI: 10.1001/jamaNeurol.2017.0934
7. Alyan O, Ozdemir O, Geyik B, Demirkan D. Polymyositis Complicated with Complete Atrioventricular Block: A Case Report and Review of the Literature. Angiology 2003; 54 (6): 729–31. DOI: 10.1177/ 000331970305400615
8. Kagen LJ. Myoglobinemia and myoglobinuria in patients with myositis. Arthritis Rheum 1971; 14 (4): 457–64. DOI: 10.1002/art. 1780140405
9. Fudman EJ, Schnitzer TJ. Dermatomyositis without creatine kinase elevation. A poor prognostic sign. Am J Med 1986; 80 (2): 329–32.
10. Schwarz MI, Matthay RA, Sahn SA et al. Interstitial lung disease in polymyositis and dermatomyositis: analysis of six cases and review of the literature. Medicine (Baltimore) 1976; 55 (1): 89–104. DOI: 10.1097/00005792-197601000-00005. PMID: 1246203.
11. Ikezoe J, Takeuchi N, Kido S et al. Dynamic Range Control Processing of Digital Chest Images: A Clinical Evaluation. Acta Radiologica 1996; 37 (1P1): 107–15. DOI: 10.1177/02841851960371P121
12. Paspalaki PK, Mihailidou EP, Bitsori M et al. Polyomyositis and myocarditis associated with acquired toxoplasmosis in an immunocompetent girl. BMC Musculoskelet Disord 2001; 2: 8. DOI: 10.1186/1471-2474-2-8
13. Uruha A, Noguchi S, Hayashi YK et al. Hepatitis C virus infection in inclusion body myositis: A case-control study. Neurology 2016; 86 (3): 211–7. DOI: 10.1212/WNL.0000000000002291
14. Lloyd TE, Pinal-Fernandez I, Michelle EH et al. Overlapping features of polymyositis and inclusion body myositis in HIV-infected patients. Neurology 2017; 88 (15): 1454–60. DOI:10.1212/WNL. 0000000000003821
15. Courtney AE, C Doherty C, Herron B et al. Acute polymyositis following renal transplantation. Am J Transplant 2004; 4 (7): 1204–7. DOI: 10.1111/j.1600-6143.2004.00489.x. PMID: 15196084.
16. Mouthon L. Physiopathology of polymyositis and dermatomyositis, mechanism of action of intravenous immunoglobulins. Rev Med Interne 2004; 25 (Spec. 3): 10–2. PMID: 15842099.
17. Rider LG, Katz JD, Jones OY. Developments in the classification and treatment of the juvenile idiopathic inflammatory myopathies. Rheum Dis Clin North Am. 2013; 39 (4): 877–904. DOI: 10.1016/ j.rdc.2013.06.001
18. Li Y, Gao X, Li Y et al. Predictors and Mortality of Rapidly Progressive Interstitial Lung Disease in Patients With Idiopathic Inflammatory Myopathy: A Series of 474 Patients. Front Med (Lausanne) 2020; 7: 363. DOI: 10.3389/fmed.2020.00363
19. Бондаренко И.Б., Мухин Н.А., Попова Е.Н. и др. Поражение легких при полимиозите и дерматомиозите. Клиническая медицина. 1998; 2: 20–4.
[Bondarenko I.B., Mukhin N.A., Popova E.N. et al. Porazhenie legkikh pri polimiozite i dermatomiozite. Klinicheskaia meditsina. 1998; 2: 20–4 (in Russian).]
20. Schmidt J. Current Classification and Management of Inflammatory Myopathies. J Neuromuscul Dis 2018; 5 (2): 109–29. DOI:10.3233/JND-180308
21. Koksal D, Koksal AS, Gurakar A. Pulmonary Manifestations among Patients with Primary Biliary Cirrhosis. J Clin Transl Hepatol 2016; 4 (3): 258–62. DOI: 10.14218/JCTH.2016.00024
22. Tanida S, Takemura M, Mizoshita T et al. Organizing Pneumonia in a Patient with Quiescent Crohn's Disease. Case Rep Gastrointest Med 2016; 2016: 8129864. DOI: 10.1155/2016/8129864
23. Saketkoo LA, Ascherman DP, Cottin V et al. Interstitial Lung Disease in Idiopathic Inflammatory Myopathy. Curr Rheumatol Rev 2010; 6 (2): 108–19. DOI: 10.2174/157339710791330740
24. Tanida S, Takemura M, Mizoshita T et al. Organizing Pneumonia in a Patient with Quiescent Crohn's Disease. Case Rep Gastrointest Med 2016; 2016: 8129864. DOI: 10.1155/2016/8129864
25. Radzikowska E, Roży A, Jaguś P et al. Cryptogenic Organizing Pneumonia: IL-1β, IL-6, IL-8, and TGF- β1 Serum Concentrations and Response to Clarithromycin Treatment. Adv Exp Med Biol 2016; 911: 77–85. DOI: 10.1007/5584_2016_223
26. Fujisawa T, Hozumi H, Kono M et al. Prognostic factors for myositis-associated interstitial lung disease. PLoS One 2014; 9 (6): e98824. DOI:10.1371/journal.pone.0098824
27. Douglas WW, Tazelaar HD, Hartman TE et al. Polymyositis-dermatomyositis-associated interstitial lung disease. Am J Respir Crit Care Med 2001; 164 (7): 1182–5. DOI: 10.1164/ajrccm.164.7.2103110
28. Lega JC, Reynaud Q, Belot A et al. Idiopathic inflammatory myopathies and the lung. Eur Respir Rev 2015; 24 (136): 216–38. DOI: 10.1183/16000617.00002015
29. Barsotti S, Lundberg IE. Current Treatment for Myositis. Curr Treatm Opt Rheumatol 2018; 4 (4): 299–315. DOI: 10.1007/s40674-018-0106-2
30. Tjärnlund A, Tang Q, Wick C et al. Abatacept in the treatment of adult dermatomyositis and polymyositis: a randomised, phase IIb treatment delayed-start trial. Ann Rheum Dis 2018; 77: 55–62. DOI: 10.1136/annrheumdis-2017-211751
31. Muscle Study Group TMS A randomized, pilot trial of etanercept in dermatomyositis. Ann Neurol 2011; 70: 427–36. DOI: 10.1002/ana. 22477
32. András C, Bodoki L, Nagy-Vincze M et al. Retrospective Analysis of Cancer-Associated Myositis Patients over the Past 3 Decades in a Hungarian Myositis Cohort. Pathol Oncol Res 2020; 26: 1749–55. DOI: 10.1007/s12253-019-00756-4
33. Интерстициальные болезни легких. Под ред Н.А. Мухина. М.: Литтерра, 2017.
[Interstitsial'nye bolezni legkikh. Ed. N.A. Mukhin. Moscow: Litterra, 2017 (in Russian).]


