Клинический разбор в общей медицине №2 2023
Аннотация
Цель. Анализ взаимосвязей содержания кальция с различными клиническими и лабораторными параметрами у больных пожилого и старческого возраста с ишемической болезнью сердца (ИБС) на основании определения концентрации ионизированного кальция в крови и суточной экскреции кальция с мочой.
Материалы и методы. Данная работа представляла собой одномоментное («поперечное») исследование, в которое были включены 102 пациента (84 женщины и 18 мужчин), страдающих ИБС, в среднем возрасте 83,0±5,9 года. У всех больных анализировали содержание ионизированного кальция в крови (N 1,16–1,32 ммоль/л) и суточную экскрецию кальция с мочой (N 2,5–7,5 ммоль/л), а также определяли концентрацию 25-гидроксикальциферола [25(OH)-витамина D]. Наряду с этим оценивали минеральную плотность костной ткани поясничного отдела позвоночника и проксимального отдела бедренной кости с помощью двухэнергетической рентгеновской абсорбциометрии.
Результаты. Средняя суточная экскреция кальция с мочой составила 1,39±1,1 (0,17–7,44) ммоль/л. У 84,4% больных наблюдалось низкое содержание кальция в суточной моче. Средняя концентрация ионизированного кальция в крови достигала 1,26±0,05 (1,16–1,53) ммоль/л.
Гиперкальциемия отмечалась у 8,3% больных. Остеопороз в проксимальных отделах бедра зарегистрирован у 32,9%, в поясничном отделе позвоночника – у 18,1% пациентов. У больных с нормальным содержанием витамина D средняя экскреция кальция с мочой составила 1,77±1,2 ммоль/л, с дефицитом витамина D – 1,1±0,7 ммоль/л (p=0,07). У пациентов с низкой экскрецией кальция с мочой среднее содержание витамина D в крови достигало 18,7±7,7, с нормальной экскрецией – 28,5±10,8 нг/мл (p=0,007). Зарегистрированы достоверные обратные взаимосвязи между экскрецией кальция с мочой и креатинином (r=-0,36; p<0,0001). В группе пациентов с низкой экскрецией кальция с мочой средний уровень креатинина достигал 102,3±23,9 мкмоль/л, с нормальной экскрецией – 84,9±11,2 мкмоль/л (p<0,0001). Зарегистрированы достоверная прямая корреляция между суточной экскрецией кальция с мочой и скоростью клубочковой фильтрации, оцененной с помощью формулы CKD-EPI (r=0,39; р<0,0001), и обратная корреляция между содержанием кальция в крови и скоростью клубочковой фильтрации (r=-0,26; р=0,01). Установлена достоверная прямая взаимосвязь между содержанием ионизированного кальция в крови и уровнем креатинина (r=0,2; р=0,05) и мочевины (r=0,32; р=0,04).
Заключение. Результаты исследования демонстрируют низкий уровень экскреции кальция с мочой у больных пожилого, старческого возраста и долгожителей с ИБС. Уровень экскреции кальция с мочой обусловлен прежде всего нарушениями функций почек и низким содержанием витамина D.
Ключевые слова: кальций, витамин D, остеопороз, старческий возраст.
Для цитирования: Тополянская С.В., Елисеева Т.А., Турна О.И., Вакуленко О.Н., Романова М.А., Бубман Л.И., Гордеева О.В., Звягина И.Н., Д.С. Кошурников, Ваколюк Р.М., Лыткина К.А., Мелконян Г.Г., Рачина С.А., Дворецкий Л.И. Обмен кальция и остеопороз у больных ишемической болезнью сердца в пожилом и старческом возрасте. Клинический разбор в общей медицине. 2023; 4 (2): 6–13. DOI: 10.47407/kr2023.4.2.00197
Клинический разбор в общей медицине №2 2023
Обмен кальция и остеопороз у больных ишемической болезнью сердца в пожилом и старческом возрасте
Аннотация
Цель. Анализ взаимосвязей содержания кальция с различными клиническими и лабораторными параметрами у больных пожилого и старческого возраста с ишемической болезнью сердца (ИБС) на основании определения концентрации ионизированного кальция в крови и суточной экскреции кальция с мочой.
Материалы и методы. Данная работа представляла собой одномоментное («поперечное») исследование, в которое были включены 102 пациента (84 женщины и 18 мужчин), страдающих ИБС, в среднем возрасте 83,0±5,9 года. У всех больных анализировали содержание ионизированного кальция в крови (N 1,16–1,32 ммоль/л) и суточную экскрецию кальция с мочой (N 2,5–7,5 ммоль/л), а также определяли концентрацию 25-гидроксикальциферола [25(OH)-витамина D]. Наряду с этим оценивали минеральную плотность костной ткани поясничного отдела позвоночника и проксимального отдела бедренной кости с помощью двухэнергетической рентгеновской абсорбциометрии.
Результаты. Средняя суточная экскреция кальция с мочой составила 1,39±1,1 (0,17–7,44) ммоль/л. У 84,4% больных наблюдалось низкое содержание кальция в суточной моче. Средняя концентрация ионизированного кальция в крови достигала 1,26±0,05 (1,16–1,53) ммоль/л.
Гиперкальциемия отмечалась у 8,3% больных. Остеопороз в проксимальных отделах бедра зарегистрирован у 32,9%, в поясничном отделе позвоночника – у 18,1% пациентов. У больных с нормальным содержанием витамина D средняя экскреция кальция с мочой составила 1,77±1,2 ммоль/л, с дефицитом витамина D – 1,1±0,7 ммоль/л (p=0,07). У пациентов с низкой экскрецией кальция с мочой среднее содержание витамина D в крови достигало 18,7±7,7, с нормальной экскрецией – 28,5±10,8 нг/мл (p=0,007). Зарегистрированы достоверные обратные взаимосвязи между экскрецией кальция с мочой и креатинином (r=-0,36; p<0,0001). В группе пациентов с низкой экскрецией кальция с мочой средний уровень креатинина достигал 102,3±23,9 мкмоль/л, с нормальной экскрецией – 84,9±11,2 мкмоль/л (p<0,0001). Зарегистрированы достоверная прямая корреляция между суточной экскрецией кальция с мочой и скоростью клубочковой фильтрации, оцененной с помощью формулы CKD-EPI (r=0,39; р<0,0001), и обратная корреляция между содержанием кальция в крови и скоростью клубочковой фильтрации (r=-0,26; р=0,01). Установлена достоверная прямая взаимосвязь между содержанием ионизированного кальция в крови и уровнем креатинина (r=0,2; р=0,05) и мочевины (r=0,32; р=0,04).
Заключение. Результаты исследования демонстрируют низкий уровень экскреции кальция с мочой у больных пожилого, старческого возраста и долгожителей с ИБС. Уровень экскреции кальция с мочой обусловлен прежде всего нарушениями функций почек и низким содержанием витамина D.
Ключевые слова: кальций, витамин D, остеопороз, старческий возраст.
Для цитирования: Тополянская С.В., Елисеева Т.А., Турна О.И., Вакуленко О.Н., Романова М.А., Бубман Л.И., Гордеева О.В., Звягина И.Н., Д.С. Кошурников, Ваколюк Р.М., Лыткина К.А., Мелконян Г.Г., Рачина С.А., Дворецкий Л.И. Обмен кальция и остеопороз у больных ишемической болезнью сердца в пожилом и старческом возрасте. Клинический разбор в общей медицине. 2023; 4 (2): 6–13. DOI: 10.47407/kr2023.4.2.00197
Abstract
Aim. To analyze the relationship between calcium and various clinical and laboratory parameters in old and very old patients with coronary artery disease (CAD) based on the determination of the blood concentration of ionized calcium and daily excretion of calcium in the urine.
Materials and methods. This work was a cross-sectional study enrolled 102 patients (84 women and 18 men) with coronary artery disease with a mean age of 83.0±5.9 years. The blood level of ionized calcium (N 1.16–1.32 mmol/l), daily excretion of calcium in the urine (N 2.5–
7.5 mmol/l) and concentration of 25-hydroxycalciferol (25(OH)D) were determined in all patients. Along with this, the bone mineral density of the lumbar spine and proximal femur was analyzed using dual-energy x-ray absorptiometry.
Results. The mean daily excretion of calcium in the urine was 1.39±1.1 mmol/l (0.17–7.44 mmol/l). 84.4% of patients had low calcium content in daily urine. The mean blood concentration of ionized calcium was 1.26±0.05 mmol/l (1.16–1.53 mmol/l). Hypercalcemia was observed in 8.3% of patients. Osteoporosis in the proximal femur was registered in 32.9% of patients, in the lumbar spine – in 18.1% of patients. In patients with normal vitamin D level the mean urinary calcium excretion was 1.77±1.2 mmol/l, with vitamin D deficiency – 1.1±0.7 mmol/l (p=0.07). In patients with low calcium excretion in the urine, the mean blood concentration of vitamin D was 18.7±7.7, with normal excretion – 28.5±10.8 ng/ml (p=0.007). Significant inverse relationships were registered between urinary calcium excretion and creatinine (r=-0.36; p<0.0001). In the group of patients with low urinary calcium excretion the mean creatinine level reached 102.3±23.9 µmol/l, with normal excretion – 84.9±11.2 µmol/l (p<0.0001). There was a significant direct correlation between daily urinary calcium excretion and glomerular filtration rate, estimated using the CKD-EPI formula (r=0.39; p<0.0001) and an inverse correlation between blood calcium and GFR (r=-0.26; p=0.01). Significant direct relationship was registered between the blood concentration of ionized calcium and the creatinine (r=0.2; p=0.05) and urea (r=0.32; p=0.04) concentration.
Conclusion. The study results demonstrate a low level of calcium excretion in the urine in old and very old patients with coronary artery disease. The urine calcium excretion is primarily due to impaired renal function and low vitamin D concentration.
Keywords: calcium, vitamin D, osteoporosis, old age.
For citation: Topolyanskaya S.V., Eliseeva T.A., Turna O.I., Vakulenko O.N., Romanova M.A., Bubman L.I., Gordeeva O.V., Zvyagina I.N.,
Koshurnikov D.S., Vakolyuk R.M., Lytkina K.A., Melkonyan G.G., Rachina S.A., Dvoretsky L.I. Calcium and osteoporosis in old and very old
patients with coronary artery disease. Clinical review for general practice. 2023; 4 (2): 6–13. DOI: 10.47407/kr2023.4.2.00197
Введение
Одно из наиболее распространенных патологических состояний – остеопороз относят к так называемым возраст-ассоциированным заболеваниям, возникающим у лиц пожилого и старческого возраста. Остеопороз, как известно, характеризуется снижением минеральной плотности костной ткани (МПКТ) и нарушением ее микроархитектоники, что обусловливает хрупкость костей и повышенный риск переломов даже при отсутствии какой-либо травмы [1]. Установлено, что кальций играет важную роль в поддержании нормальной костной массы и структуры кости, а дефицит кальция, нередко возникающий в результате старения, может привести к остеопорозу и остеомаляции [2].
Кальций является одним из 5 наиболее распространенных и жизненно необходимых элементов в организме человека [2]. Он играет ключевую роль во многих физиологических процессах, включая минерализацию скелета, сокращение мышц, передачу нервных импульсов, свертывание крови и секрецию гормонов. Более 99% кальция в организме человека хранится в костной ткани в виде гидроксиапатита, который обеспечивает прочность скелета и является источником кальция для многочисленных кальций-опосредованных функций, а также для поддержания нормального уровня кальция в крови [3]. Приблизительно 50% кальция в сыворотке крови находится в форме ионизированного кальция, примерно 45% связывается с белками и прежде всего с альбумином, а остальные 5% – c кислотой с образованием солей кальция [4]. Ионизированный кальций представляет собой биологически активную форму кальция в крови, которая может проникать в клетки и активировать основные физиологические процессы [3, 4].
Гомеостаз кальция включает в себя метаболизм кальция в кишечнике, почках и костной ткани под влиянием в первую очередь паратиреоидного гормона и 1,25(OH)-витамина D. Старение, дефицит витамина D и резистентность к данному витамину негативно влияют на эти процессы [5]. Кальций поступает в организм с пищей и всасывается в кишечнике. 1,25(OH)-витамин D является основным гормоном, контролирующим абсорбцию кальция в кишечнике [6]. Кальций всасывается из кишечника с помощью активного механизма транспорта, зависящего от витамина D, а также путем пассивной диффузии. Механизм активного транспорта играет важную роль в гомеостазе кальция, так как поглощение кальция обратно пропорционально его поступлению, т.е. всасывание кальция увеличивается при снижении его потребления. У пожилых людей взаимосвязь между более низким поступлением кальция с пищей и его повышенной абсорбцией выражена меньше, вероятно, из-за сниженной продукции 1,25(OH)-витамина D и резистентности клеток кишечника к его воздействию [7].
 В случае если нормальная концентрация кальция в крови не может поддерживаться за счет всасывания кальция в кишечнике, 1,25(OH)-витамин D и паратиреоидный гормон способствуют высвобождению кальция из костной ткани и увеличивают его реабсорбцию в дистальных канальцах почки [2]. Почки являются важнейшим регуляторным органом экскреции кальция. Сывороточный кальций фильтруется на уровне клубочков, а затем почти полностью реабсорбируется, и только около 1–3% профильтровавшегося кальция выводится с мочой. Этот механизм регулируется паратиреоидным гормоном. В кости кальций связывается с волокнами соединительной ткани и высвобождается из этого места в результате ремоделирования кости. У здорового взрослого человека существует равновесие между двунаправленными потоками кальция из кости и в кость. Это равновесие нарушается либо в сторону резорбции кости при низком уровне циркулирующего ионизированного кальция, либо в сторону отложения кальция в костях [8].
В случае если нормальная концентрация кальция в крови не может поддерживаться за счет всасывания кальция в кишечнике, 1,25(OH)-витамин D и паратиреоидный гормон способствуют высвобождению кальция из костной ткани и увеличивают его реабсорбцию в дистальных канальцах почки [2]. Почки являются важнейшим регуляторным органом экскреции кальция. Сывороточный кальций фильтруется на уровне клубочков, а затем почти полностью реабсорбируется, и только около 1–3% профильтровавшегося кальция выводится с мочой. Этот механизм регулируется паратиреоидным гормоном. В кости кальций связывается с волокнами соединительной ткани и высвобождается из этого места в результате ремоделирования кости. У здорового взрослого человека существует равновесие между двунаправленными потоками кальция из кости и в кость. Это равновесие нарушается либо в сторону резорбции кости при низком уровне циркулирующего ионизированного кальция, либо в сторону отложения кальция в костях [8].
 В процессе старения происходят изменения многих факторов, участвующих в регуляции кальциевого гомеостаза. Так, наблюдается снижение всасывания кальция в кишечнике с возрастом, что приводит к вторичному гиперпаратиреозу и потере костной массы. Уменьшение всасывания кальция в кишечнике может быть связано со снижением содержания 1,25(OH)-витамина D,
В процессе старения происходят изменения многих факторов, участвующих в регуляции кальциевого гомеостаза. Так, наблюдается снижение всасывания кальция в кишечнике с возрастом, что приводит к вторичному гиперпаратиреозу и потере костной массы. Уменьшение всасывания кальция в кишечнике может быть связано со снижением содержания 1,25(OH)-витамина D,
а также с резистентностью слизистой кишечника к его воздействию. Помимо кишечника возрастные изменения происходят и в почках, что также влияет на кальциевый гомеостаз. С возрастом происходят снижение функции почек и постепенное снижение скорости клубочковой фильтрации (СКФ), которое коррелирует
со снижением уровня 1,25(OH)-витамина D в крови. Когда СКФ падает ниже 50 мл/мин, уровень 1,25(OH)2D в сыворотке снижается, так как снижается фракционная абсорбция кальция и наблюдается повышенный уровень паратиреоидного гормона в крови [7]. Хотя синтез паратиреоидного гормона по мере старения повышается, почечная продукция 1,25(OH)-витамина D в ответ на воздействие этого гормона с возрастом снижается. Также наблюдается возрастное снижение почечной экспрессии рецепторов витамина D, что сопровождается более низкой эффективностью реабсорбции кальция в почках [2]. Известно, что повышенная экскреция кальция с мочой может предрасполагать к остеопорозу, однако информации о взаимосвязи между экскрецией кальция с мочой и МПКТ у лиц пожилого и старческого возраста без клинически значимой нефропатии очень мало. Учитывая относительно немногочисленные и порой достаточно противоречивые литературные данные по обмену кальция в пожилом и старческом возрасте, нами была предпринята попытка проведения собственного исследования, основной целью которого был анализ взаимосвязей содержания кальция с различными клиническими и лабораторными параметрами у больных пожилого и старческого возраста с ишемической болезнью сердца (ИБС) на основании определения концентрации ионизированного кальция в крови и суточной экскреции кальция с мочой.
Материалы и методы
Данная работа была выполнена на клинической базе Госпиталя для ветеранов войн №3 (г. Москва) и представляла собой одномоментное («поперечное») исследование. В исследование включали больных пожилого и старческого возраста, а также долгожителей, госпитализированных с диагнозом ИБС. Для оценки состояния больных использовали стандартные методы обследования пациентов с ИБС. Кроме того, проводили комплексную гериатрическую оценку, включающую опросник «Возраст не помеха», шкалу базовой активности в повседневной жизни (индекс Бартела), шкалу оценки инструментальной деятельности в повседневной жизни (IADL) и шкалу падений Морсе.
У всех пациентов анализировали содержание ионизированного кальция в крови (N 1,16–1,32 ммоль/л) и суточную экскрецию кальция с мочой (N 2,5–7,5 ммоль/л). Кроме того, у всех больных определяли концентрацию 25-гидроксикальциферола [25(OH)D)]; уровень 25(OH)D<10 нг/мл расценивался как выраженный дефицит витамина D, 10–19 – дефицит, 20–29 – недостаточность, ≥30 нг/мл – норма. Оценивали также стандартные лабораторные показатели анализов крови и мочи. СКФ рассчитывали по формуле CKD-EPI. Наряду с этим анализировали МПКТ поясничного отдела позвоночника и проксимального отдела бедренной кости с помощью двухэнергетической рентгеновской абсорбциометрии.
Полученные данные анализировали с использованием программного обеспечения SPSS (версия 22.0). Для предоставления полученных данных использовали методы описательной статистики (среднее значение и стандартное отклонение – для количественных переменных; число и долю – для качественных переменных). При сравнении групп использовали непараметрические методы (критерий Манна–Уитни, критерий χ2 Пирсона); проводили корреляционный анализ с помощью критерия Спирмена.
Результаты
В исследование были включены 102 пациента. Средний возраст включенных в исследование больных достигал 83,0±5,9 года (70–97 лет); 14,7% были старше
90 лет. Клинико-демографическая характеристика больных представлена в таблице.
У всех включенных в исследование больных имелись признаки старческой астении. Среднее значение опросника «Возраст не помеха» составляло 5,0±0,5 балла, варьируя от 3 до 7 баллов. Показатели шкалы инструментальной активности в повседневной жизни (IADL) достигали в среднем 5,5±1,9 балла (с колебаниями от
2 до 8 баллов). Среднее значение шкалы базовой активности в повседневной жизни (Индекса Бартелa) составило 79,2±13,4 балла.
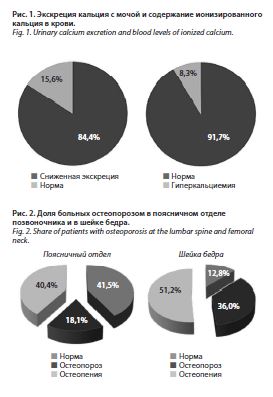
Средняя суточная экскреция кальция с мочой составила 1,39±1,1 ммоль/л с колебаниями от 0,17 до
7,44 ммоль/л. Лишь у 15,6% больных экскреция кальция была в пределах нормы, у 84,4% наблюдалось низкое содержание кальция в суточной моче (рис. 1). Средняя концентрация ионизированного кальция в крови достигала 1,26±0,05 ммоль/л, варьируя от 1,16 до 1,53 ммоль/л. Гипокальциемии не зарегистрировано ни в одном случае, гиперкальциемия наблюдалась у 8,3% больных. Гендерных различий по содержанию ионизированного кальция в крови и по суточной экскреции кальция с мочой обнаружено не было (р=0,83 и р=0,88 соответственно).
Среднее значение Т-критерия в поясничном отделе позвоночника достигало -1,0 SD, в проксимальном отделе левой бедренной кости – -1,6 SD, в шейке левого бедра – -1,8 SD, в проксимальном отделе правого бедра – -1,7 SD, в шейке правого бедра – -2,0 SD. Остеопороз в проксимальных отделах бедра зарегистрирован у 32,9% больных, остеопения – у 45,5%, нормальная МПКТ – у 21,6%. В поясничном отделе позвоночника остеопороз обнаружен у 18,1% пациентов, остеопения – у 40,4%, нормальная МПКТ – у 41,5% (рис. 2).
Среднее содержание витамина D в крови составило 20,8±11,7 нг/мл (с колебаниями от 5,0 до 61,5 нг/мл).
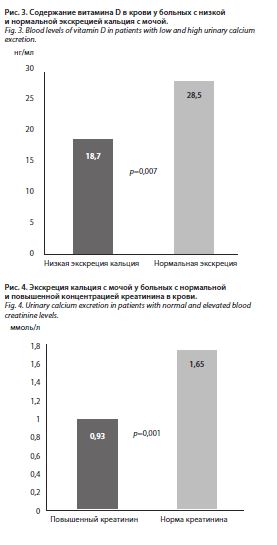
У больных с нормальной концентрацией витамина D средняя экскреция кальция с мочой достигала 1,77±
1,2 ммоль/л, с дефицитом витамина D – 1,1±0,7 ммоль/л (p=0,07). У пациентов с низкой экскрецией кальция с мочой средняя концентрация витамина D в крови была существенно меньше, чем у больных с нормальной его экскрецией (рис. 3). Установлены прямые корреляции между экскрецией кальция с мочой и содержанием витамина D в крови (r=0,31; p=0,004).
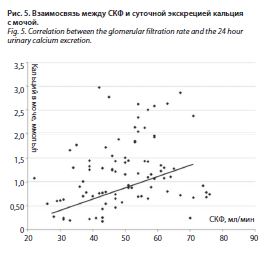
Зарегистрированы достоверные обратные взаимосвязи между экскрецией кальция с мочой и креатинином (r=-0,36; p<0,0001), а у больных с повышенным уровнем креатинина средняя суточная экскреция кальция с мочой была существенно меньше, чем в группе пациентов с нормальным креатинином, – 1,65±1,2 ммоль/л (p=0,001) (рис. 4). В группе больных с низкой экскрецией кальция с мочой средний уровень креатинина достигал 102,3±23,9 мкмоль/л, с нормальной экскрецией – 84,9±11,2 мкмоль/л (p<0,0001). Зарегистрированы достоверная прямая корреляция между суточной экскрецией кальция с мочой и СКФ, оцененной с помощью формулы CKD-EPI (r=0,39; p<0,0001); рис. 5, и обратная корреляция между содержанием кальция в крови и СКФ (r=-0,26; p=0,01). Средний возраст больных с низкой экскрецией кальция с мочой составлял 83,7±6,0 года,
с нормальной экскрецией – 80,1±5,1 года (p=0,03).
Никаких значимых корреляций между экскрецией кальция с мочой и показателями МПКТ в поясничном отделе позвоночника и в проксимальных отделах
бедренных костей не обнаружено (р=0,26–0,76).
Не установлено и достоверной взаимосвязи между содержанием ионизированного кальция в крови и экскрецией кальция с мочой (r=-0,08; p=0,44). Вместе с тем зарегистрирована достоверная прямая корреляция между содержанием ионизированного кальция в крови и уровнем креатинина (r=0,2; p=0,05) и мочевины (r=0,32; p=0,04) в крови. В группе больных с повышенным уровнем креатинина среднее содержание ионизированного кальция в крови составило 1,27±0,06 ммоль/л, с нормальным – 1,25±0,04 ммоль/л (р=0,04). Других значимых взаимосвязей между концентрацией ионизированного кальция в крови и различными клиническими и лабораторными параметрами не отмечено.
Обсуждение
Согласно доступным данным медицинской литературы, наше исследование представляет собой одно из немногочисленных исследований обмена кальция у больных пожилого и старческого возраста с ИБС. Полученные результаты свидетельствуют о частом обнаружении сниженной экскреции кальция с мочой в этой группе больных, лишь у 15,6% обследованных нами пациентов этот показатель был в пределах нормы.
По нашим данным, экскреция кальция с мочой связана прежде всего с функцией почек: зарегистрированы достоверные обратные взаимосвязи между экскрецией кальция с мочой и креатинином наряду с прямой корреляцией между суточной экскрецией кальция с мочой и СКФ. Аналогично в исследовании J. Taylor и соавт. с участием 5941 здоровых лиц в возрасте от 28 до 75 лет более низкая экскреция кальция с мочой была связана с более высоким риском развития хронической болезни почек (ХБП) в течение 10-летнего наблюдения [8]. В этой работе, как и в нашей, была обнаружена значимая прямая взаимосвязь между экскрецией кальция с мочой и расчетной СКФ, при этом увеличение экскреции кальция с мочой на каждый 1 ммоль ассоциировалось со снижением риска развития ХБП на 11% [8]. Однако в большинстве других исследований было показано, что патология канальцевого аппарата почек, приводящая не к гипокальциурии, а к гиперкальциурии, ведет к ускоренной потере почечной функции и нефрокальцинозу, что предполагает негативное влияние на почки повышенной экскреции кальция с мочой [8].
В крупном итальянском эпидемиологическом исследовании снижение СКФ также ассоциировалось с уменьшением экскреции кальция с мочой, при этом наблюдалась независимая взаимосвязь между СКФ и уровнем клубочковой фильтрации кальция, в то время как с канальцевой реабсорбцией кальция значимых корреляций обнаружено не было [9]. Как и в нашей работе, снижение экскреции кальция с мочой в этом исследовании было независимо связано с низким уровнем 1,25-дигидроксивитамина D в сыворотке, а не с гипокальциемией или высоким уровнем паратиреоидного гормона. На основании полученных результатов авторы этого исследования делают вывод о том, что уменьшение содержания кальция в моче у больных со сниженной функцией почек происходит из-за падения уровня кальция, отфильтрованного клубочками, а относительная гипокальциурия связана с более низким уровнем витамина D в сыворотке крови [9].
В исследовании J. Ramalho и соавт. у пациентов с ХБП экскреция кальция с мочой была напрямую связана с расчетной СКФ, 1,25(OH)-витамином D и содержанием кальция в крови [10]. Однако в нашем исследовании мы не обнаружили достоверной взаимосвязи межу экскрецией кальция с мочой и содержанием этого микроэлемента в крови.
У обследованных нами больных с низкой экскрецией кальция с мочой среднее содержание витамина D в крови было на 10 нг/мл ниже, чем у пациентов с нормальной экскрецией кальция. Установлены также прямые корреляции между экскрецией кальция с мочой и содержанием витамина D в крови. Можно предположить, что низкие концентрации 1,25(OH)-витамина D могут способствовать снижению содержания кальция в моче [9]. Хорошо известно, что кальцитриол влияет на метаболизм кальция в почках, однако его эффекты из-за влияния множества дополнительных факторов могут быть разными. Так, в различных исследованиях было показано, что кальцитриол может повышать, снижать или не оказывать никакого влияния на экскрецию кальция с мочой [11].
К сожалению, учитывая наблюдательный и одномоментный характер нашего исследования, невозможно определить точные механизмы взаимосвязи между низким уровнем почечной экскреции кальция и наличием ХБП. Теоретически можно предположить, что стимуляция синтеза паратиреоидного гормона в ответ на снижение концентрации кальция в крови может оказывать неблагоприятное воздействие на почки, приводя, например, к нефросклерозу. Однако в нашем исследовании не зарегистрировано ни одного случая гипокальциемии. Вместе с тем снижение почечной экскреции кальция может быть связано с гиперпаратиреозом, часто возникающим у лиц пожилого и старческого возраста. Известно, что паратиреоидный гормон стимулирует реабсорбцию ионов кальция в почках, что приводит к увеличению содержания этого микроэлемента в крови [11]. Однако по техническим причинам мы не смогли проанализировать уровень паратиреоидного гормона у наших больных. Можно предположить также, что низкая экскреция кальция с мочой лишь отражает снижение его поступления с пищей в связи с мальнутрицией, но, как уже сказано, в нашей группе больных не было ни одного случая гипокальциемии.
Нам не удалось установить каких-либо значимых взаимосвязей между показателями МПКТ и суточной экскрецией кальция с мочой. Аналогично в исследовании A. El-Husseini и соавт. у 132 больных остеопорозом не обнаружено достоверной взаимосвязи между показателями денситометрии и экскрецией кальция с мочой [12]. В этой работе, в отличие от нашей, не зарегистрировано достоверных взаимосвязей между функцией почек и суточной экскрецией кальция с мочой, но наблюдалась достоверная корреляция между фильтрацией кальция и его экскрецией с мочой, причем только у более молодых больных с высоким метаболизмом костной ткани [12].
В нашем исследовании зарегистрирована достоверная прямая взаимосвязь между содержанием ионизированного кальция в крови и уровнем креатинина и мочевины наряду с обратной корреляцией между содержанием кальция в крови и СКФ. В отличие от наших данных в японском исследовании с участием 600 больных найдена достоверная прямая взаимосвязь между кальцием в крови и расчетной СКФ [13]. При этом у пациентов с более низкой концентрацией кальция в крови наблюдался более высокий риск быстрого снижения СКФ, независимо от таких традиционных факторов риска, как ХБП, артериальная гипертензия, сахарный диабет и дислипидемия [13]. Напротив, в исследовании с участием больных первичным гиперпаратиреозом при сниженной СКФ отмечены более высокие уровни как общего, так и ионизированного кальция.
В этом исследовании содержание ионизированного кальция было ключевым предиктором повышения уровня цистатина С (аналогичного креатинину показателя азотовыделительной функции почек) [14].
Несмотря на ряд значимых данных, полученных в настоящем исследовании, в этой работе имеются некоторые ограничения. В отличие от большинства аналогичных исследований наша работа выполнена при участии особой популяции больных – лиц очень преклонного возраста, страдавших не только клинически значимыми сердечно-сосудистыми заболеваниями, но и множественной коморбидной патологией, которая могла повлиять на результаты данного исследования. К одному из ограничений нашего исследования относится также его одномоментный, а не проспективный характер, в связи с чем нельзя было изучить динамику показателей обмена кальция по мере дальнейшего старения больных и снижения показателей СКФ.
Заключение
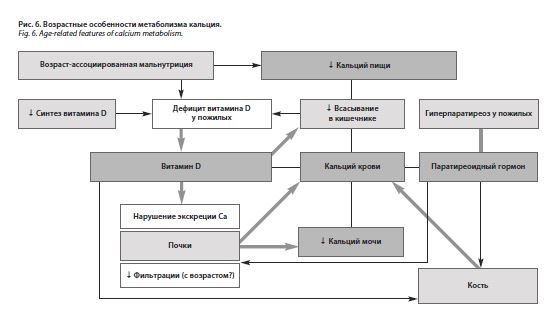
Результаты настоящего исследования позволяют говорить о низкой экскреции кальция с мочой у больных пожилого, старческого возраста и долгожителей с ИБС. Уровень экскреции кальция с мочой обусловлен прежде всего нарушениями функций почек и низким содержанием витамина D. Значимой взаимосвязи между концентрацией ионизированного кальция в крови и экскрецией кальция с мочой не зарегистрировано. Наряду с этим не обнаружено каких-либо достоверных корреляций между содержанием кальция в крови и в суточной моче, с одной стороны, и МПКТ – с другой. Целесообразно дальнейшее изучение роли кальция при различных патологических состояниях у лиц старческого возраста и долгожителей. Возможные взаимосвязи метаболизма кальция с другими параметрами представлены на рис. 6.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Источник финансирования: нет.
Тополянская Светлана Викторовна – канд. мед. наук, доц. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет), ГБУЗ «ГВВ №3». E-mail: sshekshina@yahoo.com; ORCID: 0000-0002-4131-8432
Svetlana V. Topolyanskaya – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University), War Veterans Hospital №3. E-mail: sshekshina@yahoo.com; ORCID: 0000-0002-4131-8432
Елисеева Татьяна Алексеевна – врач гериатрического отд-ния №6, ГБУЗ «ГВВ №3». E-mail: eliseet@yandex.ru;
ORCID: 0000-0002-6921-0589
Tatyana A. Eliseeva – Geriatrician, War Veterans Hospital №3. E-mail: eliseet@yandex.ru; ORCID: 0000-0002-6921-0589
Турна Ольга Игоревна – врач гериатрического отд-ния №6, ГБУЗ «ГВВ №3». E-mail: olga1414@mail.ru;
ORCID: 0000-0002-2933-7550
Olga I. Turna – Geriatrician, War Veterans Hospital №3. E-mail: olga1414@mail.ru; ORCID: 0000-0002-2933-7550
Романова Маргарита Анатольевна – зав. гериатрическим отд-нием №13, ГБУЗ «ГВВ №3». E-mail: mur1-3@mail.ru;
ORCID: 0000-0001-5351-1996
Margarita A. Romanova – Head of the Geriatrics Department №13, War Veterans Hospital №3. E-mail: mur1-3@mail.ru;
ORCID: 0000-0001-5351-1996
Вакуленко Ольга Николаевна – зав. гериатрическим отд-нием №6, ГБУЗ «ГВВ №3». E-mail: onv.62@mail.ru;
ORCID: 0000-0002-4139-5075
Olga N. Vakulenko – Head of the Geriatrics Department №6, War Veterans Hospital №3. E-mail: onv.62@mail.ru;
ORCID: 0000-0002-4139-5075
Бубман Леонид Игоревич – зав. хирургическим отд-нием №7, ГБУЗ «ГВВ №3». E-mail: bubmanleo@gmail.com;
ORCID: 0000-0002-4195-3188
Leonid I. Bubman – Head of the Department of Surgery №7, War Veterans Hospital №3. E-mail: bubmanleo@gmail.com;
ORCID: 0000-0002-4195-3188
Гордеева Оксана Валерьевна – врач неврологического отд-ния №12, ГБУЗ «ГВВ №3»
Oksana V. Gordeeva – Doctor, War Veterans Hospital №3
Aim. To analyze the relationship between calcium and various clinical and laboratory parameters in old and very old patients with coronary artery disease (CAD) based on the determination of the blood concentration of ionized calcium and daily excretion of calcium in the urine.
Materials and methods. This work was a cross-sectional study enrolled 102 patients (84 women and 18 men) with coronary artery disease with a mean age of 83.0±5.9 years. The blood level of ionized calcium (N 1.16–1.32 mmol/l), daily excretion of calcium in the urine (N 2.5–
7.5 mmol/l) and concentration of 25-hydroxycalciferol (25(OH)D) were determined in all patients. Along with this, the bone mineral density of the lumbar spine and proximal femur was analyzed using dual-energy x-ray absorptiometry.
Results. The mean daily excretion of calcium in the urine was 1.39±1.1 mmol/l (0.17–7.44 mmol/l). 84.4% of patients had low calcium content in daily urine. The mean blood concentration of ionized calcium was 1.26±0.05 mmol/l (1.16–1.53 mmol/l). Hypercalcemia was observed in 8.3% of patients. Osteoporosis in the proximal femur was registered in 32.9% of patients, in the lumbar spine – in 18.1% of patients. In patients with normal vitamin D level the mean urinary calcium excretion was 1.77±1.2 mmol/l, with vitamin D deficiency – 1.1±0.7 mmol/l (p=0.07). In patients with low calcium excretion in the urine, the mean blood concentration of vitamin D was 18.7±7.7, with normal excretion – 28.5±10.8 ng/ml (p=0.007). Significant inverse relationships were registered between urinary calcium excretion and creatinine (r=-0.36; p<0.0001). In the group of patients with low urinary calcium excretion the mean creatinine level reached 102.3±23.9 µmol/l, with normal excretion – 84.9±11.2 µmol/l (p<0.0001). There was a significant direct correlation between daily urinary calcium excretion and glomerular filtration rate, estimated using the CKD-EPI formula (r=0.39; p<0.0001) and an inverse correlation between blood calcium and GFR (r=-0.26; p=0.01). Significant direct relationship was registered between the blood concentration of ionized calcium and the creatinine (r=0.2; p=0.05) and urea (r=0.32; p=0.04) concentration.
Conclusion. The study results demonstrate a low level of calcium excretion in the urine in old and very old patients with coronary artery disease. The urine calcium excretion is primarily due to impaired renal function and low vitamin D concentration.
Keywords: calcium, vitamin D, osteoporosis, old age.
For citation: Topolyanskaya S.V., Eliseeva T.A., Turna O.I., Vakulenko O.N., Romanova M.A., Bubman L.I., Gordeeva O.V., Zvyagina I.N.,
Koshurnikov D.S., Vakolyuk R.M., Lytkina K.A., Melkonyan G.G., Rachina S.A., Dvoretsky L.I. Calcium and osteoporosis in old and very old
patients with coronary artery disease. Clinical review for general practice. 2023; 4 (2): 6–13. DOI: 10.47407/kr2023.4.2.00197
Введение
Одно из наиболее распространенных патологических состояний – остеопороз относят к так называемым возраст-ассоциированным заболеваниям, возникающим у лиц пожилого и старческого возраста. Остеопороз, как известно, характеризуется снижением минеральной плотности костной ткани (МПКТ) и нарушением ее микроархитектоники, что обусловливает хрупкость костей и повышенный риск переломов даже при отсутствии какой-либо травмы [1]. Установлено, что кальций играет важную роль в поддержании нормальной костной массы и структуры кости, а дефицит кальция, нередко возникающий в результате старения, может привести к остеопорозу и остеомаляции [2].
Кальций является одним из 5 наиболее распространенных и жизненно необходимых элементов в организме человека [2]. Он играет ключевую роль во многих физиологических процессах, включая минерализацию скелета, сокращение мышц, передачу нервных импульсов, свертывание крови и секрецию гормонов. Более 99% кальция в организме человека хранится в костной ткани в виде гидроксиапатита, который обеспечивает прочность скелета и является источником кальция для многочисленных кальций-опосредованных функций, а также для поддержания нормального уровня кальция в крови [3]. Приблизительно 50% кальция в сыворотке крови находится в форме ионизированного кальция, примерно 45% связывается с белками и прежде всего с альбумином, а остальные 5% – c кислотой с образованием солей кальция [4]. Ионизированный кальций представляет собой биологически активную форму кальция в крови, которая может проникать в клетки и активировать основные физиологические процессы [3, 4].
Гомеостаз кальция включает в себя метаболизм кальция в кишечнике, почках и костной ткани под влиянием в первую очередь паратиреоидного гормона и 1,25(OH)-витамина D. Старение, дефицит витамина D и резистентность к данному витамину негативно влияют на эти процессы [5]. Кальций поступает в организм с пищей и всасывается в кишечнике. 1,25(OH)-витамин D является основным гормоном, контролирующим абсорбцию кальция в кишечнике [6]. Кальций всасывается из кишечника с помощью активного механизма транспорта, зависящего от витамина D, а также путем пассивной диффузии. Механизм активного транспорта играет важную роль в гомеостазе кальция, так как поглощение кальция обратно пропорционально его поступлению, т.е. всасывание кальция увеличивается при снижении его потребления. У пожилых людей взаимосвязь между более низким поступлением кальция с пищей и его повышенной абсорбцией выражена меньше, вероятно, из-за сниженной продукции 1,25(OH)-витамина D и резистентности клеток кишечника к его воздействию [7].
а также с резистентностью слизистой кишечника к его воздействию. Помимо кишечника возрастные изменения происходят и в почках, что также влияет на кальциевый гомеостаз. С возрастом происходят снижение функции почек и постепенное снижение скорости клубочковой фильтрации (СКФ), которое коррелирует
со снижением уровня 1,25(OH)-витамина D в крови. Когда СКФ падает ниже 50 мл/мин, уровень 1,25(OH)2D в сыворотке снижается, так как снижается фракционная абсорбция кальция и наблюдается повышенный уровень паратиреоидного гормона в крови [7]. Хотя синтез паратиреоидного гормона по мере старения повышается, почечная продукция 1,25(OH)-витамина D в ответ на воздействие этого гормона с возрастом снижается. Также наблюдается возрастное снижение почечной экспрессии рецепторов витамина D, что сопровождается более низкой эффективностью реабсорбции кальция в почках [2]. Известно, что повышенная экскреция кальция с мочой может предрасполагать к остеопорозу, однако информации о взаимосвязи между экскрецией кальция с мочой и МПКТ у лиц пожилого и старческого возраста без клинически значимой нефропатии очень мало. Учитывая относительно немногочисленные и порой достаточно противоречивые литературные данные по обмену кальция в пожилом и старческом возрасте, нами была предпринята попытка проведения собственного исследования, основной целью которого был анализ взаимосвязей содержания кальция с различными клиническими и лабораторными параметрами у больных пожилого и старческого возраста с ишемической болезнью сердца (ИБС) на основании определения концентрации ионизированного кальция в крови и суточной экскреции кальция с мочой.
Материалы и методы
Данная работа была выполнена на клинической базе Госпиталя для ветеранов войн №3 (г. Москва) и представляла собой одномоментное («поперечное») исследование. В исследование включали больных пожилого и старческого возраста, а также долгожителей, госпитализированных с диагнозом ИБС. Для оценки состояния больных использовали стандартные методы обследования пациентов с ИБС. Кроме того, проводили комплексную гериатрическую оценку, включающую опросник «Возраст не помеха», шкалу базовой активности в повседневной жизни (индекс Бартела), шкалу оценки инструментальной деятельности в повседневной жизни (IADL) и шкалу падений Морсе.
У всех пациентов анализировали содержание ионизированного кальция в крови (N 1,16–1,32 ммоль/л) и суточную экскрецию кальция с мочой (N 2,5–7,5 ммоль/л). Кроме того, у всех больных определяли концентрацию 25-гидроксикальциферола [25(OH)D)]; уровень 25(OH)D<10 нг/мл расценивался как выраженный дефицит витамина D, 10–19 – дефицит, 20–29 – недостаточность, ≥30 нг/мл – норма. Оценивали также стандартные лабораторные показатели анализов крови и мочи. СКФ рассчитывали по формуле CKD-EPI. Наряду с этим анализировали МПКТ поясничного отдела позвоночника и проксимального отдела бедренной кости с помощью двухэнергетической рентгеновской абсорбциометрии.
Полученные данные анализировали с использованием программного обеспечения SPSS (версия 22.0). Для предоставления полученных данных использовали методы описательной статистики (среднее значение и стандартное отклонение – для количественных переменных; число и долю – для качественных переменных). При сравнении групп использовали непараметрические методы (критерий Манна–Уитни, критерий χ2 Пирсона); проводили корреляционный анализ с помощью критерия Спирмена.
Результаты
В исследование были включены 102 пациента. Средний возраст включенных в исследование больных достигал 83,0±5,9 года (70–97 лет); 14,7% были старше
90 лет. Клинико-демографическая характеристика больных представлена в таблице.
У всех включенных в исследование больных имелись признаки старческой астении. Среднее значение опросника «Возраст не помеха» составляло 5,0±0,5 балла, варьируя от 3 до 7 баллов. Показатели шкалы инструментальной активности в повседневной жизни (IADL) достигали в среднем 5,5±1,9 балла (с колебаниями от
2 до 8 баллов). Среднее значение шкалы базовой активности в повседневной жизни (Индекса Бартелa) составило 79,2±13,4 балла.
Средняя суточная экскреция кальция с мочой составила 1,39±1,1 ммоль/л с колебаниями от 0,17 до
7,44 ммоль/л. Лишь у 15,6% больных экскреция кальция была в пределах нормы, у 84,4% наблюдалось низкое содержание кальция в суточной моче (рис. 1). Средняя концентрация ионизированного кальция в крови достигала 1,26±0,05 ммоль/л, варьируя от 1,16 до 1,53 ммоль/л. Гипокальциемии не зарегистрировано ни в одном случае, гиперкальциемия наблюдалась у 8,3% больных. Гендерных различий по содержанию ионизированного кальция в крови и по суточной экскреции кальция с мочой обнаружено не было (р=0,83 и р=0,88 соответственно).
Среднее значение Т-критерия в поясничном отделе позвоночника достигало -1,0 SD, в проксимальном отделе левой бедренной кости – -1,6 SD, в шейке левого бедра – -1,8 SD, в проксимальном отделе правого бедра – -1,7 SD, в шейке правого бедра – -2,0 SD. Остеопороз в проксимальных отделах бедра зарегистрирован у 32,9% больных, остеопения – у 45,5%, нормальная МПКТ – у 21,6%. В поясничном отделе позвоночника остеопороз обнаружен у 18,1% пациентов, остеопения – у 40,4%, нормальная МПКТ – у 41,5% (рис. 2).
Среднее содержание витамина D в крови составило 20,8±11,7 нг/мл (с колебаниями от 5,0 до 61,5 нг/мл).
У больных с нормальной концентрацией витамина D средняя экскреция кальция с мочой достигала 1,77±
1,2 ммоль/л, с дефицитом витамина D – 1,1±0,7 ммоль/л (p=0,07). У пациентов с низкой экскрецией кальция с мочой средняя концентрация витамина D в крови была существенно меньше, чем у больных с нормальной его экскрецией (рис. 3). Установлены прямые корреляции между экскрецией кальция с мочой и содержанием витамина D в крови (r=0,31; p=0,004).
Зарегистрированы достоверные обратные взаимосвязи между экскрецией кальция с мочой и креатинином (r=-0,36; p<0,0001), а у больных с повышенным уровнем креатинина средняя суточная экскреция кальция с мочой была существенно меньше, чем в группе пациентов с нормальным креатинином, – 1,65±1,2 ммоль/л (p=0,001) (рис. 4). В группе больных с низкой экскрецией кальция с мочой средний уровень креатинина достигал 102,3±23,9 мкмоль/л, с нормальной экскрецией – 84,9±11,2 мкмоль/л (p<0,0001). Зарегистрированы достоверная прямая корреляция между суточной экскрецией кальция с мочой и СКФ, оцененной с помощью формулы CKD-EPI (r=0,39; p<0,0001); рис. 5, и обратная корреляция между содержанием кальция в крови и СКФ (r=-0,26; p=0,01). Средний возраст больных с низкой экскрецией кальция с мочой составлял 83,7±6,0 года,
с нормальной экскрецией – 80,1±5,1 года (p=0,03).
Никаких значимых корреляций между экскрецией кальция с мочой и показателями МПКТ в поясничном отделе позвоночника и в проксимальных отделах
бедренных костей не обнаружено (р=0,26–0,76).
Не установлено и достоверной взаимосвязи между содержанием ионизированного кальция в крови и экскрецией кальция с мочой (r=-0,08; p=0,44). Вместе с тем зарегистрирована достоверная прямая корреляция между содержанием ионизированного кальция в крови и уровнем креатинина (r=0,2; p=0,05) и мочевины (r=0,32; p=0,04) в крови. В группе больных с повышенным уровнем креатинина среднее содержание ионизированного кальция в крови составило 1,27±0,06 ммоль/л, с нормальным – 1,25±0,04 ммоль/л (р=0,04). Других значимых взаимосвязей между концентрацией ионизированного кальция в крови и различными клиническими и лабораторными параметрами не отмечено.
Обсуждение
Согласно доступным данным медицинской литературы, наше исследование представляет собой одно из немногочисленных исследований обмена кальция у больных пожилого и старческого возраста с ИБС. Полученные результаты свидетельствуют о частом обнаружении сниженной экскреции кальция с мочой в этой группе больных, лишь у 15,6% обследованных нами пациентов этот показатель был в пределах нормы.
По нашим данным, экскреция кальция с мочой связана прежде всего с функцией почек: зарегистрированы достоверные обратные взаимосвязи между экскрецией кальция с мочой и креатинином наряду с прямой корреляцией между суточной экскрецией кальция с мочой и СКФ. Аналогично в исследовании J. Taylor и соавт. с участием 5941 здоровых лиц в возрасте от 28 до 75 лет более низкая экскреция кальция с мочой была связана с более высоким риском развития хронической болезни почек (ХБП) в течение 10-летнего наблюдения [8]. В этой работе, как и в нашей, была обнаружена значимая прямая взаимосвязь между экскрецией кальция с мочой и расчетной СКФ, при этом увеличение экскреции кальция с мочой на каждый 1 ммоль ассоциировалось со снижением риска развития ХБП на 11% [8]. Однако в большинстве других исследований было показано, что патология канальцевого аппарата почек, приводящая не к гипокальциурии, а к гиперкальциурии, ведет к ускоренной потере почечной функции и нефрокальцинозу, что предполагает негативное влияние на почки повышенной экскреции кальция с мочой [8].
В крупном итальянском эпидемиологическом исследовании снижение СКФ также ассоциировалось с уменьшением экскреции кальция с мочой, при этом наблюдалась независимая взаимосвязь между СКФ и уровнем клубочковой фильтрации кальция, в то время как с канальцевой реабсорбцией кальция значимых корреляций обнаружено не было [9]. Как и в нашей работе, снижение экскреции кальция с мочой в этом исследовании было независимо связано с низким уровнем 1,25-дигидроксивитамина D в сыворотке, а не с гипокальциемией или высоким уровнем паратиреоидного гормона. На основании полученных результатов авторы этого исследования делают вывод о том, что уменьшение содержания кальция в моче у больных со сниженной функцией почек происходит из-за падения уровня кальция, отфильтрованного клубочками, а относительная гипокальциурия связана с более низким уровнем витамина D в сыворотке крови [9].
В исследовании J. Ramalho и соавт. у пациентов с ХБП экскреция кальция с мочой была напрямую связана с расчетной СКФ, 1,25(OH)-витамином D и содержанием кальция в крови [10]. Однако в нашем исследовании мы не обнаружили достоверной взаимосвязи межу экскрецией кальция с мочой и содержанием этого микроэлемента в крови.
У обследованных нами больных с низкой экскрецией кальция с мочой среднее содержание витамина D в крови было на 10 нг/мл ниже, чем у пациентов с нормальной экскрецией кальция. Установлены также прямые корреляции между экскрецией кальция с мочой и содержанием витамина D в крови. Можно предположить, что низкие концентрации 1,25(OH)-витамина D могут способствовать снижению содержания кальция в моче [9]. Хорошо известно, что кальцитриол влияет на метаболизм кальция в почках, однако его эффекты из-за влияния множества дополнительных факторов могут быть разными. Так, в различных исследованиях было показано, что кальцитриол может повышать, снижать или не оказывать никакого влияния на экскрецию кальция с мочой [11].
К сожалению, учитывая наблюдательный и одномоментный характер нашего исследования, невозможно определить точные механизмы взаимосвязи между низким уровнем почечной экскреции кальция и наличием ХБП. Теоретически можно предположить, что стимуляция синтеза паратиреоидного гормона в ответ на снижение концентрации кальция в крови может оказывать неблагоприятное воздействие на почки, приводя, например, к нефросклерозу. Однако в нашем исследовании не зарегистрировано ни одного случая гипокальциемии. Вместе с тем снижение почечной экскреции кальция может быть связано с гиперпаратиреозом, часто возникающим у лиц пожилого и старческого возраста. Известно, что паратиреоидный гормон стимулирует реабсорбцию ионов кальция в почках, что приводит к увеличению содержания этого микроэлемента в крови [11]. Однако по техническим причинам мы не смогли проанализировать уровень паратиреоидного гормона у наших больных. Можно предположить также, что низкая экскреция кальция с мочой лишь отражает снижение его поступления с пищей в связи с мальнутрицией, но, как уже сказано, в нашей группе больных не было ни одного случая гипокальциемии.
Нам не удалось установить каких-либо значимых взаимосвязей между показателями МПКТ и суточной экскрецией кальция с мочой. Аналогично в исследовании A. El-Husseini и соавт. у 132 больных остеопорозом не обнаружено достоверной взаимосвязи между показателями денситометрии и экскрецией кальция с мочой [12]. В этой работе, в отличие от нашей, не зарегистрировано достоверных взаимосвязей между функцией почек и суточной экскрецией кальция с мочой, но наблюдалась достоверная корреляция между фильтрацией кальция и его экскрецией с мочой, причем только у более молодых больных с высоким метаболизмом костной ткани [12].
В нашем исследовании зарегистрирована достоверная прямая взаимосвязь между содержанием ионизированного кальция в крови и уровнем креатинина и мочевины наряду с обратной корреляцией между содержанием кальция в крови и СКФ. В отличие от наших данных в японском исследовании с участием 600 больных найдена достоверная прямая взаимосвязь между кальцием в крови и расчетной СКФ [13]. При этом у пациентов с более низкой концентрацией кальция в крови наблюдался более высокий риск быстрого снижения СКФ, независимо от таких традиционных факторов риска, как ХБП, артериальная гипертензия, сахарный диабет и дислипидемия [13]. Напротив, в исследовании с участием больных первичным гиперпаратиреозом при сниженной СКФ отмечены более высокие уровни как общего, так и ионизированного кальция.
В этом исследовании содержание ионизированного кальция было ключевым предиктором повышения уровня цистатина С (аналогичного креатинину показателя азотовыделительной функции почек) [14].
Несмотря на ряд значимых данных, полученных в настоящем исследовании, в этой работе имеются некоторые ограничения. В отличие от большинства аналогичных исследований наша работа выполнена при участии особой популяции больных – лиц очень преклонного возраста, страдавших не только клинически значимыми сердечно-сосудистыми заболеваниями, но и множественной коморбидной патологией, которая могла повлиять на результаты данного исследования. К одному из ограничений нашего исследования относится также его одномоментный, а не проспективный характер, в связи с чем нельзя было изучить динамику показателей обмена кальция по мере дальнейшего старения больных и снижения показателей СКФ.
Заключение
Результаты настоящего исследования позволяют говорить о низкой экскреции кальция с мочой у больных пожилого, старческого возраста и долгожителей с ИБС. Уровень экскреции кальция с мочой обусловлен прежде всего нарушениями функций почек и низким содержанием витамина D. Значимой взаимосвязи между концентрацией ионизированного кальция в крови и экскрецией кальция с мочой не зарегистрировано. Наряду с этим не обнаружено каких-либо достоверных корреляций между содержанием кальция в крови и в суточной моче, с одной стороны, и МПКТ – с другой. Целесообразно дальнейшее изучение роли кальция при различных патологических состояниях у лиц старческого возраста и долгожителей. Возможные взаимосвязи метаболизма кальция с другими параметрами представлены на рис. 6.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Источник финансирования: нет.
Тополянская Светлана Викторовна – канд. мед. наук, доц. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет), ГБУЗ «ГВВ №3». E-mail: sshekshina@yahoo.com; ORCID: 0000-0002-4131-8432
Svetlana V. Topolyanskaya – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University), War Veterans Hospital №3. E-mail: sshekshina@yahoo.com; ORCID: 0000-0002-4131-8432
Елисеева Татьяна Алексеевна – врач гериатрического отд-ния №6, ГБУЗ «ГВВ №3». E-mail: eliseet@yandex.ru;
ORCID: 0000-0002-6921-0589
Tatyana A. Eliseeva – Geriatrician, War Veterans Hospital №3. E-mail: eliseet@yandex.ru; ORCID: 0000-0002-6921-0589
Турна Ольга Игоревна – врач гериатрического отд-ния №6, ГБУЗ «ГВВ №3». E-mail: olga1414@mail.ru;
ORCID: 0000-0002-2933-7550
Olga I. Turna – Geriatrician, War Veterans Hospital №3. E-mail: olga1414@mail.ru; ORCID: 0000-0002-2933-7550
Романова Маргарита Анатольевна – зав. гериатрическим отд-нием №13, ГБУЗ «ГВВ №3». E-mail: mur1-3@mail.ru;
ORCID: 0000-0001-5351-1996
Margarita A. Romanova – Head of the Geriatrics Department №13, War Veterans Hospital №3. E-mail: mur1-3@mail.ru;
ORCID: 0000-0001-5351-1996
Вакуленко Ольга Николаевна – зав. гериатрическим отд-нием №6, ГБУЗ «ГВВ №3». E-mail: onv.62@mail.ru;
ORCID: 0000-0002-4139-5075
Olga N. Vakulenko – Head of the Geriatrics Department №6, War Veterans Hospital №3. E-mail: onv.62@mail.ru;
ORCID: 0000-0002-4139-5075
Бубман Леонид Игоревич – зав. хирургическим отд-нием №7, ГБУЗ «ГВВ №3». E-mail: bubmanleo@gmail.com;
ORCID: 0000-0002-4195-3188
Leonid I. Bubman – Head of the Department of Surgery №7, War Veterans Hospital №3. E-mail: bubmanleo@gmail.com;
ORCID: 0000-0002-4195-3188
Гордеева Оксана Валерьевна – врач неврологического отд-ния №12, ГБУЗ «ГВВ №3»
Oksana V. Gordeeva – Doctor, War Veterans Hospital №3
15 мая 2023
Количество просмотров: 847

