Клинический разбор в общей медицине №2 2023
Клинический разбор в общей медицине №2 2023
Малоиммунный АНЦА-ассоциированный гломерулонефрит. Клиническое наблюдение
Аннотация
Описана больная с экстракапиллярным малоиммунным, АНЦА-ассоциированным гломерулонефритом с наличием антител к миелопероксидазе и диализпотребной почечной недостаточностью. При компьютерной томографии придаточных пазух выявлено утолщение слизистой верхнечелюстной пазухи. Пульс-терапия глюкокортикостероидами и циклофосфамидом способствовала снижению содержания антител к миелопероксидазе и улучшению азотовыделительной функции почек.
Ключевые слова: быстропрогрессирующий гломерулонефрит, малоиммунный гломерулонефрит, диффузный экстракапиллярный гломерулонефрит, АНЦА-ассоциированный гломерулонефрит.
Для цитирования: Дворецкий Л.И., Кривушкин С.А., Сидорук Н.А., Столяревич Е.С., Колендо С.Е., Ваколюк Р.М., Папко К.С. Малоиммунный АНЦА-ассоциированный гломерулонефрит. Клиническое наблюдение. Клинический разбор в общей медицине. 2023; 4 (2): 31–35. DOI: 10.47407/kr2023.4.2.00201
Описана больная с экстракапиллярным малоиммунным, АНЦА-ассоциированным гломерулонефритом с наличием антител к миелопероксидазе и диализпотребной почечной недостаточностью. При компьютерной томографии придаточных пазух выявлено утолщение слизистой верхнечелюстной пазухи. Пульс-терапия глюкокортикостероидами и циклофосфамидом способствовала снижению содержания антител к миелопероксидазе и улучшению азотовыделительной функции почек.
Ключевые слова: быстропрогрессирующий гломерулонефрит, малоиммунный гломерулонефрит, диффузный экстракапиллярный гломерулонефрит, АНЦА-ассоциированный гломерулонефрит.
Для цитирования: Дворецкий Л.И., Кривушкин С.А., Сидорук Н.А., Столяревич Е.С., Колендо С.Е., Ваколюк Р.М., Папко К.С. Малоиммунный АНЦА-ассоциированный гломерулонефрит. Клиническое наблюдение. Клинический разбор в общей медицине. 2023; 4 (2): 31–35. DOI: 10.47407/kr2023.4.2.00201
Abstract
The female patient with extracapillary pauci-immune ANCA associated glomerulonephritis having antibodies against myeloperoxidase and dialysis-requiring renal failure is described. The computed tomography revealed the mucous membrane thickening in the maxillary sinus. The pulse dose glucocorticosteroid and cyclophosphamide therapy contributed to the decrease in the levels of antibodies against myeloperoxidase and improvement of the nitrogen excretion function of the kidneys.
Keywords: rapidly progressive glomerulonephritis, pauci-immune glomerulonephritis, diffuse extracapillary glomerulonephritis, ANCA associated glomerulonephritis.
For citation: Dvoretsky L.I., Krivushkin S.A., Sidoruk N.A., Stoliarevich E.S., Kolendo S.E., Vakolyuk R.M., Papko K.S. Pauci-immune ANCA associated glomerulonephritis. Clinical case. Clinical review for general practice. 2023; 4 (2): 31–35. DOI: 10.47407/kr2023.4.2.00201
Введение
Малоиммунный гломерулонефрит (МИГН) является одним из иммунопатогенетических типов быстропрогрессирующего гломерулонефрита (БПГН) [1], который характеризуется клиническими признаками остронефритического синдрома с прогрессирующей почечной недостаточностью (удвоение содержания креатинина в срок 3 мес) и морфологической картиной экстракапиллярного гломерулонефрита. Частота МИГН в европейской популяции составляет 1–2/100 тыс. с тенденцией к росту заболеваемости за последнее время [2]. В зависимости от преимущественного механизма повреждения, клинической картины и лабораторных показателей выделяют 5 иммунопатогенетических типов БПГН [3]. Основными критериями, определяющими каждый из типов, являются данные иммунофлуоресцентного исследования, соответствующие повреждающему фактору, определяемому в сыворотке: антитела к базальной мембране клубочков (БМК), иммунные комплексы (ИК), антинейтрофильные цитоплазматические антитела (АНЦА). При МИГН, наиболее распространенном иммунопатогенетическом типе (50%), отсутствуют ИК и антитела к БМК, чему соответствует негативный результат иммунофлуоресцентного исследования. Характерной морфологической особенностью всех вариантов БПГН считается наличие клеточных, фиброзно-клеточных или фиброзных полулуний [4]. Другим фактором, определяющим особенности клинической картины, является тип циркулирующих антител – миелопероксидаза (МПО) или пероксидаза 3 (Пр3), которые определяются примерно у 90% пациентов с МИГН (АНЦА-ассоциированный васкулит). При гранулематозе с полиангиитом в 65–75% случаев выявляются Пр3-АНЦА, при микроскопическом полиангиите и эозинофильном гранулематозе с полиангиитом преобладают МПО-АНЦА, выявляемые в 60 и 40% случаев соответственно. В большинстве случаев МИГН является проявлением системного васкулита, но может быть локально почечным.
В 2010 г. была предложена классификация морфологических изменений при АНЦА-ассоциированных васкулитах, выделяющая 4 варианта поражения: фокальный (более 50% клубочков без полулуний), экстракапиллярный (более 50% клубочков с клеточными либо фиброзно-клеточными полулуниями), склерозирующий (более 50% клубочков полностью склерозированы) и смешанный [5]. Подобное разделение на классы позволяет значительно точнее оценить прогноз и определить объем необходимой терапии.
Под нашим наблюдением находится больная с МИГН. Приводим клиническое наблюдение.
Клиническое наблюдение
Больная И., 61 год, поступила в ГКБ им. С.С. Юдина с жалобами на слабость, снижение аппетита, периодическую тошноту, повышение цифр артериального давления (АД). По данным анамнеза, около 15 лет страдает артериальной гипертензией с максимальным подъемом АД до 200/100 мм рт. ст., адаптирована к 130/90 мм рт. ст. В анамнезе 6 самостоятельных родов. Во время последней беременности обнаруживался белок в моче, отмечались отеки нижних конечностей, регрессировавшие после родоразрешения. В течение последнего месяца стала отмечать нарастание слабости, снижение аппетита, периодическую тошноту, повышение цифр АД. При амбулаторном обследовании выявлено повышение показателей креатинина до 500 мкмоль/л, в связи с чем больная госпитализирована.
При осмотре состояние средней тяжести. Сознание ясное. Конституция – гиперстенический тип. Питание повышенное. Кожные покровы обычной окраски. Костно-мышечная система без особенностей. Частота дыхания – 16/мин. Дыхание везикулярное, хрипов и шума трения плевры нет. АД – 130/80 мм рт. ст.; частота сердечных сокращений – 78/мин; Тоны сердца звонкие, ритмичные, шумы не выслушиваются. Живот при пальпации: мягкий, безболезненный. Печень и селезенка не увеличены. Область почек не изменена. Симптом Пастернацкого отрицательный с обеих сторон. Мочеиспускание редкое, безболезненное.
Общий анализ крови: Нb – 111 г/л, лейкоцитарная формула без особенностей, СОЭ – 69 мм/ч. Биохимический анализ крови: креатинин – 500 мкмоль/л, мочевина – 32 ммоль/л, калий – 6,2 ммоль/л. Общий анализ мочи: белок – 1 г/л, с активным мочевым осадком.
Компьютерная томография (КТ) органов грудной клетки: инфильтративных изменений не выявлено. На серии КТ придаточных пазух носа отмечается утолщение слизистой по нижней стенке правой верхнечелюстной пазухи до 20 мм, пневматизация других придаточных пазух не нарушена. Ультразвуковое исследование почек: правая – 112×63 мм, конкременты до 10 мм, левая – 116×64 мм, в нижнем сегменте округлая анэхогенная структура 67×74 мм, в центральном сегменте аналогичная – 24 мм, конкременты 3–5, паренхима – 19 мм, чашечно-лоханочные системы не расширены.
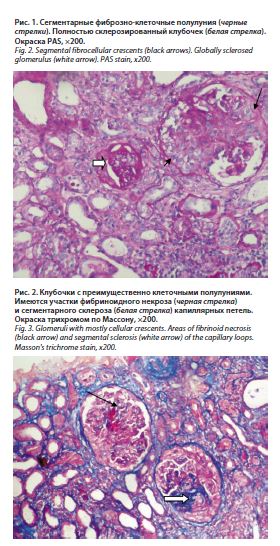
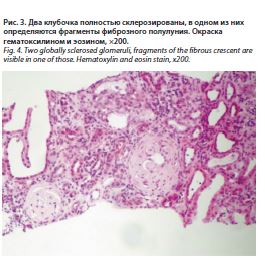 В связи с отрицательной динамикой показателей азотемии проведена имплантация временного центрального венозного катетера с последующей инициацией заместительной почечной терапии (ЗПТ). Переносимость сеансов ЗПТ удовлетворительная, гемодинамически больная была стабильна и отметила улучшение общего самочувствия. С согласия пациентки проведена пункционная нефробиопсия. По данным гистологического исследования биоптата выявлена морфологическая картина экстракапиллярного гломерулонефрита (рис. 1–3).
В связи с отрицательной динамикой показателей азотемии проведена имплантация временного центрального венозного катетера с последующей инициацией заместительной почечной терапии (ЗПТ). Переносимость сеансов ЗПТ удовлетворительная, гемодинамически больная была стабильна и отметила улучшение общего самочувствия. С согласия пациентки проведена пункционная нефробиопсия. По данным гистологического исследования биоптата выявлена морфологическая картина экстракапиллярного гломерулонефрита (рис. 1–3).
Световая микроскопия: (окраски: гематоксилином и эозином, ШИК-реакция, трихром по Массону). В препарате 16 клубочков, 8 из которых полностью склерозированы, еще один выглядит ишемизированным. Во всех оставшихся клубочках определяются сегментарные (4) и циркулярные (3) клеточные (4) и фиброзно-клеточные полулуния. Сохранные стенки капиллярных петель не утолщены, одноконтурные. Отек и формирующийся диффузно-очаговый фиброз интерстиция с сопутствующей атрофией канальцев, занимающие около 30–40% паренхимы. Диффузно-очаговая, достаточно плотная интерстициальная инфильтрация лимфоцитами в зонах склероза и перигломерулярно. Дистрофия канальцевого эпителия. Артерии – артериосклероз. Артериолы – без особенностей.
Иммунофлуоресценция: IgG – следы, IgM – негативно, IgA – негативно, C3 – негативно, C1q – негативно, Kappa – следы, Lambda – следы, фибриноген – негативно.
Заключение: экстракапиллярный малоиммунный гломерулонефрит с 88% клеточных и фиброзно-клеточных полулуний. Учитывая данные иммунофлуоресценции, морфологическая картина характерна для ANCA-ассоциированного васкулита.
Данные серологического исследования: антитела к МПО – 29,8 ед/мл, антитела к Пр3 – 2,2 ед/мл, антитела к БМК – 2,1 ед/мл.
С учетом клинического течения, морфологической картины нефробиоптата, данных серологического исследования диагностирован «Быстропрогрессирующий нефритический синдром. Диффузный экстракапиллярный гломерулонефрит» (МКБ-10: код №01.7). Иммунопатогенетический тип III, АНЦА-ассоциированный с наличием антител к МПО.
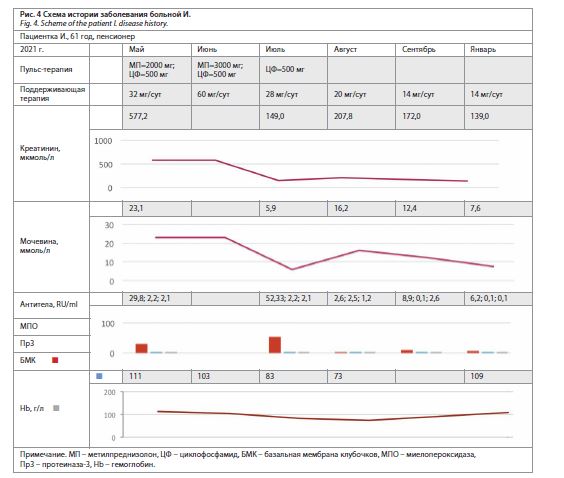
Больной назначена терапия системными глюкокортикоидами: «пульсовое» введение метилпреднизолона суммарно 2000 мг (с последующим переходом на пероральную форму в суточной дозе 24 мг в преднизолоновом эквиваленте) и циклофосфамида (циклофосфан 500 мл); рис. 4. Отмечено улучшение самочувствия (регрессия слабости, появление аппетита), повышение уровня гемоглобина до 103 г/л. В связи с сохраняющимися признаками активности процесса (активный мочевой осадок, анемия, диализпотребное почечное повреждение, гиперпродукция антител к МПО) принято решение об усилении патогенетической терапии. Повторно введено 3000 мг метилпреднизолона
(с последующим переходом на пероральный прием
60 мг/сут) и циклофосфамида (с интервалом дважды по 500 мг); см. рис. 4.
При очередном обследовании состояние больной удовлетворительное, показатели азотемии стабильные (креатинин – 149 мкмоль/л, мочевина – 5,9 ммоль/л, калий – 5 ммоль/л). В общем анализе мочи: белок –
0,3 г/л, эритроциты – 80 в поле зрения. Результаты серологического обследования: антитела к МПО –
2,6 ед/мл, антитела к Пр3 – 2,5 ед/мл, антитела к БМК – 1,2 ед/мл. Инициировано снижение дозы системных глюкокортикостероидов (в настоящий момент пациентка принимает 9,5 мг). В проведении ЗПТ не нуждается. Наблюдение за больной продолжается.
Обсуждение
 По данным исследования нефробиоптата у больной выявлена морфологическая картина экстракапиллярного гломерулонефрита (88% клеточных и фиброзно-клеточных полулуний). При иммунофлуоресцентном исследовании отсутствовало свечение иммуноглобулинов и фрагментов комплемента. Такая картина позволила отнести данный случай к III иммунопатогенетическому типу (малоиммунный экстракапиллярный нефрит). По данным иммуносерологического исследования выявлены антитела к МПО при отсутствии антител к Пр3 и БМК, что было квалифицировано как АНЦА-ассоциированный васкулит с изолированным поражением почек в виде МИГН. А с учетом особенностей светооптической картины можно констатировать смешанный класс по классификации А.Е. Berden [5]. У большинства больных МИГН выявляются АНЦА независимо от наличия или отсутствия внепочечных системных проявлений [6]. В то же время имеется специфичность АНЦА, определяющая фенотип МИГН. Так, у 81% пациентов с АНЦА-ассоциированным васкулитом с изолированным поражением почек выявлялись антитела к МПО, в то время как среди больных с наличием внепочечных проявлений (костные деструкции, седловидная деформация носа) почти во всех случаях (94%) обнаруживались антитела к Пр3 [7]. У обсуждаемой больной МИГН с наличием антител к МПО отсутствовали системные внепочечные проявления, в том числе поражение легких. Однако на серии КТ придаточных пазух выявлено утолщение слизистой по нижней стенке правой верхнечелюстной пазухи до 20 мм. В одном из недавних исследований у 44% больных системными васкулитами выявлено поражение ЛОР-органов (назальная обструкция, кровянистые выделения из носа, корки в носу, поражение пазух, кондуктивная и нейросенсорная потеря слуха, охриплость, гранулематозный синусит и воспаление гортани) [8]. При этом было установлено, что в случаях вовлечения в процесс верхних дыхательных путей наблюдаются менее выраженные фиброзные изменения в легких, тубулярная атрофия (по данным исследования почечных биоптатов) и лучшие показатели функции почек. Эти данные свидетельствуют о существовании различных фенотипов АНЦА-ассоциированных васкулитов, в том числе с поражением верхних дыхательных путей, имеющих свой прогноз. Не исключено, что выявленные при КТ-исследовании утолщения слизистой пазух может быть одним из начальных системных (внепочечных) проявлений системного васкулита, формирующих фенотип АНЦА-ассоциированного васкулита у данной больной и, возможно, определявшего относительно благоприятный прогноз.
По данным исследования нефробиоптата у больной выявлена морфологическая картина экстракапиллярного гломерулонефрита (88% клеточных и фиброзно-клеточных полулуний). При иммунофлуоресцентном исследовании отсутствовало свечение иммуноглобулинов и фрагментов комплемента. Такая картина позволила отнести данный случай к III иммунопатогенетическому типу (малоиммунный экстракапиллярный нефрит). По данным иммуносерологического исследования выявлены антитела к МПО при отсутствии антител к Пр3 и БМК, что было квалифицировано как АНЦА-ассоциированный васкулит с изолированным поражением почек в виде МИГН. А с учетом особенностей светооптической картины можно констатировать смешанный класс по классификации А.Е. Berden [5]. У большинства больных МИГН выявляются АНЦА независимо от наличия или отсутствия внепочечных системных проявлений [6]. В то же время имеется специфичность АНЦА, определяющая фенотип МИГН. Так, у 81% пациентов с АНЦА-ассоциированным васкулитом с изолированным поражением почек выявлялись антитела к МПО, в то время как среди больных с наличием внепочечных проявлений (костные деструкции, седловидная деформация носа) почти во всех случаях (94%) обнаруживались антитела к Пр3 [7]. У обсуждаемой больной МИГН с наличием антител к МПО отсутствовали системные внепочечные проявления, в том числе поражение легких. Однако на серии КТ придаточных пазух выявлено утолщение слизистой по нижней стенке правой верхнечелюстной пазухи до 20 мм. В одном из недавних исследований у 44% больных системными васкулитами выявлено поражение ЛОР-органов (назальная обструкция, кровянистые выделения из носа, корки в носу, поражение пазух, кондуктивная и нейросенсорная потеря слуха, охриплость, гранулематозный синусит и воспаление гортани) [8]. При этом было установлено, что в случаях вовлечения в процесс верхних дыхательных путей наблюдаются менее выраженные фиброзные изменения в легких, тубулярная атрофия (по данным исследования почечных биоптатов) и лучшие показатели функции почек. Эти данные свидетельствуют о существовании различных фенотипов АНЦА-ассоциированных васкулитов, в том числе с поражением верхних дыхательных путей, имеющих свой прогноз. Не исключено, что выявленные при КТ-исследовании утолщения слизистой пазух может быть одним из начальных системных (внепочечных) проявлений системного васкулита, формирующих фенотип АНЦА-ассоциированного васкулита у данной больной и, возможно, определявшего относительно благоприятный прогноз.
Особенностью данного случая является нарушение азотовыделительной функции почек с момента диагностики заболевания, требующей ЗПТ, что считается неблагоприятным прогностическим фактором. Летальность нелеченых больных МИГН в течение первого года составляет около 80%, в то время как при агрессивной иммуносупрессии 5-летняя выживаемость достигает 75% [9]. Применение глюкокортикоидов в сочетании с циклофосфамидом в режиме пульс-терапии у обсуждаемой больной с неблагоприятными прогностическими факторами (пожилой возраст, диализпотребная почечная недостаточность в дебюте заболевания) позволило снизить выработку АНЦА и предотвратить необратимое повреждение почек.
С целью оценки прогноза и выбора оптимального метода лечения адекватной и своевременной терапии всем больным с БПГН, даже при выраженной почечной недостаточности, требующей проведения гемодиализа, показана биопсия почки [10]. Своевременная иммуносупрессивная терапия иногда позволяет добиться восстановления функции почек, как это имело место у обсуждаемой нами больной.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Дворецкий Леонид Иванович – д-р мед. наук, проф., проф. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Leonid I. Dvoretsky – D. Sci. (Med.), Full Prof., Sechenov First Moscow State Medical University (Sechenov University).
E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Сидорук Нина Александровна – врач нефрологического отд-ния, ГБУЗ «ГКБ им. С.С. Юдина»
Nina A. Sidoruk – Nephrologist, Yudin City Clinical Hospital
Кривушкин Сергей Александрович – зав. нефрологическим отд-нием, ГБУЗ «ГКБ им. С.С. Юдина».
ORCID: 0000-0003-0294-6257
Sergey A. Krivushkin – Head of the Nephrological Department, Yudin City Clinical Hospital. ORCID: 0000-0003-0294-6257
Cтоляревич Екатерина Сергеевна – врач патологоанатомического отд-ния, ГБУЗ «ГКБ №52». ORCID: 0000-0002-0402-8348
Ekaterina S. Stoliarevich – Pathologist, City Clinical Hospital №52. ORCID: 0000-0002-0402-8348
Колендо Светлана Евгеньевна – доц. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова»
(Сеченовский Университет). ORCID: 0000-0002-1368-1605
Svetlana E. Kolendo – Assoc. Prof., Sechenov First Moscow State Medical University (Sechenov University). ORCID: 0000-0002-1368-1605
Ваколюк Роза Михайловна – канд. мед. наук, доц. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Rosa M. Vakolyuk – Assoc. Prof., Sechenov First Moscow State Medical University (Sechenov University)
Папко Кира Сергоевна – студент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет).
E-mail: kirapapko16@mail.ru
Kira S. Papko – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: kirapapko16@mail.ru
Поступила в редакцию / Received: 15.02.2023
Поступила после рецензирования / Revised: 27.02.2023
Принята к публикации / Accepted: 02.03.2023
The female patient with extracapillary pauci-immune ANCA associated glomerulonephritis having antibodies against myeloperoxidase and dialysis-requiring renal failure is described. The computed tomography revealed the mucous membrane thickening in the maxillary sinus. The pulse dose glucocorticosteroid and cyclophosphamide therapy contributed to the decrease in the levels of antibodies against myeloperoxidase and improvement of the nitrogen excretion function of the kidneys.
Keywords: rapidly progressive glomerulonephritis, pauci-immune glomerulonephritis, diffuse extracapillary glomerulonephritis, ANCA associated glomerulonephritis.
For citation: Dvoretsky L.I., Krivushkin S.A., Sidoruk N.A., Stoliarevich E.S., Kolendo S.E., Vakolyuk R.M., Papko K.S. Pauci-immune ANCA associated glomerulonephritis. Clinical case. Clinical review for general practice. 2023; 4 (2): 31–35. DOI: 10.47407/kr2023.4.2.00201
Введение
Малоиммунный гломерулонефрит (МИГН) является одним из иммунопатогенетических типов быстропрогрессирующего гломерулонефрита (БПГН) [1], который характеризуется клиническими признаками остронефритического синдрома с прогрессирующей почечной недостаточностью (удвоение содержания креатинина в срок 3 мес) и морфологической картиной экстракапиллярного гломерулонефрита. Частота МИГН в европейской популяции составляет 1–2/100 тыс. с тенденцией к росту заболеваемости за последнее время [2]. В зависимости от преимущественного механизма повреждения, клинической картины и лабораторных показателей выделяют 5 иммунопатогенетических типов БПГН [3]. Основными критериями, определяющими каждый из типов, являются данные иммунофлуоресцентного исследования, соответствующие повреждающему фактору, определяемому в сыворотке: антитела к базальной мембране клубочков (БМК), иммунные комплексы (ИК), антинейтрофильные цитоплазматические антитела (АНЦА). При МИГН, наиболее распространенном иммунопатогенетическом типе (50%), отсутствуют ИК и антитела к БМК, чему соответствует негативный результат иммунофлуоресцентного исследования. Характерной морфологической особенностью всех вариантов БПГН считается наличие клеточных, фиброзно-клеточных или фиброзных полулуний [4]. Другим фактором, определяющим особенности клинической картины, является тип циркулирующих антител – миелопероксидаза (МПО) или пероксидаза 3 (Пр3), которые определяются примерно у 90% пациентов с МИГН (АНЦА-ассоциированный васкулит). При гранулематозе с полиангиитом в 65–75% случаев выявляются Пр3-АНЦА, при микроскопическом полиангиите и эозинофильном гранулематозе с полиангиитом преобладают МПО-АНЦА, выявляемые в 60 и 40% случаев соответственно. В большинстве случаев МИГН является проявлением системного васкулита, но может быть локально почечным.
В 2010 г. была предложена классификация морфологических изменений при АНЦА-ассоциированных васкулитах, выделяющая 4 варианта поражения: фокальный (более 50% клубочков без полулуний), экстракапиллярный (более 50% клубочков с клеточными либо фиброзно-клеточными полулуниями), склерозирующий (более 50% клубочков полностью склерозированы) и смешанный [5]. Подобное разделение на классы позволяет значительно точнее оценить прогноз и определить объем необходимой терапии.
Под нашим наблюдением находится больная с МИГН. Приводим клиническое наблюдение.
Клиническое наблюдение
Больная И., 61 год, поступила в ГКБ им. С.С. Юдина с жалобами на слабость, снижение аппетита, периодическую тошноту, повышение цифр артериального давления (АД). По данным анамнеза, около 15 лет страдает артериальной гипертензией с максимальным подъемом АД до 200/100 мм рт. ст., адаптирована к 130/90 мм рт. ст. В анамнезе 6 самостоятельных родов. Во время последней беременности обнаруживался белок в моче, отмечались отеки нижних конечностей, регрессировавшие после родоразрешения. В течение последнего месяца стала отмечать нарастание слабости, снижение аппетита, периодическую тошноту, повышение цифр АД. При амбулаторном обследовании выявлено повышение показателей креатинина до 500 мкмоль/л, в связи с чем больная госпитализирована.
При осмотре состояние средней тяжести. Сознание ясное. Конституция – гиперстенический тип. Питание повышенное. Кожные покровы обычной окраски. Костно-мышечная система без особенностей. Частота дыхания – 16/мин. Дыхание везикулярное, хрипов и шума трения плевры нет. АД – 130/80 мм рт. ст.; частота сердечных сокращений – 78/мин; Тоны сердца звонкие, ритмичные, шумы не выслушиваются. Живот при пальпации: мягкий, безболезненный. Печень и селезенка не увеличены. Область почек не изменена. Симптом Пастернацкого отрицательный с обеих сторон. Мочеиспускание редкое, безболезненное.
Общий анализ крови: Нb – 111 г/л, лейкоцитарная формула без особенностей, СОЭ – 69 мм/ч. Биохимический анализ крови: креатинин – 500 мкмоль/л, мочевина – 32 ммоль/л, калий – 6,2 ммоль/л. Общий анализ мочи: белок – 1 г/л, с активным мочевым осадком.
Компьютерная томография (КТ) органов грудной клетки: инфильтративных изменений не выявлено. На серии КТ придаточных пазух носа отмечается утолщение слизистой по нижней стенке правой верхнечелюстной пазухи до 20 мм, пневматизация других придаточных пазух не нарушена. Ультразвуковое исследование почек: правая – 112×63 мм, конкременты до 10 мм, левая – 116×64 мм, в нижнем сегменте округлая анэхогенная структура 67×74 мм, в центральном сегменте аналогичная – 24 мм, конкременты 3–5, паренхима – 19 мм, чашечно-лоханочные системы не расширены.
Световая микроскопия: (окраски: гематоксилином и эозином, ШИК-реакция, трихром по Массону). В препарате 16 клубочков, 8 из которых полностью склерозированы, еще один выглядит ишемизированным. Во всех оставшихся клубочках определяются сегментарные (4) и циркулярные (3) клеточные (4) и фиброзно-клеточные полулуния. Сохранные стенки капиллярных петель не утолщены, одноконтурные. Отек и формирующийся диффузно-очаговый фиброз интерстиция с сопутствующей атрофией канальцев, занимающие около 30–40% паренхимы. Диффузно-очаговая, достаточно плотная интерстициальная инфильтрация лимфоцитами в зонах склероза и перигломерулярно. Дистрофия канальцевого эпителия. Артерии – артериосклероз. Артериолы – без особенностей.
Иммунофлуоресценция: IgG – следы, IgM – негативно, IgA – негативно, C3 – негативно, C1q – негативно, Kappa – следы, Lambda – следы, фибриноген – негативно.
Заключение: экстракапиллярный малоиммунный гломерулонефрит с 88% клеточных и фиброзно-клеточных полулуний. Учитывая данные иммунофлуоресценции, морфологическая картина характерна для ANCA-ассоциированного васкулита.
Данные серологического исследования: антитела к МПО – 29,8 ед/мл, антитела к Пр3 – 2,2 ед/мл, антитела к БМК – 2,1 ед/мл.
С учетом клинического течения, морфологической картины нефробиоптата, данных серологического исследования диагностирован «Быстропрогрессирующий нефритический синдром. Диффузный экстракапиллярный гломерулонефрит» (МКБ-10: код №01.7). Иммунопатогенетический тип III, АНЦА-ассоциированный с наличием антител к МПО.
Больной назначена терапия системными глюкокортикоидами: «пульсовое» введение метилпреднизолона суммарно 2000 мг (с последующим переходом на пероральную форму в суточной дозе 24 мг в преднизолоновом эквиваленте) и циклофосфамида (циклофосфан 500 мл); рис. 4. Отмечено улучшение самочувствия (регрессия слабости, появление аппетита), повышение уровня гемоглобина до 103 г/л. В связи с сохраняющимися признаками активности процесса (активный мочевой осадок, анемия, диализпотребное почечное повреждение, гиперпродукция антител к МПО) принято решение об усилении патогенетической терапии. Повторно введено 3000 мг метилпреднизолона
(с последующим переходом на пероральный прием
60 мг/сут) и циклофосфамида (с интервалом дважды по 500 мг); см. рис. 4.
При очередном обследовании состояние больной удовлетворительное, показатели азотемии стабильные (креатинин – 149 мкмоль/л, мочевина – 5,9 ммоль/л, калий – 5 ммоль/л). В общем анализе мочи: белок –
0,3 г/л, эритроциты – 80 в поле зрения. Результаты серологического обследования: антитела к МПО –
2,6 ед/мл, антитела к Пр3 – 2,5 ед/мл, антитела к БМК – 1,2 ед/мл. Инициировано снижение дозы системных глюкокортикостероидов (в настоящий момент пациентка принимает 9,5 мг). В проведении ЗПТ не нуждается. Наблюдение за больной продолжается.
Обсуждение
Особенностью данного случая является нарушение азотовыделительной функции почек с момента диагностики заболевания, требующей ЗПТ, что считается неблагоприятным прогностическим фактором. Летальность нелеченых больных МИГН в течение первого года составляет около 80%, в то время как при агрессивной иммуносупрессии 5-летняя выживаемость достигает 75% [9]. Применение глюкокортикоидов в сочетании с циклофосфамидом в режиме пульс-терапии у обсуждаемой больной с неблагоприятными прогностическими факторами (пожилой возраст, диализпотребная почечная недостаточность в дебюте заболевания) позволило снизить выработку АНЦА и предотвратить необратимое повреждение почек.
С целью оценки прогноза и выбора оптимального метода лечения адекватной и своевременной терапии всем больным с БПГН, даже при выраженной почечной недостаточности, требующей проведения гемодиализа, показана биопсия почки [10]. Своевременная иммуносупрессивная терапия иногда позволяет добиться восстановления функции почек, как это имело место у обсуждаемой нами больной.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Дворецкий Леонид Иванович – д-р мед. наук, проф., проф. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Leonid I. Dvoretsky – D. Sci. (Med.), Full Prof., Sechenov First Moscow State Medical University (Sechenov University).
E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Сидорук Нина Александровна – врач нефрологического отд-ния, ГБУЗ «ГКБ им. С.С. Юдина»
Nina A. Sidoruk – Nephrologist, Yudin City Clinical Hospital
Кривушкин Сергей Александрович – зав. нефрологическим отд-нием, ГБУЗ «ГКБ им. С.С. Юдина».
ORCID: 0000-0003-0294-6257
Sergey A. Krivushkin – Head of the Nephrological Department, Yudin City Clinical Hospital. ORCID: 0000-0003-0294-6257
Cтоляревич Екатерина Сергеевна – врач патологоанатомического отд-ния, ГБУЗ «ГКБ №52». ORCID: 0000-0002-0402-8348
Ekaterina S. Stoliarevich – Pathologist, City Clinical Hospital №52. ORCID: 0000-0002-0402-8348
Колендо Светлана Евгеньевна – доц. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова»
(Сеченовский Университет). ORCID: 0000-0002-1368-1605
Svetlana E. Kolendo – Assoc. Prof., Sechenov First Moscow State Medical University (Sechenov University). ORCID: 0000-0002-1368-1605
Ваколюк Роза Михайловна – канд. мед. наук, доц. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Rosa M. Vakolyuk – Assoc. Prof., Sechenov First Moscow State Medical University (Sechenov University)
Папко Кира Сергоевна – студент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет).
E-mail: kirapapko16@mail.ru
Kira S. Papko – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: kirapapko16@mail.ru
Поступила в редакцию / Received: 15.02.2023
Поступила после рецензирования / Revised: 27.02.2023
Принята к публикации / Accepted: 02.03.2023


