Клинический разбор в общей медицине №2 2023
Аннотация
Согласно последним данным Всемирной организации здравоохранения, на долю острых респираторных вирусных инфекций (ОРВИ) приходится около 75–90% всей инфекционной заболеваемости. Масштабы распространенности ОРВИ актуализируют поиск новых способов профилактики и лечения, адекватного контроля эпидемий и пандемий гриппа, COVID-19. ОРВИ несут значительный экономический ущерб из-за высокой обращаемости среди населения и временной утраты нетрудоспособности. Это было наиболее ощутимо с конца 2019 г., когда инфекция SARS-CoV-2 заняла приоритетное значение среди мирового медицинского сообщества и населения в целом. ОРВИ – неоднородная группа инфекционных заболеваний органов дыхания, вызываемая огромным числом вирусов (их насчитывается более 200, среди них: вирус гриппа, парагриппа, респираторно-синцитиальный вирус, аденовирус, коронавирус и др.). Симптомы ОРВИ схожи и включают лихорадку, кашель, боли в грудной клетке, головные боли, миалгии, астению, головные боли, аносмию и др. В статье рассматриваются вопросы диагностики бронхолегочных заболеваний, в том числе ОРВИ, COVID-19, а также патогенетически обоснованные механизмы воздействия на них. Рассматриваются систематические обзоры и метаанализы, в которых анализируется применение цинка, селена, витамина С, витамина А, витамина Е для профилактики или лечения бронхолегочных заболеваний у взрослого населения.
Ключевые слова: цинк, селен, бета-каротин, витамин С, витамин Е, витамин А, COVID-19, острые респираторные заболевания.
Для цитирования: Попова Е.Н., Митькина М.И., Чинова А.А., Пономарева Л.А. Роль витаминов и микроэлементов в профилактике и лечении бронхолегочных заболеваний у взрослых. Клинический разбор в общей медицине. 2023; 4 (2): 36–42. DOI: 10.47407/kr2023.4.2.00202
Abstract
According to the recent reports of the World Health Organization (WHO), the share of acute respiratory viral infections (ARVI) among all infectious diseases in about 75–90%. The ARVI prevalence rates make it urgent to search for new methods of prevention and treatment, adequate control of the epidemics and pandemics of influenza and COVID-19. ARVIs cause significant economic losses due to high appealability and temporary disability rates in the population. This was most noticeable since late 2019, when the SARS-CoV-2 infection became a priority for the global medical community and the general population. ARVIs constitute a heterogenous group of the infectious respiratory tract disorders caused by numerous viruses (there are more than 200 viruses, such as influenza virus, parainfluenza virus, respiratory syncytial virus, adenovirus, coronavirus, etc.). The symptoms of ARVIs that have much in common include fever, cough, chest pain, headache, myalgia, asthenia, anosmia, etc. The paper discusses the issues of the diagnosis of bronchopulmonary diseases, such as ARVI and COVID-19, and the pathogenetically substantiated machanisms of targeting these disorders. The paper deals with systematic reviews and meta-analyses focused on the use of zinc, selenium, vitamin C, vitamin A, and vitamin E for prevention or treatment of bronchopulmonary diseases in adults.
Keywords: zinc, selenium, beta-carotene, vitamin C, vitamin E, vitamin A, COVID-19, acute respiratory infections.
For citation: Popova E.N., Mitkina M.I., Chinova A.A., Ponomareva L.A. The role of vitamins and minerals in prevention and treatment of bronchopulmonary diseases in adults. Clinical review for general practice. 2023; 4 (2): 36–42. DOI: 10.47407/kr2023.4.2.00202
Острые респираторные вирусные инфекции (ОРВИ) занимают большую долю инфекционных заболеваний среди всех групп населения. Клинические проявления варьируются от легких симптомов «простуды» (ринорея, астения, лихорадка, кашель, боли в грудной клетке, головные боли, миалгии и др.) и гриппоподобных состояний до пневмоний и острого респираторного дистресс-синдрома. Тяжесть ОРВИ варьирует в зависимости от типа инфицирующего вируса, возраста пациента, наличия коморбидных заболеваний. Чаще всего ОРВИ завершается выздоровлением даже без лечения, однако высокая заболеваемость приводит к значительным расходам на здравоохранение и широким экономическим затратам [1–4].
За исключением вакцинации против гриппа и SARS-CoV-2 профилактические и терапевтические возможности предотвращения ОРВИ ограниченны. Клинические рекомендации сосредоточены на симптоматическом лечении с помощью препаратов, таких как нестероидные противовоспалительные средства, парацетамол, деконгестанты, а также на гигиенических мероприятиях в виде гигиены рук и ношения одноразовых масок [1, 2].
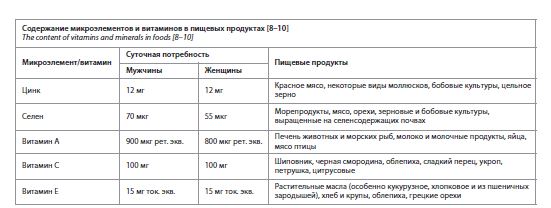 Неудивительно, что изучение применения микроэлементов и витаминов привлекло внимание во время пандемии COVID-19 [2, 5–7]. Процессы, обеспечивающие эффективную иммунную реактивность к инфекционным агентам, таким как респираторные вирусы, сложны и до сих пор до конца не изучены. На скоординированную работу и взаимодействие функций врожденного и приобретенного иммунитета влияет широкий спектр факторов образа жизни и окружающей среды. В частности, считается, что пищевые факторы и дополнительное применение нутриентов – микроэлементов и витаминов – эффективно обеспечивают резистентность к сезонным инфекциям и также обоснованы с патогенетической точки зрения (см. таблицу) для профилактики и лечения ОРВИ [8–10].
Неудивительно, что изучение применения микроэлементов и витаминов привлекло внимание во время пандемии COVID-19 [2, 5–7]. Процессы, обеспечивающие эффективную иммунную реактивность к инфекционным агентам, таким как респираторные вирусы, сложны и до сих пор до конца не изучены. На скоординированную работу и взаимодействие функций врожденного и приобретенного иммунитета влияет широкий спектр факторов образа жизни и окружающей среды. В частности, считается, что пищевые факторы и дополнительное применение нутриентов – микроэлементов и витаминов – эффективно обеспечивают резистентность к сезонным инфекциям и также обоснованы с патогенетической точки зрения (см. таблицу) для профилактики и лечения ОРВИ [8–10].
Иммунная система обеспечивает два уровня защиты от чужеродных патогенов: врожденный и приобретенный иммунитет [11]. Активация механизмов врожденного иммунитета вызывается особыми стимулами, например воздействием «консервативных» структур микроорганизмов, получивших название «патогенассоциированных» молекул (PAMP – pathogen-associated mole-cular patterns) с «образраспознающими» рецепторами (PRR – pattern-recognition receptors) фагоцитов [11, 12]. Факторы системы врожденного иммунитета не обладают иммунологической памятью, и реакции их на патогенный фактор каждый раз формируются заново [12]. Напротив, приобретенный иммунитет опосредуется Т- и В-клетками, которые обеспечивают устойчивый антигенспецифический иммунный ответ и иммунологическую память.
Витамины и микроэлементы выполняют широкий спектр функций для иммунной системы. Их поступление важно для оптимального функционирования врожденного и приобретенного иммунитета [13–15].
Цинк, Zn – незаменимый микроэлемент, имеющий решающее значение для многих физиологических процессов в организме человека, и это один из наиболее часто изучаемых факторов питания и здоровья [14, 16]. Zn играет значительную роль в активности никотинамидадениндинуклеотидфосфата (NADPH) оксидазы нейтрофильных гранулоцитов. Следовательно, пониженное образование активных форм кислорода со сниженной обезвреживающей функцией может быть результатом дефицита Zn. Исследования in vivo также показали, что дефицит Zn вызывает снижение адгезии и хемотаксиса моноцитов и нейтрофильных гранулоцитов, а также нарушение созревания и активности макрофагов, естественных киллеров (NK)-клеток. Дефицит Zn может вызвать снижение количества NK-клеток в периферической крови и привести к нарушению их функциональности. Цинк является кофактором супероксиддисмутазы, фермента, находящегося в митохондриях и цитозоле клеток, который подавляет окислительный стресс [6]. Zn также оказывает важное влияние на формирование, созревание и функцию Т-клеток, потому что Zn входит в состав гормона тимулина, который вырабатывается эпителиальными клетками тимуса и опосредует созревание пре-Т-лимфоцитов в Т-лимфоциты.
Соответственно, дефицит Zn подавляет созревание
Т-клеток в тимусе, что приводит к выраженной атрофии тимуса и снижению количества пре-Т-лимфоцитов на животных моделях. Было показано, что дефицит Zn может привести к снижению способности к пролиферации Т-клеток или выработке цитокинов, например интерлейкина (ИЛ)-2 и интерферона (ИФН)-γ.
Другая важная роль Zn заключается в том, что он также важен в процессах дифференцировки Т-клеток. Исследования, которые индуцировали дефицит Zn, показали уменьшение количества CD4+ Т-клеток, что привело к дисбалансу соотношения CD4+/CD8+. Значительное сниженное соотношение CD4+/CD8+, например ниже 1,5, клинически считается показателем или причиной иммунной дисфункции и, таким образом, прогностическим признаком различных заболеваний [13]. Вдобавок к значительному влиянию на Т-лимфоциты дефицит Zn может привести к снижению созревания
В-клеток, и это может привести к снижению выработки антител [11, 13, 17].
Было показано, что цинк необходим для эпителия дыхательных путей благодаря наличию антиоксидантной и противовоспалительной активности [18], а также для регуляции белков плотного соединения-1 (ZO-1) и клаудина-1, что скрепляет межэпителиальные контакты и как следствие повышает его барьерные функции. В свою очередь, снижение функции этих белков, являющихся наиболее важными компонентами плотных замыкающих контактов, и, соответственно, снижение барьерной функции усугубляют течение вирусных и бактериальных инфекций [19].
Исследования последних лет неоднократно показывали, что Zn оказывает значительное влияние на вирусные инфекции и может положительно влиять или даже предотвращать течение заболевания. Механизмы для этого многогранны и связаны с проникновением вирусных частиц, слияния, репликации, трансляции вирусных белков и дальнейшего высвобождения в ряде вирусов [13, 20]. Результаты метаанализа показали, что прием добавок Zn в дозе >75 мг/сут значительно сокращал продолжительность простудных заболеваний [21]. Всем известно, что у пожилых наблюдается повышенная восприимчивость к инфекциям. Было показано, что после 12 мес приема добавок Zn (45 мг Zn-глюконата в день) частота инфекций была значительно ниже в группе лиц в возрасте 55–87 лет. Это сопровождалось увеличением концентрации Zn в плазме и снижением образования фактора некроза опухоли α и маркеров окислительного стресса [22]. Результаты in vitro продемонстрировали, что катионы Zn ингибируют РНК-полимеразу коронавируса SARS (РНК-зависимую РНК-полимеразу), уменьшая репликацию вируса [23]. Цинк не только самостоятельно увеличивает выработку лейкоцитами ИФН-α [24], но и усиливает его противовирусную активность в клетках, инфицированных риновирусом [25]. В случае с инфекцией, вызванной пикорнавирусом, повышение внутриклеточного содержания цинка значительно изменяло его репликацию [26].
Возможные побочные эффекты применения нутриентов возникают редко и, как правило, при превышении рекомендуемых доз. При увеличении рекомендуемой суточной дозы (15 мг/сут) 100–300 мг Zn/сут может развиться дефицит меди с сопутствующими симптомами анемии и нейтропении, а также нарушения иммунной функции и повышение уровня холестерина липопротеидов низкой плотности. Есть предположение, что даже более низкие уровни добавок цинка, близкие по количеству к суточной норме, препятствуют усвоению меди и железа и отрицательно влияют на концентрацию холестерина липопротеидов высокой плотности [27]. В соответствии с этим, Deuster ссылается на допустимый верхний предел содержания Zn, составляющий 40 мг/сут, однако это требует дальнейших исследований [28].
У взрослого населения, когда цинк использовался с профилактической целью, был более низкий риск заражения ОРВИ. Было обнаружено, что при использовании для лечения цинк сокращает продолжительность симптомов и уменьшает тяжесть симптомов на 3-й день, но не влияет на выраженность дневных симптомов [11]. Метаанализ с включением обсервационных и рандомизированных исследований показал, что прием добавок цинка связан с более низким уровнем смертности у пациентов с COVID-19 [16].
Селен (Se) – еще один важный микроэлемент, участвующий в регуляции иммунных функций. Селен необходим в следовых количествах и достигается за счет широкого спектра пищевых источников, включая зерновые, овощи, морепродукты, мясо, молочные продукты и орехи. Основной формой Se, поступающей в организм человека, является селенометионин (Se-Met), хотя в пищевых продуктах присутствуют и другие формы [29, 30]. Диетический Se может оказывать некоторые из своих биологических эффектов за счет низкомолекулярных селеносоединений [7, 31]. Адекватные уровни Se важны для инициации иммунитета, но они также участвуют в регуляции чрезмерных иммунных реакций и хронического воспаления [13, 29].
Было показано, что селен стимулирует образование антител и активность Т-хелперов наряду с цитотоксическими Т- и NK-клетками. Он также участвует в стимуляции миграции фагоцитарных клеток и непосредственно в фагоцитозе. Выработка простагландинов – PGI2, PGE2 и PGF2a была ниже в эндотелиальных клетках с дефицитом селена [13, 31, 32].
В последние годы и с момента начала пандемии появились предположения о том, что селен может использоваться в лечении постковидного синдрома и в целом с последствиями вирусных инфекций. Особый интерес представляет его влияние на симптомы и исход SARS-CoV-2 при дефиците Se, что, по мнению авторов, – обычное явление у значительной части населения земного шара. G. Bermano и соавт. предложили использовать соответствующие маркеры для оценки статуса Se у пациентов с COVID-19, возможные добавки селена могут быть полезны для ограничения тяжести симптомов, особенно в странах, где часто наблюдается дефицит микроэлемента [32].
Селен традиционно рассматривается как потенциально эффективный метод для коррекции иммунного ответа [33]. Реакции с участием Se не до конца изучены. Выявление специфических клеточных сигнальных путей и функций иммунных клеток, регулируемых уровнями Se в рационе, представляет собой следующий логичный и необходимый шаг в использовании добавок Se для усиления или модуляции иммунитета [7, 29].
В работах Minkyung Bae и Hyeyoung Kim сообщается, что у пациентов, заболевших COVID-19, наблюдается дефицит Se в крови, наряду с низкими концентрациями переносчика Se (селенопротеин Р) и низкой ферментативной активностью секретируемого GPx3 (глутатионпероксидаза 3). Примечательно, что дефицит этих трех биомаркеров был более выражен у исследуемых пациентов по сравнению со здоровыми взрослыми европейцами. Более низкие показатели содержания Se в группах вновь заболевших или с диагностированным ранее COVID-19 по сравнению с не болевшими ОРВИ подтверждает значимость микроэлемента в борьбе с вирусом и успешном выздоровлении [30].
Передозировка Se вызывает гипохромную анемию и лейкопению, а также повреждение ногтей. Избыток Se может становиться причиной диспепсических расстройств: рвоты, диареи, изменения волос и ногтей, а также неврологических проявлений, включая акропарестезии, слабость, судороги и снижение когнитивных функций [34].
В последних систематических обзорах и метаанализах содержатся данные о том, что употребление витамина C снижает в целом заболеваемость, длительность или тяжесть обычных простудных заболеваний при непрерывном регулярном ежедневном применении или курсом при первых симптомах простуды [35–37].
Концентрация витамина C в плазме и лейкоцитах быстро снижается во время инфекций и стресса. Было обнаружено, что добавление витамина C улучшает функции иммунной системы человека, такие как антимикробная активность и активность естественных клеток-киллеров, пролиферации лимфоцитов, хемотаксис и гиперчувствительность замедленного типа [15, 38]. Витамин С способствует поддержанию окислительно-восстановительной целостности клеток и тем самым защищает их от активных форм кислорода, образующихся во время респираторного выброса и при воспалительной реакции. Суточные дозы варьируют в зависимости от пола и возраста: 90 мг/сут для взрослых мужчин и 75 мг/сут для взрослых женщин. Адекватное потребление витамина С и цинка облегчает симптомы и сокращает продолжительность инфекций дыхательных путей, включая обычную простуду [14, 36, 37].
Витамин С повышает уровень оксалатов в моче в зависимости от дозы, поэтому существует риск возможного нефролитиаза. Проспективное когортное исследование показало, что прием пероральных доз витамина С, превышающих 1 г, значительно увеличивает риск образования камней на 41% [39]. По этой причине не следует употреблять витамина С в дозах более чем 1 г в день. К тому же высокие дозы витамина С временно увеличивают экскрецию уратов [40, 41]. Аскорбиновая кислота может усиливать гемолиз у пациентов, страдающих пароксизмальной ночной гемоглобинурией [42].
Витамин А получают с пищей путем потребления продуктов, содержащих предшественники витамина А (главным образом β-каротин) и витамин А в форме ретиниловых эфиров, которые получают из растительной и животной пищи [43, 44].
Метаболиты витамина А также могут влиять на некоторые аспекты приобретенного иммунного ответа. Ретиноевая кислота усиливает цитотоксичность и пролиферацию Т-клеток, последняя, вероятно, опосредована, по крайней мере частично, усилением секреции ИЛ-2 и передачи сигналов в Т-клетках. Мыши с дефицитом витамина А имеют дефекты в активности Т-клеток. Кроме того, ретиноевая кислота ингибирует апоптоз В-лимфоцитов [43, 45, 46].
В дыхательных путях дефицит витамина A также увеличивает повреждение эпителия и ухудшает выздоровление, иногда приводя к плоскоклеточной метаплазии в альвеолах и дыхательных путях после воздействий различных патогенов, в том числе вирусов [47].
Рассмотренные выше эффекты витамина A на иммунную систему имеют несколько возможных последствий для лиц с дефицитом этого витамина. Во-первых, при дефиците повысится тяжесть воспаления 1-го типа и повреждения тканей в легких после вирусной инфекции. Во-вторых, после ликвидации инфекции SARS-CoV-2 дефицит витамина может нарушить восстановление поврежденных альвеолярных пневмоцитов и эпителия дыхательных путей. В-третьих, защитный иммунитет к SARS-CoV-2 может быть ослаблен дефицитом витамина А, особенно IgA-реакцией слизистой оболочки, которая может быть важна для устойчивости к повторной инфекции, но не нужно забывать, что также может быть затронуто развитие Th1 памяти и CD8+ цитотоксического ответа Т-лимфоцитов [38, 44, 47].
Чрезмерное потребление витамина А может вызвать тошноту, рвоту, диарею, головную боль, у младенцев – лихорадку и повышение внутричерепного давления [48, 49]. К нарушениям, связанным с нервными функциями, относят спутанность сознания, раздражительность, беспокойство, депрессию и даже суицидальные мысли. Кроме того, острая интоксикация витамином А может привести к ухудшению зрения и снижению мышечной координации. Появляется все больше свидетельств того, что дозы витамина А, превышающие потребности в питании, могут привести к таким негативным последствиям, как окислительно-восстановительные нарушения, изменения клеточной сигнализации и в зависимости от типа клеток – к клеточной гибели или пролиферации [50].
Витамин Е – жирорастворимый антиоксидант, который защищает полиненасыщенные жирные кислоты в мембране от окисления, регулирует выработку активных форм кислорода. Основными пищевыми источниками витамина Е являются растительные масла, орехи. При приеме витамина Е сообщалось об увеличении пролиферации лимфоцитов, уровней иммуноглобулина, реакции антител, активности NK и продукции ИЛ-2.
Многие исследования подтвердили, что иммуностимулирующее действие витамина Е повышает устойчивость к инфекциям. Однако величина эффектов была довольно небольшой, и в некоторых исследованиях положительные эффекты наблюдались только в подгруппах испытуемых [51]. Предполагаемыми механизмами, связанными с этими изменениями, являются снижение продукции PGE2 путем ингибирования активности
циклооксигеназы-2, опосредованное снижением продукции NO, улучшение эффективного формирования иммунных синапсов в наивных Т-клетках и инициирование сигналов активации Т-клеток, и модуляция Th1/Th2 равновесия. Более высокая активность NK и изменения в функции дендритов, такие как снижение продукции и миграции ИЛ-12, наблюдались при применении витамина Е, но лежащие в основе механизмы нуждаются в дальнейшем выяснении [12, 38, 51, 52].
Исследования на животных, а также недавно завершенные клинические испытания убедительно свидетельствуют о том, что этот эффект витамина Е связан со снижением риска заражения инфекциями, особенно инфекциями верхних дыхательных путей, в том числе у пожилых людей [52].
К побочным эффектам при приеме витамина Е в стандартных дозах относят слабость, эмоциональные нарушения, усталость, болезненность молочных желез и боли в животе. Имеются данные, что при приеме высоких доз витамина Е в течение длительного времени происходит повышение уровня холестерина в плазме крови, а также возможно развитие тромбофлебита, особенно у лиц, предрасположенных к этому или принимающих препараты эстрогена [53]. Другие негативные эффекты витамина Е включают риск развития нейродегенеративных заболеваний, геморрагических осложнений за счет ингибирования агрегации тромбоцитов и витамин K-зависимых факторов свертывания и провоспалительный эффект, являющийся результатом усиления дифференцировки и медиаторной активности
Т-клеток [54].
Анализ публикаций показывает, что биологически активные добавки (Zn, Se, витамин С, витамин Е, бета-каротин) с микроэлементами могут быть эффективны в профилактике и улучшении клинического течения ОРВИ, включая инфекцию SARS-CoV-2. Достаточное количество цинка, селена и витаминов С, Е, А необходимо для устойчивости к вирусным инфекциям, иммунной функции и уменьшения клинических проявлений ОРВИ. Однако эффективность и безопасность микронутриентов, предоставляемых в тех диапазонах доз, при которых их действие наиболее выражено, требует дальнейшего изучения в различных группах больных, клинически здоровых и людей с риском респираторных заболеваний.
В качестве средства для профилактики ОРВИ можно рассмотреть комбинированный витаминно-минеральный комплекс Селцинк Плюс® (PRO.MED.CS Praha a. s., Czech Republic), в состав таблетки которого входит комплекс микроэлементов и витаминов, обладающий антиоксидантной активностью, в частности: Se – 50 мкг; Zn – 8 мг; бета-каротин – 4,8 мг; витамин Е – 23,5 мг; вита-
мин С – 200 мг. Эффекты препарата Селцинк Плюс® обусловлены свойствами входящих в состав препарата микроэлементов: Se и Zn, а также важных витаминов А, С и Е.
В комплексном лечении сезонных ОРВИ и гриппа перспективно в качестве дополнительной терапии применение новой формы препарата Селцинк® компании PRO.MED.CS Praha a. s – Селцинк Ультра Флю®, которая характеризуется повышенным содержанием Zn и витамина С, появившийся на отечественном фармацевтическом рынке в декабре 2022 г. В состав таблетки Селцинк Ультра Флю® входят: Se – 50 мкг; Zn – 20 мг; витамин С – 225 мг.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Попова Елена Николаевна – д-р мед. наук, проф. каф. внутренних, профессиональных болезней и ревматологии,
ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru
Elena N. Popova – D. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru
Пономарева Любовь Андреевна – ассистент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет).
E-mail: liubaponomareva18@yandex.ru
Liubov A. Ponomareva – Аssistant, Sechenov First Moscow State Medical University (Sechenov University).
E-mail: liubaponomareva18@yandex.ru
Чинова Алина Александровна – студентка, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Alina A. Chinova – Student, Sechenov First Moscow State Medical University (Sechenov University)
Митькина Мария Игоревна – студентка, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Maria I. Mitkina – Student, Sechenov First Moscow State Medical University (Sechenov University)
Поступила в редакцию / Received: 21.03.2023
Поступила после рецензирования / Revised: 23.03.2023
Принята к публикации / Accepted: 30.03.2023
Клинический разбор в общей медицине №2 2023
Роль витаминов и микроэлементов в профилактике и лечении бронхолегочных заболеваний у взрослых
Аннотация
Согласно последним данным Всемирной организации здравоохранения, на долю острых респираторных вирусных инфекций (ОРВИ) приходится около 75–90% всей инфекционной заболеваемости. Масштабы распространенности ОРВИ актуализируют поиск новых способов профилактики и лечения, адекватного контроля эпидемий и пандемий гриппа, COVID-19. ОРВИ несут значительный экономический ущерб из-за высокой обращаемости среди населения и временной утраты нетрудоспособности. Это было наиболее ощутимо с конца 2019 г., когда инфекция SARS-CoV-2 заняла приоритетное значение среди мирового медицинского сообщества и населения в целом. ОРВИ – неоднородная группа инфекционных заболеваний органов дыхания, вызываемая огромным числом вирусов (их насчитывается более 200, среди них: вирус гриппа, парагриппа, респираторно-синцитиальный вирус, аденовирус, коронавирус и др.). Симптомы ОРВИ схожи и включают лихорадку, кашель, боли в грудной клетке, головные боли, миалгии, астению, головные боли, аносмию и др. В статье рассматриваются вопросы диагностики бронхолегочных заболеваний, в том числе ОРВИ, COVID-19, а также патогенетически обоснованные механизмы воздействия на них. Рассматриваются систематические обзоры и метаанализы, в которых анализируется применение цинка, селена, витамина С, витамина А, витамина Е для профилактики или лечения бронхолегочных заболеваний у взрослого населения.
Ключевые слова: цинк, селен, бета-каротин, витамин С, витамин Е, витамин А, COVID-19, острые респираторные заболевания.
Для цитирования: Попова Е.Н., Митькина М.И., Чинова А.А., Пономарева Л.А. Роль витаминов и микроэлементов в профилактике и лечении бронхолегочных заболеваний у взрослых. Клинический разбор в общей медицине. 2023; 4 (2): 36–42. DOI: 10.47407/kr2023.4.2.00202
Abstract
According to the recent reports of the World Health Organization (WHO), the share of acute respiratory viral infections (ARVI) among all infectious diseases in about 75–90%. The ARVI prevalence rates make it urgent to search for new methods of prevention and treatment, adequate control of the epidemics and pandemics of influenza and COVID-19. ARVIs cause significant economic losses due to high appealability and temporary disability rates in the population. This was most noticeable since late 2019, when the SARS-CoV-2 infection became a priority for the global medical community and the general population. ARVIs constitute a heterogenous group of the infectious respiratory tract disorders caused by numerous viruses (there are more than 200 viruses, such as influenza virus, parainfluenza virus, respiratory syncytial virus, adenovirus, coronavirus, etc.). The symptoms of ARVIs that have much in common include fever, cough, chest pain, headache, myalgia, asthenia, anosmia, etc. The paper discusses the issues of the diagnosis of bronchopulmonary diseases, such as ARVI and COVID-19, and the pathogenetically substantiated machanisms of targeting these disorders. The paper deals with systematic reviews and meta-analyses focused on the use of zinc, selenium, vitamin C, vitamin A, and vitamin E for prevention or treatment of bronchopulmonary diseases in adults.
Keywords: zinc, selenium, beta-carotene, vitamin C, vitamin E, vitamin A, COVID-19, acute respiratory infections.
For citation: Popova E.N., Mitkina M.I., Chinova A.A., Ponomareva L.A. The role of vitamins and minerals in prevention and treatment of bronchopulmonary diseases in adults. Clinical review for general practice. 2023; 4 (2): 36–42. DOI: 10.47407/kr2023.4.2.00202
Острые респираторные вирусные инфекции (ОРВИ) занимают большую долю инфекционных заболеваний среди всех групп населения. Клинические проявления варьируются от легких симптомов «простуды» (ринорея, астения, лихорадка, кашель, боли в грудной клетке, головные боли, миалгии и др.) и гриппоподобных состояний до пневмоний и острого респираторного дистресс-синдрома. Тяжесть ОРВИ варьирует в зависимости от типа инфицирующего вируса, возраста пациента, наличия коморбидных заболеваний. Чаще всего ОРВИ завершается выздоровлением даже без лечения, однако высокая заболеваемость приводит к значительным расходам на здравоохранение и широким экономическим затратам [1–4].
За исключением вакцинации против гриппа и SARS-CoV-2 профилактические и терапевтические возможности предотвращения ОРВИ ограниченны. Клинические рекомендации сосредоточены на симптоматическом лечении с помощью препаратов, таких как нестероидные противовоспалительные средства, парацетамол, деконгестанты, а также на гигиенических мероприятиях в виде гигиены рук и ношения одноразовых масок [1, 2].
Иммунная система обеспечивает два уровня защиты от чужеродных патогенов: врожденный и приобретенный иммунитет [11]. Активация механизмов врожденного иммунитета вызывается особыми стимулами, например воздействием «консервативных» структур микроорганизмов, получивших название «патогенассоциированных» молекул (PAMP – pathogen-associated mole-cular patterns) с «образраспознающими» рецепторами (PRR – pattern-recognition receptors) фагоцитов [11, 12]. Факторы системы врожденного иммунитета не обладают иммунологической памятью, и реакции их на патогенный фактор каждый раз формируются заново [12]. Напротив, приобретенный иммунитет опосредуется Т- и В-клетками, которые обеспечивают устойчивый антигенспецифический иммунный ответ и иммунологическую память.
Витамины и микроэлементы выполняют широкий спектр функций для иммунной системы. Их поступление важно для оптимального функционирования врожденного и приобретенного иммунитета [13–15].
Цинк, Zn – незаменимый микроэлемент, имеющий решающее значение для многих физиологических процессов в организме человека, и это один из наиболее часто изучаемых факторов питания и здоровья [14, 16]. Zn играет значительную роль в активности никотинамидадениндинуклеотидфосфата (NADPH) оксидазы нейтрофильных гранулоцитов. Следовательно, пониженное образование активных форм кислорода со сниженной обезвреживающей функцией может быть результатом дефицита Zn. Исследования in vivo также показали, что дефицит Zn вызывает снижение адгезии и хемотаксиса моноцитов и нейтрофильных гранулоцитов, а также нарушение созревания и активности макрофагов, естественных киллеров (NK)-клеток. Дефицит Zn может вызвать снижение количества NK-клеток в периферической крови и привести к нарушению их функциональности. Цинк является кофактором супероксиддисмутазы, фермента, находящегося в митохондриях и цитозоле клеток, который подавляет окислительный стресс [6]. Zn также оказывает важное влияние на формирование, созревание и функцию Т-клеток, потому что Zn входит в состав гормона тимулина, который вырабатывается эпителиальными клетками тимуса и опосредует созревание пре-Т-лимфоцитов в Т-лимфоциты.
Соответственно, дефицит Zn подавляет созревание
Т-клеток в тимусе, что приводит к выраженной атрофии тимуса и снижению количества пре-Т-лимфоцитов на животных моделях. Было показано, что дефицит Zn может привести к снижению способности к пролиферации Т-клеток или выработке цитокинов, например интерлейкина (ИЛ)-2 и интерферона (ИФН)-γ.
Другая важная роль Zn заключается в том, что он также важен в процессах дифференцировки Т-клеток. Исследования, которые индуцировали дефицит Zn, показали уменьшение количества CD4+ Т-клеток, что привело к дисбалансу соотношения CD4+/CD8+. Значительное сниженное соотношение CD4+/CD8+, например ниже 1,5, клинически считается показателем или причиной иммунной дисфункции и, таким образом, прогностическим признаком различных заболеваний [13]. Вдобавок к значительному влиянию на Т-лимфоциты дефицит Zn может привести к снижению созревания
В-клеток, и это может привести к снижению выработки антител [11, 13, 17].
Было показано, что цинк необходим для эпителия дыхательных путей благодаря наличию антиоксидантной и противовоспалительной активности [18], а также для регуляции белков плотного соединения-1 (ZO-1) и клаудина-1, что скрепляет межэпителиальные контакты и как следствие повышает его барьерные функции. В свою очередь, снижение функции этих белков, являющихся наиболее важными компонентами плотных замыкающих контактов, и, соответственно, снижение барьерной функции усугубляют течение вирусных и бактериальных инфекций [19].
Исследования последних лет неоднократно показывали, что Zn оказывает значительное влияние на вирусные инфекции и может положительно влиять или даже предотвращать течение заболевания. Механизмы для этого многогранны и связаны с проникновением вирусных частиц, слияния, репликации, трансляции вирусных белков и дальнейшего высвобождения в ряде вирусов [13, 20]. Результаты метаанализа показали, что прием добавок Zn в дозе >75 мг/сут значительно сокращал продолжительность простудных заболеваний [21]. Всем известно, что у пожилых наблюдается повышенная восприимчивость к инфекциям. Было показано, что после 12 мес приема добавок Zn (45 мг Zn-глюконата в день) частота инфекций была значительно ниже в группе лиц в возрасте 55–87 лет. Это сопровождалось увеличением концентрации Zn в плазме и снижением образования фактора некроза опухоли α и маркеров окислительного стресса [22]. Результаты in vitro продемонстрировали, что катионы Zn ингибируют РНК-полимеразу коронавируса SARS (РНК-зависимую РНК-полимеразу), уменьшая репликацию вируса [23]. Цинк не только самостоятельно увеличивает выработку лейкоцитами ИФН-α [24], но и усиливает его противовирусную активность в клетках, инфицированных риновирусом [25]. В случае с инфекцией, вызванной пикорнавирусом, повышение внутриклеточного содержания цинка значительно изменяло его репликацию [26].
Возможные побочные эффекты применения нутриентов возникают редко и, как правило, при превышении рекомендуемых доз. При увеличении рекомендуемой суточной дозы (15 мг/сут) 100–300 мг Zn/сут может развиться дефицит меди с сопутствующими симптомами анемии и нейтропении, а также нарушения иммунной функции и повышение уровня холестерина липопротеидов низкой плотности. Есть предположение, что даже более низкие уровни добавок цинка, близкие по количеству к суточной норме, препятствуют усвоению меди и железа и отрицательно влияют на концентрацию холестерина липопротеидов высокой плотности [27]. В соответствии с этим, Deuster ссылается на допустимый верхний предел содержания Zn, составляющий 40 мг/сут, однако это требует дальнейших исследований [28].
У взрослого населения, когда цинк использовался с профилактической целью, был более низкий риск заражения ОРВИ. Было обнаружено, что при использовании для лечения цинк сокращает продолжительность симптомов и уменьшает тяжесть симптомов на 3-й день, но не влияет на выраженность дневных симптомов [11]. Метаанализ с включением обсервационных и рандомизированных исследований показал, что прием добавок цинка связан с более низким уровнем смертности у пациентов с COVID-19 [16].
Селен (Se) – еще один важный микроэлемент, участвующий в регуляции иммунных функций. Селен необходим в следовых количествах и достигается за счет широкого спектра пищевых источников, включая зерновые, овощи, морепродукты, мясо, молочные продукты и орехи. Основной формой Se, поступающей в организм человека, является селенометионин (Se-Met), хотя в пищевых продуктах присутствуют и другие формы [29, 30]. Диетический Se может оказывать некоторые из своих биологических эффектов за счет низкомолекулярных селеносоединений [7, 31]. Адекватные уровни Se важны для инициации иммунитета, но они также участвуют в регуляции чрезмерных иммунных реакций и хронического воспаления [13, 29].
Было показано, что селен стимулирует образование антител и активность Т-хелперов наряду с цитотоксическими Т- и NK-клетками. Он также участвует в стимуляции миграции фагоцитарных клеток и непосредственно в фагоцитозе. Выработка простагландинов – PGI2, PGE2 и PGF2a была ниже в эндотелиальных клетках с дефицитом селена [13, 31, 32].
В последние годы и с момента начала пандемии появились предположения о том, что селен может использоваться в лечении постковидного синдрома и в целом с последствиями вирусных инфекций. Особый интерес представляет его влияние на симптомы и исход SARS-CoV-2 при дефиците Se, что, по мнению авторов, – обычное явление у значительной части населения земного шара. G. Bermano и соавт. предложили использовать соответствующие маркеры для оценки статуса Se у пациентов с COVID-19, возможные добавки селена могут быть полезны для ограничения тяжести симптомов, особенно в странах, где часто наблюдается дефицит микроэлемента [32].
Селен традиционно рассматривается как потенциально эффективный метод для коррекции иммунного ответа [33]. Реакции с участием Se не до конца изучены. Выявление специфических клеточных сигнальных путей и функций иммунных клеток, регулируемых уровнями Se в рационе, представляет собой следующий логичный и необходимый шаг в использовании добавок Se для усиления или модуляции иммунитета [7, 29].
В работах Minkyung Bae и Hyeyoung Kim сообщается, что у пациентов, заболевших COVID-19, наблюдается дефицит Se в крови, наряду с низкими концентрациями переносчика Se (селенопротеин Р) и низкой ферментативной активностью секретируемого GPx3 (глутатионпероксидаза 3). Примечательно, что дефицит этих трех биомаркеров был более выражен у исследуемых пациентов по сравнению со здоровыми взрослыми европейцами. Более низкие показатели содержания Se в группах вновь заболевших или с диагностированным ранее COVID-19 по сравнению с не болевшими ОРВИ подтверждает значимость микроэлемента в борьбе с вирусом и успешном выздоровлении [30].
Передозировка Se вызывает гипохромную анемию и лейкопению, а также повреждение ногтей. Избыток Se может становиться причиной диспепсических расстройств: рвоты, диареи, изменения волос и ногтей, а также неврологических проявлений, включая акропарестезии, слабость, судороги и снижение когнитивных функций [34].
В последних систематических обзорах и метаанализах содержатся данные о том, что употребление витамина C снижает в целом заболеваемость, длительность или тяжесть обычных простудных заболеваний при непрерывном регулярном ежедневном применении или курсом при первых симптомах простуды [35–37].
Концентрация витамина C в плазме и лейкоцитах быстро снижается во время инфекций и стресса. Было обнаружено, что добавление витамина C улучшает функции иммунной системы человека, такие как антимикробная активность и активность естественных клеток-киллеров, пролиферации лимфоцитов, хемотаксис и гиперчувствительность замедленного типа [15, 38]. Витамин С способствует поддержанию окислительно-восстановительной целостности клеток и тем самым защищает их от активных форм кислорода, образующихся во время респираторного выброса и при воспалительной реакции. Суточные дозы варьируют в зависимости от пола и возраста: 90 мг/сут для взрослых мужчин и 75 мг/сут для взрослых женщин. Адекватное потребление витамина С и цинка облегчает симптомы и сокращает продолжительность инфекций дыхательных путей, включая обычную простуду [14, 36, 37].
Витамин С повышает уровень оксалатов в моче в зависимости от дозы, поэтому существует риск возможного нефролитиаза. Проспективное когортное исследование показало, что прием пероральных доз витамина С, превышающих 1 г, значительно увеличивает риск образования камней на 41% [39]. По этой причине не следует употреблять витамина С в дозах более чем 1 г в день. К тому же высокие дозы витамина С временно увеличивают экскрецию уратов [40, 41]. Аскорбиновая кислота может усиливать гемолиз у пациентов, страдающих пароксизмальной ночной гемоглобинурией [42].
Витамин А получают с пищей путем потребления продуктов, содержащих предшественники витамина А (главным образом β-каротин) и витамин А в форме ретиниловых эфиров, которые получают из растительной и животной пищи [43, 44].
Метаболиты витамина А также могут влиять на некоторые аспекты приобретенного иммунного ответа. Ретиноевая кислота усиливает цитотоксичность и пролиферацию Т-клеток, последняя, вероятно, опосредована, по крайней мере частично, усилением секреции ИЛ-2 и передачи сигналов в Т-клетках. Мыши с дефицитом витамина А имеют дефекты в активности Т-клеток. Кроме того, ретиноевая кислота ингибирует апоптоз В-лимфоцитов [43, 45, 46].
В дыхательных путях дефицит витамина A также увеличивает повреждение эпителия и ухудшает выздоровление, иногда приводя к плоскоклеточной метаплазии в альвеолах и дыхательных путях после воздействий различных патогенов, в том числе вирусов [47].
Рассмотренные выше эффекты витамина A на иммунную систему имеют несколько возможных последствий для лиц с дефицитом этого витамина. Во-первых, при дефиците повысится тяжесть воспаления 1-го типа и повреждения тканей в легких после вирусной инфекции. Во-вторых, после ликвидации инфекции SARS-CoV-2 дефицит витамина может нарушить восстановление поврежденных альвеолярных пневмоцитов и эпителия дыхательных путей. В-третьих, защитный иммунитет к SARS-CoV-2 может быть ослаблен дефицитом витамина А, особенно IgA-реакцией слизистой оболочки, которая может быть важна для устойчивости к повторной инфекции, но не нужно забывать, что также может быть затронуто развитие Th1 памяти и CD8+ цитотоксического ответа Т-лимфоцитов [38, 44, 47].
Чрезмерное потребление витамина А может вызвать тошноту, рвоту, диарею, головную боль, у младенцев – лихорадку и повышение внутричерепного давления [48, 49]. К нарушениям, связанным с нервными функциями, относят спутанность сознания, раздражительность, беспокойство, депрессию и даже суицидальные мысли. Кроме того, острая интоксикация витамином А может привести к ухудшению зрения и снижению мышечной координации. Появляется все больше свидетельств того, что дозы витамина А, превышающие потребности в питании, могут привести к таким негативным последствиям, как окислительно-восстановительные нарушения, изменения клеточной сигнализации и в зависимости от типа клеток – к клеточной гибели или пролиферации [50].
Витамин Е – жирорастворимый антиоксидант, который защищает полиненасыщенные жирные кислоты в мембране от окисления, регулирует выработку активных форм кислорода. Основными пищевыми источниками витамина Е являются растительные масла, орехи. При приеме витамина Е сообщалось об увеличении пролиферации лимфоцитов, уровней иммуноглобулина, реакции антител, активности NK и продукции ИЛ-2.
Многие исследования подтвердили, что иммуностимулирующее действие витамина Е повышает устойчивость к инфекциям. Однако величина эффектов была довольно небольшой, и в некоторых исследованиях положительные эффекты наблюдались только в подгруппах испытуемых [51]. Предполагаемыми механизмами, связанными с этими изменениями, являются снижение продукции PGE2 путем ингибирования активности
циклооксигеназы-2, опосредованное снижением продукции NO, улучшение эффективного формирования иммунных синапсов в наивных Т-клетках и инициирование сигналов активации Т-клеток, и модуляция Th1/Th2 равновесия. Более высокая активность NK и изменения в функции дендритов, такие как снижение продукции и миграции ИЛ-12, наблюдались при применении витамина Е, но лежащие в основе механизмы нуждаются в дальнейшем выяснении [12, 38, 51, 52].
Исследования на животных, а также недавно завершенные клинические испытания убедительно свидетельствуют о том, что этот эффект витамина Е связан со снижением риска заражения инфекциями, особенно инфекциями верхних дыхательных путей, в том числе у пожилых людей [52].
К побочным эффектам при приеме витамина Е в стандартных дозах относят слабость, эмоциональные нарушения, усталость, болезненность молочных желез и боли в животе. Имеются данные, что при приеме высоких доз витамина Е в течение длительного времени происходит повышение уровня холестерина в плазме крови, а также возможно развитие тромбофлебита, особенно у лиц, предрасположенных к этому или принимающих препараты эстрогена [53]. Другие негативные эффекты витамина Е включают риск развития нейродегенеративных заболеваний, геморрагических осложнений за счет ингибирования агрегации тромбоцитов и витамин K-зависимых факторов свертывания и провоспалительный эффект, являющийся результатом усиления дифференцировки и медиаторной активности
Т-клеток [54].
Анализ публикаций показывает, что биологически активные добавки (Zn, Se, витамин С, витамин Е, бета-каротин) с микроэлементами могут быть эффективны в профилактике и улучшении клинического течения ОРВИ, включая инфекцию SARS-CoV-2. Достаточное количество цинка, селена и витаминов С, Е, А необходимо для устойчивости к вирусным инфекциям, иммунной функции и уменьшения клинических проявлений ОРВИ. Однако эффективность и безопасность микронутриентов, предоставляемых в тех диапазонах доз, при которых их действие наиболее выражено, требует дальнейшего изучения в различных группах больных, клинически здоровых и людей с риском респираторных заболеваний.
В качестве средства для профилактики ОРВИ можно рассмотреть комбинированный витаминно-минеральный комплекс Селцинк Плюс® (PRO.MED.CS Praha a. s., Czech Republic), в состав таблетки которого входит комплекс микроэлементов и витаминов, обладающий антиоксидантной активностью, в частности: Se – 50 мкг; Zn – 8 мг; бета-каротин – 4,8 мг; витамин Е – 23,5 мг; вита-
мин С – 200 мг. Эффекты препарата Селцинк Плюс® обусловлены свойствами входящих в состав препарата микроэлементов: Se и Zn, а также важных витаминов А, С и Е.
В комплексном лечении сезонных ОРВИ и гриппа перспективно в качестве дополнительной терапии применение новой формы препарата Селцинк® компании PRO.MED.CS Praha a. s – Селцинк Ультра Флю®, которая характеризуется повышенным содержанием Zn и витамина С, появившийся на отечественном фармацевтическом рынке в декабре 2022 г. В состав таблетки Селцинк Ультра Флю® входят: Se – 50 мкг; Zn – 20 мг; витамин С – 225 мг.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Попова Елена Николаевна – д-р мед. наук, проф. каф. внутренних, профессиональных болезней и ревматологии,
ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru
Elena N. Popova – D. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru
Пономарева Любовь Андреевна – ассистент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет).
E-mail: liubaponomareva18@yandex.ru
Liubov A. Ponomareva – Аssistant, Sechenov First Moscow State Medical University (Sechenov University).
E-mail: liubaponomareva18@yandex.ru
Чинова Алина Александровна – студентка, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Alina A. Chinova – Student, Sechenov First Moscow State Medical University (Sechenov University)
Митькина Мария Игоревна – студентка, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Maria I. Mitkina – Student, Sechenov First Moscow State Medical University (Sechenov University)
Поступила в редакцию / Received: 21.03.2023
Поступила после рецензирования / Revised: 23.03.2023
Принята к публикации / Accepted: 30.03.2023


