Клинический разбор в общей медицине №4 2023
Omsk State Medical University, Omsk, Russia
dmitry_trukhan@mail.ru
Abstract
The use of diuretics in arterial hypertension is pathogenetically justified, which is due to the significant role of an increase in the volume of circulating blood and the retention of sodium ions in the internal environment of the body, in increasing blood pressure. In clinical guidelines, the choice of a diuretic for the treatment of hypertension is limited to 3 drugs: hydrochlorothiazide, chlorthalidone and indapamide. Thiazide and thiazide-like diuretics are often combined into a single group of "thiazides", however, they have significant differences in the mechanism of their action, clinical effects, drug safety profile, partly in the parameters of the effectiveness of blood pressure control, as well as the evidence base in randomized clinical trials. In the first part of the review, along with evidence of the effectiveness of the use of diuretics in arterial hypertension, various aspects of the drug safety of drugs in this group are considered, both possible metabolic disorders and more rare, but possible disorders of the organ of vision, skin adverse reactions and the risk of acute respiratory distress. -syndrome. The second part of the review considers the efficacy and safety of the thiazide-like diuretic indapamide.
Key words: arterial hypertension, rational pharmacotherapy, drug safety, diuretics, treatment, indapamide, hydrochlorothiazide, chlorthalidone.
For citation: Trukhan D.I., Bagisheva N.V. Rational pharmacotherapy of arterial hypertension in real clinical practice: diuretics through drug safety. Clinical review for general practice. 2023; 4 (4): 48–59. DOI: 10.47407/kr2023.4.4.00256
Артериальная гипертензия (АГ) является многоуровневой проблемой кардиологии и современной медицины в целом. С одной стороны, АГ является одним из основных факторов риска развития сердечно-сосудистых заболеваний и их осложнений, с другой – самостоятельным заболеванием [1].
Сердечно-сосудистые заболевания занимают ведущее место в структуре неинфекционной патологии взрослого населения, являясь основной причиной ранней инвалидизации и преждевременной смерти [2–4].
Под рациональной фармакотерапией, в соответствии с определением Всемирной организации здравоохранения (ВОЗ), понимается назначение пациентам лекарственных средств, соответствующих клинической ситуации, в дозах, отвечающих индивидуальным потребностям, на адекватный период времени и по наименьшей стоимости для пациентов и общества [5]. Важной составляющей рациональной фармакотерапии является лекарственная
безопасность [6, 7] – одно из приоритетных базисных направлений современной медицины и фармации [8, 9].
Диуретики в лечении АГ. Применение диуретиков при АГ патогенетически обосновано, что обусловлено значимой ролью увеличения объема циркулирующей крови и задержки ионов натрия во внутренней среде организма в повышении артериального давления (АД) [10].
Тиазидные и тиазидоподобные диуретики на протяжении более 60 лет (после появления первого препарата этой группы в 1957 г.) входят в число основных классов антигипертензивных препаратов (АГП) 1-й линии антигипертензивной терапии. В рекомендациях Европейского общества кардиологов / Европейского общества артериальной гипертензии (ESC/ESH) 2018 г. [11] и Российских клинических рекомендациях 2020 г. [12] выбор диуретика для лечения АГ ограничен 3 препаратами: гидрохлоротиазид (ГХТ), хлорталидон и индапамид.
Ведущее место тиазидные и тиазидоподобные диуретики, безусловно, занимают в терапии АГ с низкой продукцией ренина, когда на первый план в формировании АГ выходит объем-зависимый патогенетический механизм, связанный с задержкой жидкости в организме, что часто наблюдается у пациентов с метаболическим синдромом, сахарным диабетом (СД), пожилого возраста, мультиморбидных больных с сопутствующей хронической сердечной недостаточностью и/или хронической болезнью почек со скоростью клубочковой фильтрации ≥30 мл/мин/1,73 м2, а также у представителей негроидной расы [10].
Диуретики объединяют несколько подгрупп препаратов с разным механизмом действия. С учетом ренальных эффектов тиазидные и тиазидоподобные диуретики можно разделить на два поколения. Первое поколение включает производные бензотиадиазина (ГХТ, бендрофлуметиазид, политиазид и др.) и хлорталидон, второе поколение – производные хлорбензамида (индапамид, ксипамид и др.) и квиназолинона (метолазон) [13].
Тиазидные и тиазидоподобные диуретики часто объединяются в единую группу «тиазиды», однако они имеют существенные различия в механизме своего действия, клинических эффектах, профиле лекарственной безопасности, отчасти – в параметрах эффективности контроля АД, а также доказательной базе в рандомизированных контролируемых исследованиях (РКИ) [14]. Так, ГХТ имеет дозозависимый характер влияния на уровень офисного АД, для индапамида такой зависимости не выявлено, а для хлорталидона предполагается наличие как дозозависимого, так и дозонезависимого компонента действия [14].
В РКИ и метаанализах накоплена обширная доказательная база о позитивном влиянии диуретиков на прогноз в виде снижения риска развития сердечно-сосудистых и цереброваскулярных осложнений [15]. При этом в рекомендациях ESC/ESH (2018 г. ) [11] подчеркивается, что тиазидоподобные диуретики превосходят тиазидные в отношении эффективности и прогностической значимости. В метаанализе китайских кардиологов, которые провели объединенное исследование результатов 19 РКИ [16] с участием 112 113 пациентов (56 802 – получавших диуретики; 55 311 – в контрольной группе) было установлено, что лечение тиазидными и тиазидоподобными диуретиками было связано со снижением риска сердечно-сосудистых заболеваний (отношение шансов – ОШ 0,86, p=007) и сердечной недостаточности (ОШ 0,62, p<0,001), но не отличалось от инсульта (ОШ 0,92, p=0,438) или ишемической болезни сердца (ОШ 0,95, p=0,378) между диуретиками и контрольной группой. Дальнейший анализ, проведенный авторами, показал, что наблюдаемые преимущества были связаны с применением тиазидоподобных диуретиков, а не с диуретиками тиазидного типа, с более значимым снижением риска сердечно-сосудистых заболеваний (ОШ 0,78, p<0,001), сердечной недостаточности (ОШ 0,57, p<0,001) и инсульта (ОШ 0,82, p=0,016).
Вместе с тем при сходном влиянии тиазидоподобных диуретиков на снижение цереброваскулярных событий / инсультов и общую смертность хлорталидон увеличивает риск первичной ишемической болезни сердца (относительный риск – ОР 2,0, 95% ДИ 0,86–4,67) по сравнению с индапамидом (ОР 0,53, 95% ДИ 0,36–0,77) [14].
В системном обзоре и метаанализе ученых из США (38 РКИ) [17] показано, что тиазидоподобные диуретики превосходят ГХТ в снижении массы миокарда левого желудочка в 2 раза.
Тиазидоподобные диуретики имеют существенно больший период полувыведения по сравнению с тиазидами: для хлорталидона этот показатель составляет 40–60 ч, для индапамида – до 14–24 ч, а для ГХТ – 6–15 ч [14]. Длительность действия хлорталидона составляет 48–72 ч, для индапамида ≥24 ч, а у ГХТ существенно варьирует, составляя в среднем 16 ч. В сравнительном исследовании низких доз диуретиков хлорталидона 6,25 мг и ГХТ 12,5 мг по результатам суточного мониторирования АД индийскими кардиологами сделан вывод, что ГХТ в дозе 12,5 мг оказывает антигипертензивный эффект преимущественно в дневное время и не влияет на уровень АД в ночные часы, что не позволяет рассматривать монотерапию низкими дозами ГХТ в качестве эффективной терапии АГ [18].
Возможность использования ГХТ для монотерапии в качестве препарата 1-й линии для лечения АГ поставили под сомнение и ученые из Колумбийского университета (США) в систематическом обзоре и метаанализе, в который были включены 14 РКИ с применением ГХТ в дозе 12,5–25 мг и 5 исследований с ГХТ в дозе 50 мг, в котором был проведен амбулаторный мониторинг АД и сравнение контроля АД в течение 24 ч при использовании ГХТ и других АГП [19]. Авторы отметили явно недостаточный антигипертензивный эффект ГХТ в сравнении с четырьмя другими основными классами АГП, как по систолическому, так и по диастолическому АД [19].
В этой связи следует помнить, что ночное снижение АД является важной составляющей его суточного профиля, поскольку в большей степени, по сравнению с дневным, влияет на прогноз пациента в отношении сердечно-сосудистых и цереброваскулярных осложнений [20–22]. Так, установлено, что наиболее неблагоприятным суточным профилем АД служит тип night-picker – при котором АД в ночное время не только не снижается, а напротив, повышается. Для типа night-picker характерна тесная ассоциация с поражением органов-мишеней при АГ, а также связано наибольшее число сердечных смертей, инфарктов, транзиторных ишемических атак и инсультов [20–22].
Лекарственная безопасность диуретиков. Наряду с вопросом эффективности различных диуретиков, используемых для лечения АГ, актуальным является профиль их лекарственной безопасности.
Метаболические нарушения. В ряде метаанализов высказываются опасения о том, что терапия диуретиками может приводить к нарушениям электролитного баланса, негативным метаболическим эффектам – нарушениям липидного, пуринового и углеводного обмена, вплоть до повышения риска развития СД 2-го типа [23–27]. Прежде всего эти опасения относятся к тиазидным и тиазидоподобным диуретикам первого поколения – ГХТ и хлорталидону. Так, в крупномасштабном многоцентровом сравнительном когортном исследовании [28] были проанализированы эпизоды амбулаторного и стационарного лечения пациентов, впервые использовавших антигипертензивную монотерапию диуретиками в США за период 2001–2018 гг. Из 730 225 пациентов (средний возраст 51,5 года, 61,6% женщины) 36 918 получали хлорталидон и 693 337 получали ГХТ. Хлорталидон был связан со значительно более высоким риском гипокалиемии (ОР 2,72, 95% ДИ 2,38–3,12), гипонатриемии (ОР 1,31, 95% ДИ 1,16–1,47), острой почечной недостаточности (ОР 1,37; 95% ДИ 1,15–1,63), хронического заболевания почек (ОР 1,24, 95% ДИ 1,09–1,42) и СД 2-го типа (ОР 1,21; 95% ДИ 1,12–1,30) и со значительно более низким риском диагностированного аномального увеличения массы тела (ОР 0,73, 95% ДИ 0,61–0,86). Исследователи подчеркивают, что использование хлорталидона было связано с более высоким риском почечных и электролитных нарушений [28]. В другом обзоре отмечается, что риск гипонатриемии, гипокалиемии и гиперурикемии, связанные с ГХТ, ниже, чем при использовании хлорталидона, но при этом терапия ГХТ менее эффективно снижала АД в сравнении с хлорталидоном, бендрофлуметиазидом и особенно индапамидом, и была на 18% и более связана с побочными эффектами со стороны сердечно-сосудистой системы в сравнении с хлорталидоном [29].
В метаанализах, посвященных оценке клинической эффективности и безопасности ГХТ, хлорталидона и индапамида, отмечается, что тиазидоподобные диуретики превосходят ГХТ в снижении АД без увеличения частоты гипокалиемии и гипонатриемии и изменений со стороны показателей углеводного и липидного обмена [30, 31]. В метаанализе ученых из Тайваня показано, что даже у пациентов, принимавших низкие дозы ГХТ, отмечается существенное повышение уровня глюкозы натощак и HbA1c, и снижение холестерина липопротеидов высокой плотности [26].
Метаанализ сравнительного риска дискалимии (гипер- и гипокалиемии) представителей различных групп антигипертензивных препаратов, применяемых в качестве монотерапии и комбинированного лечения [32], продемонстрировал значимое повышение риска развития гипокалиемии по сравнению с плацебо при использовании комбинации блокаторов рецепторов к ангиотензину II с высокой дозой ГХТ (25 мг).
Для оценки распространенности гипокалиемии, связанной с приемом ГХТ, американские исследователи включили в исследование взрослых пациентов в возрасте ≥20 лет из национальной программы социального исследования, проводимой Национальным центром статистики здравоохранения (NHANES) в 1999–2018 гг. [33]. Гипокалиемия была отмечена у 12,6% пациентов, принимавших ГХТ, что эквивалентно ~2,0 млн взрослых в США. Более высокий риск гипокалиемии отмечен у женщин (ОШ 2,22, 95% ДИ 1,74–2,83), неиспаноязычных представителей негроидной расы (ОШ 1,65, 95% ДИ 1,31–2,08), лиц с дефицитом массы тела (ОШ 4,33, 95% ДИ 1,34–13,95) и пациентов, принимавших ГХТ в течение 5 лет или более (ОШ 1,47, 95% ДИ 1,06–2,04).
Эти же авторы оценили частоту гипокалиемии у пациентов, принимавших тиазидоподобный диуретик индапамид [34]. В проведенном ими крупном популяционном исследовании с 147 319 человеко-годами наблюдения (всего 62 881 пациент, принимавший индапамид) тяжелая гипокалиемия, требующая госпитализации, была редкостью – отмечена у 509 пациентов (0,8%). Ученые отметили, что 53% этих госпитализаций произошли в течение 1-го года лечения, а 1/2 из них в первый год произошла в течение первых 16 нед. С госпитализацией был связан женский пол (ОШ 1,75; 95% ДИ 1,45–2,12). В многомерной исследовательской модели пожилой возраст не был значимым предиктором. Во время госпитализации не было отмечено смертельных случаев, а средняя продолжительность пребывания в стационаре составила один день.
В многоцентровом американском сравнительном РКИ хлорталидона и ГХТ (13 523 пациента) частота гипокалиемии была выше в группе хлорталидона, чем в группе ГХТ (6,0% против 4,4%, p<0,001). Кроме того, у пациентов, получавших хлорталидон, не отмечено более низкой частоты основных сердечно-сосудистых исходов или смертей, не связанных с раком, чем у пациентов, получавших ГХТ [35].
Нарушения со стороны органа зрения. Во втором десятилетии нынешнего века инструкции по применению ГХТ были дополнены информацией о возможном развитии острой транзиторной миопии и острой закрытоугольной глаукомы [36–38]. Одним из первых
сообщений была публикация американских офтальмологов в 1995 г. о возможном развитии двусторонней
закрытоугольной глаукомы, связанной с повышенной чувствительностью к ГХТ [39]. Канадские и американские офтальмологи связали развитие двусторонней острой закрытоугольной глаукомы с гипонатриемией, вызванной ГХТ [40].
 Корейские офтальмологи описали 2 случая вызванной ГХТ двусторонней миопии с острым началом и мелированием передних камер у женщин среднего возраста, которые обратились с жалобами на острое двустороннее ухудшение зрения [41]. Обе пациентки имели хорошую остроту зрения без корректирующих линз до начала приема ГХТ. Полное офтальмологическое обследование выявило двусторонний миопический сдвиг, повышение внутриглазного давления, мелирование передних камер, хориоидальный выпот, лучистые складки сетчатки и хемоз конъюнктивы. Примерно через неделю после прекращения приема ГХТ все глазные изменения полностью исчезли.
Корейские офтальмологи описали 2 случая вызванной ГХТ двусторонней миопии с острым началом и мелированием передних камер у женщин среднего возраста, которые обратились с жалобами на острое двустороннее ухудшение зрения [41]. Обе пациентки имели хорошую остроту зрения без корректирующих линз до начала приема ГХТ. Полное офтальмологическое обследование выявило двусторонний миопический сдвиг, повышение внутриглазного давления, мелирование передних камер, хориоидальный выпот, лучистые складки сетчатки и хемоз конъюнктивы. Примерно через неделю после прекращения приема ГХТ все глазные изменения полностью исчезли.
Китайские офтальмологи описали у 34-летней азиатской женщины выраженное снижение остроты бинокулярного зрения через 6 ч после приема только одной дозы ГХТ 25 мг, топирамата 25 мг и флуоксетина 22,4 мг для снижения массы тела [42]. У пациентки диагностировали острую двустороннюю миопию и сужение угла зрения. При первичном осмотре выявлено снижение остроты зрения 20/100 с обеих сторон, повышение внутриглазного давления 23 мм рт. ст. на правом глазу и 24 мм рт. ст. на левом, супрахориоидальный выпот и сужение угла. После отмены этих препаратов и назначения препаратов, снижающих внутриглазное давление, зрение постепенно нормализовалось.
Индийские офтальмологи описали случай внезапной потери зрения из-за развития острой миопии после приема хлорталидона [43]. Клинически это было связано с цилиарным спазмом, неглубоким периферическим хориоидальным выпотом и стриями сетчатки в макуле с увеличением толщины желтого пятна, наблюдаемым на оптической когерентной томографии. После отмены хлорталидона зрение постепенно нормализовалось.
Кожные побочные реакции. В конце 2018 г. ряд производителей лекарственных препаратов для лечения АГ, содержащих в качестве действующего вещества ГХТ, заявили о выявлении новых побочных эффектов [44]. Согласно данным двух фармакоэпидемиологических исследований, выполненных с использованием данных Датского национального регистра рака [45, 46], была продемонстрирована связь между приемом ГХТ и повышенным риском развития немеланомного рака кожи (НМРК) – базально-клеточной карциномы (БКК) и плоскоклеточного рака кожи (ПРК). Применение ГХТ (в суммарной дозе ≥50 000 мг) было связано с ОР 1,29 (95% ДИ 1,23–1,35) для БКК и ОР 3,98 (95% ДИ 3,68–4,31) для ПРК.
Риск развития НМРК возрастал при увеличении суммарной (накопленной) дозы ГХТ. При кумулятивной дозе (≥200 000 мг ГХТ) отмечены ОР 1,54 (95% ДИ 1,38–1,71) для БКК и ОР 7,38 (95% ДИ, 6,32–8,60) для ПРК.
Возможным механизмом развития НМРК является фотосенсибилизирующее действие ГХТ. Пациентам, принимающим ГХТ и содержащие его комбинированные препараты необходимо регулярно осматривать кожу и следить за появлением новых подозрительных поражений или изменения уже имеющихся. При обнаружении подозрительных изменений кожи следует незамедлительно обратиться к врачу. Для минимизации риска развития НМРК пациентам следует ограничить воздействие солнечного света и ультрафиолетовых лучей, а также пользоваться защитными средствами. Для пациентов с НМРК в анамнезе следует пересмотреть целесообразность применения ГХТ [47]. Диагностике изменений кожи при приеме ГХТ может помочь фототестирование, фотопатч-тестирование и биопсия кожи [48].
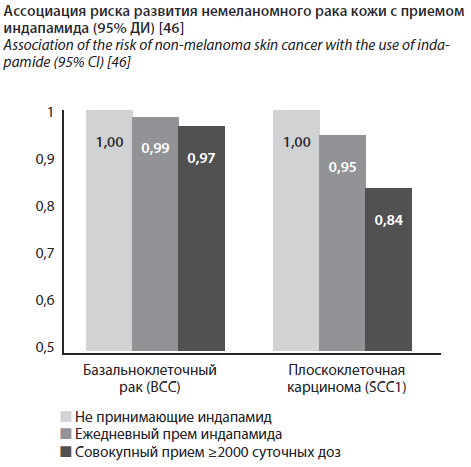
Датские ученые отметили, что использование других диуретиков и антигипертензивных средств не было связано с НМРК. Так, при использовании индапамида, напротив, исследователями отмечена (см. рисунок) отрицательная ассоциация с НМРК [46].
Португальские ученые также отметили возможную связь между использованием ГХТ и НМРК, и сообщили, что португальское национальное управление по лекарственным средствам и продуктам медицинского назначения (INFARMED) выпустило предупреждение для медицинских работников о повышенном риске НМРК
у пациентов, подвергшихся воздействию кумулятивных доз ГХТ [49]. Испанские исследователи [50] использовали данные испанской системы фармаконадзора и отметили, что для развития БКК ОШ составляет 4,8 (95% ДИ 2,2–10,7), а для развития ПРК ОШ=3,2 (95% ДИ 0,9–10,5).
В систематическом обзоре французских ученых [51] продемонстрирован повышенный риск развития ПРК. В другом исследовании в одноцентровой когорте реципиентов почек (n=2155), комбинированных реципиентов почки+поджелудочная железа (n=282) и пациентов после трансплантации поджелудочной железы (n=59) французскими трансплантологами отмечено, что воздействие ГХТ было связано с двукратно более высоким риском ПРК [52].
Связь между приемом ГХТ и повышенным риском развития НМРК – БКК и ПРК, а также рака губы была выявлена учеными из Шотландии для населения Великобритании [53].
В ретроспективном исследовании ученых из США [54] показано, что использование ГХТ было связано с более высоким риском развития БКК (ОР 1,09, 95% ДИ 1,07–1,11) и ПРК (ОР 1,15, 95% ДИ 1,12–1,17) среди представителей европеоидной расы. Кумулятивная доза ГХТ 50 000 мг или более была связана с повышенным риском ПРК в общей популяции (ОШ 1,19, 95% ДИ 1,05–1,35) и среди представителей европеоидной расы (ОШ 1,27, 95% ДИ 1,10–1,47).
Канадские ученые провели популяционное когортное исследование, в котором выявили повышение риска ПРК при использовании ГХТ [55]. Так, после 8,6-летнего медианного наблюдения ГХТ ассоциировался с повышенным риском ПРК (ОР 1,50, 95% ДИ 1,06–2,11). Риск увеличивался с кумулятивной продолжительностью использования, с доказательствами ассоциации через 5–10 лет (ОР 2,10, 95% ДИ 1,20–3,67) и самым высокими через >10 лет (ОР 3,70, 95% ДИ 1,77–7,73). Аналогичным образом ОР увеличивался при кумулятивной дозе, причем более высокие оценки были получены для ≥100 000 мг (ОР 4,96, 95% ДИ 2,51–9,81).
В систематическом обзоре и метаанализе (2181 исследований) бразильских ученых [56] продемонстрирована вероятность развития плоскоклеточного рака губ и ПРК в любой области тела у пациентов, принимавших ГХТ, в 1,76 раза выше, чем у непринимавших ГХТ. Кроме того, у принимавших ГХТ наблюдалось повышение риска развития (ОР 1,80, 95% ДИ 1,71–1,89) ПРК в области головы и шеи.
В систематическом обзоре и метаанализе [57] ученых из Тайваня (всего более 17 млн пациентов) показана связь применения ГХТ с повышенным риском НМРК (ОШ 1,16, 95% ДИ 1,08–1,24; ОР 1,26, 95% ДИ 1,04–1,54), ПРК (ОШ 1,32, 95% ДИ 1,06–1,65; ОР 1,61, 95% ДИ 0,97–2,67) и меланомы (ОШ 1,11, 95% ДИ 1,02–1,20; ОР 1,03, 95% ДИ 0,93–1,14). Повышенные риски для развития ПРК были связаны с высокими кумулятивными дозами ГХТ (ОШ 2,56, 95% ДИ 1,43–4,57; ОР 1,20, 95% ДИ 1,00–1,45).
Применение ГХТ также ассоциировалось с различными подтипами меланомы, включая поверхностно распространяющуюся (ОШ 1,18, 95% ДИ 1,05–1,33) и узловую (ОШ 1,23, 95% ДИ 1,08–1,39) формы и злокачественную меланому (ОШ 1,33, 95% ДИ 1,08–1,39). Однако связь применения ГХТ с развитием меланомы отмечена в неазиатских странах. Никакого значимого увеличения риска развития рака кожи не было связано с применением бендрофлуметиазида и индапамида [57].
Ученые из США [58] проанализировали среди неиспаноязычных пациентов европеоидной расы 9176 случаев меланомы и данные 264 781 контрольной группы, и небольшое увеличение риска меланомы всех подтипов вместе взятых, связанное с высоким использованием (≥50 000 мг) ГХТ (OР 1,11, 95% ДИ 1,00–1,23). Риск был выше для подтипа лентиго (ОШ 1,57, 95% ДИ 1,01–2,42). Несколько повышенный риск отмечен для узлового подтипа, но не был статистически значимым (ОШ 1,22, 95% ДИ 0,78–1,90), и также отмечена очень незначительная связь с поверхностным подтипом распространения (ОШ 1,05, 95% ДИ 0,80–1,37).
В популяционном исследовании «случай–контроль» [59], которое включало 6880 пациентов с впервые выявленным раком молочной железы, плоскоклеточным раком почки и инвазивным плоскоклеточным раком в период с 2003 по 2017 г. в Исландии и 69 620 человек в контрольной группе населения. Кумулятивная доза ГХТЗ выше 37 500 мг была связана с повышенным риском инвазивного ПРК (ОР 1,69, 95% ДИ 1,04–2,74). Пациенты, принимавшие ГХТ, также имели повышенный риск плоскоклеточного рака in situ (OР 1,24, 95% ДИ 1,01–1,52) и БКК (OР 1,14, 95% ДИ 1,02–1,29).
Все эти данные не означают, что ГХТ должен быть запрещен для каждого пациента, поскольку он не оказывает прямого канцерогенетического воздействия, однако косвенно приводит к повышению фоточувствительности кожи [60].
В датском общенациональном обсервационном исследовании [61] авторы провели описательный анализ когорты, включающей всех датских пользователей антигипертензивного лечения с января 2016 г. по сентябрь 2020 г. (n=1 316 476), с особым акцентом на пользователей ГХТ (n=309 743). Авторы отметили, что после публикации данных о риске развития НМРК у пациентов, принимающих ГХТ, использование ГХТ сократилось на 44% с января 2016 г. по сентябрь 2020 г., при этом доля всех комбинированных антигипертензивных препаратов, в состав которых входил ГХТ, снизилась с 12,7% до 7,2%. Это снижение было более выраженным среди молодых пациентов и пациентов с указанием в анамнезе на рак кожи. Одновременно ежемесячный показатель новых пациентов, принимающих ГХТ, в Дании снизился с ≈2350 в течение 2017 г. до 652 в течение 2020 г.
Болгарские дерматологи [62] представили клинический случай развития редкого синдрома бабуина или симметричной лекарственной интертригинозной и изгибной экзантемы (синдром SDRIFE), который возник после приема комбинации валсартан + ГХТ 160/25 мг в течение 6 лет. Пациент, мужчина 57 лет, соответствовал всем пяти диагностическим критериям этого синдрома. Отмена комбинации валсартан + ГХТ, местное и системное применение глюкокортикостероидов и антибактериальных препаратов способствовали облегчению симптомов, а последующее наблюдение показало благоприятные результаты с полной ремиссией кожных высыпаний через 4 нед. Ранее португальские врачи сообщили о случае развития синдрома SDRIFE у 48-летней женщины [63], что характеризовалось появлением резко отграниченной эритемы нижних шейных складок, подмышечных впадин и ягодичной области, начавшейся через 4 дня после начала приема комбинации телмисартана + ГХТ для лечения АГ. Биопсия кожи выявила плотный периваскулярный и периаднексальный лимфогистиоцитарный инфильтрат в поверхностной дерме с эозинофилами и тучными клетками. После отмены комбинации телмисартан + ГХТ и назначения глюкокортикостероидов отмечено постепенное исчезновение изменений на коже.
Острый респираторный дистресс-синдром. Федеральное государственное бюджетное учреждение «Научный центр экспертизы средств медицинского применения» в своем письме в марте 2023 г. дало рекомендации производителям лекарственных препаратов, содержащих в своем составе ГХТ, внести изменения в инструкции по его применению [64]. Это связано с тем, что в конце прошлого года зарубежные регуляторы обращения лекарственных средств (Управление по контролю за оборотом лекарственных средств и изделий медицинского назначения Австралии – TGA от сентября 2022 г., Агентство по фармацевтическим препаратам и медицинским изделиям Японии Pharmaceutical and Medical Devices Аgеnсе – РМРА от ноября 2022 г. и регуляторный орган Канады – Неаlth Сапаdа от декабря 2022 г.) опубликовали новые данные по безопасности применения ГХТ, касающиеся возможного развития ранее не описанного побочного действия – острого респираторного дистресс-синдрома (ОРДС) [64].
Сообщения о риске развития ОРДС у взрослых пациентов, связанном с приемом ГХТ, впервые появились в 1980-х годах [65, 66].
В 1990 г. пульмонологи из Кливленда (Огайо, США) описали клинический случай развития острого отека легких, вызванного ГХТ, и рассмотрели в своем обзоре 16 ранее описанных случаев [67].
В 1991 г. датские врачи описали развитие острого отека легких у 44-летней женщины, который развился через 30 мин после приема одной таблетки препарата Модуретик (ГХТ + амилорид). В обзоре авторы указывают на 18 случаев отека легких, вызванного ГХТ, описанные ранее [68]. В этом же году канадские ученые в своей публикации [69] рассмотрели клинические особенности 4 неопубликованных случаев и 26 опубликованных случаев острого аллергического интерстициального пневмонита, индуцированного ГХТ. Авторы отметили, что дебют пневмонита был острым, среднее время до появления симптомов составляло 44 мин. Преобладающим фактором риска являлся женский пол –
27 (90%) из 30 пациентов были женщинами. Средний возраст составлял 56 лет; таким образом, большинство женщин находились в постменопаузе. Лечение было поддерживающим; отказ от приема ГХТ был единственным эффективным методом профилактики.
В 1992 г. гериатры из Тайваня [70] описали развитие у мужчины 67 лет после приема таблетки ГХТ некардиогенного отека легких. Симптомы уменьшились после симптоматической терапии, но появились снова после повторного применения ГХТ. Иммунологические исследования показали повышенный уровень иммуноглобулина Е. Авторы в обзоре рассмотрели еще 22 ранее зарегистрированных случая. Параллельно врачи из США [71] представили описание клинического случая развития у 42-летней женщины европеоидной расы тяжелого ОРДС через 30 мин после приема ГХТ. В рамках обсуждения в обзоре авторы рассмотрели еще 12 аналогичных клинических случаев.
В первом десятилетии XXI в. ученые из университета Торонто (Канада) в 2005 г. [72] привели описание трех случаев развития ОРДС у женщин в возрасте 64, 56 и 59 лет. В первых двух случаях – через 10–60 мин после приема 25 мг ГХТ, в последнем – после приема однократной дозы ГХТ + триамтерен. Приведенный обзор включал 36 дополнительных случаев некардиогенного отека легких после применения тиазидов. У пациентов симптомы развивались через 10–150 мин после приема ГХТ или другого тиазидного диуретика. Авторы отметили, что 90% задокументированных случаев произошли у женщин. В 2007 г. бельгийские кардиологи [73] сообщили о случае развития отека легких, связанного с низким давлением наполнения левого желудочка и гипотонией, возникшей у пациента вскоре после приема 12,5 мг ГХТ. Проведенный авторами анализ литературы (поиск Medline) выявил 49 подобных случаев. Авторы предположили, что в основе этой неблагоприятной лекарственной реакции на ГХТ лежит аллергическая реакция III типа.
В следующем десятилетии врачи из отделения неотложной медицинской помощи Бостона (США) [74] опубликовали сообщение о развитии у 50-летнего пациента после приема начальной дозы ГХТ прогрессирующей дыхательной недостаточности, для лечения которой они вынуждены были применить экстракорпоральную мембранную оксигенацию. Подобный клинический случай параллельно был описан докторами из штата Иллинойс (США) [75]. Итальянские кардиологи [76] у 73-летней женщины после замены амлодипина на комбинированную терапию с рамиприл + ГХТ через 20 мин после приема нового препарата отметили у пациентки появление лихорадки, рвоты и диареи, сразу за которыми последовало острое начало одышки.
ОРДС невольно возвращает нас к периоду пандемии новой коронавирусной инфекции (COVID-19) и еще к одному возможному побочному эффекту диуретиков – повышению уровня мочевой кислоты.
Гиперурикемия. Наличие бессимптомной гиперурикемии и подагры как сопутствующего заболевания является абсолютным противопоказанием к применению ГХТ и хлорталидона и относительным противопоказанием для индапамида [12], что также актуально в период пандемии COVID-19, поскольку SARS-CoV-2 может усиливать катаболические процессы в организме и приводить к развитию гиперурикемии [77]. Мочевая кислота потенциально вызывает повреждение почек путем изменения почечной ауторегуляции, ингибирования пролиферации эндотелиальных клеток, клеточного апоптоза, активации провоспалительного каскада и отложения кристаллов. Гиперурикемия у пациентов с COVID-19 может способствовать острому повреждению почек и неблагоприятным исходам [77–79].
Ассоциация использования диуретиков с повышенным риском развития подагры показана в целом ряде исследований и обзоров [80–83]. Многофакторный относительный риск возникновения подагры, связанный с текущим приемом антигипертензивных препаратов среди пациентов с гипертензией (n=29 138) составил для диуретиков 2,36 (95% ДИ 2,21– 2,52), в то время как для лозартана 0,81 (95% ДИ 0,70–0,94) и 0,87 (95% ДИ 0,82–0,93) для антагонистов кальция [80].
Частота развития гиперурикемии и подагры неодинакова для разных классов диуретиков: наиболее часто она ассоциирована с приемом петлевых и тиазидных диуретиков, нежели тиазидоподобных [84, 85]. Комбинированное использование петлевых и тиазидных диуретиков [81] ассоциировалось с самыми высокими оценками относительного риска подагры 4,65 (95% ДИ 3,51–6,16). Статистически значимое увеличение мочевой кислоты на 35 мкмоль/л на фоне использования хлорталидона было продемонстрировано в исследовании SHEP [86] у пожилых пациентов с изолированной систолической АГ. Повышение концентрации мочевой кислоты в сыворотке крови, вызванное диуретиками, развивается, как правило, в течение нескольких дней после начала лечения, может сохраняться при длительном ее проведении на протяжении всего лечения [87, 88] и усиливаться дозозависимым образом [89, 90].
Индапамид по сравнению с другими диуретиками в меньшей степени вызывает повышение уровня мочевой кислоты в сыворотке крови [91–96]. В Кокрейновском обзоре (Cochrane, 2014 г.) при непрямом сравнении влияния диуретиков на уровень мочевой кислоты продемонстрировано значимо меньшее влияние индапамида по сравнению с ГХТ и, особенно, хлорталидоном [94].
В нашем исследовании комбинация эналаприла с индапамидом (1-я группа) по сравнению с комбинацией эналаприла с ГХТ (2-я группа) через 3 мес лечения не только выявила высокую метаболическую нейтральность, но и показала более выраженный эффект в снижении уровня АД и улучшения качества жизни [96, 97]. В 1-й группе исходный уровень калия в сыворотке крови повысился на 1,7%, уровень глюкозы снизился на 1%, уровень мочевой кислоты повысился на 0,8%. Во
2-й группе исходный уровень калия в сыворотке крови снизился на 7,2%, уровень глюкозы повысился на 8,7%, уровень мочевой кислоты повысился на 4,5%.
Индапамид: эффективность и безопасность. Синтезированный в 1974 г. тиазидоподобный диуретик индапамид не стал мишенью для критических стрел по поводу своей эффективности и безопасности [98–100].
Индапамид оказывает антигипертензивный эффект на протяжении суток (как в дневное, так и ночное время), а также стабилизирует вариабельность АД,
которая тесным образом ассоциирована с развитием сердечно-сосудистых осложнений и прогрессированием поражения органов-мишеней АГ [101]. В дозах, используемых при АГ (0,625–2,5 мг/сут) индапамид действует, прежде всего, как артериальный вазодилататор. При его применении в дозе 2,5 мг/сут суточный объем мочи почти не изменяется. Индапамид, благодаря его хорошо документированному позитивному влиянию на сердечно-сосудистые и почечные исходы, представляет собой безопасный и ценный вариант лечения пациентов с высоким АД с учетом ассоциирующихся с АГ факторов риска [102].
В метаанализе 9 РКИ, включавшем более 10 тыс. пациентов, показано, что частота нежелательных реакций при использовании индапамида сравнима с плацебо (ОР 0,97, 95% ДИ 0,76–1,22) [103]. В 6-месячном многоцентровом проспективном наблюдательном интервенционном открытом клиническом исследовании ACES с участием 9124 амбулаторных пациентов – авторами отмечена метаболическая нейтральность индапамида, сходная с карведилолом и амлодипином [104].
Индапамид практически не оказывает влияния на метаболические процессы в организме: экскрецию калия, уровни глюкозы, холестерина и мочевой кислоты в крови. Метаболическая безопасность и высокая эффективность применения индапамида в обычной (2,5 мг) и в ретардированной форме (1,5 мг), в том числе и у проблемных пациентов (с АГ и СД 2-го типа, метаболическим синдромом и у пациентов пожилого возраста), подтверждена результатами международных и российских исследований ADVANCE, HYVET, NESTOR, PROGRESS, АРГУС-2, МИНОТАВР, ЭПИГРАФ и целого ряда других [13, 100].
В экспериментальном исследовании индапамид предотвращал развитие фиброза миокарда у молодых спонтанно гипертензивных крыс, но при этом не оказывал влияния на соотношение коллагена типа I к типу III. Антифибротический эффект индапамида не связан с метаболизмом оксида азота [105].
Нефропротективный эффект индапамида [106] наиболее отчетливо продемонстрирован в комбинации с периндоприлом на всех стадиях хронической болезни почек у пациентов с АГ и СД [107, 108].
На основании результатов 26 РКИ индапамид рассматривается как оптимальный диуретик для применения у пациентов с нормолипидемией или гиперлипидемией, поскольку увеличивает уровень холестерина липопротеинов высокой плотности и при этом не повышает уровень холестерина липопротеинов низкой плотности [109].
Таким образом, индапамид, имеющий доказанные органопротективные свойства, наиболее оптимальный метаболический профиль среди диуретиков и благоприятно влияющий на прогноз в рамках сердечно-сосудистого континуума, занимает прочные позиции как в моно-, так и в комбинированной терапии АГ [98–110].
Индапамид одобрен FDA не только для лечения первичной гипертензии в качестве монотерапии или в сочетании с другими антигипертензивными препаратами, но и для лечения задержки соли и жидкости, связанной с хронической сердечной недостаточностью [111].
Генерический препарат индапамида – Индап® (PRO.MED.CS Praha a. s., Czech Republic) является единственным генериком индапамида с наличием объективных доказательств терапевтической эквивалентности с двумя формами выпуска оригинального индапамида [112]. Успешный опыт использования препарата Индап® в России на протяжении 25 лет, данные широкомасштабных проектов с длительным наблюдением пациентов, проведенных практически во всех регионах Российской Федерации и других странах, свидетельствуют о его метаболической нейтральности, наличии органопротективных свойств и высокой антигипертензивной эффективности, в том числе и у проблемных мультиморбидных пациентов (с артериальной гипертензией и СД 2-го типа или метаболическим синдромом, пациентов гериатрической практики). Индап® может эффективно и безопасно применяться как в сочетании с липидснижающими и антигипергликемическими препаратами, так и в комбинации с другими антигипертензивными препаратами [98, 99, 110, 112–117].
Появление на российском фармацевтическом рынке новой формы выпуска препарата Индап® , делимой на 4 равные части (со специальной риской) таблетки индапамида 2,5 мг, не только способствует удобству его применения и повышению приверженности пациентов к лечению, но и дает возможность врачу в условиях реальной клинической практики титровать индапамид в 4 разных дозах (0,625 мг, 1,25 мг, 1,875 мг, 2,5 мг) и комбинировать его с другими АГП, что способствует профилактике дозозависимых нежелательных реакций за счет возможности постепенного титрования дозы, позволяет индивидуализировать подбор минимально эффективной дозы индапамида, что наиболее актуально для пациентов старших возрастных групп, с наличием ишемической болезни сердца и гемодинамически значимых стенозов брахиоцефальных артерий, перенесших инсульт или транзиторную ишемическую атаку, а также в постковидном периоде после новой коронавирусной инфекции (COVID-19), для которого характерна нестабильность АД.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Трухан Дмитрий Иванович – д-р мед. наук, доц., проф. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО
ОмГМУ. E-mail: dmitry_trukhan@mail.ru; ORCID 0000-0002-1597-1876
Dmitry I. Trukhan – D. Sci. (Med.), Prof., Omsk State Medical University. E-mail: dmitry_trukhan@mail.ru; ORCID: 0000-0002-1597-1876
Багишева Наталья Викторовна – канд. мед. наук, доц. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО
ОмГМУ. E-mail: ppi100@mail.ru; ORCID: 0000-0003-3668-1023
Natalya V. Bagisheva – Cand. Sci. (Med.), Omsk State Medical University. E-mail: ppi100@rambler.ru; ORCID: 0000-0003-3668-1023
Поступила в редакцию / Received: 17.04.2023
Поступила после рецензирования / Revised: 28.04.2023
Принята к публикации / Accepted: 25.05.2023
Клинический разбор в общей медицине №4 2023
Рациональная фармакотерапия артериальной гипертензии в реальной клинической практике: диуретики сквозь призму лекарственной безопасности
Номера страниц в выпуске:48-59
Аннотация
Применение диуретиков при артериальной гипертензии (АГ) патогенетически обосновано, что обусловлено значимой ролью увеличения объема циркулирующей крови и задержки ионов натрия во внутренней среде организма в повышении артериального давления.
В клинических рекомендациях выбор диуретика для лечения АГ ограничен 3 препаратами: гидрохлоротиазид, хлорталидон и индапамид. Тиазидные и тиазидоподобные диуретики часто объединяются в единую группу «тиазиды», однако они имеют существенные различия в механизме своего действия, клинических эффектах, профиле лекарственной безопасности, отчасти – в параметрах эффективности контроля артериального давления, а также доказательной базе в рандомизированных клинических исследованиях. В первой части обзора, наряду с доказательствами эффективности применения диуретиков при АГ, рассмотрены различные аспекты лекарственной безопасности препаратов этой группы, как возможные метаболические нарушения, так и более редкие, но возможные нарушения со стороны органа зрения, кожные побочные реакции и риск развития острого респираторного дистресс-синдрома. Во второй части обзора рассмотрены вопросы эффективности и безопасности тиазидоподобного диуретика индапамида.
Ключевые слова: артериальная гипертензия, рациональная фармакотерапия, лекарственная безопасность, диуретики, лечение, индапамид, гидрохлоротиазид, хлорталидон.
Для цитирования: Трухан Д.И., Багишева Н.В. Рациональная фармакотерапия артериальной гипертензии в реальной клинической практике: диуретики сквозь призму лекарственной безопасности. Клинический разбор в общей медицине. 2023; 4 (4): 48–59.
DOI: 10.47407/kr2023.4.4.00256
Применение диуретиков при артериальной гипертензии (АГ) патогенетически обосновано, что обусловлено значимой ролью увеличения объема циркулирующей крови и задержки ионов натрия во внутренней среде организма в повышении артериального давления.
В клинических рекомендациях выбор диуретика для лечения АГ ограничен 3 препаратами: гидрохлоротиазид, хлорталидон и индапамид. Тиазидные и тиазидоподобные диуретики часто объединяются в единую группу «тиазиды», однако они имеют существенные различия в механизме своего действия, клинических эффектах, профиле лекарственной безопасности, отчасти – в параметрах эффективности контроля артериального давления, а также доказательной базе в рандомизированных клинических исследованиях. В первой части обзора, наряду с доказательствами эффективности применения диуретиков при АГ, рассмотрены различные аспекты лекарственной безопасности препаратов этой группы, как возможные метаболические нарушения, так и более редкие, но возможные нарушения со стороны органа зрения, кожные побочные реакции и риск развития острого респираторного дистресс-синдрома. Во второй части обзора рассмотрены вопросы эффективности и безопасности тиазидоподобного диуретика индапамида.
Ключевые слова: артериальная гипертензия, рациональная фармакотерапия, лекарственная безопасность, диуретики, лечение, индапамид, гидрохлоротиазид, хлорталидон.
Для цитирования: Трухан Д.И., Багишева Н.В. Рациональная фармакотерапия артериальной гипертензии в реальной клинической практике: диуретики сквозь призму лекарственной безопасности. Клинический разбор в общей медицине. 2023; 4 (4): 48–59.
DOI: 10.47407/kr2023.4.4.00256
Rational pharmacotherapy of arterial hypertension in real clinical practice: diuretics through drug safety
Dmitry I. Trukhan, Natalya V. BagishevaOmsk State Medical University, Omsk, Russia
dmitry_trukhan@mail.ru
Abstract
The use of diuretics in arterial hypertension is pathogenetically justified, which is due to the significant role of an increase in the volume of circulating blood and the retention of sodium ions in the internal environment of the body, in increasing blood pressure. In clinical guidelines, the choice of a diuretic for the treatment of hypertension is limited to 3 drugs: hydrochlorothiazide, chlorthalidone and indapamide. Thiazide and thiazide-like diuretics are often combined into a single group of "thiazides", however, they have significant differences in the mechanism of their action, clinical effects, drug safety profile, partly in the parameters of the effectiveness of blood pressure control, as well as the evidence base in randomized clinical trials. In the first part of the review, along with evidence of the effectiveness of the use of diuretics in arterial hypertension, various aspects of the drug safety of drugs in this group are considered, both possible metabolic disorders and more rare, but possible disorders of the organ of vision, skin adverse reactions and the risk of acute respiratory distress. -syndrome. The second part of the review considers the efficacy and safety of the thiazide-like diuretic indapamide.
Key words: arterial hypertension, rational pharmacotherapy, drug safety, diuretics, treatment, indapamide, hydrochlorothiazide, chlorthalidone.
For citation: Trukhan D.I., Bagisheva N.V. Rational pharmacotherapy of arterial hypertension in real clinical practice: diuretics through drug safety. Clinical review for general practice. 2023; 4 (4): 48–59. DOI: 10.47407/kr2023.4.4.00256
Артериальная гипертензия (АГ) является многоуровневой проблемой кардиологии и современной медицины в целом. С одной стороны, АГ является одним из основных факторов риска развития сердечно-сосудистых заболеваний и их осложнений, с другой – самостоятельным заболеванием [1].
Сердечно-сосудистые заболевания занимают ведущее место в структуре неинфекционной патологии взрослого населения, являясь основной причиной ранней инвалидизации и преждевременной смерти [2–4].
Под рациональной фармакотерапией, в соответствии с определением Всемирной организации здравоохранения (ВОЗ), понимается назначение пациентам лекарственных средств, соответствующих клинической ситуации, в дозах, отвечающих индивидуальным потребностям, на адекватный период времени и по наименьшей стоимости для пациентов и общества [5]. Важной составляющей рациональной фармакотерапии является лекарственная
безопасность [6, 7] – одно из приоритетных базисных направлений современной медицины и фармации [8, 9].
Диуретики в лечении АГ. Применение диуретиков при АГ патогенетически обосновано, что обусловлено значимой ролью увеличения объема циркулирующей крови и задержки ионов натрия во внутренней среде организма в повышении артериального давления (АД) [10].
Тиазидные и тиазидоподобные диуретики на протяжении более 60 лет (после появления первого препарата этой группы в 1957 г.) входят в число основных классов антигипертензивных препаратов (АГП) 1-й линии антигипертензивной терапии. В рекомендациях Европейского общества кардиологов / Европейского общества артериальной гипертензии (ESC/ESH) 2018 г. [11] и Российских клинических рекомендациях 2020 г. [12] выбор диуретика для лечения АГ ограничен 3 препаратами: гидрохлоротиазид (ГХТ), хлорталидон и индапамид.
Ведущее место тиазидные и тиазидоподобные диуретики, безусловно, занимают в терапии АГ с низкой продукцией ренина, когда на первый план в формировании АГ выходит объем-зависимый патогенетический механизм, связанный с задержкой жидкости в организме, что часто наблюдается у пациентов с метаболическим синдромом, сахарным диабетом (СД), пожилого возраста, мультиморбидных больных с сопутствующей хронической сердечной недостаточностью и/или хронической болезнью почек со скоростью клубочковой фильтрации ≥30 мл/мин/1,73 м2, а также у представителей негроидной расы [10].
Диуретики объединяют несколько подгрупп препаратов с разным механизмом действия. С учетом ренальных эффектов тиазидные и тиазидоподобные диуретики можно разделить на два поколения. Первое поколение включает производные бензотиадиазина (ГХТ, бендрофлуметиазид, политиазид и др.) и хлорталидон, второе поколение – производные хлорбензамида (индапамид, ксипамид и др.) и квиназолинона (метолазон) [13].
Тиазидные и тиазидоподобные диуретики часто объединяются в единую группу «тиазиды», однако они имеют существенные различия в механизме своего действия, клинических эффектах, профиле лекарственной безопасности, отчасти – в параметрах эффективности контроля АД, а также доказательной базе в рандомизированных контролируемых исследованиях (РКИ) [14]. Так, ГХТ имеет дозозависимый характер влияния на уровень офисного АД, для индапамида такой зависимости не выявлено, а для хлорталидона предполагается наличие как дозозависимого, так и дозонезависимого компонента действия [14].
В РКИ и метаанализах накоплена обширная доказательная база о позитивном влиянии диуретиков на прогноз в виде снижения риска развития сердечно-сосудистых и цереброваскулярных осложнений [15]. При этом в рекомендациях ESC/ESH (2018 г. ) [11] подчеркивается, что тиазидоподобные диуретики превосходят тиазидные в отношении эффективности и прогностической значимости. В метаанализе китайских кардиологов, которые провели объединенное исследование результатов 19 РКИ [16] с участием 112 113 пациентов (56 802 – получавших диуретики; 55 311 – в контрольной группе) было установлено, что лечение тиазидными и тиазидоподобными диуретиками было связано со снижением риска сердечно-сосудистых заболеваний (отношение шансов – ОШ 0,86, p=007) и сердечной недостаточности (ОШ 0,62, p<0,001), но не отличалось от инсульта (ОШ 0,92, p=0,438) или ишемической болезни сердца (ОШ 0,95, p=0,378) между диуретиками и контрольной группой. Дальнейший анализ, проведенный авторами, показал, что наблюдаемые преимущества были связаны с применением тиазидоподобных диуретиков, а не с диуретиками тиазидного типа, с более значимым снижением риска сердечно-сосудистых заболеваний (ОШ 0,78, p<0,001), сердечной недостаточности (ОШ 0,57, p<0,001) и инсульта (ОШ 0,82, p=0,016).
Вместе с тем при сходном влиянии тиазидоподобных диуретиков на снижение цереброваскулярных событий / инсультов и общую смертность хлорталидон увеличивает риск первичной ишемической болезни сердца (относительный риск – ОР 2,0, 95% ДИ 0,86–4,67) по сравнению с индапамидом (ОР 0,53, 95% ДИ 0,36–0,77) [14].
В системном обзоре и метаанализе ученых из США (38 РКИ) [17] показано, что тиазидоподобные диуретики превосходят ГХТ в снижении массы миокарда левого желудочка в 2 раза.
Тиазидоподобные диуретики имеют существенно больший период полувыведения по сравнению с тиазидами: для хлорталидона этот показатель составляет 40–60 ч, для индапамида – до 14–24 ч, а для ГХТ – 6–15 ч [14]. Длительность действия хлорталидона составляет 48–72 ч, для индапамида ≥24 ч, а у ГХТ существенно варьирует, составляя в среднем 16 ч. В сравнительном исследовании низких доз диуретиков хлорталидона 6,25 мг и ГХТ 12,5 мг по результатам суточного мониторирования АД индийскими кардиологами сделан вывод, что ГХТ в дозе 12,5 мг оказывает антигипертензивный эффект преимущественно в дневное время и не влияет на уровень АД в ночные часы, что не позволяет рассматривать монотерапию низкими дозами ГХТ в качестве эффективной терапии АГ [18].
Возможность использования ГХТ для монотерапии в качестве препарата 1-й линии для лечения АГ поставили под сомнение и ученые из Колумбийского университета (США) в систематическом обзоре и метаанализе, в который были включены 14 РКИ с применением ГХТ в дозе 12,5–25 мг и 5 исследований с ГХТ в дозе 50 мг, в котором был проведен амбулаторный мониторинг АД и сравнение контроля АД в течение 24 ч при использовании ГХТ и других АГП [19]. Авторы отметили явно недостаточный антигипертензивный эффект ГХТ в сравнении с четырьмя другими основными классами АГП, как по систолическому, так и по диастолическому АД [19].
В этой связи следует помнить, что ночное снижение АД является важной составляющей его суточного профиля, поскольку в большей степени, по сравнению с дневным, влияет на прогноз пациента в отношении сердечно-сосудистых и цереброваскулярных осложнений [20–22]. Так, установлено, что наиболее неблагоприятным суточным профилем АД служит тип night-picker – при котором АД в ночное время не только не снижается, а напротив, повышается. Для типа night-picker характерна тесная ассоциация с поражением органов-мишеней при АГ, а также связано наибольшее число сердечных смертей, инфарктов, транзиторных ишемических атак и инсультов [20–22].
Лекарственная безопасность диуретиков. Наряду с вопросом эффективности различных диуретиков, используемых для лечения АГ, актуальным является профиль их лекарственной безопасности.
Метаболические нарушения. В ряде метаанализов высказываются опасения о том, что терапия диуретиками может приводить к нарушениям электролитного баланса, негативным метаболическим эффектам – нарушениям липидного, пуринового и углеводного обмена, вплоть до повышения риска развития СД 2-го типа [23–27]. Прежде всего эти опасения относятся к тиазидным и тиазидоподобным диуретикам первого поколения – ГХТ и хлорталидону. Так, в крупномасштабном многоцентровом сравнительном когортном исследовании [28] были проанализированы эпизоды амбулаторного и стационарного лечения пациентов, впервые использовавших антигипертензивную монотерапию диуретиками в США за период 2001–2018 гг. Из 730 225 пациентов (средний возраст 51,5 года, 61,6% женщины) 36 918 получали хлорталидон и 693 337 получали ГХТ. Хлорталидон был связан со значительно более высоким риском гипокалиемии (ОР 2,72, 95% ДИ 2,38–3,12), гипонатриемии (ОР 1,31, 95% ДИ 1,16–1,47), острой почечной недостаточности (ОР 1,37; 95% ДИ 1,15–1,63), хронического заболевания почек (ОР 1,24, 95% ДИ 1,09–1,42) и СД 2-го типа (ОР 1,21; 95% ДИ 1,12–1,30) и со значительно более низким риском диагностированного аномального увеличения массы тела (ОР 0,73, 95% ДИ 0,61–0,86). Исследователи подчеркивают, что использование хлорталидона было связано с более высоким риском почечных и электролитных нарушений [28]. В другом обзоре отмечается, что риск гипонатриемии, гипокалиемии и гиперурикемии, связанные с ГХТ, ниже, чем при использовании хлорталидона, но при этом терапия ГХТ менее эффективно снижала АД в сравнении с хлорталидоном, бендрофлуметиазидом и особенно индапамидом, и была на 18% и более связана с побочными эффектами со стороны сердечно-сосудистой системы в сравнении с хлорталидоном [29].
В метаанализах, посвященных оценке клинической эффективности и безопасности ГХТ, хлорталидона и индапамида, отмечается, что тиазидоподобные диуретики превосходят ГХТ в снижении АД без увеличения частоты гипокалиемии и гипонатриемии и изменений со стороны показателей углеводного и липидного обмена [30, 31]. В метаанализе ученых из Тайваня показано, что даже у пациентов, принимавших низкие дозы ГХТ, отмечается существенное повышение уровня глюкозы натощак и HbA1c, и снижение холестерина липопротеидов высокой плотности [26].
Метаанализ сравнительного риска дискалимии (гипер- и гипокалиемии) представителей различных групп антигипертензивных препаратов, применяемых в качестве монотерапии и комбинированного лечения [32], продемонстрировал значимое повышение риска развития гипокалиемии по сравнению с плацебо при использовании комбинации блокаторов рецепторов к ангиотензину II с высокой дозой ГХТ (25 мг).
Для оценки распространенности гипокалиемии, связанной с приемом ГХТ, американские исследователи включили в исследование взрослых пациентов в возрасте ≥20 лет из национальной программы социального исследования, проводимой Национальным центром статистики здравоохранения (NHANES) в 1999–2018 гг. [33]. Гипокалиемия была отмечена у 12,6% пациентов, принимавших ГХТ, что эквивалентно ~2,0 млн взрослых в США. Более высокий риск гипокалиемии отмечен у женщин (ОШ 2,22, 95% ДИ 1,74–2,83), неиспаноязычных представителей негроидной расы (ОШ 1,65, 95% ДИ 1,31–2,08), лиц с дефицитом массы тела (ОШ 4,33, 95% ДИ 1,34–13,95) и пациентов, принимавших ГХТ в течение 5 лет или более (ОШ 1,47, 95% ДИ 1,06–2,04).
Эти же авторы оценили частоту гипокалиемии у пациентов, принимавших тиазидоподобный диуретик индапамид [34]. В проведенном ими крупном популяционном исследовании с 147 319 человеко-годами наблюдения (всего 62 881 пациент, принимавший индапамид) тяжелая гипокалиемия, требующая госпитализации, была редкостью – отмечена у 509 пациентов (0,8%). Ученые отметили, что 53% этих госпитализаций произошли в течение 1-го года лечения, а 1/2 из них в первый год произошла в течение первых 16 нед. С госпитализацией был связан женский пол (ОШ 1,75; 95% ДИ 1,45–2,12). В многомерной исследовательской модели пожилой возраст не был значимым предиктором. Во время госпитализации не было отмечено смертельных случаев, а средняя продолжительность пребывания в стационаре составила один день.
В многоцентровом американском сравнительном РКИ хлорталидона и ГХТ (13 523 пациента) частота гипокалиемии была выше в группе хлорталидона, чем в группе ГХТ (6,0% против 4,4%, p<0,001). Кроме того, у пациентов, получавших хлорталидон, не отмечено более низкой частоты основных сердечно-сосудистых исходов или смертей, не связанных с раком, чем у пациентов, получавших ГХТ [35].
Нарушения со стороны органа зрения. Во втором десятилетии нынешнего века инструкции по применению ГХТ были дополнены информацией о возможном развитии острой транзиторной миопии и острой закрытоугольной глаукомы [36–38]. Одним из первых
сообщений была публикация американских офтальмологов в 1995 г. о возможном развитии двусторонней
закрытоугольной глаукомы, связанной с повышенной чувствительностью к ГХТ [39]. Канадские и американские офтальмологи связали развитие двусторонней острой закрытоугольной глаукомы с гипонатриемией, вызванной ГХТ [40].
 Корейские офтальмологи описали 2 случая вызванной ГХТ двусторонней миопии с острым началом и мелированием передних камер у женщин среднего возраста, которые обратились с жалобами на острое двустороннее ухудшение зрения [41]. Обе пациентки имели хорошую остроту зрения без корректирующих линз до начала приема ГХТ. Полное офтальмологическое обследование выявило двусторонний миопический сдвиг, повышение внутриглазного давления, мелирование передних камер, хориоидальный выпот, лучистые складки сетчатки и хемоз конъюнктивы. Примерно через неделю после прекращения приема ГХТ все глазные изменения полностью исчезли.
Корейские офтальмологи описали 2 случая вызванной ГХТ двусторонней миопии с острым началом и мелированием передних камер у женщин среднего возраста, которые обратились с жалобами на острое двустороннее ухудшение зрения [41]. Обе пациентки имели хорошую остроту зрения без корректирующих линз до начала приема ГХТ. Полное офтальмологическое обследование выявило двусторонний миопический сдвиг, повышение внутриглазного давления, мелирование передних камер, хориоидальный выпот, лучистые складки сетчатки и хемоз конъюнктивы. Примерно через неделю после прекращения приема ГХТ все глазные изменения полностью исчезли. Китайские офтальмологи описали у 34-летней азиатской женщины выраженное снижение остроты бинокулярного зрения через 6 ч после приема только одной дозы ГХТ 25 мг, топирамата 25 мг и флуоксетина 22,4 мг для снижения массы тела [42]. У пациентки диагностировали острую двустороннюю миопию и сужение угла зрения. При первичном осмотре выявлено снижение остроты зрения 20/100 с обеих сторон, повышение внутриглазного давления 23 мм рт. ст. на правом глазу и 24 мм рт. ст. на левом, супрахориоидальный выпот и сужение угла. После отмены этих препаратов и назначения препаратов, снижающих внутриглазное давление, зрение постепенно нормализовалось.
Индийские офтальмологи описали случай внезапной потери зрения из-за развития острой миопии после приема хлорталидона [43]. Клинически это было связано с цилиарным спазмом, неглубоким периферическим хориоидальным выпотом и стриями сетчатки в макуле с увеличением толщины желтого пятна, наблюдаемым на оптической когерентной томографии. После отмены хлорталидона зрение постепенно нормализовалось.
Кожные побочные реакции. В конце 2018 г. ряд производителей лекарственных препаратов для лечения АГ, содержащих в качестве действующего вещества ГХТ, заявили о выявлении новых побочных эффектов [44]. Согласно данным двух фармакоэпидемиологических исследований, выполненных с использованием данных Датского национального регистра рака [45, 46], была продемонстрирована связь между приемом ГХТ и повышенным риском развития немеланомного рака кожи (НМРК) – базально-клеточной карциномы (БКК) и плоскоклеточного рака кожи (ПРК). Применение ГХТ (в суммарной дозе ≥50 000 мг) было связано с ОР 1,29 (95% ДИ 1,23–1,35) для БКК и ОР 3,98 (95% ДИ 3,68–4,31) для ПРК.
Риск развития НМРК возрастал при увеличении суммарной (накопленной) дозы ГХТ. При кумулятивной дозе (≥200 000 мг ГХТ) отмечены ОР 1,54 (95% ДИ 1,38–1,71) для БКК и ОР 7,38 (95% ДИ, 6,32–8,60) для ПРК.
Возможным механизмом развития НМРК является фотосенсибилизирующее действие ГХТ. Пациентам, принимающим ГХТ и содержащие его комбинированные препараты необходимо регулярно осматривать кожу и следить за появлением новых подозрительных поражений или изменения уже имеющихся. При обнаружении подозрительных изменений кожи следует незамедлительно обратиться к врачу. Для минимизации риска развития НМРК пациентам следует ограничить воздействие солнечного света и ультрафиолетовых лучей, а также пользоваться защитными средствами. Для пациентов с НМРК в анамнезе следует пересмотреть целесообразность применения ГХТ [47]. Диагностике изменений кожи при приеме ГХТ может помочь фототестирование, фотопатч-тестирование и биопсия кожи [48].
Датские ученые отметили, что использование других диуретиков и антигипертензивных средств не было связано с НМРК. Так, при использовании индапамида, напротив, исследователями отмечена (см. рисунок) отрицательная ассоциация с НМРК [46].
Португальские ученые также отметили возможную связь между использованием ГХТ и НМРК, и сообщили, что португальское национальное управление по лекарственным средствам и продуктам медицинского назначения (INFARMED) выпустило предупреждение для медицинских работников о повышенном риске НМРК
у пациентов, подвергшихся воздействию кумулятивных доз ГХТ [49]. Испанские исследователи [50] использовали данные испанской системы фармаконадзора и отметили, что для развития БКК ОШ составляет 4,8 (95% ДИ 2,2–10,7), а для развития ПРК ОШ=3,2 (95% ДИ 0,9–10,5).
В систематическом обзоре французских ученых [51] продемонстрирован повышенный риск развития ПРК. В другом исследовании в одноцентровой когорте реципиентов почек (n=2155), комбинированных реципиентов почки+поджелудочная железа (n=282) и пациентов после трансплантации поджелудочной железы (n=59) французскими трансплантологами отмечено, что воздействие ГХТ было связано с двукратно более высоким риском ПРК [52].
Связь между приемом ГХТ и повышенным риском развития НМРК – БКК и ПРК, а также рака губы была выявлена учеными из Шотландии для населения Великобритании [53].
В ретроспективном исследовании ученых из США [54] показано, что использование ГХТ было связано с более высоким риском развития БКК (ОР 1,09, 95% ДИ 1,07–1,11) и ПРК (ОР 1,15, 95% ДИ 1,12–1,17) среди представителей европеоидной расы. Кумулятивная доза ГХТ 50 000 мг или более была связана с повышенным риском ПРК в общей популяции (ОШ 1,19, 95% ДИ 1,05–1,35) и среди представителей европеоидной расы (ОШ 1,27, 95% ДИ 1,10–1,47).
Канадские ученые провели популяционное когортное исследование, в котором выявили повышение риска ПРК при использовании ГХТ [55]. Так, после 8,6-летнего медианного наблюдения ГХТ ассоциировался с повышенным риском ПРК (ОР 1,50, 95% ДИ 1,06–2,11). Риск увеличивался с кумулятивной продолжительностью использования, с доказательствами ассоциации через 5–10 лет (ОР 2,10, 95% ДИ 1,20–3,67) и самым высокими через >10 лет (ОР 3,70, 95% ДИ 1,77–7,73). Аналогичным образом ОР увеличивался при кумулятивной дозе, причем более высокие оценки были получены для ≥100 000 мг (ОР 4,96, 95% ДИ 2,51–9,81).
В систематическом обзоре и метаанализе (2181 исследований) бразильских ученых [56] продемонстрирована вероятность развития плоскоклеточного рака губ и ПРК в любой области тела у пациентов, принимавших ГХТ, в 1,76 раза выше, чем у непринимавших ГХТ. Кроме того, у принимавших ГХТ наблюдалось повышение риска развития (ОР 1,80, 95% ДИ 1,71–1,89) ПРК в области головы и шеи.
В систематическом обзоре и метаанализе [57] ученых из Тайваня (всего более 17 млн пациентов) показана связь применения ГХТ с повышенным риском НМРК (ОШ 1,16, 95% ДИ 1,08–1,24; ОР 1,26, 95% ДИ 1,04–1,54), ПРК (ОШ 1,32, 95% ДИ 1,06–1,65; ОР 1,61, 95% ДИ 0,97–2,67) и меланомы (ОШ 1,11, 95% ДИ 1,02–1,20; ОР 1,03, 95% ДИ 0,93–1,14). Повышенные риски для развития ПРК были связаны с высокими кумулятивными дозами ГХТ (ОШ 2,56, 95% ДИ 1,43–4,57; ОР 1,20, 95% ДИ 1,00–1,45).
Применение ГХТ также ассоциировалось с различными подтипами меланомы, включая поверхностно распространяющуюся (ОШ 1,18, 95% ДИ 1,05–1,33) и узловую (ОШ 1,23, 95% ДИ 1,08–1,39) формы и злокачественную меланому (ОШ 1,33, 95% ДИ 1,08–1,39). Однако связь применения ГХТ с развитием меланомы отмечена в неазиатских странах. Никакого значимого увеличения риска развития рака кожи не было связано с применением бендрофлуметиазида и индапамида [57].
Ученые из США [58] проанализировали среди неиспаноязычных пациентов европеоидной расы 9176 случаев меланомы и данные 264 781 контрольной группы, и небольшое увеличение риска меланомы всех подтипов вместе взятых, связанное с высоким использованием (≥50 000 мг) ГХТ (OР 1,11, 95% ДИ 1,00–1,23). Риск был выше для подтипа лентиго (ОШ 1,57, 95% ДИ 1,01–2,42). Несколько повышенный риск отмечен для узлового подтипа, но не был статистически значимым (ОШ 1,22, 95% ДИ 0,78–1,90), и также отмечена очень незначительная связь с поверхностным подтипом распространения (ОШ 1,05, 95% ДИ 0,80–1,37).
В популяционном исследовании «случай–контроль» [59], которое включало 6880 пациентов с впервые выявленным раком молочной железы, плоскоклеточным раком почки и инвазивным плоскоклеточным раком в период с 2003 по 2017 г. в Исландии и 69 620 человек в контрольной группе населения. Кумулятивная доза ГХТЗ выше 37 500 мг была связана с повышенным риском инвазивного ПРК (ОР 1,69, 95% ДИ 1,04–2,74). Пациенты, принимавшие ГХТ, также имели повышенный риск плоскоклеточного рака in situ (OР 1,24, 95% ДИ 1,01–1,52) и БКК (OР 1,14, 95% ДИ 1,02–1,29).
Все эти данные не означают, что ГХТ должен быть запрещен для каждого пациента, поскольку он не оказывает прямого канцерогенетического воздействия, однако косвенно приводит к повышению фоточувствительности кожи [60].
В датском общенациональном обсервационном исследовании [61] авторы провели описательный анализ когорты, включающей всех датских пользователей антигипертензивного лечения с января 2016 г. по сентябрь 2020 г. (n=1 316 476), с особым акцентом на пользователей ГХТ (n=309 743). Авторы отметили, что после публикации данных о риске развития НМРК у пациентов, принимающих ГХТ, использование ГХТ сократилось на 44% с января 2016 г. по сентябрь 2020 г., при этом доля всех комбинированных антигипертензивных препаратов, в состав которых входил ГХТ, снизилась с 12,7% до 7,2%. Это снижение было более выраженным среди молодых пациентов и пациентов с указанием в анамнезе на рак кожи. Одновременно ежемесячный показатель новых пациентов, принимающих ГХТ, в Дании снизился с ≈2350 в течение 2017 г. до 652 в течение 2020 г.
Болгарские дерматологи [62] представили клинический случай развития редкого синдрома бабуина или симметричной лекарственной интертригинозной и изгибной экзантемы (синдром SDRIFE), который возник после приема комбинации валсартан + ГХТ 160/25 мг в течение 6 лет. Пациент, мужчина 57 лет, соответствовал всем пяти диагностическим критериям этого синдрома. Отмена комбинации валсартан + ГХТ, местное и системное применение глюкокортикостероидов и антибактериальных препаратов способствовали облегчению симптомов, а последующее наблюдение показало благоприятные результаты с полной ремиссией кожных высыпаний через 4 нед. Ранее португальские врачи сообщили о случае развития синдрома SDRIFE у 48-летней женщины [63], что характеризовалось появлением резко отграниченной эритемы нижних шейных складок, подмышечных впадин и ягодичной области, начавшейся через 4 дня после начала приема комбинации телмисартана + ГХТ для лечения АГ. Биопсия кожи выявила плотный периваскулярный и периаднексальный лимфогистиоцитарный инфильтрат в поверхностной дерме с эозинофилами и тучными клетками. После отмены комбинации телмисартан + ГХТ и назначения глюкокортикостероидов отмечено постепенное исчезновение изменений на коже.
Острый респираторный дистресс-синдром. Федеральное государственное бюджетное учреждение «Научный центр экспертизы средств медицинского применения» в своем письме в марте 2023 г. дало рекомендации производителям лекарственных препаратов, содержащих в своем составе ГХТ, внести изменения в инструкции по его применению [64]. Это связано с тем, что в конце прошлого года зарубежные регуляторы обращения лекарственных средств (Управление по контролю за оборотом лекарственных средств и изделий медицинского назначения Австралии – TGA от сентября 2022 г., Агентство по фармацевтическим препаратам и медицинским изделиям Японии Pharmaceutical and Medical Devices Аgеnсе – РМРА от ноября 2022 г. и регуляторный орган Канады – Неаlth Сапаdа от декабря 2022 г.) опубликовали новые данные по безопасности применения ГХТ, касающиеся возможного развития ранее не описанного побочного действия – острого респираторного дистресс-синдрома (ОРДС) [64].
Сообщения о риске развития ОРДС у взрослых пациентов, связанном с приемом ГХТ, впервые появились в 1980-х годах [65, 66].
В 1990 г. пульмонологи из Кливленда (Огайо, США) описали клинический случай развития острого отека легких, вызванного ГХТ, и рассмотрели в своем обзоре 16 ранее описанных случаев [67].
В 1991 г. датские врачи описали развитие острого отека легких у 44-летней женщины, который развился через 30 мин после приема одной таблетки препарата Модуретик (ГХТ + амилорид). В обзоре авторы указывают на 18 случаев отека легких, вызванного ГХТ, описанные ранее [68]. В этом же году канадские ученые в своей публикации [69] рассмотрели клинические особенности 4 неопубликованных случаев и 26 опубликованных случаев острого аллергического интерстициального пневмонита, индуцированного ГХТ. Авторы отметили, что дебют пневмонита был острым, среднее время до появления симптомов составляло 44 мин. Преобладающим фактором риска являлся женский пол –
27 (90%) из 30 пациентов были женщинами. Средний возраст составлял 56 лет; таким образом, большинство женщин находились в постменопаузе. Лечение было поддерживающим; отказ от приема ГХТ был единственным эффективным методом профилактики.
В 1992 г. гериатры из Тайваня [70] описали развитие у мужчины 67 лет после приема таблетки ГХТ некардиогенного отека легких. Симптомы уменьшились после симптоматической терапии, но появились снова после повторного применения ГХТ. Иммунологические исследования показали повышенный уровень иммуноглобулина Е. Авторы в обзоре рассмотрели еще 22 ранее зарегистрированных случая. Параллельно врачи из США [71] представили описание клинического случая развития у 42-летней женщины европеоидной расы тяжелого ОРДС через 30 мин после приема ГХТ. В рамках обсуждения в обзоре авторы рассмотрели еще 12 аналогичных клинических случаев.
В первом десятилетии XXI в. ученые из университета Торонто (Канада) в 2005 г. [72] привели описание трех случаев развития ОРДС у женщин в возрасте 64, 56 и 59 лет. В первых двух случаях – через 10–60 мин после приема 25 мг ГХТ, в последнем – после приема однократной дозы ГХТ + триамтерен. Приведенный обзор включал 36 дополнительных случаев некардиогенного отека легких после применения тиазидов. У пациентов симптомы развивались через 10–150 мин после приема ГХТ или другого тиазидного диуретика. Авторы отметили, что 90% задокументированных случаев произошли у женщин. В 2007 г. бельгийские кардиологи [73] сообщили о случае развития отека легких, связанного с низким давлением наполнения левого желудочка и гипотонией, возникшей у пациента вскоре после приема 12,5 мг ГХТ. Проведенный авторами анализ литературы (поиск Medline) выявил 49 подобных случаев. Авторы предположили, что в основе этой неблагоприятной лекарственной реакции на ГХТ лежит аллергическая реакция III типа.
В следующем десятилетии врачи из отделения неотложной медицинской помощи Бостона (США) [74] опубликовали сообщение о развитии у 50-летнего пациента после приема начальной дозы ГХТ прогрессирующей дыхательной недостаточности, для лечения которой они вынуждены были применить экстракорпоральную мембранную оксигенацию. Подобный клинический случай параллельно был описан докторами из штата Иллинойс (США) [75]. Итальянские кардиологи [76] у 73-летней женщины после замены амлодипина на комбинированную терапию с рамиприл + ГХТ через 20 мин после приема нового препарата отметили у пациентки появление лихорадки, рвоты и диареи, сразу за которыми последовало острое начало одышки.
ОРДС невольно возвращает нас к периоду пандемии новой коронавирусной инфекции (COVID-19) и еще к одному возможному побочному эффекту диуретиков – повышению уровня мочевой кислоты.
Гиперурикемия. Наличие бессимптомной гиперурикемии и подагры как сопутствующего заболевания является абсолютным противопоказанием к применению ГХТ и хлорталидона и относительным противопоказанием для индапамида [12], что также актуально в период пандемии COVID-19, поскольку SARS-CoV-2 может усиливать катаболические процессы в организме и приводить к развитию гиперурикемии [77]. Мочевая кислота потенциально вызывает повреждение почек путем изменения почечной ауторегуляции, ингибирования пролиферации эндотелиальных клеток, клеточного апоптоза, активации провоспалительного каскада и отложения кристаллов. Гиперурикемия у пациентов с COVID-19 может способствовать острому повреждению почек и неблагоприятным исходам [77–79].
Ассоциация использования диуретиков с повышенным риском развития подагры показана в целом ряде исследований и обзоров [80–83]. Многофакторный относительный риск возникновения подагры, связанный с текущим приемом антигипертензивных препаратов среди пациентов с гипертензией (n=29 138) составил для диуретиков 2,36 (95% ДИ 2,21– 2,52), в то время как для лозартана 0,81 (95% ДИ 0,70–0,94) и 0,87 (95% ДИ 0,82–0,93) для антагонистов кальция [80].
Частота развития гиперурикемии и подагры неодинакова для разных классов диуретиков: наиболее часто она ассоциирована с приемом петлевых и тиазидных диуретиков, нежели тиазидоподобных [84, 85]. Комбинированное использование петлевых и тиазидных диуретиков [81] ассоциировалось с самыми высокими оценками относительного риска подагры 4,65 (95% ДИ 3,51–6,16). Статистически значимое увеличение мочевой кислоты на 35 мкмоль/л на фоне использования хлорталидона было продемонстрировано в исследовании SHEP [86] у пожилых пациентов с изолированной систолической АГ. Повышение концентрации мочевой кислоты в сыворотке крови, вызванное диуретиками, развивается, как правило, в течение нескольких дней после начала лечения, может сохраняться при длительном ее проведении на протяжении всего лечения [87, 88] и усиливаться дозозависимым образом [89, 90].
Индапамид по сравнению с другими диуретиками в меньшей степени вызывает повышение уровня мочевой кислоты в сыворотке крови [91–96]. В Кокрейновском обзоре (Cochrane, 2014 г.) при непрямом сравнении влияния диуретиков на уровень мочевой кислоты продемонстрировано значимо меньшее влияние индапамида по сравнению с ГХТ и, особенно, хлорталидоном [94].
В нашем исследовании комбинация эналаприла с индапамидом (1-я группа) по сравнению с комбинацией эналаприла с ГХТ (2-я группа) через 3 мес лечения не только выявила высокую метаболическую нейтральность, но и показала более выраженный эффект в снижении уровня АД и улучшения качества жизни [96, 97]. В 1-й группе исходный уровень калия в сыворотке крови повысился на 1,7%, уровень глюкозы снизился на 1%, уровень мочевой кислоты повысился на 0,8%. Во
2-й группе исходный уровень калия в сыворотке крови снизился на 7,2%, уровень глюкозы повысился на 8,7%, уровень мочевой кислоты повысился на 4,5%.
Индапамид: эффективность и безопасность. Синтезированный в 1974 г. тиазидоподобный диуретик индапамид не стал мишенью для критических стрел по поводу своей эффективности и безопасности [98–100].
Индапамид оказывает антигипертензивный эффект на протяжении суток (как в дневное, так и ночное время), а также стабилизирует вариабельность АД,
которая тесным образом ассоциирована с развитием сердечно-сосудистых осложнений и прогрессированием поражения органов-мишеней АГ [101]. В дозах, используемых при АГ (0,625–2,5 мг/сут) индапамид действует, прежде всего, как артериальный вазодилататор. При его применении в дозе 2,5 мг/сут суточный объем мочи почти не изменяется. Индапамид, благодаря его хорошо документированному позитивному влиянию на сердечно-сосудистые и почечные исходы, представляет собой безопасный и ценный вариант лечения пациентов с высоким АД с учетом ассоциирующихся с АГ факторов риска [102].
В метаанализе 9 РКИ, включавшем более 10 тыс. пациентов, показано, что частота нежелательных реакций при использовании индапамида сравнима с плацебо (ОР 0,97, 95% ДИ 0,76–1,22) [103]. В 6-месячном многоцентровом проспективном наблюдательном интервенционном открытом клиническом исследовании ACES с участием 9124 амбулаторных пациентов – авторами отмечена метаболическая нейтральность индапамида, сходная с карведилолом и амлодипином [104].
Индапамид практически не оказывает влияния на метаболические процессы в организме: экскрецию калия, уровни глюкозы, холестерина и мочевой кислоты в крови. Метаболическая безопасность и высокая эффективность применения индапамида в обычной (2,5 мг) и в ретардированной форме (1,5 мг), в том числе и у проблемных пациентов (с АГ и СД 2-го типа, метаболическим синдромом и у пациентов пожилого возраста), подтверждена результатами международных и российских исследований ADVANCE, HYVET, NESTOR, PROGRESS, АРГУС-2, МИНОТАВР, ЭПИГРАФ и целого ряда других [13, 100].
В экспериментальном исследовании индапамид предотвращал развитие фиброза миокарда у молодых спонтанно гипертензивных крыс, но при этом не оказывал влияния на соотношение коллагена типа I к типу III. Антифибротический эффект индапамида не связан с метаболизмом оксида азота [105].
Нефропротективный эффект индапамида [106] наиболее отчетливо продемонстрирован в комбинации с периндоприлом на всех стадиях хронической болезни почек у пациентов с АГ и СД [107, 108].
На основании результатов 26 РКИ индапамид рассматривается как оптимальный диуретик для применения у пациентов с нормолипидемией или гиперлипидемией, поскольку увеличивает уровень холестерина липопротеинов высокой плотности и при этом не повышает уровень холестерина липопротеинов низкой плотности [109].
Таким образом, индапамид, имеющий доказанные органопротективные свойства, наиболее оптимальный метаболический профиль среди диуретиков и благоприятно влияющий на прогноз в рамках сердечно-сосудистого континуума, занимает прочные позиции как в моно-, так и в комбинированной терапии АГ [98–110].
Индапамид одобрен FDA не только для лечения первичной гипертензии в качестве монотерапии или в сочетании с другими антигипертензивными препаратами, но и для лечения задержки соли и жидкости, связанной с хронической сердечной недостаточностью [111].
Генерический препарат индапамида – Индап® (PRO.MED.CS Praha a. s., Czech Republic) является единственным генериком индапамида с наличием объективных доказательств терапевтической эквивалентности с двумя формами выпуска оригинального индапамида [112]. Успешный опыт использования препарата Индап® в России на протяжении 25 лет, данные широкомасштабных проектов с длительным наблюдением пациентов, проведенных практически во всех регионах Российской Федерации и других странах, свидетельствуют о его метаболической нейтральности, наличии органопротективных свойств и высокой антигипертензивной эффективности, в том числе и у проблемных мультиморбидных пациентов (с артериальной гипертензией и СД 2-го типа или метаболическим синдромом, пациентов гериатрической практики). Индап® может эффективно и безопасно применяться как в сочетании с липидснижающими и антигипергликемическими препаратами, так и в комбинации с другими антигипертензивными препаратами [98, 99, 110, 112–117].
Появление на российском фармацевтическом рынке новой формы выпуска препарата Индап® , делимой на 4 равные части (со специальной риской) таблетки индапамида 2,5 мг, не только способствует удобству его применения и повышению приверженности пациентов к лечению, но и дает возможность врачу в условиях реальной клинической практики титровать индапамид в 4 разных дозах (0,625 мг, 1,25 мг, 1,875 мг, 2,5 мг) и комбинировать его с другими АГП, что способствует профилактике дозозависимых нежелательных реакций за счет возможности постепенного титрования дозы, позволяет индивидуализировать подбор минимально эффективной дозы индапамида, что наиболее актуально для пациентов старших возрастных групп, с наличием ишемической болезни сердца и гемодинамически значимых стенозов брахиоцефальных артерий, перенесших инсульт или транзиторную ишемическую атаку, а также в постковидном периоде после новой коронавирусной инфекции (COVID-19), для которого характерна нестабильность АД.
Заключение
Завершая обсуждение вопросов рациональной фармакотерапии АГ и рассмотрение диуретиков сквозь призму лекарственной безопасности, хотелось бы вспомнить две рекомендации: основоположника клинической фармакологии в нашей стране академика Бориса Евгеньевича Вотчала – «Мы живем в век безопасной хирургии и все более опасной лекарственной терапии», и основоположника научной медицины Гиппократа – «При лечении болезней имейте привычку соблюдать два правила: помогать или, по крайней мере, не вредить», о которых не стоит забывать при выборе лекарственной терапии в реальной клинической практике.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Трухан Дмитрий Иванович – д-р мед. наук, доц., проф. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО
ОмГМУ. E-mail: dmitry_trukhan@mail.ru; ORCID 0000-0002-1597-1876
Dmitry I. Trukhan – D. Sci. (Med.), Prof., Omsk State Medical University. E-mail: dmitry_trukhan@mail.ru; ORCID: 0000-0002-1597-1876
Багишева Наталья Викторовна – канд. мед. наук, доц. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО
ОмГМУ. E-mail: ppi100@mail.ru; ORCID: 0000-0003-3668-1023
Natalya V. Bagisheva – Cand. Sci. (Med.), Omsk State Medical University. E-mail: ppi100@rambler.ru; ORCID: 0000-0003-3668-1023
Поступила в редакцию / Received: 17.04.2023
Поступила после рецензирования / Revised: 28.04.2023
Принята к публикации / Accepted: 25.05.2023
Список исп. литературыСкрыть список1. Трухан Д.И., Филимонов С.Н. Болезни сердечно-сосудистой системы: клиника, диагностика и лечение. СПб.: СпецЛит, 2016. URL: https: //elibrary.ru/item.asp?id=36478361
[Truhan D.I., Filimonov S.N. Bolezni serdechno-sosudistoj sistemy: klinika, diagnostika i lechenie. Saint Petersburg: SpecLit, 2016. URL: https: //elibrary.ru/item.asp?id=36478361 (in Russian).]
2. Викторова И.А., Лисняк М.В., Трухан Д.И. Влияние социально-демографических и психологических факторов на приверженность к антигипертензивной терапии. Сибирское медицинское обозрение. 2014; 5 (89): 75–8. URL: https: //www.elibrary.ru/item. asp?id=22561261
[Viktorova I.A., Lisnyak M.V., Truhan D.I. Vliyanie social'no-demograficheskih i psihologicheskih faktorov na priverzhennost' k antigipertenzivnoj terapii. Sibirskoe medicinskoe obozrenie. 2014; 5 (89): 75–8. URL: https: //www.elibrary.ru/item.asp?id=22561261 (in Russian).]
3. Демографический ежегодник России. 2021. URL: https: //gks.ru/bgd/regl/B21_16/Main.htm
[Demograficheskij ezhegodnik Rossii. 2021. URL: https: //gks.ru/bgd/regl/B21_16/Main.htm (in Russian).]
4. Трухан Д.И., Филимонов С.Н., Темникова Е.А. Болезни сердечно-сосудистой системы: клиника, диагностика и лечение. Гериатрические аспекты в кардиологии. СПб.: СпецЛит, 2022. URL: https: //elibrary.ru/item.asp?id=48110916
[Trukhan D.I., Filimonov S.N., Temnikova E.A. Bolezni serdechno-sosudistoi sistemy: klinika, diagnostika i lechenie. Geriatricheskie aspekty v kardiologii. St. Petersburg: SpetsLit, 2022. Rezhim dostupa: https: //elibrary.ru/item.asp?id=48110916 (in Russian).]
5. Национальные рекомендации по рациональной фармакотерапии больных сердечно-сосудистыми заболеваниями. Кардиоваскулярная терапия и профилактика 2009; 8 (6), Приложение 4. URL: https: //scardio.ru/en/guidelines/rsc_guidelines/nacionalnye_rekomendacii_po_racionalnoy_farmakoterapii_bolnyh_serdechnososudistymi_zabolevaniyami/
[Nacional'nye rekomendacii po racional'noj farmakoterapii bol'nyh serdechno-sosudistymi zabolevaniyami. Kardiovaskulyarnaya terapiya i profilaktika 2009; 8 (6), Prilozhenie 4. URL: https: //scardio.ru/en/guidelines/rsc_guidelines/nacionalnye_rekomendacii_po_racionalnoy_farmakoterapii_bolnyh_serdechnososudistymi_zabolevaniyami/ (in Russian).]
6. Трухан Д.И., Тарасова Л.В. Рациональная фармакотерапия и лекарственная безопасность в кардиологии. Справочник поликлинического врача. 2013; 5: 21–6. URL: https: //elibrary.ru/item.asp? id=21746647
[Truhan D.I., Tarasova L.V. Racional'naya farmakoterapiya i lekarstvennaya bezopasnost' v kardiologii. Spravochnik poliklinicheskogo vracha. 2013; 5: 21–6. URL: https: //elibrary.ru/item.asp? id=21746647 (in Russian).]
7. Трухан Д.И. Выбор лекарственного препарата с позиций рациональной фармакотерапии. Consilium Medicum. 2013; 11: 45–9. URL: https: //elibrary.ru/item.asp?id=21014169
[Truhan D.I. Vybor lekarstvennogo preparata s pozicij racional'noj farmakoterapii. Consilium Medicum. 2013; 11: 45–9. URL: https: //elibrary.ru/item.asp?id=21014169 (in Russian).]
8. Трухан Д.И., Коншу Н.В. Рациональная фармакотерапия в клинике внутренних болезней сквозь призму мультиморбидности и лекарственной безопасности. Справочник поликлинического врача. 2019; 02: 10–8. URL: https: //www.elibrary.ru/item.asp? id=44162870
[Truhan D.I., Konshu N.V. Racional'naya farmakoterapiya v klinike vnutrennih boleznej skvoz' prizmu mul'timorbidnosti i lekarstvennoj bezopasnosti. Spravochnik poliklinicheskogo vracha. 2019; 02: 10–8. URL: https: //www.elibrary.ru/item.asp?id=44162870 (in Russian).]
9. Трухан Д.И. Рациональная фармакотерапия в реальной клинической практике сквозь призму мультиморбидности и лекарственной безопасности. Клинический разбор в общей медицине. 2020; 2: 29-39. DOI: 10.47407/kr2020.1.2.00015
[Truhan D.I. Racional'naya farmakoterapiya v real'noj klinicheskoj praktike skvoz' prizmu mul'timorbidnosti i lekarstvennoj bezopasnosti. Clinical review for general practice. 2020; 2: 29-39. DOI: 10.47407/kr2020.1.2.00015 (in Russian).]
10. Tamargo J, Segura J, Ruilope LM. Diuretics in the treatment of hypertension. Part 1: thiazide and thiazide-like diuretics. Expert Opin Pharmacother 2014; 15 (4): 527–47. DOI: 10.1517/14656566. 2014.879118
11. Williams B, Mancia G, Spiering W et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J 2018; 39 (33): 3021–104. DOI: 10.1093/eurheartj/ehy339.
12. Клинические рекомендации Артериальная гипертензия у взрослых. РКО. 2020. URL: https: //scardio.ru/content/Guidelines/Clinic_rek_AG_2020.pdf
[Klinicheskie rekomendacii Arterial'naya gipertenziya u vzroslyh. RKO. 2020. URL: https: //scardio.ru/content/Guidelines/ Clinic_rek_AG_2020.pdf (in Russian).]
13. Трухан Д.И., Давыдов Е.Л., Дрокина О.В. Рациональная фармакотерапия артериальной гипертензии в реальной клинической практике сквозь призму лекарственной безопасности и мультиморбидности. Терапия. 2021; 2 (44): 141–52. DOI: 10.18565/therapy.2021.2.141-152
[Truhan D.I., Davydov E.L., Drokina O.V. Racional'naya farmakoterapiya arterial'noj gipertenzii v real'noj klinicheskoj praktike skvoz' prizmu lekarstvennoj bezopasnosti i mul'timorbidnosti. Terapiya. 2021; 2 (44): 141–52. DOI: 10.18565/therapy.2021.2.141-152 (in Russian).]
14. Burnier M, Bakris G, Williams B. Redefining diuretics use in hypertension: why select a thiazide-like diuretic? J Hypertens 2019; 37 (8): 1574–86. DOI: 10.1097/HJH.0000000000002088
15. Thomopoulos C, Parati G, Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension. 1. Overview, meta-analyses, and meta-regression analyses of randomized trials. J Hypertens 2014; 32 (12): 2285–95. DOI: 10.1097/HJH.0000000 000000378
16. Chen P, Chaugai S, Zhao F, Wang DW. Cardioprotective Effect of Thiazide-Like Diuretics: A Meta-Analysis. Am J Hypertens 2015; 28 (12): 1453–63. DOI: 10.1093/ajh/hpv050
17. Roush GC, Abdelfattah R, Song S et al. Hydrochlorothiazide vs chlorthalidone, indapamide, and potassium-sparing/hydrochlorothiazide diuretics for reducing left ventricular hypertrophy: A systematic review and meta-analysis. J Clin Hypertens (Greenwich) 2018; 20 (10): 1507–15. DOI: 10.1111/jch.13386
18. Pareek AK, Messerli FH, Chandurkar NB et al. Efficacy of Low-Dose Chlorthalidone and Hydrochlorothiazide as Assessed by 24-h Ambulatory Blood Pressure Monitoring. J Am Coll Cardiol 2016; 67 (4): 379–89. DOI: 10.1016/j.jacc.2015.10.083
19. Messerli FH, Makani H, Benjo A et al. Antihypertensive efficacy of hydrochlorothiazide as evaluated by ambulatory blood pressure monitoring: a meta-analysis of randomized trials. J Am Coll Cardiol 2011; 57 (5): 590–600. DOI: 10.1016/j.jacc.2010.07.053
20. Boggia J, Li Y, Thijs L et al. Prognostic accuracy of day versus night ambulatory blood pressure: a cohort study. Lancet 2007; 370 (9594): 1219–29. DOI: 10.1016/S0140-6736 (07)61538-4
21. Fagard RH, Thijs L, Staessen JA et al. Night-day blood pressure ratio and dipping pattern as predictors of death and cardiovascular events in hypertension. J Hum Hypertens 2009; 23 (10): 645–53. DOI: 10.1038/jhh.2009.9
22. O'Brien E, Parati G, Stergiou G et al. European Society of Hypertension position paper on ambulatory blood pressure monitoring. J Hypertens 2013; 31 (9): 1731–68. DOI: 10.1097/HJH. 0b013e32 8363e964
23. Chrysant SG, Neller GK, Dillard B, Frohlich ED. Effects of diuretics on lipid metabolism in patients with essential hypertension. Angiology 1976; 27 (12): 707–11. DOI: 10.1177/000331977602701205.
24. Elliott WJ, Meyer PM. Incident diabetes in clinical trials of antihypertensive drugs: a network metaanalysis. Lancet 2007; 369 (9557): 201–7. DOI: 10.1016/S0140-6736 (07)60108-1.
25. Sica DA, Carter B, Cushman W, Hamm L. Thiazide and loop diuretics. J Clin Hypertens (Greenwich) 2011; 13 (9): 639–43. DOI: 10.1111/j.1751-7176.2011.00512.x
26. Lin J-J, Chang H-C, Ku C-T, Chen H-Y. Hydrochlorothiazide hypertension treatment induced metabolic effects in type 2 diabetes: a meta-analysis of parallel-design RCTs. Eur Rev Med Pharmacol Sci 2016; 20 (13): 2926–34. URL: https: //pubmed.ncbi.nlm.nih.gov/ 27424996/
27. Zhang X, Zhao Q. Association of thiazide-type diuretics with glycemic changes in hypertensive patients: a systematic review and meta-analysis of randomized controlled clinical trials. J Clin Hypertens (Greenwich) 2016; 18 (4): 342–51. DOI: 10.1111/jch.12679
28. Hripcsak G, Suchard MA, Shea S et al. Comparison of Cardiovascular and Safety Outcomes of Chlorthalidone vs Hydrochlorothiazide to Treat Hypertension. JAMA Intern Med 2020; 180 (4): 542–51. DOI: 10.1001/jamainternmed.2019.7454
29. Vongpatanasin W. Hydrochlorothiazide is not the most useful nor versatile thiazide diuretic. Curr Opin Cardiol 2015; 30 (4): 361–5. DOI: 10.1097/HCO.0000000000000178
30. Roush GC, Ernst ME, Kostis JB et al. Head-to-head comparisons of hydrochlorothiazide with indapamide and chlorthalidone: antihypertensive and metabolic effects. Hypertension 2015; 65 (5): 1041–6. DOI: 10.1161/HYPERTENSIONAHA.114.05021
31. Liang W, Ma H, Cao L et al. Comparison of thiazide-like diuretics versus thiazide-type diuretics: a meta-analysis. J Cell Mol Med 2017; 21 (11): 2634–42. DOI: 10.1111/jcmm.13205
32. Qin L, Zhang N, Ishigami J et al. Dyskalemia risk associated with fixed-dose anti-hypertensive medication combinations. J Hum Hypertens 2022; 36 (11): 989–95. DOI: 10.1038/s41371-021-00600-w
33. Lin Z, Li HL, Tsoi MF, Cheung BMY. Hypokalaemia associated with hydrochlorothiazide used in the treatment of hypertension in NHANES 1999-2018. J Hum Hypertens 2022. DOI: 10.1038/s41371-022-00704-x
34. Lin Z, Cheung BMY, Tang V, Tsoi MF. Incidence of severe hypokalaemia in patients taking indapamide. Intern Emerg Med 2023; 18 (2): 549–57. DOI: 10.1007/s11739-023-03209-8
35. Ishani A, Cushman WC, Leatherman SM et al; Diuretic Comparison Project Writing Group. Chlorthalidone vs. Hydrochlorothiazide for Hypertension-Cardiovascular Events. N Engl J Med 2022; 387 (26): 2401–10. DOI: 10.1056/NEJMoa2212270
36. Гидрохлоротиазид: новые данные о безопасности. URL: http: //www.rlsnet.ru/news_1791.htm
[Gidrohlorotiazid: novye dannye o bezopasnosti. URL: http: //www.rlsnet.ru/news_1791.htm (in Russian).]
37. Трухан Д.И., Лебедев О.И. Изменение органа зрения при заболеваниях внутренних органов. М.: Практическая медицина. 2014. URL: https: //elibrary.ru/item.asp?id=26002880
[Truhan D.I., Lebedev O.I. Izmenenie organa zreniya pri zabolevaniyah vnutrennih organov. M.: Prakticheskaya medicina. 2014. URL: https: //elibrary.ru/item.asp?id=26002880 (in Russian).]
38. Yang MC, Lin KY. Drug-induced Acute Angle-closure Glaucoma: A Review. Drug-induced Acute Angle-closure Glaucoma: A Review. J Curr Glaucoma Pract 2019; 13 (3): 104–9. DOI: 10.5005/jp-journals-10078-1261
39. Geanon JD, Perkins TW. Bilateral acute angle-closure glaucoma associated with drug sensitivity to hydrochlorothiazide. Arch Ophthalmol 1995; 113 (10): 1231–2. DOI: 10.1001/archopht.1995. 01100100019012
40. Chen SH, Karanjia R, Chevrier RL, Marshall DH. Bilateral acute angle closure glaucoma associated with hydrochlorothiazide-induced hyponatraemia. BMJ Case Rep 2014; 2014: bcr2014206690. DOI: 10.1136/bcr-2014-206690
41. Roh Y-R, Woo SJ, Park KH. Acute-Onset Bilateral Myopia and Ciliochoroidal Effusion Induced by Hydrochlorothiazide. Korean Journal of Ophthalmology: KJO 2011; 25 (3): 214–7. DOI: 10.3341/kjo. 2011.25.3.214
42. Wu C, Pan H, Feng S et al. Low-dose topiramate and hydrochlorothiazide-associated early acute myopia and angle narrowing: A case report. Front Med (Lausanne) 2023; 10: 1062160. DOI: 10.3389/ fmed.2023.1062160
43. Mahesh G, Giridhar A, Saikumar SJ, Fegde S. Drug-induced acute myopia following chlorthalidone treatment. Indian J Ophthalmol 2007; 55 (5): 386–8. DOI: 10.4103/0301-4738.33830
44. Федеральная служба по надзору в сфере здравоохранения. Информационное письмо от 26.12.2018 № 01И-3093/18. О новых данных по безопасности лекарственных препаратов содержащих в качестве действующего вещества гидрохлоротиазид. URL: http: //roszdravnadzor.ru/drugs/monitpringlp/documents/ 56341
[Federal'naya sluzhba po nadzoru v sfere zdravoohraneniya. Informacionnoe pis'mo ot 26.12.2018 № 01I-3093/18. O novyh dannyh po bezopasnosti lekarstvennyh preparatov soderzhashchih v kachestve dejstvuyushchego veshchestva gidrohlorotiazid. URL: http: //roszdravnadzor.ru/drugs/monitpringlp/documents/56341 (in Rus-sian).]
45. Pottegård A, Hallas J, Olesen M et.al. Hydrochlorothiazide use is strongly associated with risk of lip cancer. J Intern Med 2017; 282 (4): 322–31. DOI: 10.1111/joim.12629
46. Pedersen SA, Gaist D, Schmidt SAJ et al. Hydrochlorothiazide use and risk of nonmelanoma skin cancer: A nationwide case-control study from Denmark. J Am Acad Dermatol 2018; 78 (4): 673–81.e9. DOI: 10.1016/j.jaad.2017.11.042
47. Федеральная служба по надзору в сфере здравоохранения. Информационное письмо от 05.02.2019 №01И-318/19. О внесении изменений в инструкции по применению лекарственных препаратов, содержащих гидрохлоротиазид. URL: http: //roszdravnadzor.ru/drugs/monitpringlp/documents/57228
[Federal'naya sluzhba po nadzoru v sfere zdravoohraneniya. Informacionnoe pis'mo ot 05.02.2019 №01I-318/19. O vnesenii izmenenij v instrukcii po primeneniyu lekarstvennyh preparatov, soderzhashchih gidrohlorotiazid. URL: http: //roszdravnadzor.ru/ drugs/monitpringlp/documents/57228 (in Russian).]
48. Llamas-Molina JM, Navarro-Triviño FJ, Ruiz-Villaverde R. What Dermatologists Should Know About Thiazides. Actas Dermosifiliogr 2022; 113 (5): 498–504. DOI: 10.1016/j.ad.2021.12.015
49. Garrido PM, Borges-Costa J. Hydrochlorothiazide treatment and risk of non-melanoma skin cancer: Review of the literature. Rev Port Cardiol (Engl Ed) 2020; 39 (3): 163–70. DOI: 10.1016/ j.repc.2019.07.008
50. Lecaros-Astorga DA, Molina-Guarneros JA, Rodríguez-Jiménez P et al. Hydrochlorothiazide use and risk of non-melanoma skin cancer in Spain: A case/non-case study. Int J Clin Pharmacol Ther 2021; 59 (4): 280–8. DOI: 10.5414/CP203769
51. Becquart O, Guillot B, Bourrain J-L et al. Hydrochlorothiazide use and risk of skin cancers: A systematic review. Rev Med Interne 2019; 40 (9): 617–22. DOI: 10.1016/j.revmed.2019.04.008
52. Letellier T, Le Borgne F, Kerleau C et al; Divat Consortium. Association between Use of Hydrochlorothiazide and Risk of Keratinocyte Cancers in Kidney Transplant Recipients. Clin J Am Soc Nephrol 20207; 15 (12): 1804–13. DOI: 10.2215/CJN.02560220
53. Carney K, Cousins M. Does hydrochlorothiazide increase the incidence of skin, lip and oral cancer in a UK population? Evid Based Dent 2022; 23 (1): 38–9. DOI: 10.1038/s41432-022-0255-x
54. Eworuke E, Haug N, Bradley M et al. Risk of Nonmelanoma Skin Cancer in Association With Use of Hydrochlorothiazide-Containing Products in the United States. JNCI Cancer Spectr 2021; 5 (2): pkab009. DOI: 10.1093/jncics/pkab009
55. Rouette J, Yin H, Pottegård A et.al. Use of Hydrochlorothiazide and Risk of Melanoma and Nonmelanoma Skin Cancer. Drug Saf 2021; 44 (2): 245–54. DOI: 10.1007/s40264-020-01015-1
56. de Macedo Andrade AC, Felix FA, França GM et al. Hydrochlorothiazide use is associated with the risk of cutaneous and lip squamous cell carcinoma: A systematic review and meta-analysis. Eur J Clin Pharmacol 2022; 78 (6): 919–30. DOI: 10.1007/s00228-022-03299-x
57. Shao SC, Lai CC, Chen YH et al. Associations of thiazide use with skin cancers: a systematic review and meta-analysis. BMC Med 2022; 20 (1): 228. DOI: 10.1186/s12916-022-02419-9
58. Habel LA, Achacoso N, Fireman B et.al. Hydrochlorothiazide and risk of melanoma subtypes. Pharmacoepidemiol Drug Saf 2021; 30 (10): 1396–401. DOI: 10.1002/pds.5266
59. Adalsteinsson JA, Muzumdar S, Waldman R et al. Association between hydrochlorothiazide and the risk of in situ and invasive squamous cell skin carcinoma and basal cell carcinoma: A population-based case-control study. J Am Acad Dermatol 2021; 84 (3): 669–75. DOI: 10.1016/j.jaad.2020.08.025
60. Damps T, Czuwara J, Warszawik-Hendzel O et al. The role of drugs and selected dietary factors in cutaneous squamous cell carcinogenesis. Postepy Dermatol Alergol 2021; 38 (2): 198–204. DOI: 10.5114/ada.2021.106196
61. Pottegård A, Bech BH, Pedersen SA, Christensen B. Use of hydrochlorothiazide in Denmark following publication of skin cancer risk findings. Pharmacoepidemiol Drug Saf 2021; 30 (11): 1611–6. DOI: 10.1002/pds.5350
62. Tchernev G, Oliveira N, Kandathil LJ. Baboon syndrome (SDRIFE) after valsartan/hydrochlorothiazide intake for several years. Dermatol Reports 2021; 14 (2): 9412. DOI: 10.4081/dr.2022.9412
63. Ferreira O, Mota A, Morais P et al. Symmetrical drug-related intertriginous and flexural exanthema (SDRIFE) induced by telmisartan-hydrochlorothiazide. Cutan Ocul Toxicol 2010; 29 (4): 293–5. DOI: 10.3109/15569527.2010.491103
64. Федеральное государственное бюджетное учреждение «Научный центр экспертизы средств медицинского применения» (ФГБУ «НЦЭСМП» Минздрава России). Информационное письмо №4785 от 13 марта 2023 г.
[Federal'noe gosudarstvennoe byudzhetnoe uchrezhdenie «Nauchnyj centr ekspertizy sredstv medicinskogo primeneniya» (FGBU «NCESMP» Minzdrava Rossii). Informacionnoe pis'mo №4785 ot 13 marta 2023 g. (in Russian).]
65. Levay ID. Hydrochlorothiazide-induced pulmonary edema. Drug Intell Clin Pharm 1984; 18 (3): 238–9. DOI: 10.1177/106002808401800311
66. González G, Ligueros M, Castro P et al. Adult respiratory distress syndrome associated with hydrochlorothiazide: a report of 2 cases and review of the literature. Rev Med Chil 1988; 116 (10): 1047–53. URL: https: //pubmed.ncbi.nlm.nih.gov/3077199/
67. Kavaru MS, Ahmad M, Hydrochlorothiazide-induced acute pulmonary edema. Amirthalingam KN. Cleve Clin J Med 1990; 57 (2): 181–4. DOI: 10.3949/ccjm.57.2.181
68. Nielsen-Kudsk JE, Knudsen AS, Sørensen PV. Pulmonary edema induced by hydrochlorothiazide/amiloride (Moduretic). Ugeskr Laeger 1991; 153 (11): 791–2. URL: https: //pubmed.ncbi.nlm.nih.gov/2008731/
69. Biron P, Dessureault J, Napke E. Acute allergic interstitial pneumonitis induced by hydrochlorothiazide. CMAJ 1991; 145 (1): 28–34. URL: https: //pubmed.ncbi.nlm.nih.gov/2049694/
70. Shieh CM, Chen CH, Tao CW et al. Hydrochlorothiazide-induced pulmonary edema: a case report and literature review. Zhonghua Yi Xue Za Zhi (Taipei) 1992; 50 (6): 495–9. URL: https: //pubmed.ncbi.nlm.nih.gov/1338027/#affiliation-1
71. Garcia MJ, Kidwai Z, Rosa J, Cooper EB. Thiazide-induced pulmonary edema: a case report. Conn Med 1992; 56 (4): 185–6. URL: https: //pubmed.ncbi.nlm.nih.gov/1606817/
72. Knowles SR, Wong GA, Rahim SA et al. Hydrochlorothiazide-induced noncardiogenic pulmonary edema: an underrecognized yet serious adverse drug reaction. Pharmacotherapy 2005; 25 (9): 1258–65. DOI: 10.1592/phco.2005.25.9.1258
73. Goetschalckx K, Ceuppens J, Van Mieghem W. Hydrochlorothiazide-associated noncardiogenic pulmonary oedema and shock: a case report and review of the literature. Acta Cardiol 2007; 62 (2): 215–20. DOI: 10.2143/AC.62.2.2020246
74. Jansson PS, Leisten DC, Sarkisian TM et al. Recurrent Hydrochlorothiazide-Induced Acute Respiratory Distress Syndrome Treated With Extracorporeal Membrane Oxygenation. J Emerg Med 2018; 55 (6): 836–40. DOI: 10.1016/j.jemermed.2018.09.019
75. Kane SP, Cohen E. Life-threatening idiopathic reaction to hydrochlorothiazide treated with veno-venous extracorporeal membrane oxygenation. Perfusion 2018; 33 (4): 320–2. DOI: 10.1177/0267659117745370
76. Traversa M, Collini A, Villois P et al. When a Diuretic Causes Pulmonary Oedema. Eur J Case Rep Intern Med 2018; 5 (6): 000864. DOI: 10.12890/2018_000864
77. Chauhan K, Pattharanitima P, Piani F et al. Prevalence and Outcomes Associated with Hyperuricemia in Hospitalized Patients with COVID-19. Am J Nephrol 2022; 53 (1): 78–86. DOI: 10.1159/ 000520355
78. Трухан Д.И. Новая коронавирусная инфекция (COVID-19) и заболевания / патологические состояния почек и мочевых путей. Клинический разбор в общей медицине. 2022; 1: 6–15. DOI: 10.47407/kr2022.3.1.00111
[Truhan D.I. Novaya koronavirusnaya infekciya (COVID-19) i zabolevaniya / patologicheskie sostoyaniya pochek i mochevyh putej. Clinical review for general practice. 2022; 1: 6–15. DOI: 10.47407/kr2022.3.1.00111 (in Russian).]
79. Трухан Д.И., Викторова И.А. Новая коронавирусная инфекция (COVID-19) и основные ревматические заболевания. Клинический разбор в общей медицине. 2023; 4 (1): 36–43. DOI: 10.47407/kr2023.4.1.00187
[Truhan D.I., Viktorova I.A. Novaya koronavirusnaya infekciya (COVID-19) i osnovnye revmaticheskie zabolevaniya. Clinical review for general practice. 2023; 4 (1): 36–43. DOI: 10.47407/ kr2023.4.1.00187 (in Russian).]
80. Choi HK, Soriano LC, Zhang Y, Rodríguez L.A. Antihypertensive drugs and risk of incident gout among patients with hypertension: population based case-control study. BMJ 2012; 344: d8190. DOI: 10.1136/bmj.d8190
81. Bruderer S, Bodmer M, Jick SS, Meier CR. Use of diuretics and risk of incident gout: a population-based case-control study. Arthritis Rheumatol 2014; 66 (1): 185–96. DOI: 10.1002/art.38203
82. Ueno S, Hamada T, Taniguchi S et al. Effect of Antihypertensive Drugs on Uric Acid Metabolism in Patients with Hypertension: Cross-Sectional Cohort Study. Drug Res (Stuttg) 2016; 66 (12): 628–32. DOI: 10.1055/s-0042-113183
83. Переверзев А.П., Остроумова О.Д. Лекарственно-индуцированные гиперурикемия/подагра. Часть 2: отдельные лекарственные средства, прием которых ассоциирован с повышенным риском развития этих заболеваний. Терапия. 2021; 7: 159–69. DOI: 10.18565/therapy.2021.7.159-169
[Pereverzev A.P., Ostroumova O.D. Lekarstvenno-inducirovannye giperurikemiya/podagra. CHast' 2: otdel'nye lekarstvennye sredstva, priem kotoryh associirovan s povyshennym riskom razvitiya etih zabolevanij. Terapiya. 2021; 7: 159–69. DOI: 10.18565/therapy.2021.7.159-169 (in Russian).]
84. Waller PC, Ramsay LE. Predicting acute gout in diuretic-treated hypertensive patients. J Hum Hypertens 1989; 3 (6): 457–61. https: //pubmed.ncbi.nlm.nih.gov/2607519/
85. Hunter DJ, York M, Chaisson CE et al. Recent diuretic use and the risk of recurrent gout attacks: the online case-crossover gout study. J Rheumatol 2006; 33 (7): 1341–45. https: //pubmed.ncbi.nlm.nih. gov/16758506/
86. Savage PJ, Pressel SL, Curb JD, et al. Influence of long-term, low-dose, diuretic-based, antihypertensive therapy on glucose, lipid, uric acid, and potassium levels in older men and women with isolated systolic hypertension: the Systolic Hypertension in the Elderly Program. SHEP Cooperative Research Group. Arch Intern Med 1998; 158: 741–51. DOI: 10.1001/archinte.158.7.741
87. Palmer B.F. Metabolic complications associated with use of diuretics. Semin Nephrol 2011; 31 (6): 542–52. DOI: 10.1016/j. semnephrol. 2011.09.009
88. Handler J. Managing hypertensive patients with gout who take thiazide. J Clin Hypertens (Greenwich) 2010; 12 (9): 731–35. DOI: 10.1111/j.1751-7176.2010.00346.x
89. Reyes AJ. Cardiovascular drugs and serum uric acid. Cardiovasc Drugs Ther 2003; 17 (5–6): 397–414. DOI: 10.1023/b: card.0000015855.02485.e3
90. Ben Salem C, Slim R, Fathallah N, Hmouda H. Drug-induced hyperuricaemia and gout. Rheumatology 2017; 56 (5): 679–88. DOI: 10.1093/rheumatology/kew293
91. Plante GE, Robillard C. Indapamide in the treatment of essential arterial hypertension: results of a controlled study. Curr Med Res Opin 1983; 8 (Suppl. 3): 59–66. DOI: 10.1185/03007998309109837
92. Weidmann P. Metabolic profile of indapamide sustained-release in patients with hypertension: data from three randomised double-blind studies. Drug Saf 2001; 24: 1155–65. DOI: 10.2165/00002018-200124150-00006
93. Reilly RF, Peixoto AJ, Desir GV. The evidence-based use of thiazide diuretics in hypertension and nephrolithiasis. CJASN 2010; 5 (10): 1893–903. DOI: 10.2215/CJN.04670510
94. Musini VM, Nazer M, Bassett K, Wright JM. Blood pressure-lowering efficacy of monotherapy with thiazide diuretics for primary hypertension. Cochrane Database Syst Rev 2014; 5: CD003824. DOI: 10.1002/14651858.CD003824.pub2
95. Трухан Д.И., Давыдов Е.Л. Место и роль терапевта и врача общей практики в курации коморбидных пациентов в период пандемии новой коронавирусной инфекции (COVID-19): акцент на реабилитационный этап. Фарматека. 2021; 13: 44–53. DOI: 10.18565/pharmateca.2021.13.44-53
[Truhan D.I., Davydov E.L. Mesto i rol' terapevta i vracha obshchej praktiki v kuracii komorbidnyh pacientov v period pandemii novoj koronavirusnoj infekcii (COVID-19): akcent na reabilitacionnyj etap. Farmateka. 2021; 13: 44–53. DOI: 10.18565/pharmateca. 2021.13.44-53 (in Russian).]
96. Трухан Д.И. Коморбидный пациент на терапевтическом приеме в период пандемии COVID-19. Актуальные аспекты реабилитационного периода. Фарматека. 2022; 29 (13): 15–24. DOI: 10.18565/pharmateca.2022.13.15-24
[Truhan D.I. Komorbidnyj pacient na terapevticheskom prieme v period pandemii COVID-19. Aktual'nye aspekty reabilitacionnogo perioda. Farmateka. 2022; 29 (13): 15–24. DOI: 10.18565/pharmateca.2022.13.15-24 (in Russian).]
97. Мазуров А.Л., Трухан Д.И. Сравнительная характеристика индапамида и гидрохлоротиазида. Современные наукоемкие технологии. 2010; 2: 100–1. URL: https: //elibrary.ru/item. asp?id=13042875
[Mazurov A.L., Truhan D.I. Sravnitel'naya harakteristika indapamida i gidrohlorotiazida. Sovremennye naukoemkie tekhnologii. 2010; 2: 100–1. URL: https: //elibrary.ru/item.asp?id=13042875 (in Russian).]
98. Павлова Т.В. Роль диуретиков в лечении АГ. Справочник поликлинического врача. 2013; 7–8: 37–41. URL: https: //elibrary.ru/ item.asp?id=22149450
[Pavlova T.V. Rol' diuretikov v lechenii AG. Spravochnik poliklinicheskogo vracha. 2013; 7–8: 37–41. URL: https: //elibrary.ru/item. asp?id=22149450 (in Russian).]
99. Недогода С.В. Диуретики при артериальной гипертензии: ангелы и демоны. Российский кардиологический журнал. 2013; 3: 62–6. URL: https: //elibrary.ru/item.asp?id=19121461
[Nedogoda S.V. Diuretiki pri arterial'noj gipertenzii: angely i demony. Rossijskij kardiologicheskij zhurnal. 2013; 3: 62–6. URL: https: //elibrary.ru/item.asp?id=19121461 (in Russian).]
100. Трухан Д.И., Филимонов С.Н. Лечение артериальной гипертензии I–II стадий у пациентов с риском сердечно-сосудистых осложнений выше умеренного в реальной клинической практике: возможности индапамида в составе комбинированной терапии. Терапия. 2021; 5 (47): 173–83. DOI: 10.18565/therapy.2021.5.173-183
[Truhan D.I., Filimonov S.N. Lechenie arterial'noj gipertenzii I–II stadij u pacientov s riskom serdechno-sosudistyh oslozhnenij vyshe umerennogo v real'noj klinicheskoj praktike: vozmozhnosti indapamida v sostave kombinirovannoj terapii. Terapiya. 2021; 5 (47): 173–83. DOI: 10.18565/therapy.2021.5.173-183 (in Russian).]
101. Zhang Y, Agnoletti D, Safar ME, Blacher J. Effect of antihypertensive agents on blood pressure variability: the Natrilix SR versus candesartan and amlodipine in the reduction of systolic blood pressure in hypertensive patients (X-CELLENT) study. Hypertension 2011; 58 (2): 155–60. DOI: 10.1161/HYPERTENSIONAHA.111.174383
102. Waeber B, Rotaru C, Feihl F. Position of indapamide, a diuretic with vasorelaxant activities, in antihypertensive therapy. Expert Opin Pharmacother 2012; 13 (10): 1515–26. DOI: 10.1517/14656566. 2012.698611
103. Brodszky V, Nagy V, Farsang C et–al. The efficacy of indapamide in different cardiovascular outcome-meta-analysis. Orv Hetil 2007; 148 (26): 1203–11. DOI: 10.1556/OH.2007.28046
104. Nádházi Z, Dézsi CA. The Results of ACES (Antihypertensive Combinations' Long Term Efficacy Comparing Study): Analysis of Metabolic Effects of Antihypertensive Combination Therapies. Clin Drug Investig 2016; 36 (10): 819–27. DOI: 10.1007/s40261-016-0431-x
105. Janega P, Kojsová S, Jendeková L et al. Indapamide-induced prevention of myocardial fibrosis in spontaneous hypertension rats is not nitric oxide-related. Physiol Res 2007; 56 (6): 825–8. URL: https: //pubmed.ncbi.nlm.nih.gov/18197750
106. Jungmann E. Prevention and treatment of diabetic nephropathy in older patients. Drugs Aging 2003; 20 (6): 419–35. DOI: 10.2165/00002512-200320060-00002
107. Waeber B. Managing hypertension in high-risk patients: lessons and promises from the STRATHE and ADVANCE trials. J Hypertens Suppl 2006; 24 (3): S19–27. DOI: 10.1097/01.hjh.0000229465. 09610.b6
108. Heerspink HJ, Ninomiya T, Perkovic V et al; ADVANCE Collaborative Group. Effects of a fixed combination of perindopril and indapamide in patients with type 2 diabetes and chronic kidney disease. Eur Heart J 2010; 31 (23): 2888–96. DOI: 10.1093/eurheartj/ ehq139
109. Aubert I, Djian F, Rouffy J. Beneficial effects of indapamide on lipoproteins and apoproteins in ambulatory hypertensive patients. Am J Cardiol 1990; 65 (17): 77H-80H. DOI: 10.1016/0002-9149 (90)90349-6
110. Мамедов М.Н. Возможности применения индапамида на различных этапах сердечно-сосудистого континуума и в отдельных группах пациентов. Российский кардиологический журнал. 2010; 6: 107–11. URL: https: //elibrary.ru/item. asp?id=15518059
[Mamedov M.N. Vozmozhnosti primeneniya indapamida na razlichnyh etapah serdechno-sosudistogo kontinuuma i v otdel'nyh gruppah pacientov. Rossijskij kardiologicheskij zhurnal. 2010; 6: 107–11. URL: https: //elibrary.ru/item.asp?id=15518059 (in Russian).]
111. Akbari P, Khorasani-Zadeh A. Treasure Island (FL): StatPearls Publishing; 2023 Jan. URL: https: //pubmed.ncbi.nlm.nih.gov/ 30422513/
112. Марцевич С.Ю., Кутишенко Н.П., Деев А.Д., Якусевич В.В. Изучение эффективности и переносимости препарата индап в сравнении с препаратами арифон и арифон ретард у больных мягкой и умеренной артериальной гипертонией, назначаемых как в виде монотерапии, так и в комбинации с ингибиторами АПФ. Многоцентровое, открытое, рандомизированное перекрестное исследование. Российский кардиологический журнал. 2006; 2: 73–7. URL: https: //elibrary.ru/item.asp?id=10133950
[Marcevich S.Yu., Kutishenko N.P., Deev A.D., YAkusevich V.V. Izuchenie effektivnosti i perenosimosti preparata indap v sravnenii s preparatami arifon i arifon retard u bol'nyh myagkoj i umerennoj arterial'noj gipertoniej, naznachaemyh kak v vide monoterapii, tak i v kombinacii s ingibitorami APF. Mnogocentrovoe, otkrytoe, randomizirovannoe perekrestnoe issledovanie. Rossijskij kardiologicheskij zhurnal. 2006; 2: 73–7. URL: https: //elibrary.ru/item. asp?id=10133950 (in Russian).]
113. Трухан Д.И., Павлова Т.В., Викторова И.А. Оптимизация немедикаментозного и медикаментозного воздействия на патогенетические факторы развития и течения артериальной гипертензии в рамках новой научно-исследовательской образовательной оздоровительной программы ПЕРСПЕКТИВА. Справочник поликлинического врача. 2012. 11: 18–22. URL: https: //elibrary.ru/item.asp?id=23502186
[Truhan D.I., Pavlova T.V., Viktorova I.A. Optimizaciya nemedikamentoznogo i medikamentoznogo vozdejstviya na patogeneticheskie faktory razvitiya i techeniya arterial'noj gipertenzii v ramkah novoj nauchno-issledovatel'skoj obrazovatel'noj ozdorovitel'noj programmy PERSPEKTIVA. Spravochnik poliklinicheskogo vracha. 2012. 11: 18–22. URL: https: //elibrary.ru/item.asp?id=23502186 (in Russian).]
114. Сыров А.В., Минушкина Л.О. Выбор оптимального тиазидоподобного диуретика у пациентов с артериальной гипертензией. Терапия. 2021; 1 (43): 172–180. DOI: 10.18565/therapy.2021.1.172-180
[Syrov A.V., Minushkina L.O. Vybor optimal'nogo tiazidopodobnogo diuretika u pacientov s arterial'noj gipertenziej. Terapiya. 2021; 1 (43): 172–180. DOI: 10.18565/therapy.2021.1.172-180 (in Russian).]
115. Сыров А.В. Применение индапамида в клинической практике. Терапия. 2021; 10 (52): 188–94. DOI: 10.18565/therapy.2021. 10.188-194
[Syrov A.V. Primenenie indapamida v klinicheskoj praktike. Terapiya. 2021; 10 (52): 188–94. DOI: 10.18565/therapy.2021.10.188-194 (in Russian).]
116. Остроумова О.Д., Полякова О.А., Листратов А.И. и др. Тиазидные и тиазидоподобные диуретики: как правильно сделать выбор? Кардиология. 2022; 1: 89–97. DOI: 10.18087/cardio. 2022.1.n1862
[Ostroumova O.D., Polyakova O.A., Listratov A.I. et al. Tiazidnye i tiazidopodobnye diuretiki: kak pravil'no sdelat' vybor? Kardiologiya. 2022; 1: 89–97. DOI: 10.18087/cardio.2022.1.n1862 (in Russian).]
117. Полякова О.А., Остроумова О.Д., Араблинский А.В. Лекарственная безопасность и полиморбидность как важные составляющие рациональной фармакотерапии в кардиологии. Терапия. 2022; 4 (56): 141–8. DOI: 10.18565/therapy.2022.4.141-148
[Polyakova O.A., Ostroumova O.D., Arablinskij A.V. Lekarstvennaya bezopasnost' i polimorbidnost' kak vazhnye sostavlyayushchie racional'noj farmakoterapii v kardiologii. Terapiya. 2022; 4 (56): 141–8. DOI: 10.18565/therapy.2022.4.141-148 (in Russian).]
