Клинический разбор в общей медицине №5 2023
1 Russian Medical Academy of Continuous Professional Education, Moscow, Russia;
2 Central clinical hospital of the medicine of the Russian Railways, Russia
docpolyakova.olga@gmail.com
Abstract
Atrial fibrillation (AF) is one of the most common types of arrhythmias and represents a significant health and economic burden worldwide. Along with the aging of the population, there has been a rapid increase in the prevalence and incidence of AF. Among adults over the age of 55, one in three is expected to be diagnosed with AF during their lifetime. However, due to the fact that some patients do not experience symptoms associated with arrhythmia, unfortunately, all too often AF remains undiagnosed and untreated. Detection of asymptomatic and/or previously unknown AF is one of the key tasks of outpatient care, and considering that prevention of cardiovascular disease and cardiovascular complications is considered an important part of the work of general practitioners, this article will review pathophysiological mechanisms of AF, risk factors and diagnostic criteria of AF, and discuss algorithms of management tactics for patients with AF, which may be useful for routine clinical activities of the general practitioner.
Key words: atrial fibrillation, anticoagulants, adherence to therapy, apixaban.
For citation: Polyakova O.A., Mironova E.V., Grishin G.P., Ostroumova O.D. A patient with atrial fibrillation at a general practitioner's appointment. Clinical review for general practice. 2023; 4 (5): 71–80 (In Russ.). DOI: 10.47407/kr2023.4.5.00237
Некоторые пациенты с ФП испытывают признаки нарушения ритма и симптомы, такие как сердцебиение, одышка и головокружение. Вместе с тем 1/3 всех пациентов с ФП бессимптомна, что в значительной степени затрудняет диагностику данной тахиаритмии [4]. Пациенты с ФП, как симптомной, так и бессимптомной, имеют повышенный риск развития инсульта, сердечной недостаточности и других сердечно-сосудистых осложнений (ССО) [5]. При этом имеются убедительные доказательства того, что своевременная терапия пероральными антикоагулянтами может снизить риск инсульта у больных с ФП более чем на 60% [6]. Однако, к сожалению, слишком часто ФП остается невыявленной и нелеченной. Так, имеются сведения, что ранее неизвестная ФП обнаруживается почти у 1/4 пациентов, перенесших инсульт [7]. Кроме того, следует отметить, что у больных ФП существует высокий риск смертности в течение первого (20%) и пятого (50%) года уже после постановки диагноза ФП [8], в связи с этим крайне важно своевременно выявлять группу больных высокого риска развития ФП и ассоциированных с ней ССО, в которой профилактические и лечебные вмешательства будут эффективны и принесут больше пользы.
Выявление бессимптомной («немой») и/или ранее неизвестной ФП является одной из ключевых задач амбулаторного звена, а учитывая, что профилактика сердечно-сосудистых заболеваний (ССЗ) и ССО считается важной частью работы врачей общей практики, в данной статье будут рассматриваться патофизиологические механизмы ФП, факторы риска и диагностические критерии ФП, а также обсуждаться алгоритмы тактики ведения пациента с ФП, которые могут быть полезны для рутинной клинической деятельности врача общей практики.
Электрические свойства миокарда контролируются ионными каналами, присутствующими на клеточной мембране. Активация клеток в основном зависит от натриевых, кальциевых и калиевых каналов [10]. Рефрактерный период клеток примерно зависит от времени между активацией клетки и возвращением потенциала действия к исходному уровню. Увеличение притока ионов кальция и натрия удлиняет рефрактерный период, в то время как увеличение оттока калия приводит к укорочению этого периода [9, 10].
Другим важным компонентом нормальной электрофизиологии сердца являются коннексины: это белки, присутствующие в соединениях между кардиомиоцитами, которые отвечают за ионную проницаемость между клетками, обеспечивая нормальное распространение электрического импульса [9].
При ФП происходят изменения в этих компонентах нормальной клеточной электрофизиологии, которые называются электрическим ремоделированием. Наиболее распространенная форма электрического ремоделирования возникает в результате острого поступления кальция в клетки, которые деполяризуются с повышенной частотой. Это приводит к инактивации кальциевых токов и усилению калиевых токов, что способствует сокращению продолжительности потенциала действия и повышению «уязвимости» к развитию ФП, а также раннему рецидиву после кардиоверсии и прогрессированию пароксизмальных форм в более персистирующие формы аритмии [9, 10].
Генетические факторы могут быть связаны с дефектами вышеописанных ионных каналов и, таким образом, с предрасположенностью к ФП. Семейные формы аритмии, хотя и редкие, и гетерогенные, хорошо описаны в литературе [11]. В настоящее время роль генетики в ФП изучается и представляет собой многообещающий путь во все более современном поиске методов персонализированного лечения.
Вегетативная активность также играет важную роль в возникновении и поддержании ФП. Активация блуждающего нерва может изменить активируемые ацетилхолином калиевые токи с последующим уменьшением продолжительности потенциала действия, стабилизируя тем самым путь повторного входа электрического импульса [12]. Кроме того, адренергическая активация способна вызвать накопление внутриклеточного кальция и последующее развитие аритмии [12].
Изменения в структуре миокарда предсердий, особенно фиброз, разделяют мышечные волокна и нарушают непрерывность проведения электрического импульса, снижая скорость проведения, что является основополагающим фактором для повторного входа. Фиброз приводит к прогрессированию ФП и потенциально является терапевтической мишенью и предиктором ответа на лечение [13].
Хотя электрофизиологические факторы, такие как электрическое ремоделирование, и морфологические факторы, такие как фиброз и дилатация предсердий (структурное ремоделирование), считаются основными факторами, участвующими в патофизиологии ФП, появляется все больше данных о том, что инфекционные или воспалительные процессы могут объединять эти две ситуации. Так, в исследовании «случай–контроль» с участием 56 870 участников оценивалась связь между инфекцией вирусом гриппа, вакцинацией и риском развития ФП [14]. Авторы показали, что инфекция повышает риск развития аритмии, а вакцинация оказывает защитное действие в разных группах больных [14]. В другом исследовании наличие воспалительного инфильтрата, клеточного некроза и интерстициального фиброза было выше у пациентов с ФП без структурного заболевания сердца по сравнению с пациентами без аритмии и ССЗ [15]. Также было продемонстрировано, что у пациентов с ФП наблюдается более высокая концентрация маркеров воспаления, таких как интерлейкин-6 и высокочувствительный С-реактивный белок, нежели у пациентов без ФП [16].
Таким образом, исходя из понимания патофизиологических механизмов развития ФП, врачу общей практики при опросе больного, сборе анамнеза и клиническом осмотре следует выяснить/оценить у пациента:
• наличие/отсутствие случаев ФП и других аритмий у ближайших родственников;
• наличие/отсутствие сопутствующих ССЗ, включая артериальную гипертензию и структурные изменения сердца (врожденные/приобретенные аномалии, инфаркт миокарда в анамнезе и др.);
• наличие/отсутствие тревоги, нарушений сна и других проявлений хронического психосоциального стресса в рамках диагностики дисфункции вегетативной нервной системы (в амбулаторных условиях с большей вероятностью выявить тревогу и/или депрессию у пациента общесоматического профиля позволяет использование опросников и шкал, например госпитальной шкалы тревоги и депрессии – Hospital Anxiety and Depression Scale, HADS) [17];
с целью диагностики нарушений сна помимо проведения опроса можно попросить пациента вести в течение 1–2 нед дневник сна1);
• наличие/отсутствие острого и хронического воспалительного процесса, недавно перенесенной инфекции.
• малоподвижный образ жизни;
• курение;
• избыточную массу тела и ожирение;
• артериальную гипертензию;
• сахарный диабет;
• синдром обструктивного апноэ сна [19].
Также следует отметить, что, согласно данным глобального исследования бремени болезней (2019 г.) [20], оценивающего бремя ФП и связанных с ним факторов риска с 1990 по 2019 гг., стандартизированная по возрасту смертность от ФП в мире в 2019 г. была в первую очередь связана с высоким систолическим артериальным давлением (АД; 34,0%), а далее – с высоким индексом массы тела (20,2%), употреблением алкоголя (7,4%), курением (4,3%) и диетой с высоким содержанием натрия (4,2%).
В российских клинических рекомендациях «Фибрилляция и трепетание предсердий» (2020 г.) [21], помимо вышеописанных факторов, еще выделяют ряд ассоци-
ированных клинических состояний, связанных с повышенным риском развития нарушений ритма, таких как структурные заболевания сердца (приобретенные или врожденные структурные патологии миокарда, перикарда, клапанного аппарата и/или магистральных сосудов), ишемическая болезнь сердца, клинически выраженная сердечная недостаточность, нарушение функции щитовидной железы (гипотиреоз и гипертиреоз, а также, вероятно, субклиническая дисфункция щитовидной железы).
Таким образом, врачу общей практики при опросе больного, сборе анамнеза и клиническом осмотре следует выяснить/оценить у пациента:
• наличие/отсутствие курения (расчет индекса курильщика, при курении сигарет оценка степени никотиновой зависимости по тесту Фагерстрема и др.), уровень употребления алкоголя;
• уровень физической активности, особенности питания (в частности, наличие диеты с высоким содержанием соли);
• индекс массы тела, измерить окружность талии и бедер;
• уровень АД в соответствии с правилами2, отраженными в российских клинических рекомендациях – «Артериальная гипертензия у взрослых» (2020 г.) [21], оценить частоту сердечных сокращений (на лучевой и сонной артерии одномоментно, на лучевой артерии на правой и левой руке одномоментно, и при необходимости рассчитать дефицит пульса);
• наличие/отсутствие ССЗ (в частности, ишемической болезни сердца, сердечной недостаточности), сахарного диабета, синдрома обструктивного апноэ сна, патологии щитовидной железы.
Далее, определив жалобы пациента, при наличии симптоматики необходимо установить наличие аритмии, а именно зарегистрировать при проведении электрокардиографии (ЭКГ) эпизод аритмии длительностью не менее 30 с и с характерными для ФП ЭКГ-признаками. Характерные ЭКГ-признаки ФП представлены на рис. 1.
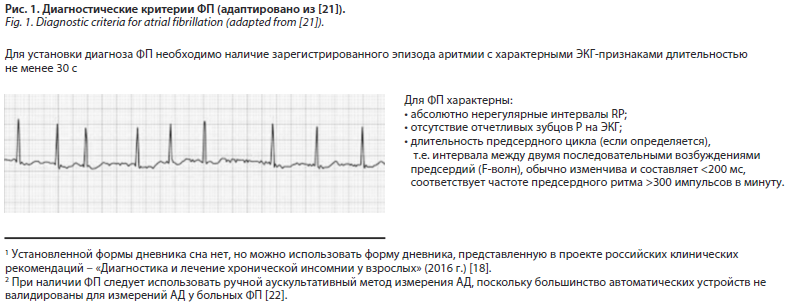
Вместе с тем, если на ЭКГ эпизод аритмии зафиксирован не был, но пациент продолжает предъявлять жалобы на неритмичное сердцебиение, необходимо выполнить суточное мониторирование ЭКГ.
В случае отсутствия симптомов, ФП можно выявить при рутинном обследовании, если отметить наличие нерегулярного пульса, например во время измерения АД. При этом следует отметить, что в настоящее время для повышения эффективности выявления ФП были разработаны новые методы, такие как электронные тонометры с функцией обнаружения ФП, портативные устройства ЭКГ, которые могут записывать полосу ритма, и носимые устройства. Эти методы потенциально могут облегчить врачам общей практики выявление бессимптомной ФП.
Согласно российским и европейским рекомендациям по ФП, всем пациентам старше 65 лет рекомендовано проводить скрининг на наличие ФП путем применения пальпаторного исследования пульса или аускультации сердца либо использования кратковременной записи ЭКГ [7, 21].
При выявлении ФП на ЭКГ необходимо выяснить длительность данной аритмии и определить ее тип в соответствии с классификацией (рис. 2).

Обследование по сопутствующим состояниям и заболеваниям, которые влияют на принятие решения по ведению пациента с фибрилляцией предсердий
После выявления впервые зарегистрированной ФП рекомендовано направить пациента к кардиологу или специалисту по лечению ФП для дальнейшего дообследования, оценки рисков и выбора наиболее оправданной тактики.
Всем пациентам с ФП показана комплексная оценка состояния сердечно-сосудистой системы, включая сбор жалоб, анализ анамнестических данных и сопутствующей патологии, физикальный осмотр, оценку риска кровотечений (шкала HAS-BLED) и тромбоэмболических осложнений (ТЭО; шкала CHA2DS2-VASc), функции печени и почек, выявление нарушений электролитного баланса и эндокринологического статуса (оценка функции щитовидной железы, наличия/отсутствия сахарного диабета), оценку ЭКГ в 12 отведениях и данных эхокардиографического исследования. Также при необходимости показано проведение суточного мониторирования ЭКГ и чреспищеводного эхокардиографического исследования, анализ когнитивного статуса, уровня воспалительных маркеров (высокочувствительный С-реактивный белок), кардиоспецифичных ферментов и натрийуретических пептидов. Кроме того, пациенты должны быть обследованы на наличие вероятного лекарственно-индуцированного генеза развития аритмии3.
С целью выбора оптимальной тактики ведения больного с ФП, включая оценку наличия/отсутствия у пациента потенциальных источников кровотечения перед назначением антитромботической терапии, следует провести следующие диагностические мероприятия [21].
Лабораторное обследование:
• клинический анализ крови – исключение анемии и тромбоцитопении (важно оценить их наличие/отсутствие перед назначением антитромботической терапии, поскольку это связано с риском развития кровотечений), выявление воспалительного процесса;
• биохимический анализ крови – оценка состояния функции печени (печеночные ферменты, общий билирубин, общий белок) и почек (креатинин, мочевина, электролиты; расчет скорости клубочковой фильтрации и клиренса креатинина для выявления хронической болезни почек и ее стадии – необходимо для выбора дозы антикоагулянтов), липидного и углеводного обменов (общий холестерин, липопротеины низкой и высокой плотности, триглицериды, глюкоза, гликированный гемоглобин);
• общий анализ мочи – исключение альбуминурии и эритроцитурии;
• коагулограмма, в частности определение международного нормализованного отношения – исключения нарушения синтеза факторов свертывания в печени, оценка риска кровотечения/тромбоза;
• уровень тиреотропного гормона сыворотки крови – исключение гипо- и гипертиреоза, как этиологического фактора развития ФП.
Инструментальное обследование:
• эзофагогастродуоденоскопия – исключение потенциального источника кровотечения в виде острых эрозий и язв или обострения хронического эрозивно-язвенного поражения желудочно-кишечного тракта (рекомендовано проводить всем пациентам с анамнезом желудочно-кишечного кровотечения – ЖКК, эрозивно-язвенного поражения желудочно-кишечного тракта);
• колоноскопия – исключение потенциального источника кровотечения (рекомендовано проводить тем больным, у которых выявлена анемия, но явные источники кровотечения отсутствуют);
• ультразвуковое исследование брюшной полости (оценка состояния печени) и забрюшинного пространства (оценка состояния мочеполовой системы – исключение мочекаменной болезни, опухолей, воспалительных заболеваний мочеполовой системы как потенциальных источников кровотечения; в особенности, ультразвуковое исследование почек и мочевыводящих путей рекомендовано больным с эритроцитурией);
• компьютерная томография и/или магнитно-резонансная томография головного мозга и интракраниальных артерий – исключения геморрагического характера инсульта и сосудистых мальформаций у пациентов недавно перенесших инсульт (в предыдущие 8 нед) или с выраженным остаточным неврологическим дефицитом при отсутствии данных нейровизуализации.
Консультации:
• консультация гинеколога – исключения дисфункциональных кровотечений и опухолей как причины кровотечений у женщин с анамнезом аномальных маточных геморрагий;
• консультация офтальмолога – следует назначить пациентам с рефрактерной артериальной гипертензией и сахарным диабетом.
Также следует отметить, что у пациентов с ФП перед стартом антитромботической терапии необходимо исключить наличие аневризмы аорты и ее ветвей, онкологии, хронического геморроя, миомы матки, проведя соответствующее обследование [21].
С течением времени происходит регулярный пересмотр лечебной тактики, основываясь на верификации новых факторов риска, динамики симптомов и прогрессировании стадии заболевания, а также с учетом появления новых современных возможностей терапии. При наблюдении за пациентами с ФП врач общей практики может сталкиваться с ситуациями, в которых необходимо принимать данные решения. В связи с этим на рис. 3 приведен ряд так называемых «красных флагов», способных помочь врачу своевременно реагировать на данные ситуации.

Также следует отметить, что, несмотря на то что ПОАК стали основой профилактики инсульта при неклапанной ФП, вытеснив антагонистов витамина К в качестве терапии 1-й линии как в российских, так и зарубежных рекомендациях [7, 21], до сих пор отсутствовало надежное прямое сравнение доступных агентов. Однако недавно опубликованное (2022 г.) многонациональное популяционное когортное исследование, включившее 527 226 человек с впервые диагностированной ФП, помогло ответить на этот вопрос [28]. Так, в стандартизированных электронных базах данных о здоровье, охватывающих 221 млн человек из Франции, Германии, Великобритании и США, были выявлены пациенты, у которых впервые была диагностирована ФП и которые получили новый рецепт на ПОАК. Апиксабан ассоциировался с более низким риском ЖКК, чем дабигатран, ривароксабан и эдоксабан (отношение рисков – ОР 0,81 [95% доверительный интервал – ДИ 0,70–0,94]; ОР 0,77 [95% ДИ 0,66–0,91] и ОР 0,72 [95% ДИ 0,66–0,79] соответственно) [28]. Также исследователи отметили, что применение апиксабана у пациентов с ФП было связано с аналогичными более низкими показателями риска развития ишемического инсульта или системной эмболии, внутричерепного кровоизлияния и смертности от всех причин по сравнению с дабигатраном, эдоксабаном и ривароксабаном [28]. Этот вывод был последовательным для пациентов в возрасте 80 лет и старше и пациентов с хроническим заболеванием почек (ХБП), которые часто недостаточно представлены в клинических испытаниях.
Таким образом, исходя из вышеописанных данных, у врача общей практики есть инструменты, позволяющие повысить приверженность пациентов с ФП к антикоагулянтной терапии, а именно в случаях отсутствия противопоказаний отдавать предпочтение ПОАК, и, основываясь на данных исследований по профилю эффективности и безопасности, рекомендовать тот ПОАК, который продемонстрировал больший уровень приверженности к терапии, – апиксабан.
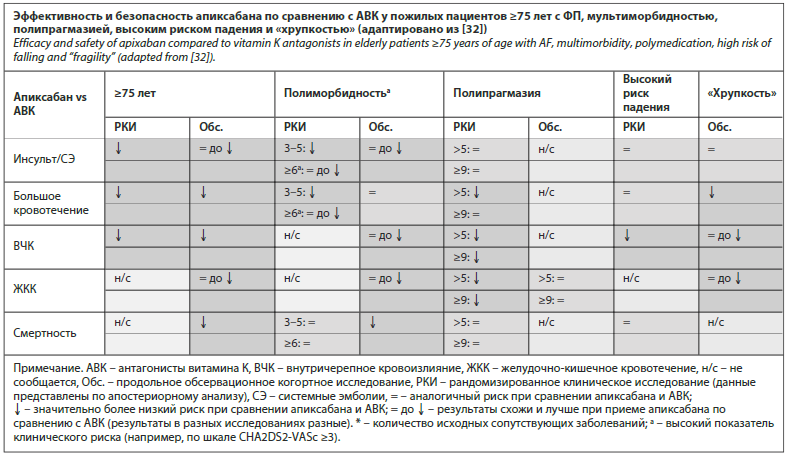
Применение апиксабана у пациентов пожилого возраста подлежало активному изучению. Так, при анализе подгрупп исследования ARISTOTLE (в общей сложности 18 201 пациент с ФП и повышенным риском инсульта, из них 30% были моложе 65 лет, 39% – от 65 до <75 лет и 31% – старше 75 лет; средний период наблюдения 1,8 года) было установлено, что применение апиксабана более эффективно по сравнению с варфарином в предотвращении инсульта и снижении смертности во всех возрастных группах, а также ассоциировано с меньшим количеством больших кровотечений и внутричерепных кровоизлияний независимо от возраста [31]. Кроме того, исследователи отметили, что из-за более высокого риска ТЭО и инсульта в пожилом возрасте абсолютная польза использования апиксабана была выше у пожилых людей [31].
По данным недавнего систематического обзора и метаанализа, целью которого явилась оценка дополнительных преимуществ ПОАК у гериатрических пациентов с ФП с высоким риском ТЭО и кровотечения, также было показано, что апиксабан неизменно ассоциировался с наиболее благоприятным соотношением пользы и риска во всех гериатрических подгруппах (пожилые пациенты в возрасте ≥75 лет с ФП, мультиморбидностью, полипрагмазией, высоким риском падения и «хрупкостью») и наиболее благоприятным профилем эффективности и безопасности среди всех ПОАК (дабигатран в дозе 150 и 110 мг, ривароксабан, эдоксабан), и поэтому ему следует отдавать предпочтение у гериатрических пациентов с ФП [3]. Адаптированные данные по эффективности и
безопасности апиксабана по сравнению с АВК представлены в таблице.
Пациенты с хронической болезнью почек (ХБП). ФП часто встречается у пациентов с ХБП, при этом оценки распространенности колеблются от 13% до почти 50%, в зависимости от стадии ХБП и метода выявления [33]. С другой стороны, ХБП распространена у больных с ФП и связана с повышенным риском инсульта/системной эмболии и кровотечения.
Доказательства безопасности и пользы антикоагулянтной терапии для профилактики инсульта у пациентов с ФП и ХБП не столь обширны, но вместе с тем для апиксабана такие данные представлены (кроме того, важно отметить, что апиксабан преимущественно метаболизируется в печени и имеет относительно низкую почечную экскрецию равную ≈25–35%) [34]. Например, в ранее озвученном исследовании ARISTOTLE показано, что у пациентов с ФП и расчетным клиренсом креатинина >25 мл/мин применение апиксабана ассоциировано со значительно меньшим риском развития кровотечений по сравнению с варфарином; также отмечено, что пациенты с ежегодным снижением скорости клубочковой фильтрации на 20% и более чувствовали себя значительно лучше на апиксабане, чем на варфарине [33, 35, 36].
Пациенты с желудочно-кишечным кровотечением (ЖКК). Исследование ARISTOTLE показало, что частота больших кровотечений при применении апиксабана в дозе 20 мг составляла 2,13% в год по сравнению с 3,09% в год в группе, получавшей варфарин (ОР 0,69; 95% ДИ 0,60–0,80) [37]. Соответствующие показатели смертности по любой причине составили 3,5% и 3,9% (ОР 0,89; 95% ДИ 0,80–0,99) [37]. Вероятность серьезных ЖКК, связанных с приемом апиксабана в дозе 20 мг, была аналогична таковой при применении варфарина, но риск увеличивался в пожилом возрасте [37].
У пациентов, принимавших апиксабан вместо варфарина, был меньший риск небольших кровотечений, включая ЖКК (ОР 0,69; 95% ДИ 0,63–0,75) [37].
Риск ЖКК при приеме ПОАК оценивался в нескольких систематических обзорах и метаанализах. Так, метаанализ рандомизированных исследований III фазы показал, что по сравнению с варфарином, ривароксабаном (ОР 1,46; 95% ДИ 1,2–1,8), высокими дозами эдоксабана (ОР 1,22; 95% ДИ 1,01–1,47) и дабигатраном (ОР 1,50; 95% ДИ 1,20–1,88), значительно увеличивающими риски ЖКК, у апиксабана такого эффекта обнаружено не было [38]. Основываясь на этих данных, исследователи сделали вывод, что применение ривароксабана и высоких доз дабигатрана и эдоксабана следует избегать у пациентов с высоким риском ЖКК [38].
Более поздний метаанализ включал в общей сложности 43 рандомизированных исследования с участием 166 289 пациентов [39]. В результате дабигатран (2,0% против 1,4% соответственно; отношение шансов (ОШ) 1,27; 95% ДИ 1 ,04–1,55) и ривароксабан (1,7% против 1,3% соответственно; ОШ 1,40; 95% ДИ 1,15–1,70) были связаны с повышенными шансами больших ЖКК по сравнению с обычной антикоагулянтной терапией, тогда как для апиксабана не было обнаружено различий (0,6% против 0,7% соответственно; ОШ 0,81; 95% ДИ 0,64–1,02) [39].
Таким образом, согласно накопленным данным, апиксабан является одним из наиболее безопасных антикоагулянтов в клинической практике, что позволяет рекомендовать его даже тем группам пациентов, которые имеют высокие риски геморрагических осложнений. Кроме того, согласно российским клиническим рекомендациям «Фибрилляция и трепетание предсердий» (2020 г.) [21], апиксабан не требует снижения дозы у пациентов с высоким риском ЖКК, в отличие от ривароксабана и дабигатрана, прием которых в полных дозах не рекомендован к использованию в данной клинической ситуации.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Полякова Ольга Александровна – канд. мед. наук, ассистент каф. терапии и полиморбидной патологии им. акад. М.С. Вовси, ФГБОУ ДПО РМАНПО. E-mail: docpolyakova.olga@gmail.com;
ORCID: 0000-0003-0491-8823; eLibrary SPIN: 5104-9117
Olga A. Polyakova – Cand. Sci. (Med.), Assistant, Russian Medical Academy of Continuous Professional Education.
E-mail: docpolyakova.olga@gmail.com; ORCID: 0000-0003-0491-8823; eLibrary SPIN: 5104-9117
Миронова Елена Владимировна – канд. мед. наук, зав. кардиологическим отд-нием, Центральная клиническая больница
«РЖД-Медицина». E-mail: e.v.mironova@mail.ru; ORCID: 0000-0002-2988-1767
Elena V. Mironova – Cand. Sci. (Med.), Central clinical hospital of the medicine of the Russian Railways. E-mail: e.v.mironova@mail.ru; ORCID: 0000-0002-2988-1767
Гришин Геннадий Петрович – канд. мед. наук, зав. кабинетом рентгенохирургических методов диагностики и лечения,
Центральная клиническая больница «РЖД-Медицина». E-mail: grishingp@mail.ru; ORCID: 0000000260634609
Gennady P. Grishin – Cand. Sci. (Med.), Central clinical hospital of the medicine of the Russian Railways. E-mail: grishingp@mail.ru;
ORCID: 0000000260634609
Остроумова Ольга Дмитриевна – д-р мед. наук, проф., зав. каф. терапии и полиморбидной патологии им. акад. М.С. Вовси, ФГБОУ ДПО РМАНПО. E-mail: ostroumova.olga@mail.ru; ORCID: 0000-0002-0795-8225; eLibrary SPIN: 3910-6585
Olga D. Ostroumova – Dr. Sci. (Med.), Full Prof., Russian Medical Academy of Continuous Professional Education.
E-mail: ostroumova.olga@mail.ru; ORCID: 0000-0002-0795-8225; eLibrary SPIN: 3910-6585
Поступила в редакцию: 26.06.2023
Поступила после рецензирования: 27.06.2023
Принята к публикации: 29.06.2023
Received: 26.06.2023
Revised: 27.06.2023
Accepted: 29.06.2023
Клинический разбор в общей медицине №5 2023
Пациент с фибрилляцией предсердий на приеме у врача общей практики
Номера страниц в выпуске:71-80
Аннотация
Фибрилляция предсердий (ФП) является одним из наиболее распространенных видов аритмий и представляет собой существенное бремя для здравоохранения и экономики во всем мире. Наряду со старением населения наблюдается быстрый рост распространенности
и заболеваемости ФП. Предполагается, что среди взрослых в возрасте старше 55 лет у каждого третьего в течение жизни будет диагностирована ФП. Однако в связи с тем, что часть пациентов не испытывают симптомы, ассоциированные с аритмией, к сожалению, слишком часто ФП остается невыявленной и нелеченной. Выявление бессимптомной и/или ранее неизвестной ФП является одной из ключевых задач амбулаторного звена, а учитывая, что профилактика сердечно-сосудистых заболеваний и сердечно-сосудистых осложнений считается важной частью работы врачей общей практики, в данной статье будут рассматриваться патофизиологические механизмы ФП, факторы риска и диагностические критерии ФП, а также обсуждаться алгоритмы тактики ведения пациента с ФП, которые могут быть полезны для рутинной клинической деятельности врача общей практики.
Ключевые слова: фибрилляция предсердий, антикоагулянты, приверженность к терапии, апиксабан.
Для цитирования: Полякова О.А., Миронова Е.В., Гришин Г.П., Остроумова О.Д. Пациент с фибрилляцией предсердий на приеме
у врача общей практики. Клинический разбор в общей медицине. 2023; 4 (5): 71–80. DOI: 10.47407/kr2023.4.5.00237
Фибрилляция предсердий (ФП) является одним из наиболее распространенных видов аритмий и представляет собой существенное бремя для здравоохранения и экономики во всем мире. Наряду со старением населения наблюдается быстрый рост распространенности
и заболеваемости ФП. Предполагается, что среди взрослых в возрасте старше 55 лет у каждого третьего в течение жизни будет диагностирована ФП. Однако в связи с тем, что часть пациентов не испытывают симптомы, ассоциированные с аритмией, к сожалению, слишком часто ФП остается невыявленной и нелеченной. Выявление бессимптомной и/или ранее неизвестной ФП является одной из ключевых задач амбулаторного звена, а учитывая, что профилактика сердечно-сосудистых заболеваний и сердечно-сосудистых осложнений считается важной частью работы врачей общей практики, в данной статье будут рассматриваться патофизиологические механизмы ФП, факторы риска и диагностические критерии ФП, а также обсуждаться алгоритмы тактики ведения пациента с ФП, которые могут быть полезны для рутинной клинической деятельности врача общей практики.
Ключевые слова: фибрилляция предсердий, антикоагулянты, приверженность к терапии, апиксабан.
Для цитирования: Полякова О.А., Миронова Е.В., Гришин Г.П., Остроумова О.Д. Пациент с фибрилляцией предсердий на приеме
у врача общей практики. Клинический разбор в общей медицине. 2023; 4 (5): 71–80. DOI: 10.47407/kr2023.4.5.00237
Review A patient with atrial fibrillation at a general practitioner's appointment
Olga A. Polyakova1, Elena V. Mironova2, Gennady P. Grishin2, Olga D. Ostroumova11 Russian Medical Academy of Continuous Professional Education, Moscow, Russia;
2 Central clinical hospital of the medicine of the Russian Railways, Russia
docpolyakova.olga@gmail.com
Abstract
Atrial fibrillation (AF) is one of the most common types of arrhythmias and represents a significant health and economic burden worldwide. Along with the aging of the population, there has been a rapid increase in the prevalence and incidence of AF. Among adults over the age of 55, one in three is expected to be diagnosed with AF during their lifetime. However, due to the fact that some patients do not experience symptoms associated with arrhythmia, unfortunately, all too often AF remains undiagnosed and untreated. Detection of asymptomatic and/or previously unknown AF is one of the key tasks of outpatient care, and considering that prevention of cardiovascular disease and cardiovascular complications is considered an important part of the work of general practitioners, this article will review pathophysiological mechanisms of AF, risk factors and diagnostic criteria of AF, and discuss algorithms of management tactics for patients with AF, which may be useful for routine clinical activities of the general practitioner.
Key words: atrial fibrillation, anticoagulants, adherence to therapy, apixaban.
For citation: Polyakova O.A., Mironova E.V., Grishin G.P., Ostroumova O.D. A patient with atrial fibrillation at a general practitioner's appointment. Clinical review for general practice. 2023; 4 (5): 71–80 (In Russ.). DOI: 10.47407/kr2023.4.5.00237
Введение
Фибрилляция предсердий (ФП) является одним из наиболее распространенных видов аритмий и представляет собой существенное бремя для здравоохранения и экономики во всем мире [1]. Наряду со старением населения наблюдается быстрый рост распространенности и заболеваемости ФП [2]. Предполагается, что среди взрослых в возрасте старше 55 лет у каждого третьего в течение жизни будет диагностирована ФП [3].Некоторые пациенты с ФП испытывают признаки нарушения ритма и симптомы, такие как сердцебиение, одышка и головокружение. Вместе с тем 1/3 всех пациентов с ФП бессимптомна, что в значительной степени затрудняет диагностику данной тахиаритмии [4]. Пациенты с ФП, как симптомной, так и бессимптомной, имеют повышенный риск развития инсульта, сердечной недостаточности и других сердечно-сосудистых осложнений (ССО) [5]. При этом имеются убедительные доказательства того, что своевременная терапия пероральными антикоагулянтами может снизить риск инсульта у больных с ФП более чем на 60% [6]. Однако, к сожалению, слишком часто ФП остается невыявленной и нелеченной. Так, имеются сведения, что ранее неизвестная ФП обнаруживается почти у 1/4 пациентов, перенесших инсульт [7]. Кроме того, следует отметить, что у больных ФП существует высокий риск смертности в течение первого (20%) и пятого (50%) года уже после постановки диагноза ФП [8], в связи с этим крайне важно своевременно выявлять группу больных высокого риска развития ФП и ассоциированных с ней ССО, в которой профилактические и лечебные вмешательства будут эффективны и принесут больше пользы.
Выявление бессимптомной («немой») и/или ранее неизвестной ФП является одной из ключевых задач амбулаторного звена, а учитывая, что профилактика сердечно-сосудистых заболеваний (ССЗ) и ССО считается важной частью работы врачей общей практики, в данной статье будут рассматриваться патофизиологические механизмы ФП, факторы риска и диагностические критерии ФП, а также обсуждаться алгоритмы тактики ведения пациента с ФП, которые могут быть полезны для рутинной клинической деятельности врача общей практики.
Патофизиологические механизмы ФП
К ФП приводят различные патофизиологические механизмы, включающие гемодинамические, электрофизиологические, структурные и вегетативные (модулирующие) изменения, а также воздействие триггерных факторов, представленных экстрасистолами и предсердной тахикардией [9, 10]. Факторы, запускающие развитие ФП, широко варьируют от генетических полиморфизмов до макроскопических изменений в структуре предсердий, влияющих на электрическую активность клеток и приводящих к дезорганизованной электрической активности предсердий.Электрические свойства миокарда контролируются ионными каналами, присутствующими на клеточной мембране. Активация клеток в основном зависит от натриевых, кальциевых и калиевых каналов [10]. Рефрактерный период клеток примерно зависит от времени между активацией клетки и возвращением потенциала действия к исходному уровню. Увеличение притока ионов кальция и натрия удлиняет рефрактерный период, в то время как увеличение оттока калия приводит к укорочению этого периода [9, 10].
Другим важным компонентом нормальной электрофизиологии сердца являются коннексины: это белки, присутствующие в соединениях между кардиомиоцитами, которые отвечают за ионную проницаемость между клетками, обеспечивая нормальное распространение электрического импульса [9].
При ФП происходят изменения в этих компонентах нормальной клеточной электрофизиологии, которые называются электрическим ремоделированием. Наиболее распространенная форма электрического ремоделирования возникает в результате острого поступления кальция в клетки, которые деполяризуются с повышенной частотой. Это приводит к инактивации кальциевых токов и усилению калиевых токов, что способствует сокращению продолжительности потенциала действия и повышению «уязвимости» к развитию ФП, а также раннему рецидиву после кардиоверсии и прогрессированию пароксизмальных форм в более персистирующие формы аритмии [9, 10].
Генетические факторы могут быть связаны с дефектами вышеописанных ионных каналов и, таким образом, с предрасположенностью к ФП. Семейные формы аритмии, хотя и редкие, и гетерогенные, хорошо описаны в литературе [11]. В настоящее время роль генетики в ФП изучается и представляет собой многообещающий путь во все более современном поиске методов персонализированного лечения.
Вегетативная активность также играет важную роль в возникновении и поддержании ФП. Активация блуждающего нерва может изменить активируемые ацетилхолином калиевые токи с последующим уменьшением продолжительности потенциала действия, стабилизируя тем самым путь повторного входа электрического импульса [12]. Кроме того, адренергическая активация способна вызвать накопление внутриклеточного кальция и последующее развитие аритмии [12].
Изменения в структуре миокарда предсердий, особенно фиброз, разделяют мышечные волокна и нарушают непрерывность проведения электрического импульса, снижая скорость проведения, что является основополагающим фактором для повторного входа. Фиброз приводит к прогрессированию ФП и потенциально является терапевтической мишенью и предиктором ответа на лечение [13].
Хотя электрофизиологические факторы, такие как электрическое ремоделирование, и морфологические факторы, такие как фиброз и дилатация предсердий (структурное ремоделирование), считаются основными факторами, участвующими в патофизиологии ФП, появляется все больше данных о том, что инфекционные или воспалительные процессы могут объединять эти две ситуации. Так, в исследовании «случай–контроль» с участием 56 870 участников оценивалась связь между инфекцией вирусом гриппа, вакцинацией и риском развития ФП [14]. Авторы показали, что инфекция повышает риск развития аритмии, а вакцинация оказывает защитное действие в разных группах больных [14]. В другом исследовании наличие воспалительного инфильтрата, клеточного некроза и интерстициального фиброза было выше у пациентов с ФП без структурного заболевания сердца по сравнению с пациентами без аритмии и ССЗ [15]. Также было продемонстрировано, что у пациентов с ФП наблюдается более высокая концентрация маркеров воспаления, таких как интерлейкин-6 и высокочувствительный С-реактивный белок, нежели у пациентов без ФП [16].
Таким образом, исходя из понимания патофизиологических механизмов развития ФП, врачу общей практики при опросе больного, сборе анамнеза и клиническом осмотре следует выяснить/оценить у пациента:
• наличие/отсутствие случаев ФП и других аритмий у ближайших родственников;
• наличие/отсутствие сопутствующих ССЗ, включая артериальную гипертензию и структурные изменения сердца (врожденные/приобретенные аномалии, инфаркт миокарда в анамнезе и др.);
• наличие/отсутствие тревоги, нарушений сна и других проявлений хронического психосоциального стресса в рамках диагностики дисфункции вегетативной нервной системы (в амбулаторных условиях с большей вероятностью выявить тревогу и/или депрессию у пациента общесоматического профиля позволяет использование опросников и шкал, например госпитальной шкалы тревоги и депрессии – Hospital Anxiety and Depression Scale, HADS) [17];
с целью диагностики нарушений сна помимо проведения опроса можно попросить пациента вести в течение 1–2 нед дневник сна1);
• наличие/отсутствие острого и хронического воспалительного процесса, недавно перенесенной инфекции.
Факторы риска фибрилляции предсердий
Исследования показали, что пожилой возраст, мужской пол и европеоидная раса являются важными факторами риска развития ФП [19]. Среди модифицируемых факторов риска, предрасполагающих к ФП, и где каждый из которых, как было показано, вызывает структурное и электрическое ремоделирование предсердий, выделяют:• малоподвижный образ жизни;
• курение;
• избыточную массу тела и ожирение;
• артериальную гипертензию;
• сахарный диабет;
• синдром обструктивного апноэ сна [19].
Также следует отметить, что, согласно данным глобального исследования бремени болезней (2019 г.) [20], оценивающего бремя ФП и связанных с ним факторов риска с 1990 по 2019 гг., стандартизированная по возрасту смертность от ФП в мире в 2019 г. была в первую очередь связана с высоким систолическим артериальным давлением (АД; 34,0%), а далее – с высоким индексом массы тела (20,2%), употреблением алкоголя (7,4%), курением (4,3%) и диетой с высоким содержанием натрия (4,2%).
В российских клинических рекомендациях «Фибрилляция и трепетание предсердий» (2020 г.) [21], помимо вышеописанных факторов, еще выделяют ряд ассоци-
ированных клинических состояний, связанных с повышенным риском развития нарушений ритма, таких как структурные заболевания сердца (приобретенные или врожденные структурные патологии миокарда, перикарда, клапанного аппарата и/или магистральных сосудов), ишемическая болезнь сердца, клинически выраженная сердечная недостаточность, нарушение функции щитовидной железы (гипотиреоз и гипертиреоз, а также, вероятно, субклиническая дисфункция щитовидной железы).
Таким образом, врачу общей практики при опросе больного, сборе анамнеза и клиническом осмотре следует выяснить/оценить у пациента:
• наличие/отсутствие курения (расчет индекса курильщика, при курении сигарет оценка степени никотиновой зависимости по тесту Фагерстрема и др.), уровень употребления алкоголя;
• уровень физической активности, особенности питания (в частности, наличие диеты с высоким содержанием соли);
• индекс массы тела, измерить окружность талии и бедер;
• уровень АД в соответствии с правилами2, отраженными в российских клинических рекомендациях – «Артериальная гипертензия у взрослых» (2020 г.) [21], оценить частоту сердечных сокращений (на лучевой и сонной артерии одномоментно, на лучевой артерии на правой и левой руке одномоментно, и при необходимости рассчитать дефицит пульса);
• наличие/отсутствие ССЗ (в частности, ишемической болезни сердца, сердечной недостаточности), сахарного диабета, синдрома обструктивного апноэ сна, патологии щитовидной железы.
Диагностика фибрилляции предсердий
Диагностику ФП, как и любого другого заболевания, следует начинать со сбора жалоб пациента. Однако жалобы при ФП не обладают специфичностью и могут встречаться при других нарушениях ритма и ССЗ. Вместе с тем чаще всего больные с ФП предъявляют жалобы на общую слабость, ощущение сердцебиения, тяжести в груди, одышку, наличие нарушений сна, тревоги и других психосоциальных расстройств [21]. Также необходимо помнить, что у части пациентов, как упоминалось выше, и вовсе отсутствует какая-либо симптоматика, и поэтому нередко у таких больных диагноз ФП выставляется уже после эпизода инсульта или транзиторной ишемической атаки [21].Далее, определив жалобы пациента, при наличии симптоматики необходимо установить наличие аритмии, а именно зарегистрировать при проведении электрокардиографии (ЭКГ) эпизод аритмии длительностью не менее 30 с и с характерными для ФП ЭКГ-признаками. Характерные ЭКГ-признаки ФП представлены на рис. 1.

Вместе с тем, если на ЭКГ эпизод аритмии зафиксирован не был, но пациент продолжает предъявлять жалобы на неритмичное сердцебиение, необходимо выполнить суточное мониторирование ЭКГ.
В случае отсутствия симптомов, ФП можно выявить при рутинном обследовании, если отметить наличие нерегулярного пульса, например во время измерения АД. При этом следует отметить, что в настоящее время для повышения эффективности выявления ФП были разработаны новые методы, такие как электронные тонометры с функцией обнаружения ФП, портативные устройства ЭКГ, которые могут записывать полосу ритма, и носимые устройства. Эти методы потенциально могут облегчить врачам общей практики выявление бессимптомной ФП.
Согласно российским и европейским рекомендациям по ФП, всем пациентам старше 65 лет рекомендовано проводить скрининг на наличие ФП путем применения пальпаторного исследования пульса или аускультации сердца либо использования кратковременной записи ЭКГ [7, 21].
При выявлении ФП на ЭКГ необходимо выяснить длительность данной аритмии и определить ее тип в соответствии с классификацией (рис. 2).

Обследование по сопутствующим состояниям и заболеваниям, которые влияют на принятие решения по ведению пациента с фибрилляцией предсердий
После выявления впервые зарегистрированной ФП рекомендовано направить пациента к кардиологу или специалисту по лечению ФП для дальнейшего дообследования, оценки рисков и выбора наиболее оправданной тактики.
Всем пациентам с ФП показана комплексная оценка состояния сердечно-сосудистой системы, включая сбор жалоб, анализ анамнестических данных и сопутствующей патологии, физикальный осмотр, оценку риска кровотечений (шкала HAS-BLED) и тромбоэмболических осложнений (ТЭО; шкала CHA2DS2-VASc), функции печени и почек, выявление нарушений электролитного баланса и эндокринологического статуса (оценка функции щитовидной железы, наличия/отсутствия сахарного диабета), оценку ЭКГ в 12 отведениях и данных эхокардиографического исследования. Также при необходимости показано проведение суточного мониторирования ЭКГ и чреспищеводного эхокардиографического исследования, анализ когнитивного статуса, уровня воспалительных маркеров (высокочувствительный С-реактивный белок), кардиоспецифичных ферментов и натрийуретических пептидов. Кроме того, пациенты должны быть обследованы на наличие вероятного лекарственно-индуцированного генеза развития аритмии3.
С целью выбора оптимальной тактики ведения больного с ФП, включая оценку наличия/отсутствия у пациента потенциальных источников кровотечения перед назначением антитромботической терапии, следует провести следующие диагностические мероприятия [21].
Лабораторное обследование:
• клинический анализ крови – исключение анемии и тромбоцитопении (важно оценить их наличие/отсутствие перед назначением антитромботической терапии, поскольку это связано с риском развития кровотечений), выявление воспалительного процесса;
• биохимический анализ крови – оценка состояния функции печени (печеночные ферменты, общий билирубин, общий белок) и почек (креатинин, мочевина, электролиты; расчет скорости клубочковой фильтрации и клиренса креатинина для выявления хронической болезни почек и ее стадии – необходимо для выбора дозы антикоагулянтов), липидного и углеводного обменов (общий холестерин, липопротеины низкой и высокой плотности, триглицериды, глюкоза, гликированный гемоглобин);
• общий анализ мочи – исключение альбуминурии и эритроцитурии;
• коагулограмма, в частности определение международного нормализованного отношения – исключения нарушения синтеза факторов свертывания в печени, оценка риска кровотечения/тромбоза;
• уровень тиреотропного гормона сыворотки крови – исключение гипо- и гипертиреоза, как этиологического фактора развития ФП.
Инструментальное обследование:
• эзофагогастродуоденоскопия – исключение потенциального источника кровотечения в виде острых эрозий и язв или обострения хронического эрозивно-язвенного поражения желудочно-кишечного тракта (рекомендовано проводить всем пациентам с анамнезом желудочно-кишечного кровотечения – ЖКК, эрозивно-язвенного поражения желудочно-кишечного тракта);
• колоноскопия – исключение потенциального источника кровотечения (рекомендовано проводить тем больным, у которых выявлена анемия, но явные источники кровотечения отсутствуют);
• ультразвуковое исследование брюшной полости (оценка состояния печени) и забрюшинного пространства (оценка состояния мочеполовой системы – исключение мочекаменной болезни, опухолей, воспалительных заболеваний мочеполовой системы как потенциальных источников кровотечения; в особенности, ультразвуковое исследование почек и мочевыводящих путей рекомендовано больным с эритроцитурией);
• компьютерная томография и/или магнитно-резонансная томография головного мозга и интракраниальных артерий – исключения геморрагического характера инсульта и сосудистых мальформаций у пациентов недавно перенесших инсульт (в предыдущие 8 нед) или с выраженным остаточным неврологическим дефицитом при отсутствии данных нейровизуализации.
Консультации:
• консультация гинеколога – исключения дисфункциональных кровотечений и опухолей как причины кровотечений у женщин с анамнезом аномальных маточных геморрагий;
• консультация офтальмолога – следует назначить пациентам с рефрактерной артериальной гипертензией и сахарным диабетом.
Также следует отметить, что у пациентов с ФП перед стартом антитромботической терапии необходимо исключить наличие аневризмы аорты и ее ветвей, онкологии, хронического геморроя, миомы матки, проведя соответствующее обследование [21].
Лечение фибрилляции предсердий
Лечение ФП направлено на улучшение прогноза пациентов преимущественно за счет профилактики ТЭО с помощью антикоагулянтной терапии и коррекции сопутствующих ССЗ и, кроме того, на уменьшение симптоматики посредством контроля ритма и частоты сердечных сокращений. При этом важно отметить, что процесс лечения является пациент-ориентированным, т.е. клиническая тактика и выбор терапии всегда обсуждается лечащим врачом и пациентом с разъяснением возможных особенностей, рисков и преимуществ того или иного метода [24].С течением времени происходит регулярный пересмотр лечебной тактики, основываясь на верификации новых факторов риска, динамики симптомов и прогрессировании стадии заболевания, а также с учетом появления новых современных возможностей терапии. При наблюдении за пациентами с ФП врач общей практики может сталкиваться с ситуациями, в которых необходимо принимать данные решения. В связи с этим на рис. 3 приведен ряд так называемых «красных флагов», способных помочь врачу своевременно реагировать на данные ситуации.

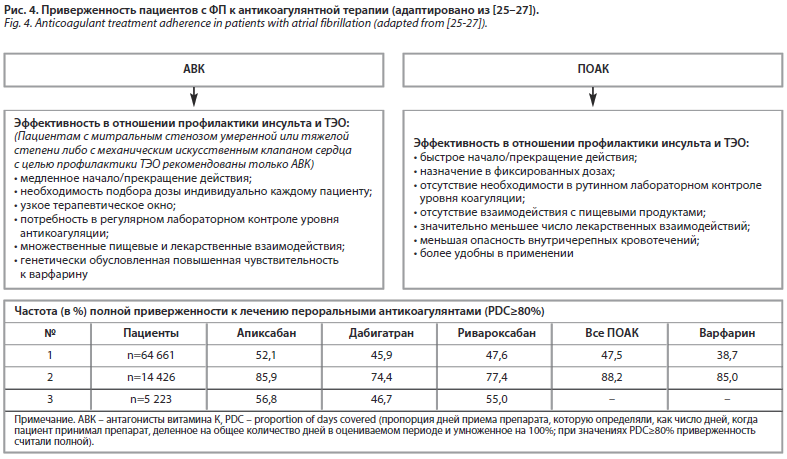
Приверженность к антикоагулянтной терапии
Большинству пациентов с ФП следует длительное время принимать пероральные антикоагулянты для снижения риска ишемического инсульта и других ТЭО (при этом польза для большинства пациентов от антикоагулянтной терапии перевешивает связанное с ней увеличение риска кровотечений). В течение нескольких десятилетий с этой целью использовали антагонисты витамина K (АВK), самым известным и наиболее хорошо изученным представителем которых является варфарин. Но, при несомненной эффективности в отношении профилактики инсульта и ТЭО, АВK имеют некоторые особенности, затрудняющие их широкое применение в повседневной клинической практике, которые нередко оказывают значимое влияние на приверженность пациентов к лечению (рис. 4). Напротив, появившиеся в последние годы прямые оральные антикоагулянты (ПОАК) выгодно отличаются от АВK по ряду характеристик и более удобны в практическом аспекте. Сравнение приверженности к терапии различными ПОАК было выполнено в исследованиях реальной клинической практики, результаты некоторых из них представлены на рис. 4.

Также следует отметить, что, несмотря на то что ПОАК стали основой профилактики инсульта при неклапанной ФП, вытеснив антагонистов витамина К в качестве терапии 1-й линии как в российских, так и зарубежных рекомендациях [7, 21], до сих пор отсутствовало надежное прямое сравнение доступных агентов. Однако недавно опубликованное (2022 г.) многонациональное популяционное когортное исследование, включившее 527 226 человек с впервые диагностированной ФП, помогло ответить на этот вопрос [28]. Так, в стандартизированных электронных базах данных о здоровье, охватывающих 221 млн человек из Франции, Германии, Великобритании и США, были выявлены пациенты, у которых впервые была диагностирована ФП и которые получили новый рецепт на ПОАК. Апиксабан ассоциировался с более низким риском ЖКК, чем дабигатран, ривароксабан и эдоксабан (отношение рисков – ОР 0,81 [95% доверительный интервал – ДИ 0,70–0,94]; ОР 0,77 [95% ДИ 0,66–0,91] и ОР 0,72 [95% ДИ 0,66–0,79] соответственно) [28]. Также исследователи отметили, что применение апиксабана у пациентов с ФП было связано с аналогичными более низкими показателями риска развития ишемического инсульта или системной эмболии, внутричерепного кровоизлияния и смертности от всех причин по сравнению с дабигатраном, эдоксабаном и ривароксабаном [28]. Этот вывод был последовательным для пациентов в возрасте 80 лет и старше и пациентов с хроническим заболеванием почек (ХБП), которые часто недостаточно представлены в клинических испытаниях.
Таким образом, исходя из вышеописанных данных, у врача общей практики есть инструменты, позволяющие повысить приверженность пациентов с ФП к антикоагулянтной терапии, а именно в случаях отсутствия противопоказаний отдавать предпочтение ПОАК, и, основываясь на данных исследований по профилю эффективности и безопасности, рекомендовать тот ПОАК, который продемонстрировал больший уровень приверженности к терапии, – апиксабан.
Применение апиксабана в особых группах пациентов
Пациенты старше 65 лет. Отдельную и существенную проблему в клинической деятельности врача общей практики составляет ведение пациентов пожилого возраста, число которых в соответствии с увеличением ожидаемой продолжительности жизни ежегодно растет. Пожилые пациенты отличаются более высоким уровнем полиморбидности (нередко сопряженным с полипрагмазией), распространенности астении, деменции и других неврологических и гериатрических синдромов. Кроме того, в данном случае возраст выступает в качестве значимого фактора риска развития как ТЭО, так и кровотечений [29, 30]. В связи с этим организация антикоагулянтной терапии у пожилого больного с ФП является сложной задачей, а выбор конкретного антикоагулянта – наиболее принципиальным для данной возрастной категории.Применение апиксабана у пациентов пожилого возраста подлежало активному изучению. Так, при анализе подгрупп исследования ARISTOTLE (в общей сложности 18 201 пациент с ФП и повышенным риском инсульта, из них 30% были моложе 65 лет, 39% – от 65 до <75 лет и 31% – старше 75 лет; средний период наблюдения 1,8 года) было установлено, что применение апиксабана более эффективно по сравнению с варфарином в предотвращении инсульта и снижении смертности во всех возрастных группах, а также ассоциировано с меньшим количеством больших кровотечений и внутричерепных кровоизлияний независимо от возраста [31]. Кроме того, исследователи отметили, что из-за более высокого риска ТЭО и инсульта в пожилом возрасте абсолютная польза использования апиксабана была выше у пожилых людей [31].
По данным недавнего систематического обзора и метаанализа, целью которого явилась оценка дополнительных преимуществ ПОАК у гериатрических пациентов с ФП с высоким риском ТЭО и кровотечения, также было показано, что апиксабан неизменно ассоциировался с наиболее благоприятным соотношением пользы и риска во всех гериатрических подгруппах (пожилые пациенты в возрасте ≥75 лет с ФП, мультиморбидностью, полипрагмазией, высоким риском падения и «хрупкостью») и наиболее благоприятным профилем эффективности и безопасности среди всех ПОАК (дабигатран в дозе 150 и 110 мг, ривароксабан, эдоксабан), и поэтому ему следует отдавать предпочтение у гериатрических пациентов с ФП [3]. Адаптированные данные по эффективности и
безопасности апиксабана по сравнению с АВК представлены в таблице.
Пациенты с хронической болезнью почек (ХБП). ФП часто встречается у пациентов с ХБП, при этом оценки распространенности колеблются от 13% до почти 50%, в зависимости от стадии ХБП и метода выявления [33]. С другой стороны, ХБП распространена у больных с ФП и связана с повышенным риском инсульта/системной эмболии и кровотечения.
Доказательства безопасности и пользы антикоагулянтной терапии для профилактики инсульта у пациентов с ФП и ХБП не столь обширны, но вместе с тем для апиксабана такие данные представлены (кроме того, важно отметить, что апиксабан преимущественно метаболизируется в печени и имеет относительно низкую почечную экскрецию равную ≈25–35%) [34]. Например, в ранее озвученном исследовании ARISTOTLE показано, что у пациентов с ФП и расчетным клиренсом креатинина >25 мл/мин применение апиксабана ассоциировано со значительно меньшим риском развития кровотечений по сравнению с варфарином; также отмечено, что пациенты с ежегодным снижением скорости клубочковой фильтрации на 20% и более чувствовали себя значительно лучше на апиксабане, чем на варфарине [33, 35, 36].
Пациенты с желудочно-кишечным кровотечением (ЖКК). Исследование ARISTOTLE показало, что частота больших кровотечений при применении апиксабана в дозе 20 мг составляла 2,13% в год по сравнению с 3,09% в год в группе, получавшей варфарин (ОР 0,69; 95% ДИ 0,60–0,80) [37]. Соответствующие показатели смертности по любой причине составили 3,5% и 3,9% (ОР 0,89; 95% ДИ 0,80–0,99) [37]. Вероятность серьезных ЖКК, связанных с приемом апиксабана в дозе 20 мг, была аналогична таковой при применении варфарина, но риск увеличивался в пожилом возрасте [37].
У пациентов, принимавших апиксабан вместо варфарина, был меньший риск небольших кровотечений, включая ЖКК (ОР 0,69; 95% ДИ 0,63–0,75) [37].
Риск ЖКК при приеме ПОАК оценивался в нескольких систематических обзорах и метаанализах. Так, метаанализ рандомизированных исследований III фазы показал, что по сравнению с варфарином, ривароксабаном (ОР 1,46; 95% ДИ 1,2–1,8), высокими дозами эдоксабана (ОР 1,22; 95% ДИ 1,01–1,47) и дабигатраном (ОР 1,50; 95% ДИ 1,20–1,88), значительно увеличивающими риски ЖКК, у апиксабана такого эффекта обнаружено не было [38]. Основываясь на этих данных, исследователи сделали вывод, что применение ривароксабана и высоких доз дабигатрана и эдоксабана следует избегать у пациентов с высоким риском ЖКК [38].
Более поздний метаанализ включал в общей сложности 43 рандомизированных исследования с участием 166 289 пациентов [39]. В результате дабигатран (2,0% против 1,4% соответственно; отношение шансов (ОШ) 1,27; 95% ДИ 1 ,04–1,55) и ривароксабан (1,7% против 1,3% соответственно; ОШ 1,40; 95% ДИ 1,15–1,70) были связаны с повышенными шансами больших ЖКК по сравнению с обычной антикоагулянтной терапией, тогда как для апиксабана не было обнаружено различий (0,6% против 0,7% соответственно; ОШ 0,81; 95% ДИ 0,64–1,02) [39].
Таким образом, согласно накопленным данным, апиксабан является одним из наиболее безопасных антикоагулянтов в клинической практике, что позволяет рекомендовать его даже тем группам пациентов, которые имеют высокие риски геморрагических осложнений. Кроме того, согласно российским клиническим рекомендациям «Фибрилляция и трепетание предсердий» (2020 г.) [21], апиксабан не требует снижения дозы у пациентов с высоким риском ЖКК, в отличие от ривароксабана и дабигатрана, прием которых в полных дозах не рекомендован к использованию в данной клинической ситуации.
Заключение
Ведение пациентов с ФП в практике врача амбулаторного звена представляет собой сложную и многогранную проблему, требующую широкого спектра знаний и профессиональных компетенций. Учитывая, что большая часть таких больных имеет полиморбидную патологию, высокий риск развития ТЭО и ишемического инсульта, крайне важным аспектом является не только своевременная диагностика данной тахиаритмии, но и верно подобранное лечение, обеспечивающее высокий уровень приверженности к терапии. В этом контексте особое внимание заслуживает тактика выбора антикоагулянтной терапии и конкретного лекарственного препарата. В настоящее время, благодаря накопленным данным по применению ПОАК, можно сделать вывод, что прием апиксабана наряду с высоким уровнем эффективности и безопасности ассоциирован с одним из самых высоких уровней приверженности к терапии, что позволяет рекомендовать данный препарат в качестве препарата выбора при лечении больных с ФП.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Полякова Ольга Александровна – канд. мед. наук, ассистент каф. терапии и полиморбидной патологии им. акад. М.С. Вовси, ФГБОУ ДПО РМАНПО. E-mail: docpolyakova.olga@gmail.com;
ORCID: 0000-0003-0491-8823; eLibrary SPIN: 5104-9117
Olga A. Polyakova – Cand. Sci. (Med.), Assistant, Russian Medical Academy of Continuous Professional Education.
E-mail: docpolyakova.olga@gmail.com; ORCID: 0000-0003-0491-8823; eLibrary SPIN: 5104-9117
Миронова Елена Владимировна – канд. мед. наук, зав. кардиологическим отд-нием, Центральная клиническая больница
«РЖД-Медицина». E-mail: e.v.mironova@mail.ru; ORCID: 0000-0002-2988-1767
Elena V. Mironova – Cand. Sci. (Med.), Central clinical hospital of the medicine of the Russian Railways. E-mail: e.v.mironova@mail.ru; ORCID: 0000-0002-2988-1767
Гришин Геннадий Петрович – канд. мед. наук, зав. кабинетом рентгенохирургических методов диагностики и лечения,
Центральная клиническая больница «РЖД-Медицина». E-mail: grishingp@mail.ru; ORCID: 0000000260634609
Gennady P. Grishin – Cand. Sci. (Med.), Central clinical hospital of the medicine of the Russian Railways. E-mail: grishingp@mail.ru;
ORCID: 0000000260634609
Остроумова Ольга Дмитриевна – д-р мед. наук, проф., зав. каф. терапии и полиморбидной патологии им. акад. М.С. Вовси, ФГБОУ ДПО РМАНПО. E-mail: ostroumova.olga@mail.ru; ORCID: 0000-0002-0795-8225; eLibrary SPIN: 3910-6585
Olga D. Ostroumova – Dr. Sci. (Med.), Full Prof., Russian Medical Academy of Continuous Professional Education.
E-mail: ostroumova.olga@mail.ru; ORCID: 0000-0002-0795-8225; eLibrary SPIN: 3910-6585
Поступила в редакцию: 26.06.2023
Поступила после рецензирования: 27.06.2023
Принята к публикации: 29.06.2023
Received: 26.06.2023
Revised: 27.06.2023
Accepted: 29.06.2023
Список исп. литературыСкрыть список1. Kornej J, Börschel CS, Benjamin EJ, Schnabel RB. Epidemiology of Atrial Fibrillation in the 21st Century: Novel Methods and New Insights. Circ Res 2020; 127 (1): 4–20. DOI: 10.1161/CIRCRESAHA.120.316340
2. Di Carlo A, Bellino L, Consoli D et al. Prevalence of atrial fibrillation in the Italian elderly population and projections from 2020 to 2060 for Italy and the European Union: the FAI Project. Europace 2019; 21 (10): 1468–1475. DOI:10.1093/europace/euz141
3. Staerk L, Wang B, Preis SR et al. Lifetime risk of atrial fibrillation according to optimal, borderline, or elevated levels of risk factors: cohort study based on longitudinal data from the Framingham Heart Study. BMJ 2018; 361:k1453. DOI:10.1136/bmj.k1453
4. Svennberg E, Engdahl J, Al-Khalili F et al. Mass Screening for Untreated Atrial Fibrillation: The STROKESTOP Study. Circulation 2015; 131 (25): 2176–2184. DOI: 10.1161/CIRCULATIONAHA.114. 014343
5. Vanassche T, Lauw MN, Eikelboom JW et al. Risk of ischaemic stroke according to pattern of atrial fibrillation: analysis of 6563 aspirin-treated patients in ACTIVE-A and AVERROES. Eur Heart J 2015; 36 (5): 281–7a. DOI:10.1093/eurheartj/ehu307
6. Hindricks G, Potpara T, Dagres N et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2021; 42 (5): 373–498. DOI:10.1093/eurheartj/ehaa612
7. Sposato LA, Cipriano LE, Saposnik G et al. Diagnosis of atrial fibrillation after stroke and transient ischaemic attack: a systematic review and meta-analysis. Lancet Neurol 2015; 14 (4): 377–387. DOI:10.1016/S1474-4422(15)70027-X
8. Piccini JP, Hammill BG, Sinner MF et al. Clinical course of atrial fibrillation in older adults: the importance of cardiovascular events beyond stroke. Eur Heart J 2014; 35 (4): 250–6. DOI:10.1093/eurheartj/eht483
9. Cintra FD, Figueiredo MJO. Atrial Fibrillation (Part 1): Pathophysiology, Risk Factors, and Therapeutic Basis. Arq Bras Cardiol 2021; 116 (1): 129–39. DOI:10.36660/abc.20200485
10. Schotten U, Verheule S, Kirchhof P, Goette A. Pathophysiological mechanisms of atrial fibrillation: a translational appraisal. Physiol Rev 2011; 91 (1): 265–325. DOI: 10.1152/physrev.00031.2009
11. Christophersen IE, Rienstra M, Roselli C et al. Large-scale analyses of common and rare variants identify 12 new loci associated with atrial fibrillation. Nat Genet 2017; 49 (6): 946–52. DOI:10.1038/ng.3843
12. Chou CC, Chen PS. New concepts in atrial fibrillation: neural mechanisms and calcium dynamics. Cardiol Clin 2009; 27 (1): 35-viii. DOI:10.1016/j.ccl.2008.09.003
13. Akoum N, Daccarett M, McGann C et al. Atrial fibrosis helps select the appropriate patient and strategy in catheter ablation of atrial fibrillation: a DE-MRI guided approach. J Cardiovasc Electrophysiol 2011; 22 (1): 16-22. DOI:10.1111/j.1540-8167.2010.01876.x
14. Chang TY, Chao TF, Liu CJ et al. The association between influenza infection, vaccination, and atrial fibrillation: A nationwide case-control study. Heart Rhythm 2016; 13 (6): 1189–94. DOI:10.1016/j.hrthm.2016.01.026
15. Issac TT, Dokainish H, Lakkis NM. Role of inflammation in initiation and perpetuation of atrial fibrillation: a systematic review of the published data. J Am Coll Cardiol 2007; 50 (21): 2021–8. DOI:10.1016/j.jacc.2007.06.054
16. Chung MK, Martin DO, Sprecher D et al. C-reactive protein elevation in patients with atrial arrhythmias: inflammatory mechanisms and persistence of atrial fibrillation. Circulation 2001; 104 (24): 2886–91. DOI:10.1161/hc4901.101760
17. Тревожно-фобические расстройства. Клинические рекомендации, утвержденные Минздравом России. М., 2021. URL: https://cr.minzdrav.gov.ru/recomend/455_2
Anxiety-phobic disorders. Clinical recommendations approved by the Ministry of Health of Russia. Moscow, 2021. URL: https://cr.minzdrav.gov.ru/recomend/455_2 (in Russian).
18. Полуэктов М.Г., Бузунов Р.В., Авербух В.М. и др. Проект клинических рекомендаций по диагностике и лечению хронической инсомнии у взрослых. Consilium Medicum. Неврология и Ревматология. 2016; 2: 41–51.
Poluektov M.G., Buzunov R.V., Averbukh VM et al. Project of clinical recommendations on diagnosis and treatment of chronic insomnia in adults. Consilium Medicum. Neurology and Rheumatology. 2016; 2: 41–51 (in Russian).
19. Bizhanov KA, Аbzaliyev KB, Baimbetov AK et al. Atrial fibrillation: Epidemiology, pathophysiology, and clinical complications (literature review). J Cardiovasc Electrophysiol 2023; 34 (1): 153–65. DOI:10.1111/jce.15759
20. Dong XJ, Wang BB, Hou FF et al. Global burden of atrial fibrillation/atrial flutter and its attributable risk factors from 1990 to 2019. Europace 2023; 25 (3): 793–803. DOI:10.1093/europace/euac237
21. Аракелян М.Г., Бокерия Л.А., Васильева Е.Ю. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021; 26 (7): 190–260. DOI: 10.15829/1560-4071-2021-4594
Arakelyan M.G., Bockeria L.A., Vasilieva E.Yu. et al. 2020 Clinical guidelines for Atrial fibrillation and atrial flutter. Russian Journal of Cardiology 2021; 26 (7): 190–260 (in Russian).
22. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020; 25 (3): 149–218. DOI:10.15829/1560-4071-2020-3-3786
Arterial hypertension in adults. Clinical guidelines 2020. Russian Journal of Cardiology. 2020;25(3):149-218 DOI:10.15829/1560-4071-2020-3-3786 (in Russian).
23. Лекарственно-индуцированные заболевания. Том II: монография. Под общ. ред. Д.А. Сычева, О.Д. Остроумовой; ред. разделов А.И. Кочетков. М.: Прометей, 2022. ISBN 978-5-00172-304-2
[Drug-induced diseases. Volume II: monograph. Ed. by D.A. Sychev, O.D. Ostroumova; sections ed. by A.I. Kochetkov. Moscow: Prometheus, 2022. (in Russian)].
24. Алгоритмы ведения пациентов с нарушениями ритма сердца: учеб. пособие. 2-е изд., испр. и доп. Под ред. Д.С. Лебедева,
Е.Н. Михайлова. М.: Российское кардиологическое общество, 2021. ISBN 978_5_6044101_2_7
Algorithms of management of patients with cardiac rhythm disturbances: textbook. Ed. by D.S. Lebedev, E.N. Mikhailov. Moscow: Russian Cardiological Society, 2021. (in Russian).
25. Yao X, Abraham NS, Alexander GC et al. Effect of Adherence to Oral Anticoagulants on Risk of Stroke and Major Bleeding Among Patients With Atrial Fibrillation. J Am Heart Assoc 2016; 5 (2): e003074. DOI:10.1161/JAHA.115.003074
26. Forslund T, Wettermark B, Hjemdahl P. Comparison of treatment persistence with different oral anticoagulants in patients with atrial fibrillation. Eur J Clin Pharmacol 2016; 72 (3): 329–38. DOI: 10.1007/s00228-015-1983-z
27. Brown JD, Shewale AR, Talbert JC. Adherence to Rivaroxaban, Dabigatran, and Apixaban for Stroke Prevention in Incident, Treatment-Naïve Nonvalvular Atrial Fibrillation. J Manag Care Spec Pharm 2016; 22 (11): 1319–29. DOI:10.18553/jmcp.2016.22.11.1319
28. Lau WCY, Torre CO, Man KKC et al. Comparative Effectiveness and Safety Between Apixaban, Dabigatran, Edoxaban, and Rivaroxaban Among Patients With Atrial Fibrillation: A Multinational Population-Based Cohort Study. Ann Intern Med 2022; 175 (11): 1515–24. DOI: 10.7326/M22-0511
29. Grymonprez M, Steurbaut S, De Backer TL et al. Effectiveness and Safety of Oral Anticoagulants in Older Patients With Atrial Fibrillation: A Systematic Review and Meta-Analysis. Front Pharmacol 2020; 11: 583311. DOI: 10.3389/fphar.2020.583311
30. Chao TF, Chiang CE, Liao JN t al. Comparing the Effectiveness and Safety of Nonvitamin K Antagonist Oral Anticoagulants and Warfarin in Elderly Asian Patients With Atrial Fibrillation: A Nationwide Cohort Study. Chest 2020; 157 (5): 1266–1277. DOI: 10.1016/j.chest.2019.11.025
31. Halvorsen S, Atar D, Yang H et al. Efficacy and safety of apixaban compared with warfarin according to age for stroke prevention in atrial fibrillation: observations from the ARISTOTLE trial. Eur Heart J 2014; 35 (28): 1864–1872. DOI: 10.1093/eurheartj/ehu046
32. Grymonprez M, Steurbaut S, De Backer TL et al. Effectiveness and Safety of Oral Anticoagulants in Older Patients With Atrial Fibrillation: A Systematic Review and Meta-Analysis. Front Pharmacol 2020; 11: 583311. DOI: 10.3389/fphar.2020.583311
33. Pokorney SD, Chertow GM, Al-Khalidi HR et al. Apixaban for Patients With Atrial Fibrillation on Hemodialysis: A Multicenter Randomized Controlled Trial. Circulation 2022; 146 (23): 1735–45. DOI: 10.1161/CIRCULATIONAHA.121.054990
34. Chang M, Yu Z, Shenker A et al. Effect of renal impairment on the pharmacokinetics, pharmacodynamics, and safety of apixaban. J Clin Pharmacol 2016; 56 (5): 637–45. DOI: 10.1002/jcph.633
35. Granger CB, Alexander JH, McMurray JJ et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365 (11): 981–92. DOI: 10.1056/NEJMoa1107039
36. Hijazi Z, Hohnloser SH, Andersson U et al. Efficacy and Safety of Apixaban Compared With Warfarin in Patients With Atrial Fibrillation in Relation to Renal Function Over Time: Insights From the ARISTOTLE Randomized Clinical Trial. JAMA Cardiol 2016; 1 (4): 451–60. DOI: 10.1001/jamacardio.2016.1170
37. Granger CB, Alexander JH, McMurray JJ et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365 (11): 981–92. DOI: 10.1056/NEJMoa1107039
38. Loffredo L, Perri L, Violi F. Impact of new oral anticoagulants on gastrointestinal bleeding in atrial fibrillation: A meta-analysis of interventional trials. Dig Liver Dis 2015; 47 (5): 429–31. DOI: 10.1016/j.dld.2015.01.159
39. Miller CS, Dorreen A, Martel M et al. Risk of Gastrointestinal Bleeding in Patients Taking Non-Vitamin K Antagonist Oral Anticoagulants: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol 2017; 15 (11): 1674–83.e3. DOI: 10.1016/j.cgh.2017.04.031
31 июля 2023
Количество просмотров: 1150


