Клинический разбор в общей медицине №9 2023
Sergey P. Prokopenko1,4, Eric K. Saribekyan1, Elena A. Rasskazova1, Mikhail L. Mazo1,4, Ekaterina A. Zanozina1
1 Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology, Moscow, Russia; 2 National Medical Research Center of Radiology, Obninsk, Russia;
3 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
4 Patrice Lumumba Peoples' Friendship University of Russia, Moscow, Russia
shahirizada_90@mail.ru
Abstract
There is a steady trend towards de-escalation of surgical intervention in the breast cancer treatment strategy. At first, this topic concerned the de-velopment and implementation of methods of organ-preserving operations on the mammary gland itself. With the advent of the concept and the development of the sentinel lymph node biopsy technique, the problem of performing a gentle lymphadenectomy with the prevalence of the cN0 process was solved. In recent years, the most innovative technique has begun to develop, namely targeted lymphadenectomy, which allows per-
forming economical interventions on the lymph pathways with the prevalence of the cN1→ypN0 process, that is, in the presence of a verified metastatic lymph node with complete clinical resorption of metastasis during neoadjuvant polychemotherapy. The article is devoted to the de-
scription of the technique of performing targeted lymphadenectomy.
Key words: breast cancer, targeted lymphadenectomy, sentinel (signal) lymph node biopsy, neoadjuvant polychemotherapy, lymphadenectomy.
For citation: Abdulloeva Sh.Sh., Kaprin A.D., Zikiryakhodzhaev A.D., Prokopenko S.P., Saribekyan E.K., Rasskazova E.A., Mazo M.L., Zanozina E.A. Targeted lymphadenectomy for breast cancer. Execution method. Clinical case. Clinical review for general practice. 2023; 2023; 4 (9): 135–140 (In Russ.). DOI: 10.47407/kr2023.4.9.00320
В большинстве случаев пациентам, у которых диагностирован РМЖ с поражением регионарных лимфатических узлов (ЛУ), на первом этапе лечения проводится неоадъювантная полихимиотерапия (НАПХТ). В настоящее время эффект НАПХТ учитывают при решении вопроса об объеме операций на молочной железе (МЖ). Данный вопрос уже хорошо изучен и освещен во многих публикациях и клинических рекомендациях. При регрессе опухолевого узла расширяют показания к органосохраняющим операциям. Что же касается объема лимфаденэктомии, то ситуация на сегодняшний день более консервативна. В большинстве случаев при наличии верифицированного метастаза онкологи выполняют полную аксиллярную лимфаденэктомию независимо от числа пораженных метастазами ЛУ [1–3]. Экономную лифаденэктомию в виде удаления сторожевых ЛУ (СЛУ) производят при категории сN0, редко – при категории pN1miс, т.е. микрометастазе до 2 мм.
Наиболее крупные и цитируемые исследования, изучающие информативность методики биопсии СЛУ после НАПХТ, такие как GANEA, ACOSOG Z1071, SENTINA, SN FNAC, показали, что если в отношении пациентов с cN0 ее информативность достигает 90% и выше, то в отношении пациентов с cN1→yсN0 информативность метода снижается, показывая высокие проценты ложноотрицательных результатов. Данная картина, вероятно, связана с фиброзированием пораженных ЛУ после резорбции метастаза, а также закупоркой отдельных звеньев лимфосистемы, обусловленными продуктами клеточного распада и/или опухолевыми эмболами в ходе лечения, что вызывает изменения путей лимфооттока [1–5].
С целью снижения частоты ложноотрицательных результатов и повышения информативности биопсии СЛУ у пациентов с поражением ЛУ были применены методики их маркировки до проведения НАПХТ, что создало основу для появления нового направления в онкохирургии – таргетной лимфаденэктомии (TЛАЭ).
TЛАЭ – это метод хирургического вмешательства в зоне регионарного лимфооттока, включающий в себя маркировку клинически позитивных ЛУ до НАПХТ различными материалами (углеродная татуировка, радиоактивный йод, металлические маркеры, ферромагнитные семена и т.д.) с последующим интраоперационным его удалением вместе с биопсией СЛУ [6–10].
Ниже описан случай лечения пациентки с cN1 путем применения ТЛАЭ с использованием маркировки пораженного ЛУ.
 Пациентка Ж. 43 лет в октябре 2022 г. самостоятельно обнаружила опухолевое образование в левой МЖ. Обратилась в поликлинику по месту жительства. Проведено обследование в стандартном объеме: ультразвуковое исследование (УЗИ) МЖ, цифровая маммография, УЗИ брюшной полости, малого таза, компьютерная томография органов грудной клетки, сцинтиграфия костей скелета, биопсия узла левой МЖ. Самостоятельно обратилась в Московский научно-исследовательский онкологический институт им. П.А. Герцена им. П.А. Герцена.
Пациентка Ж. 43 лет в октябре 2022 г. самостоятельно обнаружила опухолевое образование в левой МЖ. Обратилась в поликлинику по месту жительства. Проведено обследование в стандартном объеме: ультразвуковое исследование (УЗИ) МЖ, цифровая маммография, УЗИ брюшной полости, малого таза, компьютерная томография органов грудной клетки, сцинтиграфия костей скелета, биопсия узла левой МЖ. Самостоятельно обратилась в Московский научно-исследовательский онкологический институт им. П.А. Герцена им. П.А. Герцена.
Местный статус. При пальпации левой МЖ в верхненаружном квадранте определяется плотная подвижная опухоль размером 2×3 см. В левой подмышечной области пальпируется единичный ЛУ плотной консистенции размерами 1,5×1,5 см.
Цифровая маммография: на фоне участка перестроенной структуры с наличием микрокальцинатов 3,0×2,3 см определяется узловое образование с тяжистыми контурами 2,3×2,2 см.
УЗИ: МЖ представлены жировой и железистой тканью с признаками фиброза. Слева на границе верхних квадрантов визуализируется образование с неровными нечеткими контурами, неправильной формы, гипоэхогенной структуры, ориентировочный размер 22×16×14 мм.
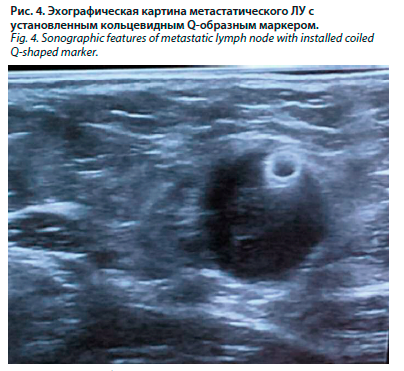
В режиме цветового доплеровского картирования кровоток не усилен. При компрессионной соноэластографии коэффициент SR 9,7 ед. УЗИ регионарных зон: в надключичных, подключичных, парастернальных областях с двух сторон, подмышечной области справа – без патологических изменений. В подмышечной области слева визуализируется единичный ЛУ с неоднородной эхоструктурой, утолщенным кортикальным слоем, размером 14×9 мм. Произведена тонкоигольная аспирационная биопсия. Цитологически – метастаз умеренно дифференцированного аденогенного рака.
Диагностирован рак левой МЖ IIВ стадии, сТ2N1М0G2. Нелюминальный, HER-2/neu-позитивный тип.
На онкологическом консилиуме решено провести лечение комплексным методом. Первый этап – НАПХТ. Перед НАПХТ произвести предварительную маркировку метастатически измененного подмышечного ЛУ методом клипирования и маркировать по стандартной методике опухоль в МЖ.
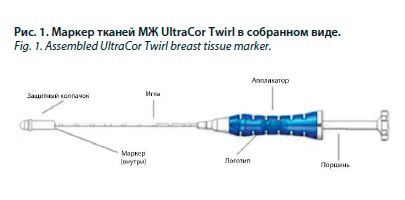
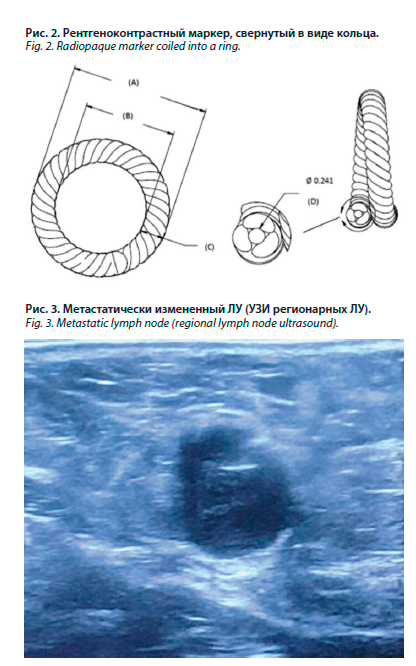
Клипирование производилось маркером тканей МЖ UltraCor Twirl (США) в соответствии с инструкцией по применению изделия. Данное изделие представляет собой комплексную систему, состоящую из аппликатора в виде иглы со скошенным кончиком, содержащей нитиноловый рентгеноконтрастный Q-образный маркер с памятью формы, который сворачивается в форму кольца при размещении в тканях. Данный маркер предназначен для длительной рентгенологической маркировки места биопсии в тканях. В аппликаторе используются игла калибра 17G×10 см со скошенным кончиком и блокируемый поршень, сворачивающийся кольцом маркер, который выдвигается из скошенного кончика иглы и размещается в тканях (рис. 1, 2).
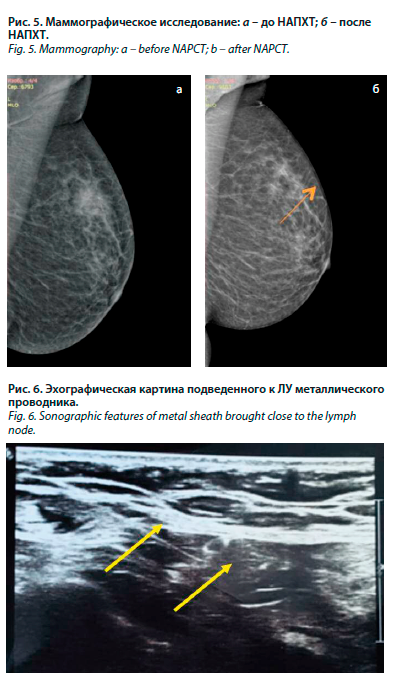
В положении пациентки на спине с руками, заведенными за голову, при навигации ультразвуковым датчиком визуализирован измененный подмышечный ЛУ. Под местной анестезией установлен внутритканевой
Q-образный маркер аксиллярного ЛУ (рис. 3, 4).
Проведено 6 курсов полихимиотерапии по схеме DCH: доцетаксел 75 мг/м2 внутривенно в 1-й день 1 раз в 3 нед + карбоплатин AUC-6 внутривенно в 1-й день 1 раз в 3 нед + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) внутривенно в 1-й день 1 раз в 3 нед + пертузумаб 420 мг (нагрузочная доза 840 мг) внутривенно в 1-й день 1 раз в 3 нед, 6 курсов. По данным контрольного обследования лучевыми методами отмечается положительная динамика в виде полного регресса опухолевого узла левой МЖ и метастатически измененного подмышечного ЛУ. При рентгенографическом обследовании в проекции ранее описанного образования в верхненаружном квадранте левой МЖ на расстоянии 6 см от ареолы определяется внутритканевая метка (рис. 5).
При УЗИ МЖ – картина равномерно развитой железистой ткани, узловых образований не выявлено. В аксиллярных областях – ЛУ без видимых структурных изменений.
Повторный онкологический консилиум по результатам 1-го этапа лечения принял решение о проведении хирургического лечения в объеме резекции левой МЖ с интраоперационным исследованием и удалением СЛУ и клипированного ЛУ.
В день операции под контролем ультразвукового наведения в зону ранее маркированного ЛУ установлен металлический проводник (локализационный гарпун); рис. 6, 7.
Пациентке 15.03.2023 выполнена резекция левой МЖ с биопсией СЛУ и таргетного ЛУ.
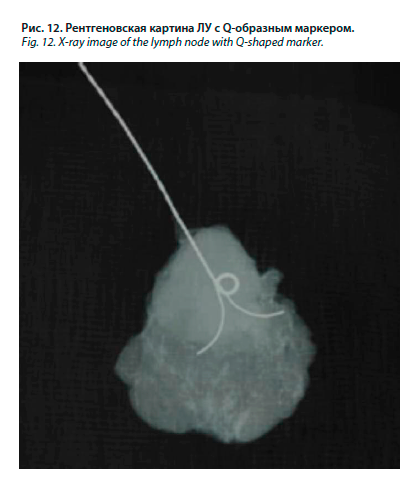
Этапы оперативного вмешательства. За 10 мин до начала операции параареолярно введен раствор красителя (индоцианин зеленый) для определения СЛУ. Спустя несколько минут при выключенном наружном освещении методом флуоресценции получено изображение движения красителя по лимфопутям на экране компьютера аппарата SP-2000. В месте обрыва дорожки в подмышечной области рассечены кожа и подкожная клетчатка. При помощи аппарата Striker определены 2 СЛУ с наибольшим флюоресцентным сигналом (рис. 8).
Один из СЛУ, который накопил контрастный препарат, совпадал с ЛУ с локализованным металлическим гарпуном, маркированным Q-образным маркером. На рис. 9 виден исходящий из подмышечной области от маркированного ЛУ гарпун.
Выделен и удален маркированный ЛУ (рис. 10). Удалены также второй СЛУ и произвольно выбранный прилежащий к маркированному один ЛУ (рис. 11).
ЛУ отправлен на рентгенологическое исследование, подтвердившее наличие метки (рис. 12).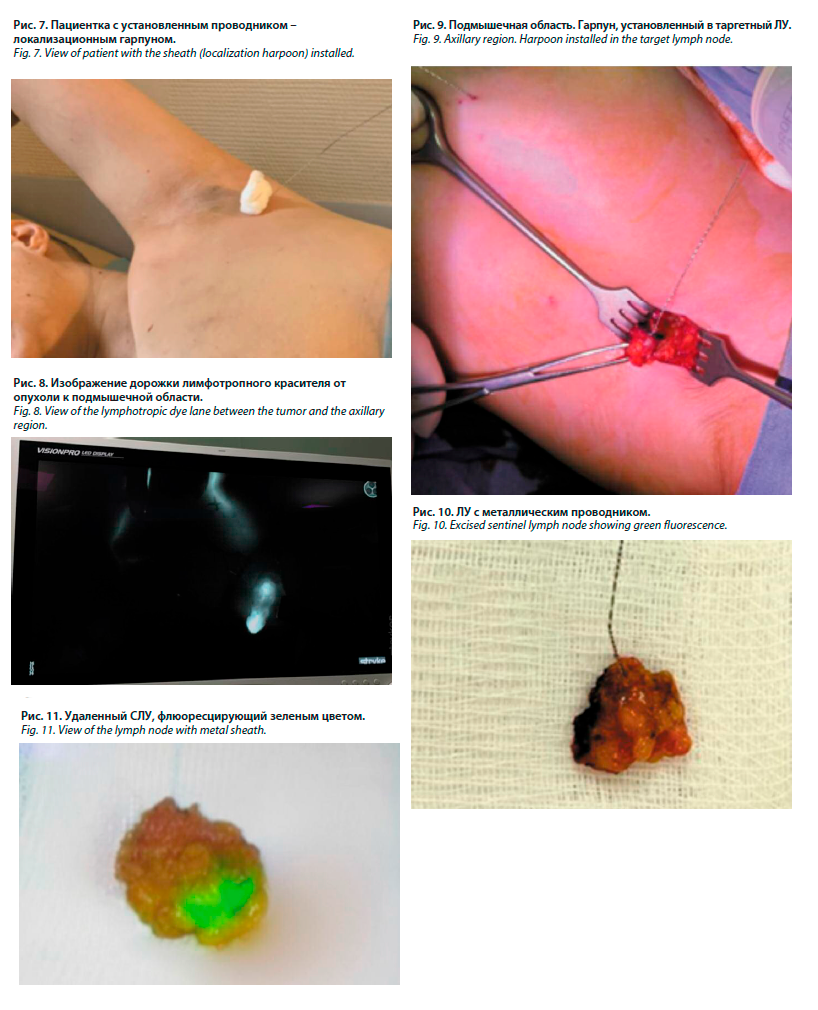
 Удаленные ЛУ макроскопически изучены морфологами, произведены разрезы ЛУ по длиннику в трех параллельных плоскостях. Взяты соскобы с поверхности ЛУ на стекла, окрашены гематоксилин-эозином. При срочном цитологическом исследовании – без метастазов.
Удаленные ЛУ макроскопически изучены морфологами, произведены разрезы ЛУ по длиннику в трех параллельных плоскостях. Взяты соскобы с поверхности ЛУ на стекла, окрашены гематоксилин-эозином. При срочном цитологическом исследовании – без метастазов.
Следующим этапом через отдельный разрез кожи в области верхненаружного квадранта удален сектор МЖ с металлическим локализационным гарпуном. Послеоперационный период протекал без осложнений. Пациентка выписана на 3-е сутки после операции, удалена дренажная трубка. Рука функционирует в полном объеме.
Результат планового морфологического исследования: в ткани сектора в проекции участка фиброза (ложа опухоли) и вне этой зоны – умеренный перидуктальный, пери- и интралобулярный склероз со слабой диффузной лимфоцитарной инфильтрацией с примесью нейтрофильных сегментоядерных лейкоцитов, свежие очаговые кровоизлияния. В отдельно досеченных краях резекции опухолевого роста нет. В маркированном меткой ЛУ морфологическая картина может соответствовать 4-й степени лечебного патоморфоза по классификации Г.А. Лавниковой. В двух дополнительно удаленных ЛУ – без метастазов.
На повторном консилиуме рекомендовано:
• третьим этапом лечения – проведение лучевой терапии на резецированную МЖ в разовой очаговой дозе 2–2,5 Гр, суммарной очаговой дозе 50 Гр-экв, буст на область ложа опухоли в разовой очаговой дозе 2,5 Гр 4 фракции, зоны регионарного лимфооттока слева – суммарная очаговая доза 45 Гр-экв;
• четвертым этапом – таргетная терапия: трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) внутривенно 1 раз в 3 нед до общей длительности 12 мес.
Лучевую терапию перенесла без осложнений. Таргетную терапию проходит у химиотерапевта по месту жительства.
Преимущество методики в избирательном удалении единичных ЛУ мотивирует клиницистов продолжать исследование в данном направлении.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Абдуллоева Шахноза Шералиевна – аспирантка отд-ния онкологии и реконструктивно-пластической хирургии молочной железы и кожи МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии». E-mail: shahirizada_90@mail.ru; ORCID: 0000-0002-3178-0877
Shakhnoza Sh. Abdulloeva – Graduate Student, Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology. E-mail: shahirizada_90@mail.ru; ORCID: 0000-0002-3178-0877
Каприн Андрей Дмитриевич – акад. РАН, акад. РАО, д-р мед. наук, проф., ген. дир. ФГБУ «НМИЦ радиологии», дир. МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии». E-mail.ru: contact@nmicr.ru; ORCID: 0000-0001-8784-8415
Andrey D. Kaprin – Acad. RAS, Acad. RAE, Dr. Sci. (Med.), Professor, General Director of the National Medical Research Center of Radiology, Director of Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology. E-mail: contact@nmicr.ru; ORСID: 0000-0001-8784-8415
Зикиряходжаев Азиз Дильшодович – д-р мед. наук, проф., рук. отд-ния онкологии и реконструктивно-пластической хирургии молочной железы и кожи МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии», доц. каф. онкологии и радиотерапии ИПО ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: azizz@mail.ru; ORCID: 0000-0001-7141-2502
Aziz D. Zikiryakhodzhaev – Dr. Sci. (Med.), Professor, Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology, Sechenov First Moscow State Medical University (Sechenov University).
E-mail: azizz@mail.ru; ORCID: 0000-0001-7141-2502
Прокопенко Сергей Павлович – канд. мед. наук, доц., зав. отд-нием комплексной диагностики и интервенционной радиологии в маммологии Национального центра онкологии репродуктивных органов МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии», зав. каф. клинической маммологии, лучевой диагностики и лучевой терапии фак-та непрерывного медицинского образования Медицинского института ФГАОУ ВО РУДН. E-mail: procopenkosp@gmail.com; ORCID: 0000-0002-0369-5755
Sergey P. Prokopenko – Cand. Sci. (Med.), Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology, Patrice Lumumba Peoples' Friendship University of Russia. E-mail: procopenkosp@gmail.com; ORCID: 0000-0002-0369-5755
Сарибекян Эрик Карлович – д-р мед. наук, вед. науч. сотр. отд-ния онкологии и реконструктивно-пластической хирургии молочной железы и кожи МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии». E-mail: mammolog3@yandex.ru; ORCID: 0000-0003-0827-7998
Eric K. Saribekyan – Dr. Sci. (Med.), Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology. E-mail: mammolog3@yandex.ru; ORCID: 0000-0003-0827-7998
Рассказова Елена Александровна – канд. мед. наук, науч. сотр. отд-ния онкологии и реконструктивно-пластической хирургии молочной железы и кожи МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии». E-mail: rasskaz2@yandex.ru; ORCID: 0000-0003-0307-8252
Elena A. Rasskazova – Cand. Sci. (Med.), Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology. E-mail: rasskaz2@yandex.ru; ORCID: 0000-0003-0307-8252
Мазо Михаил Львович – канд. мед. наук, ст. науч. сотр. отд-ния комплексной диагностики и интервенционной радиологии в маммологии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии», доц. каф. каф. клинической маммологии, лучевой диагностики и лучевой терапии фак-та непрерывного медицинского образования Медицинского института ФГАОУ ВО РУДН. ORCID: 0000-0002-1313-6420
Mikhail L. Mazo – Cand. Sci. (Med.), Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology, Patrice Lumumba Peoples' Friendship University of Russia. ORCID: 0000-0002-1313-6420
Занозина Екатерина Алексеевна – аспирантка отд-ния онкологии и реконструктивно-пластической хирургии молочной железы и кожи в МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии». E-mail: zanozinaekaterina@gmail.ru; ORCID: 0000-0003-2050-142X
Ekaterina A. Zanozina – Graduate Student, Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology. E-mail: zanozinaekaterina@gmail.ru; ORCID: 0000-0003-2050-142X
Поступила в редакцию: 03.11.2023
Поступила после рецензирования: 08.11.2023
Принята к публикации: 09.11.2023
Received: 03.11.2023
Revised: 08.11.2023
Accepted: 09.11.2023
Клинический разбор в общей медицине №9 2023
Таргетная лимфаденэктомия при раке молочной железы. Методика выполнения. Клинический случай
Номера страниц в выпуске:135-140
Аннотация
В стратегии лечения рака молочной железы имеется устойчивая тенденция к деэскалации хирургического вмешательства. Вначале данная тема касалась отработки и внедрения методик органосохраняющих операций на самой молочной железе. С появлением концепции и развитием методики биопсии сторожевого лимфатического узла решилась проблема с выполнением щадящей лимфаденэктомии при распространенности процесса cN0. В последние годы стала развиваться самая новаторская методика, а именно таргетная лимфаденэктомия, которая позволяет выполнять экономные вмешательства на лимфопутях при распространенности процесса cN1→ypN0, т.е. при наличии верифицированного метастатического лимфоузла с полной клинической резорбцией метастаза в процессе неоадъювантной полихимиотерапии. Статья посвящена описанию методики выполнения таргетной лимфаденэктомии.
Ключевые слова: рак молочной железы, таргетная лимфаденэктомия, биопсия сторожевого (сигнального) лимфатического узла,
неоадъювантная полихимиотерапия, лимфаденэктомия.
Для цитирования: Абдуллоева Ш.Ш., Каприн А.Д., Зикиряходжаев А.Д., Прокопенко С.П., Сарибекян Э.К., Рассказова Е.А., Мазо М.Л., Занозина Е.А. Таргетная лимфаденэктомия при раке молочной железы. Методика выполнения. Клинический случай. Клинический разбор в общей медицине. 2023; 4 (9): 135–140. DOI: 10.47407/kr2023.4.9.00320
В стратегии лечения рака молочной железы имеется устойчивая тенденция к деэскалации хирургического вмешательства. Вначале данная тема касалась отработки и внедрения методик органосохраняющих операций на самой молочной железе. С появлением концепции и развитием методики биопсии сторожевого лимфатического узла решилась проблема с выполнением щадящей лимфаденэктомии при распространенности процесса cN0. В последние годы стала развиваться самая новаторская методика, а именно таргетная лимфаденэктомия, которая позволяет выполнять экономные вмешательства на лимфопутях при распространенности процесса cN1→ypN0, т.е. при наличии верифицированного метастатического лимфоузла с полной клинической резорбцией метастаза в процессе неоадъювантной полихимиотерапии. Статья посвящена описанию методики выполнения таргетной лимфаденэктомии.
Ключевые слова: рак молочной железы, таргетная лимфаденэктомия, биопсия сторожевого (сигнального) лимфатического узла,
неоадъювантная полихимиотерапия, лимфаденэктомия.
Для цитирования: Абдуллоева Ш.Ш., Каприн А.Д., Зикиряходжаев А.Д., Прокопенко С.П., Сарибекян Э.К., Рассказова Е.А., Мазо М.Л., Занозина Е.А. Таргетная лимфаденэктомия при раке молочной железы. Методика выполнения. Клинический случай. Клинический разбор в общей медицине. 2023; 4 (9): 135–140. DOI: 10.47407/kr2023.4.9.00320
Targeted lymphadenectomy for breast cancer. Execution method. Clinical case
Shakhnoza Sh. Abdulloeva*1, Andrey D. Kaprin1,2, Aziz D. Zikiryakhodzhaev1,3,Sergey P. Prokopenko1,4, Eric K. Saribekyan1, Elena A. Rasskazova1, Mikhail L. Mazo1,4, Ekaterina A. Zanozina1
1 Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology, Moscow, Russia; 2 National Medical Research Center of Radiology, Obninsk, Russia;
3 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
4 Patrice Lumumba Peoples' Friendship University of Russia, Moscow, Russia
shahirizada_90@mail.ru
Abstract
There is a steady trend towards de-escalation of surgical intervention in the breast cancer treatment strategy. At first, this topic concerned the de-velopment and implementation of methods of organ-preserving operations on the mammary gland itself. With the advent of the concept and the development of the sentinel lymph node biopsy technique, the problem of performing a gentle lymphadenectomy with the prevalence of the cN0 process was solved. In recent years, the most innovative technique has begun to develop, namely targeted lymphadenectomy, which allows per-
forming economical interventions on the lymph pathways with the prevalence of the cN1→ypN0 process, that is, in the presence of a verified metastatic lymph node with complete clinical resorption of metastasis during neoadjuvant polychemotherapy. The article is devoted to the de-
scription of the technique of performing targeted lymphadenectomy.
Key words: breast cancer, targeted lymphadenectomy, sentinel (signal) lymph node biopsy, neoadjuvant polychemotherapy, lymphadenectomy.
For citation: Abdulloeva Sh.Sh., Kaprin A.D., Zikiryakhodzhaev A.D., Prokopenko S.P., Saribekyan E.K., Rasskazova E.A., Mazo M.L., Zanozina E.A. Targeted lymphadenectomy for breast cancer. Execution method. Clinical case. Clinical review for general practice. 2023; 2023; 4 (9): 135–140 (In Russ.). DOI: 10.47407/kr2023.4.9.00320
Введение
В последние годы тактика хирургического лечения больных раком молочной железы (РМЖ) претерпевает фундаментальные изменения. Это продиктовано повсеместной тенденцией к деэскалации объема хирургического вмешательства, которая стала возможной в связи с улучшением диагностики и прогрессом лекарственной терапии.В большинстве случаев пациентам, у которых диагностирован РМЖ с поражением регионарных лимфатических узлов (ЛУ), на первом этапе лечения проводится неоадъювантная полихимиотерапия (НАПХТ). В настоящее время эффект НАПХТ учитывают при решении вопроса об объеме операций на молочной железе (МЖ). Данный вопрос уже хорошо изучен и освещен во многих публикациях и клинических рекомендациях. При регрессе опухолевого узла расширяют показания к органосохраняющим операциям. Что же касается объема лимфаденэктомии, то ситуация на сегодняшний день более консервативна. В большинстве случаев при наличии верифицированного метастаза онкологи выполняют полную аксиллярную лимфаденэктомию независимо от числа пораженных метастазами ЛУ [1–3]. Экономную лифаденэктомию в виде удаления сторожевых ЛУ (СЛУ) производят при категории сN0, редко – при категории pN1miс, т.е. микрометастазе до 2 мм.
Наиболее крупные и цитируемые исследования, изучающие информативность методики биопсии СЛУ после НАПХТ, такие как GANEA, ACOSOG Z1071, SENTINA, SN FNAC, показали, что если в отношении пациентов с cN0 ее информативность достигает 90% и выше, то в отношении пациентов с cN1→yсN0 информативность метода снижается, показывая высокие проценты ложноотрицательных результатов. Данная картина, вероятно, связана с фиброзированием пораженных ЛУ после резорбции метастаза, а также закупоркой отдельных звеньев лимфосистемы, обусловленными продуктами клеточного распада и/или опухолевыми эмболами в ходе лечения, что вызывает изменения путей лимфооттока [1–5].
С целью снижения частоты ложноотрицательных результатов и повышения информативности биопсии СЛУ у пациентов с поражением ЛУ были применены методики их маркировки до проведения НАПХТ, что создало основу для появления нового направления в онкохирургии – таргетной лимфаденэктомии (TЛАЭ).
TЛАЭ – это метод хирургического вмешательства в зоне регионарного лимфооттока, включающий в себя маркировку клинически позитивных ЛУ до НАПХТ различными материалами (углеродная татуировка, радиоактивный йод, металлические маркеры, ферромагнитные семена и т.д.) с последующим интраоперационным его удалением вместе с биопсией СЛУ [6–10].
Ниже описан случай лечения пациентки с cN1 путем применения ТЛАЭ с использованием маркировки пораженного ЛУ.
Клинический случай. Описание



 Пациентка Ж. 43 лет в октябре 2022 г. самостоятельно обнаружила опухолевое образование в левой МЖ. Обратилась в поликлинику по месту жительства. Проведено обследование в стандартном объеме: ультразвуковое исследование (УЗИ) МЖ, цифровая маммография, УЗИ брюшной полости, малого таза, компьютерная томография органов грудной клетки, сцинтиграфия костей скелета, биопсия узла левой МЖ. Самостоятельно обратилась в Московский научно-исследовательский онкологический институт им. П.А. Герцена им. П.А. Герцена.
Пациентка Ж. 43 лет в октябре 2022 г. самостоятельно обнаружила опухолевое образование в левой МЖ. Обратилась в поликлинику по месту жительства. Проведено обследование в стандартном объеме: ультразвуковое исследование (УЗИ) МЖ, цифровая маммография, УЗИ брюшной полости, малого таза, компьютерная томография органов грудной клетки, сцинтиграфия костей скелета, биопсия узла левой МЖ. Самостоятельно обратилась в Московский научно-исследовательский онкологический институт им. П.А. Герцена им. П.А. Герцена.Местный статус. При пальпации левой МЖ в верхненаружном квадранте определяется плотная подвижная опухоль размером 2×3 см. В левой подмышечной области пальпируется единичный ЛУ плотной консистенции размерами 1,5×1,5 см.
Цифровая маммография: на фоне участка перестроенной структуры с наличием микрокальцинатов 3,0×2,3 см определяется узловое образование с тяжистыми контурами 2,3×2,2 см.
УЗИ: МЖ представлены жировой и железистой тканью с признаками фиброза. Слева на границе верхних квадрантов визуализируется образование с неровными нечеткими контурами, неправильной формы, гипоэхогенной структуры, ориентировочный размер 22×16×14 мм.
В режиме цветового доплеровского картирования кровоток не усилен. При компрессионной соноэластографии коэффициент SR 9,7 ед. УЗИ регионарных зон: в надключичных, подключичных, парастернальных областях с двух сторон, подмышечной области справа – без патологических изменений. В подмышечной области слева визуализируется единичный ЛУ с неоднородной эхоструктурой, утолщенным кортикальным слоем, размером 14×9 мм. Произведена тонкоигольная аспирационная биопсия. Цитологически – метастаз умеренно дифференцированного аденогенного рака.
Диагностирован рак левой МЖ IIВ стадии, сТ2N1М0G2. Нелюминальный, HER-2/neu-позитивный тип.
На онкологическом консилиуме решено провести лечение комплексным методом. Первый этап – НАПХТ. Перед НАПХТ произвести предварительную маркировку метастатически измененного подмышечного ЛУ методом клипирования и маркировать по стандартной методике опухоль в МЖ.
Клипирование производилось маркером тканей МЖ UltraCor Twirl (США) в соответствии с инструкцией по применению изделия. Данное изделие представляет собой комплексную систему, состоящую из аппликатора в виде иглы со скошенным кончиком, содержащей нитиноловый рентгеноконтрастный Q-образный маркер с памятью формы, который сворачивается в форму кольца при размещении в тканях. Данный маркер предназначен для длительной рентгенологической маркировки места биопсии в тканях. В аппликаторе используются игла калибра 17G×10 см со скошенным кончиком и блокируемый поршень, сворачивающийся кольцом маркер, который выдвигается из скошенного кончика иглы и размещается в тканях (рис. 1, 2).
В положении пациентки на спине с руками, заведенными за голову, при навигации ультразвуковым датчиком визуализирован измененный подмышечный ЛУ. Под местной анестезией установлен внутритканевой
Q-образный маркер аксиллярного ЛУ (рис. 3, 4).
Проведено 6 курсов полихимиотерапии по схеме DCH: доцетаксел 75 мг/м2 внутривенно в 1-й день 1 раз в 3 нед + карбоплатин AUC-6 внутривенно в 1-й день 1 раз в 3 нед + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) внутривенно в 1-й день 1 раз в 3 нед + пертузумаб 420 мг (нагрузочная доза 840 мг) внутривенно в 1-й день 1 раз в 3 нед, 6 курсов. По данным контрольного обследования лучевыми методами отмечается положительная динамика в виде полного регресса опухолевого узла левой МЖ и метастатически измененного подмышечного ЛУ. При рентгенографическом обследовании в проекции ранее описанного образования в верхненаружном квадранте левой МЖ на расстоянии 6 см от ареолы определяется внутритканевая метка (рис. 5).
При УЗИ МЖ – картина равномерно развитой железистой ткани, узловых образований не выявлено. В аксиллярных областях – ЛУ без видимых структурных изменений.
Повторный онкологический консилиум по результатам 1-го этапа лечения принял решение о проведении хирургического лечения в объеме резекции левой МЖ с интраоперационным исследованием и удалением СЛУ и клипированного ЛУ.
В день операции под контролем ультразвукового наведения в зону ранее маркированного ЛУ установлен металлический проводник (локализационный гарпун); рис. 6, 7.
Пациентке 15.03.2023 выполнена резекция левой МЖ с биопсией СЛУ и таргетного ЛУ.
Этапы оперативного вмешательства. За 10 мин до начала операции параареолярно введен раствор красителя (индоцианин зеленый) для определения СЛУ. Спустя несколько минут при выключенном наружном освещении методом флуоресценции получено изображение движения красителя по лимфопутям на экране компьютера аппарата SP-2000. В месте обрыва дорожки в подмышечной области рассечены кожа и подкожная клетчатка. При помощи аппарата Striker определены 2 СЛУ с наибольшим флюоресцентным сигналом (рис. 8).
Один из СЛУ, который накопил контрастный препарат, совпадал с ЛУ с локализованным металлическим гарпуном, маркированным Q-образным маркером. На рис. 9 виден исходящий из подмышечной области от маркированного ЛУ гарпун.
Выделен и удален маркированный ЛУ (рис. 10). Удалены также второй СЛУ и произвольно выбранный прилежащий к маркированному один ЛУ (рис. 11).
ЛУ отправлен на рентгенологическое исследование, подтвердившее наличие метки (рис. 12).

 Удаленные ЛУ макроскопически изучены морфологами, произведены разрезы ЛУ по длиннику в трех параллельных плоскостях. Взяты соскобы с поверхности ЛУ на стекла, окрашены гематоксилин-эозином. При срочном цитологическом исследовании – без метастазов.
Удаленные ЛУ макроскопически изучены морфологами, произведены разрезы ЛУ по длиннику в трех параллельных плоскостях. Взяты соскобы с поверхности ЛУ на стекла, окрашены гематоксилин-эозином. При срочном цитологическом исследовании – без метастазов.Следующим этапом через отдельный разрез кожи в области верхненаружного квадранта удален сектор МЖ с металлическим локализационным гарпуном. Послеоперационный период протекал без осложнений. Пациентка выписана на 3-е сутки после операции, удалена дренажная трубка. Рука функционирует в полном объеме.
Результат планового морфологического исследования: в ткани сектора в проекции участка фиброза (ложа опухоли) и вне этой зоны – умеренный перидуктальный, пери- и интралобулярный склероз со слабой диффузной лимфоцитарной инфильтрацией с примесью нейтрофильных сегментоядерных лейкоцитов, свежие очаговые кровоизлияния. В отдельно досеченных краях резекции опухолевого роста нет. В маркированном меткой ЛУ морфологическая картина может соответствовать 4-й степени лечебного патоморфоза по классификации Г.А. Лавниковой. В двух дополнительно удаленных ЛУ – без метастазов.
На повторном консилиуме рекомендовано:
• третьим этапом лечения – проведение лучевой терапии на резецированную МЖ в разовой очаговой дозе 2–2,5 Гр, суммарной очаговой дозе 50 Гр-экв, буст на область ложа опухоли в разовой очаговой дозе 2,5 Гр 4 фракции, зоны регионарного лимфооттока слева – суммарная очаговая доза 45 Гр-экв;
• четвертым этапом – таргетная терапия: трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) внутривенно 1 раз в 3 нед до общей длительности 12 мес.
Лучевую терапию перенесла без осложнений. Таргетную терапию проходит у химиотерапевта по месту жительства.
Заключение
Данный клинический случай наглядно показывает эффективность, безопасность и возможность выполнения методики ТЛАЭ при наличии соответствующих технических возможностей. Применение данной методики в хирургических отделениях способствует ранней реабилитации больных, отвечает требованием современной медицины, позволяет избежать необоснованно завышенного объема хирургического вмешательства на регионарных зонах при РМЖ.Преимущество методики в избирательном удалении единичных ЛУ мотивирует клиницистов продолжать исследование в данном направлении.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Абдуллоева Шахноза Шералиевна – аспирантка отд-ния онкологии и реконструктивно-пластической хирургии молочной железы и кожи МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии». E-mail: shahirizada_90@mail.ru; ORCID: 0000-0002-3178-0877
Shakhnoza Sh. Abdulloeva – Graduate Student, Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology. E-mail: shahirizada_90@mail.ru; ORCID: 0000-0002-3178-0877
Каприн Андрей Дмитриевич – акад. РАН, акад. РАО, д-р мед. наук, проф., ген. дир. ФГБУ «НМИЦ радиологии», дир. МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии». E-mail.ru: contact@nmicr.ru; ORCID: 0000-0001-8784-8415
Andrey D. Kaprin – Acad. RAS, Acad. RAE, Dr. Sci. (Med.), Professor, General Director of the National Medical Research Center of Radiology, Director of Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology. E-mail: contact@nmicr.ru; ORСID: 0000-0001-8784-8415
Зикиряходжаев Азиз Дильшодович – д-р мед. наук, проф., рук. отд-ния онкологии и реконструктивно-пластической хирургии молочной железы и кожи МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии», доц. каф. онкологии и радиотерапии ИПО ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: azizz@mail.ru; ORCID: 0000-0001-7141-2502
Aziz D. Zikiryakhodzhaev – Dr. Sci. (Med.), Professor, Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology, Sechenov First Moscow State Medical University (Sechenov University).
E-mail: azizz@mail.ru; ORCID: 0000-0001-7141-2502
Прокопенко Сергей Павлович – канд. мед. наук, доц., зав. отд-нием комплексной диагностики и интервенционной радиологии в маммологии Национального центра онкологии репродуктивных органов МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии», зав. каф. клинической маммологии, лучевой диагностики и лучевой терапии фак-та непрерывного медицинского образования Медицинского института ФГАОУ ВО РУДН. E-mail: procopenkosp@gmail.com; ORCID: 0000-0002-0369-5755
Sergey P. Prokopenko – Cand. Sci. (Med.), Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology, Patrice Lumumba Peoples' Friendship University of Russia. E-mail: procopenkosp@gmail.com; ORCID: 0000-0002-0369-5755
Сарибекян Эрик Карлович – д-р мед. наук, вед. науч. сотр. отд-ния онкологии и реконструктивно-пластической хирургии молочной железы и кожи МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии». E-mail: mammolog3@yandex.ru; ORCID: 0000-0003-0827-7998
Eric K. Saribekyan – Dr. Sci. (Med.), Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology. E-mail: mammolog3@yandex.ru; ORCID: 0000-0003-0827-7998
Рассказова Елена Александровна – канд. мед. наук, науч. сотр. отд-ния онкологии и реконструктивно-пластической хирургии молочной железы и кожи МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии». E-mail: rasskaz2@yandex.ru; ORCID: 0000-0003-0307-8252
Elena A. Rasskazova – Cand. Sci. (Med.), Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology. E-mail: rasskaz2@yandex.ru; ORCID: 0000-0003-0307-8252
Мазо Михаил Львович – канд. мед. наук, ст. науч. сотр. отд-ния комплексной диагностики и интервенционной радиологии в маммологии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии», доц. каф. каф. клинической маммологии, лучевой диагностики и лучевой терапии фак-та непрерывного медицинского образования Медицинского института ФГАОУ ВО РУДН. ORCID: 0000-0002-1313-6420
Mikhail L. Mazo – Cand. Sci. (Med.), Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology, Patrice Lumumba Peoples' Friendship University of Russia. ORCID: 0000-0002-1313-6420
Занозина Екатерина Алексеевна – аспирантка отд-ния онкологии и реконструктивно-пластической хирургии молочной железы и кожи в МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии». E-mail: zanozinaekaterina@gmail.ru; ORCID: 0000-0003-2050-142X
Ekaterina A. Zanozina – Graduate Student, Herzen Moscow Research Oncology Institute – branch of the National Medical Research Center of Radiology. E-mail: zanozinaekaterina@gmail.ru; ORCID: 0000-0003-2050-142X
Поступила в редакцию: 03.11.2023
Поступила после рецензирования: 08.11.2023
Принята к публикации: 09.11.2023
Received: 03.11.2023
Revised: 08.11.2023
Accepted: 09.11.2023
Список исп. литературыСкрыть список1. Classe JM, Loaec C et al. Sentinel lymph node biopsy without axillary lymphadenectomy after neoadjuvant chemotherapy is accurate and safe for selected patients: the GANEA 2 study. Breast Cancer Res Treat 2019; 173 (2): 343–52.
2. Boughey JC, Suman VJ et al. Alliance for Clinical Trials in Oncology. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial. JAMA 2013; 310 (14): 1455–61.
3. Kuehn T, Bauerfeind I et al. Sentinel-lymph-node biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): a prospective, multicentre cohort study. Lancet Oncol 2013; 14 (7): 609–18.
4. Boileau JF, Poirier B, Basik M et al. Sentinel node biopsy after neoadjuvant chemotherapy in biopsy-proven node-positive breast cancer: the SN FNAC study. J Clin Oncol 2015; 33 (3): 258–64.
5. Volkova YuI, Zikiryakhodzhayev AD et al. Biopsy of the sentinel lymph node and targeted axillary lymph node dissection in patients with breast cancer after neoadjuvant chemotherapy. P.A. Herzen Journal of Oncology 2022; 11 (6): 44–8.
6. Natsiopoulos I, Intzes S et al. Axillary Lymph Node Tattooing and Targeted Axillary Dissection in Breast Cancer Patients Who Presented as cN+ Before Neoadjuvant Chemotherapy and Became cN0 After Treatment. Clin Breast Cancer 2019; 19 (3): 208–15.
7. Patel R, MacKerricher W et al. Pretreatment Tattoo Marking of Suspicious Axillary Lymph Nodes: Reliability and Correlation with Sentinel Lymph Node. Ann Surg Oncol 2019; 26 (8):
2452–8.
8. Sun J, Henry DA, Carr MJ et al. Feasibility of Axillary Lymph Node Localization and Excision Using Radar Reflector Localization. Clin Breast Cancer 2021; 21 (3): e189–e193.
9. Lowes S, Bell A et al. Use of Hologic Localizer radiofrequency identification (RFID) tags to localise impalpable breast lesions and axillary nodes: experience of the first 150 cases in a UK breast unit. Clin Radiol 2020; 75 (12): 942–9.
10. Swarnkar PK, Tayeh S et al. The Evolving Role of Marked Lymph Node Biopsy (MLNB) and Targeted Axillary Dissection (TAD) after Neoadjuvant Chemotherapy (NACT) for Node-Positive Breast Cancer: Systematic Review and Pooled Analysis. Cancers (Basel) 2021; 13 (7): 1539.

