Клинический разбор в общей медицине №8 2023
1 Kemerovo State Medical University, Kemerovo, Russia;
2 Berezovsk City Hospital named A.M. Nazarenko, Berezovsky, Kemerovo region, Russia
eka-pl@rambler.ru
Abstract
Dietary imbalances and overeating can lead to a common disease today - obesity. Apart from aesthetic considerations, obesity is defined as an excess of adipose tissue, which can lead to serious health problems and predispose to a number of pathological changes and clinical diseases such as diabetes, hypertension, atherosclerosis, coronary heart disease, obstructive sleep apnea, depression, arthropathy weight-related diseases, as well as endometrial and breast cancer. Body weight exceeding the ideal weight for age, sex and height by 20% poses a serious health risk. Bariatric surgery is a comprehensive surgical treatment for morbid obesity when other treatments such as diet, increased physical activity, behavior modification and medications have failed. The two most common procedures used today are sleeve gastrectomy and Roux-en-Y gastric bypass. These procedures have gained popularity recently and are generally considered safe and effective. The article describes common and standard disorders in the digestive system that occur after bariatric surgery. A clinical example of a patient’s history after sleeve gastrectomy is also given, who was not observed and did not carry out the standard necessary postoperative measures.
Key words: bariatric surgery, long-term results, obesity, Roux-en-Y gastric bypass, sleeve gastrectomy, gastroenterological consequences of bariatric surgery, effectiveness, safety, quality of life.
For citation: Plotnikova E.Yu., Kolpinsky G.I., Semenchuk I.N., Krasnov K.A. Gastroenterological problems of bariatric surgery. Clinical review for general practice. 2023; 4 (8): 83–92 (In Russ.). DOI: 10.47407/kr2023.4.8.00335
Ожирение, признанное хроническим заболеванием, связано с системным воспалительным процессом низкой степени тяжести и иммунной дисфункцией [1, 2]. Предполагается, что длительное состояние воспаления приводит к нарушению гомеостатических механизмов и, как следствие, к метаболическим расстройствам, обычно связанных с ожирением опосредованными не до конца изученными путями, включающими продукцию цитокинов, адипокинов, гормонов и реагентов острой фазы [3]. Эпидемия ожирения продолжает расти во всем мире [4, 5]. На сегодняшний день опубликованы сотни исследований о мировой эпидемии ожирения и глобальном опыте метаболической и бариатрической хирургии (БХ), что значительно улучшило понимание ожирения и его лечения [6, 7].
Глобальные рекомендации по БХ были установлены после консенсусной конференции Национального института здравоохранения в 1991 г. Именно тогда было признано, что проводимые ранее бариатрические операции, такие как еюноилеальное шунтирование, несут существенные долгосрочные риски. Таким образом, идея хирургического лечения ожирения в первую очередь была отвергнута. В течение следующих нескольких лет ограниченные доказательства безопасности и эффективности БХ были опровергнуты. Впоследствии консенсусная комиссия решила, что такие пособия, как желудочное шунтирование по Ру (RYGB) и вертикальная гастропластика (VGB), безопасны и эффективны для пациентов с индексом массы тела (ИМТ) ≥40 кг/м2 или с ИМТ≥35 кг/м2 и сопутствующими медицинскими осложнениями ожирения [8]. В итоге был установлен ранее отсутствовавший стандарт практики, и в это же время данный вид хирургии был узаконен как хирургическая дисциплина. С тех пор база клинических данных по БХ значительно выросла.
БХ в настоящее время является единственным эффективным методом лечения патологического ожирения, который приводит к существенной и устойчивой потере массы тела, ремиссии сопутствующих заболеваний, связанных с ожирением, и улучшению качества жизни в долгосрочной перспективе [9–11]. В многочисленных исследованиях по БХ сообщалось о значительном улучшении метаболических заболеваний, а также снижении общей смертности, что еще раз подтверждает важность этого метода лечения [13, 14]. Одновременно широко сообщается о безопасности БХ [15–17]. Послеоперационная смертность очень низкая и колеблется от 0,03% до 0,2% [18]. Таким образом, неудивительно, что бариатрические операции стали одними из наиболее часто выполняемых операций в общей хирургии [19].
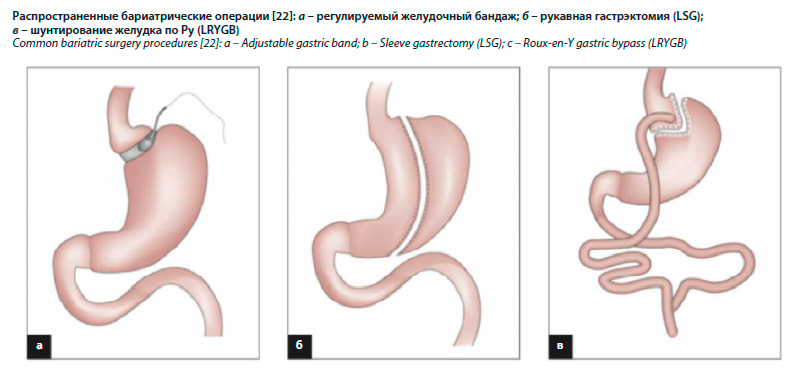
Ежегодное количество бариатрических процедур, выполняемых во всем мире, в настоящее время составляет около 700 тыс. Двумя наиболее распространенными бариатрическими процедурами являются лапароскопическая рукавная резекция желудка (LSG) и лапароскопическое шунтирование желудка по Ру (LRYGB) (см. рисунок). Лапароскопическая рукавная гастрэктомия является наиболее часто выполняемой бариатрической процедурой с 2014 г. и до сих пор демонстрирует устойчивый ежегодный рост как количества, так и доли всех бариатрических хирургических процедур [20]. Этот сдвиг в глобальном предпочтении LSG по сравнению с LRYGB произошел до того, как были доступны адекватные долгосрочные данные по LSG [21]. В настоящее время бариатрические операции выполняются с использованием минимально инвазивных хирургических подходов (лапароскопических или роботизированных).
Россия имеет свой Национальный бариатрический реестр, который был создан в 2013 г. [23]. Это ресурс, где все бариатрические хирурги России вносят данные о проведенных операциях, наблюдениях за пациентами и, по возможности, результаты их похудения. С 2013 по 2020 г. в России выполнено 16 980 бариатрических операций. Самой популярной операцией в России в этот период стала продольная резекция желудка (49% всех операций). Бандажирование желудка (пик популярности – 2013–2015 гг.) и мини желудочное шунтирование желудка (активно набирает популярность в последние годы) расположились соответственно на втором и третьем местах [24]. А за последние три года по сегодняшний день в России проведено еще 18 245 бариатрических операций, из них 51% – LSG [23].
S. Grönroos и соавт. в рандомизированном клиническом исследовании с участием 240 пациентов с морбидным ожирением выявили, что среднее процентное снижение лишней массы тела за 7 лет составило 47% после LSG против 55% после LRYGB, но разница не была клинически значимой. Качество жизни, связанное с заболеванием, и общее качество жизни в обеих группах были схожими [25].
БХ имеет значительные преимущества для здоровья, такие как уменьшение гипергликемии или нормализация уровня глюкозы в крови, снижение артериального давления и уровня холестерина, а также улучшение состояния при обструктивном апноэ во сне, микро- и макрососудистых осложнениях, связанных с диабетом. Хирургические методы бариатрических вмешательств разнообразны и включают в себя разные вмешательства. Когда они включают «обход» двенадцатиперстной кишки, также происходит снижение гормона грелина и увеличение GLP-1 (глюкагоноподобный пептид 1) и PYY (панкреатический тирозин-тирозиновый пептид), что улучшает чувствительность к инсулину, а также другие метаболические параметры [26].
БХ приводит к более значительному снижению массы тела и гораздо эффективнее при лечении диабета 2-го типа у пациентов с ожирением, чем нехирургические методы лечения. Долгосрочные наблюдения также показали, что достигнутые результаты сохраняются более пяти лет после операции. Однако факторы прогнозирования долгосрочных осложнений, долгосрочной выживаемости, а также влияния на психическое здоровье пациентов и затраты на восстановление должны постоянно обновляться [27].
БХ, как и любые другие хирургические пособия, имеет свои риски, некоторые из них представляют собой опасные для жизни долгосрочные осложнения алиментарного характера. Часто после этой процедуры у пациентов развивается анемия сложного генеза, происходят потери кальция и витаминов, которые необходимо замещать на протяжении всей жизни. Некоторые из потенциально тяжелых осложнений БХ – это дефицит микро- и макронутриентов. Кроме того, могут возникать стеноз и/или изъязвление анастомоза, рефлюкс-эзофагит и другие заболевания желудочно-кишечного тракта, а также желчнокаменная болезнь, стеатогепатит, изменение фармакокинетики и фармакодинамики пероральных лекарственных препаратов [28–30]. Дополнительные риски, которые часто упускаются из виду: рецидивирующий оксалатно-кальциевый уролитиаз и остеопороз. Оба осложнения чаще описываются после LRYGB, минующей двенадцатиперстную кишку, где преимущественно всасывается кальций. К сожалению, после LRYGB было описано повышенное выделение оксалатов, которое обычно трудно поддается лечению. Низкий уровень кальция в моче согласуется с мальабсорбцией кальция. Несмотря на это, остеопороз, связанный с LRYGB, не связан с изменениями массы тела или метаболизмом витамина D [31].
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ). Ожирение является важным фактором риска развития ГЭРБ и связанных с ним осложнений. Обычно снижение массы тела после модификации образа жизни значительно облегчает симптомы ГЭРБ. Что касается БХ и ее влияния на ГЭРБ, исследования показали несоответствие между различными типами БХ. LSG связана с увеличением заболеваемости ГЭРБ после этой процедуры за счет уменьшения послеоперационного угла Гиса и повышения внутрижелудочного давления. Бандажирование желудка улучшает симптомы ГЭРБ в краткосрочной перспективе; однако у небольшой группы пациентов в долгосрочной перспективе возвращаются симптомы рефлюкса и эзофагита. Наиболее эффективной бариатрической процедурой для облегчения ГЭРБ является LRYGB, эффективность которой, как сообщается, аналогична эффективности фундопликации по Ниссену. Поскольку бариатрические операции по-разному влияют на анатомию и физиологию желудочно-кишечного тракта, важно оценивать сопутствующие заболевания пациентов при рассмотрении различных вариантов бариатрических операций. На основании анализа исследований T. Stefura и соавт. показали, что LRYGB обеспечивает наилучшее облегчение симптомов, связанных с ГЭРБ и сопутствующими заболеваниями [32]. Некоторые авторы сообщают о формировании пищевода Барретта de novo после LSG [33, 34].
Демпинг-синдром. Его распространенность составляет 75% после операции шунтирования по Ру и 45% после вертикальной рукавной резекции желудка [35]. Выделяют два типа демпинг-синдрома.
Ранний демпинг-синдром возникает в ближайшем постпрандиальном периоде (через 10–30 мин) вследствие воздействия на тонкую кишку непереваренных углеводов. Они вызывают внутрипросветную кишечную гиперосмолярность, которая приводит к вторичной осмотической диарее с попаданием интерстициальной и внутрисосудистой жидкости в просвет кишки. Связанная с этим потеря эндоваскулярного объема часто приводит к артериальной гипотензии. Этот общий процесс активирует вазоактивные кишечные пептиды (нейротензин, VIP, серотонин, вещество Р и катехоламины), которые вызывают сердцебиение, потоотделение и ощущение «приливов» [36].
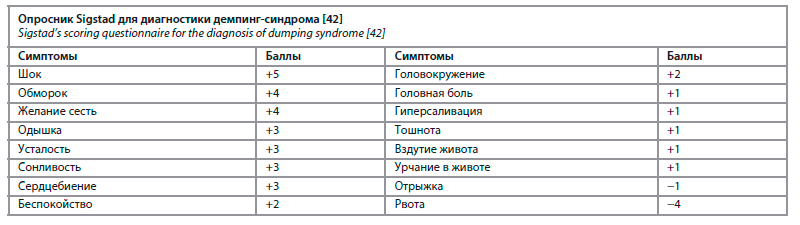
Синдром позднего демпинга, в свою очередь, проявляется через 2–4 ч после приема пищи по типу гипогликемии, которая может привести к утрате сознания, судорогам или даже смерти. В случае шунтирования по Ру распространенность такого демпинг-синдрома составляет 0,2–6,6% [37]. Одним из наиболее широко распространенных патофизиологических механизмов является быстрое всасывание глюкозы, которое стимулирует высвобождение энтероглюкагона и вызывает гиперинсулинемию, приводящую к гипогликемии [36]. Другие исследования связывают гипогликемию с нарушением функции бета-клеток поджелудочной железы, вторичной по отношению к диабету до операции и/или резистентности к инсулину, что приводит к гиперсекреции инсулина [38, 39]. Более поздние исследования показали, что в случае ускоренного опорожнения желудка возникает гиперсекреция и/или гиперчувствительность глюкагоноподобного пептида 1 (GLP-1). Этот пептид стимулирует выработку инсулина, тем самым вызывая гипогликемию [40, 41]. Диагноз ставится на основании опросника Sigstad (диагноз подтверждается при сумме >7 баллов; см. таблицу) и/или пероральном тесте на глюкозу, который включает в себя введение большой дозы глюкозы для провокации симптомов [42].
Постваготомический синдром. Ваготомия может быть выполнена намеренно, чтобы вызывать быстрое насыщение, или случайно, как интраоперационное осложнение [43]. Характерные клинические признаки включают быстрое чувство насыщения, рвоту, а в 10% случаев может возникнуть диарея. В патофизиологические механизмы, лежащие в основе этих симптомов, вовлечены измененная микробиота, гипомоторика и желудочная гипохлоргидрия. Октреотид может быть хорошим вариантом лечения диареи, вызванной постваготомическим синдромом [44].
Синдром короткой кишки. Синдром короткой кишки возникает примерно у 4–6,4% всех пациентов после LRYGB из-за чрезмерного уменьшения площади всасывающей поверхности кишечника. Не существует достаточно чувствительного или специфического теста для диагностики синдрома короткой кишки, поэтому данный диагноз определяется как диагноз-исключение. Лечение состоит из поддерживающих мероприятий в виде энтерального питания. Если возможно, следует попытаться восстановить нормальную анатомию с помощью реверсивной хирургии. В рефрактерных случаях рекомендуется парентеральное питание [45].
Мальабсорбция углеводов. Существует несколько типов мальабсорбции углеводов, наиболее важными из которых являются лактоза, фруктоза и сахароза. Лактоза – это углевод, который усваивается под действием фермента лактазы. Влияние БХ как феномена, усугубляющего это состояние, неясно, хотя одно скандинавское исследование продемонстрировало, что уровень непереносимости лактозы наблюдается у 30% пациентов после бариатрических операций [46]. Когда лактоза не всасывается, она достигает толстой кишки неповрежденной, создавая гиперосмолярное состояние, вызывающее осмотическую диарею. Кроме того, сапрофитная флора толстой кишки метаболизирует лактозу с образованием короткоцепочечных жирных кислот, углекислого газа, водорода и метана. Это, в свою очередь, приводит к характерной клинической триаде: вздутию живота, диарее и метеоризму. Диагностика мальабсорбции лактозы основывается на реакции пациента на тестовую диету. Также можно провести водородный дыхательный тест с лактозой, хотя его информативность после БХ ограничена. Лечение основано на диете, исключающей лактозу, и/или заместительной терапии лактазой [47].
Мальабсорбция белка. Большинство макро- и микроэлементов, включая белки, всасываются в средней и дистальной части тощей кишки [48]. Некоторые методы БХ, например LRYGB, выключают эти сегменты, что может привести к нарушению белковой мальабсорбции. Гипоальбуминемия возникает у 18% всех пациентов, перенесших операцию по выключению двенадцатиперстной кишки [49]. Гипоальбуминемия, в свою очередь, связана с диареей или алиментарной недостаточностью питания и сходна с болезнью Квашиоркора [50]. Парентеральное питание считается важным терапевтическим вариантом. В определенных ситуациях следует предпринять попытки восстановить анатомию путем реверсивной хирургии.
Кишечная микрофлора. Хирургическое лечение ожирения приводит к изменениям кишечной микробиоты (КМ) или микробного пейзажа кишечника. У пациентов, перенесших RYGB, в большинстве исследований наблюдалось увеличение количества Bacteroidetes (В), Actinobacteria (A), Proteobacteria (P) и их разнообразия, причем соотношение Firmicutes (F)/B не было постоянным. Было продемонстрировано, что LRYGB, в отличие от LSG, существенно уменьшает разнообразие кишечной микробиоты [51] параллельно с увеличением доли Gammaproteobacteria и уменьшением количества Clostridium [52]. После LSG наблюдалось увеличение доли B и P, при этом не было сообщений об A или консенсуса по соотношению F/B. При обеих хирургических процедурах сообщалось об уменьшении доли F. Масштаб изменений численности бактерий также неизвестен. Результаты противоречивы, различаются в зависимости от хирургической процедуры и могут меняться в зависимости от изучаемого послеоперационного периода; таким образом, невозможно сказать, будут ли изменения в КМ постоянными. Кроме того, в доступной литературе невозможно провести различие между тем, вызваны ли изменения проведением LSG (гормональными, анатомическими, функциональными и микробиологическими факторами), а не изменениями в диете и образе жизни, которые также происходят после операции. На данный момент нецелесообразно указывать величину влияния изменений КМ как фактора, способствующего снижению массы тела и улучшению метаболизма после БХ [53]. Интересно, что изменения КМ после БХ в настоящее время предлагаются как один из механизмов, объясняющих благоприятные клинические результаты БХ, которые позволяют частично купировать дисбиоз слизистой оболочки желудка, наблюдаемый при ожирении. Некоторые из характеристик КМ, измененных после БХ (состав с точки зрения бактерий и функций), связаны с положительными результатами БХ, такими как снижение массы тела и/или улучшение метаболизма. Тем не менее изменения КМ после БХ демонстрируют значительную вариабельность от одного пациента к другому. Таким образом, все еще необходимы дальнейшие исследования большого размера выборки, чтобы полностью расшифровать роль КМ в клинических улучшениях, наблюдаемых после бариатрической операции [54].
Синдром избыточного бактериального роста (SIBOS), определяемый как избыточное количество бактерий в тонкой кишке [55], имеет распространенность 2,5% у здоровых людей [56] и до 41% у пациентов с ожирением [57]. После бариатрических операций существует повышенный риск формирования избыточного бактериального роста из-за хирургических анастомозов [58]. По сути, зоны анастомоза представляют собой точки измененной подвижности, особенно анастомозы «конец в бок», где имеется слепой конец, действующий как резервуар. Клинические проявления избыточного бактериального роста включают диарею и боли в животе, иногда сопровождающиеся внекишечными проявлениями, такими как полиартрит и поражения кожи [59]. В идеале диагноз основывается на посеве аспирата тощей кишки (>104 КОЕ/мл), хотя доступность этого метода низкая. В клинической практике обычно проводят водородный дыхательный тест с глюкозой/лактулозой (ЛВДТ), имеющий чувствительность и специфичность 62% и 83% соответственно [60]. Бразильская группа исследователей описала частое возникновение избыточного бактериального роста в культе желудка после LRYGB или LSG у пациентов с морбидным ожирением при оценке после среднего периода наблюдения 7,3 года [59]. Последствия SIBOS после БХ не изучены. Питательные вещества, непереваренные в тонкой кишке из-за SIBOS, могут привести к повышению уровня коротко- и среднецепочечных жирных кислот в результате их метаболизма в толстой кишке, что приводит к более высокому поглощению калорий [61, 62]. Однако данные об ожидаемом снижении массы тела противоречивы [63]. Измененная анатомия с исключенными сегментами тонкой кишки серьезно затрудняет диагностические мероприятия; аспирация и посев могут оказаться невозможными, несмотря на передовые эндоскопические методы, а тестирование дыхания лежит в основе тех же ограничений [64].
SIBOS может проявляться более серьезными симптомами. В серии случаев у двух пациенток, перенесших LRYGB, наблюдалось повышение уровня выдыхаемого водорода (ЛВДТ) в сочетании со снижением общей массы тела на 52% и 34% в течение 21 и 15 мес после операции соответственно, сопровождалось астенией, алопецией, отеками и гипоальбуминемией (до 24 г/л и 34 г/л соответственно). Обе пациентки получали 30-дневную терапию ципрофлоксацином и тетрациклином, что привело к разрешению их симптомов [65]. Хотя ретроспективный характер исследований и небольшой размер выборки не позволяют сделать убедительные выводы о роли SIBOS как потенциальной причины стойкого дефицита витаминов и общей белковой недостаточности у пациентов, перенесших бариатрическую операцию, необходимо применять диагностику с помощью ЛВДТ и антибиотикотерапию при необходимости. Своевременная диагностика SIBOS у бариатрических пациентов с аномальными желудочно-кишечными симптомами может помочь в выборе соответствующей антибиотикотерапии и предотвратить потенциальную заболеваемость, вызванную длительным дефицитом витаминов, желудочно-кишечными расстройствами, общей белковой недостаточностью и/или субоптимальным снижением массы тела. При правильной терапии можно добиться облегчения симптомов у этих пациентов и предотвращения развития серьезных осложнений, таких как энцефалопатия Вернике [66].
Антибиотик-ассоциированные кишечные осложнения. БХ в сочетании с антибиотикотерапией – либо в качестве профилактики, либо в качестве терапии в случае осложнений – является фактором риска колита, вызванного C. difficile [67]. Это заболевание проявляется воспалительным колитом, вызывающим вторичную диарею и энтеропатию с потерей белка. Его следует заподозрить, если острая диарея возникает в ближайшем послеоперационном периоде или после операции на фоне предшествующей терапии антибиотиками. Диагноз основывается на обнаружении микробного токсина в кале. Обычно лечение проводится только пероральными антибиотиками, метронидазолом и ванкомицином. Учитывая анатомические изменения после БХ и фармакокинетику метронидазола (он почти полностью всасывается в тонкой кишке), внутривенный ванкомицин может быть предпочтительным вариантом первичного лечения [68]. Трансплантация фекальной микробиоты является новым методом лечения рецидивирующих инфекций, который также вызвал интерес в бариатрическом сообществе из-за его влияния на уменьшение массы тела [69].
Мальабсорбция желчных кислот. Нарушение всасывания солей желчных кислот вызывает диарею без болей в животе. Роль желчных кислот в развитии морбидного ожирения, его коморбидности и снижения массы тела у постбариатрических пациентов вызывает повышенный интерес, поскольку они, по-видимому, играют важную роль в послеоперационном метаболическом улучшении. Целью интереса являются FX- и TGR5-рецепторы и их влияние на метаболизм желчных кислот с последующим усилением гормонального, в частности инкретинового, ответа и изменением состава кишечной микробиоты [70, 71]. Соли желчных кислот преимущественно всасываются в подвздошной кишке (95%), а любые анатомические или функциональные изменения на уровне подвздошной кишки, вызванные БХ, могут привести к нарушению всасывания солей желчных кислот. Заболевание может быть также связано с холецистэктомией (до или одновременно с бариатрической операцией) и ваготомией [72].
Экзокринная недостаточность поджелудочной железы (EPI). LSG и LRYGB могут сформировать вторичную EPI, приводящую к стеаторее [73, 74] с последующим дефицитом жирорастворимых витаминов. В зависимости от варианта LRYGB, проксимального или дистального, распространенность EPI составляет до 19–48% соответственно [73]. Изменения калорийности, состава и физических свойств блюд после LRYGB приводят к снижению и нескоординированности реакции поджелудочной железы на пищевые стимулы. Измененная анатомия после LRYGB приводит к сокращению времени контакта ферментов с химусом. Кроме того, деградация ферментов поджелудочной железы ускоряется при отсутствии химуса в билиопанкреатическом отделе двенадцатиперстной кишки [75]. В редких случаях выполняется левосторонняя резекция поджелудочной железы по поводу демпинг-синдрома, что приводит к первичной эндо- и экзопанкреатической недостаточности [76]. Тестирование на EPI оказывается трудным из-за измененной анатомии. Заместительная терапия ферментами поджелудочной железы с удалением их кислотоустойчивого покрытия является основой лечения EPI [75].
Запор является частым побочным эффектом после желудочного бандажирования, LSG и LRYGB. Его распространенность после бариатрических процедур колеблется от 7% до 39%. Этиология включает недостаточное потребление жидкости в послеоперационной диете, применение витаминных и минеральных добавок, таких как кальций и железо, а также применение опиоидов в качестве послеоперационных анальгетиков. Диетологическое лечение должно быть сосредоточено на повышенном потреблении воды или негазированных сладких напитков и пищевых волокон, содержащихся в фруктах, овощах и цельнозерновых крупах [77, 78].
Холелитиаз. Распространенным поздним послеоперационным осложнением со стороны желудочно-кишечного тракта, возникающим при быстром снижении массы тела в результате БХ, является образование камней в билиарном тракте [79]. Частота развития желчных камней после БХ колеблется от 22% до 71% [80, 81]. При оценке эффективности урсодезоксихолевой кислоты (УДХК) в снижении образования желчных камней при бандажировании желудка и LRYGB исследования показали значительно более низкие показатели образования желчных камней в этих группах по сравнению с пациентами, принимавшими плацебо или ибупрофен соответственно [82]. Таким образом, рекомендуется регулярное использование УДХК во время быстрого снижения массы тела (6 мес после LRYGB), что снижает скорость образования желчных камней до менее чем 5% [83, 84]. УДХК значительно снижает риск образования как бессимптомных, так и симптоматических желчных камней после бариатрической операции. Доза не менее 600 мг/сут связана с улучшенным соблюдением режима лечения и лучшими результатами, независимо от типа операции. УДХК следует рассматривать как часть стандартного пакета послеоперационного ведения пациента после бариатрической операции.
Клинический пример. Мы приводим фрагменты истории болезни пациента, которому была выполнена лапаротомная рукавная резекция желудка в 2017 г., но не проводилось медицинское наблюдение – ни ранней, ни поздней реабилитации. Пациент Т., 50 лет, в стационаре одной из ЦРБ Кемеровской области: на обходе 03.03.2023. Жалобы на резкую слабость, сильную отечность, особенно ног, осиплость голоса, огромное грыжевое выпячивание по средней линии живота. Доставлен бригадой скорой медицинской помощи с диагнозом анасарка неясного генеза. В 2017 г. проведена лапаротомная бариатрическая операция (в Новосибирске), общее снижение массы тела составило более 100 кг (исходная масса тела – 186 кг при росте 185 см) в течение 1,5 года. После операции были даны общие рекомендации по питанию и физической нагрузке, больше пациент ни разу не был у врача по поводу перенесенного оперативного пособия. В августе 2022 г. появилась желтуха и приступообразные боли в правом подреберье, при обследовании – множественные камни желчного пузыря и холедоха. Выполнены холецистэктомия с холедохотомией, литоэкстракция, наложен билиодигестивный анастомоз. В ноябре 2022 г. язвенное кровотечение культи желудка, ушивание язвенного дефекта. Три недели назад появились отеки, самостоятельно принимал фуросемид – без эффекта, при обращении к участковому врачу отправлен в стационар.
Объективные данные: состояние тяжелое. Замедленная речь. Кожные покровы и видимые слизистые бледные, анасарка, множественные гематомы. Саркопения. Масса тела – 86 кг. Дыхание с жестким оттенком, значительно ослаблено или отсутствует в нижних отделах, частота дыхательных движений – 18–20 в мин. Границы сердца перкуторно увеличены влево до 1–2 см, тоны приглушенные, ритмичные, систолический шум на верхушке и в точке Боткина, частота сердечных сокращений – 109 в секунду, артериальное давление – 130/75 мм рт. ст. Язык со сглаженными сосочками, ярко-красная кайма. Живот значительно увеличен за счет асцита и грыжевого выпячивания по всей белой линии живота 30×20 см, под кожей пальпируются петли вздутой кишки. Печень 10–12–14 см по Курлову, край при пальпации плотный, округлый, безболезненный. Стул кашицеобразный с кусочками непереваренной пищи до 5–7 раз в сутки. Мочеиспускание редкое, малыми порциями.
Данные обследования при поступлении: Нb – 97 г/л; эритроциты – 2,68×1012; макроцитоз, анизоцитоз; лейкоциты – 5,6×109; тромбоциты – 78×109; СОЭ – 8 мм/ч. Анализ мочи без патологии. Биохимические анализы крови: глюкоза – 5,9 ммоль/л; мочевина – 5,3 ммоль/л; креатинин – 111,0 мкмоль/л; общий белок – 51,6 г/л; билирубин общий – 42,3 мкмоль/л (26,9 прямой);
аланинаминотрансфераза – 42,3 Ед/л; аспартатаминотрансфераза – 91,2 Ед/л; щелочная фосфатаза – 150,19 Ед/л; фибриноген – 6,6 г/л; общий холестерин – 1,0 ммоль/л, триглицериды – 0,48 ммоль/л; сывороточное железо – 3,5 мкмоль/л; активированное частичное тромбопластиновое время – 41,0 с. Электрокардиография (ЭКГ): синусовый ритм, частота сердечных сокращений – 96 в минуту. Полугоризонтальное положение электрической оси. Замедление проведения по правой ножке пучка Гиса. Снижен вольтаж ЭКГ. Гипертрофия левого желудочка. Удлинение интервала QT до 0,33.
Мультиспиральная компьютерная томография (МСКТ) органов грудной клетки: двусторонний малый гидроторакс. КТ-признаки очагового уплотнения в верхней доле правого легкого. Фиброзные изменения легких с обеих сторон, участок консолидации в нижней доле правого легкого (вероятно, поствоспалительного характера).
МСКТ органов брюшной полости: гепатоспленомегалия. Выраженный стеатоз печени (до 20 HU). КТ-признаки аэробилии. Жировая инфильтрация поджелудочной железы, парапельвикальные кисты почек. Грыжа передней брюшной стенки больших размеров, состояние после оперативного лечения желудка.
Диагноз: состояние после рукавного гастрошунтирования. Гипопротеинемия, анасарка (асцит, двусторонний гидроторакс, периферические отеки). Анемия средней степени тяжести (железодефицитная + В12-дефицитная). Желчнокаменная болезнь, состояние после холецистэктомии, гепатикоеюностомии. Гигантская
постлапаротомическая вентральная грыжа. Стеатогепатит, легкой степени тяжести. Липоматоз поджелудочной железы. Синдром избыточного бактериального роста (СИБР). Дислипидемия по типу выраженной гипохолестеринемии.
Проведено лечение и даны дальнейшие рекомендации:
• питание с повышенным содержанием белка;
• гемотрансфузии;
• инфузии альбумина;
• УДХК 1000 мг/сут;
• орнитин-аспартат 1 саше 3 раза в сутки;
• антибиотикотерапия системная;
• панкреатин;
• диуретическая терапия (спиронолактон);
• деконтаминация кишечника – топические энтеросептики;
• пробиотики, поливитамины и микроэлементы.
Витамин В12 по 1000 мкг 1 раз в 2 недели 3 мес, затем 1 раз в 3 мес пожизненно. Состояние несколько улучшилось, проявления отечного синдрома значительно уменьшились. Выписан с рекомендациями на амбулаторное лечение.
16.04.2023 пациент Т., 50 лет, поступил в хирургическое отделение городской больницы Кемерово с диагнозом: перитонит на фоне гигантского межкишечного абсцесса с прорывом в брюшную полость. На фоне тяжелой интоксикации развился сепсис, двусторонняя пневмония, полиорганная недостаточность... Несмотря на хирургическое пособие, интенсивную терапию пациент Т. 17.04.2023 умер.
Что было бы, если бы пациенту Т. была выполнена не лапаротомная, а лапароскопическая бариатрическая операция? Сформировалась бы гигантская вентральная грыжа на фоне выраженной саркопении? Были ли даны индивидуальные рекомендации по питанию, физической нагрузке? Масса тела должна уходить не стремительно, в идеале – не более 4 кг в месяц. Необходимы ранние нутриционная и диетическая поддержка каждому бариатрическому пациенту. Назначили ли УДХК из расчета не менее 10 г на килограмм массы тела? При постоянном приеме УДХК риск билиарного литолиза минимальный. Назначили ли поливитамины, микроэлементы, витамин В12 по 1000 мкг 1 раз в 3 мес подкожно? Для лечения и контроля СИБРа периодически проводились ли курсы кишечной деконтаминации? Один раз в год (первый год каждые три месяца) исследовались ли основные показатели углеводного, липидного, белкового обменов, уровень железа и витамина В12?
И еще много вопросов...
Наверное, при наблюдении и своевременных рекомендациях, хотя бы гастроэнтеролога, пациент бы имел совершенно другое качество и количество жизни. Но, к сожалению, в описанной ситуации, сослагательное наклонение неприемлемо. Если мы вернемся к началу нашей статьи и вспомним статистику [https: //bareoreg.ru/]: в России c 2018 по 2023 г. выполнены 42 619 бариатрических операций, в том числе 6 786 за 2023 г. Количество наблюдений: c 2018 по 2023 г. – 26 687 и в том числе
4 734 за 2023 г. Мы видим, что более 1/2 пациентов остались без наблюдения, какова их судьба?
Настоящая статья демонстрирует, что БХ по сравнению с консервативной терапией снижает смертность и частоту сердечно-сосудистых заболеваний у людей с ожирением, при этом уровень смертности после бариатрических операций колеблется от 0% до 0,64% [85] – при корректном послеоперационном ведении пациентов. Крупные метаанализы показали, что сердечно-сосудистая и онкологическая смертность после БХ снизилась примерно вдвое по сравнению с соответствующей нехирургической когортой в исследованиях продолжительностью до 14 лет [86, 87]. После подробно проведенного нами анализа гастроэнтерологических долгосрочных осложнений и смертности становится ясно, что эти осложнения вполне курабельны, а польза от самой бариатрической операции превышает связанные с ней риски.
Разработка индивидуально подобранной программы реабилитации для каждого бариатрического пациента должна быть приоритетом для их комплексного ведения с использованием многопрофильного командного подхода. Многопрофильные команды предлагают лучшие послеоперационные результаты [88], решая вопросы качества снижения массы тела, медицинских и психиатрических сопутствующих заболеваний, психосоциальных проблем и физической инвалидности [89]. Чтобы обеспечить плавный переход от пре- к послеоперационной реабилитации, физическая и биопсихосоциальная модель реабилитации продолжает оставаться актуальной, акцент должен быть сделан на предотвращении хирургических осложнений, вторичной профилактике сердечно-сосудистых заболеваний, устранении нарушений, связанных с ожирением, психологических и социально-экологических барьеров, улучшении физической функции посредством адаптированной физической активности, обучения управлению питанием, а также реализации стратегий устойчивого управления весом. Каждый член многопрофильной команды должен предоставить подробную оценку нарушений, наметить стратегии профилактики и предложить решения по лечению заболеваний наряду с реализацией программы функционального восстановления. Программа функционального восстановления в послеоперационном периоде должна быть направлена не только на достижение заметного снижения массы тела, но и на предотвращение ее набора, прогрессирования сопутствующих заболеваний, связанных с ожирением, восстановление физического функционирования и повышение качества жизни, связанного со здоровьем [90].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Плотникова Екатерина Юрьевна – д-р мед. наук, проф. каф. поликлинической терапии, постдипломной подготовки врачей и ВСО, руководитель курса клинической гастроэнтерологии, ФГБОУ ВО КемГМУ. E-mail: eka-pl@rambler.ru; ORCID: 0000-0002-6150-1808
Ekaterina Yu. Plotnikova ‒ Dr. Sci. (Med.), Prof., Kemerovo State Medical University E-mail: eka-pl@rambler.ru; ORCID: 0000-0002-6150-1808
Колпинский Глеб Иванович – д-р мед. наук, проф. каф. онкологии, лучевой диагностики и лучевой терапии, ФГБОУ ВО КемГМУ. ORCID: 0000-0002-5526-2687
Gleb I. Kolpinsky – Dr. Sci. (Med.), Prof., Kemerovo State Medical University. ORCID: 0000-0002-5526-2687
Семенчук Ирина Николаевна – зав. терапевтическим отделением, ГБУЗ «Березовская городская больница им. А.М. Назаренко»
Irina N. Semenchuk – Head of the therapeutic department, Berezovsk City Hospital named A.M. Nazarenko
Краснов Константин Аркадьевич – канд. мед. наук, доц. каф. госпитальной хирургии, ФГБОУ ВО КемГМУ. E-mail: krasnov8k@rambler.ru; ORCID: 0000-0002-9262-3656
Konstantin A. Krasnov – Cand. Sci. (Med.), Kemerovo State Medical University. E-mail: krasnov8k@rambler.ru; ORCID: 0000-0002-9262-3656
Поступила в редакцию: 17.11.2023
Поступила после рецензирования: 20.11.2023
Принята к публикации: 23.11.2023
Received: 17.11.2023
Revised: 20.11.2023
Accepted: 23.11.2023
Клинический разбор в общей медицине №8 2023
Гастроэнтерологические проблемы бариатрической хирургии
Номера страниц в выпуске:83-92
Аннотация
Диетический дисбаланс и переедание могут привести к распространенному сегодня заболеванию – ожирению. Помимо эстетических соображений, ожирение определяется как избыток жировой ткани, который может привести к серьезным проблемам со здоровьем и предрасполагать к ряду патологических изменений и клинических заболеваний, таких как диабет, гипертония, атеросклероз, ишемическая болезнь сердца, обструктивное апноэ во сне, депрессия, артропатии, связанные с массой тела, а также рак эндометрия и молочной железы. Масса тела, превышающая идеальную для возраста, пола и роста на 20%, представляет собой серьезный риск для здоровья. Бариатрическая хирургия – это комплекс хирургических методов лечения патологического ожирения, когда другие методы лечения, такие как диета, повышенная физическая активность, изменение поведения и лекарства, не дали результата. Двумя наиболее распространенными процедурами, используемыми в настоящее время, являются рукавная гастрэктомия и желудочное шунтирование по Ру. Эти процедуры приобрели популярность в последнее время и в целом считаются безопасными и эффективными. В статье описаны распространенные и стандартные нарушения в системе пищеварения, возникающие после бариатрических операций. Также приводится клинический пример истории пациента после рукавной резекции желудка, который не наблюдался и не проводил стандартных необходимых постоперационных мероприятий.
Ключевые слова: бариатрическая хирургия, отдаленные результаты, ожирение, желудочное шунтирование по Ру, рукавная гастрэктомия, гастроэнтерологические последствия бариатрической операции, эффективность, безопасность, качество жизни.
Для цитирования: Плотникова Е.Ю., Колпинский Г.И., Семенчук И.Н., Краснов К.А. Гастроэнтерологические проблемы бариатрической хирургии. Клинический разбор в общей медицине. 2023; 4 (8): 83–92. DOI: 10.47407/kr2023.4.8.00335
Диетический дисбаланс и переедание могут привести к распространенному сегодня заболеванию – ожирению. Помимо эстетических соображений, ожирение определяется как избыток жировой ткани, который может привести к серьезным проблемам со здоровьем и предрасполагать к ряду патологических изменений и клинических заболеваний, таких как диабет, гипертония, атеросклероз, ишемическая болезнь сердца, обструктивное апноэ во сне, депрессия, артропатии, связанные с массой тела, а также рак эндометрия и молочной железы. Масса тела, превышающая идеальную для возраста, пола и роста на 20%, представляет собой серьезный риск для здоровья. Бариатрическая хирургия – это комплекс хирургических методов лечения патологического ожирения, когда другие методы лечения, такие как диета, повышенная физическая активность, изменение поведения и лекарства, не дали результата. Двумя наиболее распространенными процедурами, используемыми в настоящее время, являются рукавная гастрэктомия и желудочное шунтирование по Ру. Эти процедуры приобрели популярность в последнее время и в целом считаются безопасными и эффективными. В статье описаны распространенные и стандартные нарушения в системе пищеварения, возникающие после бариатрических операций. Также приводится клинический пример истории пациента после рукавной резекции желудка, который не наблюдался и не проводил стандартных необходимых постоперационных мероприятий.
Ключевые слова: бариатрическая хирургия, отдаленные результаты, ожирение, желудочное шунтирование по Ру, рукавная гастрэктомия, гастроэнтерологические последствия бариатрической операции, эффективность, безопасность, качество жизни.
Для цитирования: Плотникова Е.Ю., Колпинский Г.И., Семенчук И.Н., Краснов К.А. Гастроэнтерологические проблемы бариатрической хирургии. Клинический разбор в общей медицине. 2023; 4 (8): 83–92. DOI: 10.47407/kr2023.4.8.00335
Gastroenterological problems of bariatric surgery
Ekaterina Yu. Plotnikova1, Gleb I. Kolpinsky1, Irina N. Semenchuk2, Konstantin A. Krasnov11 Kemerovo State Medical University, Kemerovo, Russia;
2 Berezovsk City Hospital named A.M. Nazarenko, Berezovsky, Kemerovo region, Russia
eka-pl@rambler.ru
Abstract
Dietary imbalances and overeating can lead to a common disease today - obesity. Apart from aesthetic considerations, obesity is defined as an excess of adipose tissue, which can lead to serious health problems and predispose to a number of pathological changes and clinical diseases such as diabetes, hypertension, atherosclerosis, coronary heart disease, obstructive sleep apnea, depression, arthropathy weight-related diseases, as well as endometrial and breast cancer. Body weight exceeding the ideal weight for age, sex and height by 20% poses a serious health risk. Bariatric surgery is a comprehensive surgical treatment for morbid obesity when other treatments such as diet, increased physical activity, behavior modification and medications have failed. The two most common procedures used today are sleeve gastrectomy and Roux-en-Y gastric bypass. These procedures have gained popularity recently and are generally considered safe and effective. The article describes common and standard disorders in the digestive system that occur after bariatric surgery. A clinical example of a patient’s history after sleeve gastrectomy is also given, who was not observed and did not carry out the standard necessary postoperative measures.
Key words: bariatric surgery, long-term results, obesity, Roux-en-Y gastric bypass, sleeve gastrectomy, gastroenterological consequences of bariatric surgery, effectiveness, safety, quality of life.
For citation: Plotnikova E.Yu., Kolpinsky G.I., Semenchuk I.N., Krasnov K.A. Gastroenterological problems of bariatric surgery. Clinical review for general practice. 2023; 4 (8): 83–92 (In Russ.). DOI: 10.47407/kr2023.4.8.00335
Ожирение, признанное хроническим заболеванием, связано с системным воспалительным процессом низкой степени тяжести и иммунной дисфункцией [1, 2]. Предполагается, что длительное состояние воспаления приводит к нарушению гомеостатических механизмов и, как следствие, к метаболическим расстройствам, обычно связанных с ожирением опосредованными не до конца изученными путями, включающими продукцию цитокинов, адипокинов, гормонов и реагентов острой фазы [3]. Эпидемия ожирения продолжает расти во всем мире [4, 5]. На сегодняшний день опубликованы сотни исследований о мировой эпидемии ожирения и глобальном опыте метаболической и бариатрической хирургии (БХ), что значительно улучшило понимание ожирения и его лечения [6, 7].
Глобальные рекомендации по БХ были установлены после консенсусной конференции Национального института здравоохранения в 1991 г. Именно тогда было признано, что проводимые ранее бариатрические операции, такие как еюноилеальное шунтирование, несут существенные долгосрочные риски. Таким образом, идея хирургического лечения ожирения в первую очередь была отвергнута. В течение следующих нескольких лет ограниченные доказательства безопасности и эффективности БХ были опровергнуты. Впоследствии консенсусная комиссия решила, что такие пособия, как желудочное шунтирование по Ру (RYGB) и вертикальная гастропластика (VGB), безопасны и эффективны для пациентов с индексом массы тела (ИМТ) ≥40 кг/м2 или с ИМТ≥35 кг/м2 и сопутствующими медицинскими осложнениями ожирения [8]. В итоге был установлен ранее отсутствовавший стандарт практики, и в это же время данный вид хирургии был узаконен как хирургическая дисциплина. С тех пор база клинических данных по БХ значительно выросла.
БХ в настоящее время является единственным эффективным методом лечения патологического ожирения, который приводит к существенной и устойчивой потере массы тела, ремиссии сопутствующих заболеваний, связанных с ожирением, и улучшению качества жизни в долгосрочной перспективе [9–11]. В многочисленных исследованиях по БХ сообщалось о значительном улучшении метаболических заболеваний, а также снижении общей смертности, что еще раз подтверждает важность этого метода лечения [13, 14]. Одновременно широко сообщается о безопасности БХ [15–17]. Послеоперационная смертность очень низкая и колеблется от 0,03% до 0,2% [18]. Таким образом, неудивительно, что бариатрические операции стали одними из наиболее часто выполняемых операций в общей хирургии [19].
Ежегодное количество бариатрических процедур, выполняемых во всем мире, в настоящее время составляет около 700 тыс. Двумя наиболее распространенными бариатрическими процедурами являются лапароскопическая рукавная резекция желудка (LSG) и лапароскопическое шунтирование желудка по Ру (LRYGB) (см. рисунок). Лапароскопическая рукавная гастрэктомия является наиболее часто выполняемой бариатрической процедурой с 2014 г. и до сих пор демонстрирует устойчивый ежегодный рост как количества, так и доли всех бариатрических хирургических процедур [20]. Этот сдвиг в глобальном предпочтении LSG по сравнению с LRYGB произошел до того, как были доступны адекватные долгосрочные данные по LSG [21]. В настоящее время бариатрические операции выполняются с использованием минимально инвазивных хирургических подходов (лапароскопических или роботизированных).
Россия имеет свой Национальный бариатрический реестр, который был создан в 2013 г. [23]. Это ресурс, где все бариатрические хирурги России вносят данные о проведенных операциях, наблюдениях за пациентами и, по возможности, результаты их похудения. С 2013 по 2020 г. в России выполнено 16 980 бариатрических операций. Самой популярной операцией в России в этот период стала продольная резекция желудка (49% всех операций). Бандажирование желудка (пик популярности – 2013–2015 гг.) и мини желудочное шунтирование желудка (активно набирает популярность в последние годы) расположились соответственно на втором и третьем местах [24]. А за последние три года по сегодняшний день в России проведено еще 18 245 бариатрических операций, из них 51% – LSG [23].
S. Grönroos и соавт. в рандомизированном клиническом исследовании с участием 240 пациентов с морбидным ожирением выявили, что среднее процентное снижение лишней массы тела за 7 лет составило 47% после LSG против 55% после LRYGB, но разница не была клинически значимой. Качество жизни, связанное с заболеванием, и общее качество жизни в обеих группах были схожими [25].

БХ имеет значительные преимущества для здоровья, такие как уменьшение гипергликемии или нормализация уровня глюкозы в крови, снижение артериального давления и уровня холестерина, а также улучшение состояния при обструктивном апноэ во сне, микро- и макрососудистых осложнениях, связанных с диабетом. Хирургические методы бариатрических вмешательств разнообразны и включают в себя разные вмешательства. Когда они включают «обход» двенадцатиперстной кишки, также происходит снижение гормона грелина и увеличение GLP-1 (глюкагоноподобный пептид 1) и PYY (панкреатический тирозин-тирозиновый пептид), что улучшает чувствительность к инсулину, а также другие метаболические параметры [26].
БХ приводит к более значительному снижению массы тела и гораздо эффективнее при лечении диабета 2-го типа у пациентов с ожирением, чем нехирургические методы лечения. Долгосрочные наблюдения также показали, что достигнутые результаты сохраняются более пяти лет после операции. Однако факторы прогнозирования долгосрочных осложнений, долгосрочной выживаемости, а также влияния на психическое здоровье пациентов и затраты на восстановление должны постоянно обновляться [27].
БХ, как и любые другие хирургические пособия, имеет свои риски, некоторые из них представляют собой опасные для жизни долгосрочные осложнения алиментарного характера. Часто после этой процедуры у пациентов развивается анемия сложного генеза, происходят потери кальция и витаминов, которые необходимо замещать на протяжении всей жизни. Некоторые из потенциально тяжелых осложнений БХ – это дефицит микро- и макронутриентов. Кроме того, могут возникать стеноз и/или изъязвление анастомоза, рефлюкс-эзофагит и другие заболевания желудочно-кишечного тракта, а также желчнокаменная болезнь, стеатогепатит, изменение фармакокинетики и фармакодинамики пероральных лекарственных препаратов [28–30]. Дополнительные риски, которые часто упускаются из виду: рецидивирующий оксалатно-кальциевый уролитиаз и остеопороз. Оба осложнения чаще описываются после LRYGB, минующей двенадцатиперстную кишку, где преимущественно всасывается кальций. К сожалению, после LRYGB было описано повышенное выделение оксалатов, которое обычно трудно поддается лечению. Низкий уровень кальция в моче согласуется с мальабсорбцией кальция. Несмотря на это, остеопороз, связанный с LRYGB, не связан с изменениями массы тела или метаболизмом витамина D [31].
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ). Ожирение является важным фактором риска развития ГЭРБ и связанных с ним осложнений. Обычно снижение массы тела после модификации образа жизни значительно облегчает симптомы ГЭРБ. Что касается БХ и ее влияния на ГЭРБ, исследования показали несоответствие между различными типами БХ. LSG связана с увеличением заболеваемости ГЭРБ после этой процедуры за счет уменьшения послеоперационного угла Гиса и повышения внутрижелудочного давления. Бандажирование желудка улучшает симптомы ГЭРБ в краткосрочной перспективе; однако у небольшой группы пациентов в долгосрочной перспективе возвращаются симптомы рефлюкса и эзофагита. Наиболее эффективной бариатрической процедурой для облегчения ГЭРБ является LRYGB, эффективность которой, как сообщается, аналогична эффективности фундопликации по Ниссену. Поскольку бариатрические операции по-разному влияют на анатомию и физиологию желудочно-кишечного тракта, важно оценивать сопутствующие заболевания пациентов при рассмотрении различных вариантов бариатрических операций. На основании анализа исследований T. Stefura и соавт. показали, что LRYGB обеспечивает наилучшее облегчение симптомов, связанных с ГЭРБ и сопутствующими заболеваниями [32]. Некоторые авторы сообщают о формировании пищевода Барретта de novo после LSG [33, 34].
Демпинг-синдром. Его распространенность составляет 75% после операции шунтирования по Ру и 45% после вертикальной рукавной резекции желудка [35]. Выделяют два типа демпинг-синдрома.
Ранний демпинг-синдром возникает в ближайшем постпрандиальном периоде (через 10–30 мин) вследствие воздействия на тонкую кишку непереваренных углеводов. Они вызывают внутрипросветную кишечную гиперосмолярность, которая приводит к вторичной осмотической диарее с попаданием интерстициальной и внутрисосудистой жидкости в просвет кишки. Связанная с этим потеря эндоваскулярного объема часто приводит к артериальной гипотензии. Этот общий процесс активирует вазоактивные кишечные пептиды (нейротензин, VIP, серотонин, вещество Р и катехоламины), которые вызывают сердцебиение, потоотделение и ощущение «приливов» [36].
Синдром позднего демпинга, в свою очередь, проявляется через 2–4 ч после приема пищи по типу гипогликемии, которая может привести к утрате сознания, судорогам или даже смерти. В случае шунтирования по Ру распространенность такого демпинг-синдрома составляет 0,2–6,6% [37]. Одним из наиболее широко распространенных патофизиологических механизмов является быстрое всасывание глюкозы, которое стимулирует высвобождение энтероглюкагона и вызывает гиперинсулинемию, приводящую к гипогликемии [36]. Другие исследования связывают гипогликемию с нарушением функции бета-клеток поджелудочной железы, вторичной по отношению к диабету до операции и/или резистентности к инсулину, что приводит к гиперсекреции инсулина [38, 39]. Более поздние исследования показали, что в случае ускоренного опорожнения желудка возникает гиперсекреция и/или гиперчувствительность глюкагоноподобного пептида 1 (GLP-1). Этот пептид стимулирует выработку инсулина, тем самым вызывая гипогликемию [40, 41]. Диагноз ставится на основании опросника Sigstad (диагноз подтверждается при сумме >7 баллов; см. таблицу) и/или пероральном тесте на глюкозу, который включает в себя введение большой дозы глюкозы для провокации симптомов [42].

Постваготомический синдром. Ваготомия может быть выполнена намеренно, чтобы вызывать быстрое насыщение, или случайно, как интраоперационное осложнение [43]. Характерные клинические признаки включают быстрое чувство насыщения, рвоту, а в 10% случаев может возникнуть диарея. В патофизиологические механизмы, лежащие в основе этих симптомов, вовлечены измененная микробиота, гипомоторика и желудочная гипохлоргидрия. Октреотид может быть хорошим вариантом лечения диареи, вызванной постваготомическим синдромом [44].
Синдром короткой кишки. Синдром короткой кишки возникает примерно у 4–6,4% всех пациентов после LRYGB из-за чрезмерного уменьшения площади всасывающей поверхности кишечника. Не существует достаточно чувствительного или специфического теста для диагностики синдрома короткой кишки, поэтому данный диагноз определяется как диагноз-исключение. Лечение состоит из поддерживающих мероприятий в виде энтерального питания. Если возможно, следует попытаться восстановить нормальную анатомию с помощью реверсивной хирургии. В рефрактерных случаях рекомендуется парентеральное питание [45].
Мальабсорбция углеводов. Существует несколько типов мальабсорбции углеводов, наиболее важными из которых являются лактоза, фруктоза и сахароза. Лактоза – это углевод, который усваивается под действием фермента лактазы. Влияние БХ как феномена, усугубляющего это состояние, неясно, хотя одно скандинавское исследование продемонстрировало, что уровень непереносимости лактозы наблюдается у 30% пациентов после бариатрических операций [46]. Когда лактоза не всасывается, она достигает толстой кишки неповрежденной, создавая гиперосмолярное состояние, вызывающее осмотическую диарею. Кроме того, сапрофитная флора толстой кишки метаболизирует лактозу с образованием короткоцепочечных жирных кислот, углекислого газа, водорода и метана. Это, в свою очередь, приводит к характерной клинической триаде: вздутию живота, диарее и метеоризму. Диагностика мальабсорбции лактозы основывается на реакции пациента на тестовую диету. Также можно провести водородный дыхательный тест с лактозой, хотя его информативность после БХ ограничена. Лечение основано на диете, исключающей лактозу, и/или заместительной терапии лактазой [47].
Мальабсорбция белка. Большинство макро- и микроэлементов, включая белки, всасываются в средней и дистальной части тощей кишки [48]. Некоторые методы БХ, например LRYGB, выключают эти сегменты, что может привести к нарушению белковой мальабсорбции. Гипоальбуминемия возникает у 18% всех пациентов, перенесших операцию по выключению двенадцатиперстной кишки [49]. Гипоальбуминемия, в свою очередь, связана с диареей или алиментарной недостаточностью питания и сходна с болезнью Квашиоркора [50]. Парентеральное питание считается важным терапевтическим вариантом. В определенных ситуациях следует предпринять попытки восстановить анатомию путем реверсивной хирургии.
Кишечная микрофлора. Хирургическое лечение ожирения приводит к изменениям кишечной микробиоты (КМ) или микробного пейзажа кишечника. У пациентов, перенесших RYGB, в большинстве исследований наблюдалось увеличение количества Bacteroidetes (В), Actinobacteria (A), Proteobacteria (P) и их разнообразия, причем соотношение Firmicutes (F)/B не было постоянным. Было продемонстрировано, что LRYGB, в отличие от LSG, существенно уменьшает разнообразие кишечной микробиоты [51] параллельно с увеличением доли Gammaproteobacteria и уменьшением количества Clostridium [52]. После LSG наблюдалось увеличение доли B и P, при этом не было сообщений об A или консенсуса по соотношению F/B. При обеих хирургических процедурах сообщалось об уменьшении доли F. Масштаб изменений численности бактерий также неизвестен. Результаты противоречивы, различаются в зависимости от хирургической процедуры и могут меняться в зависимости от изучаемого послеоперационного периода; таким образом, невозможно сказать, будут ли изменения в КМ постоянными. Кроме того, в доступной литературе невозможно провести различие между тем, вызваны ли изменения проведением LSG (гормональными, анатомическими, функциональными и микробиологическими факторами), а не изменениями в диете и образе жизни, которые также происходят после операции. На данный момент нецелесообразно указывать величину влияния изменений КМ как фактора, способствующего снижению массы тела и улучшению метаболизма после БХ [53]. Интересно, что изменения КМ после БХ в настоящее время предлагаются как один из механизмов, объясняющих благоприятные клинические результаты БХ, которые позволяют частично купировать дисбиоз слизистой оболочки желудка, наблюдаемый при ожирении. Некоторые из характеристик КМ, измененных после БХ (состав с точки зрения бактерий и функций), связаны с положительными результатами БХ, такими как снижение массы тела и/или улучшение метаболизма. Тем не менее изменения КМ после БХ демонстрируют значительную вариабельность от одного пациента к другому. Таким образом, все еще необходимы дальнейшие исследования большого размера выборки, чтобы полностью расшифровать роль КМ в клинических улучшениях, наблюдаемых после бариатрической операции [54].
Синдром избыточного бактериального роста (SIBOS), определяемый как избыточное количество бактерий в тонкой кишке [55], имеет распространенность 2,5% у здоровых людей [56] и до 41% у пациентов с ожирением [57]. После бариатрических операций существует повышенный риск формирования избыточного бактериального роста из-за хирургических анастомозов [58]. По сути, зоны анастомоза представляют собой точки измененной подвижности, особенно анастомозы «конец в бок», где имеется слепой конец, действующий как резервуар. Клинические проявления избыточного бактериального роста включают диарею и боли в животе, иногда сопровождающиеся внекишечными проявлениями, такими как полиартрит и поражения кожи [59]. В идеале диагноз основывается на посеве аспирата тощей кишки (>104 КОЕ/мл), хотя доступность этого метода низкая. В клинической практике обычно проводят водородный дыхательный тест с глюкозой/лактулозой (ЛВДТ), имеющий чувствительность и специфичность 62% и 83% соответственно [60]. Бразильская группа исследователей описала частое возникновение избыточного бактериального роста в культе желудка после LRYGB или LSG у пациентов с морбидным ожирением при оценке после среднего периода наблюдения 7,3 года [59]. Последствия SIBOS после БХ не изучены. Питательные вещества, непереваренные в тонкой кишке из-за SIBOS, могут привести к повышению уровня коротко- и среднецепочечных жирных кислот в результате их метаболизма в толстой кишке, что приводит к более высокому поглощению калорий [61, 62]. Однако данные об ожидаемом снижении массы тела противоречивы [63]. Измененная анатомия с исключенными сегментами тонкой кишки серьезно затрудняет диагностические мероприятия; аспирация и посев могут оказаться невозможными, несмотря на передовые эндоскопические методы, а тестирование дыхания лежит в основе тех же ограничений [64].
SIBOS может проявляться более серьезными симптомами. В серии случаев у двух пациенток, перенесших LRYGB, наблюдалось повышение уровня выдыхаемого водорода (ЛВДТ) в сочетании со снижением общей массы тела на 52% и 34% в течение 21 и 15 мес после операции соответственно, сопровождалось астенией, алопецией, отеками и гипоальбуминемией (до 24 г/л и 34 г/л соответственно). Обе пациентки получали 30-дневную терапию ципрофлоксацином и тетрациклином, что привело к разрешению их симптомов [65]. Хотя ретроспективный характер исследований и небольшой размер выборки не позволяют сделать убедительные выводы о роли SIBOS как потенциальной причины стойкого дефицита витаминов и общей белковой недостаточности у пациентов, перенесших бариатрическую операцию, необходимо применять диагностику с помощью ЛВДТ и антибиотикотерапию при необходимости. Своевременная диагностика SIBOS у бариатрических пациентов с аномальными желудочно-кишечными симптомами может помочь в выборе соответствующей антибиотикотерапии и предотвратить потенциальную заболеваемость, вызванную длительным дефицитом витаминов, желудочно-кишечными расстройствами, общей белковой недостаточностью и/или субоптимальным снижением массы тела. При правильной терапии можно добиться облегчения симптомов у этих пациентов и предотвращения развития серьезных осложнений, таких как энцефалопатия Вернике [66].
Антибиотик-ассоциированные кишечные осложнения. БХ в сочетании с антибиотикотерапией – либо в качестве профилактики, либо в качестве терапии в случае осложнений – является фактором риска колита, вызванного C. difficile [67]. Это заболевание проявляется воспалительным колитом, вызывающим вторичную диарею и энтеропатию с потерей белка. Его следует заподозрить, если острая диарея возникает в ближайшем послеоперационном периоде или после операции на фоне предшествующей терапии антибиотиками. Диагноз основывается на обнаружении микробного токсина в кале. Обычно лечение проводится только пероральными антибиотиками, метронидазолом и ванкомицином. Учитывая анатомические изменения после БХ и фармакокинетику метронидазола (он почти полностью всасывается в тонкой кишке), внутривенный ванкомицин может быть предпочтительным вариантом первичного лечения [68]. Трансплантация фекальной микробиоты является новым методом лечения рецидивирующих инфекций, который также вызвал интерес в бариатрическом сообществе из-за его влияния на уменьшение массы тела [69].
Мальабсорбция желчных кислот. Нарушение всасывания солей желчных кислот вызывает диарею без болей в животе. Роль желчных кислот в развитии морбидного ожирения, его коморбидности и снижения массы тела у постбариатрических пациентов вызывает повышенный интерес, поскольку они, по-видимому, играют важную роль в послеоперационном метаболическом улучшении. Целью интереса являются FX- и TGR5-рецепторы и их влияние на метаболизм желчных кислот с последующим усилением гормонального, в частности инкретинового, ответа и изменением состава кишечной микробиоты [70, 71]. Соли желчных кислот преимущественно всасываются в подвздошной кишке (95%), а любые анатомические или функциональные изменения на уровне подвздошной кишки, вызванные БХ, могут привести к нарушению всасывания солей желчных кислот. Заболевание может быть также связано с холецистэктомией (до или одновременно с бариатрической операцией) и ваготомией [72].
Экзокринная недостаточность поджелудочной железы (EPI). LSG и LRYGB могут сформировать вторичную EPI, приводящую к стеаторее [73, 74] с последующим дефицитом жирорастворимых витаминов. В зависимости от варианта LRYGB, проксимального или дистального, распространенность EPI составляет до 19–48% соответственно [73]. Изменения калорийности, состава и физических свойств блюд после LRYGB приводят к снижению и нескоординированности реакции поджелудочной железы на пищевые стимулы. Измененная анатомия после LRYGB приводит к сокращению времени контакта ферментов с химусом. Кроме того, деградация ферментов поджелудочной железы ускоряется при отсутствии химуса в билиопанкреатическом отделе двенадцатиперстной кишки [75]. В редких случаях выполняется левосторонняя резекция поджелудочной железы по поводу демпинг-синдрома, что приводит к первичной эндо- и экзопанкреатической недостаточности [76]. Тестирование на EPI оказывается трудным из-за измененной анатомии. Заместительная терапия ферментами поджелудочной железы с удалением их кислотоустойчивого покрытия является основой лечения EPI [75].
Запор является частым побочным эффектом после желудочного бандажирования, LSG и LRYGB. Его распространенность после бариатрических процедур колеблется от 7% до 39%. Этиология включает недостаточное потребление жидкости в послеоперационной диете, применение витаминных и минеральных добавок, таких как кальций и железо, а также применение опиоидов в качестве послеоперационных анальгетиков. Диетологическое лечение должно быть сосредоточено на повышенном потреблении воды или негазированных сладких напитков и пищевых волокон, содержащихся в фруктах, овощах и цельнозерновых крупах [77, 78].
Холелитиаз. Распространенным поздним послеоперационным осложнением со стороны желудочно-кишечного тракта, возникающим при быстром снижении массы тела в результате БХ, является образование камней в билиарном тракте [79]. Частота развития желчных камней после БХ колеблется от 22% до 71% [80, 81]. При оценке эффективности урсодезоксихолевой кислоты (УДХК) в снижении образования желчных камней при бандажировании желудка и LRYGB исследования показали значительно более низкие показатели образования желчных камней в этих группах по сравнению с пациентами, принимавшими плацебо или ибупрофен соответственно [82]. Таким образом, рекомендуется регулярное использование УДХК во время быстрого снижения массы тела (6 мес после LRYGB), что снижает скорость образования желчных камней до менее чем 5% [83, 84]. УДХК значительно снижает риск образования как бессимптомных, так и симптоматических желчных камней после бариатрической операции. Доза не менее 600 мг/сут связана с улучшенным соблюдением режима лечения и лучшими результатами, независимо от типа операции. УДХК следует рассматривать как часть стандартного пакета послеоперационного ведения пациента после бариатрической операции.
Клинический пример. Мы приводим фрагменты истории болезни пациента, которому была выполнена лапаротомная рукавная резекция желудка в 2017 г., но не проводилось медицинское наблюдение – ни ранней, ни поздней реабилитации. Пациент Т., 50 лет, в стационаре одной из ЦРБ Кемеровской области: на обходе 03.03.2023. Жалобы на резкую слабость, сильную отечность, особенно ног, осиплость голоса, огромное грыжевое выпячивание по средней линии живота. Доставлен бригадой скорой медицинской помощи с диагнозом анасарка неясного генеза. В 2017 г. проведена лапаротомная бариатрическая операция (в Новосибирске), общее снижение массы тела составило более 100 кг (исходная масса тела – 186 кг при росте 185 см) в течение 1,5 года. После операции были даны общие рекомендации по питанию и физической нагрузке, больше пациент ни разу не был у врача по поводу перенесенного оперативного пособия. В августе 2022 г. появилась желтуха и приступообразные боли в правом подреберье, при обследовании – множественные камни желчного пузыря и холедоха. Выполнены холецистэктомия с холедохотомией, литоэкстракция, наложен билиодигестивный анастомоз. В ноябре 2022 г. язвенное кровотечение культи желудка, ушивание язвенного дефекта. Три недели назад появились отеки, самостоятельно принимал фуросемид – без эффекта, при обращении к участковому врачу отправлен в стационар.
Объективные данные: состояние тяжелое. Замедленная речь. Кожные покровы и видимые слизистые бледные, анасарка, множественные гематомы. Саркопения. Масса тела – 86 кг. Дыхание с жестким оттенком, значительно ослаблено или отсутствует в нижних отделах, частота дыхательных движений – 18–20 в мин. Границы сердца перкуторно увеличены влево до 1–2 см, тоны приглушенные, ритмичные, систолический шум на верхушке и в точке Боткина, частота сердечных сокращений – 109 в секунду, артериальное давление – 130/75 мм рт. ст. Язык со сглаженными сосочками, ярко-красная кайма. Живот значительно увеличен за счет асцита и грыжевого выпячивания по всей белой линии живота 30×20 см, под кожей пальпируются петли вздутой кишки. Печень 10–12–14 см по Курлову, край при пальпации плотный, округлый, безболезненный. Стул кашицеобразный с кусочками непереваренной пищи до 5–7 раз в сутки. Мочеиспускание редкое, малыми порциями.
Данные обследования при поступлении: Нb – 97 г/л; эритроциты – 2,68×1012; макроцитоз, анизоцитоз; лейкоциты – 5,6×109; тромбоциты – 78×109; СОЭ – 8 мм/ч. Анализ мочи без патологии. Биохимические анализы крови: глюкоза – 5,9 ммоль/л; мочевина – 5,3 ммоль/л; креатинин – 111,0 мкмоль/л; общий белок – 51,6 г/л; билирубин общий – 42,3 мкмоль/л (26,9 прямой);
аланинаминотрансфераза – 42,3 Ед/л; аспартатаминотрансфераза – 91,2 Ед/л; щелочная фосфатаза – 150,19 Ед/л; фибриноген – 6,6 г/л; общий холестерин – 1,0 ммоль/л, триглицериды – 0,48 ммоль/л; сывороточное железо – 3,5 мкмоль/л; активированное частичное тромбопластиновое время – 41,0 с. Электрокардиография (ЭКГ): синусовый ритм, частота сердечных сокращений – 96 в минуту. Полугоризонтальное положение электрической оси. Замедление проведения по правой ножке пучка Гиса. Снижен вольтаж ЭКГ. Гипертрофия левого желудочка. Удлинение интервала QT до 0,33.
Мультиспиральная компьютерная томография (МСКТ) органов грудной клетки: двусторонний малый гидроторакс. КТ-признаки очагового уплотнения в верхней доле правого легкого. Фиброзные изменения легких с обеих сторон, участок консолидации в нижней доле правого легкого (вероятно, поствоспалительного характера).
МСКТ органов брюшной полости: гепатоспленомегалия. Выраженный стеатоз печени (до 20 HU). КТ-признаки аэробилии. Жировая инфильтрация поджелудочной железы, парапельвикальные кисты почек. Грыжа передней брюшной стенки больших размеров, состояние после оперативного лечения желудка.
Диагноз: состояние после рукавного гастрошунтирования. Гипопротеинемия, анасарка (асцит, двусторонний гидроторакс, периферические отеки). Анемия средней степени тяжести (железодефицитная + В12-дефицитная). Желчнокаменная болезнь, состояние после холецистэктомии, гепатикоеюностомии. Гигантская
постлапаротомическая вентральная грыжа. Стеатогепатит, легкой степени тяжести. Липоматоз поджелудочной железы. Синдром избыточного бактериального роста (СИБР). Дислипидемия по типу выраженной гипохолестеринемии.
Проведено лечение и даны дальнейшие рекомендации:
• питание с повышенным содержанием белка;
• гемотрансфузии;
• инфузии альбумина;
• УДХК 1000 мг/сут;
• орнитин-аспартат 1 саше 3 раза в сутки;
• антибиотикотерапия системная;
• панкреатин;
• диуретическая терапия (спиронолактон);
• деконтаминация кишечника – топические энтеросептики;
• пробиотики, поливитамины и микроэлементы.
Витамин В12 по 1000 мкг 1 раз в 2 недели 3 мес, затем 1 раз в 3 мес пожизненно. Состояние несколько улучшилось, проявления отечного синдрома значительно уменьшились. Выписан с рекомендациями на амбулаторное лечение.
16.04.2023 пациент Т., 50 лет, поступил в хирургическое отделение городской больницы Кемерово с диагнозом: перитонит на фоне гигантского межкишечного абсцесса с прорывом в брюшную полость. На фоне тяжелой интоксикации развился сепсис, двусторонняя пневмония, полиорганная недостаточность... Несмотря на хирургическое пособие, интенсивную терапию пациент Т. 17.04.2023 умер.
Что было бы, если бы пациенту Т. была выполнена не лапаротомная, а лапароскопическая бариатрическая операция? Сформировалась бы гигантская вентральная грыжа на фоне выраженной саркопении? Были ли даны индивидуальные рекомендации по питанию, физической нагрузке? Масса тела должна уходить не стремительно, в идеале – не более 4 кг в месяц. Необходимы ранние нутриционная и диетическая поддержка каждому бариатрическому пациенту. Назначили ли УДХК из расчета не менее 10 г на килограмм массы тела? При постоянном приеме УДХК риск билиарного литолиза минимальный. Назначили ли поливитамины, микроэлементы, витамин В12 по 1000 мкг 1 раз в 3 мес подкожно? Для лечения и контроля СИБРа периодически проводились ли курсы кишечной деконтаминации? Один раз в год (первый год каждые три месяца) исследовались ли основные показатели углеводного, липидного, белкового обменов, уровень железа и витамина В12?
И еще много вопросов...
Наверное, при наблюдении и своевременных рекомендациях, хотя бы гастроэнтеролога, пациент бы имел совершенно другое качество и количество жизни. Но, к сожалению, в описанной ситуации, сослагательное наклонение неприемлемо. Если мы вернемся к началу нашей статьи и вспомним статистику [https: //bareoreg.ru/]: в России c 2018 по 2023 г. выполнены 42 619 бариатрических операций, в том числе 6 786 за 2023 г. Количество наблюдений: c 2018 по 2023 г. – 26 687 и в том числе
4 734 за 2023 г. Мы видим, что более 1/2 пациентов остались без наблюдения, какова их судьба?
Настоящая статья демонстрирует, что БХ по сравнению с консервативной терапией снижает смертность и частоту сердечно-сосудистых заболеваний у людей с ожирением, при этом уровень смертности после бариатрических операций колеблется от 0% до 0,64% [85] – при корректном послеоперационном ведении пациентов. Крупные метаанализы показали, что сердечно-сосудистая и онкологическая смертность после БХ снизилась примерно вдвое по сравнению с соответствующей нехирургической когортой в исследованиях продолжительностью до 14 лет [86, 87]. После подробно проведенного нами анализа гастроэнтерологических долгосрочных осложнений и смертности становится ясно, что эти осложнения вполне курабельны, а польза от самой бариатрической операции превышает связанные с ней риски.
Разработка индивидуально подобранной программы реабилитации для каждого бариатрического пациента должна быть приоритетом для их комплексного ведения с использованием многопрофильного командного подхода. Многопрофильные команды предлагают лучшие послеоперационные результаты [88], решая вопросы качества снижения массы тела, медицинских и психиатрических сопутствующих заболеваний, психосоциальных проблем и физической инвалидности [89]. Чтобы обеспечить плавный переход от пре- к послеоперационной реабилитации, физическая и биопсихосоциальная модель реабилитации продолжает оставаться актуальной, акцент должен быть сделан на предотвращении хирургических осложнений, вторичной профилактике сердечно-сосудистых заболеваний, устранении нарушений, связанных с ожирением, психологических и социально-экологических барьеров, улучшении физической функции посредством адаптированной физической активности, обучения управлению питанием, а также реализации стратегий устойчивого управления весом. Каждый член многопрофильной команды должен предоставить подробную оценку нарушений, наметить стратегии профилактики и предложить решения по лечению заболеваний наряду с реализацией программы функционального восстановления. Программа функционального восстановления в послеоперационном периоде должна быть направлена не только на достижение заметного снижения массы тела, но и на предотвращение ее набора, прогрессирования сопутствующих заболеваний, связанных с ожирением, восстановление физического функционирования и повышение качества жизни, связанного со здоровьем [90].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Плотникова Екатерина Юрьевна – д-р мед. наук, проф. каф. поликлинической терапии, постдипломной подготовки врачей и ВСО, руководитель курса клинической гастроэнтерологии, ФГБОУ ВО КемГМУ. E-mail: eka-pl@rambler.ru; ORCID: 0000-0002-6150-1808
Ekaterina Yu. Plotnikova ‒ Dr. Sci. (Med.), Prof., Kemerovo State Medical University E-mail: eka-pl@rambler.ru; ORCID: 0000-0002-6150-1808
Колпинский Глеб Иванович – д-р мед. наук, проф. каф. онкологии, лучевой диагностики и лучевой терапии, ФГБОУ ВО КемГМУ. ORCID: 0000-0002-5526-2687
Gleb I. Kolpinsky – Dr. Sci. (Med.), Prof., Kemerovo State Medical University. ORCID: 0000-0002-5526-2687
Семенчук Ирина Николаевна – зав. терапевтическим отделением, ГБУЗ «Березовская городская больница им. А.М. Назаренко»
Irina N. Semenchuk – Head of the therapeutic department, Berezovsk City Hospital named A.M. Nazarenko
Краснов Константин Аркадьевич – канд. мед. наук, доц. каф. госпитальной хирургии, ФГБОУ ВО КемГМУ. E-mail: krasnov8k@rambler.ru; ORCID: 0000-0002-9262-3656
Konstantin A. Krasnov – Cand. Sci. (Med.), Kemerovo State Medical University. E-mail: krasnov8k@rambler.ru; ORCID: 0000-0002-9262-3656
Поступила в редакцию: 17.11.2023
Поступила после рецензирования: 20.11.2023
Принята к публикации: 23.11.2023
Received: 17.11.2023
Revised: 20.11.2023
Accepted: 23.11.2023
Список исп. литературыСкрыть список1. Gossman H, Butsch WS, Jastreboff AM. Treating the chronic disease of obesity. Med Clin N Am. 2021; 105 (6): 983–1016. DOI: 10.1016/j.mcna.2021.06.005
2. Kawai T, Autieri MV, Scalia R. Adipose tissue inflammation and metabolic dysfunction in obesity. Am J Physiol Cell Physiol. 2021; 320 (3): C375–C391. DOI: 10.1152/ajpcell.00379.2020
3. Chang SS, Eisenberg D, Zhao L et al. Chemerin activation in human obesity. Obesity (Silver Spring) 2016; 24 (7): 1522–29. DOI: 10.1002/oby.21534
4. Afshin A, Forouzanfar MH, Reitsma MB et al. GBD 2015 Obesity Collaborators. Health effects of overweight and obesity in 195 countries over 25 years. N Engl J Med. 2017; 377 (1): 13–27. DOI: 10.1056/NEJMoa1614362
5. Ogden CL, Carroll MD, Lawman HG, et al. Trends in obesity prevalence among children and adolescents in the United States, 1988-1994 through 2013–2014. JAMA. 2016; 315 (21): 2292–99. DOI: 10.1001/jama.2016.6361
6. World Health Organization (WHO) [monograph on the Internet]. Geneva: World Health Organization; 2002. URL: https: //www.who.int/publications/i/item/9241562072
7. Ogden CL, Carroll MD, Kit BK, Flegal KL. Prevalence of childhood and adult obesity in the United States 2011–12. JAMA. 2014; 311 (8): 806–14. DOI: 10.1001/jama.2014.732
8. Finks JF, Dimick JB. An updated National Institutes of Health consensus panel on bariatric surgery. JAMA Surg. 2014; 149 (12): 1329–30. DOI: 10.1001/jamasurg.2014.2443
9. Schauer PR, Bhatt DL, Kirwan JP et al. STAMPEDE Investigators. Bariatric surgery versus intensive medical therapy for diabetes – 5-year outcomes. N Engl J Med. 2017; 376 (7): 641–51. DOI: 10.1056/NEJMoa1600869
10. Adams TD, Davidson LE, Litwin SE et al. Weight and metabolic outcomes 12 years after gastric bypass. N Engl J Med. 2017; 377 (12): 1143–55. DOI: 10.1056/NEJMoa1700459
11. Ikramuddin S, Korner J, Lee WJ et al. Lifestyle intervention and medical management with vs without Roux-en-Y gastric bypass and control of hemoglobin A1c, LDL cholesterol, and systolic blood pressure at 5 years in the Diabetes Surgery Study. JAMA. 2018; 319 (3): 266–78. DOI: 10.1001/jama.2017.20813
12. Arterburn DE, Olsen MK, Smith VA et al. Association between bariatric surgery and long-term survival. JAMA. 2015; 313 (1): 62–70. DOI: 10.1001/jama.2014.16968
13. Aminian A, Zajicheck A, Arterburn DE et al. Association of metabolic surgery with major adverse cardiovascular outcomes in patients with type 2 diabetes and obesity. JAMA. 2019; 322 (13): 1271–82. DOI: 10.1001/jama.2019.14231
14. Aminian A, Al-Kurd A, Wilson R et al. Association of bariatric surgery with major adverse liver and cardiovascular outcomes in patients with biopsy-proven nonalcoholic steatohepatitis. JAMA. 2021; 26 (20): 2031–42. DOI: 10.1001/jama.2021.19569
15. Goldberg I, Yang J, Nie L, Bates AT et al. Safety of bariatric surgery in patients older than 65 years. Surg Obes Relat Dis. 2019; 15 (8): 1380–7. DOI: 10.1016/j.soard.2019.05.016
16. Phillips BT, Shikora SA. The history of metabolic and bariatric surgery: development of standards for patient safety and efficacy. Metabolism. 2018; 79: 97–107. DOI: 10.1016/j.metabol.2017.12.010
17. Buchwald H, Estok R, Fahrbach K, Banel D, Sledge I. Trends in mortality in bariatric surgery: a systematic review and meta-analysis. Surgery. 2007; 142 (4): 621–32. DOI: 10.1016/j.surg.2007.07.018
18. Arterburn DE, Telem DA, Kushner RF, Courcoulas AP. Benefits and risks of bariatric surgery in adults: a review. JAMA. 2020; 324 (9): 879–87. DOI: 10.1001/jama.2020.12567
19. American Society of Metabolic and Bariatric Surgery (ASMBS) [Internet]. Newberry, FL: The Society [updated 2022 Jun; cited YYYY Mon D]. Estimate of Bariatric Surgery Numbers, 2011–2020. URL: https: //asmbs.org/resources/estimate-of-bariatric-surgery-numbers
20. Angrisani L, Santonicola A, Iovino P et al. IFSO worldwide survey 2016: primary, endoluminal, and revisional procedures. Obes Surg. 2018; 28 (12): 3783–94. DOI: 10.1007/s11695-018-3450-2
21. Puzziferri N, Roshek TB III, Mayo HG et al. Long-term follow-up after bariatric surgery: a systematic review. JAMA. 2014; 312 (9): 934–42. DOI: 10.1001/jama.2014.10706
22. Lee PC, Dixon J. Bariatric-metabolic surgery: A guide for the primary care physician. Aust Fam Physician. 2017; 46 (7): 465–71.
23. URL: https: //bareoreg.ru/
24. URL: https: //bariatriarf.ru/bareoreg-2020/
25. Grönroos S, Helmiö M, Juuti A, Tiusanen R et al. Effect of Laparoscopic Sleeve Gastrectomy vs Roux-en-Y Gastric Bypass on Weight Loss and Quality of Life at 7 Years in Patients With Morbid Obesity: The SLEEVEPASS Randomized Clinical Trial. JAMA Surg. 2021; 156 (2): 137–46. DOI: 10.1001/jamasurg.2020.5666
26. Sheng B, Truong K, Spitler H et al. The Long-Term Effects of Bariatric Surgery on Type 2 Diabetes Remission, Microvascular and Macrovascular Complications, and Mortality: a Systematic Review and Meta-Analysis. Obes Surg. 2017; 27: 2724–32. DOI: 10.1007/s11695-017-2866-4
27. Crozet J, Pasquer A, Pelascini E, Robert M. Factors influencing bariatric surgery outcomes. J Visc Surg. 2023; 160 (2S): S7-S11. DOI: 10.1016/j.jviscsurg.2022.12.001
28. Nuzzo A, Czernichow S, Hertig A et al. Prevention and treatment of nutritional complications after bariatric surgery. Lancet Gastroenterol Hepatol. 2021; 6 (3): 238–51. DOI: 10.1016/S2468-1253 (20)30331-9
29. Chevallier JM. De la chirurgie de l'obésité a la chirurgie a visée métabolique. Expérience de quinze ans dans un service hospitalier universitaire [From bariatric to metabolic surgery: 15 years experience in a French university hospital]. Bull Acad Natl Med. 2010; 194 (1): 25–36; discussion 36–8. French. DOI: org/10.1016/S0001-4079 (19)32359-3
30. Koch TR, Finelli FC. Postoperative metabolic and nutritional complications of bariatric surgery. Gastroenterol Clin North Am. 2010; 39 (1): 109–24. DOI: 10.1016/j.gtc.2009.12.003
31. Weiss D. Long-term Complications of Bariatric Surgery. JAMA. 2021; 325 (2): 186. DOI: 10.1001/jama.2020.22478. PMID: 33433569
32. Stefura T, Zapała B, Gosiewski T et al. Changes in the Composition of Oral and Intestinal Microbiota After Sleeve Gastrectomy and Roux-En-Y Gastric Bypass and Their Impact on Outcomes of Bariatric Surgery. Obes Surg. 2022; 32 (5): 1439–50. DOI: 10.1007/s11695-022-05954-9
33. Felsenreich DM, Kefurt R, Schermann M et al. Reflux, Sleeve Dilation, and Barrett's Esophagus after Laparoscopic Sleeve Gastrectomy: Long-Term Follow-Up. Obes Surg. 2017; 27 (12): 3092–101. DOI: 10.1007/s11695-017-2748-9
34. Genco A, Soricelli E, Casella G, Maselli R et al. Gastroesophageal reflux disease and Barrett's esophagus after laparoscopic sleeve gastrectomy: a possible, underestimated long-term complication. Surg Obes Relat Dis. 2017; 13 (4): 568–74. DOI: 10.1016/j.soard.2016.11.029
35. Borbély YM, Osterwalder A, Kröll D et al. Diarrhea after bariatric procedures: Diagnosis and therapy. World J Gastroenterol. 2017; 23 (26): 4689–700. DOI: 10.3748/wjg.v23.i26.4689
36. Chaves YD, Destefani AC. Pathophysiology, diagnosis and treatmentof dumping syndrome and its relation to bariatric surgery. Arq Bras Cir Dig. 2016; 29 (Suppl.): 116–9. DOI: 10.1590/0102-6720201600S10028
37. Marsk R, Jonas E, Rasmussen F, Näslund E. Nationwide cohort study of post-gastric bypass hypoglycaemia including 5,040 patients undergoing surgery for obesity in 1986-2006 in Sweden. Diabetologia. 2010; 53 (11): 2307–11. DOI: 10.1007/s00125-010-1798-5
38. Service GJ, Thompson GB, Service FJ et al. Hyperinsulinemic hypoglycemia with nesidioblastosis after gastric-bypass surgery. N Engl J Med. 2005; 353 (3): 249–54. DOI: 10.1056/NEJMoa043690
39. Patti ME, McMahon G, Mun EC et al. Severe hypoglycaemia post-gastric bypass requiring partial pancreatectomy: evidence for inappropriate insulin secretion and pancreatic islet hyperplasia. Diabetologia. 2005; 48 (11): 2236–40. DOI: 10.1007/s00125-005-1933-x
40. Falkén Y, Hellström PM, Holst JJ, Näslund E. Changes in glucose homeostasis after Roux-en-Y gastric bypass surgery for obesity at day three, two months, and one year after surgery: role of gut peptides. J Clin Endocrinol Metab. 2011; 96 (7): 2227–35. DOI: 10.1210/jc.2010-2876
41. Marathe CS, Rayner CK, Jones KL, Horowitz M. Relationships between gastric emptying, postprandial glycemia, and incretin hormones. Diabetes Care. 2013; 36 (5): 1396–405. DOI: 10.2337/dc12-1609
42. van Beek AP, Emous M, Laville M, Tack J. Dumping syndrome after esophageal, gastric or bariatric surgery: pathophysiology, diagnosis, and management. Obes Rev. 2017; 18 (1): 68–85. DOI: 10.1111/ obr.12467
43. Ikramuddin S, Blackstone RP, Brancatisano A et al. Effect of reversible intermittent intra-abdominal vagal nerve blockade on morbid obesity: the ReCharge randomized clinical trial. JAMA. 2014; 312 (9): 915–22. DOI: 10.1001/jama.2014.10540
44. Borbély YM, Osterwalder A, Kröll D et al. Diarrhea after bariatric procedures: Diagnosis and therapy. World J Gastroenterol. 2017; 23 (26): 4689–700. DOI: 10.3748/wjg.v23.i26.4689
45. McBride CL, Petersen A, Sudan D, Thompson J. Short bowel syndrome following bariatric surgical procedures. Am J Surg. 2006; 192 (6): 828–32. DOI: 10.1016/j.amjsurg.2006.08.052
46. Potoczna N, Harfmann S, Steffen R et al. Bowel habits after bariatric surgery. Obes Surg. 2008; 18 (10): 1287–96. DOI: 10.1007/s11695-008-9456-4
47. Gudmand-Höyer E, Asp NG, Skovbjerg H, Andersen B. Lactose malabsorption after bypass operation for obesity. Scand J Gastroenterol. 1978; 13 (6): 641–7. DOI: 10.3109/00365527809181776
48. Bal BS, Finelli FC, Shope TR, Koch TR. Nutritional deficiencies after bariatric surgery. Nat Rev Endocrinol. 2012; 8 (9): 544–56. DOI: 10.1038/nrendo.2012.48
49. Currò G, Centorrino T, Cogliandolo A et al. A clinical and nutritional comparison of biliopancreatic diversion performed with different common and alimentary channel lengths. Obes Surg. 2015; 25 (1): 45–9. DOI: 10.1007/s11695-014-1347-2
50. Coulthard MG. Oedema in kwashiorkor is caused by hypoalbuminaemia. Paediatr Int Child Health. 2015; 35 (2): 83–9. DOI: 10.1179/2046905514Y.0000000154
51. Shao Y, Ding R, Xu B et al. Alterations of Gut Microbiota After Roux-en-Y Gastric Bypass and Sleeve Gastrectomy in Sprague-Dawley Rats. Obes Surg. 2017; 27 (2): 295–302. DOI: 10.1007/s11695-016-
2297-7
52. Furet JP, Kong LC, Tap J et al. Differential adaptation of human gut microbiota to bariatric surgery-induced weight loss: links with metabolic and low-grade inflammation markers. Diabetes. 2010; 59 (12): 3049–57. DOI: 10.2337/db10-0253
53. Coimbra VOR, Crovesy L, Ribeiro-Alves M et al. Gut Microbiota Profile in Adults Undergoing Bariatric Surgery: A Systematic Review. Nutrients. 2022; 14 (23): 4979. DOI: 10.3390/nu14234979
54. Debédat J, Clément K, Aron-Wisnewsky J. Gut Microbiota Dysbiosis in Human Obesity: Impact of Bariatric Surgery. Curr Obes Rep. 2019; 8 (3): 229–42. DOI: 10.1007/s13679-019-00351-3
55. Rezaie A, Pimentel M, Rao SS. How to Test and Treat Small Intestinal Bacterial Overgrowth: an Evidence-Based Approach. Curr Gastroenterol Rep. 2016; 18 (2): 8. DOI: 10.1007/s11894-015-0482-9
56. Sabaté JM, Jouët P, Harnois F et al. High prevalence of small intestinal bacterial overgrowth in patients with morbid obesity: a contributor to severe hepatic steatosis. Obes Surg. 2008; 18 (4): 371–7. DOI: 10.1007/s11695-007-9398-2
57. Madrid AM, Poniachik J, Quera R, Defilippi C. Small intestinal clustered contractions and bacterial overgrowth: a frequent finding in obese patients. Dig Dis Sci. 2011; 56 (1): 155–60. DOI: 10.1007/s10620-010-1239-9
58. Bures J, Cyrany J, Kohoutova D et al. Small intestinal bacterial overgrowth syndrome. World J Gastroenterol. 2010; 16 (24): 2978–90. DOI: 10.3748/wjg.v16.i24.2978
59. Ishida RK, Faintuch J, Paula AM et al. Microbial flora of the stomach after gastric bypass for morbid obesity. Obes Surg. 2007; 17 (6): 752–8. DOI: 10.1007/s11695-007-9139-6
60. Gasbarrini A, Corazza GR, Gasbarrini G et al. 1st Rome H2-Breath Testing Consensus Conference Working Group. Methodology and indications of H2-breath testing in gastrointestinal diseases: the Rome Consensus Conference. Aliment Pharmacol Ther. 2009; 29: 1–49. DOI: 10.1111/j.1365-2036.2009.03951.x
61. Schwiertz A, Taras D, Schäfer K et al. Microbiota and SCFA in lean and overweight healthy subjects. Obesity (Silver Spring). 2010; 18 (1): 190–5. DOI: 10.1038/oby.2009.167
62. Jeppesen PB, Mortensen PB. Colonic digestion and absorption of energy from carbohydrates and medium-chain fat in small bowel failure. JPEN J Parenter Enteral Nutr. 1999; 23 (5 Suppl.): S101–5. DOI: 10.1177/014860719902300525
63. Andalib I, Shah H, Bal BS et al. Breath Hydrogen as a Biomarker for Glucose Malabsorption after Roux-en-Y Gastric Bypass Surgery. Dis Markers. 2015; 2015: 102760. DOI: 10.1155/2015/102760
64. Choung RS, Ruff KC, Malhotra A et al. Clinical predictors of small intestinal bacterial overgrowth by duodenal aspirate culture. Aliment Pharmacol Ther. 2011; 33 (9): 1059–67. DOI: 10.1111/j.1365-2036.2011.04625.x
65. Machado JD, Campos CS, Lopes Dah Silva C et al. Intestinal bacterial overgrowth after Roux-en-Y gastric bypass. Obes Surg. 2008; 18 (1): 139–43. DOI: 10.1007/s11695-007-9365-y
66. Sabate JM, Coupaye M, Ledoux S et al. Consequences of Small Intestinal Bacterial Overgrowth in Obese Patients Before and After Bariatric Surgery. Obes Surg. 2017; 27 (3): 599–605. DOI: 10.1007/s11695-016-2343-5
67. Bagdasarian N, Rao K, Malani PN. Diagnosis and treatment of Clostridium difficile in adults: a systematic review. JAMA. 2015; 313 (4): 398–408. DOI: 10.1001/jama.2014.17103
68. Al-Jashaami LS, DuPont HL. Management of Clostridium difficile Infection. Gastroenterol Hepatol (NY). 2016; 12 (10): 609–16.
69. Gérard P. Gut microbiota and obesity. Cell Mol Life Sci. 2016; 73 (1): 147–62. DOI: 10.1007/s00018-015-2061-5
70. Ryan KK, Tremaroli V, Clemmensen C et al. FXR is a molecular target for the effects of vertical sleeve gastrectomy. Nature. 2014; 509 (7499): 183–8. DOI: 10.1038/nature13135
71. Kohli R, Seeley RJ. Diabetes: the search for mechanisms underlying bariatric surgery. Nat Rev Endocrinol. 2013; 9 (10): 572–4. DOI: 10.1038/nrendo.2013.159
72. Worni M, Guller U, Shah A et al. Cholecystectomy concomitant with laparoscopic gastric bypass: a trend analysis of the nationwide inpatient sample from 2001 to 2008. Obes Surg. 2012; 22 (2): 220–9. DOI: 10.1007/s11695-011-0575-y
73. Borbély Y, Plebani A, Kröll D et al. Exocrine Pancreatic Insufficiency after Roux-en-Y gastric bypass. Surg Obes Relat Dis. 2016; 12 (4): 790–4. DOI: 10.1016/j.soard.2015.10.084
74. Friess H, Böhm J, Müller MW et al. Maldigestion after total gastrectomy is associated with pancreatic insufficiency. Am J Gastroenterol. 1996; 91 (2): 341–7.
75. Keller J, Layer P. Human pancreatic exocrine response to nutrients in health and disease. Gut. 2005; 54 (Suppl. 6): vi1-28. DOI: 10.1136/gut.2005.065946
76. Vanderveen KA, Grant CS, Thompson GB et al. Outcomes and quality of life after partial pancreatectomy for noninsulinoma pancreatogenous hypoglycemia from diffuse islet cell disease. Surgery. 2010; 148 (6): 1237–45; discussion 1245–6. DOI: 10.1016/j.surg.2010.09.027
77. Poylin V, Serrot FJ, Madoff RD et al. Obesity and bariatric surgery: a systematic review of associations with defecatory dysfunction. Colorectal Dis. 2011; 13 (6): e92–103. DOI: 10.1111/j.1463-1318.2011.02584.x
78. Sherf Dagan S, Goldenshluger A, Globus I et al. Nutritional Recommendations for Adult Bariatric Surgery Patients: Clinical Practice. Adv Nutr. 2017; 8 (2): 382–94. DOI: 10.3945/an.116.014258
79. Miller K, Hell E, Lang B, Lengauer E. Gallstone formation prophylaxis after gastric restrictive procedures for weight loss: a randomized double-blind placebo-controlled trial. Ann Surg. 2003; 238 (5): 697–702. DOI: 10.1097/01.sla.0000094305.77843.cf
80. Bult MJ, van Dalen T, Muller AF. Surgical treatment of obesity. Eur J Endocrinol. 2008; 158 (2): 135–45. DOI: 10.1530/EJE-07-0145
81. Villegas L, Schneider B, Provost D et al. Is routine cholecystectomy required during laparoscopic gastric bypass? Obes Surg. 2004; 14 (2): 206–11. DOI: 10.1381/096089204322857573
82. Wudel LJ Jr, Wright JK, Debelak JP et al. Prevention of gallstone formation in morbidly obese patients undergoing rapid weight loss: results of a randomized controlled pilot study. J Surg Res. 2002; 102 (1): 50–6. DOI: 10.1006/jsre.2001.6322
83. Swanson CM, Roust LR, Miller K, Madura JA 2nd. What every hospitalist should know about the post-bariatric surgery patient. J Hosp Med. 2012; 7 (2): 156–63. DOI: 10.1002/jhm.939
84. Fearon NM, Kearns EC, Kennedy CA et al. The impact of ursodeoxycholic acid on gallstone disease after bariatric surgery: a meta-analysis of randomized control trials. Surg Obes Relat Dis. 2022; 18 (1): 77–84. DOI: 10.1016/j.soard.2021.10.004
85. Gulinac M, Miteva DG, Peshevska-Sekulovska M et al. Long-term effectiveness, outcomes and complications of bariatric surgery. World J Clin Cases. 2023; 11 (19): 4504–12. DOI: 10.12998/wjcc.v11.i19.
4504
86. Pontiroli AE, Morabito A. Long-term prevention of mortality in morbid obesity through bariatric surgery. a systematic review and meta-analysis of trials performed with gastric banding and gastric bypass. Ann Surg. 2011; 253 (3): 484–7. DOI: 10.1097/SLA.0b013e31820d98cb
87. Kwok CS, Pradhan A, Khan MA et al. Bariatric surgery and its impact on cardiovascular disease and mortality: a systematic review and meta-analysis. Int J Cardiol. 2014; 173 (1): 20–8. DOI: 10.1016/j.ijcard.2014.02.026
88. Heber D, Greenway FL, Kaplan LM et al. Endocrine Society. Endocrine and nutritional management of the post-bariatric surgery patient: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2010; 95 (11): 4823–43. DOI: 10.1210/jc.2009-2128
89. Oppert JM, Bellicha A, Roda C et al. Resistance Training and Protein Supplementation Increase Strength After Bariatric Surgery: A Randomized Controlled Trial. Obesity (Silver Spring). 2018; 26 (11): 1709–20. DOI: 10.1002/oby.22317
90. Suhaimi A, Yuliawiratman BS. From Prehab to Rehab: The Functional Restoration of a Bariatric Individual. Bariatric Surgery – From the Non-Surgical Approach to the Post-Surgery Individual Care. 2021; 166 р. DOI: 10.5772/intechopen.94418
12 декабря 2023
Количество просмотров: 1977

