Клинический разбор в общей медицине №8 2023
Ammar Rakan Deia (Mohammad Hadi)1, Aleksandra O. Sosnina2
1 People’s Friendship University of Russia (RUDN University), Moscow, Russia;
2 Vinogradov State Clinical Hospital, Moscow, Russia
kar3745@yandex.ru
Abstract
Pharyngoesophageal diverticulum, or Zenker's diverticulum (ZD), is a rare pathology. With small diverticula that do not cause inflammation in the esophagus, the patient may not have any complaints or may only have a slight cough. As food accumulates in the formed diverticulum, its size increases, which is often accompanied by inflammation of the esophageal wall, compression of nearby organs, development of aspiration pneumonia, and in some cases may lead to esophageal perforation or esophageal bleeding. These complications can be life-threatening, so early diagnosis of ZD is extremely important. The article describes a clinical case of an elderly man with a late diagnosis of pharyngoesophageal diverticulum, complicated by the development of aspiration pneumonia, cachexia, electrolyte disturbances and acute renal failure. The complexity of patient management and diagnosis was due to recurrent aspiration with the development of severe pneumonia and the complexity of endoscopic examination methods.
Key words: pharyngoesophageal diverticulum, Zenker's diverticulum, esophageal obstruction, aspiration pneumonia, infectious esophagitis.
For citation: Arisheva O.S., Karnaushkina M.A., Strutynskaya A.D. et al. Giant Zenker's diverticulum with esophageal obstruction and severe aspiration pneumonia. Clinical review for general practice. 2023; 4 (8): 93–100 (In Russ.). DOI: 10.47407/kr2023.4.8.00336
Дивертикул Ценкера (ДЦ) – это редкое заболевание, встречающееся преимущественно у людей старшего возраста, распространенность которого колеблется от 0,01% до 0,11% [1]. Чаще всего он формируется в ротоглоточном конце пищевода в свободном пространстве между перстнеглоточной мышцей и нижним констриктором глотки. Он также может локализоваться в других частях пищевода, например в зоне Киллиана–Джеймисона (между косыми и поперечными волокнами перстнеглоточной мышцы) или в треугольнике Лаймера (между перстнеглоточной мышцей и пищеводными мышцами) [2–4].
Впервые глоточно-пищеводный дивертикул в 1877 г. был описан Фридрихом Альбертом Ценкером и стал носить его имя [5]. Этиология ДЦ до конца не ясна. По мнению большинства ученых, ведущая роль в его формировании принадлежит аномальному строению перстнеглоточной мышцы, для которого нормальное давление пищевого комка в ходе акта глотания оказывается избыточным, вследствие чего возникает расхождение мышечных волокон и образуется дивертикул [6].
В сформировавшемся глоточно-пищеводном дивертикуле накапливается пища, что часто сопровождается воспалением стенки пищевода, сдавлением близлежащих органов и развитием аспирационной пневмонии. Кроме того, при поздней диагностике и больших размерах ДЦ возможно развитие ряда осложнений: нарушения глотания, регургитации и аспирации пищей, воспаления дивертикулярного мешка, реже – перфорации пищевода или кровотечения. Эти осложнения, безусловно, представляют угрозу для жизни пациента [7]. Поэтому так значима ранняя диагностика и лечение ДЦ.
При небольших дивертикулах, которые не вызывают воспалительных процессов и нарушения состояния или при наличии тяжелых сопутствующих заболеваний, используют наблюдательную тактику. Она направлена, в первую очередь, на уменьшение степени задержки пищевых масс в полости дивертикула и предупреждение застойного дивертикулита [8, 9]. В остальных случаях основным методом лечения является хирургическая коррекция дивертикула.
Представляем клиническое наблюдение пациента с развитием тяжелых осложнений на фоне длительно существующего не диагностированного гигантского ДЦ (рис. 1).
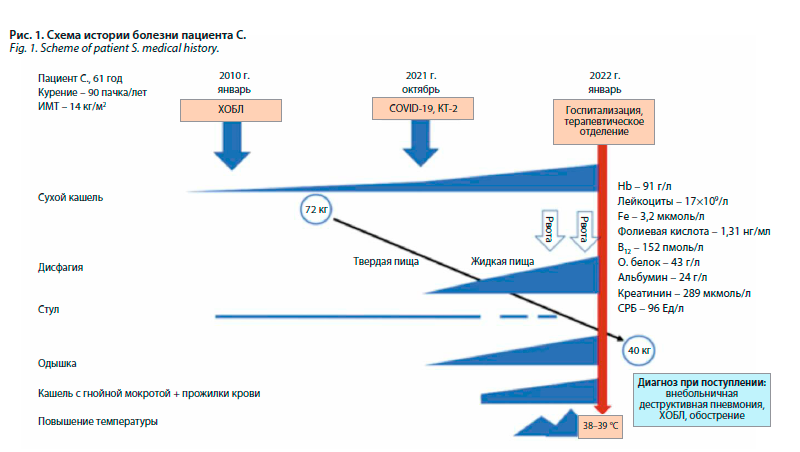
Пациент С. 61 год, поступил в ГКБ им В.В. Виноградова с жалобами на выраженную слабость, одышку в покое, кашель со скудной гнойной мокротой с прожилками крови, невозможность проглатывать как твердую, так и жидкую пищу, повышение температуры тела до 39 °С.
Из анамнеза известно, что пациент ведет малоактивный образ жизни, работает из дома. Курит в течение 33 лет по 30–40 сигарет в сутки. В 2010 г. обратился к врачу по поводу сухого утреннего кашля, был поставлен диагноз – хроническая обструктивная болезнь легких (ХОБЛ). В течение последних 5 лет кашель приобрел «навязчивый» характер и стал беспокоить как в дневное, так и в ночное время, появились неприятные ощущения за грудиной во время «быстрого» приема пищи. После перенесенной в январе 2021 г. новой коронавирусной инфекции появилась и стала нарастать слабость, одышка при физической нагрузке, появились трудности при проглатывании твердой пищи, отметил постепенное снижение массы тела. Кашель сохранялся, однако появилась скудная желтоватая мокрота. При обращении в поликлинику терапевт расценил данные симптомы как постковидный синдром, рекомендовал прием поливитаминов и муколитиков.
На фоне проводимой терапии состояние не улучшилось: наросла слабость, появилось затруднение глотания при приеме жидкой пищи и приступы кашля с гнойной мокротой, сопровождающиеся повышением температуры до субфебрильных значений. При повторном обращении к терапевту состояние было расценено как обострение ХОБЛ. Обследование не проводилось. Рекомендованы ингаляционные бронходилататоры.
В декабре 2021 г. состояние ухудшилось: появилась рвота через 3–5 мин после приема любого количества твердой и 3–4 ложек жидкой пищи. Продолжалось снижение массы тела, нарастание слабости, перестал вставать с кровати, стал отказываться от еды, чтобы не провоцировать рвоту, стул стал редким (1 раз в 7–8 дней).
В январе 2022 г. резко усилился кашель, мокрота приобрела гнойный характер, появились прожилки крови, температура повысилась до фебрильных цифр. Госпитализирован в ГКБ им. В.В. Виноградова с направительным диагнозом: внебольничная полисегментарная деструктивная пневмония – тяжелое течение, ХОБЛ, обострение, ДН 1.
При поступлении состояние тяжелое. Температура – 38,7 °С. Кожные покровы и видимые слизистые землистого цвета. Тургор кожи резко снижен. Кахексия. Индекс массы тела (ИМТ) – 14 кг/м2. Стопы и голени пастозны. Грудная клетка эмфизематозна. Перкуторный звук – коробочный. Дыхание – проводится во все отделы, жесткое, разнотембровые сухие хрипы над всей поверхностью легких. ЧДД – 22 в мин. Сатурация (Sat) O2 – 92% при дыхании комнатным воздухом. Тоны сердца приглушены, ритмичны. Шумы – не выслушиваются. Артериальное давление (АД) – 90/50 мм рт. ст., пульс – 120 уд/мин. Живот мягкий, слабо болезненный при пальпации в эпигастрии. Печень перкуторно не увеличена. Край печени ровный мягкоэластичный. Селезенка не пальпируется.
По данным инструментально-лабораторного обследования, выявлены следующие синдромы:
1. Анемия: гемоглобин – 91 г/л, MCV – 87 фл, MCH – 28,3 пг, ферритин – 609 мкг/л, Fe2+ – 3,2 мкмоль/л, фолиевая кислота – 1,31 нг/мл, В12 – 152 пмоль/л.
2. Общевоспалительный синдром: лейкоциты –
17,0×109/л, нейтрофилы – 82 (палочкоядерные – 8%),
С-реактивный белок (СРБ) – 96 Ед/л, ферритин –
609 мкг/л, прокальцитонин – 0,05 нг/мл.
3. Острое повреждение почек (ОПП): креатинин – 289 мкмоль/л, мочевина – 33,6 ммоль/л, скорость клубочковой фильтрации (СКФ) – 19 мл/мин/1,73 м2, с незначительными электролитными нарушениями: Na+ – 128,8 ммоль/л, Cl- – 94 ммоль/л, K+ – 4,2 ммоль/л.
4. Гипопротеинемия: снижение общего белка – 43 г/л, альбумина – 24 г/л.
5. Пищеводная дисфагия: при проведении рентгеноскопии пищевода с водорастворимым контрастом выявлена задержка контрастного препарата в области глоточно-пищеводного перехода, где визуализируется округлой формы тень диаметром до 71 мм с полукруглым четким нижним контуром и горизонтальной верхней границей, далее просвет пищевода не визуализируется в течение 2 ч после приема контраста (рис. 2).
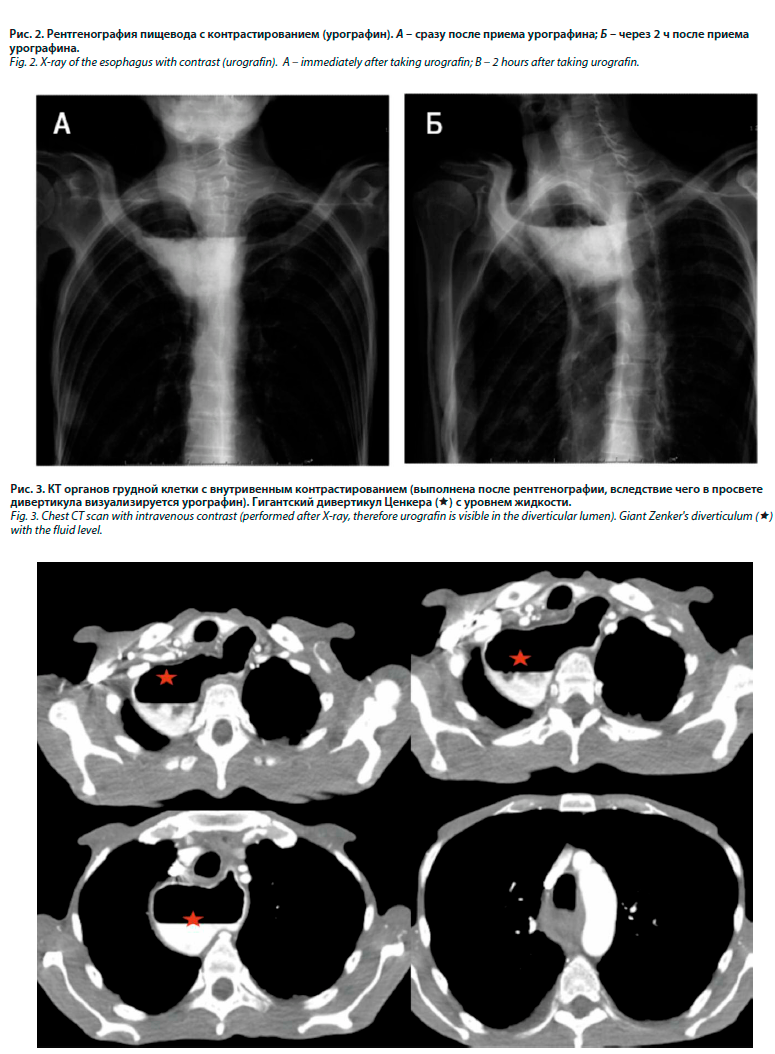
На компьютерной томографии (КТ) органов грудной клетки с внутривенным контрастированием в проекции пищевода в верхнем и среднем средостении определяется образование с уровнем жидкости диаметром 89 мм, распространяющееся до уровня бифуркации трахеи, соответствующее ДЦ. Признаков воспаления не выявлено (рис. 3). На эзофагогастродуоденоскопии (ЭГДС) в области глоточно-пищеводного перехода визуализируется вход в полость мешковидной формы, протяженностью до 10 см. Вход в пищевод не визуализируется.
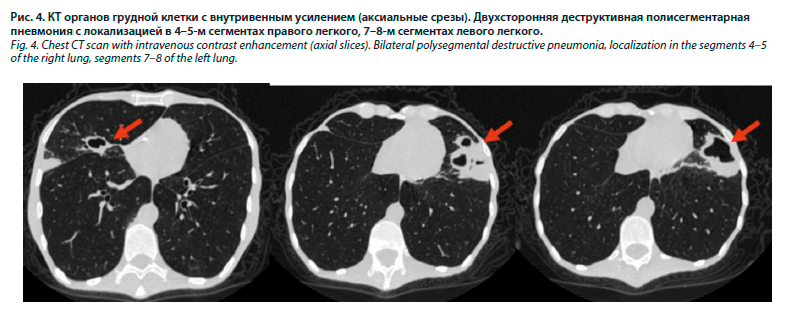
6. Синдром деструкции легочной ткани: на КТ органов грудной клетки в 4-м сегменте правого легкого субплеврально определяется зона консолидации; в 5-м сегменте правого легкого и 8-м сегменте левого легкого – полости с толстыми неровными стенками с уровнями жидкости. Описанная картина соответствует двухсторонней аспирационной деструктивной полисегментарной пневмонии (рис. 4). При фибробронхоскопии выявлены признаки гнойного диффузного эндобронхита. При проведении санации удалены фрагменты пищи. Микробиологическое исследование бронхиального аспирата: Escherichia coli – 106, Klebsiella pneumoniae – 107.
Поскольку одним из ведущих синдромов являлась дисфагия, пациенту также проведены обследования, позволявшие исключить не только пищеводные, но и основные внепищеводные причины нарушения глотания. Специалисты исключили нейромышечные заболевания и нарушение мозгового кровообращения, патологию щитовидной железы (выявлены нормальные уровни тиреотропного гормона, тироксина и трийодтиронина и отсутствие патологии при ультразвуковом исследовании щитовидной железы), заболевания соединительной ткани (креатинфосфокиназа, антинуклеарный фактор, анти-Jo-1 – норма; данных, подтверждающих склеродермию, антисинтетазный синдром и дерматомиозит не получено). Оториноларинголог установил наличие хронического фарингита. Эхокардиография показала удовлетворительную сократительную способность левого желудочка (фракция выброса – 68%), систолическое давление в легочной артерии –
28 мм рт. ст.
На основании данных проведенного обследования основной диагноз сформулирован как «Фаринго-эзофагиальный (ценкеровский) дивертикул, 3-я стадия, инфекционный эзофагит». Осложнения: внебольничная двухсторонняя полисегментарная деструктивная пневмония (аспирационная) – тяжелое течение, кахексия, непроходимость пищевода, синдром электролитных нарушений.
Пациенту назначена антибактериальная терапия (меропенем 1 г 3 раза в день), муколитическая терапия (ацетилцистеин 300 мг 2 раза в день), бронхолитическая терапия (ипратропия бромид + фенотерол 0,5 мг 3 раза в день), инфузионная терапия (0,9% NaCl 500 мл + 5% глюкоза 500 мл 2 раза в день), альбумин (20% 100 мл 1 раз в день). Проводилась ежедневная эндоскопическая санация дивертикула. С учетом невозможности питания пациента через рот пациенту наложена гастростома. После консультации с торакальным хирургом принято решение об отказе от оперативного лечения ДЦ в данном случае в связи с тяжестью состояния пациента (инфекционно-воспалительного синдрома, аспирационной пневмонии, кахексии, почечной недостаточности).
На фоне проводимого лечения отмечалась положительная динамика в состоянии пациента: воспалительный синдром, признаки дыхательной недостаточности и острое почечное повреждение, гипоальбуминемия, водно-электролитные нарушения регрессировали (лейкоциты – 8,23×109/л, нейтрофилы – 6,22%, СРБ – 7,6 Ед/л, Sat O2 – 97%, креатинин – 91 ммоль/л, мочевина – 5 ммоль/л, СКФ – 78 мл/мин/1,73 м2, Na+ – 138 ммоль/л, Cl- – 102 ммоль/л, гемоглобин – 97 г/л). За время госпитализации наблюдалось увеличение массы тела на 4 кг, пациент стал самостоятельно себя обслуживать и ходить.
На контрольной КТ органов грудной клетки отмечалась выраженная положительная динамика в виде отсутствия признаков воспалительной инфильтрации, уменьшения толщины стенок выявленных ранее полостей и отсутствия содержимого в них.
При повторной ЭГДС размеры и положение дивертикула не изменились, отмечается появление плотного белого налета (по данным гистологического исследования – кандидозный эзофагит). Вход в пищевод расположен на 20 см по отметке эндоскопа на 1 часе условного циферблата. Эндоскоп диаметром 0,9 см проведен в просвет желудка. Просвет пищевода хорошо расправляется воздухом, слизистая оболочка – бледно-розовая, гладкая, блестящая. Зубчатая линяя выражена хорошо. Кардия свободно проходима. Желудок при инсуфляции хорошо расправляется воздухом, стенки – эластичные. Складки среднего калибра, извиты, расположены продольно. Слизистая оболочка бледно-розовая. В антральном отделе по передней стенке определяется дистальный конец гастростомической трубки.
Пациент выписан в удовлетворительном состоянии с рекомендацией продолжить лечение в НИИ скорой помощи им. Н.В. Склифосовского. Рекомендовано питание через гастростому, прием флюконалола 200 мг/сут в течение 3 нед. Через 2 мес после выписки из ГКБ им В.В. Виноградова на КТ органов грудной клетки изменений в легочной ткани не визуализируется. Через 3 мес после выписки – в НИИ скорой помощи им.
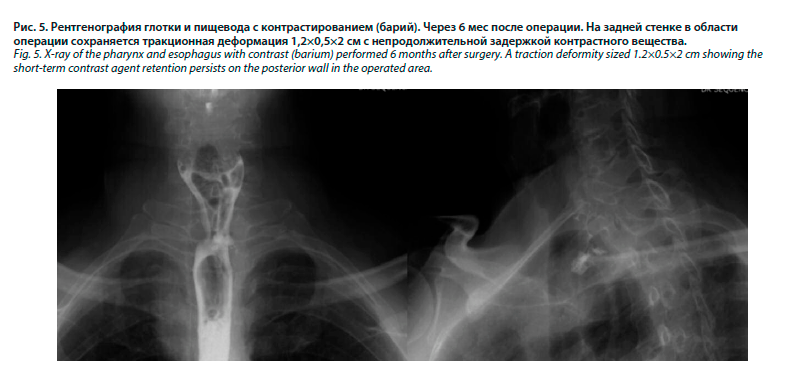
Н.В. Склифосовского пациенту удалена гастростома и проведена дивертикулэктомия левосторонним шейным доступом. При проведении контрольной рентгеноскопии глотки и пищевода с контрастированием акт глотания не нарушен, пищевод свободно проходим, на уровне С7-Th1 отмечается небольшая дивертикулоподобная деформация задне-правой стенки, затекание контраста за контуры не выявлено (рис. 5).
В настоящее время состояние пациента удовлетворительное, самочувствие хорошее. Дисфагия полностью регрессировала. Набрал 40 кг за 1,5 года (ИМТ – 28 кг/м2), одышка возникает только при выраженной физической нагрузке. Рекомендован отказ от курения, дообследование у пульмонолога для подтверждения диагноза ХОБЛ и подбора при необходимости постоянной ингаляционной терапии.
В представленном клиническом случае ведущими синдромами являлись дисфагия и синдром бронхолегочной инфекции. Врачам необходимо было экстренно выявить их причины.
В первую очередь необходимо было установить причину дисфагии – ротоглоточную или пищеводную, которые отличаются по локализации процесса и быстроте возникновения симптомов [9]. В первом случае нарушается формирование пищевого комка в полости рта, его продвижение в направлении горла и начальные глотательные движения. Во втором случае затрудняется прохождение пищи непосредственно по пищеводу и попадание ее в желудок. Поэтому для ротоглоточной дисфагии характерно появление симптомов сразу после приема пищи (<2 с), регургитация в носоглотку, охриплость голоса, частые аспирации. Причиной ротоглоточной дисфагии являются состояния, нарушающие поступление пищи в пищевод. Например, нарушение мозгового кровообращения, миопатии, дерматомиозит, склеродермия. Все эти заболевания были исключены у пациента в ходе проведенного обследования. Жалобы, предъявляемые им, также не соответствовали данной форме дисфагии. Вторая форма дисфагии – пищеводная – характеризуется медленным началом симптомов после приема пищи (>2 с), ощущением препятствия или болью при прохождении пищи по пищеводу. Наиболее часто она развивается у курящих мужчин старше 50 лет [10]. В представленном случае у пациента отмечалась именно пищеводная дисфагия.
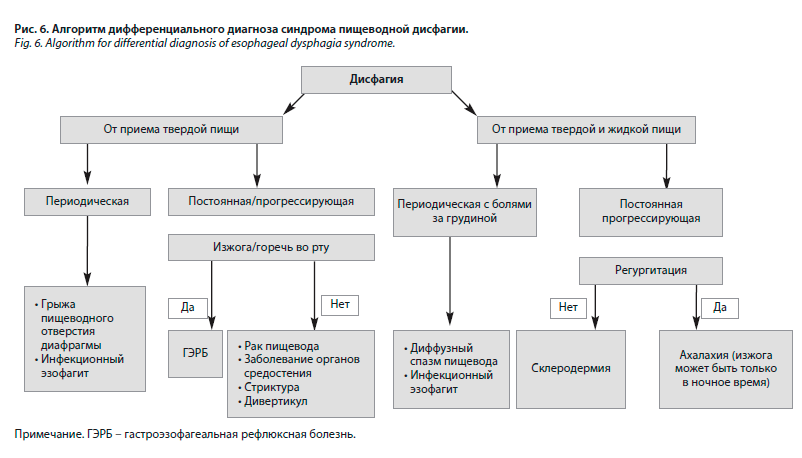
Следующим диагностическим этапом являлось подтверждение диагноза и выявление непосредственной причины развития дисфагии (рис. 6) [10].
В качестве первого метода обследования была выбрана рентгеноскопия пищевода с контрастированием, поскольку данный метод более безопасен, чем эзофагогастродуоденоскопия, и имеет меньший риск перфорации пищевода у пациентов с подозрением на его сужение. В качестве контрастного вещества выбран водорастворимый урографин, поскольку у пациента имелась клиническая картина непроходимости пищевода 3-й степени. Наличие сужения пищевода также было подтверждено при проведении КТ органов грудной клетки с контрастированием и ЭГДС. Согласно представленному алгоритму диагностики (см. рис. 6) при проведении данных исследований были исключены заболевания средостения. Однако только после проведения контрольной ЭГДС и КТ органов грудной клетки были исключены опухоль пищевода и его стриктура, а также выявлен инфекционный эзофагит, осложнивший течение основного заболевания.
При ретроспективном анализе истории заболевания можно предположить, что сухой «навязчивый» кашель, который беспокоил пациента в течение последних 10 лет, и неприятные ощущения за грудиной во время «быстрого» приема пищи являлись проявлением не ХОБЛ, а прогрессирующего течения глоточно-пищеводного дивертикула.
По данным литературы, как раз ощущение першения, жжения в горле, сухой кашель часто являются первыми симптомами ДЦ и неправильно интерпретируются врачами при первичном обращении пациента. В некоторых случаях проводится терапия заболеваний зева, гортани, легких. В дальнейшем, по мере увеличения дивертикула в объеме, появляется дисфагия, которая и становится ведущим синдромом. Затем может присоединиться регургитация и срыгивание принятой пищи. Кроме того, у некоторых пациентов может наблюдаться затруднение дыхания и осиплость голоса, являющиеся соответственно признаками сдавления трахеи и возвратного гортанного нерва [11]. Попадание застойного содержимого дивертикула в дыхательные пути приводит к развитию аспирационных пневмоний, что и наблюдалось у представленного пациента. С учетом кахексии и наличия непроходимости пищевода возникла необходимость провести дифференциальную диагностику с опухолевым, рубцовым или иным механическим сужением пищевода. Исключению данных групп заболеваний всегда необходимо уделять пристальное внимание, поскольку эти патологии вызывают дисфагию чаще дивертикула.
Наличие синдрома бронхолегочной инфекции у представленного пациента в виде повышения температуры тела, кашля, лейкоцитоза, повышения СРБ и деструктивных изменений в легочной ткани не только обусловило тяжесть состояния пациента, но и затруднило диагностику, требуя исключения не только аспирационной, но и параканкрозной пневмонии у пациента с заболеванием пищевода. Аспирационный генез пневмонии был заподозрен в связи с тем, что любая дисфагия является одним из ведущих состояний, предрасполагающих к развитию аспирации. Учитывая характерную рентгенологическую картину, положительный ответ на антибактериальную терапию и полный регресс воспалительных изменений в легочной ткани можно говорить, что данная пневмония носила именно аспирационный характер. Кроме того, при бронхоскопии, проведенной в ходе обследования, установлено наличие пищи в бронхах. Антибактериальная терапия карбапенемами была выбрана, поскольку пневмония носила деструктивный характер и не исключался эпизод аспирации [12]. Полученные в последующем результаты микробиологического исследования подтвердили правильность выбранной антибактериальной терапии, а проведение санации бронхиального дерева позволило как восстановить проходимость обтурированных аспирационным содержимым бронхов, так и получить дополнительные данные, исключающие опухолевое заболевание.
Основная роль в диагностике данного заболевания принадлежит рентгенологическому контрастному полипозиционному исследованию пищевода, которое позволяет выявить локализацию, форму и размеры дивертикула, длительность
задержки бария и степень нарушения проходимости пищевода. Уникальность нашего наблюдения заключается в диагностировании редко встречающегося дивертикула очень больших размеров – гигантского ДЦ – который привел к развитию тяжелых осложнений (кахексии, электролитных нарушений и аспирационной пневмонии).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Аришева Ольга Сергеевна – канд. мед. наук, доц. каф. внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В.С. Моисеева, ФГАОУ ВО РУДН. E-mail: olga.arisheva@yandex.ru; ORCID: 0000-0002-3569-4597
Olga S. Arisheva – Cand. Sci. (Med.), People’s Friendship University of Russia (RUDN University). E-mail: olga.arisheva@yandex.ru; ORCID: 0000-0002-3569-4597
Карнаушкина Мария Александровна – д-р мед. наук, доц., проф. каф. внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В.С. Моисеева, ФГАОУ ВО РУДН. E-mail: kar3745@yandex.ru; ORCID: 0000-0002-8791-2920
Maria A. Karnaushkina – Dr. Sci. (Med.), Prof., People’s Friendship University of Russia (RUDN University). E-mail: kar3745@yandex.ru; ORCID: 0000-0002-8791-2920
Струтынская Анастасия Дмитриевна – канд. мед. наук, науч. сотр. лаборатории Научного центра интегративной и трансляционной медицины МИ, ФГАОУ ВО РУДН. E-mail: strutynskaya@yandex.ru; ORCID: 0000-0001-9325-5580
Anastasia D. Strutynskaya – Cand. Sci. (Med.), Res. Officer, People’s Friendship University of Russia (RUDN University). E-mail: strutynskaya@yandex.ru; ORCID: 0000-0001-9325-5580
Аммар Ракан Дейа (Мохаммад Хади) – аспирант каф. внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В.С. Моисеева, ФГАОУ ВО РУДН. E-mail: rakan_deya@icloud.com; ORCID: 0009-0008-6210-0310
Ammar Rakan Deia (Mohammad Hadi) – Graduate Student, People’s Friendship University of Russia (RUDN University). E-mail: rakan_deya@icloud.com; ORCID: 0009-0008-6210-0310
Соснина Александра Олеговна – врач-терапевт отделения терапии, ГБУЗ «ГКБ им. В.В. Виноградова». E-mail: beecynic@mail.ru
Aleksandra O. Sosnina – therapist, Vinogradov State Clinical Hospital. E-mail: beecynic@mail.ru
Поступила в редакцию: 19.10.2023
Поступила после рецензирования: 27.10.2023
Принята к публикации: 02.11.2023
Received: 19.10.2023
Revised: 27.10.2023
Accepted: 02.11.2023
Клинический разбор в общей медицине №8 2023
Гигантский дивертикул Ценкера с непроходимостью пищевода и тяжелой аспирационной пневмонией
Номера страниц в выпуске:93-100
Аннотация
Глоточно-пищеводный дивертикул или дивертикул Ценкера (ДЦ) является редкой патологией. При небольших дивертикулах, не вызывающих воспалительных процессов в пищеводе, пациент может не предъявлять жалобы или его будет беспокоить только незначительный кашель. По мере накопления пищи в сформировавшемся дивертикуле его размеры увеличиваются, что часто сопровождается воспалением стенки пищевода, сдавлением близлежащих органов, развитием аспирационной пневмонии, реже – перфорацией пищевода или кровотечением. Эти осложнения могут представлять угрозу для жизни пациента, поэтому ранняя постановка диагноза ДЦ имеет крайне важное значение. В статье представлено описание клинического случая поздней диагностики глоточно-пищеводного дивертикула у пожилого мужчины, осложнившегося развитием аспирационной пневмонии, кахексии, электролитных нарушений и острой почечной недостаточности. Сложность ведения пациента и постановка диагноза была обусловлена рецидивирующей аспирацией с развитием тяжелой пневмонии и сложностью проведения эндоскопических методов обследования.
Ключевые слова: глоточно-пищеводный дивертикул, дивертикул Ценкера, непроходимость пищевода, аспирационная пневмония, инфекционный эзофагит.
Для цитирования: Аришева О.С., Карнаушкина М.А., Струтынская А.Д. и др. Гигантский дивертикул Ценкера с непроходимостью пищевода и тяжелой аспирационной пневмонией. Клинический разбор в общей медицине. 2023; 4 (8): 93–100.
DOI: 10.47407/kr2023.4.8.00336
Глоточно-пищеводный дивертикул или дивертикул Ценкера (ДЦ) является редкой патологией. При небольших дивертикулах, не вызывающих воспалительных процессов в пищеводе, пациент может не предъявлять жалобы или его будет беспокоить только незначительный кашель. По мере накопления пищи в сформировавшемся дивертикуле его размеры увеличиваются, что часто сопровождается воспалением стенки пищевода, сдавлением близлежащих органов, развитием аспирационной пневмонии, реже – перфорацией пищевода или кровотечением. Эти осложнения могут представлять угрозу для жизни пациента, поэтому ранняя постановка диагноза ДЦ имеет крайне важное значение. В статье представлено описание клинического случая поздней диагностики глоточно-пищеводного дивертикула у пожилого мужчины, осложнившегося развитием аспирационной пневмонии, кахексии, электролитных нарушений и острой почечной недостаточности. Сложность ведения пациента и постановка диагноза была обусловлена рецидивирующей аспирацией с развитием тяжелой пневмонии и сложностью проведения эндоскопических методов обследования.
Ключевые слова: глоточно-пищеводный дивертикул, дивертикул Ценкера, непроходимость пищевода, аспирационная пневмония, инфекционный эзофагит.
Для цитирования: Аришева О.С., Карнаушкина М.А., Струтынская А.Д. и др. Гигантский дивертикул Ценкера с непроходимостью пищевода и тяжелой аспирационной пневмонией. Клинический разбор в общей медицине. 2023; 4 (8): 93–100.
DOI: 10.47407/kr2023.4.8.00336
Giant Zenker's diverticulum with esophageal obstruction and severe aspiration pneumonia
Olga S. Arisheva1, Maria A. Karnaushkina1, Anastasia D. Strutynskaya1,Ammar Rakan Deia (Mohammad Hadi)1, Aleksandra O. Sosnina2
1 People’s Friendship University of Russia (RUDN University), Moscow, Russia;
2 Vinogradov State Clinical Hospital, Moscow, Russia
kar3745@yandex.ru
Abstract
Pharyngoesophageal diverticulum, or Zenker's diverticulum (ZD), is a rare pathology. With small diverticula that do not cause inflammation in the esophagus, the patient may not have any complaints or may only have a slight cough. As food accumulates in the formed diverticulum, its size increases, which is often accompanied by inflammation of the esophageal wall, compression of nearby organs, development of aspiration pneumonia, and in some cases may lead to esophageal perforation or esophageal bleeding. These complications can be life-threatening, so early diagnosis of ZD is extremely important. The article describes a clinical case of an elderly man with a late diagnosis of pharyngoesophageal diverticulum, complicated by the development of aspiration pneumonia, cachexia, electrolyte disturbances and acute renal failure. The complexity of patient management and diagnosis was due to recurrent aspiration with the development of severe pneumonia and the complexity of endoscopic examination methods.
Key words: pharyngoesophageal diverticulum, Zenker's diverticulum, esophageal obstruction, aspiration pneumonia, infectious esophagitis.
For citation: Arisheva O.S., Karnaushkina M.A., Strutynskaya A.D. et al. Giant Zenker's diverticulum with esophageal obstruction and severe aspiration pneumonia. Clinical review for general practice. 2023; 4 (8): 93–100 (In Russ.). DOI: 10.47407/kr2023.4.8.00336
Дивертикул Ценкера (ДЦ) – это редкое заболевание, встречающееся преимущественно у людей старшего возраста, распространенность которого колеблется от 0,01% до 0,11% [1]. Чаще всего он формируется в ротоглоточном конце пищевода в свободном пространстве между перстнеглоточной мышцей и нижним констриктором глотки. Он также может локализоваться в других частях пищевода, например в зоне Киллиана–Джеймисона (между косыми и поперечными волокнами перстнеглоточной мышцы) или в треугольнике Лаймера (между перстнеглоточной мышцей и пищеводными мышцами) [2–4].
Впервые глоточно-пищеводный дивертикул в 1877 г. был описан Фридрихом Альбертом Ценкером и стал носить его имя [5]. Этиология ДЦ до конца не ясна. По мнению большинства ученых, ведущая роль в его формировании принадлежит аномальному строению перстнеглоточной мышцы, для которого нормальное давление пищевого комка в ходе акта глотания оказывается избыточным, вследствие чего возникает расхождение мышечных волокон и образуется дивертикул [6].
В сформировавшемся глоточно-пищеводном дивертикуле накапливается пища, что часто сопровождается воспалением стенки пищевода, сдавлением близлежащих органов и развитием аспирационной пневмонии. Кроме того, при поздней диагностике и больших размерах ДЦ возможно развитие ряда осложнений: нарушения глотания, регургитации и аспирации пищей, воспаления дивертикулярного мешка, реже – перфорации пищевода или кровотечения. Эти осложнения, безусловно, представляют угрозу для жизни пациента [7]. Поэтому так значима ранняя диагностика и лечение ДЦ.
При небольших дивертикулах, которые не вызывают воспалительных процессов и нарушения состояния или при наличии тяжелых сопутствующих заболеваний, используют наблюдательную тактику. Она направлена, в первую очередь, на уменьшение степени задержки пищевых масс в полости дивертикула и предупреждение застойного дивертикулита [8, 9]. В остальных случаях основным методом лечения является хирургическая коррекция дивертикула.
Представляем клиническое наблюдение пациента с развитием тяжелых осложнений на фоне длительно существующего не диагностированного гигантского ДЦ (рис. 1).

Пациент С. 61 год, поступил в ГКБ им В.В. Виноградова с жалобами на выраженную слабость, одышку в покое, кашель со скудной гнойной мокротой с прожилками крови, невозможность проглатывать как твердую, так и жидкую пищу, повышение температуры тела до 39 °С.
Из анамнеза известно, что пациент ведет малоактивный образ жизни, работает из дома. Курит в течение 33 лет по 30–40 сигарет в сутки. В 2010 г. обратился к врачу по поводу сухого утреннего кашля, был поставлен диагноз – хроническая обструктивная болезнь легких (ХОБЛ). В течение последних 5 лет кашель приобрел «навязчивый» характер и стал беспокоить как в дневное, так и в ночное время, появились неприятные ощущения за грудиной во время «быстрого» приема пищи. После перенесенной в январе 2021 г. новой коронавирусной инфекции появилась и стала нарастать слабость, одышка при физической нагрузке, появились трудности при проглатывании твердой пищи, отметил постепенное снижение массы тела. Кашель сохранялся, однако появилась скудная желтоватая мокрота. При обращении в поликлинику терапевт расценил данные симптомы как постковидный синдром, рекомендовал прием поливитаминов и муколитиков.
На фоне проводимой терапии состояние не улучшилось: наросла слабость, появилось затруднение глотания при приеме жидкой пищи и приступы кашля с гнойной мокротой, сопровождающиеся повышением температуры до субфебрильных значений. При повторном обращении к терапевту состояние было расценено как обострение ХОБЛ. Обследование не проводилось. Рекомендованы ингаляционные бронходилататоры.
В декабре 2021 г. состояние ухудшилось: появилась рвота через 3–5 мин после приема любого количества твердой и 3–4 ложек жидкой пищи. Продолжалось снижение массы тела, нарастание слабости, перестал вставать с кровати, стал отказываться от еды, чтобы не провоцировать рвоту, стул стал редким (1 раз в 7–8 дней).
В январе 2022 г. резко усилился кашель, мокрота приобрела гнойный характер, появились прожилки крови, температура повысилась до фебрильных цифр. Госпитализирован в ГКБ им. В.В. Виноградова с направительным диагнозом: внебольничная полисегментарная деструктивная пневмония – тяжелое течение, ХОБЛ, обострение, ДН 1.
При поступлении состояние тяжелое. Температура – 38,7 °С. Кожные покровы и видимые слизистые землистого цвета. Тургор кожи резко снижен. Кахексия. Индекс массы тела (ИМТ) – 14 кг/м2. Стопы и голени пастозны. Грудная клетка эмфизематозна. Перкуторный звук – коробочный. Дыхание – проводится во все отделы, жесткое, разнотембровые сухие хрипы над всей поверхностью легких. ЧДД – 22 в мин. Сатурация (Sat) O2 – 92% при дыхании комнатным воздухом. Тоны сердца приглушены, ритмичны. Шумы – не выслушиваются. Артериальное давление (АД) – 90/50 мм рт. ст., пульс – 120 уд/мин. Живот мягкий, слабо болезненный при пальпации в эпигастрии. Печень перкуторно не увеличена. Край печени ровный мягкоэластичный. Селезенка не пальпируется.
По данным инструментально-лабораторного обследования, выявлены следующие синдромы:
1. Анемия: гемоглобин – 91 г/л, MCV – 87 фл, MCH – 28,3 пг, ферритин – 609 мкг/л, Fe2+ – 3,2 мкмоль/л, фолиевая кислота – 1,31 нг/мл, В12 – 152 пмоль/л.
2. Общевоспалительный синдром: лейкоциты –
17,0×109/л, нейтрофилы – 82 (палочкоядерные – 8%),
С-реактивный белок (СРБ) – 96 Ед/л, ферритин –
609 мкг/л, прокальцитонин – 0,05 нг/мл.
3. Острое повреждение почек (ОПП): креатинин – 289 мкмоль/л, мочевина – 33,6 ммоль/л, скорость клубочковой фильтрации (СКФ) – 19 мл/мин/1,73 м2, с незначительными электролитными нарушениями: Na+ – 128,8 ммоль/л, Cl- – 94 ммоль/л, K+ – 4,2 ммоль/л.
4. Гипопротеинемия: снижение общего белка – 43 г/л, альбумина – 24 г/л.
5. Пищеводная дисфагия: при проведении рентгеноскопии пищевода с водорастворимым контрастом выявлена задержка контрастного препарата в области глоточно-пищеводного перехода, где визуализируется округлой формы тень диаметром до 71 мм с полукруглым четким нижним контуром и горизонтальной верхней границей, далее просвет пищевода не визуализируется в течение 2 ч после приема контраста (рис. 2).

На компьютерной томографии (КТ) органов грудной клетки с внутривенным контрастированием в проекции пищевода в верхнем и среднем средостении определяется образование с уровнем жидкости диаметром 89 мм, распространяющееся до уровня бифуркации трахеи, соответствующее ДЦ. Признаков воспаления не выявлено (рис. 3). На эзофагогастродуоденоскопии (ЭГДС) в области глоточно-пищеводного перехода визуализируется вход в полость мешковидной формы, протяженностью до 10 см. Вход в пищевод не визуализируется.
6. Синдром деструкции легочной ткани: на КТ органов грудной клетки в 4-м сегменте правого легкого субплеврально определяется зона консолидации; в 5-м сегменте правого легкого и 8-м сегменте левого легкого – полости с толстыми неровными стенками с уровнями жидкости. Описанная картина соответствует двухсторонней аспирационной деструктивной полисегментарной пневмонии (рис. 4). При фибробронхоскопии выявлены признаки гнойного диффузного эндобронхита. При проведении санации удалены фрагменты пищи. Микробиологическое исследование бронхиального аспирата: Escherichia coli – 106, Klebsiella pneumoniae – 107.

Поскольку одним из ведущих синдромов являлась дисфагия, пациенту также проведены обследования, позволявшие исключить не только пищеводные, но и основные внепищеводные причины нарушения глотания. Специалисты исключили нейромышечные заболевания и нарушение мозгового кровообращения, патологию щитовидной железы (выявлены нормальные уровни тиреотропного гормона, тироксина и трийодтиронина и отсутствие патологии при ультразвуковом исследовании щитовидной железы), заболевания соединительной ткани (креатинфосфокиназа, антинуклеарный фактор, анти-Jo-1 – норма; данных, подтверждающих склеродермию, антисинтетазный синдром и дерматомиозит не получено). Оториноларинголог установил наличие хронического фарингита. Эхокардиография показала удовлетворительную сократительную способность левого желудочка (фракция выброса – 68%), систолическое давление в легочной артерии –
28 мм рт. ст.
На основании данных проведенного обследования основной диагноз сформулирован как «Фаринго-эзофагиальный (ценкеровский) дивертикул, 3-я стадия, инфекционный эзофагит». Осложнения: внебольничная двухсторонняя полисегментарная деструктивная пневмония (аспирационная) – тяжелое течение, кахексия, непроходимость пищевода, синдром электролитных нарушений.
Пациенту назначена антибактериальная терапия (меропенем 1 г 3 раза в день), муколитическая терапия (ацетилцистеин 300 мг 2 раза в день), бронхолитическая терапия (ипратропия бромид + фенотерол 0,5 мг 3 раза в день), инфузионная терапия (0,9% NaCl 500 мл + 5% глюкоза 500 мл 2 раза в день), альбумин (20% 100 мл 1 раз в день). Проводилась ежедневная эндоскопическая санация дивертикула. С учетом невозможности питания пациента через рот пациенту наложена гастростома. После консультации с торакальным хирургом принято решение об отказе от оперативного лечения ДЦ в данном случае в связи с тяжестью состояния пациента (инфекционно-воспалительного синдрома, аспирационной пневмонии, кахексии, почечной недостаточности).
На фоне проводимого лечения отмечалась положительная динамика в состоянии пациента: воспалительный синдром, признаки дыхательной недостаточности и острое почечное повреждение, гипоальбуминемия, водно-электролитные нарушения регрессировали (лейкоциты – 8,23×109/л, нейтрофилы – 6,22%, СРБ – 7,6 Ед/л, Sat O2 – 97%, креатинин – 91 ммоль/л, мочевина – 5 ммоль/л, СКФ – 78 мл/мин/1,73 м2, Na+ – 138 ммоль/л, Cl- – 102 ммоль/л, гемоглобин – 97 г/л). За время госпитализации наблюдалось увеличение массы тела на 4 кг, пациент стал самостоятельно себя обслуживать и ходить.
На контрольной КТ органов грудной клетки отмечалась выраженная положительная динамика в виде отсутствия признаков воспалительной инфильтрации, уменьшения толщины стенок выявленных ранее полостей и отсутствия содержимого в них.
При повторной ЭГДС размеры и положение дивертикула не изменились, отмечается появление плотного белого налета (по данным гистологического исследования – кандидозный эзофагит). Вход в пищевод расположен на 20 см по отметке эндоскопа на 1 часе условного циферблата. Эндоскоп диаметром 0,9 см проведен в просвет желудка. Просвет пищевода хорошо расправляется воздухом, слизистая оболочка – бледно-розовая, гладкая, блестящая. Зубчатая линяя выражена хорошо. Кардия свободно проходима. Желудок при инсуфляции хорошо расправляется воздухом, стенки – эластичные. Складки среднего калибра, извиты, расположены продольно. Слизистая оболочка бледно-розовая. В антральном отделе по передней стенке определяется дистальный конец гастростомической трубки.
Пациент выписан в удовлетворительном состоянии с рекомендацией продолжить лечение в НИИ скорой помощи им. Н.В. Склифосовского. Рекомендовано питание через гастростому, прием флюконалола 200 мг/сут в течение 3 нед. Через 2 мес после выписки из ГКБ им В.В. Виноградова на КТ органов грудной клетки изменений в легочной ткани не визуализируется. Через 3 мес после выписки – в НИИ скорой помощи им.
Н.В. Склифосовского пациенту удалена гастростома и проведена дивертикулэктомия левосторонним шейным доступом. При проведении контрольной рентгеноскопии глотки и пищевода с контрастированием акт глотания не нарушен, пищевод свободно проходим, на уровне С7-Th1 отмечается небольшая дивертикулоподобная деформация задне-правой стенки, затекание контраста за контуры не выявлено (рис. 5).

В настоящее время состояние пациента удовлетворительное, самочувствие хорошее. Дисфагия полностью регрессировала. Набрал 40 кг за 1,5 года (ИМТ – 28 кг/м2), одышка возникает только при выраженной физической нагрузке. Рекомендован отказ от курения, дообследование у пульмонолога для подтверждения диагноза ХОБЛ и подбора при необходимости постоянной ингаляционной терапии.
Обсуждение
Z. Nesheiwat и соавт. в опубликованном в 2023 г. обзоре литературы показал, что клиническая симптоматика у пациента с ДЦ может проявляться по-разному, в зависимости от величины патологического образования и наличия осложнений [2].В представленном клиническом случае ведущими синдромами являлись дисфагия и синдром бронхолегочной инфекции. Врачам необходимо было экстренно выявить их причины.
В первую очередь необходимо было установить причину дисфагии – ротоглоточную или пищеводную, которые отличаются по локализации процесса и быстроте возникновения симптомов [9]. В первом случае нарушается формирование пищевого комка в полости рта, его продвижение в направлении горла и начальные глотательные движения. Во втором случае затрудняется прохождение пищи непосредственно по пищеводу и попадание ее в желудок. Поэтому для ротоглоточной дисфагии характерно появление симптомов сразу после приема пищи (<2 с), регургитация в носоглотку, охриплость голоса, частые аспирации. Причиной ротоглоточной дисфагии являются состояния, нарушающие поступление пищи в пищевод. Например, нарушение мозгового кровообращения, миопатии, дерматомиозит, склеродермия. Все эти заболевания были исключены у пациента в ходе проведенного обследования. Жалобы, предъявляемые им, также не соответствовали данной форме дисфагии. Вторая форма дисфагии – пищеводная – характеризуется медленным началом симптомов после приема пищи (>2 с), ощущением препятствия или болью при прохождении пищи по пищеводу. Наиболее часто она развивается у курящих мужчин старше 50 лет [10]. В представленном случае у пациента отмечалась именно пищеводная дисфагия.
Следующим диагностическим этапом являлось подтверждение диагноза и выявление непосредственной причины развития дисфагии (рис. 6) [10].
В качестве первого метода обследования была выбрана рентгеноскопия пищевода с контрастированием, поскольку данный метод более безопасен, чем эзофагогастродуоденоскопия, и имеет меньший риск перфорации пищевода у пациентов с подозрением на его сужение. В качестве контрастного вещества выбран водорастворимый урографин, поскольку у пациента имелась клиническая картина непроходимости пищевода 3-й степени. Наличие сужения пищевода также было подтверждено при проведении КТ органов грудной клетки с контрастированием и ЭГДС. Согласно представленному алгоритму диагностики (см. рис. 6) при проведении данных исследований были исключены заболевания средостения. Однако только после проведения контрольной ЭГДС и КТ органов грудной клетки были исключены опухоль пищевода и его стриктура, а также выявлен инфекционный эзофагит, осложнивший течение основного заболевания.
При ретроспективном анализе истории заболевания можно предположить, что сухой «навязчивый» кашель, который беспокоил пациента в течение последних 10 лет, и неприятные ощущения за грудиной во время «быстрого» приема пищи являлись проявлением не ХОБЛ, а прогрессирующего течения глоточно-пищеводного дивертикула.
По данным литературы, как раз ощущение першения, жжения в горле, сухой кашель часто являются первыми симптомами ДЦ и неправильно интерпретируются врачами при первичном обращении пациента. В некоторых случаях проводится терапия заболеваний зева, гортани, легких. В дальнейшем, по мере увеличения дивертикула в объеме, появляется дисфагия, которая и становится ведущим синдромом. Затем может присоединиться регургитация и срыгивание принятой пищи. Кроме того, у некоторых пациентов может наблюдаться затруднение дыхания и осиплость голоса, являющиеся соответственно признаками сдавления трахеи и возвратного гортанного нерва [11]. Попадание застойного содержимого дивертикула в дыхательные пути приводит к развитию аспирационных пневмоний, что и наблюдалось у представленного пациента. С учетом кахексии и наличия непроходимости пищевода возникла необходимость провести дифференциальную диагностику с опухолевым, рубцовым или иным механическим сужением пищевода. Исключению данных групп заболеваний всегда необходимо уделять пристальное внимание, поскольку эти патологии вызывают дисфагию чаще дивертикула.
Наличие синдрома бронхолегочной инфекции у представленного пациента в виде повышения температуры тела, кашля, лейкоцитоза, повышения СРБ и деструктивных изменений в легочной ткани не только обусловило тяжесть состояния пациента, но и затруднило диагностику, требуя исключения не только аспирационной, но и параканкрозной пневмонии у пациента с заболеванием пищевода. Аспирационный генез пневмонии был заподозрен в связи с тем, что любая дисфагия является одним из ведущих состояний, предрасполагающих к развитию аспирации. Учитывая характерную рентгенологическую картину, положительный ответ на антибактериальную терапию и полный регресс воспалительных изменений в легочной ткани можно говорить, что данная пневмония носила именно аспирационный характер. Кроме того, при бронхоскопии, проведенной в ходе обследования, установлено наличие пищи в бронхах. Антибактериальная терапия карбапенемами была выбрана, поскольку пневмония носила деструктивный характер и не исключался эпизод аспирации [12]. Полученные в последующем результаты микробиологического исследования подтвердили правильность выбранной антибактериальной терапии, а проведение санации бронхиального дерева позволило как восстановить проходимость обтурированных аспирационным содержимым бронхов, так и получить дополнительные данные, исключающие опухолевое заболевание.
Заключение
По итогу анализа представленного клинического наблюдения, можно отметить, что в качестве причины дисфагии стоит рассматривать не только опухоли, стриктуры или сужение пищевода вследствие патологии органов средостения, являющиеся самыми частыми ее причинами, но и учитывать в дифференциально диагностическом ряду более редкие ее причины, в частности ДЦ (см. рис. 6).
Основная роль в диагностике данного заболевания принадлежит рентгенологическому контрастному полипозиционному исследованию пищевода, которое позволяет выявить локализацию, форму и размеры дивертикула, длительность
задержки бария и степень нарушения проходимости пищевода. Уникальность нашего наблюдения заключается в диагностировании редко встречающегося дивертикула очень больших размеров – гигантского ДЦ – который привел к развитию тяжелых осложнений (кахексии, электролитных нарушений и аспирационной пневмонии).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Аришева Ольга Сергеевна – канд. мед. наук, доц. каф. внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В.С. Моисеева, ФГАОУ ВО РУДН. E-mail: olga.arisheva@yandex.ru; ORCID: 0000-0002-3569-4597
Olga S. Arisheva – Cand. Sci. (Med.), People’s Friendship University of Russia (RUDN University). E-mail: olga.arisheva@yandex.ru; ORCID: 0000-0002-3569-4597
Карнаушкина Мария Александровна – д-р мед. наук, доц., проф. каф. внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В.С. Моисеева, ФГАОУ ВО РУДН. E-mail: kar3745@yandex.ru; ORCID: 0000-0002-8791-2920
Maria A. Karnaushkina – Dr. Sci. (Med.), Prof., People’s Friendship University of Russia (RUDN University). E-mail: kar3745@yandex.ru; ORCID: 0000-0002-8791-2920
Струтынская Анастасия Дмитриевна – канд. мед. наук, науч. сотр. лаборатории Научного центра интегративной и трансляционной медицины МИ, ФГАОУ ВО РУДН. E-mail: strutynskaya@yandex.ru; ORCID: 0000-0001-9325-5580
Anastasia D. Strutynskaya – Cand. Sci. (Med.), Res. Officer, People’s Friendship University of Russia (RUDN University). E-mail: strutynskaya@yandex.ru; ORCID: 0000-0001-9325-5580
Аммар Ракан Дейа (Мохаммад Хади) – аспирант каф. внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В.С. Моисеева, ФГАОУ ВО РУДН. E-mail: rakan_deya@icloud.com; ORCID: 0009-0008-6210-0310
Ammar Rakan Deia (Mohammad Hadi) – Graduate Student, People’s Friendship University of Russia (RUDN University). E-mail: rakan_deya@icloud.com; ORCID: 0009-0008-6210-0310
Соснина Александра Олеговна – врач-терапевт отделения терапии, ГБУЗ «ГКБ им. В.В. Виноградова». E-mail: beecynic@mail.ru
Aleksandra O. Sosnina – therapist, Vinogradov State Clinical Hospital. E-mail: beecynic@mail.ru
Поступила в редакцию: 19.10.2023
Поступила после рецензирования: 27.10.2023
Принята к публикации: 02.11.2023
Received: 19.10.2023
Revised: 27.10.2023
Accepted: 02.11.2023
Список исп. литературыСкрыть список1. Hoffmann M, Fazel A, Mews KG, Ambrosch P. 32 years of experience with CO2-LASER-assisted treatment for Zenker's Diverticulum – an update of 227 patients treated in Kiel. Clin Otolaryngol. 2017; 42 (3): 592–6.
2. Nesheiwat Z, Antunes C. Zenker Diverticulum. 2023 Aug 8. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan. PMID: 29763172.
3. Achille G, Castellana M, Russo S et al. Zenker Diverticulum: A Potential Pitfall in Thyroid Ultrasound Evaluation: A Case Report and Systematic Review of Literature. Endocr Metab Immune Disord Drug Targets. 2019; 19 (1): 95–9.
4. Королев М.П., Климов А.В., Антипова М.В., Ткаченко О.Б. Диагностика и оперативное лечение дивертикулов Ценкера с применением современной эндоскопической техники. Вестник хирургии им. И.И. Грекова. 2011; 3: 35–9.
Korolev MP, Klimov AV, Antipova MV, Tkachenko OB. Diagnosis and surgical treatment of Cenker diverticula using modern endoscopic techniques. Bulletin of Surgery named after I.I. Grekov = Vestnik hirurgii im. I.I.Grekova. 2011; 3: 35–9 (in Russian).
5. Ishaq S, Sultan H, Siau K et al. New and emerging techniques for endoscopic treatment of Zenker's diverticulum: State-of-the-art review. Dig Endosc. 2018; 30 (4): 449–60.
6. Stoian S, Motofei I, Popescu B et al. Zenkers diverticulum, a rare cause of uppar gastrointestinal bleeding. Revista medico-chirurgicala a Societatii de Medici si Naturalisti din Iasi. 2013; 177 (2): 297–301.
7. Ciuc D, Birlă R, Panaitescu E et al. Zenker Diverticulum Treatment: Endoscopic or Surgical? Chirurgia (Bucur). 2018; 113 (2): 234–43.
8. Tenorio L, Palacios F. Efficacy and safety of the endoscopic management of Zenker diverticulum with IT-Knife 2 device. Rev Gastroenterol Peru. 2017; 37 (3): 203–8.
9. Patel DA, Krishnaswami S, Steger E et al. Economic and survival burden of dysphagia among inpatients in the United States. Dis Esophagus. 2018; 31 (1): 1–7.
10. Rommel N, Hamdy S. Oropharyngeal dysphagia: manifestations and diagnosis. Nat Rev Gastroenterol Hepatol. 2016; 13 (1): 49–59.
11. Абдураимов А.Б., Павлов М.В., Афанасьев А.Б., Михайлова З.Ф. Дивертикул Ценкера у пожилых пациентов. Клиническая геронтология. 2019; 25 (1–2): 62–8.
Abduraimov AB, Pavlov MV, Afanas'ev AB, Mihajlova ZF. Cenker's diverticulum in elderly patients. Clinical gerontology = Klinicheskaya gerontologiya. 2019; 25 (1–2): 62–8. (in Russian).
12. Niederman MS, Cilloniz C. Aspiration pneumonia. Rev Esp Quimioter. 2022; 35 (Suppl. 1): 73–7.
12 декабря 2023
Количество просмотров: 2287

