Клинический разбор в общей медицине №10 2023
Olga V. Podobed1, Gleb Yu. Novikov1, Igor V. Kochetkov1
1 South Ural State Medical University, Chelyabinsk, Russia;
2 Central Medical and Sanitary Unit, Magnitogorsk, Russia
maria_shes@mail.ru
Abstract
Kennedy disease is a rare neuromuscular disease associated with damage of androgen receptor gene and inherited by the X-linked recessive type. Its clinic features is characterized by a complex of neurological and extraneural disorders, including extremities peripheral paresis, bulbar syndrome. Some patients also have sensory polyneuropathy, cognitive impairment, endocrine and urological disorders. The article presents a clinical case of a man with Kennedy disease, symptoms debuted at age of 35. The features of the disease were significantly increase the level of blood creatinekinase, the presence of polyneuropathy. The data of a three-year observation of clinical and electromyographic manifestations, the results of laboratory tests, biopsies, and magnetic resonance imaging of muscles are presented. The possibilities of using and features of interpretation of the results of additional examination methods, the difficulties of differential diagnosis of the disease are discussed.
Key words: bulbospinal amyotrophy, Kennedy disease; electromyography, muscle biopsy, muscle MRI, creatine phosphate kinase.
For citation: Vasilenko A.F., Karpova M.I., Shestakova M.V. et al. The case of Kennedy's bulbospinal amiotrophy: modern diagnostic opportunities. Clinical review for general practice. 2023; 4 (10): 76–82 (In Russ.). DOI: 10.47407/kr2023.4.10.00345
Описаны редкие случаи гомозиготного носительства CAG-экспансии в гене AR у женщин, что сопровождалось развитием чрезвычайно «мягкого» фенотипа – крампи, тремора рук и редких периоральных фасцикуляций [1–3].
БСАК дебютирует на 4–5-м десятилетии жизни, возможно раннее начало на 2–3-м десятилетии, так и более позднее (после 70 лет) [3]. Дегенеративные изменения происходят преимущественно в двигательных ядрах XII, X, IX, V пар черепных нервов и мотонейронах спинного мозга, что приводит к развитию парезов с атрофиями и фасцикуляциями в проксимальных мышцах конечностей, бульбарного синдрома (фибрилляции и атрофия языка, дисфагия, дизартрия, дисфония) и слабости мимических мышц с периоральными фасцикуляциями. Мышечная слабость является основным клиническим проявлением. Помимо слабости встречаются тремор, крампи, псевдогипертрофия икроножных мышц. Тремор рук может быть первым симптомом заболевания, отмеченным у пациентов, и появляется в среднем в возрасте 35 лет. Он, как правило, постуральный и может привести к ухудшению повседневной деятельности [5]. По мере нарастания слабости и атрофии в мышцах тазового пояса, бедер появляются вспомогательные приемы при вставании, «утиная» походка. На поздних стадиях болезни может развиваться слабость дыхательных мышц, однако дыхательная недостаточность возникает редко.
У части больных БСАК помимо моторных проявлений имеются признаки сенсорной полиневропатии [1, 3, 4]. Чаще она остается субклинической и выявляется лишь при электрофизиологическом исследовании в виде снижения скорости или блока проведения по чувствительным волокнам [4]. У некоторых больных отмечаются нарушения вибрационной, болевой чувствительности, а также невропатическая боль. Помимо неврологических симптомов для БСАК характерны клинические симптомы, обусловленные нарушением гормональной рецепции. Особое внимание привлекают эндокринные нарушения (гинекомастия, импотенция, снижение либидо, тестикулярная атрофия), выявляемые более чем в 70% случаев. У большинства больных они сопровождаются нарушениями сперматогенеза и бесплодием. Гинекомастия или снижение потенции нередко выступают первыми признаками заболевания. Гинекомастия является наиболее распространенным не неврологическим проявлением и может встречаться в очень молодом возрасте. Примерно в 40% случаев при БСАК развиваются урологические проблемы, предположительно также обусловленные гипосенситивностью к андрогенам. Наиболее типичной среди них является задержка мочи в отсутствии гипертрофии простаты, требующая катетеризации [2].
Рядом авторов описано вовлечение в патологический процесс при БСАК структур головного мозга, прежде всего лобной доли. При этом паттерн выявленных нейропсихологических нарушений включает в себя нарушения памяти, исполнительных функций, внимания и указывает на преимущественно лобно-височную дизрегуляцию [6]. Это согласуется с нейровизуализационными исследованиями, показавшими распространенные изменения белого и серого вещества головного мозга, более выраженные в лобных долях [7].
Несмотря на то что БСАК характеризуется достаточно специфическим комплексом нервно-мышечных нарушений и экстраневральных расстройств, в клинической практике диагностика и дифференциальная диагностика данного заболевания зачастую вызывают затруднения. Отчасти они связаны с вариабельностью выраженности симптомов и сходством с другими заболеваниями, в частности боковым амиотрофическим склерозом (БАС) [1, 2], что нередко приводит к ложной диагностике БАС [3]. Кроме того, результаты лабораторного, нейрофизиологического и морфологического обследования при БСАК значительно отличаются от таковых при других формах СМА. Осведомленность врача об этих особенностях позволяет облегчить диагностический поиск.
Ниже приведено собственное трехлетнее наблюдение (2016–2019 гг.) спорадического случая БСАК.
Семейный анамнез: у пациента трое детей, в семье подобных заболеваний не было.
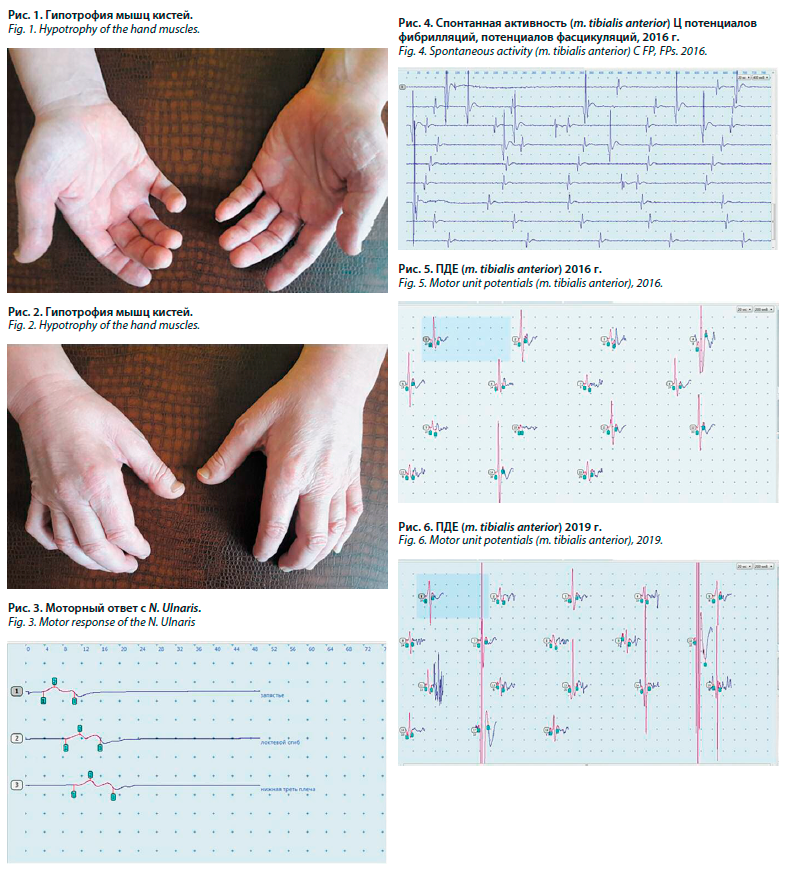
Заболевание неуклонно прогрессировало. К 2019 г. появились нарушения глотания, фонации, дизартрия, отмечается легкая слабость мимической мускулатуры, походка приобрела характер «утиной», пациент стал испытывать трудности при подъеме по лестнице, при вставании на носки, на пятки. Дистанция ходьбы без отдыха сократилась до 300 м, наросла слабость в руках и выраженность гипотрофий (рис. 1, 2). При осмотре: парез в дистальных мышцах рук – 3 балла, в проксимальных – 4 балла, в проксимальных отделах ног – 3 балла, в дистальных отделах ног – 2 балла. Расстройства чувствительности не имели четкой динамики.
По результатам проведенных исследований:
• Углеводный обмен не нарушен: показатели глюкозы крови натощак, гликированный гемоглобин были в норме за все время наблюдения.
• Уровень общей креатинфосфокиназы (КФК) крови превышал норму. В 2016 г. составил 1468 ЕД/л, в 2017 г. – 932 ЕД/л, 2018 г. – 1309 ЕД/л; 2019 г. – 565 ЕД/л (норма до 170 ЕД/л).
• Общий анализ крови без патологии, колебание значений СОЭ от 2 до 10 мм/ч. С-реактивный белок в 2016 г. – 0,5 мг/л, в 2019 г. – 1,1 мг/л. Антитела к амино-ацилсинтетазам тРНК (Jo-1) не обнаружены (в 2016 г.).
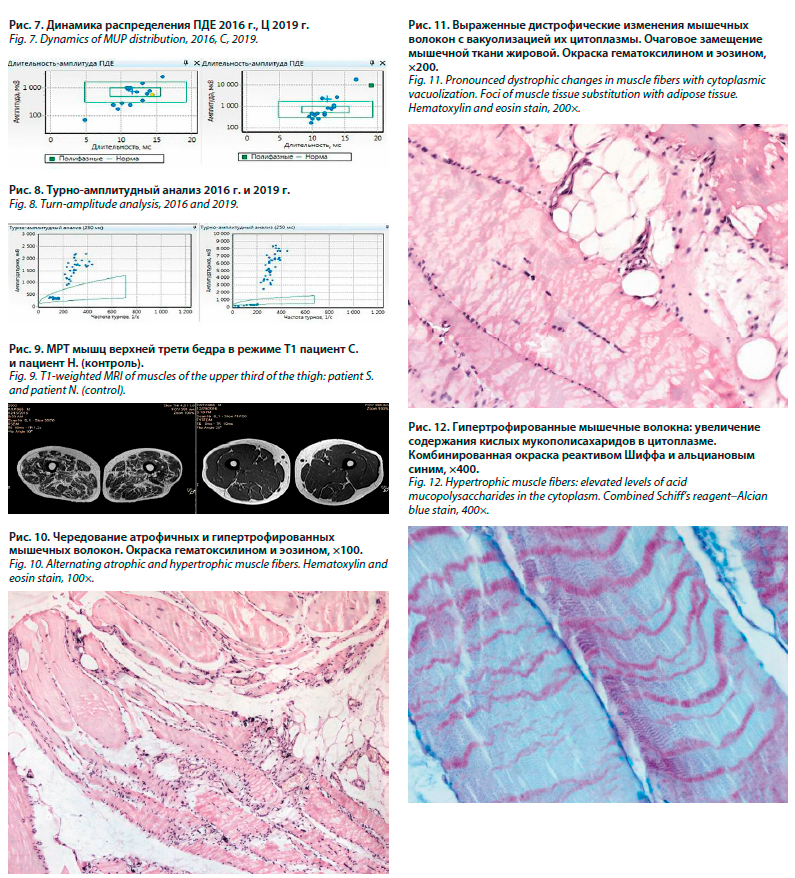
По данным электромиографии (ЭМГ) в 2016 г. регистрировалось снижение амплитуды М-ответа при регистрации с гипотрофированных мышц (рис. 3) и сенсорного ответа. Регистрировалась спонтанная активность в виде позитивных острых волн, потенциалов фасцикуляций, потенциалов фибрилляций (рис. 4).
Показатели потенциалов двигательных единиц – ПДЕ (амплитуда, длительность) составили: m. tibialis anterior максимальное значение – 2607 мкВ, 15,8 мс; среднее – 738 мкВ, 11,6 мс; m. extensorditorum максимум – 3498 мкВ, 16,9 мс, среднее – 1452 мкВ, 13,2 мс.
В 2019 г. – снизилась амплитуда моторного ответа пропорционально выраженности гипотрофии (локтевой, срединный нервы), ПДЕ m. tibialis anterior максимум – 15094 мкВ, 16,8 мс; среднее – 2538 мкВ, 13,6 мс (рис. 5–7). Паттерн рекрутирования в 2016 г. и 2019 г. носил четкий нейрогенный характер (рис. 8).
При проведении транскраниальной магнитной стимуляции (2016 г.) признаков нарушения проведения по пирамидным путям (кортико-цервикальный тракт) выявлено не было – время центрального моторного проведения 9,88–11,0 мс при норме 10,5 мс.
Учитывая наличие у пациента периферического тетрапареза в сочетании со значительно повышенным уровнем КФК, с целью дифференциального диагноза с воспалительной миопатией (до получения результатов ДНК-диагностики) были выполнены магнитно-резонансная томография (МРТ) и биопсия мышц.
При проведении МРТ мышц бедра (2016 г.) в Т1, Т2, STIR-режимах изменения мягких тканей носили симметричный характер: мышцы с признаками атрофии, с замещением соединительной и жировой тканью, межмышечные пространства увеличены – в сравнении с МР-картиной контроля (рис. 9).
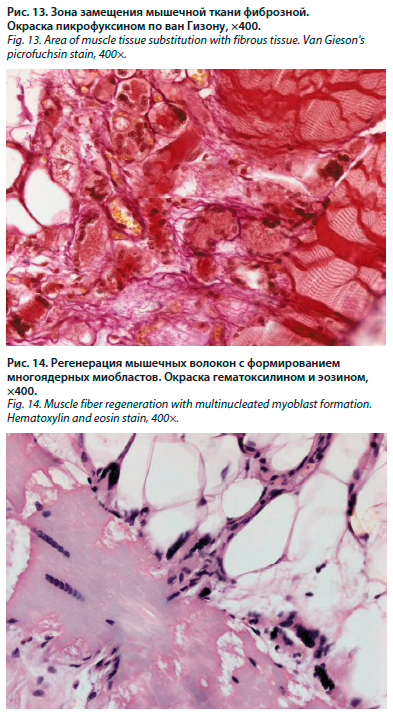
По данным биопсии кожно-мышечного лоскута бедра (2016 г.), определялось чередование участков атрофии и гипертрофии мышечных волокон (рис. 10), их выраженные дистрофические изменения с расщеплением цитоплазмы, формированием вакуолей (рис. 11) и очагов некроза. Содержание кислых мукополисахаридов было повышено (рис. 12). Зоны повреждения мышечной ткани на значительном протяжении замещены жировой и фиброзной тканью (рис. 13). Выявлялись фокусы регенерации с группами многоядерных миобластов (рис. 14), очаговые лимфоплазмоцитарные инфильтраты (рис. 15).
При проведении генетического исследования (прямая ДНК-диагностика – оценка числа CAG-повторов в 1 экзоне гена AR) было выявлено 43 повтора (2016 г.).
На ранних стадиях болезни диагностика БСАК может оказаться достаточно сложной. Круг дифференциального диагноза в первую очередь включает БАС, а также прогрессирующие мышечные дистрофии, болезнь Хироямы, постполиомиелитический синдром, полинейропатии, множественную моторную нейропатию с блоками проведения и др. [2]. Определяющим методом в постановке диагноза является ЭМГ.
При проведении нейрофизиологического обследования у пациентов с БСАК выявляются признаки текущего денервационно-реинервационного процесса. Динамическое проведение ЭМГ позволяет оценить темпы прогрессирования денервационно-реинервационного процесса, исключить быстропротекающие заболевания (БАС). Постепенно длительно текущий процесс приводит к появлению характерных для СМА значительно укрупненных ПДЕ – до десятков тысяч мкВ. Кроме того, отличительной чертой БСАК служит поражение сенсорных волокон [4, 8]. Особую роль нейрофизиологическое исследование приобретает при дифференциальной диагностике с БАС. Помимо вовлечения в дегенеративный процесс сенсорных волокон и существенно более медленной динамики миографических показателей, при БСАК в отличие от БАС отсутствуют признаки поражения центрального двигательного нейрона, выявляемые при проведении транскраниальной магнитной стимуляции. В описанном случае у пациента С. время центрального моторного проведения оставалось в норме за все время наблюдения.
В последние годы были пересмотрены представления о процессах, протекающих в мышечной ткани при БСАК. Экспериментально был доказан миопатический вклад в фенотип болезни Кеннеди [9]. Возможно, такой механизм развития амиотрофий может объяснить высокие уровни КФК, регистрируемые при этом заболевании. Учитывая, что повышение уровня КФК характерно для воспалительных миопатий, являющихся потенциально курабельными заболеваниями, для исключения миозита могут быть применены дополнительные диагностические методы: патоморфологическое и визуализационное исследование мышц. При СМА гистологическое исследование биоптатов мышц выявляет денервационную атрофию [10].
При проведении МРТ определяется мышечный объем и степень дегенерации мышц с замещением жировой тканью, оценивается наличие признаков воспаления. Одним из показаний для проведения МРТ является подозрение на миопатию вследствие специфической клинической картины, но без обнаружения первично-мышечного паттерна при ЭМГ [11]. Распределение жировой ткани и соотношение ее с мышечной исследуется в Т1-импульсном режиме. Оценивается симметричность/асимметричность, избирательность поражения отдельных мышц, что имеет значение при постановке диагноза прогрессирующих мышечных дистрофий. Для выявления воспалительных изменений применяются Т2-импульсный и STIR режимы. Избыточное накопление воды, характеризующееся усилением сигнала, симметричность и равномерность поражения свидетельствует о миозите. Проведенное пациенту С.
МР-исследование мышц не выявило паттерна, соответствующего прогрессирующей мышечной дистрофии. Отсутствие МР-признаков, характерных для воспаления, стало дополнительным аргументом против диагноза полимиозита. Выявленные визуализационные изменения согласовывались с данными биопсии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информированное согласие. Пациент подписал информированное согласие на публикацию своих данных.
Informed consent. The patient submitted the informed consent to publication of personal data.
Информация об авторах
Information about the authors
Василенко Андрей Федорович – д-р мед. наук, проф. каф. нервных болезней, ФГБОУ ВО ЮУГМУ. E-mail: afvas@mail.ru; ORCID: 0000-0001-5799-7233
Andrey F. Vasilenko – Dr. Sci. (Med.), Prof., South Ural State Medical University. E-mail: afvas@mail.ru; ORCID: 0000-0001-5799-7233
Карпова Мария Ильинична – д-р мед. наук, доц., зав. каф. нервных болезней ФГБОУ ВО ЮУГМУ. E-mail: kmi_2008@mail.ru; ORCID: 0000-0001-5848-7235
Maria I. Karpova – Dr. Sci. (Med.), South Ural State Medical University. E-mail: kmi_2008@mail.ru; ORCID: 0000-0001-5848-7235
Шестакова Мария Владиславовна – канд. мед. наук, ФГБОУ ВО ЮУГМУ. E-mail: maria_shes@mail.ru; ORCID: 0000-0002-8955-1604
Maria V. Shestakova – Cand. Sci. (Med.), South Ural State Medical University. E-mail: maria_shes@mail.ru; ORCID: 0000-0002-8955-1604
Путинцева Юлия Викторовна – врач-невролог, АНО «Центральная медико-санитарная часть», Магнитогорск. E-mail: yuliya.putintseva.94@mail.ru
Yulia V. Putintseva – Neurologist, Central Medical and Sanitary Unit, Magnitogorsk. E-mail: yuliya.putintseva.94@mail.ru
Подобед Ольга Вячеславовна – канд. мед. наук, доц. каф. патологической анатомии и судебной медицины, ФГБОУ ВО ЮУГМУ. E-mail: podobed.olga2013@yandex.ru; ORCID: 0000-0002-5211-5956
Olga V. Podobed – Cand. Sci. (Med.), South Ural State Medical University. E-mail: podobed.olga2013@yandex.ru; ORCID: 0000-0002-5211-5956
Новиков Глеб Юрьевич – врач-патологоанатом патологоанатомического отделения клиники ФГБОУ ВО ЮУГМУ. E-mail: pao.kchgma@yandex.ru; ORCID: 0000-0001-5974-5005
Gleb Yu. Novikov – the pathologist, South Ural State Medical University. E-mail: pao.kchgma@yandex.ru; ORCID: 0000-0001-5974-5005
Кочетков Игорь Валерьевич – зав. рентгеновским отделением и МРТ клиники ФГБОУ ВО ЮУГМУ. E-mail: kochetkov31@rambler.ru; ORCID: 0000-0003-3169-9777
Igor V. Kochetkov – Head of the X-ray department and MRI South Ural State Medical University. E-mail: kochetkov31@rambler.ru; ORCID: 0000-0003-3169-9777
Поступила в редакцию: 15.11.2023
Поступила после рецензирования: 16.11.2023
Принята к публикации: 16.11.2023
Received: 15.11.2023
Revised: 16.11.2023
Accepted: 16.11.2023
Клинический разбор в общей медицине №10 2023
Случай бульбоспинальной амиотрофии Кеннеди: современные диагностические возможности
Номера страниц в выпуске:76-82
Аннотация
Бульбоспинальная амиотрофия Кеннеди – редкое нервно-мышечное заболевание, связанное с повреждением гена андрогенного рецептора и наследуемого по Х-сцепленному рецессивному типу. Клиническая картина характеризуется комплексом неврологических и экстраневральных нарушений, включающим периферические парезы, бульбарный синдром, в ряде случаев сенсорную полинейропатию, когнитивные, эндокринные и урологические нарушения. В статье представлен клинический случай бульбоспинальной амиотрофии Кеннеди у мужчины с дебютом симптомов в 35 лет. Особенностями заболевания явились выраженное повышение уровня креатинфосфокиназы крови, наличие полиневропатии. Приведены данные трехлетнего наблюдения за клиническими и электромиографическими проявлениями, результаты лабораторного обследования, биопсии и магнитно-резонансной томографии мышц. Обсуждены возможности использования и особенности интерпретации результатов дополнительных методов обследования, трудности дифференциальной диагностики заболевания.
Ключевые слова: бульбоспинальная амиотрофия, болезнь Кеннеди, электромиография, биопсия мышц, магнитно-резонансная томография мышц, креатинфосфокиназа.
Для цитирования: Василенко А.Ф., Карпова М.И., Шестакова М.В. и др. Случай бульбоспинальной амиотрофии Кеннеди: современные диагностические возможности. Клинический разбор в общей медицине. 2023; 4 (10): 76–82. DOI: 10.47407/kr2023.4.10.00345
Бульбоспинальная амиотрофия Кеннеди – редкое нервно-мышечное заболевание, связанное с повреждением гена андрогенного рецептора и наследуемого по Х-сцепленному рецессивному типу. Клиническая картина характеризуется комплексом неврологических и экстраневральных нарушений, включающим периферические парезы, бульбарный синдром, в ряде случаев сенсорную полинейропатию, когнитивные, эндокринные и урологические нарушения. В статье представлен клинический случай бульбоспинальной амиотрофии Кеннеди у мужчины с дебютом симптомов в 35 лет. Особенностями заболевания явились выраженное повышение уровня креатинфосфокиназы крови, наличие полиневропатии. Приведены данные трехлетнего наблюдения за клиническими и электромиографическими проявлениями, результаты лабораторного обследования, биопсии и магнитно-резонансной томографии мышц. Обсуждены возможности использования и особенности интерпретации результатов дополнительных методов обследования, трудности дифференциальной диагностики заболевания.
Ключевые слова: бульбоспинальная амиотрофия, болезнь Кеннеди, электромиография, биопсия мышц, магнитно-резонансная томография мышц, креатинфосфокиназа.
Для цитирования: Василенко А.Ф., Карпова М.И., Шестакова М.В. и др. Случай бульбоспинальной амиотрофии Кеннеди: современные диагностические возможности. Клинический разбор в общей медицине. 2023; 4 (10): 76–82. DOI: 10.47407/kr2023.4.10.00345
The case of Kennedy's bulbospinal amiotrophy: modern diagnostic opportunities
Andrey F. Vasilenko1, Maria I. Karpova1, Maria V. Shestakova1, Yulia V. Putintseva2,Olga V. Podobed1, Gleb Yu. Novikov1, Igor V. Kochetkov1
1 South Ural State Medical University, Chelyabinsk, Russia;
2 Central Medical and Sanitary Unit, Magnitogorsk, Russia
maria_shes@mail.ru
Abstract
Kennedy disease is a rare neuromuscular disease associated with damage of androgen receptor gene and inherited by the X-linked recessive type. Its clinic features is characterized by a complex of neurological and extraneural disorders, including extremities peripheral paresis, bulbar syndrome. Some patients also have sensory polyneuropathy, cognitive impairment, endocrine and urological disorders. The article presents a clinical case of a man with Kennedy disease, symptoms debuted at age of 35. The features of the disease were significantly increase the level of blood creatinekinase, the presence of polyneuropathy. The data of a three-year observation of clinical and electromyographic manifestations, the results of laboratory tests, biopsies, and magnetic resonance imaging of muscles are presented. The possibilities of using and features of interpretation of the results of additional examination methods, the difficulties of differential diagnosis of the disease are discussed.
Key words: bulbospinal amyotrophy, Kennedy disease; electromyography, muscle biopsy, muscle MRI, creatine phosphate kinase.
For citation: Vasilenko A.F., Karpova M.I., Shestakova M.V. et al. The case of Kennedy's bulbospinal amiotrophy: modern diagnostic opportunities. Clinical review for general practice. 2023; 4 (10): 76–82 (In Russ.). DOI: 10.47407/kr2023.4.10.00345
Введение
Спинальные мышечные атрофии (СМА) – гетерогенная группа наследственных заболеваний, характеризующихся дегенерацией мотонейронов передних рогов спинного мозга и двигательных ядер черепно-мозговых нервов, преимущественно с аутосомно-рецессивным типом наследования. В 1968 г. W. Kennedy и соавт. была описана СМА с поздним началом и медленно прогрессирующим течением – болезнь Кеннеди или бульбо-спинальная амиотрофия Кеннеди (БСАК). БСАК является редким заболеванием, наследуется по Х-сцепленному рецессивному типу и связана с повреждением гена андрогенного рецептора (AR), расположенного в локусе Xq11.2-12. Происходит экспансия тандемных CAG-повторов в 1-м экзоне гена AR. В норме число копий CAG составляет 9–36, при БСАК увеличивается число тандемных повторов от 38 до 72. Увеличение числа CAG-повторов и длины полиглутаминового участка соотносится с более тяжелым течением и более ранним началом заболевания [1–3]. Связывание андрогенов с патологически измененным рецептором приводит к дефекту транскрипционной регуляции, запускается каскад патологических реакций с участием белков теплового шока и отложением патологически измененных белковых структур в цитозоле и ядре, с нарушением функции митохондрий и хромосом. Мутантный белок приобретает цитотоксические свойства, вызывая гибель мотонейронов ствола и спинного мозга. В пораженных нейронах выявляются внутриядерные белковые полиглутаминсодержащие включения, что позволяет отнести данное заболевание к группе полиглутаминовых болезней.Описаны редкие случаи гомозиготного носительства CAG-экспансии в гене AR у женщин, что сопровождалось развитием чрезвычайно «мягкого» фенотипа – крампи, тремора рук и редких периоральных фасцикуляций [1–3].
БСАК дебютирует на 4–5-м десятилетии жизни, возможно раннее начало на 2–3-м десятилетии, так и более позднее (после 70 лет) [3]. Дегенеративные изменения происходят преимущественно в двигательных ядрах XII, X, IX, V пар черепных нервов и мотонейронах спинного мозга, что приводит к развитию парезов с атрофиями и фасцикуляциями в проксимальных мышцах конечностей, бульбарного синдрома (фибрилляции и атрофия языка, дисфагия, дизартрия, дисфония) и слабости мимических мышц с периоральными фасцикуляциями. Мышечная слабость является основным клиническим проявлением. Помимо слабости встречаются тремор, крампи, псевдогипертрофия икроножных мышц. Тремор рук может быть первым симптомом заболевания, отмеченным у пациентов, и появляется в среднем в возрасте 35 лет. Он, как правило, постуральный и может привести к ухудшению повседневной деятельности [5]. По мере нарастания слабости и атрофии в мышцах тазового пояса, бедер появляются вспомогательные приемы при вставании, «утиная» походка. На поздних стадиях болезни может развиваться слабость дыхательных мышц, однако дыхательная недостаточность возникает редко.
У части больных БСАК помимо моторных проявлений имеются признаки сенсорной полиневропатии [1, 3, 4]. Чаще она остается субклинической и выявляется лишь при электрофизиологическом исследовании в виде снижения скорости или блока проведения по чувствительным волокнам [4]. У некоторых больных отмечаются нарушения вибрационной, болевой чувствительности, а также невропатическая боль. Помимо неврологических симптомов для БСАК характерны клинические симптомы, обусловленные нарушением гормональной рецепции. Особое внимание привлекают эндокринные нарушения (гинекомастия, импотенция, снижение либидо, тестикулярная атрофия), выявляемые более чем в 70% случаев. У большинства больных они сопровождаются нарушениями сперматогенеза и бесплодием. Гинекомастия или снижение потенции нередко выступают первыми признаками заболевания. Гинекомастия является наиболее распространенным не неврологическим проявлением и может встречаться в очень молодом возрасте. Примерно в 40% случаев при БСАК развиваются урологические проблемы, предположительно также обусловленные гипосенситивностью к андрогенам. Наиболее типичной среди них является задержка мочи в отсутствии гипертрофии простаты, требующая катетеризации [2].
Рядом авторов описано вовлечение в патологический процесс при БСАК структур головного мозга, прежде всего лобной доли. При этом паттерн выявленных нейропсихологических нарушений включает в себя нарушения памяти, исполнительных функций, внимания и указывает на преимущественно лобно-височную дизрегуляцию [6]. Это согласуется с нейровизуализационными исследованиями, показавшими распространенные изменения белого и серого вещества головного мозга, более выраженные в лобных долях [7].
Несмотря на то что БСАК характеризуется достаточно специфическим комплексом нервно-мышечных нарушений и экстраневральных расстройств, в клинической практике диагностика и дифференциальная диагностика данного заболевания зачастую вызывают затруднения. Отчасти они связаны с вариабельностью выраженности симптомов и сходством с другими заболеваниями, в частности боковым амиотрофическим склерозом (БАС) [1, 2], что нередко приводит к ложной диагностике БАС [3]. Кроме того, результаты лабораторного, нейрофизиологического и морфологического обследования при БСАК значительно отличаются от таковых при других формах СМА. Осведомленность врача об этих особенностях позволяет облегчить диагностический поиск.
Ниже приведено собственное трехлетнее наблюдение (2016–2019 гг.) спорадического случая БСАК.
Клиническое наблюдение
Пациент С., 43 года. Первые симптомы появились в возрасте 35 лет в виде снижения толерантности к физической нагрузке (дистанция ходьбы без отдыха до 2 км), онемения стоп. Постепенно слабость нарастала, через 3 года присоединилась слабость в руках, появились онемение кистей рук и подергивание в мышцах ног. В 2016 г. в неврологическом статусе выявлялись гипотрофия языка, глотание и фонация нарушены не были. Имелись единичные фасцикулярные подергивания на туловище, языке, периорально, умеренные гипотрофии 1-го межкостного промежутка и гипотенара. Отмечалось снижение силы в проксимальных и дистальных мышцах ног до четырех баллов, в дистальных мышцах рук – до четырех баллов, в проксимальных мышцах рук сила составляла 5 баллов. Сухожильные рефлексы с ног не вызывались, с рук были снижены, без четкой разницы сторон. Имелась гипалгезия по типу «перчаток и носков», другие виды чувствительности не нарушены. Тазовые расстройства отсутствовали. Обращала на себя внимание гинекомастия. Когнитивные нарушения отсутствовали.Семейный анамнез: у пациента трое детей, в семье подобных заболеваний не было.
Заболевание неуклонно прогрессировало. К 2019 г. появились нарушения глотания, фонации, дизартрия, отмечается легкая слабость мимической мускулатуры, походка приобрела характер «утиной», пациент стал испытывать трудности при подъеме по лестнице, при вставании на носки, на пятки. Дистанция ходьбы без отдыха сократилась до 300 м, наросла слабость в руках и выраженность гипотрофий (рис. 1, 2). При осмотре: парез в дистальных мышцах рук – 3 балла, в проксимальных – 4 балла, в проксимальных отделах ног – 3 балла, в дистальных отделах ног – 2 балла. Расстройства чувствительности не имели четкой динамики.

По результатам проведенных исследований:
• Углеводный обмен не нарушен: показатели глюкозы крови натощак, гликированный гемоглобин были в норме за все время наблюдения.
• Уровень общей креатинфосфокиназы (КФК) крови превышал норму. В 2016 г. составил 1468 ЕД/л, в 2017 г. – 932 ЕД/л, 2018 г. – 1309 ЕД/л; 2019 г. – 565 ЕД/л (норма до 170 ЕД/л).
• Общий анализ крови без патологии, колебание значений СОЭ от 2 до 10 мм/ч. С-реактивный белок в 2016 г. – 0,5 мг/л, в 2019 г. – 1,1 мг/л. Антитела к амино-ацилсинтетазам тРНК (Jo-1) не обнаружены (в 2016 г.).

По данным электромиографии (ЭМГ) в 2016 г. регистрировалось снижение амплитуды М-ответа при регистрации с гипотрофированных мышц (рис. 3) и сенсорного ответа. Регистрировалась спонтанная активность в виде позитивных острых волн, потенциалов фасцикуляций, потенциалов фибрилляций (рис. 4).
Показатели потенциалов двигательных единиц – ПДЕ (амплитуда, длительность) составили: m. tibialis anterior максимальное значение – 2607 мкВ, 15,8 мс; среднее – 738 мкВ, 11,6 мс; m. extensorditorum максимум – 3498 мкВ, 16,9 мс, среднее – 1452 мкВ, 13,2 мс.
В 2019 г. – снизилась амплитуда моторного ответа пропорционально выраженности гипотрофии (локтевой, срединный нервы), ПДЕ m. tibialis anterior максимум – 15094 мкВ, 16,8 мс; среднее – 2538 мкВ, 13,6 мс (рис. 5–7). Паттерн рекрутирования в 2016 г. и 2019 г. носил четкий нейрогенный характер (рис. 8).
При проведении транскраниальной магнитной стимуляции (2016 г.) признаков нарушения проведения по пирамидным путям (кортико-цервикальный тракт) выявлено не было – время центрального моторного проведения 9,88–11,0 мс при норме 10,5 мс.
Учитывая наличие у пациента периферического тетрапареза в сочетании со значительно повышенным уровнем КФК, с целью дифференциального диагноза с воспалительной миопатией (до получения результатов ДНК-диагностики) были выполнены магнитно-резонансная томография (МРТ) и биопсия мышц.
При проведении МРТ мышц бедра (2016 г.) в Т1, Т2, STIR-режимах изменения мягких тканей носили симметричный характер: мышцы с признаками атрофии, с замещением соединительной и жировой тканью, межмышечные пространства увеличены – в сравнении с МР-картиной контроля (рис. 9).

По данным биопсии кожно-мышечного лоскута бедра (2016 г.), определялось чередование участков атрофии и гипертрофии мышечных волокон (рис. 10), их выраженные дистрофические изменения с расщеплением цитоплазмы, формированием вакуолей (рис. 11) и очагов некроза. Содержание кислых мукополисахаридов было повышено (рис. 12). Зоны повреждения мышечной ткани на значительном протяжении замещены жировой и фиброзной тканью (рис. 13). Выявлялись фокусы регенерации с группами многоядерных миобластов (рис. 14), очаговые лимфоплазмоцитарные инфильтраты (рис. 15).
При проведении генетического исследования (прямая ДНК-диагностика – оценка числа CAG-повторов в 1 экзоне гена AR) было выявлено 43 повтора (2016 г.).

Обсуждение
Как правило, при наличии развернутой клинической картины диагностика БСАК не вызывает затруднений. Сочетание признаков поражения нижнего мотонейрона с полиневропатией, проявлениями гипогонадизма и метаболическими расстройствами, данные нейрофизиологического исследования позволяют заподозрить БСАК и провести генетическое обследование. Прямая ДНК-диагностика с оценкой количества тандемных CAG-повторов в гене AR является решающим методом верификации диагноза. Так, у пациента С. в 2016 г. было выявлено 43 повтора (при норме 9–36), что соответствовало тому комплексу клинико-инструментальных данных, который имелся к моменту получения результатов генетического исследования.На ранних стадиях болезни диагностика БСАК может оказаться достаточно сложной. Круг дифференциального диагноза в первую очередь включает БАС, а также прогрессирующие мышечные дистрофии, болезнь Хироямы, постполиомиелитический синдром, полинейропатии, множественную моторную нейропатию с блоками проведения и др. [2]. Определяющим методом в постановке диагноза является ЭМГ.
При проведении нейрофизиологического обследования у пациентов с БСАК выявляются признаки текущего денервационно-реинервационного процесса. Динамическое проведение ЭМГ позволяет оценить темпы прогрессирования денервационно-реинервационного процесса, исключить быстропротекающие заболевания (БАС). Постепенно длительно текущий процесс приводит к появлению характерных для СМА значительно укрупненных ПДЕ – до десятков тысяч мкВ. Кроме того, отличительной чертой БСАК служит поражение сенсорных волокон [4, 8]. Особую роль нейрофизиологическое исследование приобретает при дифференциальной диагностике с БАС. Помимо вовлечения в дегенеративный процесс сенсорных волокон и существенно более медленной динамики миографических показателей, при БСАК в отличие от БАС отсутствуют признаки поражения центрального двигательного нейрона, выявляемые при проведении транскраниальной магнитной стимуляции. В описанном случае у пациента С. время центрального моторного проведения оставалось в норме за все время наблюдения.
В последние годы были пересмотрены представления о процессах, протекающих в мышечной ткани при БСАК. Экспериментально был доказан миопатический вклад в фенотип болезни Кеннеди [9]. Возможно, такой механизм развития амиотрофий может объяснить высокие уровни КФК, регистрируемые при этом заболевании. Учитывая, что повышение уровня КФК характерно для воспалительных миопатий, являющихся потенциально курабельными заболеваниями, для исключения миозита могут быть применены дополнительные диагностические методы: патоморфологическое и визуализационное исследование мышц. При СМА гистологическое исследование биоптатов мышц выявляет денервационную атрофию [10].
При проведении МРТ определяется мышечный объем и степень дегенерации мышц с замещением жировой тканью, оценивается наличие признаков воспаления. Одним из показаний для проведения МРТ является подозрение на миопатию вследствие специфической клинической картины, но без обнаружения первично-мышечного паттерна при ЭМГ [11]. Распределение жировой ткани и соотношение ее с мышечной исследуется в Т1-импульсном режиме. Оценивается симметричность/асимметричность, избирательность поражения отдельных мышц, что имеет значение при постановке диагноза прогрессирующих мышечных дистрофий. Для выявления воспалительных изменений применяются Т2-импульсный и STIR режимы. Избыточное накопление воды, характеризующееся усилением сигнала, симметричность и равномерность поражения свидетельствует о миозите. Проведенное пациенту С.
МР-исследование мышц не выявило паттерна, соответствующего прогрессирующей мышечной дистрофии. Отсутствие МР-признаков, характерных для воспаления, стало дополнительным аргументом против диагноза полимиозита. Выявленные визуализационные изменения согласовывались с данными биопсии.
Заключение
Таким образом, такое редко встречающееся заболевание, как БСАК, может вызвать затруднения в постановке диагноза, особенно в дебюте заболевания. Комплексный подход позволяет наиболее точно определиться с характером патологического процесса, избежав ошибочной интерпретации клинических и инструментальных проявлений.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информированное согласие. Пациент подписал информированное согласие на публикацию своих данных.
Informed consent. The patient submitted the informed consent to publication of personal data.
Информация об авторах
Information about the authors
Василенко Андрей Федорович – д-р мед. наук, проф. каф. нервных болезней, ФГБОУ ВО ЮУГМУ. E-mail: afvas@mail.ru; ORCID: 0000-0001-5799-7233
Andrey F. Vasilenko – Dr. Sci. (Med.), Prof., South Ural State Medical University. E-mail: afvas@mail.ru; ORCID: 0000-0001-5799-7233
Карпова Мария Ильинична – д-р мед. наук, доц., зав. каф. нервных болезней ФГБОУ ВО ЮУГМУ. E-mail: kmi_2008@mail.ru; ORCID: 0000-0001-5848-7235
Maria I. Karpova – Dr. Sci. (Med.), South Ural State Medical University. E-mail: kmi_2008@mail.ru; ORCID: 0000-0001-5848-7235
Шестакова Мария Владиславовна – канд. мед. наук, ФГБОУ ВО ЮУГМУ. E-mail: maria_shes@mail.ru; ORCID: 0000-0002-8955-1604
Maria V. Shestakova – Cand. Sci. (Med.), South Ural State Medical University. E-mail: maria_shes@mail.ru; ORCID: 0000-0002-8955-1604
Путинцева Юлия Викторовна – врач-невролог, АНО «Центральная медико-санитарная часть», Магнитогорск. E-mail: yuliya.putintseva.94@mail.ru
Yulia V. Putintseva – Neurologist, Central Medical and Sanitary Unit, Magnitogorsk. E-mail: yuliya.putintseva.94@mail.ru
Подобед Ольга Вячеславовна – канд. мед. наук, доц. каф. патологической анатомии и судебной медицины, ФГБОУ ВО ЮУГМУ. E-mail: podobed.olga2013@yandex.ru; ORCID: 0000-0002-5211-5956
Olga V. Podobed – Cand. Sci. (Med.), South Ural State Medical University. E-mail: podobed.olga2013@yandex.ru; ORCID: 0000-0002-5211-5956
Новиков Глеб Юрьевич – врач-патологоанатом патологоанатомического отделения клиники ФГБОУ ВО ЮУГМУ. E-mail: pao.kchgma@yandex.ru; ORCID: 0000-0001-5974-5005
Gleb Yu. Novikov – the pathologist, South Ural State Medical University. E-mail: pao.kchgma@yandex.ru; ORCID: 0000-0001-5974-5005
Кочетков Игорь Валерьевич – зав. рентгеновским отделением и МРТ клиники ФГБОУ ВО ЮУГМУ. E-mail: kochetkov31@rambler.ru; ORCID: 0000-0003-3169-9777
Igor V. Kochetkov – Head of the X-ray department and MRI South Ural State Medical University. E-mail: kochetkov31@rambler.ru; ORCID: 0000-0003-3169-9777
Поступила в редакцию: 15.11.2023
Поступила после рецензирования: 16.11.2023
Принята к публикации: 16.11.2023
Received: 15.11.2023
Revised: 16.11.2023
Accepted: 16.11.2023
Список исп. литературыСкрыть список1. Кушнир Г.М., Иошина Н.Н., Абибулаев С.А. и др. Спинальные мышечные атрофии с поздним дебютом: обзор литературы и описание клинического случая. Таврический медико-биологический вестник. 2017; 20 (3): 110–5.
Kushnir GM, Ioshina NN, Abibulayev SA et al. Spinal muscular atrophy with late onset: a review of the literature and a description of the clinical case. Tauride Medical and Biological Bulletin =Tavricheskiy mediko-biologicheskiy vestnik. 2017; 20 (3): 110–5 (in Russian).
2. Pradat P-F, Bernard E, Corcia P et al. The French national protocol for Kennedy’s disease (SBMA): consensus diagnostic and management recommendations. Orphanet J Rare Diseases. 2020; 15 (90): 1–21. PMID: 32276665. DOI: 10.1186/s13023-020-01366-z
3. Клюшников C.А., Иллариошкин С.Н., Иванова-Смоленская И.А. Семейный случай спинально-бульбарной амиотрофии Кеннеди. Нервные болезни. 2008; (1): 1–4.
Klyushnikov CA, Illarioshkin SN, Ivanova-Smolenskaya IA. Semeynyy sluchay spinalno-bulbarnoy amiotrofii Kennedi. Nervous Dis. 2008; (1): 1–4 (in Russian).
4. Касаткина Л.Ф., Гильванова О.В. Элетромиографические методы исследования в диагностике нервно-мышечных заболеваний. Игольчатая миография. М: Научно-медицинская фирма МБН «Медика», 2010.
Kasatkina LF, Gilvanova OV. Electromyographic research methods in the diagnosis of neuromuscular diseases. Needle myography. Moscow: Scientific and Medical Company MBN “Medika”, 2010 (in Russian).
5. Dias FA, Munhoz RP, Raskin S et al. Tremor in X-linked recessive spinal and bulbar muscular atrophy (Kennedy’s disease). Clinical (Sao Paulo). 2011: 66 (6): 955–7. DOI: 10.1590/s1807-593220110006 00006.
6. Soukup GR, Sperfeld AD, Uttner I et al. Frontotemporal cognitive function in Xlinked spinal and bulbar muscular atrophy (SBMA): a controlled neuropsychological study of 20 patients. J Neurol. 2009; 256 (11): 1869–75. DOI: org/10.1007/s00415-009-5212-5
7. Kassubek J, Juengling FD, Sperfeld AD. Widespread white matter changes in Kennedy disease: a voxel based morphometry study. J Neurol Neurosurg Psychiatr. 2007; 78 (11): 1209–12. DOI: org/10.1136/jnnp.2006.112532
8. Antonini G, Gragnani F, Romaniello A et al. Sensory involvement in spinal-bulbar muscular atrophy (Kennedy’s disease). Muscle Nerve. 2000; 23 (2): 252–8. DOI: 10.1002/(sici)1097-4598(200002)23: 2<252::aid-mus17>3.3.co;2-g
9. Yu Z, Dadgar N, Albertelli M et al. Androgen-dependent pathology demonstrates myopathic contribution to the Kennedy disease phenotype in a mouse knock-in model. J Clin Invest. 2006; 116 (10): 2663–72. PMID: 19078709. DOI: org/10.1172/jci28773
10. Soraru G. D’Ascenzo C, Polo A et al. Spinal and bulbar muscular atrophy: skeletal muscle pathology in male patients and heterozygous females. J Neurol Sci. 2008; 264 (1–2): 100–5. DOI: 10.1016/j.jns.2007. 08.012
11. Robert Carlier. МРТ мышц. МРТ всего тела в диагностике и динамическом наблюдении пациентов с нервно-мышечными заболеваниями. Нервно-мышечные болезни. 2014; (2): 16–26. DOI: 10.17650/2222-8721-2014-0-2-16-26
Carlier R. Muscle MRI. Whole-body MRI in diagnosis and dynamic evaluation of neuro-muscular disorders. Neuromuscular Diseases. 2014; (2): 16–26. DOI: 10.17650/2222-8721-2014-0-2-16-26 (in Russian).
17 декабря 2023
Количество просмотров: 1624

