Клинический разбор в общей медицине №1 2024
1 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
2 Scientific Research Institute of Occupational Medicine named after Academician N.F. Izmerov, Moscow, Russia;
3 Lomonosov Moscow State University, Moscow, Russia
marinaamica@mail.ru
Abstract
The results of a pilot study of the serum marker of cardiac damage sST2 in patients with chronic generalized sarcoidosis are presented. Correlations between the activity of sarcoidosis, sST2 levels and the risk of developing heart failure have been demonstrated.
Keywords: sST2, sarcoidosis, cardiac sarcoidosis, heart failure.
For citation: Lebedeva M.V., Strizhakov L.A., Beketov V.D., Taranova M.V. Clinical significance of determining sST2 in the blood of patients with cardiac sarcoidosis. Clinical review for general practice. 2024; 5 (1): 31–37 (In Russ.). DOI: 10.47407/kr2023.5.1.00357
Распространенность и заболеваемость саркоидозом лидируют среди всех интерстициальных поражений легких неустановленной этиологии [1, 2]. Среди внелегочных проявлений кардиосаркоидоз – одно из наиболее прогностически серьезных. В последние годы отмечается тенденция к увеличению частоты диагностики поражения сердца у больных саркоидозом [1–3], в том числе в возрасте старше 40 лет. Это создает определенные диагностические трудности, прежде всего в случае бессимптомного вовлечения сердца, определяет несвоевременное распознавание формирования сердечной недостаточности (СН) [1–4].
Общепризнанными критериями СН являются натрийуретические пептиды, однако их повышение, как правило, проявляется при наличии клинических и эхокардиографических проявлений СН. Актуален вопрос о поиске маркера, предсказывающего риск развития кардиальной дисфункции в ответ на воспалительный процесс в рамках кардиосаркоидоза.
Среди лабораторных маркеров СН ранней стадии рассматривают, в частности, растворимый стимулирующий фактор роста, экспрессирующийся геном 2 (sST2) [5–8]. Скудность клинических проявлений, а также известные ограничения рентгенологических и морфологических методов исследования послужили поводом для проведения нашего клинического исследования.
Цель исследования – оценить клиническое значение определения sST2 в крови больных саркоидозом хронического течения с поражением сердца.
Задачи исследования: 1) провести исследование показателей sST2 у больных хроническим саркоидозом с поражением сердца в фазах активности, прогрессирования и ремиссии; 2) сопоставить полученные результаты с другими лабораторными, а также рентгенологическими маркерами активности и прогрессирования саркоидоза.
Критерии включения:
• возраст 18–49 лет;
• морфологически подтвержденный диагноз саркоидоза легких, внутригрудных лимфатических узлов (ВГЛУ);
• рентгенологическая стадия саркоидоза легких и ВГЛУ – II, III;
• объем форсированного выдоха за 1-ю секунду >70%;
• добровольное письменное информированное согласие пациента на участие в исследовании.
Критерии исключения:
• легочная гипертензия;
• артериальная гипертензия (АГ) II–III степени;
• хроническая болезнь почек III стадии;
• врожденные/приобретенные пороки сердца;
• ишемическая болезнь сердца;
• нарушение мозгового кровообращения;
• сахарный диабет любого типа;
• бронхиальная астма;
• хроническая обструктивная болезнь легких (ХОБЛ);
• онкологические заболевания.
Пациенты распределены по группам с учетом возраста: группа А – 18–35 лет, группа Б – 36–49 лет. Внутри групп выделены три подгруппы в соответствии с фазами течения хронического саркоидоза: фаза активного альвеолита, фаза прогрессирующего фиброза, фаза стойкой ремиссии, составившая не менее 12 мес на момент включения в исследование (табл. 1).

Среди пациентов, имеющих стойкую ремиссию, ранее диагностировали кардиосаркоидоз (до достижения ими ремиссии): у 4 в группе А и у 7 в группе Б. Относительно малое число включенных пациентов определено целью исследования – изучения поражения сердца у больных саркоидозом без сочетанных заболеваний, наличие которых могло влиять на уровень изучаемого белка, а именно легочной гипертензии (ЛГ), бронхиальной астмы, ХОБЛ, ожирения II, III степеней. При включении в исследование только у двух больных группы Б, страдавших АГ I степени, выявили умеренно выраженную гипертрофию миокарда левого желудочка.
Помимо общего клинического обследования, были проведены исследования: сатурации кислорода в покое методом пульсоксиметрии, диффузионной способности легких, а также выполнены: тест 6-тиминутной ходьбы, трансторакальная эхокардиография (ЭхоКГ) на аппарате Vivid 7 (General Electric, США), компьютерная томография органов грудной клетки. По стандартным методикам исследовали диастолическую функцию обоих желудочков и систолическое давление в легочной артерии с помощью модифицированного уравнения Бернулли [5]. ЛГ констатировали при среднем давлении в легочной артерии, превышавшем 20 мм рт. ст., что являлось критерием исключения из участия в исследовании. Компьютерную томографию органов грудной клетки проводили на компьютерном томографе Asteon 4 (Toshiba, Япония). Морфологическое исследование биоптатов ткани легких и/или ВГЛУ выполнено всем больным. Поражение сердца выявляли методами однофотонной эмиссионной компьютерной томографии (ОФЭКТ) или магнитно-резонансной томографии (МРТ). Лабораторная часть включала определение растворимой циркулирующей в крови формы ST2 (Growth STimulation expressed gene 2, стимулирующий фактор роста, экспрессирующийся геном 2) – sST2 (тест-набор «Critical Diagnostics», США), N-терминального мозгового натрийуретического пептида –
NT-proBNP (тест-набор «Siemens Healthcare Diagnostics»), С-реактивного белка – СРБ (ИМТЕК, Россия), активности ангиотензин-превращающего фермента – АПФ (тест-набор «Buhlmann Laboratories AG», Германия). Референсные значения исследованных лабораторных показателей в крови обследованных больных представлены в табл. 2.

Описанный спектр лабораторных и инструментальных исследований проводили дважды: при включении в исследование и через 6 мес. Все больные, в том числе с диагностированным кардиосаркоидозом получали терапию системными глюкокортикостероидами (ГКС) или сочетанную терапию ГКС и цитостатиками по схемам, предложенным действующими клиническими рекомендациями [1].
Статистическая обработка полученных данных проводилась в программе Statiatica Advanced (http://statsoft.ru/products/STATISTICA_Advanced/ для малых выборок), достоверными считались результаты при p<0,05.
Результаты
Из 117 больных хроническим саркоидозом II и III рентгенологических стадий поражение сердца выявлено у 21 пациента (17,9%): у 9 больных группы А
и 12 пациентов группы Б, причем только в подгруппах активного альвеолита и прогрессирующего фиброза (табл. 3).
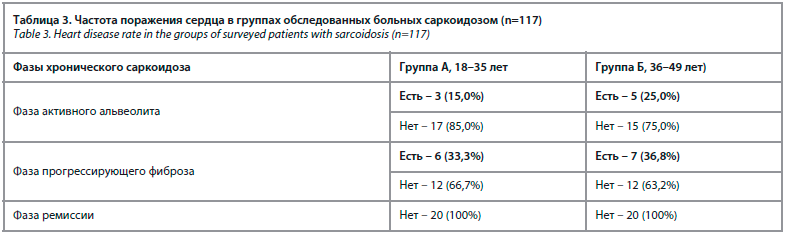
У 3 пациентов группы А и у 5 пациентов группы Б отмечались нарушения ритма и проводимости (результаты суточного мониторирования ЭКГ), диффузное некоронарогенное поражение миокарда (результаты ОФЭКТ, МРТ) с непостоянными кардиалгиями, у остальных пациентов констатировали бессимптомное течение кардиопатии, среди которых в основном методами МРТ и ОФЭКТ диагностировали некоронарогенные поражения миокарда.
Эхокардиографические признаки диастолической и систолической дисфункции миокарда отсутствовали у всех обследованных при включении в исследование. Показатели NT-proBNP оставались в пределах нормальных значений у всех больных, достоверное повышение sST2 отмечено у 11 больных саркоидозом с поражением сердца (52,4% от всех пациентов кардиосаркоидозом): у 3 в группе А, 8 в группе Б при первичном обследовании (см. табл. 3).
Через 6 мес признаки поражения сердца сохранились у 3 из 9 больных группы А (у 1 в фазе активного альвеолита, у 2 в фазе прогрессирующего фиброза легких).
В группе Б признаки поражения сердца сохранились у 8 из 12 больных (у 3 в фазе активного альвеолита, у 5 в фазе прогрессирующего фиброза легких); табл. 4.
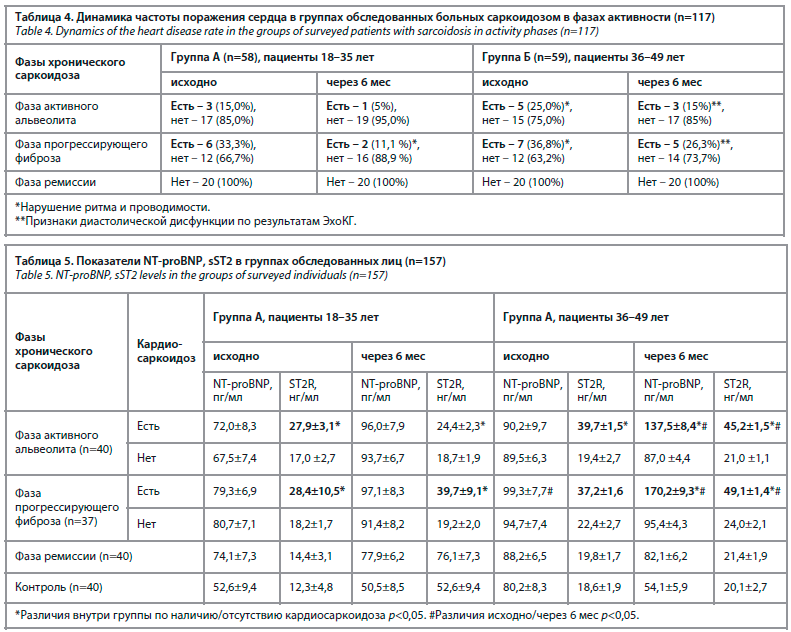
Признаки диастолической дисфункции, которые отсутствовали при включении в исследование, выявлены только в старшей возрастной группе у 8 больных из 12, параметры систолической функции были в норме. Исходно достоверное повышение sST2 зарегистрировано у этих 8 пациентов группы Б до обнаружения ультразвуковых признаков дисфункции, у этих же больных зарегистрирован дальнейший рост сывороточных значений sST2, а также появление достоверно повышенного
NT-proBNP, их максимальные значения были у больных группы Б, в фазе прогрессирующего фиброза легких, но не имевших признаков поражения правых отделов сердца и формирования ЛГ. Полученные результаты были основанием для коррекции терапии с назначением ГКС, реже в комбинации с цитостатиками.
В обеих группах у больных со стойкой ремиссией хронического саркоидоза серологические параметры растворимого рецептора и NT-proBNP были в пределах нормы (табл. 5). Через 6 мес sST2 нормализовался у 2/3 больных кардиосаркоидозом в группе А, что сопровождалось купированием кардиалгий, а также некоронарогенных изменений, выявляемых ранее при проведении сцинтиграфии, МРТ. В группе Б из 12 больных у 8 отмечено дальнейшее повышение sST2, появилось увеличение NT-proBNP, впервые были выявлены ультразвуковые признаки диастолической дисфункции при сохранной фракции выброса левого желудочка. Данные результаты позволили констатировать у них начальную стадию СН. Полученные данные отличались от значений исследуемых параметров в группе А и в подгруппе больных, имеющих стойкую ремиссию саркоидоза. Статистически достоверной динамики активности АФП отмечено не было, его показатели имели тенденцию к большему повышению у пациентов с поражением сердца в подгруппах активного альвеолита и прогрессирующего фиброза группы А (203,1±45,2 ACE unit) и группы Б (169,3±31,4 ACE unit). Динамическое наблюдение за пациентами в течение 1 года позволило диагностировать развитие хронической СН с сохранной фракцией выброса у 3 пациентов из старшей группы (Б), имевших поражение сердце по результатам сцинтиграфии, МРТ и показавших самые высокие результаты sST22. Следует отметить, что других причин хронической СН, кроме генерализованного хронического саркоидоза, выявлено не было. Течение саркоидоза у этих пациентов имело персистирующий характер активности, что потребовало проведения сочетанной иммуносупрессивной терапии ГКС и цитостатиками согласно клиническим рекомендациям [1].
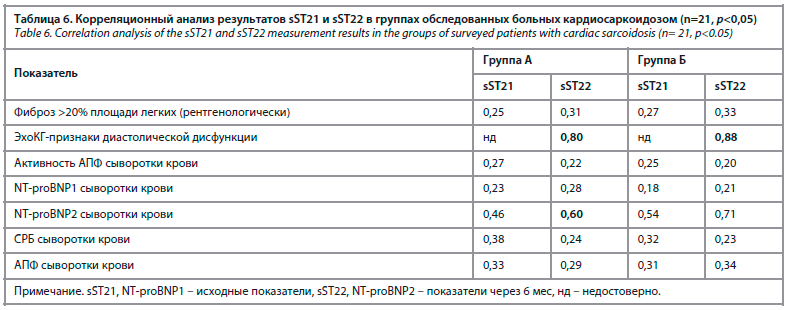
С учетом малой выборки были рассчитаны корреляционные взаимоотношения, показавшие потенциальное наличие средних и сильных связей между показателями sST22 и NT-proBNP2 сыворотки крови в группе Б (r=0,71), в группе А (r=0,60). Самые сильные прямые связи выявлены между ультразвуковыми признаками диастолической дисфункции и sST22 в обеих группах А и Б (r=0,80 и r=0,88 соответственно). Активность АПФ, СРБ крови, выраженность легочного фиброза не продемонстрировали достоверных связей с биомаркерами сердечной дисфункции (табл. 6).
Источник повышенной продукции sST2 при сердечной недостаточности пока точно не установлен. Некоторые данные указывают на то, что это могут быть не только кардиомиоциты и фибробласты сердца, но и экстракардиальные ткани (легкие, сосудистый эндотелий) [11, 12]. Ряд исследований продемонстрировали, что источниками этого маркера являются не только кардиомиоциты, но и эндотелиоциты, показана возможность значимой легочной продукции sST2 альвеолоцитами второго типа в ответ на нагрузку в экспериментальной модели острого некроза миокарда у пациентов с кардиогенным отеком легких [15, 9].
Учитывая малую выборку пациентов, нам не удалось получить корреляции между активностью АПФ и sST2 крови, отмечена лишь тенденция, показывающая их взаимный рост, что, с нашей точки зрения, в большей степени соответствовало активности прежде всего легочного поражения в рамках генерализованного саркоидозного процесса, хотя можно предположить, что повышение sST2 отражало выявленную у некоторых пациентов диастолическую дисфункцию (см. табл. 6).
Как видно из представленных результатов и данных других исследователей, определение sST2 не заменяет определение натрийуретического пептида для диагностики СН, но позволяет подойти к интегральной оценке состояния и его прогноза в случае сочетанного поражения легких, сердца, сосудов, что отличает пациентов с кардиосаркоидозом. Уровень sST2 имеет более низкую индивидуальную вариабельность, менее зависим от функции почек и индекса массы тела (основные особенности, которые надо учитывать при оценке NT-proBNP), имеет меньшую биологическую вариабельность, а соответственно, и коэффициент критической разницы [11].
В двух крупных исследованиях MOCA и PARADIGM-HF среди большого числа биомаркеров, изученных у пациентов с острой декомпенсацией СН, sST2 стал лучшим предиктором 1-летней смертности [16], после корректировки по NT-proBNP и высокочувствительному тропонину Т оказался независимым предиктором ухудшения течения СН, сердечно-сосудистой смерти и их комбинации, повышение уровня sST2 через 1 месяц наблюдения также было независимо связано с неблагоприятными исходами [17].
Применение исследования sST2 в числе дополнительных методов обследования пациентов с СН в целях стратификации риска обсуждается отечественным обществом кардиологов, рекомендовано европейским, американским кардиологическими сообществами (ACC/AHA/HFSA, 2013, 2017) [5].
Вышеизложенное послужило поводом для изучения данного маркера у больных с кардиосаркоидозом. Результаты проведенного пилотного исследования позволяют обсуждать sST2 в качестве критерия ранней диагностики поражения и/или дисфункции миокарда у больных саркоидозом в фазах активного альвеолита и прогрессирующего фиброза легких. Как было нами показано, его повышение в крови, возможно, опережает рост NT-proBNP, ультразвуковые изменения. Дальнейшее увеличение sST2 у наших пациентов коррелировало с появлением указанных патологических параметров, что отражает риск поражения сердца у больных саркоидозом. Так, корреляционный анализ в нашем исследовании показал, что у больных как молодого, так и более старшего возраста в активных фазах саркоидоза целесообразно выявление признаков поражения сердца, в том числе клинически бессимптомных. На начальном этапе исследования sST2 был повышен у 17,9% больных, половина из которых не предъявляли кардиологических жалоб и не имели нарушений, выявляемых рутинными методами стандартного обследования. Проявившиеся через 6 мес наблюдения ультразвуковые признаки, повышение NT-proBNP, дальнейший рост sST2 доказали клиническое значение определения ростового растворимого рецептора как одного из маркеров поражения миокарда у больных активным саркоидозом. Это подтвердили полученные нами убедительные прямые корреляции (см. табл. 6). Важно также отметить, что у пациентов с успешным лечением саркоидоза регистрировали уменьшение уровня sST2, что позволило при сопоставлении с результатами визуализирующих методов выбрать адекватную лечебную тактику. Дальнейшие исследования целесообразно направить в русло изучения влияния начальных стадий фиброза легких и легочной гипертензии на развитие поражения сердца. Возможность прогнозирования негативного развития фиброза на основании динамически растущего плазменного сурфактантного протеина D, как это было показано нами [18], в комплексе с кардиомаркерами позволит выделить группу риска формирования указанных осложнений среди больных хроническим саркоидозом, тем более что показана возможность повышения как sST2, так и NT-proBNP у больных с патологией нижних отделов респираторного тракта [7, 9]. Учитывая синхронность процессов воспаления и прогрессирования в пораженных органах, в том числе легких и сердца, определение концентрации данного маркера у больных саркоидозом может применяться для первичной оценки вовлечения сердца в патологический процесс, а также при мониторировании течения саркоидозного воспаления с целью принятия решений применения противовоспалительной терапии, оценки эффективности и длительности лечения.
Таким образом, по результатам впервые проведенного пилотного исследования sST2 у больных саркоидозом показано, что этот маркер возможно рассматривать как один из компонентов лабораторной части диагностического комплекса для определения вовлечения сердца в саркоидозный процесс. Целесообразны дальнейшие исследования для определения места sST2 для ранней диагностики поражения сердца, его прогрессирования, а также риска развития СН у больных саркоидозом.
2. Определение sST2 в крови можно рекомендовать включить в комплексную диагностику и динамическую оценку течения хронического саркоидоза, протекающего с поражением сердца, а также для пациентов, имеющих коморбидную кардиологическую патологию и риск развития СН.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Лебедева Марина Валерьевна – канд. мед. наук, доц. каф. внутренних, профессиональных заболеваний и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: marinaamica@mail.ru;
ORCID: 0000-0002-5923-1837
Marina V. Lebedeva – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University).
E-mail: marinaamica@mail.ru; ORCID: 0000-0002-5923-1837
Стрижаков Леонид Александрович – д-р мед. наук, проф.,
зам. директора по научной и лечебной работе ФГБНУ «НИИ МТ
им. академика Н.Ф. Измерова», проф. каф. Внутренних болезней ФГБОУ ВО «МГУ им. Ломоносова», руководитель Центра профпатологии УКБ №3, ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет).
E-mail: strizhakov76@mail.ru; ORCID: 0000-0002-2291-6453
Leonid A. Strizhakov – Dr. Sci. (Med.), Full Prof., Lomonosov Moscow State University, Sechenov First Moscow State Medical University (Sechenov University), Scientific Research Institute of Occupational Medicine named after Academician N.F. Izmerov. E-mail: strizhakov76@mail.ru; ORCID: 0000-0002-2291-6453
Бекетов Владимир Дмитриевич – канд. мед. наук, доц. каф. внутренних, профессиональных заболеваний и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: beketov-vladimir@inbox.ru;
ORCID 0000-0002-6377-0630
Vladimir D. Beketov – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University).
E-mail: beketov-vladimir@inbox.ru;
ORCID 0000-0002-6377-0630
Таранова Марина Владимировна – канд. мед. наук, доц. каф. внутренних, профессиональных заболеваний и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: mvtaranova@mail.ru;
ORCID: 0000-0002-7363-6195
Marina V. Taranova – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University).
E-mail: mvtaranova@mail.ru; ORCID: 0000-0002-7363-6195
Поступила в редакцию: 12.02.2024
Поступила после рецензирования: 20.02.2024
Принята к публикации: 22.02.2024
Received: 12.02.2024
Revised: 20.02.2024
Accepted: 22.02.2024
Клинический разбор в общей медицине №1 2024
Клиническое значение определения sST2 в крови больных кардиосаркоидозом
Номера страниц в выпуске:31-37
Аннотация
Представлены результаты пилотного исследования сывороточного маркера поражения сердца sST2 у пациентов с генерализованным саркоидозом хронического течения. Отражены корреляции между активностью саркоидоза, уровнем sST2 и риском развития сердечной недостаточности.
Ключевые слова: sST2, саркоидоз, кардиосаркоидоз, сердечная недостаточность.
Для цитирования: Лебедева М.В., Стрижаков Л.А., Бекетов В.Д., Таранова М.В. Клиническое значение определения sST2 в крови больных кардиосаркоидозом. Клинический разбор в общей медицине. 2024; 5 (1): 31–37. DOI: 10.47407/kr2023.5.1.00357
Представлены результаты пилотного исследования сывороточного маркера поражения сердца sST2 у пациентов с генерализованным саркоидозом хронического течения. Отражены корреляции между активностью саркоидоза, уровнем sST2 и риском развития сердечной недостаточности.
Ключевые слова: sST2, саркоидоз, кардиосаркоидоз, сердечная недостаточность.
Для цитирования: Лебедева М.В., Стрижаков Л.А., Бекетов В.Д., Таранова М.В. Клиническое значение определения sST2 в крови больных кардиосаркоидозом. Клинический разбор в общей медицине. 2024; 5 (1): 31–37. DOI: 10.47407/kr2023.5.1.00357
Original article Clinical significance of determining sST2 in the blood of patients with cardiac sarcoidosis
Marina V. Lebedeva1, Leonid A. Strizhakov1,2,3, Vladimir D. Beketov1, Marina V. Taranova11 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
2 Scientific Research Institute of Occupational Medicine named after Academician N.F. Izmerov, Moscow, Russia;
3 Lomonosov Moscow State University, Moscow, Russia
marinaamica@mail.ru
Abstract
The results of a pilot study of the serum marker of cardiac damage sST2 in patients with chronic generalized sarcoidosis are presented. Correlations between the activity of sarcoidosis, sST2 levels and the risk of developing heart failure have been demonstrated.
Keywords: sST2, sarcoidosis, cardiac sarcoidosis, heart failure.
For citation: Lebedeva M.V., Strizhakov L.A., Beketov V.D., Taranova M.V. Clinical significance of determining sST2 in the blood of patients with cardiac sarcoidosis. Clinical review for general practice. 2024; 5 (1): 31–37 (In Russ.). DOI: 10.47407/kr2023.5.1.00357
Распространенность и заболеваемость саркоидозом лидируют среди всех интерстициальных поражений легких неустановленной этиологии [1, 2]. Среди внелегочных проявлений кардиосаркоидоз – одно из наиболее прогностически серьезных. В последние годы отмечается тенденция к увеличению частоты диагностики поражения сердца у больных саркоидозом [1–3], в том числе в возрасте старше 40 лет. Это создает определенные диагностические трудности, прежде всего в случае бессимптомного вовлечения сердца, определяет несвоевременное распознавание формирования сердечной недостаточности (СН) [1–4].
Общепризнанными критериями СН являются натрийуретические пептиды, однако их повышение, как правило, проявляется при наличии клинических и эхокардиографических проявлений СН. Актуален вопрос о поиске маркера, предсказывающего риск развития кардиальной дисфункции в ответ на воспалительный процесс в рамках кардиосаркоидоза.
Среди лабораторных маркеров СН ранней стадии рассматривают, в частности, растворимый стимулирующий фактор роста, экспрессирующийся геном 2 (sST2) [5–8]. Скудность клинических проявлений, а также известные ограничения рентгенологических и морфологических методов исследования послужили поводом для проведения нашего клинического исследования.
Цель исследования – оценить клиническое значение определения sST2 в крови больных саркоидозом хронического течения с поражением сердца.
Задачи исследования: 1) провести исследование показателей sST2 у больных хроническим саркоидозом с поражением сердца в фазах активности, прогрессирования и ремиссии; 2) сопоставить полученные результаты с другими лабораторными, а также рентгенологическими маркерами активности и прогрессирования саркоидоза.
Материал и методы
В пилотном исследовании участвовали 117 больных: 64 женщины и 53 мужчин, в возрасте от 18 до 49 лет, страдающих хроническим саркоидозом легких и внутригрудных лимфатических узлов, и 40 лиц контрольной группы (20 женщин, 20 мужчин, сопоставимых с пациентами по возрасту и полу); в течение 12–16 мес.Критерии включения:
• возраст 18–49 лет;
• морфологически подтвержденный диагноз саркоидоза легких, внутригрудных лимфатических узлов (ВГЛУ);
• рентгенологическая стадия саркоидоза легких и ВГЛУ – II, III;
• объем форсированного выдоха за 1-ю секунду >70%;
• добровольное письменное информированное согласие пациента на участие в исследовании.
Критерии исключения:
• легочная гипертензия;
• артериальная гипертензия (АГ) II–III степени;
• хроническая болезнь почек III стадии;
• врожденные/приобретенные пороки сердца;
• ишемическая болезнь сердца;
• нарушение мозгового кровообращения;
• сахарный диабет любого типа;
• бронхиальная астма;
• хроническая обструктивная болезнь легких (ХОБЛ);
• онкологические заболевания.
Пациенты распределены по группам с учетом возраста: группа А – 18–35 лет, группа Б – 36–49 лет. Внутри групп выделены три подгруппы в соответствии с фазами течения хронического саркоидоза: фаза активного альвеолита, фаза прогрессирующего фиброза, фаза стойкой ремиссии, составившая не менее 12 мес на момент включения в исследование (табл. 1).

Среди пациентов, имеющих стойкую ремиссию, ранее диагностировали кардиосаркоидоз (до достижения ими ремиссии): у 4 в группе А и у 7 в группе Б. Относительно малое число включенных пациентов определено целью исследования – изучения поражения сердца у больных саркоидозом без сочетанных заболеваний, наличие которых могло влиять на уровень изучаемого белка, а именно легочной гипертензии (ЛГ), бронхиальной астмы, ХОБЛ, ожирения II, III степеней. При включении в исследование только у двух больных группы Б, страдавших АГ I степени, выявили умеренно выраженную гипертрофию миокарда левого желудочка.
Помимо общего клинического обследования, были проведены исследования: сатурации кислорода в покое методом пульсоксиметрии, диффузионной способности легких, а также выполнены: тест 6-тиминутной ходьбы, трансторакальная эхокардиография (ЭхоКГ) на аппарате Vivid 7 (General Electric, США), компьютерная томография органов грудной клетки. По стандартным методикам исследовали диастолическую функцию обоих желудочков и систолическое давление в легочной артерии с помощью модифицированного уравнения Бернулли [5]. ЛГ констатировали при среднем давлении в легочной артерии, превышавшем 20 мм рт. ст., что являлось критерием исключения из участия в исследовании. Компьютерную томографию органов грудной клетки проводили на компьютерном томографе Asteon 4 (Toshiba, Япония). Морфологическое исследование биоптатов ткани легких и/или ВГЛУ выполнено всем больным. Поражение сердца выявляли методами однофотонной эмиссионной компьютерной томографии (ОФЭКТ) или магнитно-резонансной томографии (МРТ). Лабораторная часть включала определение растворимой циркулирующей в крови формы ST2 (Growth STimulation expressed gene 2, стимулирующий фактор роста, экспрессирующийся геном 2) – sST2 (тест-набор «Critical Diagnostics», США), N-терминального мозгового натрийуретического пептида –
NT-proBNP (тест-набор «Siemens Healthcare Diagnostics»), С-реактивного белка – СРБ (ИМТЕК, Россия), активности ангиотензин-превращающего фермента – АПФ (тест-набор «Buhlmann Laboratories AG», Германия). Референсные значения исследованных лабораторных показателей в крови обследованных больных представлены в табл. 2.

Описанный спектр лабораторных и инструментальных исследований проводили дважды: при включении в исследование и через 6 мес. Все больные, в том числе с диагностированным кардиосаркоидозом получали терапию системными глюкокортикостероидами (ГКС) или сочетанную терапию ГКС и цитостатиками по схемам, предложенным действующими клиническими рекомендациями [1].
Статистическая обработка полученных данных проводилась в программе Statiatica Advanced (http://statsoft.ru/products/STATISTICA_Advanced/ для малых выборок), достоверными считались результаты при p<0,05.
Результаты
Из 117 больных хроническим саркоидозом II и III рентгенологических стадий поражение сердца выявлено у 21 пациента (17,9%): у 9 больных группы А
и 12 пациентов группы Б, причем только в подгруппах активного альвеолита и прогрессирующего фиброза (табл. 3).

У 3 пациентов группы А и у 5 пациентов группы Б отмечались нарушения ритма и проводимости (результаты суточного мониторирования ЭКГ), диффузное некоронарогенное поражение миокарда (результаты ОФЭКТ, МРТ) с непостоянными кардиалгиями, у остальных пациентов констатировали бессимптомное течение кардиопатии, среди которых в основном методами МРТ и ОФЭКТ диагностировали некоронарогенные поражения миокарда.
Эхокардиографические признаки диастолической и систолической дисфункции миокарда отсутствовали у всех обследованных при включении в исследование. Показатели NT-proBNP оставались в пределах нормальных значений у всех больных, достоверное повышение sST2 отмечено у 11 больных саркоидозом с поражением сердца (52,4% от всех пациентов кардиосаркоидозом): у 3 в группе А, 8 в группе Б при первичном обследовании (см. табл. 3).
Через 6 мес признаки поражения сердца сохранились у 3 из 9 больных группы А (у 1 в фазе активного альвеолита, у 2 в фазе прогрессирующего фиброза легких).
В группе Б признаки поражения сердца сохранились у 8 из 12 больных (у 3 в фазе активного альвеолита, у 5 в фазе прогрессирующего фиброза легких); табл. 4.

Признаки диастолической дисфункции, которые отсутствовали при включении в исследование, выявлены только в старшей возрастной группе у 8 больных из 12, параметры систолической функции были в норме. Исходно достоверное повышение sST2 зарегистрировано у этих 8 пациентов группы Б до обнаружения ультразвуковых признаков дисфункции, у этих же больных зарегистрирован дальнейший рост сывороточных значений sST2, а также появление достоверно повышенного
NT-proBNP, их максимальные значения были у больных группы Б, в фазе прогрессирующего фиброза легких, но не имевших признаков поражения правых отделов сердца и формирования ЛГ. Полученные результаты были основанием для коррекции терапии с назначением ГКС, реже в комбинации с цитостатиками.
В обеих группах у больных со стойкой ремиссией хронического саркоидоза серологические параметры растворимого рецептора и NT-proBNP были в пределах нормы (табл. 5). Через 6 мес sST2 нормализовался у 2/3 больных кардиосаркоидозом в группе А, что сопровождалось купированием кардиалгий, а также некоронарогенных изменений, выявляемых ранее при проведении сцинтиграфии, МРТ. В группе Б из 12 больных у 8 отмечено дальнейшее повышение sST2, появилось увеличение NT-proBNP, впервые были выявлены ультразвуковые признаки диастолической дисфункции при сохранной фракции выброса левого желудочка. Данные результаты позволили констатировать у них начальную стадию СН. Полученные данные отличались от значений исследуемых параметров в группе А и в подгруппе больных, имеющих стойкую ремиссию саркоидоза. Статистически достоверной динамики активности АФП отмечено не было, его показатели имели тенденцию к большему повышению у пациентов с поражением сердца в подгруппах активного альвеолита и прогрессирующего фиброза группы А (203,1±45,2 ACE unit) и группы Б (169,3±31,4 ACE unit). Динамическое наблюдение за пациентами в течение 1 года позволило диагностировать развитие хронической СН с сохранной фракцией выброса у 3 пациентов из старшей группы (Б), имевших поражение сердце по результатам сцинтиграфии, МРТ и показавших самые высокие результаты sST22. Следует отметить, что других причин хронической СН, кроме генерализованного хронического саркоидоза, выявлено не было. Течение саркоидоза у этих пациентов имело персистирующий характер активности, что потребовало проведения сочетанной иммуносупрессивной терапии ГКС и цитостатиками согласно клиническим рекомендациям [1].
С учетом малой выборки были рассчитаны корреляционные взаимоотношения, показавшие потенциальное наличие средних и сильных связей между показателями sST22 и NT-proBNP2 сыворотки крови в группе Б (r=0,71), в группе А (r=0,60). Самые сильные прямые связи выявлены между ультразвуковыми признаками диастолической дисфункции и sST22 в обеих группах А и Б (r=0,80 и r=0,88 соответственно). Активность АПФ, СРБ крови, выраженность легочного фиброза не продемонстрировали достоверных связей с биомаркерами сердечной дисфункции (табл. 6).

Обсуждение
Частота поражения сердца у пациентов хроническим, особенно генерализованным саркоидозом составляет 5–18%, вместе с тем риск развития СН в результате кардиосаркоидоза невысок [1, 3, 4, 9]. Однако у пациентов старше 40 лет, по данным многих авторов, отмечается рост заболеваемости саркоидозом, и нередкое наличие у них сочетанной патологии – гипертонической болезни, ИБС, определяет риск развития СН, особенно при активном течение саркоидоза [1, 4, 18, 19]. Диагностика поражения сердца при саркоидозе, его динамическая оценка требуют дальнейшего совершенствования, особенно с учетом отсутствия универсального диагностического маркера. В последние годы появились новые лабораторные показатели, позволяющие выявить функциональные изменения миокарда на ранних стадиях. Одним из них является белок ST2, представленный двумя изоформами: трансмембранной (ST2L), связанной со своим природным лигандом интерлейкином ИЛ-33, и растворимой sST2. Комплекс ИЛ-33/ST2L обладает кардиопротективным действием, в том числе и антифибротическим эффектом, в то время как sST2 наоборот демонстрирует повреждающее действие, являясь своеобразной «ловушкой» для ИЛ-33, способствуя развитию ремоделирования и фиброза сердца [10]. Установлено, что повышение концентрации sST2 ассоциируются с начальными проявлениями СН [10–12]. Исследуя sST2 у больных с острым повреждением миокарда, J. Lupón отметил его роль как независимого маркера, отражающего обратимость ремоделирования миокарда [13]. B. Dike и соавт. показали прямые сильные корреляции между sST2 и развитием диастолической дисфункции левого желудочка [14].Источник повышенной продукции sST2 при сердечной недостаточности пока точно не установлен. Некоторые данные указывают на то, что это могут быть не только кардиомиоциты и фибробласты сердца, но и экстракардиальные ткани (легкие, сосудистый эндотелий) [11, 12]. Ряд исследований продемонстрировали, что источниками этого маркера являются не только кардиомиоциты, но и эндотелиоциты, показана возможность значимой легочной продукции sST2 альвеолоцитами второго типа в ответ на нагрузку в экспериментальной модели острого некроза миокарда у пациентов с кардиогенным отеком легких [15, 9].
Учитывая малую выборку пациентов, нам не удалось получить корреляции между активностью АПФ и sST2 крови, отмечена лишь тенденция, показывающая их взаимный рост, что, с нашей точки зрения, в большей степени соответствовало активности прежде всего легочного поражения в рамках генерализованного саркоидозного процесса, хотя можно предположить, что повышение sST2 отражало выявленную у некоторых пациентов диастолическую дисфункцию (см. табл. 6).
Как видно из представленных результатов и данных других исследователей, определение sST2 не заменяет определение натрийуретического пептида для диагностики СН, но позволяет подойти к интегральной оценке состояния и его прогноза в случае сочетанного поражения легких, сердца, сосудов, что отличает пациентов с кардиосаркоидозом. Уровень sST2 имеет более низкую индивидуальную вариабельность, менее зависим от функции почек и индекса массы тела (основные особенности, которые надо учитывать при оценке NT-proBNP), имеет меньшую биологическую вариабельность, а соответственно, и коэффициент критической разницы [11].
В двух крупных исследованиях MOCA и PARADIGM-HF среди большого числа биомаркеров, изученных у пациентов с острой декомпенсацией СН, sST2 стал лучшим предиктором 1-летней смертности [16], после корректировки по NT-proBNP и высокочувствительному тропонину Т оказался независимым предиктором ухудшения течения СН, сердечно-сосудистой смерти и их комбинации, повышение уровня sST2 через 1 месяц наблюдения также было независимо связано с неблагоприятными исходами [17].
Применение исследования sST2 в числе дополнительных методов обследования пациентов с СН в целях стратификации риска обсуждается отечественным обществом кардиологов, рекомендовано европейским, американским кардиологическими сообществами (ACC/AHA/HFSA, 2013, 2017) [5].
Вышеизложенное послужило поводом для изучения данного маркера у больных с кардиосаркоидозом. Результаты проведенного пилотного исследования позволяют обсуждать sST2 в качестве критерия ранней диагностики поражения и/или дисфункции миокарда у больных саркоидозом в фазах активного альвеолита и прогрессирующего фиброза легких. Как было нами показано, его повышение в крови, возможно, опережает рост NT-proBNP, ультразвуковые изменения. Дальнейшее увеличение sST2 у наших пациентов коррелировало с появлением указанных патологических параметров, что отражает риск поражения сердца у больных саркоидозом. Так, корреляционный анализ в нашем исследовании показал, что у больных как молодого, так и более старшего возраста в активных фазах саркоидоза целесообразно выявление признаков поражения сердца, в том числе клинически бессимптомных. На начальном этапе исследования sST2 был повышен у 17,9% больных, половина из которых не предъявляли кардиологических жалоб и не имели нарушений, выявляемых рутинными методами стандартного обследования. Проявившиеся через 6 мес наблюдения ультразвуковые признаки, повышение NT-proBNP, дальнейший рост sST2 доказали клиническое значение определения ростового растворимого рецептора как одного из маркеров поражения миокарда у больных активным саркоидозом. Это подтвердили полученные нами убедительные прямые корреляции (см. табл. 6). Важно также отметить, что у пациентов с успешным лечением саркоидоза регистрировали уменьшение уровня sST2, что позволило при сопоставлении с результатами визуализирующих методов выбрать адекватную лечебную тактику. Дальнейшие исследования целесообразно направить в русло изучения влияния начальных стадий фиброза легких и легочной гипертензии на развитие поражения сердца. Возможность прогнозирования негативного развития фиброза на основании динамически растущего плазменного сурфактантного протеина D, как это было показано нами [18], в комплексе с кардиомаркерами позволит выделить группу риска формирования указанных осложнений среди больных хроническим саркоидозом, тем более что показана возможность повышения как sST2, так и NT-proBNP у больных с патологией нижних отделов респираторного тракта [7, 9]. Учитывая синхронность процессов воспаления и прогрессирования в пораженных органах, в том числе легких и сердца, определение концентрации данного маркера у больных саркоидозом может применяться для первичной оценки вовлечения сердца в патологический процесс, а также при мониторировании течения саркоидозного воспаления с целью принятия решений применения противовоспалительной терапии, оценки эффективности и длительности лечения.
Таким образом, по результатам впервые проведенного пилотного исследования sST2 у больных саркоидозом показано, что этот маркер возможно рассматривать как один из компонентов лабораторной части диагностического комплекса для определения вовлечения сердца в саркоидозный процесс. Целесообразны дальнейшие исследования для определения места sST2 для ранней диагностики поражения сердца, его прогрессирования, а также риска развития СН у больных саркоидозом.
Выводы
1. У больных хроническим саркоидозом с поражением сердца в фазах активности, прогрессирования отмечается повышение sST2 в крови, что отражает наличие саркоидозной кардиопатии в комплексной диагностике с применением методов МРТ и/или ОФЭКТ.2. Определение sST2 в крови можно рекомендовать включить в комплексную диагностику и динамическую оценку течения хронического саркоидоза, протекающего с поражением сердца, а также для пациентов, имеющих коморбидную кардиологическую патологию и риск развития СН.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Лебедева Марина Валерьевна – канд. мед. наук, доц. каф. внутренних, профессиональных заболеваний и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: marinaamica@mail.ru;
ORCID: 0000-0002-5923-1837
Marina V. Lebedeva – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University).
E-mail: marinaamica@mail.ru; ORCID: 0000-0002-5923-1837
Стрижаков Леонид Александрович – д-р мед. наук, проф.,
зам. директора по научной и лечебной работе ФГБНУ «НИИ МТ
им. академика Н.Ф. Измерова», проф. каф. Внутренних болезней ФГБОУ ВО «МГУ им. Ломоносова», руководитель Центра профпатологии УКБ №3, ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет).
E-mail: strizhakov76@mail.ru; ORCID: 0000-0002-2291-6453
Leonid A. Strizhakov – Dr. Sci. (Med.), Full Prof., Lomonosov Moscow State University, Sechenov First Moscow State Medical University (Sechenov University), Scientific Research Institute of Occupational Medicine named after Academician N.F. Izmerov. E-mail: strizhakov76@mail.ru; ORCID: 0000-0002-2291-6453
Бекетов Владимир Дмитриевич – канд. мед. наук, доц. каф. внутренних, профессиональных заболеваний и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: beketov-vladimir@inbox.ru;
ORCID 0000-0002-6377-0630
Vladimir D. Beketov – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University).
E-mail: beketov-vladimir@inbox.ru;
ORCID 0000-0002-6377-0630
Таранова Марина Владимировна – канд. мед. наук, доц. каф. внутренних, профессиональных заболеваний и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: mvtaranova@mail.ru;
ORCID: 0000-0002-7363-6195
Marina V. Taranova – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University).
E-mail: mvtaranova@mail.ru; ORCID: 0000-0002-7363-6195
Поступила в редакцию: 12.02.2024
Поступила после рецензирования: 20.02.2024
Принята к публикации: 22.02.2024
Received: 12.02.2024
Revised: 20.02.2024
Accepted: 22.02.2024
Список исп. литературыСкрыть список1. Чучалин А.Г., Авдеев С.Н., Айсанов З.Р. и др. Саркоидоз: федеральные клинические рекомендации по диагностике и лечению. Пульмонология. 2022;32(6):806-33. DOI: 10.18093/0869-0189-2022-32-6-806-833
Chuchalin A.G., Avdeev S.N., Aisanov Z.R. et al. Sarcoidosis: federal clinical guidelines for diagnosis and treatment. Pulmonologiya. 2022;32(6):806-33. DOI: 10.18093/0869-0189-2022-32-6-806-833 (in Russian).
2. Rossides M, Darlington P, Kullberg S, Arkema EV. Sarcoidosis: Epidemiology and clinical insights. J Intern Med. 2023;293(6):668-80. DOI: 10.1111/joim.13629
3. Цветкова О.А., Абдуллаева Г.Б., Воронкова О.О. и др. Саркоидоз с поражением сердца и моноклональной гаммапатией. Кардиология. 2020;60(4):151-6. DOI: 10.18087/cardio.2020.4.n712
Tsvetkova О.А., Abdullaeva G.B., Voronkova O.O. et al. Sarcoidosis With Cardiac Involvement and Monoclonal Gammopathy. Kardiologiia. 2020;60(4):151-6 (in Russian).
4. Dae-Won Sohn, Jun-Bean Park. Cardiac sarcoidosis. Heart. 2023;109(15):1132-8. DOI: 10.1136/heartjnl-2022-321379
5. Драпкина О.М., Концевая А.В., Кравченко А.Я. и др. Биомаркеры ST2 и интерлейкин 33 в оценке кардиального воспаления, фиброза и прогноза пациентов с хронической сердечной недостаточностью. Российский кардиологический журнал. 2021;26(3S):4530. DOI: 10.15829/1560-4071-2021-4530
Drapkina O.M., Kontsevaya A.V., Kravchenko A.Ya. et al. Biomarkers ST2 and interleukin 33 for assessing the severity of cardiac inflammation and fibrosis in patients with chronic heart failure. Russian Journal of Cardiology. 2021;26(3S):4530. DOI: 10.15829/1560-4071-2021-4530 (in Russian).
6. Копьева К.В., Гракова Е.В., Тепляков А.Т. Новые маркеры сердечной недостаточности: значение для диагностики и прогнозирования NT-proBNP и интерлейкиновых рецепторов – членов семейства ST2. Комплексные проблемы сердечно-сосудистых заболеваний. 2018;7(1):94-101. DOI: 10.17802/2306-1278-2018-7-1-94-101
Kopeva K.V., Grakova E.V., Teplyakov A.T. New biomarkers of heart failure: diagnostic and prognostic value of NT-proBNP and interleukin receptor family member ST2. Complex Issues of Cardiovascular Diseases. 2018;7(1):94-101. DOI: 10.17802/2306-1278-2018-7-1-94-101 (in Russian).
7. Pascual-Figal D, Perez-Martinez M, Asensio-Lopez M et al. Pulmonary Production of Soluble ST2 in Heart Failure. Circulation: Heart Failure. 2018;11(12):e005488. DOI: 10.1161/CIRCHEARTFAILURE.118.005488
8. Gruson D, Lepoutre T, Ahn SA, Rousseau MF. Increased soluble ST2 is a stronger predictor of long-term cardiovascular death than natriuretic peptides in heart failure patients with reduced ejection fraction. Int J Cardiol. 2014;172(1):e250-2. DOI: 10.1016/j.ijcard.2013.12.101
9. Самсонова М.В., Черняев А.Л. Гранулематозные заболевания легких. Пульмонология. 2017;27(2):250-61. DOI: 10.18093/086930 189320173273232503261
Samsonova M.V., Chernyaev A.L. Granulomatous lung diseases. Pulmonology. 2017;27(2):250-61. DOI: 10.18093/0869301893201732 73232503261 (in Russian).
10. Januzzi Jr JL. ST2 as a cardiovascular risk biomarker: from the bench to the bedside. J Cardiovasc Transl Res. 2013;6(4):493-500. DOI: 10.1007/s12265-013-9459-y
11. Муксинова М.Д., Нарусов О.Ю., Скворцов А.А. Натрийуретические пептиды и растворимый ST2-рецептор: роль в диагностике, стратификации риска и лечении больных с хронической сердечной недостаточностью. Кардиологический вестник. 2019;(4):22-33. DOI: 10.36396/MS.2019.15.4.003
Muksinova M.D., Narusov O.Yu., Skvortsov A.A. Natriuretic peptides and soluble ST2 receptor: role in the diagnosis, risk stratification and treatment of patients with chronic heart failure. Cardiology bulletin. 2019;(4):22-33. DOI: 10.36396/MS.2019.15.4.003 (in Russian).
12. Алиева А.М., Резник Е.В., Гасанова Э.Т. и др. Клиническое значение определения биомаркеров крови у больных с хронической сердечной недостаточностью. Архивъ внутренней медицины. 2018;8(5):333-45. DOI: 10.20514/2226-6704-2018-8-5-333-345
Alieva A.M., Reznik E.V., Gasanova E.T., Zbanov I.V., Nikitin I.G. Clinical significance of determining blood biomarkers in patients with chronic heart failure. Archive of Internal Medicine. 2018;8(5):333-45. DOI: 10.20514/2226-6704-2018-8-5-333-345 (in Russian).
13. Lupón J, Gaggin HK, de Antonio M et al. Biomarker-assist score for reverse remodeling prediction in heart failure: The ST2-R2 score. Int J Cardiol. 2015;184:337-43. DOI: 10.1016/j.ijcard.2015.02.019
14. Ojji DB, Opie LH et al. Relationship Between Left Ventricular Geometry and Soluble ST2 in a Cohort of Hypertensive Patients. J Clin Hypertens. 2013;15(12):899-904. DOI: 10.1111/jch.12205
15. Bartunek J, Delrue L, Van Durme F et al. Nonmyocardial Production of ST2 Protein in Human Hypertrophy and Failure Is Related to Diastolic Load. J Am College Cardiol. 2008;52(25):2166-74. DOI: 10.1016/j.jacc.2008.09.027
16. Lassus J, Gayat E, Mueller C et al. Incremental value of biomarkers to clinical variables for mortality prediction in acutely decompensated heart failure: The Multinational Observational Cohort on Acute Heart Failure (MOCA) study. Int J Cardiol. 2013;168(3):2186-94. DOI: 10.1016/j.ijcard.2013.01.228
17. O’Meara E, Prescott M, Claggett B et al. Independent Prognostic Value of Serum Soluble ST2 Measurements in Patients With Heart Failure and a Reduced Ejection Fraction in the PARADIGM-HF Trial (Prospective Comparison of ARNI With ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure). Circulation: Heart Failure. 2018;11(5): e004446. DOI: 10.1161/circheartfailure.117.004446.
18. Бекетов В.Д., Лебедева М.В., Мухин Н.А. и др. Сурфактантные протеины A и D в диагностике идиопатического легочного фиброза и саркоидоза. Терапевтический архив. 2018;3(90):42-6. DOI: 10.26442/terarkh201890342-46
Beketov V.D., Lebedeva M.V., Mukhin N.A. et al. Clinical significance of the determination of surfactant proteins A and D in assessing the activity of lung sarcoidosis. Therapeutic archive. 2018;3(90):42-6. DOI: 10.26442/terarkh201890342-46 (in Russian).
19. Язев Е.Е., Лебедева М.В., Стрижаков Л.А. и др. Желудочковая экстрасистолия как редкий дебют саркоидоза. Клиническая медицина. 2017;95(12):1137-40. DOI: 10.18821/0023-2149-2017-95-12-1137-1140
Yazev E.E ., Lebedeva M.V., Strizhakov L.A., Pasha S. et al. Ventricular premature beats as a rare onset of sarcoidosis. Klin. med. 2017;95(12):1137-40. DOI: DOI: 10.18821/0023-2149-2017-95-12-1137-1140 (in Russian).


