Клинический разбор в общей медицине №1 2024
Клинический разбор в общей медицине №1 2024
Опыт применения генно-инженерных биологических препаратов при тяжелой бронхиальной астме в Республике Саха (Якутия)
Номера страниц в выпуске:44-47
Аннотация
В Республике Саха (Якутия) в период с 2001 по 2020 г. регистрируется рост заболеваемости бронхиальной астмой с 4,1 до 12,5 на 1000 населения. Учитывая то, что в настоящее время одним из наиболее эффективных современных методов лечения тяжелой бронхиальной астмы (ТБА) является терапия генно-инженерными биологическими препаратами (ГИБП), а также отсутствие исследований по данной проблеме в якутской популяции, наша работа представляется актуальной. Цель настоящего исследования – оценка эффективности лечения ГИБП пациентов с ТБА в якутской популяции. В исследование вошли 17 пациентов, страдающих ТБА. Оценивали эффективность следующих ГИБП: у 5 пациентов – анти-интерлейкин (ИЛ)-4, ИЛ-13-препарата, у 6 – анти-ИЛ-5-препарата, у 6 – анти-иммуноглобулин E-препарата. Эффективность лечения оценивалась по тесту оценки контроля симптомов ACQ-5, количеству обострений за предшествующие 12 мес. терапии ГИБП, уровню иммуноглобулина E, абсолютного количества эозинофилов, показателей функции внешнего дыхания, потребности пациентов в дополнительной терапии бронхиальной астмы. Перед инициацией у 8 (47,10%) пациентов были выявлены обострения с обращением за медицинской помощью, 2 пациента госпитализированы в пульмонологическое отделение, через 6 и 12 мес. обострений и госпитализаций в специализированные стационары не было зарегистрировано. При применении ГИБП в течение 12 мес. снижалась потребность в ингаляционных глюкокортикостероидах. ТБА оказывает существенное воздействие на качество жизни пациентов и является финансово затратной как для пациентов, так и для здравоохранения.
Ключевые слова: генно-инженерные биологические препараты, тяжелая бронхиальная астма, Т2-воспаление, Т2-астма, генно-инженерная биологическая терапия, интерлейкины, иммуноглобулин Е.
Для цитирования: Данилов А.В., Аргунова А.Н., Соловьева Ю.А. Опыт применения генно-инженерных биологических препаратов при тяжелой бронхиальной астме в Республике Саха (Якутия). Клинический разбор в общей медицине. 2024; 5 (1): 44–47. DOI: 10.47407/kr2023.5.1.00359
В Республике Саха (Якутия) в период с 2001 по 2020 г. регистрируется рост заболеваемости бронхиальной астмой с 4,1 до 12,5 на 1000 населения. Учитывая то, что в настоящее время одним из наиболее эффективных современных методов лечения тяжелой бронхиальной астмы (ТБА) является терапия генно-инженерными биологическими препаратами (ГИБП), а также отсутствие исследований по данной проблеме в якутской популяции, наша работа представляется актуальной. Цель настоящего исследования – оценка эффективности лечения ГИБП пациентов с ТБА в якутской популяции. В исследование вошли 17 пациентов, страдающих ТБА. Оценивали эффективность следующих ГИБП: у 5 пациентов – анти-интерлейкин (ИЛ)-4, ИЛ-13-препарата, у 6 – анти-ИЛ-5-препарата, у 6 – анти-иммуноглобулин E-препарата. Эффективность лечения оценивалась по тесту оценки контроля симптомов ACQ-5, количеству обострений за предшествующие 12 мес. терапии ГИБП, уровню иммуноглобулина E, абсолютного количества эозинофилов, показателей функции внешнего дыхания, потребности пациентов в дополнительной терапии бронхиальной астмы. Перед инициацией у 8 (47,10%) пациентов были выявлены обострения с обращением за медицинской помощью, 2 пациента госпитализированы в пульмонологическое отделение, через 6 и 12 мес. обострений и госпитализаций в специализированные стационары не было зарегистрировано. При применении ГИБП в течение 12 мес. снижалась потребность в ингаляционных глюкокортикостероидах. ТБА оказывает существенное воздействие на качество жизни пациентов и является финансово затратной как для пациентов, так и для здравоохранения.
Ключевые слова: генно-инженерные биологические препараты, тяжелая бронхиальная астма, Т2-воспаление, Т2-астма, генно-инженерная биологическая терапия, интерлейкины, иммуноглобулин Е.
Для цитирования: Данилов А.В., Аргунова А.Н., Соловьева Ю.А. Опыт применения генно-инженерных биологических препаратов при тяжелой бронхиальной астме в Республике Саха (Якутия). Клинический разбор в общей медицине. 2024; 5 (1): 44–47. DOI: 10.47407/kr2023.5.1.00359
Original article
Ammosov North-Eastern Federal University, Yakutsk, Russia
agrafena888@mail.ru
Abstract
In the Republic of Sakha (Yakutia), from 2001 to 2020, the incidence of asthma is increasing from 4.1 per 1000 population to 12.5 per 1000 population. Considering that currently one of the most effective modern methods of treating severe asthma is genetic engineering biological therapy, research on biologically active medications, as well as the lack of research on this problem in the Yakut population, our work seems relevant. The purpose of this study was to evaluate the effectiveness of treatment with genetic engineering biological drugs (GEBD) in patients with severe asthma in the Yakut population. The study included 17 patients suffering from severe asthma. In 5 patients with severe asthma, the effectiveness of the following GEBD was assessed: anti IL-4, IL-13 drug, in 6 patients – anti IL-5 drug, in 6 patients – anti IgE drug. The effectiveness of treatment was assessed using the ACQ-5 symptom control test, the number of exacerbations over the previous 12 months of asthma therapy, IgE levels, the absolute number of eosinophils, indicators of external respiratory function, and the need of patients for additional asthma therapy. Before initiation, 8 (47.10%) patients had exacerbations and sought medical help; 2 patients were hospitalized in the pulmonology department; after 6 and 12 months, no exacerbations or hospitalizations in specialized hospitals were registered. When using a GEBD for 12 months, the need for inhaled corticosteroids decreased in micrograms/day. Thus, treatment of severe asthma in the Yakut population with GEBD makes it possible to achieve control over its symptoms, reduce the risk of severe exacerbations and the number of hospitalizations, and prevent side effects from high doses of standard therapy.
Key words: genetic engineering biological drugs, severe asthma, T2 inflammation, T2 asthma, genetic engineering biological therapy, interleukin, immunoglobulin E.
For citation: Danilov A.V., Argunova A.N., Soloveva Yu.A. Experience in the use of genetically engineered biological drugs for severe bronchial asthma in the Republic of Sakha (Yakutia). Clinical analysis in general medicine. 2024; 5 (1): 44–47 (In Russ.). DOI: 10.47407/kr2023.5.1.00359
В настоящее время одним из наиболее эффективных современных методов лечения ТБА является генно-инженерная биологическая терапия (ГИБТ). Принцип действия данных препаратов лежит в блокировании интерлейкинов (IL 5, IL 4, 13) и иммуноглобулина Е, которые участвуют в формировании каскада аллергических реакций, что приводит к заметному уменьшению клинических проявлений БА и улучшению качества жизни пациентов. ГИБТ показана для терапии тяжелой бронхиальной астмы с Т2 воспалением. Различают бронхиальную астму, обусловленную воспалением 2-го типа (Т2 астма) и не связанную с воспалением 2-го типа (не Т2 астма). Т2 астма это эозинофильный и/или аллергический фенотип. Воспаление при Т2 астме обусловлено активностью цитокинов 2-го типа (Т2 цитокинов) – это интерлейкины (IL) 4, 5, 13, играющие основную роль в развитии Т2 астмы [6-8].
Исследования, посвященные эффективности лечения бронхиальной астмы в якутской популяции, до настоящего времени не проводились. Данное заболевание представляет собой серьезную проблему общественного здоровья, особенно в условиях сурового климата и уникальных географических условий Якутии. В связи с этим, настоящее исследование представляется актуальным. Изучение этих аспектов может значительно расширить наши знания о бронхиальной астме и способствовать разработке более эффективных методов диагностики и лечения этого заболевания в якутской популяции.
Цель: оценить эффективность лечения генно-инженерными препаратами пациентов с тяжелой бронхиальной астмой в якутской популяции.
Все пациенты прошли стандартные клинико-лабораторные обследования, проведена дифференциальная диагностика трудноконтролируемой и тяжелой бронхиальной астмы, исключены из исследования пациенты с не Т2 типом воспаления, осуществлен контроль концентрации общего иммуноглобулина Е, эозинофилов в абсолютном количестве, показателей функции внешнего дыхания (ОФВ₁, ПСВ, ЖЕЛ, ИТ, МОС25, МОС50, МОС75), концентрации С-реактивного белка, мочевины, активности трансаминаз в сыворотке крови, проведены паразитологические исследования, исследована сопутствующая атопия и коморбидная патология.
Эффективность лечения оценивалась по тесту оценки контроля симптомов ACQ-5 [2] (общий индекс по опроснику ACQ-5 может варьировать от 0 - полностью контролируемая астма до 6 - абсолютно неконтролируемая астма), количеству обострений за предшествующие 12 месяцев терапии ГИБП, уровню общего IgE, абсолютного количества эозинофилов, показателей функции внешнего дыхания, потребность пациентов к дополнительной терапии БА. (таб. 1). Средний суммарный балл по шкале ACQ-5 составил 3,5 ± 1,25 балла, у всех пациентов из группы исследования была диагностировано неконтролируемое течение БА. Целевыми показателями эффективности терапии считались: достижение ремиссии, уменьшение частоты обострений и клинических проявлений, обращений за медицинской помощью в специализированные стационары. Ремиссию ставили при отсутствии обострений и клинических проявлений в течение 6 последовательных месяцев.
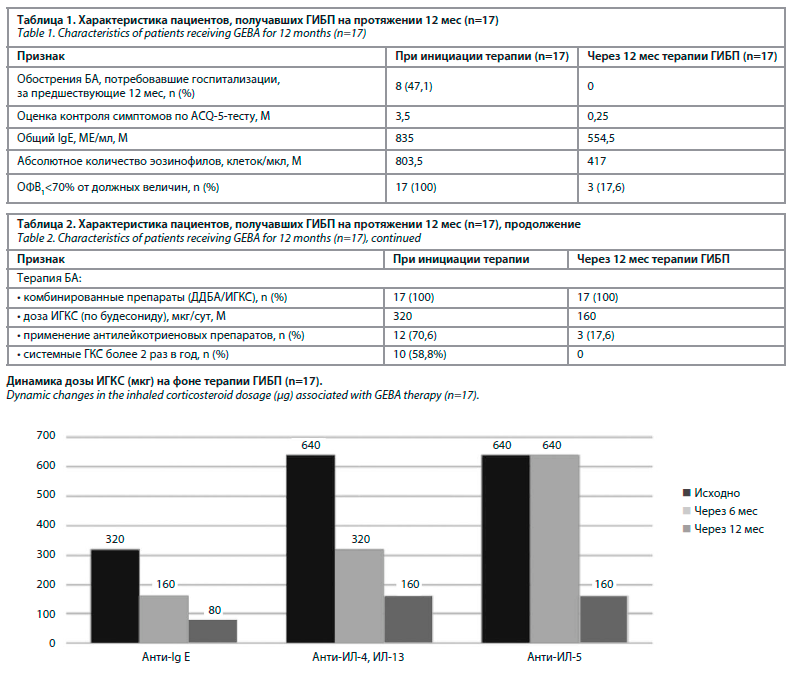
При применении ГИБП в течение 12 месяцев снижалась потребность к ИГКС будесонид в микрограммах/ сутки, так при анти-IgЕ препарате – перед началом терапии в среднем 320 мкг/сут., через 6 месяцев 160 мкг/сут., через 12 месяцев 80 мкг/сутки. На анти-интерлейкин 4,13 препарате – исходно в среднем 640 мкг/сутки, через 6 месяцев 320 мкг/сут., через 12 месяцев 160 мкг/сут. На анти-интерлейкин 5 препарате – исходно в среднем 640 мкг/сут., через 6 мес. без изменений, через 12 мес. 160 мкг/сут. (Рис. 1).
ГИБП приводят к уменьшению воспаления в нижних дыхательных путях, что приводит к значимому сокращению обострений ТБА, госпитализаций в специализированные стационары, улучшению функции внешнего дыхания, уменьшения дозы и отказа от системных глюкокортикостероидов, достижения контроля БА и улучшению качества жизни пациента.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Данилов Алексей Владимирович – ассистент кафедры «Госпитальная терапия, профессиональные болезни и клиническая фармакология», Медицинский институт, ФГАОУ ВО «Северо-Восточный федеральный университет имени М. К. Аммосова», врач-пульмонолог клиники «Северо-Восточного федерального университета имени М. К. Аммосова». E-mail: alvldan@mail.ru
Aleksey V. Danilov – Аssistant, Ammosov North-Eastern Federal University. E-mail: alvldan@mail.ru
Аргунова Аграфена Николаевна – канд. мед. наук, доц., зав. каф. госпитальной терапии, профессиональных болезней и клинической фармакологии, Медицинский институт, ФГАОУ ВО «Северо-Восточный федеральный университет имени М. К. Аммосова».
E-mail: agrafena888@mail.ru
Agrafena N. Argunova – Cand. Sci. (Med.), Assoc. Prof., Ammosov North-Eastern Federal University.
E-mail: agrafena888@mail.ru
Соловьева Юлия Алексеевна – старший преподаватель кафедры госпитальной терапии, профессиональных болезней и клинической фармакологии, Медицинский институт, ФГАОУ ВО «Северо-Восточный федеральный университет имени М. К. Аммосова».
E-mail: md.pop@mail.ru
Yulia A. Solovyeva – Senior Lecturer, Ammosov North-Eastern Federal University. E-mail: md.pop@mail.ru
Поступила в редакцию: 07.02.2024
Поступила после рецензирования: 09.02.2024
Принята к публикации: 15.02.2024
Received: 07.02.2024
Revised: 09.02.2024
Accepted: 15.02.2024
Experience in the use of genetically engineered biological drugs for severe bronchial asthma in the Republic of Sakha (Yakutia)
Aleksey V. Danilov, Agrafena N. Argunova, Yulia A. SolovyevaAmmosov North-Eastern Federal University, Yakutsk, Russia
agrafena888@mail.ru
Abstract
In the Republic of Sakha (Yakutia), from 2001 to 2020, the incidence of asthma is increasing from 4.1 per 1000 population to 12.5 per 1000 population. Considering that currently one of the most effective modern methods of treating severe asthma is genetic engineering biological therapy, research on biologically active medications, as well as the lack of research on this problem in the Yakut population, our work seems relevant. The purpose of this study was to evaluate the effectiveness of treatment with genetic engineering biological drugs (GEBD) in patients with severe asthma in the Yakut population. The study included 17 patients suffering from severe asthma. In 5 patients with severe asthma, the effectiveness of the following GEBD was assessed: anti IL-4, IL-13 drug, in 6 patients – anti IL-5 drug, in 6 patients – anti IgE drug. The effectiveness of treatment was assessed using the ACQ-5 symptom control test, the number of exacerbations over the previous 12 months of asthma therapy, IgE levels, the absolute number of eosinophils, indicators of external respiratory function, and the need of patients for additional asthma therapy. Before initiation, 8 (47.10%) patients had exacerbations and sought medical help; 2 patients were hospitalized in the pulmonology department; after 6 and 12 months, no exacerbations or hospitalizations in specialized hospitals were registered. When using a GEBD for 12 months, the need for inhaled corticosteroids decreased in micrograms/day. Thus, treatment of severe asthma in the Yakut population with GEBD makes it possible to achieve control over its symptoms, reduce the risk of severe exacerbations and the number of hospitalizations, and prevent side effects from high doses of standard therapy.
Key words: genetic engineering biological drugs, severe asthma, T2 inflammation, T2 asthma, genetic engineering biological therapy, interleukin, immunoglobulin E.
For citation: Danilov A.V., Argunova A.N., Soloveva Yu.A. Experience in the use of genetically engineered biological drugs for severe bronchial asthma in the Republic of Sakha (Yakutia). Clinical analysis in general medicine. 2024; 5 (1): 44–47 (In Russ.). DOI: 10.47407/kr2023.5.1.00359
Актуальность
Тяжелая бронхиальная астма (ТБА) – согласно стратификации тяжести, предложенной в глобальной стратегии GINA (The Global Initiative for Asthma) [1] – бронхиальная астма, которая поддается контролю только терапии 4-5 ступени по GINA, подразумевающей применение высоких доз ингаляционных глюкокортикостероидов (иГКС) в сочетании с длительно действующими бронходилататорами (ДДБА) или прием системных глюкокортикостероидов [2, 3]. В настоящее время ТБА представляет собой актуальную проблему в медицинской науке ввиду стойкой тенденции к увеличению количества пациентов, у которых не удается добиться контроля бронхиальной астмы на фоне терапии иГКС+ДДБА, а также пациентов, требующих неотложной медицинской помощи и госпитализации в связи с тяжелым течением заболевания. В РФ, по данным недавно проведенного эпидемиологического исследования, распространенность БА среди взрослых составляет 6,9%, а среди детей и подростков – около 10% [3]. В Республике Саха (Якутия) с 2001 по 2020 г. (за 20 лет) идет рост заболеваемости бронхиальной астмой (увеличение с 0,041 на 100 тыс. населения до 0,125 на 100 тыс. населения). Однако, смертность от БА имеет тенденцию по снижению (с 2008 г. по 2019 г. (за 12 лет) – с 2,4 на 100 тыс. населения до 0,3 на 100 тыс. населения) вследствие улучшения диагностики, контроля, бесплатного обеспечения больных базисными препаратами [4, 5]. Однако, несмотря на улучшение показателей смертности, лечение ТБА является экономически затратной как для пациента, так и для здравоохранения и существенно влияет на качество жизни пациентов.В настоящее время одним из наиболее эффективных современных методов лечения ТБА является генно-инженерная биологическая терапия (ГИБТ). Принцип действия данных препаратов лежит в блокировании интерлейкинов (IL 5, IL 4, 13) и иммуноглобулина Е, которые участвуют в формировании каскада аллергических реакций, что приводит к заметному уменьшению клинических проявлений БА и улучшению качества жизни пациентов. ГИБТ показана для терапии тяжелой бронхиальной астмы с Т2 воспалением. Различают бронхиальную астму, обусловленную воспалением 2-го типа (Т2 астма) и не связанную с воспалением 2-го типа (не Т2 астма). Т2 астма это эозинофильный и/или аллергический фенотип. Воспаление при Т2 астме обусловлено активностью цитокинов 2-го типа (Т2 цитокинов) – это интерлейкины (IL) 4, 5, 13, играющие основную роль в развитии Т2 астмы [6-8].
Исследования, посвященные эффективности лечения бронхиальной астмы в якутской популяции, до настоящего времени не проводились. Данное заболевание представляет собой серьезную проблему общественного здоровья, особенно в условиях сурового климата и уникальных географических условий Якутии. В связи с этим, настоящее исследование представляется актуальным. Изучение этих аспектов может значительно расширить наши знания о бронхиальной астме и способствовать разработке более эффективных методов диагностики и лечения этого заболевания в якутской популяции.
Цель: оценить эффективность лечения генно-инженерными препаратами пациентов с тяжелой бронхиальной астмой в якутской популяции.
Материалы и методы исследования
В исследование вошло 17 пациентов, страдающих ТБА. Средний возраст исследуемых составил 49,5 лет, женщин - 13 (76,5%), мужчин – 4 (23,5%). У 5 пациентов с ТБА оценивали эффективность следующих генно-инженерных биологических препаратов (ГИБП) Анти-IL4, IL 13 препарата, у 6 пациентов – Анти-IL 5 препарата, у 6 пациентов Анти-IgE препарата.Все пациенты прошли стандартные клинико-лабораторные обследования, проведена дифференциальная диагностика трудноконтролируемой и тяжелой бронхиальной астмы, исключены из исследования пациенты с не Т2 типом воспаления, осуществлен контроль концентрации общего иммуноглобулина Е, эозинофилов в абсолютном количестве, показателей функции внешнего дыхания (ОФВ₁, ПСВ, ЖЕЛ, ИТ, МОС25, МОС50, МОС75), концентрации С-реактивного белка, мочевины, активности трансаминаз в сыворотке крови, проведены паразитологические исследования, исследована сопутствующая атопия и коморбидная патология.
Эффективность лечения оценивалась по тесту оценки контроля симптомов ACQ-5 [2] (общий индекс по опроснику ACQ-5 может варьировать от 0 - полностью контролируемая астма до 6 - абсолютно неконтролируемая астма), количеству обострений за предшествующие 12 месяцев терапии ГИБП, уровню общего IgE, абсолютного количества эозинофилов, показателей функции внешнего дыхания, потребность пациентов к дополнительной терапии БА. (таб. 1). Средний суммарный балл по шкале ACQ-5 составил 3,5 ± 1,25 балла, у всех пациентов из группы исследования была диагностировано неконтролируемое течение БА. Целевыми показателями эффективности терапии считались: достижение ремиссии, уменьшение частоты обострений и клинических проявлений, обращений за медицинской помощью в специализированные стационары. Ремиссию ставили при отсутствии обострений и клинических проявлений в течение 6 последовательных месяцев.
Результаты исследования
У пациентов с ТБА диагностированы сопутствующие атопии как полипозный риносинусит у 5 (29,4%) пациентов, у 12 (70,6%) аллергический ринит, у 3 (17,6%) атопический дерматит, у 3 (17,6%) поллиноз, а также коморбидные состояния – ожирение у 2 (11,8%) пациентов. Данные сопутствующие атопии приводили к ухудшению течения БА, негативно влияли на прогноз заболевания и качество жизни пациента. С начала терапии, через 3 месяца, по результатам теста ACQ-5 отмечается улучшение показателей в среднем до 2,4 ± 1,25 балла, через 6 месяцев – 1,2 ± 0,75 балла, через 12 месяцев - 0,25 ± 0,75 балла (таб. 1), данный анализ показывает достижение контроля бронхиальной астмы. До начала терапии показатели общего IgE были в среднем 835 МЕ/мл, через 6 месяцев 743 МЕ/мл, через 12 месяцев отмечается снижение показателей в среднем до 554,5 МЕ/мл, абсолютное количество эозинофилов в периферической крови перед началом терапии в среднем было 803,5 кл/мкл, через 6 месяцев 566 кл/мкл, через 12 месяцев снижение показателей в среднем до 417 кл/мкл. Функция внешнего дыхания, в частности показатели ОФВ₁ перед началом терапии ниже 70% было зарегистрировано у 17 (100%) пациентов, через 6 месяцев у 7 (41%) пациентов, через 12 месяцев у 3 (17,6%) пациентов. По данным нашего исследования ГИБТ значительно улучшила лабораторные и инструментальные показатели пациентов. Перед инициацией у 8 (47,10%) пациентов были выявлены обострения БА с обращением за медицинской помощью, 2 пациента госпитализированы в пульмонологическое отделение с тяжелым обострением БА, через 6 и 12 месяцев обострений и госпитализаций в специализированные стационары не было зарегистрировано. На момент начала терапии ГИБП системные глюкокортикостероиды (ГКС) получали 10 (58,8%) пациентов (таб. 2), через 12 месяцев под строгим контролем постепенно снижали дозировки до полной отмены 10 пациентов. Таким образом высокая эффективность ГИБТ дала возможность отменить системные ГКС. За весь период наблюдения на фоне лечения ГИБП ни одному пациенту системные ГКС не были назначены de novo.
При применении ГИБП в течение 12 месяцев снижалась потребность к ИГКС будесонид в микрограммах/ сутки, так при анти-IgЕ препарате – перед началом терапии в среднем 320 мкг/сут., через 6 месяцев 160 мкг/сут., через 12 месяцев 80 мкг/сутки. На анти-интерлейкин 4,13 препарате – исходно в среднем 640 мкг/сутки, через 6 месяцев 320 мкг/сут., через 12 месяцев 160 мкг/сут. На анти-интерлейкин 5 препарате – исходно в среднем 640 мкг/сут., через 6 мес. без изменений, через 12 мес. 160 мкг/сут. (Рис. 1).
ГИБП приводят к уменьшению воспаления в нижних дыхательных путях, что приводит к значимому сокращению обострений ТБА, госпитализаций в специализированные стационары, улучшению функции внешнего дыхания, уменьшения дозы и отказа от системных глюкокортикостероидов, достижения контроля БА и улучшению качества жизни пациента.
Заключение
ТБА оказывает существенное воздействие на качество жизни пациентов и является финансово затратной как для пациентов, так и для здравоохранения. Применение биологических препаратов в терапии тяжелой бронхиальной астмы в якутской популяции позволяет контролировать ее симптомы, снизить риск тяжелых обострений и госпитализаций, а также предотвратить побочные эффекты от высоких доз стандартной терапии. У пациентов с тяжелой неконтролируемой бронхиальной астмой применение генно-инженерных биологических препаратов (ГИБП), которые модифицируют течение болезни, позволяет уменьшить объем противовоспалительной терапии и системных глюкокортикостероидов. По нашим данным, наблюдения за применением ГИБП показывают, что достигнутый контроль симптомов бронхиальной астмы сохраняется, уменьшается потребность в использовании короткодействующих бронходилататоров (КДБА) и доз базисных препаратов.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Данилов Алексей Владимирович – ассистент кафедры «Госпитальная терапия, профессиональные болезни и клиническая фармакология», Медицинский институт, ФГАОУ ВО «Северо-Восточный федеральный университет имени М. К. Аммосова», врач-пульмонолог клиники «Северо-Восточного федерального университета имени М. К. Аммосова». E-mail: alvldan@mail.ru
Aleksey V. Danilov – Аssistant, Ammosov North-Eastern Federal University. E-mail: alvldan@mail.ru
Аргунова Аграфена Николаевна – канд. мед. наук, доц., зав. каф. госпитальной терапии, профессиональных болезней и клинической фармакологии, Медицинский институт, ФГАОУ ВО «Северо-Восточный федеральный университет имени М. К. Аммосова».
E-mail: agrafena888@mail.ru
Agrafena N. Argunova – Cand. Sci. (Med.), Assoc. Prof., Ammosov North-Eastern Federal University.
E-mail: agrafena888@mail.ru
Соловьева Юлия Алексеевна – старший преподаватель кафедры госпитальной терапии, профессиональных болезней и клинической фармакологии, Медицинский институт, ФГАОУ ВО «Северо-Восточный федеральный университет имени М. К. Аммосова».
E-mail: md.pop@mail.ru
Yulia A. Solovyeva – Senior Lecturer, Ammosov North-Eastern Federal University. E-mail: md.pop@mail.ru
Поступила в редакцию: 07.02.2024
Поступила после рецензирования: 09.02.2024
Принята к публикации: 15.02.2024
Received: 07.02.2024
Revised: 09.02.2024
Accepted: 15.02.2024
Список исп. литературыСкрыть список1. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention. Updated 2021. Available at: http:ginasthma.org (accessed 06.06.2021).
2. Зайцева С.В., Томилова А.Ю., Зайцева О.В. и др. Опыт применения генно-инженерных биологических препаратов в терапии бронхиальной астмы у детей. Педиатрическая фармакология. 2021;18(6):460-8. DOI: 10.15690/pf.v18i6.2325
Zaitseva S.V., Tomilova A.Yu., Zaitseva O.V. et al. Experience in the use of genetically engineered biological drugs in the treatment of bronchial asthma in children. Pediatric pharmacology. 2021;18(6):460-8. DOI: 10.15690/pf.v18i6.2325 (in Russian).
3. Российское респираторное общество. Клинические рекомендации. Бронхиальная астма. М., 2021. Режим доступа: http://www. spulmo.ru/
Russian Respiratory Society. Clinical recommendations. Bronchial asthma. Moscow, 2021. Available at: http://www.spulmo.ru/ (in Russian).
4. Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Республике Саха (Якутия) в 2022 году». Режим доступа: https://14.rospotrebnadzor.ru/content/ 1344/163281/
State report “On the state of sanitary and epidemiological well-being of the population in the Republic of Sakha (Yakutia) in 2022.” Available at: https://14.rospotrebnadzor.ru/content/1344/163281/ (in Russian).
5. Иванова О.Н., Петрова П.Г. Эпидемиология бронхиальной астмы у детей в Республике Саха (Якутия). Вестник СВФУ. 2013;(1):96-9.
Ivanova O.N., Petrova P.G. Epidemiology of bronchial asthma in children in the Republic of Sakha (Yakutia). NEFU Bulletin. 2013;(1):96-9 (in Russian).
6. Авдеев А.С., Волкова В.О., Демко Д.И. и др. Организация помощи пациентам с тяжелой бронхиальной астмой в различных субъектах российской федерации. от эндотипов и фенотипов бронхиальной астмы к персонализированному выбору терапии. Терапевтический архив. 2020;92(2):119-23.
Avdeev A.S., Volkova V.O., Demko D.I. et al. Organization of care for patients with severe bronchial asthma in various regions of the Russian Federation. from endotypes and phenotypes of bronchial asthma to personalized choice of therapy. Therapeutic archive. 2020;92(2):119-23 (in Russian).
7. Платонова Н.С. Аллергопатология у народностей Крайнего Севера. Особенности аллергенного профиля, структуры аллергопатологии и клинических проявлений. Автореф. дис. … д-ра мед. наук. Якутск, 2001.
Platonova N.S. Allergopathology among the peoples of the Far North. Features of the allergen profile, the structure of allergopathology and clinical manifestations. Author's abstract. dis. ... dr. sci. (med.). Yakutsk, 2001 (in Russian).
8. Sumi T et al. Successful management of severe bronchial asthma exacerbated by anti-PD-L1 treatment: A report of two cases. Respirology Case Reports. 2021;9(11).


