Клинический разбор в общей медицине №4 2024
Maria V. Golimbekova1, Ksenia D. Melnikova1, Tatiana M. Kolontai1, Medina Kh. Pilyarova1,
Alexander Yu. Molochnikov1, Gayane Yu. Melik-Ogandjanyan1, Karine A. Lytkina1,
Georgiy G. Melkonyan1,3, Svetlana A. Rachina1
1 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
2 War Veterans Hospital No. 3, Moscow, Russia;
3 Russian Medical Academy of Continuous Professional Education, Moscow, Russia
sshekshina@yandex.ru
Abstract
Aim. To investigate the prevalence and some aspects of the carbohydrate metabolism pathology in patients with combat limb injuries.
Materials and methods. 210 patients who suffered from combat injuries of the lower and/or upper extremities from 4 to 58 days (mean 15.9±8.7 days) before admission to the hospital were enrolled in the study. All study participants were men. The mean age of the patients was 36.0±8.4 years (19–59 years). Fasting venous blood glucose concentrations were determined in all patients. Patients with hyperglycemia underwent a study of the glycemic profile and HbA1c. Stress-induced hyperglycemia, estimated mean glucose level over the past 3 months (ADAG), and glycemic gap were calculated. Insulin in fasting blood plasma was determined and the HOMA-IR insulin resistance index was calculated.
Results. The incidence of hyperglycemia was 23.3%. In the general group of patients, the mean glucose concentration was 5.5±1.0 mmol/l (3.1–9.73 mmol/l). In the group of patients with hyperglycemia, the mean blood glucose level reached 6.7±0.9 mmol/l, in patients with normal glucose concentration – 5.1±0.5 mmol/l (p<0.000001). The mean fasting blood glucose concentration in patients aged 40 years and older reached 5.7±1.1 mmol/l, those under 40 years old – 5.2±0.8 mmol/l (p=0.005). A significant direct correlation was registered between the fasting glucose level upon admission to the hospital and the age of the patients (r=0.26; p=0.00003). The relative risk of hyperglycemia in patients aged 40 years and older was 1.84 (confidence interval 1.005–3.37; p=0.01). The mean time elapsed since injury in patients with hyperglycemia reached 13.2±5.7 days, with normal glucose concentration – 16.7±9.2 days (p=0.02). Patients with hyperglycemia had lower levels of total protein (58.3±10.2 and 62.1±6.9 g/l, respectively; p=0.004), albumin (31.2±4.6 and 33.2±4.9 g/l; p=0.04), hemoglobin (97.7±18.9 and 105.9±16.9 g/l; p=0.004), but higher levels of C-reactive protein (61.0±55.4 and 32.9±38.1 mg/l; p=0.0001), leukocytes (10.6±4.4 and 9.3±3.4×109/l; p=0.02), count of neutrophils (7.8±4.3 and 6.4±2.9×109/l; p=0.01), proportion of neutrophils (71.6±9.6% and 67.7±7.7%; p=0.004), as well as fibrinogen concentration (5.7±1.4 and 4.8±1.2 g/l; p=0.0002) than patients with normal blood glucose levels. In patients with hyperglycemia, the mean HbA1c level was 5.3±0.6%, stress-induced hyperglycemia – 1.4±0.2 mmol/l. The median glycemic gap reached 1.51 mmol/l (Q1–Q3: 0.88–2.1 mmol/l). The median insulin concentration was 12.9 µIU/ml (Q1–Q3: 9.2–27.0 µIU/ml), the insulin resistance index was 3.3 (Q1–Q3: 2.1–8.8). The mean fasting blood glucose concentration at the last determination in patients with initial hyperglycemia reached 5.8±1.3 mmol/l. During observation, in 64.6% of the patients with hyperglycemia upon admission, glucose levels returned to normal, while in 35.4% mild hyperglycemia remained. The median time to normalization of fasting blood glucose concentration or to the last determination of this indicator was 17.5 days (Q1–Q3: 8–30 days).
Conclusions. The study results indicate a frequent detection of hyperglycemia in patients with combat limb injuries. In most cases the increase in fasting glucose levels is small and in most patients this indicator returns to normal within a relatively short time. It is necessary to continue research of stress-induced hyperglycemia in the patients with combat injuries and to elucidate the pathogenetic basis of this pathology.
Keywords: glucose, hyperglycemia, stress-induced hyperglycemia, glycated hemoglobin, combat injuries.
For citation: Topolyanskaya S.V., Kurzhos M.N., Bubman L.I., Vasilyeva Yu.Yu., Golimbekova M.V., Melnikova K.D., Kolontai T.M., Pilyarova M.H., Molochnikov A.Yu., Melik-Oganjanyan G.Yu., Lytkina K.A., Melkonyan G.G., Rachina S.A. Hyperglycemia in patients with combat injuries. Clinical review for general practice. 2024; 5 (4): 24–32 (In Russ.). DOI: 10.47407/kr2024.5.4.00416
Развитие стрессиндуцированной гипергликемии обусловлено сложным взаимодействием различных гормонов и цитокинов [4, 5]. Основной механизм взаимосвязи между стрессом и патологией углеводного обмена заключается в активации симпатической нервной системы и оси гипоталамус–гипофиз–надпочечники [6]. Стимуляция двух этих звеньев приводит к повышению уровня контринсулярных гормонов – катехоламинов, кортизола, глюкагона и гормона роста, которые усиливают гликогенолиз и гиперметаболизм и приводят к избыточной продукции глюкозы, снижению секреции инсулина и ИР [1, 5, 7]. По мнению ряда авторов, усиление печеночного глюконеогенеза, регулируемого катехоламинами, глюкагоном и цитокинами, по-видимому, является наиболее важным фактором, способствующим стрессиндуцированной гипергликемии [4, 5]. Преходящая ИР – еще один механизм, посредством которого «гормоны стресса» могут влиять на метаболизм глюкозы [7]. ИР возникает в результате дефектов пострецепторной передачи сигналов инсулина и подавления транспортера глюкозы, приводя к снижению опосредованного инсулином поглощения глюкозы [4]. Катехоламины и кортизол могут ингибировать связывание инсулина и его активацию, приводя к ИР с гиперинсулинемией; глюкокортикоиды также ограничивают поглощение глюкозы периферическими тканями, а гормон роста предотвращает активацию инсулина [4, 5, 7].
Синдром системного воспалительного ответа также может приводить к гипергликемии [7]. Повышение уровня провоспалительных цитокинов, таких как фактор некроза опухоли α (ФНО-α) и интерлейкин (ИЛ)-6, способствует ИР и подавлению высвобождения инсулина, еще больше нарушая метаболизм глюкозы [4, 5, 7].
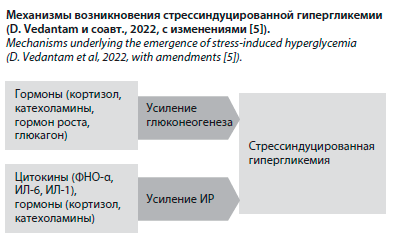 Воспаление способствует повышению уровня кортикотропин-рилизинг-гормона и стимулирует высвобождение адренокортикотропного гормона, что, в свою очередь, приводит к гипергликемии [7]. Таким образом, в результате взаимодействия между различными гормонами и цитокинами возникают ИР и чрезмерный глюконеогенез в печени (см. рисунок) [4, 5].
Воспаление способствует повышению уровня кортикотропин-рилизинг-гормона и стимулирует высвобождение адренокортикотропного гормона, что, в свою очередь, приводит к гипергликемии [7]. Таким образом, в результате взаимодействия между различными гормонами и цитокинами возникают ИР и чрезмерный глюконеогенез в печени (см. рисунок) [4, 5].
Хирургические операции, анестезия, некоторые терапевтические вмешательства (инфузии катехоламинов, кортикостероидов, энтеральное и парентеральное питание) и психологические факторы также могут приводить к гипергликемии у пациентов с тяжелой травмой или заболеванием [4, 5, 7]. Гипергликемия во время острых состояний может быть обусловлена и не диагностированным ранее сахарным диабетом (СД) [1].
Гипергликемия усугубляет цитокиновую, воспалительную и окислительную реакцию на стресс, потенциально создавая порочный круг, в результате которого гипергликемия приводит к дальнейшему повышению уровня глюкозы в крови и различным неблагоприятным последствиям [4, 8]. Гиперинсулинемия также может приводить к усилению воспалительных и гормональных нарушений и патологическому фибринолизу [4]. Глюкотоксичность, липотоксичность и воспаление – ключевые компоненты синдрома так называемой чрезмерной ИР, связанной с острым заболеванием (exaggerated global insulin-resistance syndrome associated with acute illness) [4].
Распространенность стрессиндуцированной гипергликемии составляет 4–4,9% у пациентов со всеми травмами, 7,8% – с черепно-мозговыми травмами средней и тяжелой степени, 24% – с ишемическими инсультами и 47,9% – у пожилых больных с переломом бедра [2, 8, 9]. По данным других авторов, до 50% пациентов отделений интенсивной терапии в первые 48 ч после поступления имеют повышение уровня глюкозы в крови [10]. Наряду с этим гипергликемию считают одним из наиболее распространенных осложнений у пациентов с черепно-мозговыми травмами, которое коррелирует с тяжестью травмы и ее неблагоприятными исходами [7]. Установлена также связь между гипергликемией и плохим прогнозом при ишемическом инсульте, субарахноидальном и внутримозговом кровоизлиянии [7, 8]. Стрессиндуцированная гипергликемия ассоциируется с увеличением смертности, особенно у пациентов без СД в анамнезе [2, 5], приводит к увеличению риска инфекционных осложнений, дисфункции иммунной системы, замедлению репарации тканей и полиорганной недостаточности [8]. Уровень глюкозы в крови при поступлении в стационар может представлять собой клинически значимый предиктор летального исхода и инфекционных осложнений у пациентов с травмой, а достижение нормогликемии в раннем посттравматическом периоде может снизить риск неблагоприятного исхода [1].
Большинство исследований стрессиндуцированной гипергликемии проведено у гражданских пациентов с СД, травмами головного мозга, инсультами, но не у участников военных конфликтов [6]. В одном из израильских исследований у 82 пациентов с СД во время войны в Персидском заливе были зарегистрированы более высокие уровни гликированного гемоглобина (HbA1c) по сравнению с этим показателем, измеренным до или после военных действий [11]. Еще в одной работе, проведенной среди госпитализированных пациентов с СД, отмечено повышение показателей глюкозы крови во время военной операции по сравнению с анализами, проведенными за неделю до ее начала [12].
В небольшом исследовании боснийских беженцев с посттравматическим стрессовым расстройством после воздействия стрессового фактора обнаружены значительно более высокие уровни глюкозы и инсулина [13].
В настоящее время в доступной литературе нам не удалось найти данные по патологии углеводного обмена у пациентов с боевыми травмами, полученными в ходе участия в специальной военной операции. Настоящее исследование было разработано с целью изучения возможных нарушений углеводного обмена и стрессиндуцированной гипергликемии у пациентов с боевыми ранениями.
Цель исследования – изучить частоту встречаемости и некоторые аспекты патологии углеводного обмена у пациентов с боевыми ранениями конечностей.
Определяли относительную (стрессиндуцированную) гипергликемию по формуле: концентрация глюкозы в крови при поступлении, разделенная на предполагаемый средний уровень глюкозы (HbA1c) [14]. Рассчитывали предполагаемый средний уровень глюкозы за последние 3 мес по формуле ADAG (A1c-Derived Average Glucose study): 28,7×HbA1c-46,7 [15]. Определяли гликемический разрыв по формуле: концентрация глюкозы при поступлении минус предполагаемый средний уровень глюкозы за последние 3 мес по формуле ADAG [2]. Инсулин в плазме крови натощак (норма 2,2–25,0 мкМЕ/мл) определяли методом иммунохемилюминесценции. Рассчитывали индекс ИР – HOMA-IR (норма 0–2,7).
Наряду с этим всем пациентам проводили стандартные общий и биохимический анализы крови, а также скрининговую коагулограмму.
Полученные данные анализировали с использованием программного обеспечения Statistica (версия 13). Количественные переменные исследованы на нормальность распределения с помощью критерия Шапиро–Уилкса. При нормальном распределении описание количественных переменных представляли в виде минимального, максимального, среднего значения и стандартного отклонения (СО), качественных – в виде n (%), при ненормальном распределении – в виде медианы и квартилей. Проводили корреляционный анализ с помощью критерия Спирмена.
Частота гипергликемии в изученной группе пациентов составила 23,3%. В большинстве своем отмечалось небольшое повышение концентрации глюкозы в крови. Так, у 9 (18,4%) пациентов глюкоза находилась в диапазоне 5,91–5,99 ммоль/л, 20 (40,8%) – 6,05–6,59 ммоль/л, 12 (24,5%) – 7,1-7,93 ммоль/л, 4 (8,2%) – 8,2–8,95 ммоль/л, 3 (6,1%) – 9,1–9,73 ммоль/л. У 37 (17,6%) раненых уровень глюкозы в венозной крови натощак превышал 6,1 ммоль/л. В общей группе пациентов средняя концентрация глюкозы составила 5,5±1,0 ммоль/л, варьируя от 3,1 до 9,73 ммоль/л. В группе раненых с гипергликемией средний уровень глюкозы в крови достигал 6,7±0,9 ммоль/л, у пациентов с нормальной концентрацией глюкозы – 5,1±0,5 ммоль/л (р<0,000001).
Средний возраст раненых с гипергликемией составлял 39,2±7,7 года, с нормальной концентрацией глюкозы в крови – 35,0±8,4 года (р=0,002). В группе пациентов с гипергликемией 51,1% раненых были в возрасте 40 лет и старше, тогда как с нормальной концентрацией глюкозы – 30,9% (р=0,01). Зарегистрирована достоверная прямая корреляция между уровнем глюкозы натощак при поступлении в стационар и возрастом пациентов (r=0,26; р=0,00003). Средняя концентрация глюкозы крови натощак у раненых в возрасте 40 лет и старше достигала 5,7±1,1 ммоль/л, моложе 40 лет – 5,2±0,8 ммоль/л (р=0,005). Относительный риск гипергликемии у пациентов в возрасте 40 лет и старше составил 1,84, доверительный интервал – 1,005–3,37 (р=0,01).
Среднее время, прошедшее с момента ранения, у пациентов с гипергликемией достигало 13,2±5,7 дня, с нормальной концентрацией глюкозы – 16,7±9,2 дня (р=0,02). Значимых корреляций между временем, прошедшим с момента ранения, и глюкозой крови натощак при поступлении обнаружено не было (r=-0,1; р=0,14).
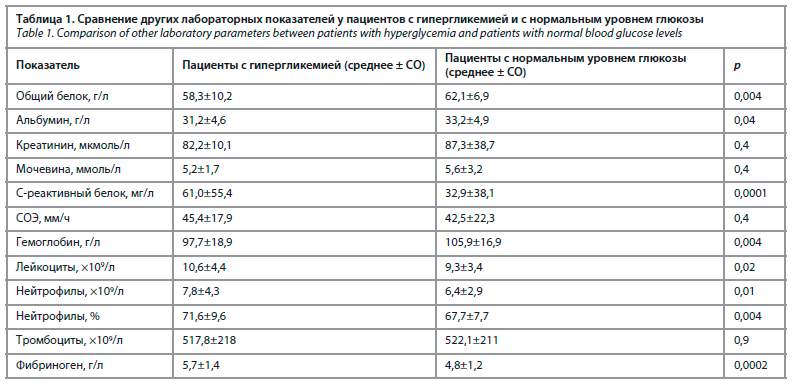
Сравнение показателей общего и биохимического анализов крови в группе пациентов с гипергликемией и нормальным уровнем глюкозы крови натощак представлено в табл. 1.
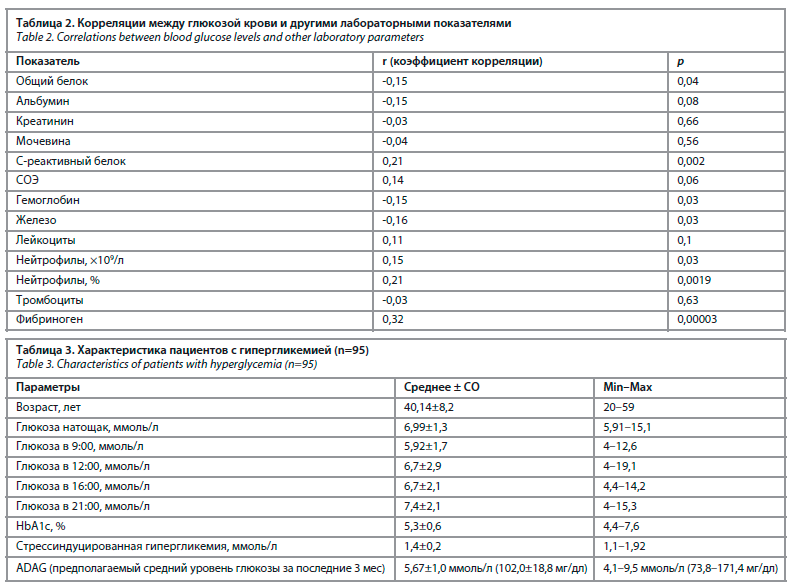
Корреляционные взаимосвязи между концентрацией глюкозы в крови натощак при поступлении в стационар и другими лабораторными показателями представлены в табл. 2.
Наблюдалась также корреляция между концентрацией глюкозы в венозной крови натощак и числом вторичных хирургических обработок ран (r=0,15; р=0,03).
При проведении регрессионного анализа значимыми факторами, связанными с гипергликемией, были возраст пациентов (β=0,27; р=0,02) и процентное число нейтрофилов (β=0,35; р=0,01). Итоговой наиболее значимой переменной, ассоциированной с гипергликемией, оказался возраст пациентов (β=0,3; р=0,04).
В повторных анализах крови средняя концентрация глюкозы натощак у пациентов с гипергликемией составила 5,5±0,9 ммоль /л (4,1–9,0 ммоль/л), тогда как исходная – 6,5±0,9 ммоль/л (р=0,000001). Среднее время до нормализации уровня глюкозы или до последнего ее определения составило 20,3±16,7 дня (3–83 дня), медиана – 17 дней (Q1–Q3: 7,5–25 дней).
Характеристика пациентов с гипергликемией представлена в табл. 3.
Медиана показателя гликемического разрыва составила 1,51 ммоль/л (27,2 мг/дл) [Q1–Q3: 0,88-2,1 ммоль/л (15,9–37,7 мг/дл)].
При проведении корреляционного анализа в изученной группе пациентов с гипергликемией показатели HbA1c коррелировали только с концентрацией глюкозы в крови натощак (r=0,49; р=0,004), ADAG – лишь с глюкозой крови натощак (r=0,49; р=0,004) и стрессиндуцированной гипергликемией (r=-0,43; р=0,01), показатели гликемического разрыва – с глюкозой крови натощак (r=0,67; р=0,00003), стрессиндуцированной гипергликемией (r=0,98; р<0,0000001) и ADAG (r=-0,40; р=0,03). Параметры стрессиндуцированной гликемии коррелировали с глюкозой крови натощак (r=0,6; р=0,0009), уровнем гемоглобина (r=-0,4; р=0,03), С-реактивного белка (r=0,4; р=0,05), концентрацией железа (r=-0,42; р=0,04), процентным числом нейтрофилов (r=0,37; р=0,04). Наблюдалась также тенденция к обратной взаимосвязи между стрессиндуцированной гликемией и уровнем общего белка (r=-0,3; р=0,1) и альбумина (r=-0,4; р=0,1).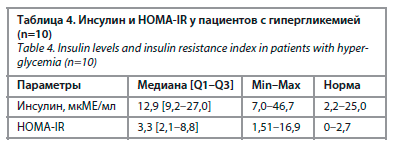 Концентрация инсулина в плазме крови натощак и HOMA-IR у пациентов с гипергликемией представлены в табл. 4. Уровень инсулина был повышен у 3 из 10 обследованных пациентов, HOMA-IR – у 6 из 10 раненых. При проведении корреляционного анализа достоверных взаимосвязей между HOMA-IR и другими изученными клиническими и лабораторными параметрами обнаружено не было. Содержание инсулина в плазме крови коррелировало только с HOMA-IR (r=0,98; p=0,00001).
Концентрация инсулина в плазме крови натощак и HOMA-IR у пациентов с гипергликемией представлены в табл. 4. Уровень инсулина был повышен у 3 из 10 обследованных пациентов, HOMA-IR – у 6 из 10 раненых. При проведении корреляционного анализа достоверных взаимосвязей между HOMA-IR и другими изученными клиническими и лабораторными параметрами обнаружено не было. Содержание инсулина в плазме крови коррелировало только с HOMA-IR (r=0,98; p=0,00001).
Повторное определение глюкозы крови натощак было проведено у 65 (68,4%) из 95 пациентов с гипергликемией, у 30 раненых данный показатель больше не определялся. Концентрация глюкозы крови натощак при последнем определении достигала в среднем 5,8±1,3 ммоль/л, варьируя от 4,1 до 12 ммоль/л. В ходе наблюдения у 64,6% из 65 раненых уровень глюкозы нормализовался, у 35,4% сохранялась небольшая гипергликемия. Средняя концентрация глюкозы у этих пациентов достигала 7,1 ммоль/л (5,97–12 ммоль/л).
У 16 из этих раненых уровень глюкозы крови натощак не превышал 7 ммоль/л, у трех он находился в пределах 7,21–7,92 ммоль/л, у одного – 8,32 ммоль/л, у двух – 9,04-9,1 ммоль/л и лишь еще у одного – 12 ммоль/л. Медиана времени до нормализации концентрации глюкозы крови натощак или до проведения последнего определения данного показателя составила 17,5 дня (Q1–Q3: 8–30 дней). В ходе наблюдения лишь 3 пациентам (в возрасте 56, 46 и 37 лет) был поставлен диагноз впервые выявленного СД.
Очень ограниченное число исследований были посвящены влиянию боевой травмы на повышение уровня глюкозы. Так, израильские исследователи обнаружили более высокие показатели глюкозы в дни военных операций по сравнению с другим временем, особенно среди тех, кто проживал в местах, где интенсивность военной угрозы выше. Аналогично нашим данным, в этом исследовании повышение уровня глюкозы крови было минимальным (в целом по группе всего лишь на 2,1% выше). По мнению авторов этой работы, не только гипергликемия, но и относительное повышение уровня глюкозы натощак может быть связано с повышенным риском сердечно-сосудистых осложнений [6].
Хорошо известно, что при острых стрессовых реакциях происходит нарушение гомеостаза глюкозы, а война – это выраженный стресс, хотя ее точное влияние на углеводный обмен неизвестно. Еще в одном израильском исследовании уровни глюкозы у госпитализированных взрослых пациентов были значительно выше во время военной кампании по сравнению с неделей, предшествовавшей войне (9,7 и 9,3 ммоль/л соответственно) [12]. В другом небольшом исследовании с участием боснийских беженцев после воздействия стрессового фактора наблюдалось достоверное повышение уровня глюкозы и инсулина в крови; авторы этой работы пришли к выводу о независимом влиянии острого психологического стресса на метаболизм глюкозы [13].
В наших наблюдениях средний возраст раненых с гипергликемией достигал практически 40 лет и был достоверно выше, чем у пациентов с нормальной концентрацией глюкозы в крови, а в группе пациентов с гипергликемией более половины были в возрасте 40 лет и старше. В индийском наблюдательном исследовании гипергликемии среди пациентов отделений реанимации и интенсивной терапии (ОРИТ) средний возраст участников составил 40,3 года и среди них преобладали мужчины [16]. В этом исследовании частота гипергликемии среди пациентов, не страдавших ранее СД, составила 20,3% [16], тогда как в нашей работе – 23,3%.
У 87,5% наших раненых с гипергликемией уровень HbA1c был менее 5,7%, у 6,2% – 5,7%, 3,1% – 6,5% и 7,6%, а в индийском исследовании у 77,3% участников HbA1c был менее 5,7%, а у 20,7% этот показатель находился в диапазоне от 5,7 до 6,4% [16].
Вместе с тем в исследовании Y. Chen и соавт. частота стрессиндуцированной гипергликемии у пациентов с переломом бедра составила 47,9% [9]. Однако, в отличие от наших наблюдений, средний возраст участников этого исследования был 75,2 года (тогда как у нас – 36 лет), 64,5% были женщинами, 57,7% страдали артериальной гипертензией, 49,9% – ишемической болезнью сердца (или она была диагностирована у близких родственников), 37,7% были с ожирением [9].
По нашим данным в большинстве случаев отмечалось небольшое повышение концентрации глюкозы в крови и лишь у 14,3% пациентов с гипергликемией уровень глюкозы натощак превышал 8 ммоль/л. Уровень и частота гипергликемии в нашей работе были ниже, чем в анализе A. Corstjens и соавт., которые обнаружили, что 38% пациентов стационара общего профиля имели гипергликемию натощак более 7 мммоль/л или выше 11,1 ммоль/л при двух случайных определениях, а у пациентов ОРИТ в 23,3% случаев была зарегистрирована гипергликемия выше 11,1 ммоль/л [17]. Эти различия могут объясняться тем, что наши пациенты – это крепкие молодые мужчины, не имевшие до ранения соматической патологии, поэтому у них и меньший уровень глюкозы, и меньшая частота гипергликемии.
В 12-летнем исследовании долгосрочных исходов у пациентов с травмами и с гипергликемией участники с травматическими повреждениями были моложе, чаще были мужчинами и имели более низкие уровни глюкозы при поступлении, чем больные, не имевшие травм (123 и 133 мг/дл соответственно) [18]. В нашей работе средняя концентрация глюкозы в крови натощак была аналогичной и составляла 125,9 мг/дл. В вышеуказанном исследовании у пациентов с травмами гипергликемический индекс лучше коррелировал со смертностью, чем у больных без травм [18].
Время, прошедшее с момента ранения, у наших пациентов с гипергликемией составляло в среднем 13,2 дня, с нормальной концентрацией глюкозы – 16,7 дня, и эти различия были статистически достоверными. Эти данные подтверждают тот факт, что максимальный уровень глюкозы отмечается в момент стресса. Так, у здоровых прыгунов с тарзанки концентрация глюкозы и «гормонов стресса» повышалась непосредственно перед прыжком и после него, функция β-клеток поджелудочной железы снижалась непосредственно перед прыжком, а резистентность к инсулину повышалась сразу после прыжка [19]. По данным M. Plummer и соавт. максимальная частота гипергликемии у пациентов в ОРИТ регистрируется в первые 48 ч после поступления, когда до 50% этих больных имеют гипергликемию [10]. По мнению A. Laird и соавт., гипергликемия вследствие метаболического стресса проявляется в ранние сроки госпитализации больных в ОРИТ и разрешается, как только катаболические реакции затихают [20].
У наших раненых с гипергликемией отмечались более высокие показатели С-реактивного белка, лейкоцитов, нейтрофилов и фибриногена. Как было уже отмечено ранее в данной статье, синдром системного воспалительного ответа может играть важную роль в развитии стрессиндуцированной гипергликемии, а повышение уровня провоспалительных цитокинов способствует ИР и подавлению высвобождения инсулина [4, 5, 7].
По нашим наблюдениям у пациентов с гипергликемией были более высокие уровни лейкоцитов и нейтрофилов, но не тромбоцитов. В исследовании C.-S. Rau и соавт. у пациентов со стрессиндуцированной гипергликемией наблюдалось значительно большее число нейтрофилов, моноцитов и лимфоцитов по сравнению с пациентами с нормогликемией. В этом исследовании, аналогично нашим данным, также не было отмечено значительного увеличения числа тромбоцитов. Хорошо известно, что после травмы в результате системной воспалительной реакции происходит изменение числа лейкоцитов и их субпопуляций, а сразу после травмы наблюдается повышение числа и активности нейтрофилов [21]. В нашей группе пациентов с гипергликемией наблюдалась обратная корреляция между временем с момента ранения и числом лейкоцитов (r=-0,21; p=0,04), а также нейтрофилов (r=-0,21; p=0,04), однако с числом тромбоцитов никакой взаимосвязи обнаружено не было (r=0,02; p=0,85). Одновременно с увеличением числа нейтрофилов и других популяций лейкоцитов наблюдается повышение концентраций провоспалительных цитокинов [21], которые, как отмечалось ранее, способствуют гипергликемии.
В нашей работе мы использовали уравнение ADAG, которое, по мнению ряда ученых, отражает сильную корреляцию между HbA1c и средним уровнем глюкозы в крови в течение предыдущих 3 мес [15]. Кроме того, мы рассчитывали гликемический разрыв (уровень глюкозы при поступлении минус ADAG), который отражает повышение глюкозы у больных СД при возникновении критических состояний. В проведенных ранее исследованиях величина гликемического разрыва более 72 мг/дл и 80 мг/дл ассоциировалась с неблагоприятными исходами у пациентов с СД и абсцессом печени, а также у пациентов ОРИТ [22, 23]. Стоит отметить, что среди наших пациентов только у одного гликемический разрыв превышал 67 мг/дл. По мнению других авторов, коэффициент стрессиндуцированной гипергликемии (уровень глюкозы при поступлении, разделенный на HbA1c) может использоваться в качестве лучшего биомаркера критического состояния по сравнению с абсолютной гипергликемией. Даже при относительно низкой концентрации глюкозы (менее 10 ммоль/л) этот показатель способствовал выявлению пациентов с высоким риском возникновения критического состояния, причем как с гипергликемией, так и без нее [14]. В исследовании G. Roberts и соавт. средний уровень стрессиндуцированной гипергликемии составил 1,11 ммоль/л, тогда как у нас – 1,4 ммоль/л, однако в их работе 16,7% пациентов имели повышение HbA1c≥6,5%. В этой работе увеличение показателя стрессиндуцированной гипергликемии на каждые 0,1 ммоль/л приводило к повышению риска развития критического состояния на 20%. У участников этого исследования с показателем стрессиндуцированной гипергликемии более 1,14 риск критического состояния увеличивался в 2,4 раза, более 1,38 – в 3,9 раза [14]. В нашей работе только у одного пациента показатель стрессиндуцированной гипергликемии был менее 1,14, у 18 пациентов он составлял 1,15–1,38, у 12 – 1,39–1,92. Медиана показателя стрессиндуцированной гипергликемии среди наших раненых составила 1,33 (Q1–Q3: 1,26–1,42). У наших пациентов с показателем стрессиндуцированной гипергликемии выше 1,42 зарегистрированы более высокие показатели глюкозы натощак (7,6±1,3 и 6,7±0,6 ммоль/л; p=0,005), меньший HbA1c (4,8±0,5% и 5,2±0,4%; p=0,03) и средняя глюкоза по формуле ADAG (91,0±15,9 и 102,9±12,2 мг/дл; p=0,03), более высокий гликемический разрыв (46,6±11,3 и 18,5±9,5 мг/дл; p<0,000001), меньший уровень гемоглобина в общей крови (97,5±21,9 и 113,3±15,7 г/л; p=0,03), а также большая доля нейтрофилов (71,3±9,4% и 57,3±18,7%; p=0,05). Раненые в нашем исследовании с показателем стрессиндуцированной гипергликемии, соответствующим 3–4-му квартилю, были более старшего возраста (42,2±9,7 и 36,5±6,3 года; p=0,05), имели более высокий уровень глюкозы в 12 ч (7±0,7 и 5,7±1,3 ммоль/л; p=0,04), меньший HbA1c (4,8±0,5% и 5,3±0,4%; p=0,002), меньшую глюкозу по формуле ADAG (92,4±13,5 мг/дл и 106,6±10,7 мг/дл; p=0,002), более высокий гликемический разрыв (37,5±13,4 и 14,8±8,5 мг/дл; p=0,000004), а также большую долю нейтрофилов периферической крови (68,3±11,4% и 54,2±20,1%; p=0,02).
Все наши пациенты были с проникающими минно-взрывными или огнестрельными ранениями конечностей. В исследовании J. Meizoso и соавт. у умерших пациентов с травмой и гипергликемией в 4–8 раз чаще наблюдалось сочетание гипергликемии и проникающей травмы по сравнению с тупой травмой. В этом исследовании гипергликемия при поступлении свыше 150 мг/дл достоверно предсказывала смертность у пациентов с проникающей травмой и выше 200 мг/дл – с тупой [24]. В нашей работе у абсолютного большинства пациентов (у 89,5%) уровень глюкозы крови натощак был менее 150 мг/дл, у 8,4% он находился в диапазоне 150–175 мг/дл и лишь у 2,1% он превышал 200 мг/дл.
В исследовании A. Laird и соавт. ранняя гипергликемия с концентрацией глюкозы ≥200 мг/дл у пациентов с травмами ассоциировалась с значительно более высоким риском инфекционных осложнений и смертельного исхода, но такого повышения не было отмечено при более низких значениях глюкозы [20].
В нашей работе у 6 из 10 пациентов с определенным HOMA-IR этот показатель был повышен. Состояние ИР описано в разных исследованиях пациентов с различными травмами, включая ожоги. По данным ряда авторов, взрослые пациенты с травмами имели в два раза меньшее поглощение глюкозы, несмотря на гиперинсулинемию, а у детей с сильными ожогами инсулин-стимулированное поглощение глюкозы составляло только половину по сравнению со здоровыми детьми [25].
В ходе наблюдения трем нашим пациентам был поставлен диагноз впервые выявленного СД. По данным американских исследователей, ветераны боевых действий, особенно с черепно-мозговыми травмами, имеют высокий риск возникновения СД, что может быть связано с нейроэндокринными нарушениями, посттравматическим стрессовым расстройством, хронической посттравматической энцефалопатией и сидячим образом жизни [26].
Несмотря на достаточно существенные результаты, полученные в ходе настоящего исследования, в данной работе имеется ряд ограничений. Все пациенты в этом исследовании были с ранами конечностей, поэтому оценить вклад другой патологии, в первую очередь травм головного мозга, в развитие гипергликемии не представилось возможным. С учетом относительно короткого времени наблюдения за пациентами с гипергликемией в стационаре не удалось оценить ее долгосрочные исходы и более точно определить долю пациентов с полной нормализацией гликемии. По техническим причинам не удалось провести гормональное исследование катехоламинов, кортизола и глюкагона, что не позволило уточнить роль гормональных нарушений в развитии гипергликемии у раненых.
В большинстве своем повышение уровня глюкозы натощак в этой группе пациентов небольшое, и у большинства раненых этот показатель нормализуется в течение относительно короткого периода времени. Наиболее часто гипергликемия регистрируется у пациентов более старшего возраста. Наше исследование закладывает основу для последующего изучения стрессиндуцированной гипергликемии у раненых и выяснения патогенетических основ этой патологии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация о финансировании. Финансирование данной работы не проводилось.
Information about funding. The study had no financial support.
Информация об авторах
Information about the authors
Тополянская Светлана Викторовна – д-р мед. наук, доц. каф. госпитальной терапии №2 ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет), ГБУЗ ГВВ №3.
E-mail: sshekshina@yandex.ru; ORCID: 0000-0002-4131-8432
Svetlana V. Topolyanskaya – Dr. Sci. (Med.), Associate Professor, Sechenov First Moscow State Medical University (Sechenov University), War Veterans Hospital No. 3.
E-mail: sshekshina@yandex.ru; ORCID: 0000-0002-4131-8432
Куржос Мария Николаевна – врач-терапевт ГБУЗ ГВВ №3.
E-mail: masha1shevchyk@gmail.com
Maria N. Kurzhos – general practitioner, War Veterans Hospital No. 3. E-mail: masha1shevchyk@gmail.com
Бубман Леонид Игоревич – врач-хирург ГБУЗ ГВВ №3.
E-mail: bubmanli@gvv3.net; ORCID: 0000-0002-4195-3188
Leonid I. Bubman – surgeon, War Veterans Hospital No. 3.
E-mail: bubmanli@gvv3.net; ORCID: 0000-0002-4195-3188
Васильева Юлия Юрьевна – врач клинико-диагностической лаб. ГБУЗ ГВВ №3. E-mail: vasilievayy@gvv3.net
Yulia Yu. Vasilyeva – doctor, War Veterans Hospital No. 3. E-mail: vasilievayy@gvv3.net
Голимбекова Мария Вячелавовна – врач-терапевт ГБУЗ ГВВ №3. E-mail: golimbekovamv@gvv3.net; ORCID: 0009-0003-6234-2807
Maria V. Golimbekova – general practitioner, War Veterans Hospital No. 3. E-mail: golimbekovamv@gvv3.net;
ORCID: 0009-0003-6234-2807
Мельникова Ксения Дмитриевна – врач-терапевт ГБУЗ ГВВ №3. E-mail: melnikovakd@gvv3.net
Ksenia D. Melnikova – general practitioner, War Veterans Hospital No. 3. E-mail: melnikovakd@gvv3.net
Колонтай Татьяна Михайловна – врач-эндокринолог ГБУЗ ГВВ №3. E-mail: kolontaitm@gvv3.net
Tatiana M. Kolontai – endocrinologist, War Veterans Hospital No. 3. E-mail: kolontaitm@gvv3.net
Пилярова Медина Халитовна – врач-гериатр ГБУЗ ГВВ №3.
E-mail: pilyarovamk@gvv3.net
Medina Kh. Pilyarova – geriatrician, War Veterans Hospital No. 3. E-mail: pilyarovamk@gvv3.net
Молочников Александр Юрьевич – зав. хирургическим отд-нием №21 ГБУЗ ГВВ №3. E-mail: molochnikovay@gvv3.net
Alexander Yu. Molochnikov – head of the Surgical Department No. 21, War Veterans Hospital No. 3.
E-mail: molochnikovay@gvv3.net
Мелик-Оганджанян Гаянэ Юрьевна – зам. глав. врача ГБУЗ ГВВ №3 по медицинской части. E-mail: nachmed@gvv3.net
Gayane Yu. Melik-Ogandjanyan – Deputy Chief doctor, War Veterans Hospital No. 3. E-mail: nachmed@gvv3.net
Лыткина Каринэ Арнольдовна – канд. мед. наук, зам. глав. врача по терапии ГБУЗ ГВВ №3. E-mail: lytkinaka@gvv3.net;
ORCID: 0000-0001-9647-7492
Karine A. Lytkina – Cand. Sci. (Med.), Deputy Chief doctor, War Veterans Hospital No. 3. E-mail: lytkinaka@gvv3.net; ORCID: 0000-0001-9647-7492
Мелконян Георгий Геннадьевич – д-р мед. наук, проф., глав. врач ГБУЗ ГВВ №3, ФГБОУ ДПО РМАНПО.
E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Georgiy G. Melkonyan – Dr. Sci. (Med.), Professor, Chief doctor, War Veterans Hospital No. 3, Russian Medical Academy of Continuous Professional Education.
E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Рачина Светлана Александровна – д-р мед. наук, проф.,
зав. каф. госпитальной терапии №2 ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет). E-mail: svetlana.ratchina@antibiotic.ru; ORCID: 0000-0002-3329-7846
Svetlana A. Rachina – Dr. Sci. (Med.), Professor, Sechenov First Moscow State Medical University (Sechenov University). E-mail: svetlana.ratchina@antibiotic.ru;
ORCID: 0000-0002-3329-7846
Поступила в редакцию: 15.04.2024
Поступила после рецензирования: 23.04.2024
Принята к публикации: 25.04.2024
Received: 15.04.2024
Revised: 23.04.2024
Accepted: 25.04.2024
Клинический разбор в общей медицине №4 2024
Нарушения углеводного обмена у пациентов с боевыми травмами
Номера страниц в выпуске:24-32
Аннотация
Цель. Изучить частоту встречаемости и некоторые аспекты патологии углеводного обмена у пациентов с боевыми травмами конечностей.
Материалы и методы. В исследование включены 210 пациентов, перенесших ранение нижних или/и верхних конечностей в сроки от 4 до 58 дней (в среднем 15,9±8,7 дня) до поступления в стационар. Все участники исследования были мужчинами. Средний возраст пациентов составлял 36,0±8,4 года (19–59 лет). У всех пациентов проводилось определение концентрации глюкозы в венозной крови натощак. Пациентам с гипергликемией проводили исследование гликемического профиля и гликированного гемоглобина. Рассчитывали показатели стрессиндуцированной гипергликемии, предполагаемого среднего уровня глюкозы за последние 3 мес (ADAG), гликемического разрыва. Определяли инсулин в плазме крови натощак и рассчитывали индекс инсулинорезистентности HOMA-IR.
Результаты. Частота гипергликемии в изученной группе пациентов составила 23,3%. В общей группе пациентов средняя концентрация глюкозы составила 5,5±1,0 ммоль/л (3,1–9,73 ммоль/л). В группе раненых с гипергликемией средний уровень глюкозы в крови достигал 6,7±0,9 ммоль/л, у пациентов с нормальной концентрацией глюкозы – 5,1±0,5 ммоль/л (р<0,000001). Средняя концентрация глюкозы крови натощак у раненых в возрасте 40 лет и старше достигала 5,7±1,1 ммоль/л, моложе 40 лет – 5,2±0,8 ммоль/л (р=0,005). Зарегистрирована достоверная прямая корреляция между уровнем глюкозы натощак при поступлении в стационар и возрастом пациентов (r=0,26; р=0,00003). Относительный риск гипергликемии у пациентов в возрасте 40 лет и старше составил 1,84 (доверительный интервал 1,005–3,37; р=0,01). Среднее время, прошедшее с момента ранения, у пациентов с гипергликемией достигало 13,2±5,7 дня, с нормальной концентрацией глюкозы – 16,7±9,2 дня (р=0,02). У пациентов с гипергликемией зарегистрированы более низкие показатели общего белка (58,3±10,2 и 62,1±6,9 г/л соответственно; р=0,004), альбумина (31,2±4,6 и 33,2±4,9 г/л; р=0,04), гемоглобина (97,7±18,9 и 105,9±16,9 г/л; р=0,004), но более высокие показатели С-реактивного белка (61,0±55,4 и 32,9±38,1 мг/л; р=0,0001), лейкоцитов (10,6±4,4 и 9,3±3,4×109/л; р=0,02), числа нейтрофилов (7,8±4,3 и 6,4±2,9×109/л; р=0,01), доли нейтрофилов (71,6±9,6% и 67,7±7,7%; р=0,004), а также концентрации фибриногена (5,7±1,4 и 4,8±1,2 г/л; р=0,0002), чем у раненых с нормальным уровнем глюкозы крови. У пациентов с гипергликемией средняя концентрация гликированного гемоглобина составила 5,3±0,6%, стрессиндуцированной гипергликемии – 1,4±0,2 ммоль/л. Медиана показателя гликемического разрыва достигала 1,51 ммоль/л (Q1–Q3: 0,88–2,1 ммоль/л). Медиана концентрации инсулина составила 12,9 мкМЕ/мл (Q1–Q3: 9,2–27,0 мкМЕ/мл), индекса инсулинорезистентности – 3,3 (Q1–Q3: 2,1–8,8). Концентрация глюкозы в крови натощак при последнем определении у пациентов с исходной гипергликемией достигала в среднем 5,8±1,3 ммоль/л. В ходе наблюдения у 64,6% раненых с гипергликемией при поступлении уровень глюкозы нормализовался, у 35,4% сохранялась небольшая гипергликемия. Медиана времени до нормализации концентрации глюкозы в крови натощак или до проведения последнего определения данного показателя составила 17,5 дня (Q1–Q3: 8–30 дней).
Выводы. Результаты настоящего исследования свидетельствуют о достаточно частом обнаружении гипергликемии у пациентов с боевыми травмами конечностей. В большинстве своем повышение уровня глюкозы натощак небольшое и у большинства пациентов этот показатель нормализуется в течение относительно короткого периода времени. Необходимо продолжение исследований стрессиндуцированной гипергликемии у раненых и выяснение патогенетических основ этой патологии.
Ключевые слова: глюкоза, гипергликемия, стрессиндуцированная гипергликемия, гликированный гемоглобин, боевые ранения.
Для цитирования: Тополянская С.В., Куржос М.Н., Бубман Л.И., Васильева Ю.Ю., Голимбекова М.В., Мельникова К.Д., Колонтай Т.М., Пилярова М.Х., Молочников А.Ю., Мелик-Оганджанян Г.Ю., Лыткина К.А., Мелконян Г.Г., Рачина С.А. Нарушения углеводного обмена у пациентов с боевыми травмами. Клинический разбор в общей медицине. 2024; 5 (4): 24–32. DOI: 10.47407/kr2024.5.4.00416
Цель. Изучить частоту встречаемости и некоторые аспекты патологии углеводного обмена у пациентов с боевыми травмами конечностей.
Материалы и методы. В исследование включены 210 пациентов, перенесших ранение нижних или/и верхних конечностей в сроки от 4 до 58 дней (в среднем 15,9±8,7 дня) до поступления в стационар. Все участники исследования были мужчинами. Средний возраст пациентов составлял 36,0±8,4 года (19–59 лет). У всех пациентов проводилось определение концентрации глюкозы в венозной крови натощак. Пациентам с гипергликемией проводили исследование гликемического профиля и гликированного гемоглобина. Рассчитывали показатели стрессиндуцированной гипергликемии, предполагаемого среднего уровня глюкозы за последние 3 мес (ADAG), гликемического разрыва. Определяли инсулин в плазме крови натощак и рассчитывали индекс инсулинорезистентности HOMA-IR.
Результаты. Частота гипергликемии в изученной группе пациентов составила 23,3%. В общей группе пациентов средняя концентрация глюкозы составила 5,5±1,0 ммоль/л (3,1–9,73 ммоль/л). В группе раненых с гипергликемией средний уровень глюкозы в крови достигал 6,7±0,9 ммоль/л, у пациентов с нормальной концентрацией глюкозы – 5,1±0,5 ммоль/л (р<0,000001). Средняя концентрация глюкозы крови натощак у раненых в возрасте 40 лет и старше достигала 5,7±1,1 ммоль/л, моложе 40 лет – 5,2±0,8 ммоль/л (р=0,005). Зарегистрирована достоверная прямая корреляция между уровнем глюкозы натощак при поступлении в стационар и возрастом пациентов (r=0,26; р=0,00003). Относительный риск гипергликемии у пациентов в возрасте 40 лет и старше составил 1,84 (доверительный интервал 1,005–3,37; р=0,01). Среднее время, прошедшее с момента ранения, у пациентов с гипергликемией достигало 13,2±5,7 дня, с нормальной концентрацией глюкозы – 16,7±9,2 дня (р=0,02). У пациентов с гипергликемией зарегистрированы более низкие показатели общего белка (58,3±10,2 и 62,1±6,9 г/л соответственно; р=0,004), альбумина (31,2±4,6 и 33,2±4,9 г/л; р=0,04), гемоглобина (97,7±18,9 и 105,9±16,9 г/л; р=0,004), но более высокие показатели С-реактивного белка (61,0±55,4 и 32,9±38,1 мг/л; р=0,0001), лейкоцитов (10,6±4,4 и 9,3±3,4×109/л; р=0,02), числа нейтрофилов (7,8±4,3 и 6,4±2,9×109/л; р=0,01), доли нейтрофилов (71,6±9,6% и 67,7±7,7%; р=0,004), а также концентрации фибриногена (5,7±1,4 и 4,8±1,2 г/л; р=0,0002), чем у раненых с нормальным уровнем глюкозы крови. У пациентов с гипергликемией средняя концентрация гликированного гемоглобина составила 5,3±0,6%, стрессиндуцированной гипергликемии – 1,4±0,2 ммоль/л. Медиана показателя гликемического разрыва достигала 1,51 ммоль/л (Q1–Q3: 0,88–2,1 ммоль/л). Медиана концентрации инсулина составила 12,9 мкМЕ/мл (Q1–Q3: 9,2–27,0 мкМЕ/мл), индекса инсулинорезистентности – 3,3 (Q1–Q3: 2,1–8,8). Концентрация глюкозы в крови натощак при последнем определении у пациентов с исходной гипергликемией достигала в среднем 5,8±1,3 ммоль/л. В ходе наблюдения у 64,6% раненых с гипергликемией при поступлении уровень глюкозы нормализовался, у 35,4% сохранялась небольшая гипергликемия. Медиана времени до нормализации концентрации глюкозы в крови натощак или до проведения последнего определения данного показателя составила 17,5 дня (Q1–Q3: 8–30 дней).
Выводы. Результаты настоящего исследования свидетельствуют о достаточно частом обнаружении гипергликемии у пациентов с боевыми травмами конечностей. В большинстве своем повышение уровня глюкозы натощак небольшое и у большинства пациентов этот показатель нормализуется в течение относительно короткого периода времени. Необходимо продолжение исследований стрессиндуцированной гипергликемии у раненых и выяснение патогенетических основ этой патологии.
Ключевые слова: глюкоза, гипергликемия, стрессиндуцированная гипергликемия, гликированный гемоглобин, боевые ранения.
Для цитирования: Тополянская С.В., Куржос М.Н., Бубман Л.И., Васильева Ю.Ю., Голимбекова М.В., Мельникова К.Д., Колонтай Т.М., Пилярова М.Х., Молочников А.Ю., Мелик-Оганджанян Г.Ю., Лыткина К.А., Мелконян Г.Г., Рачина С.А. Нарушения углеводного обмена у пациентов с боевыми травмами. Клинический разбор в общей медицине. 2024; 5 (4): 24–32. DOI: 10.47407/kr2024.5.4.00416
Hyperglycemia in patients with combat injuries
Svetlana V. Topolyanskaya1,2, Maria N. Kurzhos1, Leonid I. Bubman1, Yulia Yu. Vasilyeva1,Maria V. Golimbekova1, Ksenia D. Melnikova1, Tatiana M. Kolontai1, Medina Kh. Pilyarova1,
Alexander Yu. Molochnikov1, Gayane Yu. Melik-Ogandjanyan1, Karine A. Lytkina1,
Georgiy G. Melkonyan1,3, Svetlana A. Rachina1
1 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
2 War Veterans Hospital No. 3, Moscow, Russia;
3 Russian Medical Academy of Continuous Professional Education, Moscow, Russia
sshekshina@yandex.ru
Abstract
Aim. To investigate the prevalence and some aspects of the carbohydrate metabolism pathology in patients with combat limb injuries.
Materials and methods. 210 patients who suffered from combat injuries of the lower and/or upper extremities from 4 to 58 days (mean 15.9±8.7 days) before admission to the hospital were enrolled in the study. All study participants were men. The mean age of the patients was 36.0±8.4 years (19–59 years). Fasting venous blood glucose concentrations were determined in all patients. Patients with hyperglycemia underwent a study of the glycemic profile and HbA1c. Stress-induced hyperglycemia, estimated mean glucose level over the past 3 months (ADAG), and glycemic gap were calculated. Insulin in fasting blood plasma was determined and the HOMA-IR insulin resistance index was calculated.
Results. The incidence of hyperglycemia was 23.3%. In the general group of patients, the mean glucose concentration was 5.5±1.0 mmol/l (3.1–9.73 mmol/l). In the group of patients with hyperglycemia, the mean blood glucose level reached 6.7±0.9 mmol/l, in patients with normal glucose concentration – 5.1±0.5 mmol/l (p<0.000001). The mean fasting blood glucose concentration in patients aged 40 years and older reached 5.7±1.1 mmol/l, those under 40 years old – 5.2±0.8 mmol/l (p=0.005). A significant direct correlation was registered between the fasting glucose level upon admission to the hospital and the age of the patients (r=0.26; p=0.00003). The relative risk of hyperglycemia in patients aged 40 years and older was 1.84 (confidence interval 1.005–3.37; p=0.01). The mean time elapsed since injury in patients with hyperglycemia reached 13.2±5.7 days, with normal glucose concentration – 16.7±9.2 days (p=0.02). Patients with hyperglycemia had lower levels of total protein (58.3±10.2 and 62.1±6.9 g/l, respectively; p=0.004), albumin (31.2±4.6 and 33.2±4.9 g/l; p=0.04), hemoglobin (97.7±18.9 and 105.9±16.9 g/l; p=0.004), but higher levels of C-reactive protein (61.0±55.4 and 32.9±38.1 mg/l; p=0.0001), leukocytes (10.6±4.4 and 9.3±3.4×109/l; p=0.02), count of neutrophils (7.8±4.3 and 6.4±2.9×109/l; p=0.01), proportion of neutrophils (71.6±9.6% and 67.7±7.7%; p=0.004), as well as fibrinogen concentration (5.7±1.4 and 4.8±1.2 g/l; p=0.0002) than patients with normal blood glucose levels. In patients with hyperglycemia, the mean HbA1c level was 5.3±0.6%, stress-induced hyperglycemia – 1.4±0.2 mmol/l. The median glycemic gap reached 1.51 mmol/l (Q1–Q3: 0.88–2.1 mmol/l). The median insulin concentration was 12.9 µIU/ml (Q1–Q3: 9.2–27.0 µIU/ml), the insulin resistance index was 3.3 (Q1–Q3: 2.1–8.8). The mean fasting blood glucose concentration at the last determination in patients with initial hyperglycemia reached 5.8±1.3 mmol/l. During observation, in 64.6% of the patients with hyperglycemia upon admission, glucose levels returned to normal, while in 35.4% mild hyperglycemia remained. The median time to normalization of fasting blood glucose concentration or to the last determination of this indicator was 17.5 days (Q1–Q3: 8–30 days).
Conclusions. The study results indicate a frequent detection of hyperglycemia in patients with combat limb injuries. In most cases the increase in fasting glucose levels is small and in most patients this indicator returns to normal within a relatively short time. It is necessary to continue research of stress-induced hyperglycemia in the patients with combat injuries and to elucidate the pathogenetic basis of this pathology.
Keywords: glucose, hyperglycemia, stress-induced hyperglycemia, glycated hemoglobin, combat injuries.
For citation: Topolyanskaya S.V., Kurzhos M.N., Bubman L.I., Vasilyeva Yu.Yu., Golimbekova M.V., Melnikova K.D., Kolontai T.M., Pilyarova M.H., Molochnikov A.Yu., Melik-Oganjanyan G.Yu., Lytkina K.A., Melkonyan G.G., Rachina S.A. Hyperglycemia in patients with combat injuries. Clinical review for general practice. 2024; 5 (4): 24–32 (In Russ.). DOI: 10.47407/kr2024.5.4.00416
Введение
Стрессиндуцированная гипергликемия – повышение уровня глюкозы, обычно возникающее у пациентов с тяжелым заболеванием или травмой и обусловленное избыточным глюконеогенезом в печени, снижением выработки инсулина и инсулинорезистентностью (ИР) вследствие гормонального и цитокинового дисбаланса [1, 2]. Глюкоза является предпочтительным энергетическим субстратом для защиты клеток различных органов и систем и репарации тканей после травмы или заболевания. Чтобы удовлетворить эти энергетические потребности, печень метаболически перепрограммируется на восстановление глюкозы из лактата и гликогенных аминокислот в результате процессов протеолиза и липолиза в мышечной и жировой ткани [3]. По мнению некоторых ученых, стрессиндуцированная гипергликемия может быть важной и полезной в острой, угрожающей жизни ситуации, оказывая защитное действие и обеспечивая энергию для головного мозга и других органов и систем в момент стресса [1, 3]. Однако персистирующая гипергликемия и ИР могут оказаться пагубными в долгосрочной перспективе, способствуя эндотелиальной дисфункции, повышенному образованию свободных радикалов и окислительному стрессу, воспалительным реакциям, дисфункции сердечно-сосудистой и иммунной системы, выраженному метаболическому стрессу [1, 3].Развитие стрессиндуцированной гипергликемии обусловлено сложным взаимодействием различных гормонов и цитокинов [4, 5]. Основной механизм взаимосвязи между стрессом и патологией углеводного обмена заключается в активации симпатической нервной системы и оси гипоталамус–гипофиз–надпочечники [6]. Стимуляция двух этих звеньев приводит к повышению уровня контринсулярных гормонов – катехоламинов, кортизола, глюкагона и гормона роста, которые усиливают гликогенолиз и гиперметаболизм и приводят к избыточной продукции глюкозы, снижению секреции инсулина и ИР [1, 5, 7]. По мнению ряда авторов, усиление печеночного глюконеогенеза, регулируемого катехоламинами, глюкагоном и цитокинами, по-видимому, является наиболее важным фактором, способствующим стрессиндуцированной гипергликемии [4, 5]. Преходящая ИР – еще один механизм, посредством которого «гормоны стресса» могут влиять на метаболизм глюкозы [7]. ИР возникает в результате дефектов пострецепторной передачи сигналов инсулина и подавления транспортера глюкозы, приводя к снижению опосредованного инсулином поглощения глюкозы [4]. Катехоламины и кортизол могут ингибировать связывание инсулина и его активацию, приводя к ИР с гиперинсулинемией; глюкокортикоиды также ограничивают поглощение глюкозы периферическими тканями, а гормон роста предотвращает активацию инсулина [4, 5, 7].
Синдром системного воспалительного ответа также может приводить к гипергликемии [7]. Повышение уровня провоспалительных цитокинов, таких как фактор некроза опухоли α (ФНО-α) и интерлейкин (ИЛ)-6, способствует ИР и подавлению высвобождения инсулина, еще больше нарушая метаболизм глюкозы [4, 5, 7].
 Воспаление способствует повышению уровня кортикотропин-рилизинг-гормона и стимулирует высвобождение адренокортикотропного гормона, что, в свою очередь, приводит к гипергликемии [7]. Таким образом, в результате взаимодействия между различными гормонами и цитокинами возникают ИР и чрезмерный глюконеогенез в печени (см. рисунок) [4, 5].
Воспаление способствует повышению уровня кортикотропин-рилизинг-гормона и стимулирует высвобождение адренокортикотропного гормона, что, в свою очередь, приводит к гипергликемии [7]. Таким образом, в результате взаимодействия между различными гормонами и цитокинами возникают ИР и чрезмерный глюконеогенез в печени (см. рисунок) [4, 5].Хирургические операции, анестезия, некоторые терапевтические вмешательства (инфузии катехоламинов, кортикостероидов, энтеральное и парентеральное питание) и психологические факторы также могут приводить к гипергликемии у пациентов с тяжелой травмой или заболеванием [4, 5, 7]. Гипергликемия во время острых состояний может быть обусловлена и не диагностированным ранее сахарным диабетом (СД) [1].
Гипергликемия усугубляет цитокиновую, воспалительную и окислительную реакцию на стресс, потенциально создавая порочный круг, в результате которого гипергликемия приводит к дальнейшему повышению уровня глюкозы в крови и различным неблагоприятным последствиям [4, 8]. Гиперинсулинемия также может приводить к усилению воспалительных и гормональных нарушений и патологическому фибринолизу [4]. Глюкотоксичность, липотоксичность и воспаление – ключевые компоненты синдрома так называемой чрезмерной ИР, связанной с острым заболеванием (exaggerated global insulin-resistance syndrome associated with acute illness) [4].
Распространенность стрессиндуцированной гипергликемии составляет 4–4,9% у пациентов со всеми травмами, 7,8% – с черепно-мозговыми травмами средней и тяжелой степени, 24% – с ишемическими инсультами и 47,9% – у пожилых больных с переломом бедра [2, 8, 9]. По данным других авторов, до 50% пациентов отделений интенсивной терапии в первые 48 ч после поступления имеют повышение уровня глюкозы в крови [10]. Наряду с этим гипергликемию считают одним из наиболее распространенных осложнений у пациентов с черепно-мозговыми травмами, которое коррелирует с тяжестью травмы и ее неблагоприятными исходами [7]. Установлена также связь между гипергликемией и плохим прогнозом при ишемическом инсульте, субарахноидальном и внутримозговом кровоизлиянии [7, 8]. Стрессиндуцированная гипергликемия ассоциируется с увеличением смертности, особенно у пациентов без СД в анамнезе [2, 5], приводит к увеличению риска инфекционных осложнений, дисфункции иммунной системы, замедлению репарации тканей и полиорганной недостаточности [8]. Уровень глюкозы в крови при поступлении в стационар может представлять собой клинически значимый предиктор летального исхода и инфекционных осложнений у пациентов с травмой, а достижение нормогликемии в раннем посттравматическом периоде может снизить риск неблагоприятного исхода [1].
Большинство исследований стрессиндуцированной гипергликемии проведено у гражданских пациентов с СД, травмами головного мозга, инсультами, но не у участников военных конфликтов [6]. В одном из израильских исследований у 82 пациентов с СД во время войны в Персидском заливе были зарегистрированы более высокие уровни гликированного гемоглобина (HbA1c) по сравнению с этим показателем, измеренным до или после военных действий [11]. Еще в одной работе, проведенной среди госпитализированных пациентов с СД, отмечено повышение показателей глюкозы крови во время военной операции по сравнению с анализами, проведенными за неделю до ее начала [12].
В небольшом исследовании боснийских беженцев с посттравматическим стрессовым расстройством после воздействия стрессового фактора обнаружены значительно более высокие уровни глюкозы и инсулина [13].
В настоящее время в доступной литературе нам не удалось найти данные по патологии углеводного обмена у пациентов с боевыми травмами, полученными в ходе участия в специальной военной операции. Настоящее исследование было разработано с целью изучения возможных нарушений углеводного обмена и стрессиндуцированной гипергликемии у пациентов с боевыми ранениями.
Цель исследования – изучить частоту встречаемости и некоторые аспекты патологии углеводного обмена у пациентов с боевыми ранениями конечностей.
Материалы и методы
Данная работа была выполнена на клинической базе Госпиталя для ветеранов войн №3 (Москва) и представляла собой наблюдательное исследование. В исследование включали раненых с боевыми травмами конечностей. Всем пациентам проводилось определение концентрации глюкозы в венозной крови натощак. Пациентам с гипергликемией проводили исследование гликемического профиля и HbA1c. HbA1c (норма 4,0–6,0%) определялся методом хроматографии. Пациенты с тяжелой анемией и уровнем гемоглобина менее 80 г/л были исключены из анализа HbA1c.Определяли относительную (стрессиндуцированную) гипергликемию по формуле: концентрация глюкозы в крови при поступлении, разделенная на предполагаемый средний уровень глюкозы (HbA1c) [14]. Рассчитывали предполагаемый средний уровень глюкозы за последние 3 мес по формуле ADAG (A1c-Derived Average Glucose study): 28,7×HbA1c-46,7 [15]. Определяли гликемический разрыв по формуле: концентрация глюкозы при поступлении минус предполагаемый средний уровень глюкозы за последние 3 мес по формуле ADAG [2]. Инсулин в плазме крови натощак (норма 2,2–25,0 мкМЕ/мл) определяли методом иммунохемилюминесценции. Рассчитывали индекс ИР – HOMA-IR (норма 0–2,7).
Наряду с этим всем пациентам проводили стандартные общий и биохимический анализы крови, а также скрининговую коагулограмму.
Полученные данные анализировали с использованием программного обеспечения Statistica (версия 13). Количественные переменные исследованы на нормальность распределения с помощью критерия Шапиро–Уилкса. При нормальном распределении описание количественных переменных представляли в виде минимального, максимального, среднего значения и стандартного отклонения (СО), качественных – в виде n (%), при ненормальном распределении – в виде медианы и квартилей. Проводили корреляционный анализ с помощью критерия Спирмена.
Результаты
В скрининговое исследование по изучению частоты и характера гипергликемии у пациентов с боевыми травмами конечностей включены 210 пациентов, перенесших ранение нижних или/и верхних конечностей в сроки от 4 до 58 дней (в среднем 15,9±8,7 дня) до поступления в стационар. Все участники исследования были мужчинами. Возраст пациентов варьировал от 19 до 59 лет, в среднем составляя 36,0±8,4 года. Доля больных 19–29 лет достигала 26,2%, 30–39 лет – 38,1%, 40–49 лет – 29,5%, 50 лет и старше – 5,7%. Наиболее частой локализацией ран были голени (у 29,3%), стопы (12,8%), голени и стопы (9,6%), бедра (9,2%) и бедра в сочетании с голенями (8,4%). У 26,6% раненых были ампутированы нижние или верхние конечности.Частота гипергликемии в изученной группе пациентов составила 23,3%. В большинстве своем отмечалось небольшое повышение концентрации глюкозы в крови. Так, у 9 (18,4%) пациентов глюкоза находилась в диапазоне 5,91–5,99 ммоль/л, 20 (40,8%) – 6,05–6,59 ммоль/л, 12 (24,5%) – 7,1-7,93 ммоль/л, 4 (8,2%) – 8,2–8,95 ммоль/л, 3 (6,1%) – 9,1–9,73 ммоль/л. У 37 (17,6%) раненых уровень глюкозы в венозной крови натощак превышал 6,1 ммоль/л. В общей группе пациентов средняя концентрация глюкозы составила 5,5±1,0 ммоль/л, варьируя от 3,1 до 9,73 ммоль/л. В группе раненых с гипергликемией средний уровень глюкозы в крови достигал 6,7±0,9 ммоль/л, у пациентов с нормальной концентрацией глюкозы – 5,1±0,5 ммоль/л (р<0,000001).
Средний возраст раненых с гипергликемией составлял 39,2±7,7 года, с нормальной концентрацией глюкозы в крови – 35,0±8,4 года (р=0,002). В группе пациентов с гипергликемией 51,1% раненых были в возрасте 40 лет и старше, тогда как с нормальной концентрацией глюкозы – 30,9% (р=0,01). Зарегистрирована достоверная прямая корреляция между уровнем глюкозы натощак при поступлении в стационар и возрастом пациентов (r=0,26; р=0,00003). Средняя концентрация глюкозы крови натощак у раненых в возрасте 40 лет и старше достигала 5,7±1,1 ммоль/л, моложе 40 лет – 5,2±0,8 ммоль/л (р=0,005). Относительный риск гипергликемии у пациентов в возрасте 40 лет и старше составил 1,84, доверительный интервал – 1,005–3,37 (р=0,01).
Среднее время, прошедшее с момента ранения, у пациентов с гипергликемией достигало 13,2±5,7 дня, с нормальной концентрацией глюкозы – 16,7±9,2 дня (р=0,02). Значимых корреляций между временем, прошедшим с момента ранения, и глюкозой крови натощак при поступлении обнаружено не было (r=-0,1; р=0,14).
Сравнение показателей общего и биохимического анализов крови в группе пациентов с гипергликемией и нормальным уровнем глюкозы крови натощак представлено в табл. 1.

Корреляционные взаимосвязи между концентрацией глюкозы в крови натощак при поступлении в стационар и другими лабораторными показателями представлены в табл. 2.
Наблюдалась также корреляция между концентрацией глюкозы в венозной крови натощак и числом вторичных хирургических обработок ран (r=0,15; р=0,03).
При проведении регрессионного анализа значимыми факторами, связанными с гипергликемией, были возраст пациентов (β=0,27; р=0,02) и процентное число нейтрофилов (β=0,35; р=0,01). Итоговой наиболее значимой переменной, ассоциированной с гипергликемией, оказался возраст пациентов (β=0,3; р=0,04).
В повторных анализах крови средняя концентрация глюкозы натощак у пациентов с гипергликемией составила 5,5±0,9 ммоль /л (4,1–9,0 ммоль/л), тогда как исходная – 6,5±0,9 ммоль/л (р=0,000001). Среднее время до нормализации уровня глюкозы или до последнего ее определения составило 20,3±16,7 дня (3–83 дня), медиана – 17 дней (Q1–Q3: 7,5–25 дней).
Характеристика пациентов с гипергликемией представлена в табл. 3.

Медиана показателя гликемического разрыва составила 1,51 ммоль/л (27,2 мг/дл) [Q1–Q3: 0,88-2,1 ммоль/л (15,9–37,7 мг/дл)].
При проведении корреляционного анализа в изученной группе пациентов с гипергликемией показатели HbA1c коррелировали только с концентрацией глюкозы в крови натощак (r=0,49; р=0,004), ADAG – лишь с глюкозой крови натощак (r=0,49; р=0,004) и стрессиндуцированной гипергликемией (r=-0,43; р=0,01), показатели гликемического разрыва – с глюкозой крови натощак (r=0,67; р=0,00003), стрессиндуцированной гипергликемией (r=0,98; р<0,0000001) и ADAG (r=-0,40; р=0,03). Параметры стрессиндуцированной гликемии коррелировали с глюкозой крови натощак (r=0,6; р=0,0009), уровнем гемоглобина (r=-0,4; р=0,03), С-реактивного белка (r=0,4; р=0,05), концентрацией железа (r=-0,42; р=0,04), процентным числом нейтрофилов (r=0,37; р=0,04). Наблюдалась также тенденция к обратной взаимосвязи между стрессиндуцированной гликемией и уровнем общего белка (r=-0,3; р=0,1) и альбумина (r=-0,4; р=0,1).
 Концентрация инсулина в плазме крови натощак и HOMA-IR у пациентов с гипергликемией представлены в табл. 4. Уровень инсулина был повышен у 3 из 10 обследованных пациентов, HOMA-IR – у 6 из 10 раненых. При проведении корреляционного анализа достоверных взаимосвязей между HOMA-IR и другими изученными клиническими и лабораторными параметрами обнаружено не было. Содержание инсулина в плазме крови коррелировало только с HOMA-IR (r=0,98; p=0,00001).
Концентрация инсулина в плазме крови натощак и HOMA-IR у пациентов с гипергликемией представлены в табл. 4. Уровень инсулина был повышен у 3 из 10 обследованных пациентов, HOMA-IR – у 6 из 10 раненых. При проведении корреляционного анализа достоверных взаимосвязей между HOMA-IR и другими изученными клиническими и лабораторными параметрами обнаружено не было. Содержание инсулина в плазме крови коррелировало только с HOMA-IR (r=0,98; p=0,00001).Повторное определение глюкозы крови натощак было проведено у 65 (68,4%) из 95 пациентов с гипергликемией, у 30 раненых данный показатель больше не определялся. Концентрация глюкозы крови натощак при последнем определении достигала в среднем 5,8±1,3 ммоль/л, варьируя от 4,1 до 12 ммоль/л. В ходе наблюдения у 64,6% из 65 раненых уровень глюкозы нормализовался, у 35,4% сохранялась небольшая гипергликемия. Средняя концентрация глюкозы у этих пациентов достигала 7,1 ммоль/л (5,97–12 ммоль/л).
У 16 из этих раненых уровень глюкозы крови натощак не превышал 7 ммоль/л, у трех он находился в пределах 7,21–7,92 ммоль/л, у одного – 8,32 ммоль/л, у двух – 9,04-9,1 ммоль/л и лишь еще у одного – 12 ммоль/л. Медиана времени до нормализации концентрации глюкозы крови натощак или до проведения последнего определения данного показателя составила 17,5 дня (Q1–Q3: 8–30 дней). В ходе наблюдения лишь 3 пациентам (в возрасте 56, 46 и 37 лет) был поставлен диагноз впервые выявленного СД.
Обсуждение
Полученные нами результаты свидетельствуют о достаточно частом повышении глюкозы крови у пациентов с ранениями конечностей. Частота гипергликемии в изученной группе раненых составила 23,3%.Очень ограниченное число исследований были посвящены влиянию боевой травмы на повышение уровня глюкозы. Так, израильские исследователи обнаружили более высокие показатели глюкозы в дни военных операций по сравнению с другим временем, особенно среди тех, кто проживал в местах, где интенсивность военной угрозы выше. Аналогично нашим данным, в этом исследовании повышение уровня глюкозы крови было минимальным (в целом по группе всего лишь на 2,1% выше). По мнению авторов этой работы, не только гипергликемия, но и относительное повышение уровня глюкозы натощак может быть связано с повышенным риском сердечно-сосудистых осложнений [6].
Хорошо известно, что при острых стрессовых реакциях происходит нарушение гомеостаза глюкозы, а война – это выраженный стресс, хотя ее точное влияние на углеводный обмен неизвестно. Еще в одном израильском исследовании уровни глюкозы у госпитализированных взрослых пациентов были значительно выше во время военной кампании по сравнению с неделей, предшествовавшей войне (9,7 и 9,3 ммоль/л соответственно) [12]. В другом небольшом исследовании с участием боснийских беженцев после воздействия стрессового фактора наблюдалось достоверное повышение уровня глюкозы и инсулина в крови; авторы этой работы пришли к выводу о независимом влиянии острого психологического стресса на метаболизм глюкозы [13].
В наших наблюдениях средний возраст раненых с гипергликемией достигал практически 40 лет и был достоверно выше, чем у пациентов с нормальной концентрацией глюкозы в крови, а в группе пациентов с гипергликемией более половины были в возрасте 40 лет и старше. В индийском наблюдательном исследовании гипергликемии среди пациентов отделений реанимации и интенсивной терапии (ОРИТ) средний возраст участников составил 40,3 года и среди них преобладали мужчины [16]. В этом исследовании частота гипергликемии среди пациентов, не страдавших ранее СД, составила 20,3% [16], тогда как в нашей работе – 23,3%.
У 87,5% наших раненых с гипергликемией уровень HbA1c был менее 5,7%, у 6,2% – 5,7%, 3,1% – 6,5% и 7,6%, а в индийском исследовании у 77,3% участников HbA1c был менее 5,7%, а у 20,7% этот показатель находился в диапазоне от 5,7 до 6,4% [16].
Вместе с тем в исследовании Y. Chen и соавт. частота стрессиндуцированной гипергликемии у пациентов с переломом бедра составила 47,9% [9]. Однако, в отличие от наших наблюдений, средний возраст участников этого исследования был 75,2 года (тогда как у нас – 36 лет), 64,5% были женщинами, 57,7% страдали артериальной гипертензией, 49,9% – ишемической болезнью сердца (или она была диагностирована у близких родственников), 37,7% были с ожирением [9].
По нашим данным в большинстве случаев отмечалось небольшое повышение концентрации глюкозы в крови и лишь у 14,3% пациентов с гипергликемией уровень глюкозы натощак превышал 8 ммоль/л. Уровень и частота гипергликемии в нашей работе были ниже, чем в анализе A. Corstjens и соавт., которые обнаружили, что 38% пациентов стационара общего профиля имели гипергликемию натощак более 7 мммоль/л или выше 11,1 ммоль/л при двух случайных определениях, а у пациентов ОРИТ в 23,3% случаев была зарегистрирована гипергликемия выше 11,1 ммоль/л [17]. Эти различия могут объясняться тем, что наши пациенты – это крепкие молодые мужчины, не имевшие до ранения соматической патологии, поэтому у них и меньший уровень глюкозы, и меньшая частота гипергликемии.
В 12-летнем исследовании долгосрочных исходов у пациентов с травмами и с гипергликемией участники с травматическими повреждениями были моложе, чаще были мужчинами и имели более низкие уровни глюкозы при поступлении, чем больные, не имевшие травм (123 и 133 мг/дл соответственно) [18]. В нашей работе средняя концентрация глюкозы в крови натощак была аналогичной и составляла 125,9 мг/дл. В вышеуказанном исследовании у пациентов с травмами гипергликемический индекс лучше коррелировал со смертностью, чем у больных без травм [18].
Время, прошедшее с момента ранения, у наших пациентов с гипергликемией составляло в среднем 13,2 дня, с нормальной концентрацией глюкозы – 16,7 дня, и эти различия были статистически достоверными. Эти данные подтверждают тот факт, что максимальный уровень глюкозы отмечается в момент стресса. Так, у здоровых прыгунов с тарзанки концентрация глюкозы и «гормонов стресса» повышалась непосредственно перед прыжком и после него, функция β-клеток поджелудочной железы снижалась непосредственно перед прыжком, а резистентность к инсулину повышалась сразу после прыжка [19]. По данным M. Plummer и соавт. максимальная частота гипергликемии у пациентов в ОРИТ регистрируется в первые 48 ч после поступления, когда до 50% этих больных имеют гипергликемию [10]. По мнению A. Laird и соавт., гипергликемия вследствие метаболического стресса проявляется в ранние сроки госпитализации больных в ОРИТ и разрешается, как только катаболические реакции затихают [20].
У наших раненых с гипергликемией отмечались более высокие показатели С-реактивного белка, лейкоцитов, нейтрофилов и фибриногена. Как было уже отмечено ранее в данной статье, синдром системного воспалительного ответа может играть важную роль в развитии стрессиндуцированной гипергликемии, а повышение уровня провоспалительных цитокинов способствует ИР и подавлению высвобождения инсулина [4, 5, 7].
По нашим наблюдениям у пациентов с гипергликемией были более высокие уровни лейкоцитов и нейтрофилов, но не тромбоцитов. В исследовании C.-S. Rau и соавт. у пациентов со стрессиндуцированной гипергликемией наблюдалось значительно большее число нейтрофилов, моноцитов и лимфоцитов по сравнению с пациентами с нормогликемией. В этом исследовании, аналогично нашим данным, также не было отмечено значительного увеличения числа тромбоцитов. Хорошо известно, что после травмы в результате системной воспалительной реакции происходит изменение числа лейкоцитов и их субпопуляций, а сразу после травмы наблюдается повышение числа и активности нейтрофилов [21]. В нашей группе пациентов с гипергликемией наблюдалась обратная корреляция между временем с момента ранения и числом лейкоцитов (r=-0,21; p=0,04), а также нейтрофилов (r=-0,21; p=0,04), однако с числом тромбоцитов никакой взаимосвязи обнаружено не было (r=0,02; p=0,85). Одновременно с увеличением числа нейтрофилов и других популяций лейкоцитов наблюдается повышение концентраций провоспалительных цитокинов [21], которые, как отмечалось ранее, способствуют гипергликемии.
В нашей работе мы использовали уравнение ADAG, которое, по мнению ряда ученых, отражает сильную корреляцию между HbA1c и средним уровнем глюкозы в крови в течение предыдущих 3 мес [15]. Кроме того, мы рассчитывали гликемический разрыв (уровень глюкозы при поступлении минус ADAG), который отражает повышение глюкозы у больных СД при возникновении критических состояний. В проведенных ранее исследованиях величина гликемического разрыва более 72 мг/дл и 80 мг/дл ассоциировалась с неблагоприятными исходами у пациентов с СД и абсцессом печени, а также у пациентов ОРИТ [22, 23]. Стоит отметить, что среди наших пациентов только у одного гликемический разрыв превышал 67 мг/дл. По мнению других авторов, коэффициент стрессиндуцированной гипергликемии (уровень глюкозы при поступлении, разделенный на HbA1c) может использоваться в качестве лучшего биомаркера критического состояния по сравнению с абсолютной гипергликемией. Даже при относительно низкой концентрации глюкозы (менее 10 ммоль/л) этот показатель способствовал выявлению пациентов с высоким риском возникновения критического состояния, причем как с гипергликемией, так и без нее [14]. В исследовании G. Roberts и соавт. средний уровень стрессиндуцированной гипергликемии составил 1,11 ммоль/л, тогда как у нас – 1,4 ммоль/л, однако в их работе 16,7% пациентов имели повышение HbA1c≥6,5%. В этой работе увеличение показателя стрессиндуцированной гипергликемии на каждые 0,1 ммоль/л приводило к повышению риска развития критического состояния на 20%. У участников этого исследования с показателем стрессиндуцированной гипергликемии более 1,14 риск критического состояния увеличивался в 2,4 раза, более 1,38 – в 3,9 раза [14]. В нашей работе только у одного пациента показатель стрессиндуцированной гипергликемии был менее 1,14, у 18 пациентов он составлял 1,15–1,38, у 12 – 1,39–1,92. Медиана показателя стрессиндуцированной гипергликемии среди наших раненых составила 1,33 (Q1–Q3: 1,26–1,42). У наших пациентов с показателем стрессиндуцированной гипергликемии выше 1,42 зарегистрированы более высокие показатели глюкозы натощак (7,6±1,3 и 6,7±0,6 ммоль/л; p=0,005), меньший HbA1c (4,8±0,5% и 5,2±0,4%; p=0,03) и средняя глюкоза по формуле ADAG (91,0±15,9 и 102,9±12,2 мг/дл; p=0,03), более высокий гликемический разрыв (46,6±11,3 и 18,5±9,5 мг/дл; p<0,000001), меньший уровень гемоглобина в общей крови (97,5±21,9 и 113,3±15,7 г/л; p=0,03), а также большая доля нейтрофилов (71,3±9,4% и 57,3±18,7%; p=0,05). Раненые в нашем исследовании с показателем стрессиндуцированной гипергликемии, соответствующим 3–4-му квартилю, были более старшего возраста (42,2±9,7 и 36,5±6,3 года; p=0,05), имели более высокий уровень глюкозы в 12 ч (7±0,7 и 5,7±1,3 ммоль/л; p=0,04), меньший HbA1c (4,8±0,5% и 5,3±0,4%; p=0,002), меньшую глюкозу по формуле ADAG (92,4±13,5 мг/дл и 106,6±10,7 мг/дл; p=0,002), более высокий гликемический разрыв (37,5±13,4 и 14,8±8,5 мг/дл; p=0,000004), а также большую долю нейтрофилов периферической крови (68,3±11,4% и 54,2±20,1%; p=0,02).
Все наши пациенты были с проникающими минно-взрывными или огнестрельными ранениями конечностей. В исследовании J. Meizoso и соавт. у умерших пациентов с травмой и гипергликемией в 4–8 раз чаще наблюдалось сочетание гипергликемии и проникающей травмы по сравнению с тупой травмой. В этом исследовании гипергликемия при поступлении свыше 150 мг/дл достоверно предсказывала смертность у пациентов с проникающей травмой и выше 200 мг/дл – с тупой [24]. В нашей работе у абсолютного большинства пациентов (у 89,5%) уровень глюкозы крови натощак был менее 150 мг/дл, у 8,4% он находился в диапазоне 150–175 мг/дл и лишь у 2,1% он превышал 200 мг/дл.
В исследовании A. Laird и соавт. ранняя гипергликемия с концентрацией глюкозы ≥200 мг/дл у пациентов с травмами ассоциировалась с значительно более высоким риском инфекционных осложнений и смертельного исхода, но такого повышения не было отмечено при более низких значениях глюкозы [20].
В нашей работе у 6 из 10 пациентов с определенным HOMA-IR этот показатель был повышен. Состояние ИР описано в разных исследованиях пациентов с различными травмами, включая ожоги. По данным ряда авторов, взрослые пациенты с травмами имели в два раза меньшее поглощение глюкозы, несмотря на гиперинсулинемию, а у детей с сильными ожогами инсулин-стимулированное поглощение глюкозы составляло только половину по сравнению со здоровыми детьми [25].
В ходе наблюдения трем нашим пациентам был поставлен диагноз впервые выявленного СД. По данным американских исследователей, ветераны боевых действий, особенно с черепно-мозговыми травмами, имеют высокий риск возникновения СД, что может быть связано с нейроэндокринными нарушениями, посттравматическим стрессовым расстройством, хронической посттравматической энцефалопатией и сидячим образом жизни [26].
Несмотря на достаточно существенные результаты, полученные в ходе настоящего исследования, в данной работе имеется ряд ограничений. Все пациенты в этом исследовании были с ранами конечностей, поэтому оценить вклад другой патологии, в первую очередь травм головного мозга, в развитие гипергликемии не представилось возможным. С учетом относительно короткого времени наблюдения за пациентами с гипергликемией в стационаре не удалось оценить ее долгосрочные исходы и более точно определить долю пациентов с полной нормализацией гликемии. По техническим причинам не удалось провести гормональное исследование катехоламинов, кортизола и глюкагона, что не позволило уточнить роль гормональных нарушений в развитии гипергликемии у раненых.
Заключение
Результаты настоящего исследования свидетельствуют о достаточно частом обнаружении гипергликемии у пациентов с боевыми травмами конечностей.В большинстве своем повышение уровня глюкозы натощак в этой группе пациентов небольшое, и у большинства раненых этот показатель нормализуется в течение относительно короткого периода времени. Наиболее часто гипергликемия регистрируется у пациентов более старшего возраста. Наше исследование закладывает основу для последующего изучения стрессиндуцированной гипергликемии у раненых и выяснения патогенетических основ этой патологии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация о финансировании. Финансирование данной работы не проводилось.
Information about funding. The study had no financial support.
Информация об авторах
Information about the authors
Тополянская Светлана Викторовна – д-р мед. наук, доц. каф. госпитальной терапии №2 ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет), ГБУЗ ГВВ №3.
E-mail: sshekshina@yandex.ru; ORCID: 0000-0002-4131-8432
Svetlana V. Topolyanskaya – Dr. Sci. (Med.), Associate Professor, Sechenov First Moscow State Medical University (Sechenov University), War Veterans Hospital No. 3.
E-mail: sshekshina@yandex.ru; ORCID: 0000-0002-4131-8432
Куржос Мария Николаевна – врач-терапевт ГБУЗ ГВВ №3.
E-mail: masha1shevchyk@gmail.com
Maria N. Kurzhos – general practitioner, War Veterans Hospital No. 3. E-mail: masha1shevchyk@gmail.com
Бубман Леонид Игоревич – врач-хирург ГБУЗ ГВВ №3.
E-mail: bubmanli@gvv3.net; ORCID: 0000-0002-4195-3188
Leonid I. Bubman – surgeon, War Veterans Hospital No. 3.
E-mail: bubmanli@gvv3.net; ORCID: 0000-0002-4195-3188
Васильева Юлия Юрьевна – врач клинико-диагностической лаб. ГБУЗ ГВВ №3. E-mail: vasilievayy@gvv3.net
Yulia Yu. Vasilyeva – doctor, War Veterans Hospital No. 3. E-mail: vasilievayy@gvv3.net
Голимбекова Мария Вячелавовна – врач-терапевт ГБУЗ ГВВ №3. E-mail: golimbekovamv@gvv3.net; ORCID: 0009-0003-6234-2807
Maria V. Golimbekova – general practitioner, War Veterans Hospital No. 3. E-mail: golimbekovamv@gvv3.net;
ORCID: 0009-0003-6234-2807
Мельникова Ксения Дмитриевна – врач-терапевт ГБУЗ ГВВ №3. E-mail: melnikovakd@gvv3.net
Ksenia D. Melnikova – general practitioner, War Veterans Hospital No. 3. E-mail: melnikovakd@gvv3.net
Колонтай Татьяна Михайловна – врач-эндокринолог ГБУЗ ГВВ №3. E-mail: kolontaitm@gvv3.net
Tatiana M. Kolontai – endocrinologist, War Veterans Hospital No. 3. E-mail: kolontaitm@gvv3.net
Пилярова Медина Халитовна – врач-гериатр ГБУЗ ГВВ №3.
E-mail: pilyarovamk@gvv3.net
Medina Kh. Pilyarova – geriatrician, War Veterans Hospital No. 3. E-mail: pilyarovamk@gvv3.net
Молочников Александр Юрьевич – зав. хирургическим отд-нием №21 ГБУЗ ГВВ №3. E-mail: molochnikovay@gvv3.net
Alexander Yu. Molochnikov – head of the Surgical Department No. 21, War Veterans Hospital No. 3.
E-mail: molochnikovay@gvv3.net
Мелик-Оганджанян Гаянэ Юрьевна – зам. глав. врача ГБУЗ ГВВ №3 по медицинской части. E-mail: nachmed@gvv3.net
Gayane Yu. Melik-Ogandjanyan – Deputy Chief doctor, War Veterans Hospital No. 3. E-mail: nachmed@gvv3.net
Лыткина Каринэ Арнольдовна – канд. мед. наук, зам. глав. врача по терапии ГБУЗ ГВВ №3. E-mail: lytkinaka@gvv3.net;
ORCID: 0000-0001-9647-7492
Karine A. Lytkina – Cand. Sci. (Med.), Deputy Chief doctor, War Veterans Hospital No. 3. E-mail: lytkinaka@gvv3.net; ORCID: 0000-0001-9647-7492
Мелконян Георгий Геннадьевич – д-р мед. наук, проф., глав. врач ГБУЗ ГВВ №3, ФГБОУ ДПО РМАНПО.
E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Georgiy G. Melkonyan – Dr. Sci. (Med.), Professor, Chief doctor, War Veterans Hospital No. 3, Russian Medical Academy of Continuous Professional Education.
E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Рачина Светлана Александровна – д-р мед. наук, проф.,
зав. каф. госпитальной терапии №2 ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет). E-mail: svetlana.ratchina@antibiotic.ru; ORCID: 0000-0002-3329-7846
Svetlana A. Rachina – Dr. Sci. (Med.), Professor, Sechenov First Moscow State Medical University (Sechenov University). E-mail: svetlana.ratchina@antibiotic.ru;
ORCID: 0000-0002-3329-7846
Поступила в редакцию: 15.04.2024
Поступила после рецензирования: 23.04.2024
Принята к публикации: 25.04.2024
Received: 15.04.2024
Revised: 23.04.2024
Accepted: 25.04.2024
Список исп. литературыСкрыть список1. Di Luzio R, Dusi R, Mazzotti A et al. Stress Hyperglycemia and Complications Following Traumatic Injuries in Individuals With/Without Diabetes: The Case of Orthopedic Surgery. Diabetes Metab Syndr Obes 2020;13:9-17. DOI: 10.2147/DMSO.S225796
2. Rau CS, Wu SC, Chen YC et al. Stress-Induced Hyperglycemia in Diabetes: A Cross-Sectional Analysis to Explore the Definition Based on the Trauma Registry Data. Int J Environ Res Public Health 2017;14(12):1527. DOI: 10.3390/ijerph14121527
3. Rugg C, Schmid S, Zipperle J, Kreutziger J. Stress hyperglycaemia following trauma – a survival benefit or an outcome detriment? Curr Opin Anaesthesiol 2024;37(2):131-8. DOI: 10.1097/ACO.000000000000 1350
4. Dungan KM, Braithwaite SS, Preiser JC. Stress hyperglycaemia. Lancet 2009;373(9677):1798-807. DOI: 10.1016/S0140-6736(09)60553-5
5. Vedantam D, Poman DS, Motwani L et al. Stress-Induced Hyperglycemia: Consequences and Management. Cureus 2022;14(7):e26714. DOI: 10.7759/cureus.26714
6. Yitshak-Sade M, Mendelson N, Novack V et al. The association between an increase in glucose levels and armed conflict-related stress: A population-based study. Sci Rep 2020;10(1):1710. DOI: 10.1038/s41598-020-58679-z
7. Shi J, Dong B, Mao Y et al. Review: Traumatic brain injury and hyperglycemia, a potentially modifiable risk factor. Oncotarget 2016;7(43):71052-61. DOI: 10.18632/oncotarget.11958
8. Zhang H, Yue K, Jiang Z et al. Incidence of Stress-Induced Hyperglycemia in Acute Ischemic Stroke: A Systematic Review and Meta-Analysis. Brain Sciences 2023;13(4):556. DOI: 10.3390/brainsci13040556
9. Chen Y, Yang X, Meng K et al. Stress-induced hyperglycemia after hip fracture and the increased risk of acute myocardial infarction in nondiabetic patients. Diabetes Care 2013;36(10):3328-32. DOI: 10.2337/dc13-0119
10. Plummer MP, Bellomo R, Cousins CE et al. Dysglycaemia in the critically ill and the interaction of chronic and acute glycaemia with mortality. Intensive Care Med 2014;40(7):973-80. DOI: 10.1007/s00134-014-3287-7
11. Rubinstein A, Koffler M, Villa Y, Graff E. The Gulf War and diabetes mellitus. Diabet Med 1993;10(8):774-6. DOI: 10.1111/j.1464-5491.1993.tb00163.x
12. Boaz M, Matas Z, Chaimy T et al. Institutional point-of-care glucometer identifies population trends in blood glucose associated with war. Diabetes Technol Ther 2013;15(11):964-7. DOI: 10.1089/dia.2013.0035
13. Nowotny B, Cavka M, Herder C et al. Effects of acute psychological stress on glucose metabolism and subclinical inflammation in patients with post-traumatic stress disorder. Horm Metab Res 2010;42(10):746-53. DOI: 10.1055/s-0030-1261924
14. Roberts GW, Quinn SJ, Valentine N et al. Relative Hyperglycemia, a Marker of Critical Illness: Introducing the Stress Hyperglycemia Ratio. J Clin Endocrinol Metab 2015;100(12):4490-7. DOI: 10.1210/jc.2015-2660
15. Nathan DM, Kuenen J, Borg R et al. A1c-Derived Average Glucose Study Group. Translating the A1C assay into estimated average glucose values. Diabetes Care 2008;31(8):1473-8. DOI: 10.2337/dc08-0545
16. Sharma J, Chittawar S, Maniram RS et al. Clinical and epidemiological study of stress hyperglycemia among medical intensive care unit patients in Central India. Indian J Endocrinol Metab 2017;21(1):137-41. DOI: 10.4103/2230-8210.196011
17. Corstjens AM, van der Horst IC, Zijlstra JG et al. Hyperglycaemia in critically ill patients: marker or mediator of mortality? Crit Care 2006;10(3):216. DOI: 10.1186/cc4957
18. Vogelzang M, Nijboer JM, van der Horst IC et al. Hyperglycemia has a stronger relation with outcome in trauma patients than in other critically ill patients. J Trauma 2006;60(4):873-7. DOI: 10.1097/01.ta. 0000195715.63978.80
19. Kruyt ND, van Westerloo DJ, DeVries JH. Stress-induced hyperglycemia in healthy bungee jumpers without diabetes due to decreased pancreatic β-cell function and increased insulin resistance. Diabetes Technol Ther 2012;14(4):311-4. DOI: 10.1089/dia.2011.0171
20. Laird AM, Miller PR, Kilgo PD et al. Relationship of early hyperglycemia to mortality in trauma patients. J Trauma 2004;56(5):1058-62. DOI: 10.1097/01.ta.0000123267.39011.9f
21. Rau C-S, Kuo SC-H, Tsai C-H et al. Elevation of White Blood Cell Subtypes in Adult Trauma Patients with Stress-Induced Hyperglycemia. Diagnostics 2023;13(22):3451. DOI: 10.3390/diagnostics13223451
22. Liao WI, Sheu WH, Chang WC et al. An elevated gap between admission and A1C-derived average glucose levels is associated with adverse outcomes in diabetic patients with pyogenic liver abscess. PLoS One 2013;8(5):e64476. DOI: 10.1371/journal.pone.0064476
23. Liao WI, Wang JC, Chang WC et al. Usefulness of Glycemic Gap to Predict ICU Mortality in Critically Ill Patients With Diabetes. Medicine (Baltimore) 2015;94(36):e1525. DOI: 10.1097/MD.000000000000 1525
24. Meizoso JP, Ray JJ, Karcutskie CA et al. Admission hyperglycemia is associated with different outcomes after blunt versus penetrating trauma. J Surg Res 2016;206(1):83-9. DOI: 10.1016/j.jss.2016.07.012
25. Cree MG, Wolfe RR. Postburn trauma insulin resistance and fat metabolism. Am J Physiol Endocrinol Metab 2008;294(1):E1-9. DOI: 10.1152/ajpendo.00562.2007
26. Saberian S, Mustroph CM, Atif F et al. Traumatic Brain Injury as a Potential Risk Factor for Diabetes Mellitus in the Veteran Population. Cureus 2022;14(7):e27296. DOI: 10.7759/cureus.27296

