Клинический разбор в общей медицине №4 2024
Клинический разбор в общей медицине №4 2024
Экспрессия ARID1a в эндометрии женщин репродуктивного возраста с аномальными маточными кровотечениями и ожирением
Номера страниц в выпуске:46-52
Аннотация
Одной из ведущих причин госпитализации женщин в гинекологический стационар являются аномальные маточные кровотечения (АМК). Ежегодный рост числа пациентов с ожирением и сочетание данного заболевания с АМК может приводить к выраженной анемизации пациенток, что крайне негативно влияет на репродуктивное здоровье нации. При рутинном патоморфологическом исследовании биоптатов эндометрия нами было зафиксировано, что у пациенток с АМК и ожирением зачастую АМК протекало на фоне наличия в эндометрии фазы десквамации (АМК-Е), в сравнении с нормовесными. Предположение, что причиной последнего может быть замедленная регенерация эндометрия на фоне хронического латентного воспаления, легло в основу настоящего исследования, целью которого была оценка экспрессии пролиферативного маркера – белка, обогащенного AT-доменом взаимодействия 1a (ARID1a), представителя семейства SWI/SNF, играющего важную роль в регуляции синтеза ДНК, транскрипции, метилирования ДНК и восстановлении повреждений ДНК в биоптатах эндометрия пациенток с АМК и ожирением, и его роли в патогенезе эндометриальной дисфункции.
Материалы и методы. В исследование включены 40 образцов эндометрия от пациенток репродуктивного возраста с АМК-Е: 20 – от пациенток с АМК-Е и ожирением (1-я группа) и 20 – от пациенток с нормальным индексом массы тела и АМК (2-группа). Десять образцов эндометрия были получены от здоровых женщин репродуктивного возраста, взятых на 2–3-й день менструального цикла. Всем пациенткам проведено гистологическое исследование по стандартной методике. На втором этапе выполнено иммуногистохимическое исследование маркера пролиферации ARID1а с использованием поликлональных кроличьих антител к Anti-ARID1а (клон EPR13501-73) в стандартном разведении (1:500) согласно протоколу производителя Abcam (Великобритания). Для статистического анализа данных использовали программу IBM SPSS Statistics v.26 (IBM Corporation, США). Для определения статистически значимых различий между количественными параметрами с нормальным распределением использовали однофакторный дисперсионный анализ (ANOVA) с расчетом 95% доверительного интервала с последующим post-hoc-тестом Геймса–Хоуэлла для множественных сравнений. Различия считали значимыми при p<0,05.
Результаты. Экспрессия ARID1а оценивалась в железистом и стромальном компартменте эндометрия. В железах эндометрия экспрессия ARID1а статистически значимо была выше в 1-й группе пациенток с ожирением по сравнению с нормовесными и контрольной группой. В строме эндометрия экспрессия пролиферативного маркера была выше в основной группе по сравнению с контрольной. Однако при межгрупповом сравнении внутри основной группы статистическая значимость в уровне экспрессии не была достигнута.
Заключение. Полученные результаты свидетельствуют о возможном патологическом влиянии ожирения на структурно-функциональные свойства эндометрия, что приводит к замедленной регенерации эндометрия за счет железистого компонента и, следовательно, к АМК-Е.
Ключевые слова: аномальное маточное кровотечение, ожирение, эндометриальная дисфункция, ARID1а.
Для цитирования: Хамошина М.Б., Толибова Г.Х., Траль Т.Г., Артеменко Ю.С. Экспрессия ARID1a в эндометрии женщин репродуктивного возраста с аномальными маточными кровотечениями и ожирением. Клинический разбор в общей медицине. 2024; 5 (4): 46–52. DOI: 10.47407/kr2024.5.4.00418
Одной из ведущих причин госпитализации женщин в гинекологический стационар являются аномальные маточные кровотечения (АМК). Ежегодный рост числа пациентов с ожирением и сочетание данного заболевания с АМК может приводить к выраженной анемизации пациенток, что крайне негативно влияет на репродуктивное здоровье нации. При рутинном патоморфологическом исследовании биоптатов эндометрия нами было зафиксировано, что у пациенток с АМК и ожирением зачастую АМК протекало на фоне наличия в эндометрии фазы десквамации (АМК-Е), в сравнении с нормовесными. Предположение, что причиной последнего может быть замедленная регенерация эндометрия на фоне хронического латентного воспаления, легло в основу настоящего исследования, целью которого была оценка экспрессии пролиферативного маркера – белка, обогащенного AT-доменом взаимодействия 1a (ARID1a), представителя семейства SWI/SNF, играющего важную роль в регуляции синтеза ДНК, транскрипции, метилирования ДНК и восстановлении повреждений ДНК в биоптатах эндометрия пациенток с АМК и ожирением, и его роли в патогенезе эндометриальной дисфункции.
Материалы и методы. В исследование включены 40 образцов эндометрия от пациенток репродуктивного возраста с АМК-Е: 20 – от пациенток с АМК-Е и ожирением (1-я группа) и 20 – от пациенток с нормальным индексом массы тела и АМК (2-группа). Десять образцов эндометрия были получены от здоровых женщин репродуктивного возраста, взятых на 2–3-й день менструального цикла. Всем пациенткам проведено гистологическое исследование по стандартной методике. На втором этапе выполнено иммуногистохимическое исследование маркера пролиферации ARID1а с использованием поликлональных кроличьих антител к Anti-ARID1а (клон EPR13501-73) в стандартном разведении (1:500) согласно протоколу производителя Abcam (Великобритания). Для статистического анализа данных использовали программу IBM SPSS Statistics v.26 (IBM Corporation, США). Для определения статистически значимых различий между количественными параметрами с нормальным распределением использовали однофакторный дисперсионный анализ (ANOVA) с расчетом 95% доверительного интервала с последующим post-hoc-тестом Геймса–Хоуэлла для множественных сравнений. Различия считали значимыми при p<0,05.
Результаты. Экспрессия ARID1а оценивалась в железистом и стромальном компартменте эндометрия. В железах эндометрия экспрессия ARID1а статистически значимо была выше в 1-й группе пациенток с ожирением по сравнению с нормовесными и контрольной группой. В строме эндометрия экспрессия пролиферативного маркера была выше в основной группе по сравнению с контрольной. Однако при межгрупповом сравнении внутри основной группы статистическая значимость в уровне экспрессии не была достигнута.
Заключение. Полученные результаты свидетельствуют о возможном патологическом влиянии ожирения на структурно-функциональные свойства эндометрия, что приводит к замедленной регенерации эндометрия за счет железистого компонента и, следовательно, к АМК-Е.
Ключевые слова: аномальное маточное кровотечение, ожирение, эндометриальная дисфункция, ARID1а.
Для цитирования: Хамошина М.Б., Толибова Г.Х., Траль Т.Г., Артеменко Ю.С. Экспрессия ARID1a в эндометрии женщин репродуктивного возраста с аномальными маточными кровотечениями и ожирением. Клинический разбор в общей медицине. 2024; 5 (4): 46–52. DOI: 10.47407/kr2024.5.4.00418
Original article
1 Patrice Lumumba People’s Friendship University of Russia, Moscow, Russia;
2 Ott Research Institute of Obstetrics, Gynecology and Reproductology, Saint Petersburg, Russia;
3 Mechnikov North-Western State Medical University, Saint Petersburg, Russia
iu.pavlova@yandex.ru
Abstract
Objective. The aim of the study was to evaluate the expression of the proliferative marker ARID1a in endometrial biopsies of patients with abnormal uterine bleeding (AUB) and obesity and its role in the pathogenesis of endometrial dysfunction.
Materials and methods. The study included 40 endometrial samples from patients of reproductive age with AUB-E: 20 from patients with AUB-E and obesity (group 1) and 20 from patients with normal body mass index (BMI) and AUB (group 2). 10 endometrial samples were obtained from healthy women of reproductive age, taken on the 2nd-3rd day of the menstrual cycle. All patients underwent histological examination according to the standard procedure. At the second stage, an immunohistochemical study of the ARID1a proliferation marker was performed using polyclonal rabbit antibodies to Anti-ARID1a (clone EPR13501-73) in standard dilution (1:500) according to the protocol of the manufacturer
Abcam (Great Britain). The IBM SPSS Statistics v.26 program (IBM Corporation, USA) was used for statistical data analysis. To determine statistically significant differences between quantitative parameters with a normal distribution, one-factor analysis of variance (ANOVA) was used with the calculation of a 95% confidence interval followed by the post-hoc Games-Howell test for multiple comparisons. The differences were considered significant at p<0.05.
Results. ARID1a expression was evaluated in the glandular and stromal compartments of the endometrium. In the endometrial glands, the expression of ARID1a was statistically significantly higher in the first group of obese patients compared with the normal and control groups. In the endometrial stroma, the expression of the proliferative marker was higher in the main group compared with the control group. However, when comparing between groups within the main group, statistical significance in the level of expression was not achieved.
Conclusion. The results obtained demonstrate the possible pathological effect of obesity on the structural and functional properties of the endometrium, which leads to delayed regeneration of the endometrium due to the glandular component and, consequently, to AUB-E.
Keywords: abnormal uterine bleeding, obesity, endometrial dysfunction, ARID1a.
For citation: Khamoshina M.B., Tolibova G.Kh., Tral T.G., Artemenko Yu.S. ARID1a expression in the endometrium of women of reproductive age with abnormal uterine bleeding and obesity. Clinical review for general practice. 2024; 5 (4): 46–52 (In Russ.). DOI: 10.47407/kr2024.5.4.00418
Существующая на сегодняшний день классификация PALM-COEIN унифицирует тактику ведения пациенток с АМК [2, 6]. Категория PALM включает структурные изменения эндометрия (АМК – P-полип; АМК-А – аденомиоз; АМК-L – лейомиома; АМК-М – злокачественные/предраковые состояния). Аббревиатура COEIN содержит заболевания, обусловленные неструктурными изменениями матки, такими как коагулопатия (АМК-C), овуляторная дисфункция (АМК-O), эндометриальные причины (АМК-E), ятрогенные причины (АМК-I) и неклассифицированные (АМК-N). На сегодняшний день активно изучаются эндометриальные причины АМК (АМК-Е), составляющие порядка 50% всех причин АМК [7] и заключающиеся в первичном заболевании эндометрия. Также на сегодняшний день неизвестно, обусловлены ли механизмы, возникающие при наличии миомы матки или аденомиоза, существующими аномалиями в эндометрии (AМК-E) или они являются вторичным эффектом из-за наличия миомы матки или аденомиоза [8].
В качестве эндометриальных причин рассматриваются нарушение регенерации эндометрия, аномальный ангиогенез, чрезмерное воспаление, дефект гипоксического ответа [9]. Перименструальный эндометрий подвержен множеству изменений, включающих отек тканей, увеличение кровотока в эндометрии, проницаемости и хрупкости сосудов, а также большой приток лейкоцитов. В совокупности это рассматривается как воспалительное явление [10]. Разрешение воспаления имеет решающее значение для ограничения повреждения эндометрия и контроля объема менструальной кровопотери.
С целью прекращения менструального кровотечения необходимы три составляющих: сужение спиральных артериол для контроля кровотока, эффективный гемостатический ответ, который восстанавливает поврежденные сосуды в функциональном слое, и своевременно произведенная реэпителизация обнаженного базального эндометрия [11]. Восстановление и регенерация эндометрия происходят за счет трех компартментов: эпителиального, стромального и сосудистого [12].
Ежегодный рост числа пациентов с избыточной массой тела и ожирением [13] и влияние их на репродуктивное здоровье женщин нацеливает на поиск возможных путей взаимосвязи данной патологии с эндометриальными причинами АМК. Ожирение зачастую рассматривается как фактор риска АМК-М и АМК-О, а также как предиктор рецидивов АМК. Влияние ожирения на эндометриальную дисфункцию изучено недостаточно. При рутинном патоморфологическом исследовании биоптатов эндометрия нами было зафиксировано, что у пациенток с ожирением зачастую АМК протекало на фоне наличия в эндометрии фазы десквамации, в сравнении с нормовесными [14]. Мы предположили, что одним из патогенетических механизмов полученных нами результатов может быть замедленная регенерация эндометрия у пациенток данной когорты.
Белок, обогащенный AT-доменом взаимодействия 1а (ARID1а), представляет собой белок семейства SWI/SNF, ремоделирующих нуклеосомы, которые, как считается, играют важную роль в регуляции синтеза ДНК, транскрипции, метилирования ДНК, восстановлении повреждений ДНК [15].
ARID1а с известной функцией супрессора опухолей был связан как с эндометриозом, так и с регуляцией восприимчивости эндометрия [16–18]. В последнее время активно изучается участие ARID1а в имплантации и поддержании беременности на ранних сроках.
В нормальных условиях ARID1а поддерживает сильную ядерную экспрессию во всех отделах матки на протяжении всего менструального цикла у женщин и на протяжении всей ранней беременности у мышей [17]. Ранее сообщалось, что удаление маточного ARID1а у мышей вызывает бесплодие из-за дефектов имплантации и децидуализации, повышенной патологической пролиферации эпителия, вызванной эстрадиолом, и снижения передачи сигналов эпителия прогестероном перед имплантацией [17].
Недостаточно изученной остается роль ARID1а в нормальной физиологии эндометрия и при доброкачественных заболеваниях. В исследовании T.H. Kim и соавт. (2015 г.) уровни ARID1а были значительно ниже как в стромальных, так и в эпителиальных клетках эндометрия у пациенток с эндометриозом в пролиферативной и секреторной фазах по сравнению с женщинами без эндометриоза [17].
Данные последних исследований демонстрируют необходимость гипоксии для своевременного прекращения менструального кровотечения [19], а чрезмерное воспаление способствует замедленной регенерации эндометрия на мышиных моделях, которые находились на диете с высоким содержанием жира [7].
Мы предположили, что высокий индекс массы тела (ИМТ) у женщин может привести к снижению пролиферативной активности эндометрия за счет формирования провоспалительного профиля, приводящего к затяжной гипоксии и, таким образом, послужить причиной АМК-Е.
Цель исследования – оценить экспрессию пролиферативного маркера ARID1а в биоптатах эндометрия пациенток с АМК и ожирением и его роль в патогенезе эндометриальной дисфункции.
Abcam (Великобритания). Визуализацию экспрессии маркера проводили на микроскопе Olympus BX46, программное обеспечение CellSens 47 Entry. Методом морфометрии определяли площадь экспрессии маркера в эндометрии (железах и строме) в программе «ВидеоТестМорфология 5.2» (Россия) на 10 микрофотографиях с каждого микропрепарата. Расчет площади экспрессии осуществляли по формуле S (%) = Sпозитив/Sобщая × 100. Для статистической обработки данных использовали пакет программ SPSS Statistics 26 (IBM Corporation, США). Для определения статистически значимых различий между количественными параметрами с нормальным распределением использовали однофакторный дисперсионный анализ (ANOVA) с расчетом 95% доверительного интервала (ДИ) с последующим post-hoc тестом Геймса–Хоуэлла для множественных сравнений. Различия считали значимыми при p<0,05.
При рутинном патоморфологическом исследовании в 1-й группе фаза десквамации отмечалась у 13 (65%) пациенток, фаза пролиферации – 5 (25%), фаза секреции – 2 (10%), во 2-й группе эндометрий фазы десквамации был зафиксирован у 9 (45%) женщин, фазы пролиферации – 8 (40%), фазы секреции – 3 (15%). В группе контроля 4 (40%) пациентки имели эндометрий фазы десквамации, 4 (40%) – фазы пролиферации и 2 (20%) – фазы секреции.
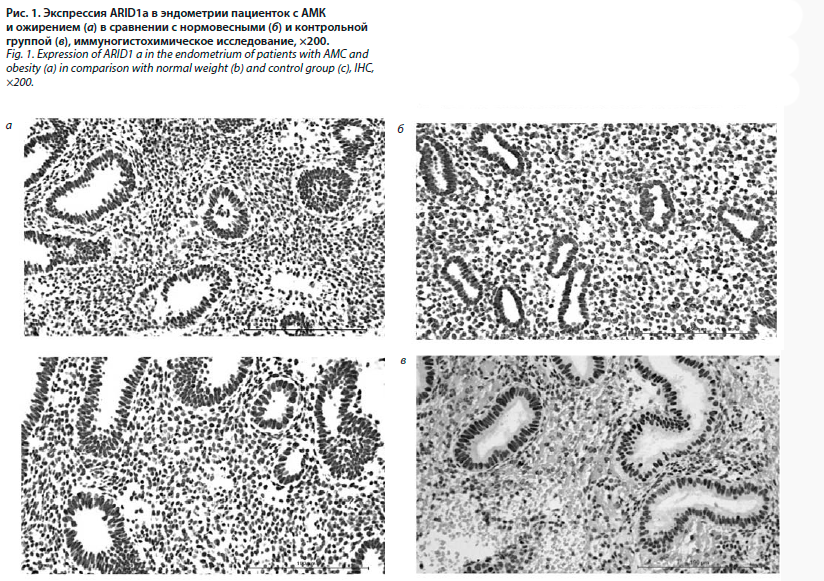
Экспрессия ARID1а верифицировалась в железах и стромальном компоненте эндометрия и имела ядерную локализацию. В эндометрии женщин с АМК и ожирением и нормовесных пациенток отмечается выраженная экспрессия ARID1а, которая локализуется в ядрах желез и стромы эндометрия. В контрольной группе диагностировано равномерное распределение экспрессии в обеих гистогенетических структурах эндометрия (рис. 1).
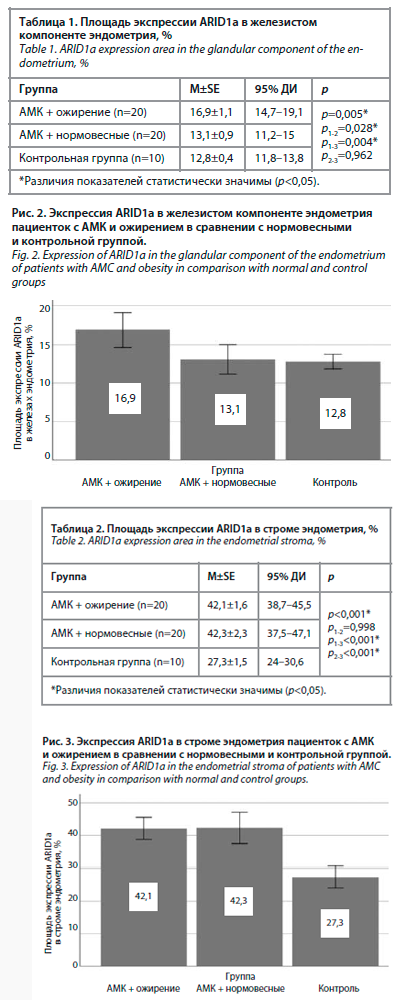 Результаты иммуногистохимического исследования показали статистически значимые различия в экспрессии ARID1а как в железистом (р=0,005), так и в стромальном компоненте эндометрия (р<0,001) между сравниваемыми группами. Данные анализа морфометрического исследования экспрессии маркера в железах эндометрия с применением статистических программ представлены в табл. 1. Экспрессия ARID1а в железах была выше у женщин с АМК и ожирением по сравнению с нормовесными и контрольной группой (рис. 2).
Результаты иммуногистохимического исследования показали статистически значимые различия в экспрессии ARID1а как в железистом (р=0,005), так и в стромальном компоненте эндометрия (р<0,001) между сравниваемыми группами. Данные анализа морфометрического исследования экспрессии маркера в железах эндометрия с применением статистических программ представлены в табл. 1. Экспрессия ARID1а в железах была выше у женщин с АМК и ожирением по сравнению с нормовесными и контрольной группой (рис. 2).
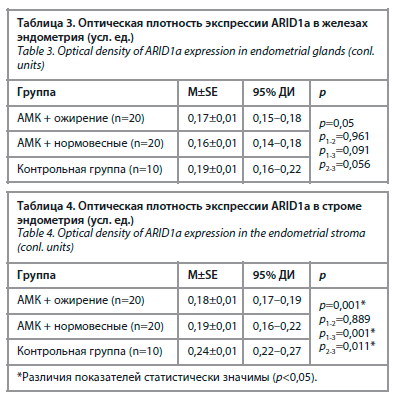
Результаты морфометрического исследования экспрессии ARID1а в стромальном компоненте эндометрия представлены в табл. 2. Статистически значимое повышение экспрессии ARID1а было обнаружено в строме эндометрия пациенток основной группы по сравнению с контрольной группой (р<0,001). Внутри основных групп значимое отличие не обнаружено (р=0,998); рис. 3.
При оценке оптической плотности экспрессии ARID1а в железах эндометрия не было зафиксировано статистически значимой разницы внутри основных групп. Аналогичные результаты были получены при сравнении с контрольной группой. Результаты оптической плотности экспрессии маркера в железах эндометрия представлены в табл. 3.
Анализ оптической плотности экспрессии ARID1а в стромальном компоненте эндометрия продемонстрировал статистически значимое ее снижение в группе пациенток с АМК и ожирением по сравнению с контрольной группой (р=0,001) и в группе пациенток с нормальным ИМТ так же по сравнению с группой контроля (р=0,011), однако при сравнении внутри основных групп значимое отличие не выявлено (табл. 4).
Жировая ткань рассматривается как эндокринный орган, участвующий во многих метаболических процессах [20]. Избыток жировой ткани приводит к формированию хронического латентного воспаления, метаболическим нарушениям, окислительному стрессу, иммунной и митохондриальной дисфункциям [21]. Основными регуляторами воспалительных реакций в жировой ткани считаются макрофаги, хотя есть исследования о роли нейтрофилов в инициации воспаления [22, 23]. Чрезмерное накопление жировой ткани в организме приводит к ее дисфункции и формированию латентного низкоуровневого воспаления ввиду избыточного синтеза провоспалительных цитокинов, таких как фактор некроза опухоли α, интерлейкин (ИЛ)-6, ИЛ-12, ИЛ-1β и др. [22].
Последние, в свою очередь, способствуют прогрессированию воспалительной реакции, увеличению количества макрофагов в жировой ткани и поддержанию их в провоспалительном состоянии [24]. Вдобавок продуцируемый жировой тканью адипокин – лептин, избыток которого отмечается у пациентов с ожирением, усиливает воспалительную реакцию и препятствует разрешению воспаления [25]. Важно отметить, что провоспалительные цитокины не только локально накапливаются в жировой ткани, но и проникают в системный кровоток, распространяясь по всему организму и вызывая воспалительные реакции в других тканях, включая органы малого таза [26].
 Активно изучается влияние ожирения на функциональную активность эндометрия с точки зрения рака эндометрия [27] и нарушения имплантационных способностей [28]. Неконтролируемый внегонадный синтез эстрогенов адипоцитами способствует развитию гиперплазии и рака эндометрия, приводя к АМК-М [29, 30]. Одними из первых, кто изучал взаимосвязь ожирения с эндометриальной дисфункцией и развитием обильной менструальной кровопотери, были
Активно изучается влияние ожирения на функциональную активность эндометрия с точки зрения рака эндометрия [27] и нарушения имплантационных способностей [28]. Неконтролируемый внегонадный синтез эстрогенов адипоцитами способствует развитию гиперплазии и рака эндометрия, приводя к АМК-М [29, 30]. Одними из первых, кто изучал взаимосвязь ожирения с эндометриальной дисфункцией и развитием обильной менструальной кровопотери, были
J.J. Reavey и соавт. (2021 г.). В своем исследовании они отметили положительную корреляцию ИМТ с менструальной кровопотерей у женщин и подтвердили, что диета с высоким содержанием жиров значительно замедляла восстановление эндометрия на мышиной модели менструации. У мышей с избыточной массой тела также наблюдалось значительное повышение уровня медиаторов воспаления в эндометрии и снижение пролиферации эпителиальных клеток эндометрия [7]. Как упоминалось выше, гипоксия играет ключевую роль в быстром восстановлении эндометрия, необходимом для ограничения менструальной кровопотери. Эта локальная гипоксия может изменять воспалительную среду, влиять на ремоделирование сосудов и модулировать пролиферацию эндометрия для оптимизации функции эндометрия [31]. Взаимодействие провоспалительных цитокинов в эндометриальной среде с гипоксической реакцией активно изучается. Роль гипоксии в стимулировании набора нейтрофилов при карциноме эндометрия была подтверждена помещением мышей в гипероксические камеры [32]. Это привело к резкому снижению притока нейтрофилов в опухоль, а также улучшило способность этих клеток противостоять росту опухоли за счет повышенной активации и экспрессии нескольких матриксных металлопротеиназ (ММП) и продукции активных форм кислорода. Возможно, что у пациенток в АМК-Е наблюдается дефект гипоксического ответа на фоне ожирения и хронического латентного воспаления, что приводит к замедлению регенерации эндометрия и профузным маточным кровотечениям.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Источники финансирования. Публикация выполнена в рамках проекта РУДН №030145-0-000.
Funding. This publication has been supported by project of RUDN University №030145-0-000.
Вклад авторов. М.Б. Хамошина – концепция и дизайн исследования;
Ю.С. Артеменко – обзор литературы, сбор и обработка материалов; Г.Х. Толибова,
Т.Г. Траль – проведение исследования; Ю.С. Артеменко, Г.Х. Толибова – статистическая обработка данных; Ю.С. Артеменко – написание текста. Все авторы внесли существенный вклад в разработку концепции, проведение исследования
и подготовку статьи, прочли и одобрили финальную версию перед публикацией.
Contribution of the authors. M.B. Khamoshina – concept and design of the study; Yu.S. Artemenko – literature review, collection and processing of materials; G.H. Tolibova, T.G. Tral – conducting research; Yu.S. Artemenko, G.H. Tolibova – statistical data processing; Yu.S. Artemenko – text writing. All the authors made a significant contribution to the development of the concept, research and preparation of the article, read and approved the final version before publication.
Информация об авторах
Information about the authors
Хамошина Марина Борисовна – д-р мед. наук, проф., проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН.
Е-mail: khamoshina@mail.ru; ORCID:0000-0003-1940-4534
Marina B. Khamoshina – Dr. Sci. (Med.), Professor,
Patrice Lumumba People’s Friendship University of Russia.
Е-mail: khamoshina@mail.ru; ORCID: 0000-0003-1940-4534
Толибова Гулрухсор Хайбуллоевна – д-р мед. наук, вед. науч. сотр., зав. отд. патоморфологии ФГБНУ «НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта», доц. каф. акушерства и гинекологии им. С.Н. Давыдова ФГБОУ ВО «СЗГМУ им. И.И. Мечникова». E-mail: gulyatolibova@yandex.ru;
ORCID: 0000-0002-6216-6220
Gulrukhsor Kh. Tolibova – Dr. Sci. (Med.), Head of the Pathomorphology Department, Ott Research Institute of Obstetrics, Gynecology and Reproductology; Associate Professor, Mechnikov North-Western State Medical University.
E-mail: gulyatolibova@yandex.ru;
ORCID: 0000-0002-6216-6220
Траль Татьяна Георгиевна – канд. мед. наук, зав. лаб. иммуногистохимии патологоанатомического отделения ФГБНУ «НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта». E-mail: ttg.tral@yandex.ru; ORCID: 0000-0001-8948-4811
Tatyana G. Tral – Cand. Sci. (Med.), Head of the Laboratory of Immunohistochemistry, Ott Research Institute of Obstetrics, Gynecology and Reproductology. E-mail: ttg.tral@yandex.ru; ORCID: 0000-0001-8948-4811
Артеменко Юлия Сергеевна – аспирант каф. акушерства
и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. E-mail: iu.pavlova@yandex.ru;
ORCID: 0000-0003-2116-1420
Yulia S. Artemenko – Graduate Student, Patrice Lumumba People’s Friendship University of Russia.
E-mail: iu.pavlova@yandex.ru; ORCID: 0000-0003-2116-1420
Поступила в редакцию: 17.03.2024
Поступила после рецензирования: 26.03.2024
Принята к публикации: 28.03.2024
Received: 17.03.2024
Revised: 26.03.2024
Accepted: 28.03.2024
ARID1a expression in the endometrium of women of reproductive age with abnormal uterine bleeding and obesity
Marina B. Khamoshina1, Gulrukhsor Kh. Tolibova2,3, Tatyana G. Tral2, Yulia S. Artemenko11 Patrice Lumumba People’s Friendship University of Russia, Moscow, Russia;
2 Ott Research Institute of Obstetrics, Gynecology and Reproductology, Saint Petersburg, Russia;
3 Mechnikov North-Western State Medical University, Saint Petersburg, Russia
iu.pavlova@yandex.ru
Abstract
Objective. The aim of the study was to evaluate the expression of the proliferative marker ARID1a in endometrial biopsies of patients with abnormal uterine bleeding (AUB) and obesity and its role in the pathogenesis of endometrial dysfunction.
Materials and methods. The study included 40 endometrial samples from patients of reproductive age with AUB-E: 20 from patients with AUB-E and obesity (group 1) and 20 from patients with normal body mass index (BMI) and AUB (group 2). 10 endometrial samples were obtained from healthy women of reproductive age, taken on the 2nd-3rd day of the menstrual cycle. All patients underwent histological examination according to the standard procedure. At the second stage, an immunohistochemical study of the ARID1a proliferation marker was performed using polyclonal rabbit antibodies to Anti-ARID1a (clone EPR13501-73) in standard dilution (1:500) according to the protocol of the manufacturer
Abcam (Great Britain). The IBM SPSS Statistics v.26 program (IBM Corporation, USA) was used for statistical data analysis. To determine statistically significant differences between quantitative parameters with a normal distribution, one-factor analysis of variance (ANOVA) was used with the calculation of a 95% confidence interval followed by the post-hoc Games-Howell test for multiple comparisons. The differences were considered significant at p<0.05.
Results. ARID1a expression was evaluated in the glandular and stromal compartments of the endometrium. In the endometrial glands, the expression of ARID1a was statistically significantly higher in the first group of obese patients compared with the normal and control groups. In the endometrial stroma, the expression of the proliferative marker was higher in the main group compared with the control group. However, when comparing between groups within the main group, statistical significance in the level of expression was not achieved.
Conclusion. The results obtained demonstrate the possible pathological effect of obesity on the structural and functional properties of the endometrium, which leads to delayed regeneration of the endometrium due to the glandular component and, consequently, to AUB-E.
Keywords: abnormal uterine bleeding, obesity, endometrial dysfunction, ARID1a.
For citation: Khamoshina M.B., Tolibova G.Kh., Tral T.G., Artemenko Yu.S. ARID1a expression in the endometrium of women of reproductive age with abnormal uterine bleeding and obesity. Clinical review for general practice. 2024; 5 (4): 46–52 (In Russ.). DOI: 10.47407/kr2024.5.4.00418
Введение
В настоящее время отмечается рост числа пациенток с аномальными маточными кровотечениями (АМК). Согласно данным мировой статистики, каждая третья пациентка репродуктивного возраста сталкивается хотя бы раз в жизни с симптомами АМК [1, 2]. В России этот показатель составляет 30% и достигает 70% в перименопаузальном периоде [3]. АМК определяется как кровотечение, чрезмерное по длительности (более 8 дней), объему (более 80 мл) и/или частоте (менее 24 дней) [2]. Негативное влияние АМК на физическое, социальное, эмоциональное [4] и материальное качество жизни женщины, а также увеличение риска преждевременной смерти [5] приумножает значимость данного заболевания.Существующая на сегодняшний день классификация PALM-COEIN унифицирует тактику ведения пациенток с АМК [2, 6]. Категория PALM включает структурные изменения эндометрия (АМК – P-полип; АМК-А – аденомиоз; АМК-L – лейомиома; АМК-М – злокачественные/предраковые состояния). Аббревиатура COEIN содержит заболевания, обусловленные неструктурными изменениями матки, такими как коагулопатия (АМК-C), овуляторная дисфункция (АМК-O), эндометриальные причины (АМК-E), ятрогенные причины (АМК-I) и неклассифицированные (АМК-N). На сегодняшний день активно изучаются эндометриальные причины АМК (АМК-Е), составляющие порядка 50% всех причин АМК [7] и заключающиеся в первичном заболевании эндометрия. Также на сегодняшний день неизвестно, обусловлены ли механизмы, возникающие при наличии миомы матки или аденомиоза, существующими аномалиями в эндометрии (AМК-E) или они являются вторичным эффектом из-за наличия миомы матки или аденомиоза [8].
В качестве эндометриальных причин рассматриваются нарушение регенерации эндометрия, аномальный ангиогенез, чрезмерное воспаление, дефект гипоксического ответа [9]. Перименструальный эндометрий подвержен множеству изменений, включающих отек тканей, увеличение кровотока в эндометрии, проницаемости и хрупкости сосудов, а также большой приток лейкоцитов. В совокупности это рассматривается как воспалительное явление [10]. Разрешение воспаления имеет решающее значение для ограничения повреждения эндометрия и контроля объема менструальной кровопотери.
С целью прекращения менструального кровотечения необходимы три составляющих: сужение спиральных артериол для контроля кровотока, эффективный гемостатический ответ, который восстанавливает поврежденные сосуды в функциональном слое, и своевременно произведенная реэпителизация обнаженного базального эндометрия [11]. Восстановление и регенерация эндометрия происходят за счет трех компартментов: эпителиального, стромального и сосудистого [12].
Ежегодный рост числа пациентов с избыточной массой тела и ожирением [13] и влияние их на репродуктивное здоровье женщин нацеливает на поиск возможных путей взаимосвязи данной патологии с эндометриальными причинами АМК. Ожирение зачастую рассматривается как фактор риска АМК-М и АМК-О, а также как предиктор рецидивов АМК. Влияние ожирения на эндометриальную дисфункцию изучено недостаточно. При рутинном патоморфологическом исследовании биоптатов эндометрия нами было зафиксировано, что у пациенток с ожирением зачастую АМК протекало на фоне наличия в эндометрии фазы десквамации, в сравнении с нормовесными [14]. Мы предположили, что одним из патогенетических механизмов полученных нами результатов может быть замедленная регенерация эндометрия у пациенток данной когорты.
Белок, обогащенный AT-доменом взаимодействия 1а (ARID1а), представляет собой белок семейства SWI/SNF, ремоделирующих нуклеосомы, которые, как считается, играют важную роль в регуляции синтеза ДНК, транскрипции, метилирования ДНК, восстановлении повреждений ДНК [15].
ARID1а с известной функцией супрессора опухолей был связан как с эндометриозом, так и с регуляцией восприимчивости эндометрия [16–18]. В последнее время активно изучается участие ARID1а в имплантации и поддержании беременности на ранних сроках.
В нормальных условиях ARID1а поддерживает сильную ядерную экспрессию во всех отделах матки на протяжении всего менструального цикла у женщин и на протяжении всей ранней беременности у мышей [17]. Ранее сообщалось, что удаление маточного ARID1а у мышей вызывает бесплодие из-за дефектов имплантации и децидуализации, повышенной патологической пролиферации эпителия, вызванной эстрадиолом, и снижения передачи сигналов эпителия прогестероном перед имплантацией [17].
Недостаточно изученной остается роль ARID1а в нормальной физиологии эндометрия и при доброкачественных заболеваниях. В исследовании T.H. Kim и соавт. (2015 г.) уровни ARID1а были значительно ниже как в стромальных, так и в эпителиальных клетках эндометрия у пациенток с эндометриозом в пролиферативной и секреторной фазах по сравнению с женщинами без эндометриоза [17].
Данные последних исследований демонстрируют необходимость гипоксии для своевременного прекращения менструального кровотечения [19], а чрезмерное воспаление способствует замедленной регенерации эндометрия на мышиных моделях, которые находились на диете с высоким содержанием жира [7].
Мы предположили, что высокий индекс массы тела (ИМТ) у женщин может привести к снижению пролиферативной активности эндометрия за счет формирования провоспалительного профиля, приводящего к затяжной гипоксии и, таким образом, послужить причиной АМК-Е.
Цель исследования – оценить экспрессию пролиферативного маркера ARID1а в биоптатах эндометрия пациенток с АМК и ожирением и его роль в патогенезе эндометриальной дисфункции.
Материалы и методы
В наше исследование были включены 40 биоптатов эндометрия, взятых во время маточного кровотечения, пациенток с верифицированным диагнозом АМК, относящегося к категории АМК-Е. В зависимости от наличия ожирения пациентки были стратифицированы на две группы: 1-я группа (n=20) включала пациенток с ожирением (ИМТ≥30 кг/м2), 2-я группа (n=20) – нормовесных пациенток (ИМТ 18,5–24,9 кг/м2). В качестве группы контроля (n=10) были взяты биоптаты эндометрия от здоровых женщин репродуктивного возраста на 2–3-й день менструального цикла. Каждая пациентка дала добровольное информированное согласие на участие в исследовании. Фиксация полученного материала проводилась в 10% нейтральном формалине с последующим обезвоживанием в спиртах нарастающей концентрации. Срезы толщиной 3–4 мкм изготавливали после заливки материала парафином. Далее проводились депарафинирование срезов и окрашивание препарата гематоксилином и эозином. При световой микроскопии (увеличение ×100, ×200, ×400) оценивали структуру железистого и стромального компонента и его соответствие фазе цикла. Иммуногистохимическое исследование (НИИ АГиР им. Д.О. Отта, патологоанатомическое отделение с лабораторией иммуногистохимии, заведующая отделением – Г.Х. Толибова, заведующая лабораторией – Т.Г. Траль) проводили на парафиновых срезах. Для проведения иммуногистохимической реакции использовали одноэтапный протокол с демаскировкой антигена. Оценку экспрессии ARID1а проводили с использованием первичных поликлональных кроличьих антител к Anti-ARID1a (клон EPR13501-73) в стандартном разведении (1:500) производстваAbcam (Великобритания). Визуализацию экспрессии маркера проводили на микроскопе Olympus BX46, программное обеспечение CellSens 47 Entry. Методом морфометрии определяли площадь экспрессии маркера в эндометрии (железах и строме) в программе «ВидеоТестМорфология 5.2» (Россия) на 10 микрофотографиях с каждого микропрепарата. Расчет площади экспрессии осуществляли по формуле S (%) = Sпозитив/Sобщая × 100. Для статистической обработки данных использовали пакет программ SPSS Statistics 26 (IBM Corporation, США). Для определения статистически значимых различий между количественными параметрами с нормальным распределением использовали однофакторный дисперсионный анализ (ANOVA) с расчетом 95% доверительного интервала (ДИ) с последующим post-hoc тестом Геймса–Хоуэлла для множественных сравнений. Различия считали значимыми при p<0,05.
Результаты
Средний возраст пациенток 1-й группы составил 36,2±8,8 года (95% ДИ 32,0–40,5), 2-й группы – 35±9,1 года (95% ДИ 30,6–39,3), группы контроля – 32,5±7,9 года (95% ДИ 26,9–38,2), p=0,56.При рутинном патоморфологическом исследовании в 1-й группе фаза десквамации отмечалась у 13 (65%) пациенток, фаза пролиферации – 5 (25%), фаза секреции – 2 (10%), во 2-й группе эндометрий фазы десквамации был зафиксирован у 9 (45%) женщин, фазы пролиферации – 8 (40%), фазы секреции – 3 (15%). В группе контроля 4 (40%) пациентки имели эндометрий фазы десквамации, 4 (40%) – фазы пролиферации и 2 (20%) – фазы секреции.
Экспрессия ARID1а верифицировалась в железах и стромальном компоненте эндометрия и имела ядерную локализацию. В эндометрии женщин с АМК и ожирением и нормовесных пациенток отмечается выраженная экспрессия ARID1а, которая локализуется в ядрах желез и стромы эндометрия. В контрольной группе диагностировано равномерное распределение экспрессии в обеих гистогенетических структурах эндометрия (рис. 1).

 Результаты иммуногистохимического исследования показали статистически значимые различия в экспрессии ARID1а как в железистом (р=0,005), так и в стромальном компоненте эндометрия (р<0,001) между сравниваемыми группами. Данные анализа морфометрического исследования экспрессии маркера в железах эндометрия с применением статистических программ представлены в табл. 1. Экспрессия ARID1а в железах была выше у женщин с АМК и ожирением по сравнению с нормовесными и контрольной группой (рис. 2).
Результаты иммуногистохимического исследования показали статистически значимые различия в экспрессии ARID1а как в железистом (р=0,005), так и в стромальном компоненте эндометрия (р<0,001) между сравниваемыми группами. Данные анализа морфометрического исследования экспрессии маркера в железах эндометрия с применением статистических программ представлены в табл. 1. Экспрессия ARID1а в железах была выше у женщин с АМК и ожирением по сравнению с нормовесными и контрольной группой (рис. 2).Результаты морфометрического исследования экспрессии ARID1а в стромальном компоненте эндометрия представлены в табл. 2. Статистически значимое повышение экспрессии ARID1а было обнаружено в строме эндометрия пациенток основной группы по сравнению с контрольной группой (р<0,001). Внутри основных групп значимое отличие не обнаружено (р=0,998); рис. 3.
При оценке оптической плотности экспрессии ARID1а в железах эндометрия не было зафиксировано статистически значимой разницы внутри основных групп. Аналогичные результаты были получены при сравнении с контрольной группой. Результаты оптической плотности экспрессии маркера в железах эндометрия представлены в табл. 3.
Анализ оптической плотности экспрессии ARID1а в стромальном компоненте эндометрия продемонстрировал статистически значимое ее снижение в группе пациенток с АМК и ожирением по сравнению с контрольной группой (р=0,001) и в группе пациенток с нормальным ИМТ так же по сравнению с группой контроля (р=0,011), однако при сравнении внутри основных групп значимое отличие не выявлено (табл. 4).
Обсуждение
В настоящем исследовании нами было обнаружено, что ожирение может способствовать замедленной регенерации эндометрия за счет его железистого компонента, что в итоге приводит к профузным АМК без структурных причин.Жировая ткань рассматривается как эндокринный орган, участвующий во многих метаболических процессах [20]. Избыток жировой ткани приводит к формированию хронического латентного воспаления, метаболическим нарушениям, окислительному стрессу, иммунной и митохондриальной дисфункциям [21]. Основными регуляторами воспалительных реакций в жировой ткани считаются макрофаги, хотя есть исследования о роли нейтрофилов в инициации воспаления [22, 23]. Чрезмерное накопление жировой ткани в организме приводит к ее дисфункции и формированию латентного низкоуровневого воспаления ввиду избыточного синтеза провоспалительных цитокинов, таких как фактор некроза опухоли α, интерлейкин (ИЛ)-6, ИЛ-12, ИЛ-1β и др. [22].
Последние, в свою очередь, способствуют прогрессированию воспалительной реакции, увеличению количества макрофагов в жировой ткани и поддержанию их в провоспалительном состоянии [24]. Вдобавок продуцируемый жировой тканью адипокин – лептин, избыток которого отмечается у пациентов с ожирением, усиливает воспалительную реакцию и препятствует разрешению воспаления [25]. Важно отметить, что провоспалительные цитокины не только локально накапливаются в жировой ткани, но и проникают в системный кровоток, распространяясь по всему организму и вызывая воспалительные реакции в других тканях, включая органы малого таза [26].
 Активно изучается влияние ожирения на функциональную активность эндометрия с точки зрения рака эндометрия [27] и нарушения имплантационных способностей [28]. Неконтролируемый внегонадный синтез эстрогенов адипоцитами способствует развитию гиперплазии и рака эндометрия, приводя к АМК-М [29, 30]. Одними из первых, кто изучал взаимосвязь ожирения с эндометриальной дисфункцией и развитием обильной менструальной кровопотери, были
Активно изучается влияние ожирения на функциональную активность эндометрия с точки зрения рака эндометрия [27] и нарушения имплантационных способностей [28]. Неконтролируемый внегонадный синтез эстрогенов адипоцитами способствует развитию гиперплазии и рака эндометрия, приводя к АМК-М [29, 30]. Одними из первых, кто изучал взаимосвязь ожирения с эндометриальной дисфункцией и развитием обильной менструальной кровопотери, были J.J. Reavey и соавт. (2021 г.). В своем исследовании они отметили положительную корреляцию ИМТ с менструальной кровопотерей у женщин и подтвердили, что диета с высоким содержанием жиров значительно замедляла восстановление эндометрия на мышиной модели менструации. У мышей с избыточной массой тела также наблюдалось значительное повышение уровня медиаторов воспаления в эндометрии и снижение пролиферации эпителиальных клеток эндометрия [7]. Как упоминалось выше, гипоксия играет ключевую роль в быстром восстановлении эндометрия, необходимом для ограничения менструальной кровопотери. Эта локальная гипоксия может изменять воспалительную среду, влиять на ремоделирование сосудов и модулировать пролиферацию эндометрия для оптимизации функции эндометрия [31]. Взаимодействие провоспалительных цитокинов в эндометриальной среде с гипоксической реакцией активно изучается. Роль гипоксии в стимулировании набора нейтрофилов при карциноме эндометрия была подтверждена помещением мышей в гипероксические камеры [32]. Это привело к резкому снижению притока нейтрофилов в опухоль, а также улучшило способность этих клеток противостоять росту опухоли за счет повышенной активации и экспрессии нескольких матриксных металлопротеиназ (ММП) и продукции активных форм кислорода. Возможно, что у пациенток в АМК-Е наблюдается дефект гипоксического ответа на фоне ожирения и хронического латентного воспаления, что приводит к замедлению регенерации эндометрия и профузным маточным кровотечениям.
Выводы
Таким образом, влияние ожирения на функцию эндометрия, вероятно, многофакторно. Можно предположить, что формирование и прогрессирование провоспалительного профиля у пациентов с ожирением способствует вовлечению в воспалительный процесс ткани эндометрия и потере ее функциональной активности. Наше исследование демонстрирует новые доказательства влияния ожирения на маточную кровопотерю, экспрессия ARID1а в железистом компартменте у пациенток с АМК и ожирением была выше, что предполагает замедленное восстановление и регенерацию эндометриальной ткани, а также снижение пролиферативной активности и длительное кровотечение. Новые пути патогенеза эндометриальных причин при АМК позволяют расширить терапевтические и профилактические возможности, направленные на снижение частоты рецидивов данного заболевания.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Источники финансирования. Публикация выполнена в рамках проекта РУДН №030145-0-000.
Funding. This publication has been supported by project of RUDN University №030145-0-000.
Вклад авторов. М.Б. Хамошина – концепция и дизайн исследования;
Ю.С. Артеменко – обзор литературы, сбор и обработка материалов; Г.Х. Толибова,
Т.Г. Траль – проведение исследования; Ю.С. Артеменко, Г.Х. Толибова – статистическая обработка данных; Ю.С. Артеменко – написание текста. Все авторы внесли существенный вклад в разработку концепции, проведение исследования
и подготовку статьи, прочли и одобрили финальную версию перед публикацией.
Contribution of the authors. M.B. Khamoshina – concept and design of the study; Yu.S. Artemenko – literature review, collection and processing of materials; G.H. Tolibova, T.G. Tral – conducting research; Yu.S. Artemenko, G.H. Tolibova – statistical data processing; Yu.S. Artemenko – text writing. All the authors made a significant contribution to the development of the concept, research and preparation of the article, read and approved the final version before publication.
Информация об авторах
Information about the authors
Хамошина Марина Борисовна – д-р мед. наук, проф., проф. каф. акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН.
Е-mail: khamoshina@mail.ru; ORCID:0000-0003-1940-4534
Marina B. Khamoshina – Dr. Sci. (Med.), Professor,
Patrice Lumumba People’s Friendship University of Russia.
Е-mail: khamoshina@mail.ru; ORCID: 0000-0003-1940-4534
Толибова Гулрухсор Хайбуллоевна – д-р мед. наук, вед. науч. сотр., зав. отд. патоморфологии ФГБНУ «НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта», доц. каф. акушерства и гинекологии им. С.Н. Давыдова ФГБОУ ВО «СЗГМУ им. И.И. Мечникова». E-mail: gulyatolibova@yandex.ru;
ORCID: 0000-0002-6216-6220
Gulrukhsor Kh. Tolibova – Dr. Sci. (Med.), Head of the Pathomorphology Department, Ott Research Institute of Obstetrics, Gynecology and Reproductology; Associate Professor, Mechnikov North-Western State Medical University.
E-mail: gulyatolibova@yandex.ru;
ORCID: 0000-0002-6216-6220
Траль Татьяна Георгиевна – канд. мед. наук, зав. лаб. иммуногистохимии патологоанатомического отделения ФГБНУ «НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта». E-mail: ttg.tral@yandex.ru; ORCID: 0000-0001-8948-4811
Tatyana G. Tral – Cand. Sci. (Med.), Head of the Laboratory of Immunohistochemistry, Ott Research Institute of Obstetrics, Gynecology and Reproductology. E-mail: ttg.tral@yandex.ru; ORCID: 0000-0001-8948-4811
Артеменко Юлия Сергеевна – аспирант каф. акушерства
и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. E-mail: iu.pavlova@yandex.ru;
ORCID: 0000-0003-2116-1420
Yulia S. Artemenko – Graduate Student, Patrice Lumumba People’s Friendship University of Russia.
E-mail: iu.pavlova@yandex.ru; ORCID: 0000-0003-2116-1420
Поступила в редакцию: 17.03.2024
Поступила после рецензирования: 26.03.2024
Принята к публикации: 28.03.2024
Received: 17.03.2024
Revised: 26.03.2024
Accepted: 28.03.2024
Список исп. литературыСкрыть список1. Heavy menstrual bleeding: assessment and management. London: National Institute for Health and Care Excellence (NICE), May 24, 2018.
2. Munro MG, Critchley HOD, Fraser IS; FIGO Menstrual Disorders Committee. The two FIGO systems for normal and abnormal uterine bleeding symptoms and classification of causes of abnormal uterine bleeding in the reproductive years: 2018 revisions. Int J Gynaecol Obstet. 2018;143(3):393-408. DOI:10.1002/ijgo.12666
3. Аномальные маточные кровотечения. Клинические рекомендации. Минздрав России. М., 2021. Дата обращения: 12.03.2024. URL: https://cr.minzdrav.gov.ru/recomend/645_1
Abnormal uterine bleeding. Clinical recommendations Ministry of Health of the Russian Federation. Moscow, 2021. URL: https://cr. minzdrav.gov.ru/recomend/645_1. Date of application: 12.03.2024 (in Russian).
4. Dutton B, Kai J. Women’s experiences of heavy menstrual bleeding and medical treatment: a qualitative study in primary care. Br J Gen Pract. 2023;73(729):e294-e301. DOI: 10.3399/BJGP.2022.0460
5. Wang YX, Arvizu M, Rich-Edwards JW et al. Menstrual cycle regularity and length across the reproductive lifespan and risk of premature mortality: prospective cohort study. BMJ. 2020;371:m3464. DOI: 10.1136/bmj.m3464
6. Munro MG, Critchley HO, Broder MS, Fraser IS. FIGO classification system (PALM- COEIN) for causes of abnormal uterine bleeding in nongravid women of reproductive age. Int J Gynaecol Obstet. 2011;113:3-13. DOI:10.1016/j.ijgo.2010.11.011
7. Reavey JJ, Walker C, Murray AA et al. Obesity is associated with heavy menstruation that may be due to delayed endometrial repair. J Endocrinol. 2021;249(2):71-82. DOI: 10.1530/JOE-20-0446
8. Vannuccini S, Jain V, Critchley H, Petraglia F. From menarche to menopause, heavy menstrual bleeding is the underrated compass in reproductive health. Fertil Steril. 2022;118(4):625-36. DOI:10.1016/ j.fertnstert.2022.07.021
9. Critchley HOD, Babayev E, Bulun SE et al. Menstruation: science and Society. Am J Obstet Gynecol. 2020;223:624-64. DOI: 10.1016/ j.ajog.2020.06.004
10. Armstrong GM, Maybin JA, Murray AA et al. Endometrial apoptosis and neutrophil infiltration during menstruation exhibits spatial and temporal dynamics that are recapitulated in a mouse model. Sci Rep. 2017;7(1):17416. DOI: 10.1038/s41598-017-17565-x
11. Jain V, Chodankar RR, Maybin JA, Critchley HOD. Uterine bleeding: how understanding endometrial physiology underpins menstrual health. Nat Rev Endocrinol. 2022;18(5):290-308. DOI: 10.1038 /s41574-021-00629-4
12. Salamonsen LA, Hutchison JC, Gargett CE. Cyclical endometrial repair and regeneration. Development. 2021;148(17):dev199577. DOI: 10.1242/dev.199577
13. Алферова В.И., Мустафина С.В. Распространенность ожирения во взрослой популяции Российской Федерации (обзор литературы). Ожирение и метаболизм. 2022;19(1):96-105. DOI: 10.14341/ omet12809
Alferova V.I., Mustafina S.V. The prevalence of obesity in the adult population of the Russian Federation (literature review). Obesity and metabolism. 2022;19(1):96-105. DOI: 10.14341/omet12809 (in Russian).
14. Артеменко Ю.С., Хамошина М.Б., Петренко Н.В., Демина О.А. Патоморфологические особенности эндометрия при аномальных маточных кровотечениях у пациенток репродуктивного возраста с ожирением. Акушерство и гинекология: новости, мнения, обучение. 2023;11(Спецвыпуск):36-41. DOI: 10.33029/2303-9698-2023-11-suppl-36-41
Artemenko Y.S., Khamoshina M.B., Petrenko N.V., Demina О.А. Pathomorphological features of endometrium in abnormal uterine bleeding in obese patients of reproductive age. Akusherstvo i ginekologiya: novosti, mneniya, obuchenie = Obstetrics and Gynecology: News, Opinions, Training. 2023;11(Supplement):36–41. DOI: 10.33029/ 2303-9698-2023-11-suppl-36-41 (in Russian).
15. Ayhan A, Mao TL, Suryo Rahmanto Y et al. Increased proliferation in atypical hyperplasia/endometrioid intraepithelial neoplasia of the endometrium with concurrent inactivation of ARID1A and PTEN tumour suppressors. J Pathol Clin. Res. 2015;1(3):186-93. DOI: 10.1002/ cjp2.22
16. Mathur R. ARID1A loss in cancer: Towards a mechanistic understanding. Pharmacol Ther. 2018;190:15-23. DOI: 10.1016/j.pharmthera. 2018.05.001
17. Kim TH, Yoo JY, Wang Z et al. ARID1A Is Essential for Endometrial Function during Early Pregnancy. PLoS Genet. 2015;11(9):e1005537. DOI: 10.1371/journal.pgen.1005537
18. Anglesio MS, Papadopoulos N, Ayhan A et al. Cancer-Associated Mutations in Endometriosis without Cancer. N Engl J Med. 2017;376(19):1835-48. DOI: 10.1056/NEJMoa1614814
19. Maybin JA, Murray AA, Saunders PTK et al. Hypoxia and hypoxia inducible factor-1α are required for normal endometrial repair during menstruation. Nat Commun. 2018;9(1):295. DOI: 10.1038/s41467-017-02375-6
20. Ouchi N, Parker JL, Lugus JJ, Walsh K. Adipokines in inflammation and metabolic disease. Nat Rev Immunol. 2011;11(2):85-97. DOI: 10.1038/nri2921
21. Pararasa C, Bailey CJ, Griffiths HR. Ageing, adipose tissue, fatty acids and inflammation. Biogerontology. 2015;16(2):235-48. DOI: 10.1007/s10522-014-9536-x
22. Murray PJ, Allen JE, Biswas SK et al. Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity. 2014;41(1):14-20. DOI: 10.1016/j.immuni.2014.06.008
23. Uribe-Querol E, Rosales C. Neutrophils Actively Contribute to Obesity-Associated Inflammation and Pathological Complications. Cells. 2022;11(12):1883. DOI: 10.3390/cells11121883
24. Thomas D, Apovian C. Macrophage functions in lean and obese adipose tissue. Metabolism. 2017;72:120-43. DOI: 10.1016/j.metabol.2017.04.005
25. Santander AM, Lopez-Ocejo O, Casas O et al. Paracrine Interactions between Adipocytes and Tumor Cells Recruit and Modify Macrophages to the Mammary Tumor Microenvironment: The Role of Obesity and Inflammation in Breast Adipose Tissue. Cancers (Basel). 2015;7(1):143-78. DOI: 10.3390/cancers7010143
26. Nteeba J, Ortinau LC, Perfield JW, Keating AF. Diet-induced obesity alters immune cell infiltration and expression of inflammatory cytokine genes in mouse ovarian and peri-ovarian adipose depot tissues. Mol Reprod Dev. 2013;80(11):948-58. DOI: 10.1002/mrd.22231
27. MacKintosh ML, Derbyshire AE, McVey RJ et al. The impact of obesity and bariatric surgery on circulating and tissue biomarkers of endometrial cancer risk. Int J Cancer. 2019;144(3):641-50. DOI: 10.1002/ ijc.31913
28. Silvestris E, de Pergola G, Rosania R, Loverro G. Obesity as disruptor of the female fertility. Reprod Biol Endocrinol. 2018;16(1):22. DOI: 10.1186/s12958-018-0336-z
29. Onstad MA, Schmandt RE, Lu KH. Addressing the Role of Obesity in Endometrial Cancer Risk, Prevention, and Treatment. J Clin Oncol. 2016;34(35):4225-30. DOI: 10.1200/JCO.2016.69.4638
30. Thrastardottir TO, Copeland VJ, Constantinou C. The Association Between Nutrition, Obesity, Inflammation, and Endometrial Cancer: A Scoping Review. Curr Nutr Rep. 2023;12(1):98-121. DOI: 10.1007/ s13668-022-00447-8
31. Martínez-Aguilar R, Kershaw LE, Reavey JJ et al. HYPOXIA AND REPRODUCTIVE HEALTH: The presence and role of hypoxia in the endometrium. Reproduction. 2021;161(1):F1-F17. DOI: 10.1530/REP-20-0268
32. Mahiddine K, Blaisdell A, Ma S et al. Relief of tumor hypoxia unleashes the tumoricidal potential of neutrophils. J Clin Invest. 2020;130(1): 389-403. DOI: 10.1172/JCI130952

