Клинический разбор в общей медицине №6 2024
Аннотация
Цель. Представить клиническое наблюдение пациента со среднетяжелым течением коронавирусной инфекции и COVID-19-ассоциированным поражением печени.
Материалы и методы. Описан клинический случай пациента П., 56 лет, с диагнозом «коронавирусная инфекция COVID-19» и изменениями функции печени смешанной природы, расцененное как COVID-19-ассоциированное поражение печени, в лечении которого использовалась урсодезоксихолевая кислота (УДКХ). Через 2 месяца проведена динамическая оценка физикальных данных, общего и биохимического анализов крови, ультразвукового исследования органов брюшной полости (УЗИ ОБП).
Результаты. На фоне терапии с использованием урсодезоксихолевой кислоты отмечалось улучшение общего самочувствия пациента, положительная динамика лабораторных показателей аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), общего билирубина. На УЗИ ОБП выявлена нормализация размеров правой и левой долей печени по сравнению с исходными данными.
Заключение. Применение урсодезоксихолевой кислоты у пациента с COVID-19-ассоциированным повреждением печени сопровождалось положительной динамикой в виде нормализации печеночных ферментов и улучшением общего состояния. Необходимы дополнительные исследования для изучения механизма действия УДКХ у пациентов с поражением печени на фоне COVID-19.
Ключевые слова: инфекция COVID-19, патология печени, УДХК.
Для цитирования: Сафонова К.А., Дехнич Н.Н., Абраменкова Н.Ю., Честных С.В., Ильин Д.Ю., Пунин А.А. Клинический случай: поражение печени у пациента с коронавирусной инфекцией. Клинический разбор в общей медицине. 2024; 5 (6): 21–25. DOI: 10.47407/kr2024.5.6.00430
Клинический разбор в общей медицине №6 2024
Клинический случай: поражение печени у пациента с коронавирусной инфекцией
Аннотация
Цель. Представить клиническое наблюдение пациента со среднетяжелым течением коронавирусной инфекции и COVID-19-ассоциированным поражением печени.
Материалы и методы. Описан клинический случай пациента П., 56 лет, с диагнозом «коронавирусная инфекция COVID-19» и изменениями функции печени смешанной природы, расцененное как COVID-19-ассоциированное поражение печени, в лечении которого использовалась урсодезоксихолевая кислота (УДКХ). Через 2 месяца проведена динамическая оценка физикальных данных, общего и биохимического анализов крови, ультразвукового исследования органов брюшной полости (УЗИ ОБП).
Результаты. На фоне терапии с использованием урсодезоксихолевой кислоты отмечалось улучшение общего самочувствия пациента, положительная динамика лабораторных показателей аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), общего билирубина. На УЗИ ОБП выявлена нормализация размеров правой и левой долей печени по сравнению с исходными данными.
Заключение. Применение урсодезоксихолевой кислоты у пациента с COVID-19-ассоциированным повреждением печени сопровождалось положительной динамикой в виде нормализации печеночных ферментов и улучшением общего состояния. Необходимы дополнительные исследования для изучения механизма действия УДКХ у пациентов с поражением печени на фоне COVID-19.
Ключевые слова: инфекция COVID-19, патология печени, УДХК.
Для цитирования: Сафонова К.А., Дехнич Н.Н., Абраменкова Н.Ю., Честных С.В., Ильин Д.Ю., Пунин А.А. Клинический случай: поражение печени у пациента с коронавирусной инфекцией. Клинический разбор в общей медицине. 2024; 5 (6): 21–25. DOI: 10.47407/kr2024.5.6.00430
Clinical case: liver damage in a patient with coronavirus disease
Kseniya A. Safonova1, Natalya N. Dekhnich2, Natalya Yu. Abramenkova2, Sofiya V. Chestnykh2, Dmitry Yu. Ilyin2, Alexander A. Punin2
1 Clinical Hospital No 1, Smolensk, Russia;
2 Smolensk State Medical University, Smolensk, Russia
n.dekhnich@mail.ru
Abstract
Objective. To present a clinical observation of a patient with a moderate course of coronavirus infection and COVID-19-associated liver damage.
Materials and methods. A clinical case of patient P., 56 years old, with a diagnosis of coronavirus infection COVID-19 and changes in liver function of a mixed nature, regarded as COVID-19-associated liver damage, treated with ursodeoxycholic acid (UDCA), is described. A dynamic assessment of physical data, general and biochemical blood tests, ultrasound of the abdominal cavity was performed after two months.
Results. Against the background of ongoing therapy with the use of ursodeoxycholic acid, there was an improvement in the patient's general well-being, positive laboratory dynamics of alanine transferase (ALT), aspartate transferase (AST), and total bilirubin. Ultrasound of the abdominal cavity revealed normalization sizes of the right and left lobes of the liver, compared with the initial data.
Conclusion. The use of ursodesoxycholic acid in a patient with COVID-19-associated liver damage was accompanied by positive dynamics in the form of normalization of hepatic enzymes and improvement of general condition. More research is needed to investigate the mechanism of action of UDCA in patients with COVID-19 and liver pathology.
Keywords: COVID-19 infection, liver pathology, UDCA.
For citation: Safonova K.A., Dekhnich N.N., Abramenkova N.Yu., Chestnykh S.V., Ilyin D.Yu., Punin A.A. Clinical case: liver damage in a patient with coronavirus disease. Clinical review for general practice. 2024; 5 (6): 21–25 (In Russ.). DOI: 10.47407/kr2024.5.6.00430
Введение
COVID-19-ассоциированное поражение печени включает любые изменения ее функции, которые происходят во время прогрессирования коронавирусной инфекции и лечения пациентов с COVID-19 при наличии сопутствующих заболеваний печени или без них. Общая частота повреждения печени при COVID-19 в среднем составляет 15–53% [1]. Повреждение печени при COVID-19 может происходить в результате синдрома системного воспалительного ответа и развития цитокинового шторма, а также гипоксии, вызванной осложнениями, связанными с COVID-19, приводящей к синдрому ишемии-реперфузии печени. Кроме того, описаны механизмы прямого повреждения гепатоцитов при проникновении SARS-CoV-2 через рецепторы ангиотензинпревращающего фермента, экспрессирующихся на гепатоцитах и холангиоцитах, и побочного действия лекарственных препаратов, которые используют для лечения COVID-19 [2–5]. Факторы риска развития повреждения печени при COVID-19: мужской пол, возраст >60 лет, индекс массы тела (ИМТ) >25 кг/м2, хронические заболевания печени, лекарственные препараты (ритонавир, парацетамол, диклофенак и др.), тяжелое течение COVID-19 [6]. В связи с тем, что классификация COVID-19-ассоциированного поражения печени отсутствует, характер повреждения печени исследователи условно подразделяют на следующие типы: гепатоцеллюлярный (повышение уровня аланинаминотрансферазы (АЛТ) и/или аспартатаминотрансферазы (АСТ) более чем в 2 раза), холестатический (повышение уровня щелочной фосфатазы – ЩФ – более чем в 2 раза) и смешанный (одновременное повышение АЛТ и/или АСТ и ЩФ более чем в 2 раза). Пациенты с гепатоцеллюлярным типом повреждения печени имеют почти
в 3 раза больший риск тяжелого течения COVID-19, а у пациентов со смешанным типом повреждения вероятность тяжелого течения COVID-19 увеличивается более чем в 4 раза [7]. По данным различных исследований, повышение уровня АСТ было ассоциировано с высоким риском смертности по сравнению с другими показателями [8].
Для лечения патологии печени при COVID-19 может использоваться урсодезоксихолевая кислота (УДХК). УДХК стабилизирует митохондрии гепатоцитов, что улучшает метаболическую активность, уменьшает повреждающее действие окислителей и, соответственно, защищает клетки от гибели, оказывая антиапоптотическое действие [10]. УДКХ снижает насыщение желчевыводящих путей холестерином, ингибируя всасывание холестерина в кишечнике и его секрецию в желчь, а также повышает проницаемость белка оболочки SARS-CoV-2 и блокирует слияние мембран вируса и клеток хозяина [11, 12]. Тем не менее опыт применения УДКХ при COVID-19-ассоциированном поражении печени ограничен, в связи с этим описание данного клинического наблюдения представляется целесообразным.
Цель
Представить клиническое наблюдение пациента со среднетяжелым течением коронавирусной инфекции и COVID-19-ассоциированным поражением печени.
Материалы и методы
Описан клинический случай пациента П., 56 лет, с диагнозом «коронавирусная инфекция COVID-19» и изменениями функции печени смешанной природы, расцененное как COVID-19-ассоциированное поражение печени, в лечении которого использовали УДКХ. Через 2 месяца проведена динамическая оценка физикальных данных, общего и биохимического анализов крови, ультразвукового исследования органов брюшной полости (УЗИ ОБП).
Результаты
Пациент П., 56 лет, доставлен в экстренном порядке в 4-й инфекционный госпиталь областного государственного бюджетного учреждения здравоохранения «Клиническая больница №1» г. Смоленска (ОГБУЗ КБ №1) с жалобами на общую слабость, одышку при физической нагрузке. Из анамнеза известно, что пациент обратился к участковому терапевту по поводу повышения температуры тела до 38° С, появления одышки и сухого кашля. Больной несколько лет страдает ишемической болезнью сердца (ИБС) и артериальной гипертензией. Был проведен экспресс-тест на определение антигенов SARS-CoV-2 в мазках из носо- и ротоглотки, результат положительный. Для дальнейшего обследования и лечения пациент был направлен в ОГБУЗ КБ №1 Смоленска с диагнозом подтвержденной коронавирусной инфекции.
При объективном осмотре состояние пациента средней степени тяжести за счет основной и сопутствующей патологии. Телосложение нормостеническое, ИМТ 31,02 кг/м2, распределение подкожно-жировой клетчатки равномерное, оволосение по мужскому типу, температура тела 36,70 С. Кожные покровы умеренно влажные, тургор нормальный. Периферические лимфоузлы не пальпируются. Деформации костно-суставной системы нет. Носовое дыхание свободное, отделяемого нет, слизистая преддверия носовых ходов бледно-розовая. Грудная клетка обычной формы. При аускультации легких дыхание везикулярное, ослабленное, хрипы не выслушиваются. Частота дыхательных движений 20 в минуту. Транскутанная сатурация (SpO2) при спонтанном дыхании на воздухе 90–93%. Одышка смешанного характера. Область сердца визуально не изменена. При аускультации сердца тоны аритмичные, приглушены, частота сердечных сокращений 120 в минуту, пульс 100 в минуту, дефицит пульса 20 в минуту, артериальное давление 140/100 мм рт. ст. Язык влажный, чистый. Живот симметричен, безболезненный при пальпации, печень выступает из-под края реберной дуги на 2,0 см нижним краем, гладким, ровным. Мочеиспускание нормальное, безболезненное, цвет мочи желтый. Стул оформленной консистенции, коричневого цвета.
Пациент был обследован по плану отделения в соответствии с действующими «Временными методическими рекомендациями по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19)»: общий анализ крови, биохимический анализ крови, С-реактивный белок (СРБ), лактат, ферритин, прокальцитонин, коагулограмма, профиль глюкозы крови, общий анализ мочи, лабораторное определение антигенов SARS-CoV-2 в мазках носо- и ротоглотки, общий анализ мокроты, микробиологическое исследование мокроты, электрокардиография (ЭКГ), УЗИ ОБП полости и почек, УЗИ плевральных полостей, мультиспиральная компьютерная томография органов грудной клетки (МСКТ ОГК), эхокардиография (ЭхоКГ).
По результатам лабораторных методов исследования отмечались отклонения показателей от нормы: повышение лейкоцитов до 10,66×109/л, общего билирубина до 24 мкмоль/л, СРБ до 48,23 мг/л, активности АЛТ до 212 Ед/л, АСТ до 177 Ед/л. На фоне терапии глюкокортикостероидами уровень глюкозы крови повысился до 8,8 ммоль/л. По данным ЭКГ – фибрилляция предсердий, ЧЖС 100–160 в минуту, нарушение проводимости по правой ножке пучка Гиса, признаки увеличения левых отделов сердца. По данным МСКТ ОГК выявлены КТ-признаки двусторонней полисегментарной пневмонии (вероятно, вирусной этиологии), двустороннего плеврита (справа 50 мл, слева 100 мл), пневмофиброз, эмфизема легких (дистальная ацинарная, центриацинарная). По результатам УЗИ ОБП установлено увеличение правой доли печени, замедление оттока желчи, диффузные изменения печени и поджелудочной железы. По данным ЭхоКГ: атеросклероз аорты, уплотнение створок аортального клапана с незначительной регургитацией, дилатация левого предсердия с его выраженной гипертрофией, умеренно-выраженная недостаточность митрального клапана 2-й степени, умеренная легочная гипертензия (систолическое давление в легочной артерии 42 мм рт. ст.).
На основании клинических и лабораторно-инструментальных методов обследования был установлен следующий клинический диагноз. Основное заболевание: коронавирусная инфекция СOVID-19, среднетяжелое течение. Фоновое заболевание: Хронический бронхит. Пневмосклероз. Эмфизема легких. Осложнение: двусторонняя полисегментарная пневмония смешанной природы (вирусной, бактериальной), среднетяжелое течение. ДН 0–1-я степень. Двусторонний выпотной плеврит. Сопутствующее заболевание: ИБС. Атеросклеротический кардиосклероз. Атеросклероз аорты. Артериальная гипертензия III стадия, риск 4. ХСН IIА,
II ФК. Легочная гипертензия. Фибрилляция предсердий, постоянная форма. Хронический гепатит смешанной природы. Дискинезия желчевыводящих путей. Мочекаменная болезнь. Хронический пиелонефрит. Ожирение 1-й степени. Стероид-индуцированная гипергликемия.
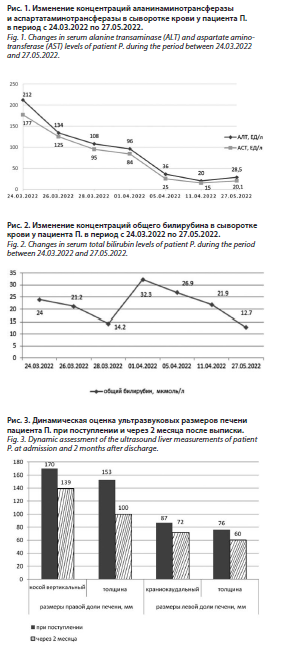 Во время стационарного лечения проводилась медикаментозная терапия: увлажненный O2 через маску, ремдесивир по схеме внутривенно, дексаметазон 20 мг в сутки внутривенно капельно, гепарин 5000 EД 4 раза в сутки подкожно, цефоперазон/сульбактам 2,0 г 2 раза в сутки внутривенно, фуросемид 20 мг в сутки внутривенно, эналаприл 1,25 мг утром внутрь, бисопролол
Во время стационарного лечения проводилась медикаментозная терапия: увлажненный O2 через маску, ремдесивир по схеме внутривенно, дексаметазон 20 мг в сутки внутривенно капельно, гепарин 5000 EД 4 раза в сутки подкожно, цефоперазон/сульбактам 2,0 г 2 раза в сутки внутривенно, фуросемид 20 мг в сутки внутривенно, эналаприл 1,25 мг утром внутрь, бисопролол
2,5 мг в обед внутрь, аторвастатин 10 мг вечером внутрь, дигоксин 0,25 мг по 0,5 таблетки 2 раза в сутки, омепразол 20 мг 2 раза в сутки внутрь, амброксол 30 мг 3 раза в сутки внутрь. Состояние пациента без отрицательной динамики, средней степени тяжести. Учитывая наличие у пациента признаков гепатоцеллюлярного типа повреждения печени в виде повышения активности аминотрансфераз АЛТ и АСТ, дискинезии желчевыводящих путей была назначена УДХК 500 мг 3 раза в день перорально (из расчета 15 мг/кг/сут в 3 приема).
На фоне лечения отмечалось улучшение общего состояния пациента в виде уменьшения выраженности одышки, кашля, общей слабости, сохранение стойко нормальной температуры тела, SpO2 при спонтанном дыхании на воздухе – 98%. Отмечалась нормализация лабораторных показателей: уровень активности печеночных трансаминаз через 6 дней приема УДХК составил АЛТ – 96 Ед/л, АСТ – 84 Ед/л; через 16 дней уровень активности АЛТ – 20 Ед/л, АСТ – 15 Ед/л (рис. 1), на фоне этиотропной и патогенетической терапии СРБ с 48,23 мг/л снизился до 7,1 мг/л, а число лейкоцитов – с 10,66×109/л до 8,24×109/л.
Пациент был переведен на амбулаторный этап лечения с рекомендациями продолжить прием УДХК 500 мг 3 раза в сутки внутрь в течение 2 месяцев с последующим лабораторным и УЗИ контролем, проводимую терапию по коррекции сопутствующих заболеваний.
При контрольном обследовании через 2 месяца отклонений уровня активности аминотрансфераз выявлено не было (АЛТ 28,5 ЕД/л, АСТ 20,1 ЕД/л), общий билирубин 12,7 мкмоль/л, прямой билирубин 2,0 мкмоль/л (рис. 2).
По результатам УЗИ ОБП размеры печени нормализовались, однако сохранялись признаки дискинезии желчевыводящих путей и диффузные изменения паренхимы поджелудочной железы (рис. 3).
Обсуждение результатов
На фоне инфекции COVID-19 могут возникать повреждения печени, связанные с различными факторами: прямое повреждение гепатоцитов при проникновении SARS-CoV-2 через рецепторы ангиотензинпревращающего фермента; цитокиновый шторм за счет действия провоспалительных интерлейкинов, выделяющихся при COVID-19; ишемия-реперфузия печени вследствие гипоксии при COVID-19; лекарственные средства или другие экзогенные факторы [2, 4, 13]. Это подтверждается физикальными, лабораторными и инструментальными методами обследования.
В случае пациента П. можно сказать, что повреждение печени носило многофакторный характер за счет непосредственно вирус-индуцированного повреждения гепатоцитов и холангиоцитов, развития цитокинового шторма, гипоксемии и гипоксии в результате имеющейся сердечной недостаточности. Объективно об этом свидетельствовали физикальные данные обследования (увеличение печени при пальпации), лабораторные признаки (повышение активности трансаминаз АЛТ до 212 ЕД/л и АСТ до 177 ЕД/л, повышение уровня общего билирубина до 32,3 мкмоль/л), изменения по данным УЗИ (увеличение печени, диффузные изменения структуры печени).
Учитывая наличие признаков дискинезии желчевыводящих путей и хронического гепатита смешанного генеза, был назначен препарат УДХК из расчета 15 мг/кг в дозе 500 мг 3 раза в сутки с последующим динамическим лабораторным и функциональным контролем через 2 месяца.
УДХК является гепатопротекторным средством, оказывающим также желчегонное, гипохолестеринемическое, гиполипидемическое, иммуномодулирующее действие (уменьшает экспрессию антигенов HLA-1 на мембране гепатоцитов, влияет на количество T-лимфоцитов, образование интерлейкина-2, подавляет иммунокомпетентные иммуноглобулины) [10]. Общие показания для назначения препарата – первичный билиарный цирроз при отсутствии признаков декомпенсации, растворение холестериновых камней желчного пузыря, билиарный рефлюкс-гастрит, первичный склерозирущий холангит, алкогольная болезнь печени, неалкогольный стеатогепатит, кистозный фиброз, хронические гепатиты различного генеза, дискинезия желчевыводящих путей.
На фоне лечения во время госпитализации уровни аминотрансфераз, показатели воспаления стабилизировались, и пациент был переведен на амбулаторный этап лечения. При контрольном обследовании больного через 2 месяца регулярного приема УДХК отмечались нормальные уровни печеночных трансаминаз. Признаков увеличения печени по данным УЗИ ОБП установлено не было.
Заключение
Данный клинический случай демонстрирует позитивное влияние УДХК на показатели печеночных ферментов при COVID-19-ассоциированном повреждении печени, способствуя более быстрому восстановлению ее размеров и функции. Необходимы дополнительные исследования для изучения механизма действия УДХК у пациентов с COVID-19 и поражением печени.
Конфликт интересов. Авторы заявляют об отсутствии конфликтов интересов.
Conflict of interest. The authors declare that there are no conflicts of interest.
Информация об авторах
Information about the authors
Сафонова Ксения Анатольевна – врач-терапевт, ОГБУЗ «Клиническая больница №1», г. Смоленск.
E-mail: kseniya.safonova.2013@mail.ru; ORCID: 0000-0002-4817-1277
Kseniya A. Safonova – Therapist, Clinical Hospital No 1, Smolensk. E-mail: kseniya.safonova.2013@mail.ru.
ORCID: 0000-0002-4817-1277
Дехнич Наталья Николаевна – д-р мед. наук, проф. каф. факультетской терапии, проректор по дополнительному профессиональному образованию и развитию регионального здравоохранения, ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России.
E-mail: n.dekhnich@mail.ru; ORCID: 0000-0002-6144-3919
Natalya N. Dekhnich – D. Sci. (Med.), Prof., Smolensk State Medical University. E-mail: n.dekhnich@mail.ru;
ORCID: 0000-0002-6144-3919
Абраменкова Наталья Юрьевна – канд. мед. наук, доц. каф. терапии, ультразвуковой и функциональной диагностики ФДПО, ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России.
E-mail: Abramenkowa.natalya@yandex.ru;
ORCID: 0000-0001-8460-073X
Natalya Yu. Abramenkova – Cand. Sci (Med.), Associate Professor, Smolensk State Medical University.
E-mail: Abramenkowa.natalya@yandex.ru;
ORCID: 0000-0001-8460-073X
Честных София Владиславовна – студентка, ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России. E-mail: chestnykh.sofiya@mail.ru;
ORCID: 0009-0007-6201-014X
Sofiya V. Chestnykh – Student, Smolensk State Medical University. E-mail: chestnykh.sofiya@mail.ru;
ORCID: 0009-0007-6201-014X
Ильин Дмитрий Юрьевич – ассистент каф. гистологии, цитологии, эмбриологии, ординатор кафедры анестезиологии и реаниматологии с курсом ДПО, ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России.
E-mail: dimi99@mail.ru; ORCID: 0000-0001-8809-7115
Dmitry Yu. Ilyin – Аssistant, Resident doctor, Smolensk State Medical University. E-mail: dimi99@mail.ru;
ORCID: 0000-0001-8809-7115
Пунин Александр Алексеевич – д-р мед. наук, проф., зав. каф. факультетской терапии ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России.
E-mail: 001e316@mail.ru; ORCID: 0000-0001-9883-8378
Alexander A. Punin – D. Sci. (Med.), Prof., Head of the Department of Faculty Therapy. Smolensk State Medical University. E-mail: 001e316@mail.ru;
ORCID: 0000-0001-9883-8378
Поступила в редакцию: 03.06.2024
Поступила после рецензирования: 11.06.2024
Принята к публикации: 20.06.2024
Received: 03.06.2024
Revised: 11.06.2024
Accepted: 20.06.2024
Kseniya A. Safonova1, Natalya N. Dekhnich2, Natalya Yu. Abramenkova2, Sofiya V. Chestnykh2, Dmitry Yu. Ilyin2, Alexander A. Punin2
1 Clinical Hospital No 1, Smolensk, Russia;
2 Smolensk State Medical University, Smolensk, Russia
n.dekhnich@mail.ru
Abstract
Objective. To present a clinical observation of a patient with a moderate course of coronavirus infection and COVID-19-associated liver damage.
Materials and methods. A clinical case of patient P., 56 years old, with a diagnosis of coronavirus infection COVID-19 and changes in liver function of a mixed nature, regarded as COVID-19-associated liver damage, treated with ursodeoxycholic acid (UDCA), is described. A dynamic assessment of physical data, general and biochemical blood tests, ultrasound of the abdominal cavity was performed after two months.
Results. Against the background of ongoing therapy with the use of ursodeoxycholic acid, there was an improvement in the patient's general well-being, positive laboratory dynamics of alanine transferase (ALT), aspartate transferase (AST), and total bilirubin. Ultrasound of the abdominal cavity revealed normalization sizes of the right and left lobes of the liver, compared with the initial data.
Conclusion. The use of ursodesoxycholic acid in a patient with COVID-19-associated liver damage was accompanied by positive dynamics in the form of normalization of hepatic enzymes and improvement of general condition. More research is needed to investigate the mechanism of action of UDCA in patients with COVID-19 and liver pathology.
Keywords: COVID-19 infection, liver pathology, UDCA.
For citation: Safonova K.A., Dekhnich N.N., Abramenkova N.Yu., Chestnykh S.V., Ilyin D.Yu., Punin A.A. Clinical case: liver damage in a patient with coronavirus disease. Clinical review for general practice. 2024; 5 (6): 21–25 (In Russ.). DOI: 10.47407/kr2024.5.6.00430
Введение
COVID-19-ассоциированное поражение печени включает любые изменения ее функции, которые происходят во время прогрессирования коронавирусной инфекции и лечения пациентов с COVID-19 при наличии сопутствующих заболеваний печени или без них. Общая частота повреждения печени при COVID-19 в среднем составляет 15–53% [1]. Повреждение печени при COVID-19 может происходить в результате синдрома системного воспалительного ответа и развития цитокинового шторма, а также гипоксии, вызванной осложнениями, связанными с COVID-19, приводящей к синдрому ишемии-реперфузии печени. Кроме того, описаны механизмы прямого повреждения гепатоцитов при проникновении SARS-CoV-2 через рецепторы ангиотензинпревращающего фермента, экспрессирующихся на гепатоцитах и холангиоцитах, и побочного действия лекарственных препаратов, которые используют для лечения COVID-19 [2–5]. Факторы риска развития повреждения печени при COVID-19: мужской пол, возраст >60 лет, индекс массы тела (ИМТ) >25 кг/м2, хронические заболевания печени, лекарственные препараты (ритонавир, парацетамол, диклофенак и др.), тяжелое течение COVID-19 [6]. В связи с тем, что классификация COVID-19-ассоциированного поражения печени отсутствует, характер повреждения печени исследователи условно подразделяют на следующие типы: гепатоцеллюлярный (повышение уровня аланинаминотрансферазы (АЛТ) и/или аспартатаминотрансферазы (АСТ) более чем в 2 раза), холестатический (повышение уровня щелочной фосфатазы – ЩФ – более чем в 2 раза) и смешанный (одновременное повышение АЛТ и/или АСТ и ЩФ более чем в 2 раза). Пациенты с гепатоцеллюлярным типом повреждения печени имеют почти
в 3 раза больший риск тяжелого течения COVID-19, а у пациентов со смешанным типом повреждения вероятность тяжелого течения COVID-19 увеличивается более чем в 4 раза [7]. По данным различных исследований, повышение уровня АСТ было ассоциировано с высоким риском смертности по сравнению с другими показателями [8].
Для лечения патологии печени при COVID-19 может использоваться урсодезоксихолевая кислота (УДХК). УДХК стабилизирует митохондрии гепатоцитов, что улучшает метаболическую активность, уменьшает повреждающее действие окислителей и, соответственно, защищает клетки от гибели, оказывая антиапоптотическое действие [10]. УДКХ снижает насыщение желчевыводящих путей холестерином, ингибируя всасывание холестерина в кишечнике и его секрецию в желчь, а также повышает проницаемость белка оболочки SARS-CoV-2 и блокирует слияние мембран вируса и клеток хозяина [11, 12]. Тем не менее опыт применения УДКХ при COVID-19-ассоциированном поражении печени ограничен, в связи с этим описание данного клинического наблюдения представляется целесообразным.
Цель
Представить клиническое наблюдение пациента со среднетяжелым течением коронавирусной инфекции и COVID-19-ассоциированным поражением печени.
Материалы и методы
Описан клинический случай пациента П., 56 лет, с диагнозом «коронавирусная инфекция COVID-19» и изменениями функции печени смешанной природы, расцененное как COVID-19-ассоциированное поражение печени, в лечении которого использовали УДКХ. Через 2 месяца проведена динамическая оценка физикальных данных, общего и биохимического анализов крови, ультразвукового исследования органов брюшной полости (УЗИ ОБП).
Результаты
Пациент П., 56 лет, доставлен в экстренном порядке в 4-й инфекционный госпиталь областного государственного бюджетного учреждения здравоохранения «Клиническая больница №1» г. Смоленска (ОГБУЗ КБ №1) с жалобами на общую слабость, одышку при физической нагрузке. Из анамнеза известно, что пациент обратился к участковому терапевту по поводу повышения температуры тела до 38° С, появления одышки и сухого кашля. Больной несколько лет страдает ишемической болезнью сердца (ИБС) и артериальной гипертензией. Был проведен экспресс-тест на определение антигенов SARS-CoV-2 в мазках из носо- и ротоглотки, результат положительный. Для дальнейшего обследования и лечения пациент был направлен в ОГБУЗ КБ №1 Смоленска с диагнозом подтвержденной коронавирусной инфекции.
При объективном осмотре состояние пациента средней степени тяжести за счет основной и сопутствующей патологии. Телосложение нормостеническое, ИМТ 31,02 кг/м2, распределение подкожно-жировой клетчатки равномерное, оволосение по мужскому типу, температура тела 36,70 С. Кожные покровы умеренно влажные, тургор нормальный. Периферические лимфоузлы не пальпируются. Деформации костно-суставной системы нет. Носовое дыхание свободное, отделяемого нет, слизистая преддверия носовых ходов бледно-розовая. Грудная клетка обычной формы. При аускультации легких дыхание везикулярное, ослабленное, хрипы не выслушиваются. Частота дыхательных движений 20 в минуту. Транскутанная сатурация (SpO2) при спонтанном дыхании на воздухе 90–93%. Одышка смешанного характера. Область сердца визуально не изменена. При аускультации сердца тоны аритмичные, приглушены, частота сердечных сокращений 120 в минуту, пульс 100 в минуту, дефицит пульса 20 в минуту, артериальное давление 140/100 мм рт. ст. Язык влажный, чистый. Живот симметричен, безболезненный при пальпации, печень выступает из-под края реберной дуги на 2,0 см нижним краем, гладким, ровным. Мочеиспускание нормальное, безболезненное, цвет мочи желтый. Стул оформленной консистенции, коричневого цвета.
Пациент был обследован по плану отделения в соответствии с действующими «Временными методическими рекомендациями по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19)»: общий анализ крови, биохимический анализ крови, С-реактивный белок (СРБ), лактат, ферритин, прокальцитонин, коагулограмма, профиль глюкозы крови, общий анализ мочи, лабораторное определение антигенов SARS-CoV-2 в мазках носо- и ротоглотки, общий анализ мокроты, микробиологическое исследование мокроты, электрокардиография (ЭКГ), УЗИ ОБП полости и почек, УЗИ плевральных полостей, мультиспиральная компьютерная томография органов грудной клетки (МСКТ ОГК), эхокардиография (ЭхоКГ).
По результатам лабораторных методов исследования отмечались отклонения показателей от нормы: повышение лейкоцитов до 10,66×109/л, общего билирубина до 24 мкмоль/л, СРБ до 48,23 мг/л, активности АЛТ до 212 Ед/л, АСТ до 177 Ед/л. На фоне терапии глюкокортикостероидами уровень глюкозы крови повысился до 8,8 ммоль/л. По данным ЭКГ – фибрилляция предсердий, ЧЖС 100–160 в минуту, нарушение проводимости по правой ножке пучка Гиса, признаки увеличения левых отделов сердца. По данным МСКТ ОГК выявлены КТ-признаки двусторонней полисегментарной пневмонии (вероятно, вирусной этиологии), двустороннего плеврита (справа 50 мл, слева 100 мл), пневмофиброз, эмфизема легких (дистальная ацинарная, центриацинарная). По результатам УЗИ ОБП установлено увеличение правой доли печени, замедление оттока желчи, диффузные изменения печени и поджелудочной железы. По данным ЭхоКГ: атеросклероз аорты, уплотнение створок аортального клапана с незначительной регургитацией, дилатация левого предсердия с его выраженной гипертрофией, умеренно-выраженная недостаточность митрального клапана 2-й степени, умеренная легочная гипертензия (систолическое давление в легочной артерии 42 мм рт. ст.).
На основании клинических и лабораторно-инструментальных методов обследования был установлен следующий клинический диагноз. Основное заболевание: коронавирусная инфекция СOVID-19, среднетяжелое течение. Фоновое заболевание: Хронический бронхит. Пневмосклероз. Эмфизема легких. Осложнение: двусторонняя полисегментарная пневмония смешанной природы (вирусной, бактериальной), среднетяжелое течение. ДН 0–1-я степень. Двусторонний выпотной плеврит. Сопутствующее заболевание: ИБС. Атеросклеротический кардиосклероз. Атеросклероз аорты. Артериальная гипертензия III стадия, риск 4. ХСН IIА,
II ФК. Легочная гипертензия. Фибрилляция предсердий, постоянная форма. Хронический гепатит смешанной природы. Дискинезия желчевыводящих путей. Мочекаменная болезнь. Хронический пиелонефрит. Ожирение 1-й степени. Стероид-индуцированная гипергликемия.
 Во время стационарного лечения проводилась медикаментозная терапия: увлажненный O2 через маску, ремдесивир по схеме внутривенно, дексаметазон 20 мг в сутки внутривенно капельно, гепарин 5000 EД 4 раза в сутки подкожно, цефоперазон/сульбактам 2,0 г 2 раза в сутки внутривенно, фуросемид 20 мг в сутки внутривенно, эналаприл 1,25 мг утром внутрь, бисопролол
Во время стационарного лечения проводилась медикаментозная терапия: увлажненный O2 через маску, ремдесивир по схеме внутривенно, дексаметазон 20 мг в сутки внутривенно капельно, гепарин 5000 EД 4 раза в сутки подкожно, цефоперазон/сульбактам 2,0 г 2 раза в сутки внутривенно, фуросемид 20 мг в сутки внутривенно, эналаприл 1,25 мг утром внутрь, бисопролол 2,5 мг в обед внутрь, аторвастатин 10 мг вечером внутрь, дигоксин 0,25 мг по 0,5 таблетки 2 раза в сутки, омепразол 20 мг 2 раза в сутки внутрь, амброксол 30 мг 3 раза в сутки внутрь. Состояние пациента без отрицательной динамики, средней степени тяжести. Учитывая наличие у пациента признаков гепатоцеллюлярного типа повреждения печени в виде повышения активности аминотрансфераз АЛТ и АСТ, дискинезии желчевыводящих путей была назначена УДХК 500 мг 3 раза в день перорально (из расчета 15 мг/кг/сут в 3 приема).
На фоне лечения отмечалось улучшение общего состояния пациента в виде уменьшения выраженности одышки, кашля, общей слабости, сохранение стойко нормальной температуры тела, SpO2 при спонтанном дыхании на воздухе – 98%. Отмечалась нормализация лабораторных показателей: уровень активности печеночных трансаминаз через 6 дней приема УДХК составил АЛТ – 96 Ед/л, АСТ – 84 Ед/л; через 16 дней уровень активности АЛТ – 20 Ед/л, АСТ – 15 Ед/л (рис. 1), на фоне этиотропной и патогенетической терапии СРБ с 48,23 мг/л снизился до 7,1 мг/л, а число лейкоцитов – с 10,66×109/л до 8,24×109/л.
Пациент был переведен на амбулаторный этап лечения с рекомендациями продолжить прием УДХК 500 мг 3 раза в сутки внутрь в течение 2 месяцев с последующим лабораторным и УЗИ контролем, проводимую терапию по коррекции сопутствующих заболеваний.
При контрольном обследовании через 2 месяца отклонений уровня активности аминотрансфераз выявлено не было (АЛТ 28,5 ЕД/л, АСТ 20,1 ЕД/л), общий билирубин 12,7 мкмоль/л, прямой билирубин 2,0 мкмоль/л (рис. 2).
По результатам УЗИ ОБП размеры печени нормализовались, однако сохранялись признаки дискинезии желчевыводящих путей и диффузные изменения паренхимы поджелудочной железы (рис. 3).
Обсуждение результатов
На фоне инфекции COVID-19 могут возникать повреждения печени, связанные с различными факторами: прямое повреждение гепатоцитов при проникновении SARS-CoV-2 через рецепторы ангиотензинпревращающего фермента; цитокиновый шторм за счет действия провоспалительных интерлейкинов, выделяющихся при COVID-19; ишемия-реперфузия печени вследствие гипоксии при COVID-19; лекарственные средства или другие экзогенные факторы [2, 4, 13]. Это подтверждается физикальными, лабораторными и инструментальными методами обследования.
В случае пациента П. можно сказать, что повреждение печени носило многофакторный характер за счет непосредственно вирус-индуцированного повреждения гепатоцитов и холангиоцитов, развития цитокинового шторма, гипоксемии и гипоксии в результате имеющейся сердечной недостаточности. Объективно об этом свидетельствовали физикальные данные обследования (увеличение печени при пальпации), лабораторные признаки (повышение активности трансаминаз АЛТ до 212 ЕД/л и АСТ до 177 ЕД/л, повышение уровня общего билирубина до 32,3 мкмоль/л), изменения по данным УЗИ (увеличение печени, диффузные изменения структуры печени).
Учитывая наличие признаков дискинезии желчевыводящих путей и хронического гепатита смешанного генеза, был назначен препарат УДХК из расчета 15 мг/кг в дозе 500 мг 3 раза в сутки с последующим динамическим лабораторным и функциональным контролем через 2 месяца.
УДХК является гепатопротекторным средством, оказывающим также желчегонное, гипохолестеринемическое, гиполипидемическое, иммуномодулирующее действие (уменьшает экспрессию антигенов HLA-1 на мембране гепатоцитов, влияет на количество T-лимфоцитов, образование интерлейкина-2, подавляет иммунокомпетентные иммуноглобулины) [10]. Общие показания для назначения препарата – первичный билиарный цирроз при отсутствии признаков декомпенсации, растворение холестериновых камней желчного пузыря, билиарный рефлюкс-гастрит, первичный склерозирущий холангит, алкогольная болезнь печени, неалкогольный стеатогепатит, кистозный фиброз, хронические гепатиты различного генеза, дискинезия желчевыводящих путей.
На фоне лечения во время госпитализации уровни аминотрансфераз, показатели воспаления стабилизировались, и пациент был переведен на амбулаторный этап лечения. При контрольном обследовании больного через 2 месяца регулярного приема УДХК отмечались нормальные уровни печеночных трансаминаз. Признаков увеличения печени по данным УЗИ ОБП установлено не было.
Заключение
Данный клинический случай демонстрирует позитивное влияние УДХК на показатели печеночных ферментов при COVID-19-ассоциированном повреждении печени, способствуя более быстрому восстановлению ее размеров и функции. Необходимы дополнительные исследования для изучения механизма действия УДХК у пациентов с COVID-19 и поражением печени.
Конфликт интересов. Авторы заявляют об отсутствии конфликтов интересов.
Conflict of interest. The authors declare that there are no conflicts of interest.
Информация об авторах
Information about the authors
Сафонова Ксения Анатольевна – врач-терапевт, ОГБУЗ «Клиническая больница №1», г. Смоленск.
E-mail: kseniya.safonova.2013@mail.ru; ORCID: 0000-0002-4817-1277
Kseniya A. Safonova – Therapist, Clinical Hospital No 1, Smolensk. E-mail: kseniya.safonova.2013@mail.ru.
ORCID: 0000-0002-4817-1277
Дехнич Наталья Николаевна – д-р мед. наук, проф. каф. факультетской терапии, проректор по дополнительному профессиональному образованию и развитию регионального здравоохранения, ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России.
E-mail: n.dekhnich@mail.ru; ORCID: 0000-0002-6144-3919
Natalya N. Dekhnich – D. Sci. (Med.), Prof., Smolensk State Medical University. E-mail: n.dekhnich@mail.ru;
ORCID: 0000-0002-6144-3919
Абраменкова Наталья Юрьевна – канд. мед. наук, доц. каф. терапии, ультразвуковой и функциональной диагностики ФДПО, ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России.
E-mail: Abramenkowa.natalya@yandex.ru;
ORCID: 0000-0001-8460-073X
Natalya Yu. Abramenkova – Cand. Sci (Med.), Associate Professor, Smolensk State Medical University.
E-mail: Abramenkowa.natalya@yandex.ru;
ORCID: 0000-0001-8460-073X
Честных София Владиславовна – студентка, ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России. E-mail: chestnykh.sofiya@mail.ru;
ORCID: 0009-0007-6201-014X
Sofiya V. Chestnykh – Student, Smolensk State Medical University. E-mail: chestnykh.sofiya@mail.ru;
ORCID: 0009-0007-6201-014X
Ильин Дмитрий Юрьевич – ассистент каф. гистологии, цитологии, эмбриологии, ординатор кафедры анестезиологии и реаниматологии с курсом ДПО, ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России.
E-mail: dimi99@mail.ru; ORCID: 0000-0001-8809-7115
Dmitry Yu. Ilyin – Аssistant, Resident doctor, Smolensk State Medical University. E-mail: dimi99@mail.ru;
ORCID: 0000-0001-8809-7115
Пунин Александр Алексеевич – д-р мед. наук, проф., зав. каф. факультетской терапии ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России.
E-mail: 001e316@mail.ru; ORCID: 0000-0001-9883-8378
Alexander A. Punin – D. Sci. (Med.), Prof., Head of the Department of Faculty Therapy. Smolensk State Medical University. E-mail: 001e316@mail.ru;
ORCID: 0000-0001-9883-8378
Поступила в редакцию: 03.06.2024
Поступила после рецензирования: 11.06.2024
Принята к публикации: 20.06.2024
Received: 03.06.2024
Revised: 11.06.2024
Accepted: 20.06.2024


