Клинический разбор в общей медицине №6 2024
Аннотация
Искусственный левый желудочек все чаще используется для лечения пациентов с терминальной сердечной недостаточностью. Наше сообщение посвящено редкому осложнению кардиохирургической практики, но с крайне высоким уровнем летальности – острой неокклюзионной мезентеральной ишемии кишечника.
Ключевые слова: неокклюзионная мезентеральная ишемия, хроническая сердечная недостаточность, искусственный левый желудочек.
Для цитирования: Ганаев К.Г., Лаврикова Т.А., Дзыбинская Е.В., Власова Э.Е., Курилина Э.В., Халилулин Т.А., Ширяев А.А., Акчурин Р.С. Острая неокклюзионная мезентеральная ишемия после имплантации искусственного левого желудочка. Клинический разбор в общей медицине. 2024; 5 (6): 26–32. DOI: 10.47407/kr2024.5.6.00431
Клинический разбор в общей медицине №6 2024
Острая неокклюзионная мезентеральная ишемия после имплантации искусственного левого желудочка
Аннотация
Искусственный левый желудочек все чаще используется для лечения пациентов с терминальной сердечной недостаточностью. Наше сообщение посвящено редкому осложнению кардиохирургической практики, но с крайне высоким уровнем летальности – острой неокклюзионной мезентеральной ишемии кишечника.
Ключевые слова: неокклюзионная мезентеральная ишемия, хроническая сердечная недостаточность, искусственный левый желудочек.
Для цитирования: Ганаев К.Г., Лаврикова Т.А., Дзыбинская Е.В., Власова Э.Е., Курилина Э.В., Халилулин Т.А., Ширяев А.А., Акчурин Р.С. Острая неокклюзионная мезентеральная ишемия после имплантации искусственного левого желудочка. Клинический разбор в общей медицине. 2024; 5 (6): 26–32. DOI: 10.47407/kr2024.5.6.00431
Acute non-occlusive mesenteric ischemia after implantation of an left ventricular assist device
Kamil G. Ganaev1, Tatiana A. Lavrikova1, Elena V. Dzybinskaya1, Elina E. Vlasovа1,
Ella V. Kurilina1, Timer A. Khalilulin2, Andrey A. Shiryaev1, Renat S. Akchurin1
1 Chazov National Medical Research Center of Cardiology, Moscow, Russia;
2 Shumakov National Medical Research Center of Transplantology and Artificial Organs, Moscow, Russia
dr_ganaev@mail.ru
Abstract
Artificial left ventricle is increasingly used to treat patients with end-stage heart failure. Our report is devoted to a rare complication of cardiac surgical practice, but with an extremely high mortality rate – acute non-occlusive mesenteric intestinal ischemia.
Keywords: non-occlusive mesenteric ischemia, chronic heart failure, left ventricular assist device.
For citation: Ganaev K.G., Lavrikova T.A., Dzybinskaya E.V., Vlasovа E.E., Kurilina E.V., Khalilulin T.A., Shiryaev A.A., Akchurin R.S. Acute non-occlusive mesenteric ischemia after implantation of an left ventricular assist device. Clinical review for general practice. 2024; 5 (6): 26–32 (In Russ.). DOI: 10.47407/kr2024.5.6.00431
Введение
Терминальная хроническая сердечная недостаточность (ХСН) – сложный синдром, итог многих сердечно-сосудистых заболеваний, его распространенность растет во всем мире. Несмотря на достижения в системе здравоохранения, заболеваемость сердечной недостаточностью неуклонно прогрессирует, а общая выживаемость и качество жизни при этом снижаются [1]. Рост ХСН во многом обусловлен улучшением оказания медицинской помощи больным с острым коронарным синдромом, улучшением выживаемости при многих сердечно-сосудистых заболеваниях и увеличением числа пациентов с имплантированным кардиовертерами-дефибрилляторами [2].
Возможности лечения ХСН за последние годы значительно улучшаются, однако «золотым стандартом» лечения терминальной ХСН, которая позволяет повысить функциональные возможности наряду с увеличением продолжительности жизни, остается трансплантация сердца (ТС) [3]. Однако доступ к этой терапии ограничен из-за нехватки донорских сердец и растущего числа пациентов, не подходящих для ТС. Эти и другие факторы привели к развитию производства механических устройств гемодинамической поддержки левого желудочка – искусственных левых желудочков (ИЛЖ). Первоначально ИЛЖ задумывался в качестве моста к трансплантации, когда устройство имплантировали ненадолго в качестве поддерживающей терапии, на время нахождения в списке ожидания донорского сердца. Модернизация ИЛЖ, усовершенствование медикаментозного ведения в постимплантационный период привели к тому, что ИЛЖ был одобрен в качестве целевой терапии терминальной ХСН [4]. Для достижения хороших и стабильных результатов имплантации ИЛЖ пациентам крайне высокого периоперационного риска от команды специалистов требуются качественный отбор пациентов, понимание особенностей новой модели системной гемодинамики и тщательное наблюдение в послеоперационном периоде.
Представляем собственное наблюдение летального случая после имплантации ИЛЖ, обусловленного развитием острой неокклюзионной мезентеральной ишемии (ОНМИ).
Клинический случай
Пациент А., 65 лет, поступил с жалобами на одышку при минимальной физической нагрузке, усталость при повседневной физической нагрузке, периодическое головокружение на фоне сниженного артериального давления (АД). На протяжении длительного времени отмечал повышенные цифры АД, по данному поводу не обследовался, в последующем – нормализация АД без медикаментозной терапии. Коронарный анамнез с 2014 г., когда впервые возникла клиника стенокардии напряжения на уровне 2 ФК. В 2015 г. перенес инфаркт миокарда передней локализации, проведено консервативное лечение. С этого же года дебют клиники ХСН. В 2020 г. – повторный инфаркт миокарда передне-перегородочной локализации. При обследовании: ФВ ЛЖ до 25%, многососудистое поражение коронарных артерий (окклюзия проксимального сегмента передней нисходящей артерии и правой коронарной артерии, cтеноз до 90% диагональной артерии). Коронарное шунтирование не предлагалось ввиду обширной зоны ПИКС, предложена ТС, от которой пациент отказался. Начата медикаментозная терапия ХСН, предпринимались попытки назначения сакубитрил/валсартана, однако на фоне малых доз препарата отмечалась выраженная склонность к гипотонии. В июне 2023 г. – эпизод декомпенсации ХСН, тогда же был впервые зарегистрирован пароксизм фибрилляции предсердий. В августе 2023 г. пациент поступил в отдел сердечно-сосудистой хирургии ФГБУ «Национальный медицинский исследовательский центр кардиологии им. ак.
Е.И. Чазова» Минздрава России (ФГБУ «НМИЦ кардиологии им. акад. Е.И. Чазова»).
Амбулаторно принимал: дапаглифлозин 10 мг/сут, спиронолактон 25 мг/сут, бисопролол 1,25 мг/сут, амиодарон 200 мг/сут, апиксабан 10 мг/сут, аторвастатин 40 мг/сут.
Объективный статус при поступлении: рост
168 см, масса тела 46 кг, ИМТ – 16,3, ППТ – 1,5 м2, состояние средней тяжести, одышка при минимальной нагрузке, ЧСС – 60–65 в минуту, АД – 90/60 мм рт. ст. Тоны сердца приглушены, ЧДД – 14 в минуту. В легких дыхание везикулярное, проводится во все отделы, единичные влажные хрипы в н/о. Сатурация – 98%. Печень не увеличена. Тест 6-минутной ходьбы – 310 м.
Результаты инструментального
и лабораторного обследования
ЭКГ: ритм синусовый с ЧСС 60 уд/мин, неполная блокада левой ножки пучка Гиса, подъем сегмента ST в отв. V1–V4 макс. до 1 мм. Рентгенография ОГК: очаговых и инфильтративных изменений нет. Усилен легочный рисунок за счет интерстициального компонента. Нарушений легочной гемодинамики нет. Расширение сердца в поперечнике, КТИ – 56. Спирометрия: жизненная емкость легких и показатели проходимости дыхательных путей в пределах возрастной нормы. ЭхоКГ: увеличение левых камер сердца (КДР – 7,5 см, объем ЛП – 72 мл), ФВ ЛЖ – 25%, ТМЖП: 0,7 см, ТЗСЛЖ: 0,9 см. Акинез апикальных, средних сегментов передней, передне-перегородочной стенок с переходом на апикальные сегменты боковой и нижней стенок, истончение
(~ 0,4–0,5 см) миокарда на уровне апикальных сегментов всех стенок и верхушки. Также зона гипоакинезии базального, среднего сегментов нижней и задней стенок. Функциональная регургитация МК 2–3-й степени ПП – 15 см2, ФВ ПЖ – 55%, TAPSE – 1,6 см, ПЖ FAC – 61% , RVED1 – 3,2 см, RVED2 – 2,2 см, RVED1/LV – 0,48. Признаков легочной гипертензии не выявлено. МРТ сердца с гадолинием: обширное очагово-рубцовое поражение миокарда передней локализации с формированием аневризмы в области верхушки. КДР ЛЖ =
75 мм, КДО ЛЖ = 298 мл, КДОи ЛЖ = 198 мл/м2.
Катетеризация правых отделов сердца (КПОС): СВ –
4,5 л/мин, ЛСС – 1,5 Ед. Вуда, ср. ДЛА – 16 мм рт. ст., ДЗЛА – 9 мм рт. ст. Коронарография: тип кровоснабжения правый. Окклюзия ПНА, стеноз ДА до 80%, окклюзия ПКА. В анализах крови: гемоглобин – 149 г/л, гематокрит – 45,0%, лейкоциты – 6,5×109/л, тромбоциты – 233×109/л, креатинин – 65,4 мкмоль/л, общий белок – 65,4 г/л, холестерин – 3,84 ммоль/л, NT-proBNP –
1060 пг/мл, МНО – 1,14.
Решением врачебного консилиума выставлены показания к операции: терминальная хроническая сердечная недостаточность ишемического генеза с низкой фракцией выброса обусловливала крайне неблагоприятный прогноз жизни и определила жизненные показания к имплантации устройства гемодинамической поддержки левого желудочка – ИЛЖ. Учитывая наличие гемодинамически значимого поражения ПКА в зоне кровоснабжения жизнеспособного миокарда, рекомендовано одномоментное аутовенозное КШ.
13.09.2023 выполнена операция имплантации ИЛЖ.
Протокол операции
Под наркозом в качестве аутотрансплантата выделена и подготовлена БПВ левой нижней конечности. Выполнены продольная стернотомия, перикардиотомия, системная гепаринизация, канюляция аорты и правых отделов сердца, начато ИК. При помощи системы стабилизации миокарда с использованием микрохирургической техники выполнен дистальный анастомоз аутовены с ЗМЖВ. Проведены сборка и тестирование системы ИЛЖ. Под контролем ЧП ЭхоКГ проведена пальцевая проба, определено место имплантации устройства в области верхушки сердца. Нитью этибонд 2–0 на фетровых прокладках П-образными швами на передне-боковую поверхность сердца фиксировано опорное кольцо. Клеем Bio Glue проведена дополнительная герметизация швов кольца. При помощи миокардиального ножа сформирован тоннель. Насос присоединен к кольцу, фиксирован. Проверка на герметичность с положительным результатом. Проведена частичная эвакуация воздуха из системы. При помощи туннелятора С-образно кабель выведен на переднюю брюшную стенку слева. Продольный зажим на аорту. Сформирован анастомоз по типу «конец в бок» между сосудистым протезом от устройства и восходящей частью аорты. Выполнен
1 проксимальный анастомоз коронарного шунта с аортой. Анастомозы проходимы, герметичны. Насос подсоединен к программатору. Под контролем ЧП ЭхоКГ проведена полная эвакуация воздуха из системы и полостей сердца. Верифицировано положение приносящей канюли, положение насоса удовлетворительное. Отлучение от ИК с параллельным увеличением производительности насоса. Гемодинамика стабильна. Деканюляция. Гемостаз. Подшиты электроды для наружного электрокардиостимулятора. Дренирование перикарда и переднего средостения. Послойное ушивание ран. Асептические повязки. Время операции – 240 мин, время ИК – 116 мин. Интраоперационная кардиотоническая поддержка: добутамин 5 мкг/кг/мин, норадреналин 0,03–0,1 нг/кг/мин. Объем кровопотери –
700 мл. Трансфузии: свежезамороженная плазма –
500 мл, тромбоцитарная взвесь – 267 мл, кристаллоидные р-ры – 500 мл, аутоэритроциты – 500 мл.
Послеоперационное пребывание в отделении реанимации
Первые сутки: экстубирован вечером. Сознание ясное. Гемодинамика стабильная на фоне поддержки ИЛЖ + терапии добутамином 3 мкг/кг/мин, функция органов и систем без особенностей.
Вторые сутки: повышение температуры тела до 38,4°С, в анализах крови (утро) – снижение уровня лейкоцитов до 2×109/л. Жалобы на избыточную болезненность места выхода дренажей (эпигастрий), что потребовало неоднократной аналгезии промедолом. В динамике усиление болевого синдрома в области живота, заторможенность сознания, нарастание дыхательной недостаточности, в связи с чем был переведен на неинвазивную искусственную вентиляцию легких. В последующем продолжала прогрессировать дыхательная недостаточность, отмечено нарастание уровня лактат-ацидоза, в связи с чем начата искусственная вентиляция легких. Несмотря на проводимую терапию, отмечалось снижение индекса оксигенации (PaO2/FiO2<80 мм рт. ст.), нарастание лактат-ацидоза (pH 7,1, Lac 15), гиперкапнии. Принято решение о начале вено-венозной экстракорпоральной мембранной оксигенации. В анализах крови (вечер) – панцитопения (лейкоциты – 0,2×109/л, тромбоциты – 72×109/л, эритроциты – 2,5×1012/л), признаки почечно-печеночной недостаточности, снижение уровня общего белка до 28,4 г/л, нарастание C-реактивного белка до 110,5мг/л, прокальцитонина до
55,8 нг/мл, Lac – более 15. При осмотре обращали на себя внимание вздутие живота, мышечный дефанс, отсутствие перистальтики. Установлен назогастральный зонд, по которому определялось отхождение геморрагического отделяемого. Экстренно выполнены исследования: рентгенография органов брюшной полости – большое количество воздуха в тонкой и толстой кишке; ЭГДС – дефект слизистой субкардиального отдела желудка с признаками состоявшегося кровотечения. Атрофический гастрит. Эндоскопические признаки тяжелой ишемии тонкой кишки от луковицы двенадцатиперстной кишки (ДПК); УЗИ ОБП – свободная жидкость в большом количестве. Признаки расширения петель кишечника в правой и левой подвздошных областях, в селезеночном углу. B правой мезогастральной области «чаши Клойбера», перистальтика отсутствует.
С учетом имеющихся данных в клинический диагноз внесены мезентеральная ишемия, парез кишечника.
Третьи сутки: по решению консилиума врачей с участием абдоминального хирурга принято решение о проведении лапаротомии.
13.09.2023 выполнена лапаротомия.
Протокол лапаротомии
В брюшной полости до 2000 мл непрозрачного серозно-геморрагического выпота. Определяются множественные участки некроза кишечной стенки разной степени выраженности – от багрово-синюшных до серо-зеленых. Перистальтика тонкой кишки отсутствует. Мезентеральные вены и артерии проходимы, без признаков тромбоза и окклюзии. Учитывая объем поражения кишечника, отсутствие отграничения участков некроза, выполнение резекции пораженной тонкой кишки не представлялось возможным.
На основании результатов диагностической лапаротомии абдоминальным хирургом дано следующее заключение: «неокклюзионная мезентеральная ишемия с развитием некроза кишечника, перитонита». Рекомендовано продолжение лечения в условиях ОРИТ.
Несмотря на интенсивную терапию на фоне нарастающей полиорганной недостаточности, некорригируемых метаболических нарушений, наступила остановка кровообращения, асистолия. Реанимационные мероприятия без эффекта.
16.09.2023 проведены аутопсия тела и гистологическое исследование.
Из протокола патологоанатомического вскрытия
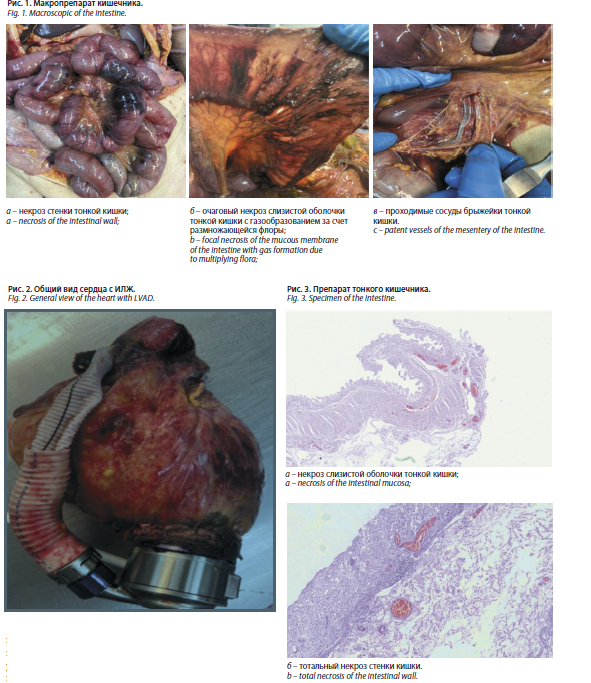 В брюшной полости около 200 мл прозрачной желтоватой жидкости без взвеси. Петли тонкой и толстой кишки на всем протяжении равномерно раздуты газами. Серозная оболочка тонкой кишки в области селезеночного угла, печеночного изгиба и подвздошной области с отграниченными участками интенсивного буровато-красного прокрашивания, целостность стенки кишки в этих зонах не нарушена. На остальном протяжении наружная оболочка гиперемирована, сосудистая сеть расширена. Листки брюшины гладкие прозрачные, без патологических наложений с расширенной капиллярной сетью и точечными кровоизлияниями по боковым фланкам. Крупные сосуды брыжейки тонкой кишки и аркады преимущественно спавшиеся, отмечается венозное полнокровие на уровне брыжеечного края кишки. Слизистая оболочка отечна, гиперемирована, с мелкими, прикрытыми слизью эрозиями, расположенными в области угла и по малой кривизне желудка. Слизистая оболочка ДПК со сглаженной складчатостью, буровато-зеленого цвета, имбибирована желчью. Область большого и малого дуоденального соска резко отечная. В просвете тощей кишки на всем протяжении – жидкое красновато-бурое содержимое. Слизистая оболочка тощей и подвздошной кишки со сглаженной складчатостью, в зонах имбибиции серозной оболочки грязно-коричневого цвета с множественными пузырьками воздуха – некроз стенки (рис. 1 а, б). Слизистая оболочка толстой кишки со сглаженной складчатостью, бледно-серая, с единичными мелкими эрозиями, прикрытыми гематином. При исследовании сосудов брыжейки признаков тромбоза в венозной и артериальной системе не обнаружено (рис. 1 в).
В брюшной полости около 200 мл прозрачной желтоватой жидкости без взвеси. Петли тонкой и толстой кишки на всем протяжении равномерно раздуты газами. Серозная оболочка тонкой кишки в области селезеночного угла, печеночного изгиба и подвздошной области с отграниченными участками интенсивного буровато-красного прокрашивания, целостность стенки кишки в этих зонах не нарушена. На остальном протяжении наружная оболочка гиперемирована, сосудистая сеть расширена. Листки брюшины гладкие прозрачные, без патологических наложений с расширенной капиллярной сетью и точечными кровоизлияниями по боковым фланкам. Крупные сосуды брыжейки тонкой кишки и аркады преимущественно спавшиеся, отмечается венозное полнокровие на уровне брыжеечного края кишки. Слизистая оболочка отечна, гиперемирована, с мелкими, прикрытыми слизью эрозиями, расположенными в области угла и по малой кривизне желудка. Слизистая оболочка ДПК со сглаженной складчатостью, буровато-зеленого цвета, имбибирована желчью. Область большого и малого дуоденального соска резко отечная. В просвете тощей кишки на всем протяжении – жидкое красновато-бурое содержимое. Слизистая оболочка тощей и подвздошной кишки со сглаженной складчатостью, в зонах имбибиции серозной оболочки грязно-коричневого цвета с множественными пузырьками воздуха – некроз стенки (рис. 1 а, б). Слизистая оболочка толстой кишки со сглаженной складчатостью, бледно-серая, с единичными мелкими эрозиями, прикрытыми гематином. При исследовании сосудов брыжейки признаков тромбоза в венозной и артериальной системе не обнаружено (рис. 1 в).
Сердце размерами 15,5×13,0×9,0 см, массой 470 г.
В области верхушки левого желудочка, по передней стенке, хирургическими швами на прокладках фиксирован насос ИЛЖ с отводящим сосудистым протезом, который анастомозирован к восходящему отделу аорты (рис. 2).
Микроскопически стенка тонкой кишки отечна, серозный слой разволокнен. Мышечный слой на всем протяжении с очаговым склерозом, полнокровными сосудами. Слизистая оболочка на фоне аутолиза/некроза атрофична, с очаговой лимфо-лейкоцитарной инфильтрацией (рис. 3 а, б).
При микроскопическом исследовании внутренних органов обнаружено наличие в них микробных отсевов. На рис. 4 представлен препарат сердца с сапрофитной флорой в просвете капилляров миокарда. В прижизненно взятых посевах крови определялся густой рост Escherichia coli (результат получен после смерти пациента).
Таким образом, детальная оценка развития хронологии клинических событий, инструментальные данные, а также совокупность патоморфологических признаков дают основание полагать, что смерть пациента наступила в результате первичной абдоминальной катастрофы – неокклюзионной мезентеральной ишемии с развитием тотального некроза тонкого кишечника, перитонита осложнившегося сепсисом, полиорганной недостаточностью.
Обсуждение
Абдоминальные осложнения после операций на отрытом сердце наблюдаются с частотой до 4% и в основном включают панкреатит, холецистит, мезентеральную ишемию (в основном тромбоэмболического генеза), язвы желудка и ДПК.
Острая неокклюзионная мезентеральная ишемия (ОНМИ) – состояние, развивающееся по причине нарушения в мезентеральных артериях нормального кровотока с нарушением перфузии различных отделов кишечника, приводящее к клеточному повреждению, ишемии и, как следствие, вторичным воспалительным изменениям [8]. Основные причины нарушения висцерального кровообращения при ОНМИ – гипоперфузия как отражение нарушения системной гемодинамики и спазм висцеральных артерий [8]. ОНМИ – редко встречаемое осложнение с самым высоким уровнем смертности – от 40 до 94% [5]. Нами проанализированы основные особенности, обусловливающие высокую смертность при ОНМИ с изучением патофизиологических механизмов, лежащих в их основе (см. таблицу).
Факторы риска развития ОНМИ делятся соответственно этапности хирургического лечения: предоперационные – сердечная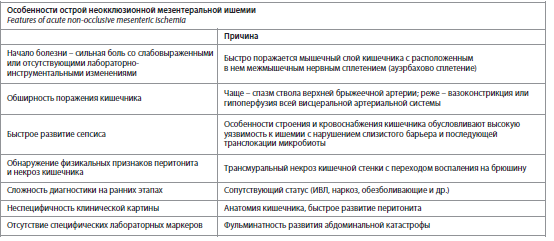 недостаточность, почечная недостаточность, старческий возраст и интраоперационные: продолжительность операции ≥240 мин, время ИК ≥100 мин, переливания >1 единицы эр. взвеси, лактат в сыворотке ≥5 ммоль/л, поддержка норадреналином ≥0,1 мкг/кг/мин [6]. У нашего пациента имелись все вышеперечисленные факторы риска развития ОНМИ за исключением наличия почечной
недостаточность, почечная недостаточность, старческий возраст и интраоперационные: продолжительность операции ≥240 мин, время ИК ≥100 мин, переливания >1 единицы эр. взвеси, лактат в сыворотке ≥5 ммоль/л, поддержка норадреналином ≥0,1 мкг/кг/мин [6]. У нашего пациента имелись все вышеперечисленные факторы риска развития ОНМИ за исключением наличия почечной
недостаточности. Учитывая низкую массу тела пациента (46 кг) на фоне длительного анамнеза терминальной сердечной недостаточности, нами при подготовке к операции был проанализирован нутритивный статус, а также наличие сердечной кахексии как самостоятельных факторов высокого периоперационного риска [7]. Нутритивный статус оценен с использованием калькулятора NRI (nutritional risk index), который установил отсутствие нутритивной недостаточности к моменту имплантации ИЛЖ. Под сердечной кахексией принято считать потерю массы тела более чем на 5% в течение как минимум 6 месяцев, не связанной с применением диуретиков при отечном синдроме или другими несердечными причинами [7]. Из анамнеза известно, что наш пациент в течение жизни имел максимальную массу тела 53 кг (в молодости), и текущая масса тела была характерной для него и в период до выявления ХСН. Таким образом, выраженная сердечная кахексия была исключена. Однако необходимо учитывать, что низкая масса тела, соответственно и низкий объем циркулирующей крови, при выполнении операции на открытом сердце стернотомическим доступом с использованием искусственного кровообращения, инотропной и вазопрессорной терапией могли сыграть роль в возникновении ОНМИ. Особый интерес представляет возможный вклад нефизиологичной системной гемодинамики (после имплантации ИЛЖ) в возникновение ОНМИ. В доступной
научной литературе нами не найдено ни одного сообщения о влиянии непрерывного потока ИЛЖ на возникновение ОНМИ. Изменения микрососудистого кровообращения и характер ответа органов и тканей в ранние и поздние сроки имплантации ИЛЖ мало изучены. По итогам недавних исследований ИЛЖ с непрерывным потоком обеспечивает эквивалентную перфузию, органов и тканей с сохранением функций, как и при пульсирующем потоке ИЛЖ [9].
С момента дебюта клинических проявлений до развития септического состояния у нашего пациента прошло не более суток. Быстрое появление клиники острого живота послужило основанием для экстренного поиска абдоминальной патологии. Рентгенография органов брюшной полости, УЗИ и ЭГДС позволили установить наличие ишемии кишечника. Учитывая быструю отрицательную динамику, тяжесть состояния и высокую вероятность необходимости хирургического лечения, были определены показания к лапаротомии, а не к углубленному поиску причин ишемии и малоинвазивных способов лечения (МСКТ с контрастом, эндоваскулярное вмешательство). Попытка радикального лечения не удалась ввиду обширности поражения кишечника и отсутствия дифференцируемой части «живого» кишечника. Зарубежные исследователи отмечают, что раннее подтверждение ОНМИ возможно при наличии у врачей так называемого высокого индекса подозрительности, основанного на выполнении МСКТ с контрастом органов брюшной полости при появлении болей в животе в сочетании с ацидозом или органной дисфункцией [10]. При выявлении окклюзии артерии возможна коррекция, при проходимых сосудах прогноз крайне неблагоприятный.
Заключение
Представленный случай – это редкое, фатальное осложнение после кардиохирургического вмешательства: острая неокклюзионная мезентеральная ишемия. Проанализировав смертельный случай нашего больного, основываясь на данных литературы и опыте экспертных центров, мы полагаем, что решение об имплантации ИЛЖ у пациентов с низкой массой тела и выраженной старческой астенией должно быть строго индивидуальным. Необходимость имплантации ИЛЖ должна основываться на оценке тяжести сопутствующих состояний, их связи с низким сердечным выбросом и обратимостью заболеваний. У пациентов с факторами риска развития ОНМИ необходимо тщательно мониторировать абдоминальный статус в раннем послеоперационном периоде. МСКТ с контрастом должно быть выполнено в кратчайшие сроки при избыточном болевом синдроме, даже при отсутствии значимых лабораторных отклонений.
Информация о финансировании. Финансирование данной работы не проводилось.
Information about funding. The study had no financial support.
Конфликт интересов. Авторы заявляют об отсутствии потенциального конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Ганаев Камиль Гаджимурадович – канд. мед. наук, мл. науч. сотр. отдела сердечно-сосудистой хирургии, ФГБУ «НМИЦ Кардиологии им. ак. Е.И. Чазова» Минздрава России. E-mail: dr_ganaev@mail.ru; ORCID: 0000-0002-8438-2450
Kamil G. Ganaev – Cand. Sci. (Med.), Department of cardiovascular surgery, Chazov National Medical Research Center of Cardiology. E-mail: dr_ganaev@mail.ru; ORCID: 0000-0002-8438-2450
Лаврикова Татьяна Александровна – аспирант отдела сердечно-сосудистой хирургии, ФГБУ «НМИЦ Кардиологии им. ак. Е.И. Чазова» Минздрава России. ORCID: 0009-0000-2410-2923
Tatiana A. Lavrikova – Graduate Student of cardiosurgery department, Chazov National Medical Research Center
of Cardiology. ORCID: 0009-0000-2410-2923
Дзыбинская Елена Владимировна – д-р мед. наук, ст. науч. сотр. лаборатории анестезиологии и реанимации, ФГБУ «НМИЦ Кардиологии им. ак. Е.И. Чазова» Минздрава России.
ORCID: 0000-0002-1849-442X
Elena V. Dzybinskaya – Cand. Sci. (Med.), Senior Researcher at the Intencive Care Unit, Chazov National Medical Research Center of Cardiology. ORCID: 0000-0002-1849-442X
Власова Элина Евгеньевна – канд. мед. наук, ст. науч. сотр. отдела микрохирургии, ФГБУ «НМИЦ Кардиологии им. ак. Е.И. Чазова» Минздрава России. ORCID: 0000-0003-2925-244X
Elina E. Vlasova – PhD, Senior Researcher, Department of cardiovascular surgery, Chazov National Medical Research Center of Cardiology. ORCID: 0000-0003-2925-244X
Курилина Элла Владимировна – заведующая отделом
патологической хирургии, ФГБУ «НМИЦ Кардиологии
им. ак. Е.И. Чазова» Минздрава России. ORCID: 0000-0002-3208-534Х
Ella V. Kurilina – Head of the Department of Pathological Anatomy, Chazov National Medical Research Center of Cardiology. ORCID: 0000-0002-3208-534Х
Халилулин Тимур Абдулнаимович – д-р мед. наук, сердечно-сосудистый хирург, ФГБУ «НМИЦ трансплантологии и искусственных органов им. ак. В.И. Шумакова» Минздрава России,
ORCID: 0000-0002-6068-4462
Timur А. Khalilulin – PhD, cardiovascular surgeon, Shumakov National Medical Research Center of Transplantology and Artificial Organs. ORCID: 0000-0002-6068-4462
Ширяев Андрей Андреевич – чл.-корр. РАН, проф., д-р мед. наук, руководитель ФГБУ «НМИЦ Кардиологии им. ак. Е.И Чазова» Минздрава России. ORCID: 0000-0002-3325-9743.
Andrej A. Shiryaev – Corr. Memb. RAS, Full Prof., Dr. Sci. (Med.), Head of the Laboratory of Cardiac and Vascular Microsurgery, Chazov National Medical Research Center of Cardiology. ORCID: 0000-0002-3325-9743
Акчурин Ренат Сулейманович – академик РАН, проф., д.м.н., зам. генерального директора по хирургии, ФГБУ «НМИЦ Кардиологии
им. ак. Е.И. Чазова» Минздрава России. ORCID: 0000-0002-6726-4612
Renat S. Akchurin – Acad. RAS, Professor, PhD, Head
of surgery, Chazov National Medical Research Center of Cardiology. ORCID: 0000-0002-6726-4612
Поступила в редакцию: 07.06.2024
Поступила после рецензирования: 13.06.2024
Принята к публикации: 13.06.2024
Received: 07.06.2024
Revised: 13.06.2024
Accepted: 13.06.2024
Kamil G. Ganaev1, Tatiana A. Lavrikova1, Elena V. Dzybinskaya1, Elina E. Vlasovа1,
Ella V. Kurilina1, Timer A. Khalilulin2, Andrey A. Shiryaev1, Renat S. Akchurin1
1 Chazov National Medical Research Center of Cardiology, Moscow, Russia;
2 Shumakov National Medical Research Center of Transplantology and Artificial Organs, Moscow, Russia
dr_ganaev@mail.ru
Abstract
Artificial left ventricle is increasingly used to treat patients with end-stage heart failure. Our report is devoted to a rare complication of cardiac surgical practice, but with an extremely high mortality rate – acute non-occlusive mesenteric intestinal ischemia.
Keywords: non-occlusive mesenteric ischemia, chronic heart failure, left ventricular assist device.
For citation: Ganaev K.G., Lavrikova T.A., Dzybinskaya E.V., Vlasovа E.E., Kurilina E.V., Khalilulin T.A., Shiryaev A.A., Akchurin R.S. Acute non-occlusive mesenteric ischemia after implantation of an left ventricular assist device. Clinical review for general practice. 2024; 5 (6): 26–32 (In Russ.). DOI: 10.47407/kr2024.5.6.00431
Введение
Терминальная хроническая сердечная недостаточность (ХСН) – сложный синдром, итог многих сердечно-сосудистых заболеваний, его распространенность растет во всем мире. Несмотря на достижения в системе здравоохранения, заболеваемость сердечной недостаточностью неуклонно прогрессирует, а общая выживаемость и качество жизни при этом снижаются [1]. Рост ХСН во многом обусловлен улучшением оказания медицинской помощи больным с острым коронарным синдромом, улучшением выживаемости при многих сердечно-сосудистых заболеваниях и увеличением числа пациентов с имплантированным кардиовертерами-дефибрилляторами [2].
Возможности лечения ХСН за последние годы значительно улучшаются, однако «золотым стандартом» лечения терминальной ХСН, которая позволяет повысить функциональные возможности наряду с увеличением продолжительности жизни, остается трансплантация сердца (ТС) [3]. Однако доступ к этой терапии ограничен из-за нехватки донорских сердец и растущего числа пациентов, не подходящих для ТС. Эти и другие факторы привели к развитию производства механических устройств гемодинамической поддержки левого желудочка – искусственных левых желудочков (ИЛЖ). Первоначально ИЛЖ задумывался в качестве моста к трансплантации, когда устройство имплантировали ненадолго в качестве поддерживающей терапии, на время нахождения в списке ожидания донорского сердца. Модернизация ИЛЖ, усовершенствование медикаментозного ведения в постимплантационный период привели к тому, что ИЛЖ был одобрен в качестве целевой терапии терминальной ХСН [4]. Для достижения хороших и стабильных результатов имплантации ИЛЖ пациентам крайне высокого периоперационного риска от команды специалистов требуются качественный отбор пациентов, понимание особенностей новой модели системной гемодинамики и тщательное наблюдение в послеоперационном периоде.
Представляем собственное наблюдение летального случая после имплантации ИЛЖ, обусловленного развитием острой неокклюзионной мезентеральной ишемии (ОНМИ).
Клинический случай
Пациент А., 65 лет, поступил с жалобами на одышку при минимальной физической нагрузке, усталость при повседневной физической нагрузке, периодическое головокружение на фоне сниженного артериального давления (АД). На протяжении длительного времени отмечал повышенные цифры АД, по данному поводу не обследовался, в последующем – нормализация АД без медикаментозной терапии. Коронарный анамнез с 2014 г., когда впервые возникла клиника стенокардии напряжения на уровне 2 ФК. В 2015 г. перенес инфаркт миокарда передней локализации, проведено консервативное лечение. С этого же года дебют клиники ХСН. В 2020 г. – повторный инфаркт миокарда передне-перегородочной локализации. При обследовании: ФВ ЛЖ до 25%, многососудистое поражение коронарных артерий (окклюзия проксимального сегмента передней нисходящей артерии и правой коронарной артерии, cтеноз до 90% диагональной артерии). Коронарное шунтирование не предлагалось ввиду обширной зоны ПИКС, предложена ТС, от которой пациент отказался. Начата медикаментозная терапия ХСН, предпринимались попытки назначения сакубитрил/валсартана, однако на фоне малых доз препарата отмечалась выраженная склонность к гипотонии. В июне 2023 г. – эпизод декомпенсации ХСН, тогда же был впервые зарегистрирован пароксизм фибрилляции предсердий. В августе 2023 г. пациент поступил в отдел сердечно-сосудистой хирургии ФГБУ «Национальный медицинский исследовательский центр кардиологии им. ак.
Е.И. Чазова» Минздрава России (ФГБУ «НМИЦ кардиологии им. акад. Е.И. Чазова»).
Амбулаторно принимал: дапаглифлозин 10 мг/сут, спиронолактон 25 мг/сут, бисопролол 1,25 мг/сут, амиодарон 200 мг/сут, апиксабан 10 мг/сут, аторвастатин 40 мг/сут.
Объективный статус при поступлении: рост
168 см, масса тела 46 кг, ИМТ – 16,3, ППТ – 1,5 м2, состояние средней тяжести, одышка при минимальной нагрузке, ЧСС – 60–65 в минуту, АД – 90/60 мм рт. ст. Тоны сердца приглушены, ЧДД – 14 в минуту. В легких дыхание везикулярное, проводится во все отделы, единичные влажные хрипы в н/о. Сатурация – 98%. Печень не увеличена. Тест 6-минутной ходьбы – 310 м.
Результаты инструментального
и лабораторного обследования
ЭКГ: ритм синусовый с ЧСС 60 уд/мин, неполная блокада левой ножки пучка Гиса, подъем сегмента ST в отв. V1–V4 макс. до 1 мм. Рентгенография ОГК: очаговых и инфильтративных изменений нет. Усилен легочный рисунок за счет интерстициального компонента. Нарушений легочной гемодинамики нет. Расширение сердца в поперечнике, КТИ – 56. Спирометрия: жизненная емкость легких и показатели проходимости дыхательных путей в пределах возрастной нормы. ЭхоКГ: увеличение левых камер сердца (КДР – 7,5 см, объем ЛП – 72 мл), ФВ ЛЖ – 25%, ТМЖП: 0,7 см, ТЗСЛЖ: 0,9 см. Акинез апикальных, средних сегментов передней, передне-перегородочной стенок с переходом на апикальные сегменты боковой и нижней стенок, истончение
(~ 0,4–0,5 см) миокарда на уровне апикальных сегментов всех стенок и верхушки. Также зона гипоакинезии базального, среднего сегментов нижней и задней стенок. Функциональная регургитация МК 2–3-й степени ПП – 15 см2, ФВ ПЖ – 55%, TAPSE – 1,6 см, ПЖ FAC – 61% , RVED1 – 3,2 см, RVED2 – 2,2 см, RVED1/LV – 0,48. Признаков легочной гипертензии не выявлено. МРТ сердца с гадолинием: обширное очагово-рубцовое поражение миокарда передней локализации с формированием аневризмы в области верхушки. КДР ЛЖ =
75 мм, КДО ЛЖ = 298 мл, КДОи ЛЖ = 198 мл/м2.
Катетеризация правых отделов сердца (КПОС): СВ –
4,5 л/мин, ЛСС – 1,5 Ед. Вуда, ср. ДЛА – 16 мм рт. ст., ДЗЛА – 9 мм рт. ст. Коронарография: тип кровоснабжения правый. Окклюзия ПНА, стеноз ДА до 80%, окклюзия ПКА. В анализах крови: гемоглобин – 149 г/л, гематокрит – 45,0%, лейкоциты – 6,5×109/л, тромбоциты – 233×109/л, креатинин – 65,4 мкмоль/л, общий белок – 65,4 г/л, холестерин – 3,84 ммоль/л, NT-proBNP –
1060 пг/мл, МНО – 1,14.
Решением врачебного консилиума выставлены показания к операции: терминальная хроническая сердечная недостаточность ишемического генеза с низкой фракцией выброса обусловливала крайне неблагоприятный прогноз жизни и определила жизненные показания к имплантации устройства гемодинамической поддержки левого желудочка – ИЛЖ. Учитывая наличие гемодинамически значимого поражения ПКА в зоне кровоснабжения жизнеспособного миокарда, рекомендовано одномоментное аутовенозное КШ.
13.09.2023 выполнена операция имплантации ИЛЖ.
Протокол операции
Под наркозом в качестве аутотрансплантата выделена и подготовлена БПВ левой нижней конечности. Выполнены продольная стернотомия, перикардиотомия, системная гепаринизация, канюляция аорты и правых отделов сердца, начато ИК. При помощи системы стабилизации миокарда с использованием микрохирургической техники выполнен дистальный анастомоз аутовены с ЗМЖВ. Проведены сборка и тестирование системы ИЛЖ. Под контролем ЧП ЭхоКГ проведена пальцевая проба, определено место имплантации устройства в области верхушки сердца. Нитью этибонд 2–0 на фетровых прокладках П-образными швами на передне-боковую поверхность сердца фиксировано опорное кольцо. Клеем Bio Glue проведена дополнительная герметизация швов кольца. При помощи миокардиального ножа сформирован тоннель. Насос присоединен к кольцу, фиксирован. Проверка на герметичность с положительным результатом. Проведена частичная эвакуация воздуха из системы. При помощи туннелятора С-образно кабель выведен на переднюю брюшную стенку слева. Продольный зажим на аорту. Сформирован анастомоз по типу «конец в бок» между сосудистым протезом от устройства и восходящей частью аорты. Выполнен
1 проксимальный анастомоз коронарного шунта с аортой. Анастомозы проходимы, герметичны. Насос подсоединен к программатору. Под контролем ЧП ЭхоКГ проведена полная эвакуация воздуха из системы и полостей сердца. Верифицировано положение приносящей канюли, положение насоса удовлетворительное. Отлучение от ИК с параллельным увеличением производительности насоса. Гемодинамика стабильна. Деканюляция. Гемостаз. Подшиты электроды для наружного электрокардиостимулятора. Дренирование перикарда и переднего средостения. Послойное ушивание ран. Асептические повязки. Время операции – 240 мин, время ИК – 116 мин. Интраоперационная кардиотоническая поддержка: добутамин 5 мкг/кг/мин, норадреналин 0,03–0,1 нг/кг/мин. Объем кровопотери –
700 мл. Трансфузии: свежезамороженная плазма –
500 мл, тромбоцитарная взвесь – 267 мл, кристаллоидные р-ры – 500 мл, аутоэритроциты – 500 мл.
Послеоперационное пребывание в отделении реанимации
Первые сутки: экстубирован вечером. Сознание ясное. Гемодинамика стабильная на фоне поддержки ИЛЖ + терапии добутамином 3 мкг/кг/мин, функция органов и систем без особенностей.
Вторые сутки: повышение температуры тела до 38,4°С, в анализах крови (утро) – снижение уровня лейкоцитов до 2×109/л. Жалобы на избыточную болезненность места выхода дренажей (эпигастрий), что потребовало неоднократной аналгезии промедолом. В динамике усиление болевого синдрома в области живота, заторможенность сознания, нарастание дыхательной недостаточности, в связи с чем был переведен на неинвазивную искусственную вентиляцию легких. В последующем продолжала прогрессировать дыхательная недостаточность, отмечено нарастание уровня лактат-ацидоза, в связи с чем начата искусственная вентиляция легких. Несмотря на проводимую терапию, отмечалось снижение индекса оксигенации (PaO2/FiO2<80 мм рт. ст.), нарастание лактат-ацидоза (pH 7,1, Lac 15), гиперкапнии. Принято решение о начале вено-венозной экстракорпоральной мембранной оксигенации. В анализах крови (вечер) – панцитопения (лейкоциты – 0,2×109/л, тромбоциты – 72×109/л, эритроциты – 2,5×1012/л), признаки почечно-печеночной недостаточности, снижение уровня общего белка до 28,4 г/л, нарастание C-реактивного белка до 110,5мг/л, прокальцитонина до
55,8 нг/мл, Lac – более 15. При осмотре обращали на себя внимание вздутие живота, мышечный дефанс, отсутствие перистальтики. Установлен назогастральный зонд, по которому определялось отхождение геморрагического отделяемого. Экстренно выполнены исследования: рентгенография органов брюшной полости – большое количество воздуха в тонкой и толстой кишке; ЭГДС – дефект слизистой субкардиального отдела желудка с признаками состоявшегося кровотечения. Атрофический гастрит. Эндоскопические признаки тяжелой ишемии тонкой кишки от луковицы двенадцатиперстной кишки (ДПК); УЗИ ОБП – свободная жидкость в большом количестве. Признаки расширения петель кишечника в правой и левой подвздошных областях, в селезеночном углу. B правой мезогастральной области «чаши Клойбера», перистальтика отсутствует.
С учетом имеющихся данных в клинический диагноз внесены мезентеральная ишемия, парез кишечника.
Третьи сутки: по решению консилиума врачей с участием абдоминального хирурга принято решение о проведении лапаротомии.
13.09.2023 выполнена лапаротомия.
Протокол лапаротомии
В брюшной полости до 2000 мл непрозрачного серозно-геморрагического выпота. Определяются множественные участки некроза кишечной стенки разной степени выраженности – от багрово-синюшных до серо-зеленых. Перистальтика тонкой кишки отсутствует. Мезентеральные вены и артерии проходимы, без признаков тромбоза и окклюзии. Учитывая объем поражения кишечника, отсутствие отграничения участков некроза, выполнение резекции пораженной тонкой кишки не представлялось возможным.
На основании результатов диагностической лапаротомии абдоминальным хирургом дано следующее заключение: «неокклюзионная мезентеральная ишемия с развитием некроза кишечника, перитонита». Рекомендовано продолжение лечения в условиях ОРИТ.
Несмотря на интенсивную терапию на фоне нарастающей полиорганной недостаточности, некорригируемых метаболических нарушений, наступила остановка кровообращения, асистолия. Реанимационные мероприятия без эффекта.
16.09.2023 проведены аутопсия тела и гистологическое исследование.
Из протокола патологоанатомического вскрытия
 В брюшной полости около 200 мл прозрачной желтоватой жидкости без взвеси. Петли тонкой и толстой кишки на всем протяжении равномерно раздуты газами. Серозная оболочка тонкой кишки в области селезеночного угла, печеночного изгиба и подвздошной области с отграниченными участками интенсивного буровато-красного прокрашивания, целостность стенки кишки в этих зонах не нарушена. На остальном протяжении наружная оболочка гиперемирована, сосудистая сеть расширена. Листки брюшины гладкие прозрачные, без патологических наложений с расширенной капиллярной сетью и точечными кровоизлияниями по боковым фланкам. Крупные сосуды брыжейки тонкой кишки и аркады преимущественно спавшиеся, отмечается венозное полнокровие на уровне брыжеечного края кишки. Слизистая оболочка отечна, гиперемирована, с мелкими, прикрытыми слизью эрозиями, расположенными в области угла и по малой кривизне желудка. Слизистая оболочка ДПК со сглаженной складчатостью, буровато-зеленого цвета, имбибирована желчью. Область большого и малого дуоденального соска резко отечная. В просвете тощей кишки на всем протяжении – жидкое красновато-бурое содержимое. Слизистая оболочка тощей и подвздошной кишки со сглаженной складчатостью, в зонах имбибиции серозной оболочки грязно-коричневого цвета с множественными пузырьками воздуха – некроз стенки (рис. 1 а, б). Слизистая оболочка толстой кишки со сглаженной складчатостью, бледно-серая, с единичными мелкими эрозиями, прикрытыми гематином. При исследовании сосудов брыжейки признаков тромбоза в венозной и артериальной системе не обнаружено (рис. 1 в).
В брюшной полости около 200 мл прозрачной желтоватой жидкости без взвеси. Петли тонкой и толстой кишки на всем протяжении равномерно раздуты газами. Серозная оболочка тонкой кишки в области селезеночного угла, печеночного изгиба и подвздошной области с отграниченными участками интенсивного буровато-красного прокрашивания, целостность стенки кишки в этих зонах не нарушена. На остальном протяжении наружная оболочка гиперемирована, сосудистая сеть расширена. Листки брюшины гладкие прозрачные, без патологических наложений с расширенной капиллярной сетью и точечными кровоизлияниями по боковым фланкам. Крупные сосуды брыжейки тонкой кишки и аркады преимущественно спавшиеся, отмечается венозное полнокровие на уровне брыжеечного края кишки. Слизистая оболочка отечна, гиперемирована, с мелкими, прикрытыми слизью эрозиями, расположенными в области угла и по малой кривизне желудка. Слизистая оболочка ДПК со сглаженной складчатостью, буровато-зеленого цвета, имбибирована желчью. Область большого и малого дуоденального соска резко отечная. В просвете тощей кишки на всем протяжении – жидкое красновато-бурое содержимое. Слизистая оболочка тощей и подвздошной кишки со сглаженной складчатостью, в зонах имбибиции серозной оболочки грязно-коричневого цвета с множественными пузырьками воздуха – некроз стенки (рис. 1 а, б). Слизистая оболочка толстой кишки со сглаженной складчатостью, бледно-серая, с единичными мелкими эрозиями, прикрытыми гематином. При исследовании сосудов брыжейки признаков тромбоза в венозной и артериальной системе не обнаружено (рис. 1 в).Сердце размерами 15,5×13,0×9,0 см, массой 470 г.
В области верхушки левого желудочка, по передней стенке, хирургическими швами на прокладках фиксирован насос ИЛЖ с отводящим сосудистым протезом, который анастомозирован к восходящему отделу аорты (рис. 2).
Микроскопически стенка тонкой кишки отечна, серозный слой разволокнен. Мышечный слой на всем протяжении с очаговым склерозом, полнокровными сосудами. Слизистая оболочка на фоне аутолиза/некроза атрофична, с очаговой лимфо-лейкоцитарной инфильтрацией (рис. 3 а, б).
При микроскопическом исследовании внутренних органов обнаружено наличие в них микробных отсевов. На рис. 4 представлен препарат сердца с сапрофитной флорой в просвете капилляров миокарда. В прижизненно взятых посевах крови определялся густой рост Escherichia coli (результат получен после смерти пациента).
Таким образом, детальная оценка развития хронологии клинических событий, инструментальные данные, а также совокупность патоморфологических признаков дают основание полагать, что смерть пациента наступила в результате первичной абдоминальной катастрофы – неокклюзионной мезентеральной ишемии с развитием тотального некроза тонкого кишечника, перитонита осложнившегося сепсисом, полиорганной недостаточностью.
Обсуждение
Абдоминальные осложнения после операций на отрытом сердце наблюдаются с частотой до 4% и в основном включают панкреатит, холецистит, мезентеральную ишемию (в основном тромбоэмболического генеза), язвы желудка и ДПК.
Острая неокклюзионная мезентеральная ишемия (ОНМИ) – состояние, развивающееся по причине нарушения в мезентеральных артериях нормального кровотока с нарушением перфузии различных отделов кишечника, приводящее к клеточному повреждению, ишемии и, как следствие, вторичным воспалительным изменениям [8]. Основные причины нарушения висцерального кровообращения при ОНМИ – гипоперфузия как отражение нарушения системной гемодинамики и спазм висцеральных артерий [8]. ОНМИ – редко встречаемое осложнение с самым высоким уровнем смертности – от 40 до 94% [5]. Нами проанализированы основные особенности, обусловливающие высокую смертность при ОНМИ с изучением патофизиологических механизмов, лежащих в их основе (см. таблицу).
Факторы риска развития ОНМИ делятся соответственно этапности хирургического лечения: предоперационные – сердечная
 недостаточность, почечная недостаточность, старческий возраст и интраоперационные: продолжительность операции ≥240 мин, время ИК ≥100 мин, переливания >1 единицы эр. взвеси, лактат в сыворотке ≥5 ммоль/л, поддержка норадреналином ≥0,1 мкг/кг/мин [6]. У нашего пациента имелись все вышеперечисленные факторы риска развития ОНМИ за исключением наличия почечной
недостаточность, почечная недостаточность, старческий возраст и интраоперационные: продолжительность операции ≥240 мин, время ИК ≥100 мин, переливания >1 единицы эр. взвеси, лактат в сыворотке ≥5 ммоль/л, поддержка норадреналином ≥0,1 мкг/кг/мин [6]. У нашего пациента имелись все вышеперечисленные факторы риска развития ОНМИ за исключением наличия почечной недостаточности. Учитывая низкую массу тела пациента (46 кг) на фоне длительного анамнеза терминальной сердечной недостаточности, нами при подготовке к операции был проанализирован нутритивный статус, а также наличие сердечной кахексии как самостоятельных факторов высокого периоперационного риска [7]. Нутритивный статус оценен с использованием калькулятора NRI (nutritional risk index), который установил отсутствие нутритивной недостаточности к моменту имплантации ИЛЖ. Под сердечной кахексией принято считать потерю массы тела более чем на 5% в течение как минимум 6 месяцев, не связанной с применением диуретиков при отечном синдроме или другими несердечными причинами [7]. Из анамнеза известно, что наш пациент в течение жизни имел максимальную массу тела 53 кг (в молодости), и текущая масса тела была характерной для него и в период до выявления ХСН. Таким образом, выраженная сердечная кахексия была исключена. Однако необходимо учитывать, что низкая масса тела, соответственно и низкий объем циркулирующей крови, при выполнении операции на открытом сердце стернотомическим доступом с использованием искусственного кровообращения, инотропной и вазопрессорной терапией могли сыграть роль в возникновении ОНМИ. Особый интерес представляет возможный вклад нефизиологичной системной гемодинамики (после имплантации ИЛЖ) в возникновение ОНМИ. В доступной
научной литературе нами не найдено ни одного сообщения о влиянии непрерывного потока ИЛЖ на возникновение ОНМИ. Изменения микрососудистого кровообращения и характер ответа органов и тканей в ранние и поздние сроки имплантации ИЛЖ мало изучены. По итогам недавних исследований ИЛЖ с непрерывным потоком обеспечивает эквивалентную перфузию, органов и тканей с сохранением функций, как и при пульсирующем потоке ИЛЖ [9].
С момента дебюта клинических проявлений до развития септического состояния у нашего пациента прошло не более суток. Быстрое появление клиники острого живота послужило основанием для экстренного поиска абдоминальной патологии. Рентгенография органов брюшной полости, УЗИ и ЭГДС позволили установить наличие ишемии кишечника. Учитывая быструю отрицательную динамику, тяжесть состояния и высокую вероятность необходимости хирургического лечения, были определены показания к лапаротомии, а не к углубленному поиску причин ишемии и малоинвазивных способов лечения (МСКТ с контрастом, эндоваскулярное вмешательство). Попытка радикального лечения не удалась ввиду обширности поражения кишечника и отсутствия дифференцируемой части «живого» кишечника. Зарубежные исследователи отмечают, что раннее подтверждение ОНМИ возможно при наличии у врачей так называемого высокого индекса подозрительности, основанного на выполнении МСКТ с контрастом органов брюшной полости при появлении болей в животе в сочетании с ацидозом или органной дисфункцией [10]. При выявлении окклюзии артерии возможна коррекция, при проходимых сосудах прогноз крайне неблагоприятный.
Заключение
Представленный случай – это редкое, фатальное осложнение после кардиохирургического вмешательства: острая неокклюзионная мезентеральная ишемия. Проанализировав смертельный случай нашего больного, основываясь на данных литературы и опыте экспертных центров, мы полагаем, что решение об имплантации ИЛЖ у пациентов с низкой массой тела и выраженной старческой астенией должно быть строго индивидуальным. Необходимость имплантации ИЛЖ должна основываться на оценке тяжести сопутствующих состояний, их связи с низким сердечным выбросом и обратимостью заболеваний. У пациентов с факторами риска развития ОНМИ необходимо тщательно мониторировать абдоминальный статус в раннем послеоперационном периоде. МСКТ с контрастом должно быть выполнено в кратчайшие сроки при избыточном болевом синдроме, даже при отсутствии значимых лабораторных отклонений.
Информация о финансировании. Финансирование данной работы не проводилось.
Information about funding. The study had no financial support.
Конфликт интересов. Авторы заявляют об отсутствии потенциального конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Ганаев Камиль Гаджимурадович – канд. мед. наук, мл. науч. сотр. отдела сердечно-сосудистой хирургии, ФГБУ «НМИЦ Кардиологии им. ак. Е.И. Чазова» Минздрава России. E-mail: dr_ganaev@mail.ru; ORCID: 0000-0002-8438-2450
Kamil G. Ganaev – Cand. Sci. (Med.), Department of cardiovascular surgery, Chazov National Medical Research Center of Cardiology. E-mail: dr_ganaev@mail.ru; ORCID: 0000-0002-8438-2450
Лаврикова Татьяна Александровна – аспирант отдела сердечно-сосудистой хирургии, ФГБУ «НМИЦ Кардиологии им. ак. Е.И. Чазова» Минздрава России. ORCID: 0009-0000-2410-2923
Tatiana A. Lavrikova – Graduate Student of cardiosurgery department, Chazov National Medical Research Center
of Cardiology. ORCID: 0009-0000-2410-2923
Дзыбинская Елена Владимировна – д-р мед. наук, ст. науч. сотр. лаборатории анестезиологии и реанимации, ФГБУ «НМИЦ Кардиологии им. ак. Е.И. Чазова» Минздрава России.
ORCID: 0000-0002-1849-442X
Elena V. Dzybinskaya – Cand. Sci. (Med.), Senior Researcher at the Intencive Care Unit, Chazov National Medical Research Center of Cardiology. ORCID: 0000-0002-1849-442X
Власова Элина Евгеньевна – канд. мед. наук, ст. науч. сотр. отдела микрохирургии, ФГБУ «НМИЦ Кардиологии им. ак. Е.И. Чазова» Минздрава России. ORCID: 0000-0003-2925-244X
Elina E. Vlasova – PhD, Senior Researcher, Department of cardiovascular surgery, Chazov National Medical Research Center of Cardiology. ORCID: 0000-0003-2925-244X
Курилина Элла Владимировна – заведующая отделом
патологической хирургии, ФГБУ «НМИЦ Кардиологии
им. ак. Е.И. Чазова» Минздрава России. ORCID: 0000-0002-3208-534Х
Ella V. Kurilina – Head of the Department of Pathological Anatomy, Chazov National Medical Research Center of Cardiology. ORCID: 0000-0002-3208-534Х
Халилулин Тимур Абдулнаимович – д-р мед. наук, сердечно-сосудистый хирург, ФГБУ «НМИЦ трансплантологии и искусственных органов им. ак. В.И. Шумакова» Минздрава России,
ORCID: 0000-0002-6068-4462
Timur А. Khalilulin – PhD, cardiovascular surgeon, Shumakov National Medical Research Center of Transplantology and Artificial Organs. ORCID: 0000-0002-6068-4462
Ширяев Андрей Андреевич – чл.-корр. РАН, проф., д-р мед. наук, руководитель ФГБУ «НМИЦ Кардиологии им. ак. Е.И Чазова» Минздрава России. ORCID: 0000-0002-3325-9743.
Andrej A. Shiryaev – Corr. Memb. RAS, Full Prof., Dr. Sci. (Med.), Head of the Laboratory of Cardiac and Vascular Microsurgery, Chazov National Medical Research Center of Cardiology. ORCID: 0000-0002-3325-9743
Акчурин Ренат Сулейманович – академик РАН, проф., д.м.н., зам. генерального директора по хирургии, ФГБУ «НМИЦ Кардиологии
им. ак. Е.И. Чазова» Минздрава России. ORCID: 0000-0002-6726-4612
Renat S. Akchurin – Acad. RAS, Professor, PhD, Head
of surgery, Chazov National Medical Research Center of Cardiology. ORCID: 0000-0002-6726-4612
Поступила в редакцию: 07.06.2024
Поступила после рецензирования: 13.06.2024
Принята к публикации: 13.06.2024
Received: 07.06.2024
Revised: 13.06.2024
Accepted: 13.06.2024


