Клинический разбор в общей медицине №7 2024
Аннотация
Рак желудка является крайне агрессивным заболеванием и представляет собой актуальную проблему среди клиницистов. В настоящее время более половины пациентов с впервые установленным диагнозом «рак желудка» имеют местно-распространенный процесс, требующий комбинированного подхода – сочетания хирургического лечения и неоадьювантной/периоперационной терапии. У ряда пациентов после проведения предоперационной лекарственной терапии отмечается выраженная или даже полная регрессия опухоли, что определяет прогноз течения заболевания. Необходимость проведения адьювантной терапии для данной категории больных является предметом дискуссии. В данной работе продемонстрировано клиническое наблюдение полного клинико-рентгенологического и морфологического ответа после неоадьюваной терапии (2 цикла химиотерапии FLOT + химиолучевая терапия) и длительной безрецидивной выживаемости у больного местно-распространенным раком желудка.
Ключевые слова: местно-распространенный рак желудка, неоадъювантная терапия, полный ответ опухоли, выживаемость.
Для цитирования: Миронова Д.Ю., Скоропад В.Ю., Силантьева Н.К., Агабабян Т.А., Жаворонкова Е.С., Иванов С.А., Каприн А.Д. Клиническое наблюдение полного клинико-рентгенологического и патоморфологического ответа у больного местно-распространенной аденокарциномой желудка после неоадъювантной терапии. Клинический разбор в общей медицине. 2024; 5 (7): 6–11. DOI: 10.47407/ kr2024.5.7.00442
Клинический разбор в общей медицине №7 2024
Клиническое наблюдение полного клинико-рентгенологического и патоморфологического ответа у больного местно-распространенной аденокарциномой желудка после неоадъювантной терапии
Аннотация
Рак желудка является крайне агрессивным заболеванием и представляет собой актуальную проблему среди клиницистов. В настоящее время более половины пациентов с впервые установленным диагнозом «рак желудка» имеют местно-распространенный процесс, требующий комбинированного подхода – сочетания хирургического лечения и неоадьювантной/периоперационной терапии. У ряда пациентов после проведения предоперационной лекарственной терапии отмечается выраженная или даже полная регрессия опухоли, что определяет прогноз течения заболевания. Необходимость проведения адьювантной терапии для данной категории больных является предметом дискуссии. В данной работе продемонстрировано клиническое наблюдение полного клинико-рентгенологического и морфологического ответа после неоадьюваной терапии (2 цикла химиотерапии FLOT + химиолучевая терапия) и длительной безрецидивной выживаемости у больного местно-распространенным раком желудка.
Ключевые слова: местно-распространенный рак желудка, неоадъювантная терапия, полный ответ опухоли, выживаемость.
Для цитирования: Миронова Д.Ю., Скоропад В.Ю., Силантьева Н.К., Агабабян Т.А., Жаворонкова Е.С., Иванов С.А., Каприн А.Д. Клиническое наблюдение полного клинико-рентгенологического и патоморфологического ответа у больного местно-распространенной аденокарциномой желудка после неоадъювантной терапии. Клинический разбор в общей медицине. 2024; 5 (7): 6–11. DOI: 10.47407/ kr2024.5.7.00442
Clinical Case
Clinical observation of a complete clinical, radiological and pathomorphological response in a patient with locally advanced gastric adenocarcinoma after neoadjuvant therapy
Diana Yu. Mironova1, Vitaliy Yu. Skoropad1, Natalya K. Silanteva1, Tatev A. Agababyan1,
Ekaterina S. Zhavoronkova1, Sergey A. Ivanov1,3, Andrey D. Kaprin2,3,4
1Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia;
2National Medical Research Radiological Centre of the Ministry of Health of the Russian Federation, Moscow, Russia;
3Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
4Hertsen Moscow Oncology Research Institute – branch of the National Medical Research Radiological Centre of the Ministry of Health of the Russian Federation, Moscow, Russia
dimir09@yandex.ru
Abstract
Stomach cancer is an aggressive disease and represents a global health problem. Currently, more than 50% of patients with a newly diagnosed stomach cancer have a locally advanced process that requires a combined approach – a combination of surgical treatment and neoadjuvant/perioperative therapy. In a number of patients, after neoadjuvant therapy, there is a marked or even complete regression of the tumor; the prognosis of the disease, as well as the need for adjuvant therapy in this category of patients is the subject of discussion. This paper demonstrates the clinical observation of a complete clinical, radiological and morphological response after neoadjuvant therapy (2 cycles of chemotherapy FLOT + chemoradiotherapy), as well as long-term relapse-free survival in a patient with locally advanced gastric cancer.
Keywords: locally advanced gastric cancer, neoadjuvant therapy, complete tumor response, survival.
For citation: Mironova D.Yu., Skoropad V.Yu., Silanteva N.K., Agababian T.A., Zhavoronkova E.S., Ivanov S.A., Kaprin A.D. Clinical observation of a complete clinical, radiological and pathomorphological response in a patient with locally advanced gastric adenocarcinoma after neoadjuvant therapy. Clinical review for general practice. 2024; 5 (7): 6-11. (In Russ.). DOI: 10.47407/kr2024.5.7.00442
Введение
Рак желудка является одним из наиболее распространенных и агрессивно текущих онкологических заболеваний; по показателям заболеваемости и смертности он входит в первую пятерку злокачественных новообразований в России и в мире, преобладают местно-распространенные и распространенные стадии [1]. В настоящее время периоперационная полихимиотерапия по схеме FLOT в сочетании с радикальным хирургическим вмешательством признаны стандартом лечения местно-распространенного рака желудка [2]. Предметом активного изучения, в том числе в рамках многоцентровых рандомизированных исследований, является безопасность и эффективность неоадъювантной химиолучевой терапии [3, 4].
Клинико-рентгенологический и патоморфологический ответ опухоли на проводимую неоадъювантную терапию являются важнейшими критериями непосредственной эффективности лечения и первичными конечными точками многих клинических исследований 2–3-й фазы. Хотя их корреляция с отдаленными результатами лечения не является общепризнанной [5], большинство авторов в своих публикациях убедительно показывают позитивное влияние выраженного ответа опухоли на прогноз заболевания. По данным ряда авторов, достижение полного лечебного патоморфоза после неоадъювантной терапии у пациентов с местно-распространенным раком желудка является независимым статистически значимым предиктором улучшения показателей общей и безрецидивной выживаемости [6–9].
В связи с этим предметом дискуссии и продолжающихся научных исследований является оптимизация неоадъювантного компонента лечения больных раком желудка, а также оценка целесообразности проведения адъювантной терапии в зависимости от ответа опухоли на проводимую терапию [3, 4, 10].
В МРНЦ им. А.Ф. Цыба был разработан и апробирован новый метод комбинированного лечения пациентов с резектабельным раком желудка. Клинический протокол 2-й фазы «Неоадъювантная индукционная полихимиотерапия и химиолучевая терапия с последующей гастрэктомией D2 у больных местно-распространенным раком желудка» был одобрен локальным этическим комитетом МРНЦ им. А.Ф. Цыба и утвержден на заседании Ученого Совета ФГБУ «НМИЦ Радиологии» Минздрава России.
В настоящей работе нами приводится клиническое наблюдение полного клинико-рентгенологического и патоморфологического ответа, а также длительной безрецидивной выживаемости у больного с местно-распространенным раком желудка после неоадъювантной терапии.
Клиническое наблюдение
Пациент М., 64 лет, был госпитализирован в стационар по месту жительства с признаками желудочно-кишечного кровотечения, была проведена гемостатическая терапия с положительным эффектом. При обследовании по данным эзофагогастродуоденоскопии (ЭФГДС) была выявлена опухоль проксимального отдела желудка. С целью выработки тактики лечения пациент обратился в МРНЦ им. А.Ф. Цыба.
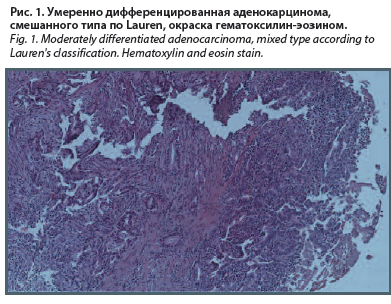 В центре было проведено дообследование, включавшее: ЭФГДС, пересмотр блоков и стекол, спиральную компьютерную томографию (СКТ) органов грудной клетки и брюшной полости с внутривенным контрастированием, ультразвуковое исследование (УЗИ) надключичных областей и малого таза, исследование уровня онкомаркеров, общеклинические тесты, осмотр профильных специалистов. По данным ЭФГДС, выявлена инфильтративная опухоль тела и проксимального отдела желудка с вовлечением кардии. При морфологическом исследовании материала биопсии выявлены фрагменты слизистой желудка с инвазивным ростом умеренно дифференцированной аденокарциномы, смешанного типа по Lauren (рис. 1).
В центре было проведено дообследование, включавшее: ЭФГДС, пересмотр блоков и стекол, спиральную компьютерную томографию (СКТ) органов грудной клетки и брюшной полости с внутривенным контрастированием, ультразвуковое исследование (УЗИ) надключичных областей и малого таза, исследование уровня онкомаркеров, общеклинические тесты, осмотр профильных специалистов. По данным ЭФГДС, выявлена инфильтративная опухоль тела и проксимального отдела желудка с вовлечением кардии. При морфологическом исследовании материала биопсии выявлены фрагменты слизистой желудка с инвазивным ростом умеренно дифференцированной аденокарциномы, смешанного типа по Lauren (рис. 1).
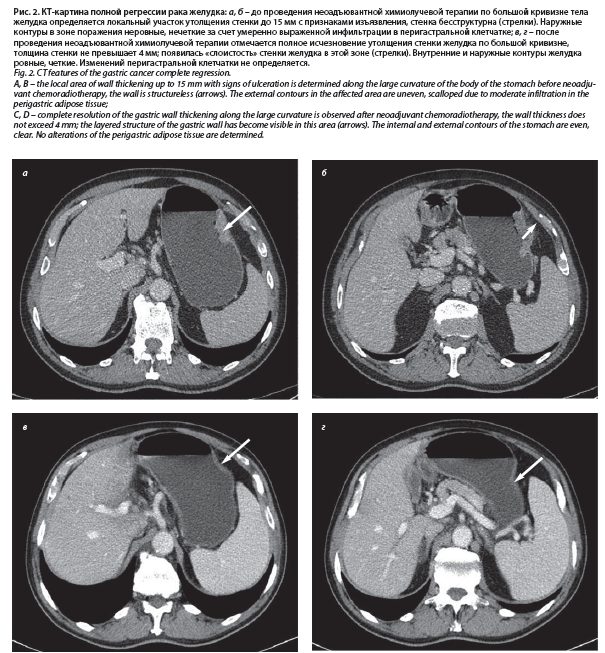
По данным СКТ: по большой кривизне тела желудка определяется локальный участок утолщения стенки толщиной до 15 мм с признаками изъязвления. Наружные контуры в зоне поражения неровные, нечеткие за счет умеренно выраженной инфильтрации в перигастральной клетчатке. Визуализируются неувеличенные регионарные лимфатические узлы диаметром до 8 мм по короткой оси. КТ-данных за отдаленное метастазирование на уровне исследования не получено (рис. 2, а, б).
Пациент был консультирован кардиологом и анестезиологом: из сопутствующей патологии диагностирована артериальная гипертензия 1 ст., риск 2; противопоказания к проведению хирургического лечения, химиотерапии и лучевой терапии отсутствовали. 09.06.2020 была выполнена диагностическая лапароскопия с внутрибрюшным лаважом. Интраоперационно выявлена опухоль проксимального отдела желудка, 3×4 см, субциркулярная, визуально прорастающая серозную оболочку. По результатам цитологического исследования смывов и лаважа брюшной полости опухолевые клетки не выявлены. По результатам
комплексного обследования был установлен клинический диагноз: рак проксимального отдела желудка сT4аN0M0, стадия II B.
Пациенту было предложено участие в клиническом исследовании, получено добровольное информированное согласие. На первом этапе лечения, с 11.06.2020 по 28.06.2020, было проведено 2 цикла индукционной полимихиотерапии по схеме FLOT c интервалом в 14 дней, имела место гематологическая токсичность 1-й степени. Далее, с 14.07.2020 по 14.08.2020, пациенту был проведен курс конформной химиолучевой терапии в разовой очаговой дозе 2 Гр до суммарной очаговой дозы 46 Гр,
5 раз в неделю, на фоне химиотерапии препаратами капецитабин 1850 мг/м2 за 2 приема и оксалиплатин
 85 мг/м2 1-й, 22-й дни. Лечение было завершено в полном объеме, без перерывов. Во время терапии отмечалась гематологическая токсичность (нейтропения 1-й степени) и подъем печеночных ферментов – аланинаминотрансферазы и аспартатаминотрансферазы – менее чем в 2 раза от верхней границы нормы, что соответствует 1-й степени токсичности.
85 мг/м2 1-й, 22-й дни. Лечение было завершено в полном объеме, без перерывов. Во время терапии отмечалась гематологическая токсичность (нейтропения 1-й степени) и подъем печеночных ферментов – аланинаминотрансферазы и аспартатаминотрансферазы – менее чем в 2 раза от верхней границы нормы, что соответствует 1-й степени токсичности.
При контрольном обследовании, по данным СКТ органов грудной клетки и брюшной полости с внутривенным контрастированием, ЭФГДС, УЗИ надключичной области и малого таза, данных, подтверждающих поражение лимфатических коллекторов и отдаленное метастазирование, не получено. При оценке первичной опухоли диагностирован полный клинический ответ как по рентгенологической картине (рис. 2, в, г), так и по результатам ЭГДС: в верхней трети желудка по большой кривизне имеется постъязвенный рубец с конвергенцией складок к плоскому образованию 0-IIb около
1 см. При морфологическом исследовании биоптата выявлен хронический умеренно выраженный гастрит с фовеолярной гиперплазией, без атрофии и без кишечной метаплазии. Признаков опухолевого роста не обнаружено.
На следующем этапе лечения 08.10.2020 пациенту была выполнена чрезбрюшинная гастрэктомия с диафрагмотомией, резекцией абдоминального сегмента пищевода, лимфодиссекцией D2. Интервал от завершения химиолучевой терапии до операции составил
55 дней. При ревизии – опухоль желудка пальпаторно не определялась, отмечались фиброзные изменения левой доли печени и забрюшинной клетчатки. Длительность операции составила 180 мин, кровопотеря – 200 мл.
При исследовании удаленного препарата макроскопически в средней трети желудка по большой кривизне определялось уплощение слизистой с изъязвлением на поверхности площадью 2,0×2,0 см. В проекции измененной слизистой – стенка желудка уплотнена, белесоватого цвета, толщиной до 1,5 см. На остальном протяжении слизистая желудка складчатая, серо-розового цвета, отечная. При микроскопическом исследовании слизистая желудка с регенераторными изменениями, в подслизистом и мышечном слоях разрастание рыхлой волокнистой соединительной ткани с диффузной умеренной лимфоцитарной и плазмоцитарной инфильтрацией, бесклеточным очагом слизи. Края резекции пищевода и желудка без признаков опухолевого роста.
В шестнадцати лимфатических узлах малого сальника и в восьми лимфатических узлах большого сальника опухоли не обнаружено. Морфологическая картина соответствует терапевтическому патоморфозу grade 1 по K. Becker (рис. 3 и 4).
Послеоперационный период протекал без осложнений, пациент был выписан в удовлетворительном состоянии на 8-е сутки после операции. К настоящему времени пациент наблюдается в течение 47 мес без признаков прогрессирования заболевания.
Обсуждение
Выбор наиболее эффективного и безопасного режима неоадъювантной и периоперационной терапии (химиотерапии, лучевой терапии, иммунотерапии, таргетной терапии и их сочетаний) местно-распространенного рака желудка является основным направлением проводимых в настоящее время научных исследований, включая крупные многоцентровые рандомизированные исследования, а также систематические обзоры и метаанализы [3–5, 9]. Так, было показано, что применение неоадъювантной терапии приводит не только к уменьшению размеров опухоли, но и к снижению ее биологического потенциала; способствует увеличению количества радикальных резекций (R0); приводит к уменьшению частоты развития локорегионарных рецидивов и отдаленных метастазов и увеличению показателей выживаемости. В связи со сложностью оценки методами визуализации состояния и динамики в процессе лечения первичной опухоли желудка и регионарных лимфатических узлов, важным и актуальным является вопрос о корреляции между клинической и морфологической оценками ответа опухоли. Одним из определяющих факторов прогноза длительное время считалась клиническая стадия опухоли (cTNM). Однако в последние годы появляется все больше работ, показывающих, что именно патоморфологическая стадия после неоадъювантной терапии (yрTNM) имеет большую прогностическую значимость и определяет результаты лечения. При достижении полной морфологической регрессии первичной опухоли и регионарных лимфатических узлов (yрT0N0M0) прогноз заболевания является наиболее благоприятным и показатели выживаемости достигают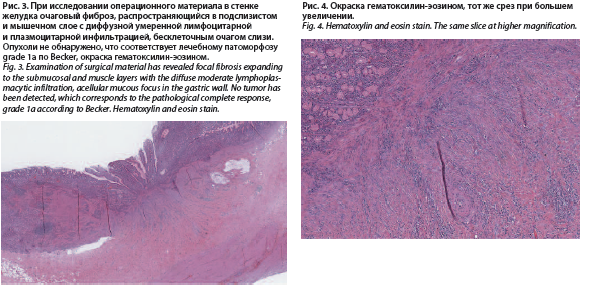 очень высоких цифр [6–9].
очень высоких цифр [6–9].
C. Lin и соавт. [6] представили результаты проведенного в Китае многоцентрового ретроспективного исследования, посвященного изучению влияния полного патоморфологического ответа (pCR) рака желудка после неоадъювантной химиотерапии на отдаленные результаты лечения. Авторами было показано, что достижение pCR способствовало статистически значимому увеличению показателей как общей, так и безрецидивной выживаемости (p<0,001), что было подтверждено и по данным многофакторного анализа.
C. Kaltenmeier и соавт. [7] опубликовали данные анализа когортного исследования, выполненного на основании национальной базы данных США. Из 14 408 пациентов c раком желудка, которым была проведена неоадьювантная терапия, у 321 (2,2%) был зафиксирован полный патоморфологический ответ опухоли.
По данным как моно-, так и многофакторного анализа, у данной категории больных показатели общей выживаемости были статистически значимо выше (5-летняя выживаемость составила 66 и 37%, p<0,001).
В зарубежной литературе имеются противоречивые данные относительно преимуществ неоадъювантной химиолучевой терапии по сравнению с химиотерапией у больных раком желудка. Так, D.A. Trumbull и соавт. [8] в рамках ретроспективного анализа выявили преимущество показателей выживаемости у пациентов после неоадъювантной химиотерапии, однако не смогли объяснить полученные результаты. В то же время Y. Zhu и соавт. [9] представили метаанализ, включавший результаты 17 клинических исследований, в том числе 7 рандомизированных, суммарно – около 7 тыс. пациентов. Полученные результаты показали статистически значимое преимущество
неоадъювантной химиолучевой терапии по сравнению с химиотерапией по следующим показателям: частота достижения полного клинического и морфологического ответа опухоли, число R0 операций, 3-летняя выживаемость.
В МРНЦ им. А.Ф.Цыба проводится клиническое исследование 2-й фазы с целью изучения безопасности и эффективности неоадъювантной терапии в составе 2 индукционных циклов полихимиотерапии по схеме FLOT с последующей химиолучевой терапией (СОД 46 Гр на фоне химиотерапии препаратами капецитабин и оксалиплатин) и гастрэктомией D2 у больных местно-распространенным раком желудка. Основным критерием включения был морфологически верифицированный рак желудка, клиническая стадия сT3-4N0-2M0. В исследование включены 47 пациентов; полный патоморфологический ответ (ypT0N0М0) был достигнут в 7 случаях, из них лишь у 1 пациента был выявлен полный клинико-рентгенологический ответ; в 5 случаях по данным СКТ состояние было расценено как частичный ответ и в 1 случае – как стабилизация заболевания. Динамическое наблюдение за больными показало, что прогрессирование заболевание имело место только у одного пациента через 19 мес от начала лечения. Остальные больные живы без признаков рецидива заболевания в течение 26–63 мес, медиана – 49 мес.
Заключение
Таким образом, представленное клиническое наблюдение демонстрирует безопасность проведения неоадъювантной химиолучевой терапии у пациентов с местно-распространенным раком желудка. Достижение полного клинического и патоморфологического ответа связано с высокими показателями общей и безрецидивной выживаемости, что согласуется с данными зарубежных авторов. В то же время нами не выявлено корреляции между клинико-рентгенологической и морфологической оценками ответа опухоли, в связи с чем радикальное хирургическое вмешательство является неотъемлемым и важнейшим компонентом лечения.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Миронова Диана Юрьевна – врач-онколог, аспирант по специальности «онкология», МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: dimir09@yandex.ru; ORCID: 0000-0002-6665-5355
Diana Yu. Mironova – Oncologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: dimir09@yandex.ru; ORCID: 0000-0002-6665-5355
Скоропад Виталий Юрьевич – д-р мед. наук, зав. отделом торако-абдоминальной онкологии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: skoropad@mrrc.obninsk.ru; ORCID: 0000-0002-2136-1994.
Vitaliy Yu. Skoropad – Dr. Sci. (Med.), Head of the Department of Thoracic and Abdominal Oncology, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. Email: skoropad@mrrc.obninsk.ru; ORCID: 0000-0002-2136-1994
Силантьева Наталья Константиновна – д-р мед. наук, вед. науч. сотр. отд-ния лучевой диагностики, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-5574-0565
Natalya K. Silanteva – Dr. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0001-5574-0565
Агабабян Татев Артаковна – канд. мед. наук, зав. отд-нием лучевой диагностики, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0002-9971-3451
Tatev A. Agababyan – Cand. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0002-9971-3451
Жаворонкова Екатерина Сергеевна – врач-патологоанатом, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0002-7957-0115
Ekaterina S. Zhavoronkova – Pathologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0002-7957-0115
Иванов Сергей Анатольевич – чл.-корр. РАН, д-р мед. наук, проф. каф. онкологии и рентгенорадиологии им. В.П. Харченко медицинского института РУДН, директор МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-7689-6032
Sergey A. Ivanov – Corr. Memb. RAS, Dr. Sci. (Med.), Director
of Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
ORCID: 0000-0001-7689-6032
Каприн Андрей Дмитриевич – академик РАН, д-р мед. наук, проф., зав. каф. онкологии и рентгенорадиологии им. В.П. Харченко медицинского института РУДН, дир. МНИОИ им. П.А. Герцена (филиал ФГБУ «НМИЦ радиологии»), ген. дир. ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-8784-8415
Andrej D. Kaprin – Acad. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University), Director Hertsen Moscow Oncology Research Institute, General Director National Medical Research Radiological Centre. ORCID: 0000-0001-8784-8415
Поступила в редакцию: 03.07.2024
Поступила после рецензирования: 15.07.2024
Принята к публикации: 18.07.2024
Received: 03.07.2024
Revised: 15.07.2024
Accepted: 18.07.2024
Clinical observation of a complete clinical, radiological and pathomorphological response in a patient with locally advanced gastric adenocarcinoma after neoadjuvant therapy
Diana Yu. Mironova1, Vitaliy Yu. Skoropad1, Natalya K. Silanteva1, Tatev A. Agababyan1,
Ekaterina S. Zhavoronkova1, Sergey A. Ivanov1,3, Andrey D. Kaprin2,3,4
1Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia;
2National Medical Research Radiological Centre of the Ministry of Health of the Russian Federation, Moscow, Russia;
3Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
4Hertsen Moscow Oncology Research Institute – branch of the National Medical Research Radiological Centre of the Ministry of Health of the Russian Federation, Moscow, Russia
dimir09@yandex.ru
Abstract
Stomach cancer is an aggressive disease and represents a global health problem. Currently, more than 50% of patients with a newly diagnosed stomach cancer have a locally advanced process that requires a combined approach – a combination of surgical treatment and neoadjuvant/perioperative therapy. In a number of patients, after neoadjuvant therapy, there is a marked or even complete regression of the tumor; the prognosis of the disease, as well as the need for adjuvant therapy in this category of patients is the subject of discussion. This paper demonstrates the clinical observation of a complete clinical, radiological and morphological response after neoadjuvant therapy (2 cycles of chemotherapy FLOT + chemoradiotherapy), as well as long-term relapse-free survival in a patient with locally advanced gastric cancer.
Keywords: locally advanced gastric cancer, neoadjuvant therapy, complete tumor response, survival.
For citation: Mironova D.Yu., Skoropad V.Yu., Silanteva N.K., Agababian T.A., Zhavoronkova E.S., Ivanov S.A., Kaprin A.D. Clinical observation of a complete clinical, radiological and pathomorphological response in a patient with locally advanced gastric adenocarcinoma after neoadjuvant therapy. Clinical review for general practice. 2024; 5 (7): 6-11. (In Russ.). DOI: 10.47407/kr2024.5.7.00442
Введение
Рак желудка является одним из наиболее распространенных и агрессивно текущих онкологических заболеваний; по показателям заболеваемости и смертности он входит в первую пятерку злокачественных новообразований в России и в мире, преобладают местно-распространенные и распространенные стадии [1]. В настоящее время периоперационная полихимиотерапия по схеме FLOT в сочетании с радикальным хирургическим вмешательством признаны стандартом лечения местно-распространенного рака желудка [2]. Предметом активного изучения, в том числе в рамках многоцентровых рандомизированных исследований, является безопасность и эффективность неоадъювантной химиолучевой терапии [3, 4].
Клинико-рентгенологический и патоморфологический ответ опухоли на проводимую неоадъювантную терапию являются важнейшими критериями непосредственной эффективности лечения и первичными конечными точками многих клинических исследований 2–3-й фазы. Хотя их корреляция с отдаленными результатами лечения не является общепризнанной [5], большинство авторов в своих публикациях убедительно показывают позитивное влияние выраженного ответа опухоли на прогноз заболевания. По данным ряда авторов, достижение полного лечебного патоморфоза после неоадъювантной терапии у пациентов с местно-распространенным раком желудка является независимым статистически значимым предиктором улучшения показателей общей и безрецидивной выживаемости [6–9].
В связи с этим предметом дискуссии и продолжающихся научных исследований является оптимизация неоадъювантного компонента лечения больных раком желудка, а также оценка целесообразности проведения адъювантной терапии в зависимости от ответа опухоли на проводимую терапию [3, 4, 10].
В МРНЦ им. А.Ф. Цыба был разработан и апробирован новый метод комбинированного лечения пациентов с резектабельным раком желудка. Клинический протокол 2-й фазы «Неоадъювантная индукционная полихимиотерапия и химиолучевая терапия с последующей гастрэктомией D2 у больных местно-распространенным раком желудка» был одобрен локальным этическим комитетом МРНЦ им. А.Ф. Цыба и утвержден на заседании Ученого Совета ФГБУ «НМИЦ Радиологии» Минздрава России.
В настоящей работе нами приводится клиническое наблюдение полного клинико-рентгенологического и патоморфологического ответа, а также длительной безрецидивной выживаемости у больного с местно-распространенным раком желудка после неоадъювантной терапии.
Клиническое наблюдение
Пациент М., 64 лет, был госпитализирован в стационар по месту жительства с признаками желудочно-кишечного кровотечения, была проведена гемостатическая терапия с положительным эффектом. При обследовании по данным эзофагогастродуоденоскопии (ЭФГДС) была выявлена опухоль проксимального отдела желудка. С целью выработки тактики лечения пациент обратился в МРНЦ им. А.Ф. Цыба.
 В центре было проведено дообследование, включавшее: ЭФГДС, пересмотр блоков и стекол, спиральную компьютерную томографию (СКТ) органов грудной клетки и брюшной полости с внутривенным контрастированием, ультразвуковое исследование (УЗИ) надключичных областей и малого таза, исследование уровня онкомаркеров, общеклинические тесты, осмотр профильных специалистов. По данным ЭФГДС, выявлена инфильтративная опухоль тела и проксимального отдела желудка с вовлечением кардии. При морфологическом исследовании материала биопсии выявлены фрагменты слизистой желудка с инвазивным ростом умеренно дифференцированной аденокарциномы, смешанного типа по Lauren (рис. 1).
В центре было проведено дообследование, включавшее: ЭФГДС, пересмотр блоков и стекол, спиральную компьютерную томографию (СКТ) органов грудной клетки и брюшной полости с внутривенным контрастированием, ультразвуковое исследование (УЗИ) надключичных областей и малого таза, исследование уровня онкомаркеров, общеклинические тесты, осмотр профильных специалистов. По данным ЭФГДС, выявлена инфильтративная опухоль тела и проксимального отдела желудка с вовлечением кардии. При морфологическом исследовании материала биопсии выявлены фрагменты слизистой желудка с инвазивным ростом умеренно дифференцированной аденокарциномы, смешанного типа по Lauren (рис. 1).По данным СКТ: по большой кривизне тела желудка определяется локальный участок утолщения стенки толщиной до 15 мм с признаками изъязвления. Наружные контуры в зоне поражения неровные, нечеткие за счет умеренно выраженной инфильтрации в перигастральной клетчатке. Визуализируются неувеличенные регионарные лимфатические узлы диаметром до 8 мм по короткой оси. КТ-данных за отдаленное метастазирование на уровне исследования не получено (рис. 2, а, б).
Пациент был консультирован кардиологом и анестезиологом: из сопутствующей патологии диагностирована артериальная гипертензия 1 ст., риск 2; противопоказания к проведению хирургического лечения, химиотерапии и лучевой терапии отсутствовали. 09.06.2020 была выполнена диагностическая лапароскопия с внутрибрюшным лаважом. Интраоперационно выявлена опухоль проксимального отдела желудка, 3×4 см, субциркулярная, визуально прорастающая серозную оболочку. По результатам цитологического исследования смывов и лаважа брюшной полости опухолевые клетки не выявлены. По результатам
комплексного обследования был установлен клинический диагноз: рак проксимального отдела желудка сT4аN0M0, стадия II B.
Пациенту было предложено участие в клиническом исследовании, получено добровольное информированное согласие. На первом этапе лечения, с 11.06.2020 по 28.06.2020, было проведено 2 цикла индукционной полимихиотерапии по схеме FLOT c интервалом в 14 дней, имела место гематологическая токсичность 1-й степени. Далее, с 14.07.2020 по 14.08.2020, пациенту был проведен курс конформной химиолучевой терапии в разовой очаговой дозе 2 Гр до суммарной очаговой дозы 46 Гр,
5 раз в неделю, на фоне химиотерапии препаратами капецитабин 1850 мг/м2 за 2 приема и оксалиплатин
 85 мг/м2 1-й, 22-й дни. Лечение было завершено в полном объеме, без перерывов. Во время терапии отмечалась гематологическая токсичность (нейтропения 1-й степени) и подъем печеночных ферментов – аланинаминотрансферазы и аспартатаминотрансферазы – менее чем в 2 раза от верхней границы нормы, что соответствует 1-й степени токсичности.
85 мг/м2 1-й, 22-й дни. Лечение было завершено в полном объеме, без перерывов. Во время терапии отмечалась гематологическая токсичность (нейтропения 1-й степени) и подъем печеночных ферментов – аланинаминотрансферазы и аспартатаминотрансферазы – менее чем в 2 раза от верхней границы нормы, что соответствует 1-й степени токсичности. При контрольном обследовании, по данным СКТ органов грудной клетки и брюшной полости с внутривенным контрастированием, ЭФГДС, УЗИ надключичной области и малого таза, данных, подтверждающих поражение лимфатических коллекторов и отдаленное метастазирование, не получено. При оценке первичной опухоли диагностирован полный клинический ответ как по рентгенологической картине (рис. 2, в, г), так и по результатам ЭГДС: в верхней трети желудка по большой кривизне имеется постъязвенный рубец с конвергенцией складок к плоскому образованию 0-IIb около
1 см. При морфологическом исследовании биоптата выявлен хронический умеренно выраженный гастрит с фовеолярной гиперплазией, без атрофии и без кишечной метаплазии. Признаков опухолевого роста не обнаружено.
На следующем этапе лечения 08.10.2020 пациенту была выполнена чрезбрюшинная гастрэктомия с диафрагмотомией, резекцией абдоминального сегмента пищевода, лимфодиссекцией D2. Интервал от завершения химиолучевой терапии до операции составил
55 дней. При ревизии – опухоль желудка пальпаторно не определялась, отмечались фиброзные изменения левой доли печени и забрюшинной клетчатки. Длительность операции составила 180 мин, кровопотеря – 200 мл.
При исследовании удаленного препарата макроскопически в средней трети желудка по большой кривизне определялось уплощение слизистой с изъязвлением на поверхности площадью 2,0×2,0 см. В проекции измененной слизистой – стенка желудка уплотнена, белесоватого цвета, толщиной до 1,5 см. На остальном протяжении слизистая желудка складчатая, серо-розового цвета, отечная. При микроскопическом исследовании слизистая желудка с регенераторными изменениями, в подслизистом и мышечном слоях разрастание рыхлой волокнистой соединительной ткани с диффузной умеренной лимфоцитарной и плазмоцитарной инфильтрацией, бесклеточным очагом слизи. Края резекции пищевода и желудка без признаков опухолевого роста.
В шестнадцати лимфатических узлах малого сальника и в восьми лимфатических узлах большого сальника опухоли не обнаружено. Морфологическая картина соответствует терапевтическому патоморфозу grade 1 по K. Becker (рис. 3 и 4).
Послеоперационный период протекал без осложнений, пациент был выписан в удовлетворительном состоянии на 8-е сутки после операции. К настоящему времени пациент наблюдается в течение 47 мес без признаков прогрессирования заболевания.
Обсуждение
Выбор наиболее эффективного и безопасного режима неоадъювантной и периоперационной терапии (химиотерапии, лучевой терапии, иммунотерапии, таргетной терапии и их сочетаний) местно-распространенного рака желудка является основным направлением проводимых в настоящее время научных исследований, включая крупные многоцентровые рандомизированные исследования, а также систематические обзоры и метаанализы [3–5, 9]. Так, было показано, что применение неоадъювантной терапии приводит не только к уменьшению размеров опухоли, но и к снижению ее биологического потенциала; способствует увеличению количества радикальных резекций (R0); приводит к уменьшению частоты развития локорегионарных рецидивов и отдаленных метастазов и увеличению показателей выживаемости. В связи со сложностью оценки методами визуализации состояния и динамики в процессе лечения первичной опухоли желудка и регионарных лимфатических узлов, важным и актуальным является вопрос о корреляции между клинической и морфологической оценками ответа опухоли. Одним из определяющих факторов прогноза длительное время считалась клиническая стадия опухоли (cTNM). Однако в последние годы появляется все больше работ, показывающих, что именно патоморфологическая стадия после неоадъювантной терапии (yрTNM) имеет большую прогностическую значимость и определяет результаты лечения. При достижении полной морфологической регрессии первичной опухоли и регионарных лимфатических узлов (yрT0N0M0) прогноз заболевания является наиболее благоприятным и показатели выживаемости достигают
 очень высоких цифр [6–9].
очень высоких цифр [6–9]. C. Lin и соавт. [6] представили результаты проведенного в Китае многоцентрового ретроспективного исследования, посвященного изучению влияния полного патоморфологического ответа (pCR) рака желудка после неоадъювантной химиотерапии на отдаленные результаты лечения. Авторами было показано, что достижение pCR способствовало статистически значимому увеличению показателей как общей, так и безрецидивной выживаемости (p<0,001), что было подтверждено и по данным многофакторного анализа.
C. Kaltenmeier и соавт. [7] опубликовали данные анализа когортного исследования, выполненного на основании национальной базы данных США. Из 14 408 пациентов c раком желудка, которым была проведена неоадьювантная терапия, у 321 (2,2%) был зафиксирован полный патоморфологический ответ опухоли.
По данным как моно-, так и многофакторного анализа, у данной категории больных показатели общей выживаемости были статистически значимо выше (5-летняя выживаемость составила 66 и 37%, p<0,001).
В зарубежной литературе имеются противоречивые данные относительно преимуществ неоадъювантной химиолучевой терапии по сравнению с химиотерапией у больных раком желудка. Так, D.A. Trumbull и соавт. [8] в рамках ретроспективного анализа выявили преимущество показателей выживаемости у пациентов после неоадъювантной химиотерапии, однако не смогли объяснить полученные результаты. В то же время Y. Zhu и соавт. [9] представили метаанализ, включавший результаты 17 клинических исследований, в том числе 7 рандомизированных, суммарно – около 7 тыс. пациентов. Полученные результаты показали статистически значимое преимущество
неоадъювантной химиолучевой терапии по сравнению с химиотерапией по следующим показателям: частота достижения полного клинического и морфологического ответа опухоли, число R0 операций, 3-летняя выживаемость.
В МРНЦ им. А.Ф.Цыба проводится клиническое исследование 2-й фазы с целью изучения безопасности и эффективности неоадъювантной терапии в составе 2 индукционных циклов полихимиотерапии по схеме FLOT с последующей химиолучевой терапией (СОД 46 Гр на фоне химиотерапии препаратами капецитабин и оксалиплатин) и гастрэктомией D2 у больных местно-распространенным раком желудка. Основным критерием включения был морфологически верифицированный рак желудка, клиническая стадия сT3-4N0-2M0. В исследование включены 47 пациентов; полный патоморфологический ответ (ypT0N0М0) был достигнут в 7 случаях, из них лишь у 1 пациента был выявлен полный клинико-рентгенологический ответ; в 5 случаях по данным СКТ состояние было расценено как частичный ответ и в 1 случае – как стабилизация заболевания. Динамическое наблюдение за больными показало, что прогрессирование заболевание имело место только у одного пациента через 19 мес от начала лечения. Остальные больные живы без признаков рецидива заболевания в течение 26–63 мес, медиана – 49 мес.
Заключение
Таким образом, представленное клиническое наблюдение демонстрирует безопасность проведения неоадъювантной химиолучевой терапии у пациентов с местно-распространенным раком желудка. Достижение полного клинического и патоморфологического ответа связано с высокими показателями общей и безрецидивной выживаемости, что согласуется с данными зарубежных авторов. В то же время нами не выявлено корреляции между клинико-рентгенологической и морфологической оценками ответа опухоли, в связи с чем радикальное хирургическое вмешательство является неотъемлемым и важнейшим компонентом лечения.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Миронова Диана Юрьевна – врач-онколог, аспирант по специальности «онкология», МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: dimir09@yandex.ru; ORCID: 0000-0002-6665-5355
Diana Yu. Mironova – Oncologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: dimir09@yandex.ru; ORCID: 0000-0002-6665-5355
Скоропад Виталий Юрьевич – д-р мед. наук, зав. отделом торако-абдоминальной онкологии, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: skoropad@mrrc.obninsk.ru; ORCID: 0000-0002-2136-1994.
Vitaliy Yu. Skoropad – Dr. Sci. (Med.), Head of the Department of Thoracic and Abdominal Oncology, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. Email: skoropad@mrrc.obninsk.ru; ORCID: 0000-0002-2136-1994
Силантьева Наталья Константиновна – д-р мед. наук, вед. науч. сотр. отд-ния лучевой диагностики, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-5574-0565
Natalya K. Silanteva – Dr. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0001-5574-0565
Агабабян Татев Артаковна – канд. мед. наук, зав. отд-нием лучевой диагностики, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0002-9971-3451
Tatev A. Agababyan – Cand. Sci. (Med.), Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0002-9971-3451
Жаворонкова Екатерина Сергеевна – врач-патологоанатом, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0002-7957-0115
Ekaterina S. Zhavoronkova – Pathologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. ORCID: 0000-0002-7957-0115
Иванов Сергей Анатольевич – чл.-корр. РАН, д-р мед. наук, проф. каф. онкологии и рентгенорадиологии им. В.П. Харченко медицинского института РУДН, директор МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-7689-6032
Sergey A. Ivanov – Corr. Memb. RAS, Dr. Sci. (Med.), Director
of Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
ORCID: 0000-0001-7689-6032
Каприн Андрей Дмитриевич – академик РАН, д-р мед. наук, проф., зав. каф. онкологии и рентгенорадиологии им. В.П. Харченко медицинского института РУДН, дир. МНИОИ им. П.А. Герцена (филиал ФГБУ «НМИЦ радиологии»), ген. дир. ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-8784-8415
Andrej D. Kaprin – Acad. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University), Director Hertsen Moscow Oncology Research Institute, General Director National Medical Research Radiological Centre. ORCID: 0000-0001-8784-8415
Поступила в редакцию: 03.07.2024
Поступила после рецензирования: 15.07.2024
Принята к публикации: 18.07.2024
Received: 03.07.2024
Revised: 15.07.2024
Accepted: 18.07.2024
20 августа 2024
Количество просмотров: 11015


