Клинический разбор в общей медицине №7 2024
Аннотация
В годы широкого применения рентгенотерапии онкологических больных частота развития местных лучевых повреждений мягких тканей (различной степени тяжести) достигала 30–40% и более. Опыт отделения лечения лучевых повреждений 1970-х и 1980-х гг. свидетельствует, что каждая 2–3-я койка была занята пациентами с данной патологией. С развитием радиологии, внедрением новых источников и методик частота формирования таких изменений в зоне полей облучения значительно снизилась и в настоящее время составляет примерно 2%. Цель предлагаемого исследования заключается в демонстрации возможностей кожно-пластических операций у данного контингента лиц, которые, как правило, в течение длительного времени не получают квалифицированной помощи. В рамках проведенной работы время, прошедшее от момента формирования патологических изменений до госпитализации в отделение, в среднем, составило 3–5 лет, и было заполнено малоэффективными консервативными мероприятиями. За последние 4 года в отделении лечения лучевых повреждений выполнено 60 реконструктивно-пластических операции с использованием кожно-мышечных (21), кожно-фасциальных (21), кожных (10) лоскутов, а также пластики местными тканями (8). В раннем послеоперационном периоде наиболее частым осложнением являлся краевой некроз лоскута (13), который у 11 пациентов стал причиной повторных операций в виде наложения вторичных швов или, в случае, когда не удавалось это выполнить, на гранулирующую рану применялась пластика дефекта островковыми кожными лоскутами. В последующем у таких пациентов отмечалось полное заживление послеоперационной раны. Таким образом, предложенные варианты реконструкции лучевых язв, развившихся после комбинированного и лучевого лечения злокачественных новообразований, являются высокоэффективными методами, которые позволяют избавиться от уродующих дефектов, улучшить качество жизни и вернуть социальную активность практически у 100% больных.
Ключевые слова: лучевая терапия, осложнения, поздние лучевые повреждения кожи, хирургическое лечение, реабилитация.
Для цитирования: Пасов В.В., Шитарева В.Н., Коротков В.А., Тивкова Л.В., Касымов М.Р., Каприн А.Д., Иванов С.А. Кожно-пластические операции у больных с поздними лучевыми повреждениями мягких тканей. Клинический разбор в общей медицине. 2024; 5 (7): 37–45. DOI: 10.47407/kr2024.5.7.00446
Клинический разбор в общей медицине №7 2024
Кожно-пластические операции у больных с поздними лучевыми повреждениями мягких тканей
Аннотация
В годы широкого применения рентгенотерапии онкологических больных частота развития местных лучевых повреждений мягких тканей (различной степени тяжести) достигала 30–40% и более. Опыт отделения лечения лучевых повреждений 1970-х и 1980-х гг. свидетельствует, что каждая 2–3-я койка была занята пациентами с данной патологией. С развитием радиологии, внедрением новых источников и методик частота формирования таких изменений в зоне полей облучения значительно снизилась и в настоящее время составляет примерно 2%. Цель предлагаемого исследования заключается в демонстрации возможностей кожно-пластических операций у данного контингента лиц, которые, как правило, в течение длительного времени не получают квалифицированной помощи. В рамках проведенной работы время, прошедшее от момента формирования патологических изменений до госпитализации в отделение, в среднем, составило 3–5 лет, и было заполнено малоэффективными консервативными мероприятиями. За последние 4 года в отделении лечения лучевых повреждений выполнено 60 реконструктивно-пластических операции с использованием кожно-мышечных (21), кожно-фасциальных (21), кожных (10) лоскутов, а также пластики местными тканями (8). В раннем послеоперационном периоде наиболее частым осложнением являлся краевой некроз лоскута (13), который у 11 пациентов стал причиной повторных операций в виде наложения вторичных швов или, в случае, когда не удавалось это выполнить, на гранулирующую рану применялась пластика дефекта островковыми кожными лоскутами. В последующем у таких пациентов отмечалось полное заживление послеоперационной раны. Таким образом, предложенные варианты реконструкции лучевых язв, развившихся после комбинированного и лучевого лечения злокачественных новообразований, являются высокоэффективными методами, которые позволяют избавиться от уродующих дефектов, улучшить качество жизни и вернуть социальную активность практически у 100% больных.
Ключевые слова: лучевая терапия, осложнения, поздние лучевые повреждения кожи, хирургическое лечение, реабилитация.
Для цитирования: Пасов В.В., Шитарева В.Н., Коротков В.А., Тивкова Л.В., Касымов М.Р., Каприн А.Д., Иванов С.А. Кожно-пластические операции у больных с поздними лучевыми повреждениями мягких тканей. Клинический разбор в общей медицине. 2024; 5 (7): 37–45. DOI: 10.47407/kr2024.5.7.00446
Skin-plastic surgery in patients with late radiation injuries of soft tissues
Viktor V. Pasov1, Veronirka N. Shitareva1, Valeriy A. Korotkov1, Lilia V. Tivkova1,
Maxim R. Kasymov1, Andrey D. Kaprin2,3,4, Sergey A. Ivanov1,3
1Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia;
2National Medical Research Radiological Centre of the Ministry of Health of the Russian Federation, Moscow, Russia;
3Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
4Hertsen Moscow Oncology Research Institute – branch of the National Medical Research Radiological Centre, Moscow, Russia
pasov@mrrc.obninsk.ru
Abstract
During the years of widespread use of radiotherapy in cancer patients, the incidence of local radiation damage to soft tissues (of varying severity) reached 30–40% or more. The experience of the radiation injury treatment department in the 70s and 80s indicates that every 2–3 beds were occupied by patients with this pathology. With the development of radiology, the introduction of new sources and techniques, the frequency of formation of such changes in the zone of irradiation fields has significantly decreased and currently stands at about 2%. The purpose of the proposed study is to demonstrate the possibilities of skin plastic surgery in this contingent of people who, as a rule, do not receive qualified care for a long time. As part of the work carried out, the time elapsed from the moment of formation of pathological changes to hospitalization in the department, on average, was 3–5 years, and was filled with ineffective conservative measures. Over the past 4 years, 60 reconstructive plastic surgeries have been performed in the radiation injury treatment department using musculoskeletal (21), skin fascial (21), skin (10) flaps, as well as plasty with local tissues (8). In the early postoperative period, the most common complication was marginal necrosis of the flap (13) which in 11 patients caused repeated operations in the form of secondary sutures or, in the case when it was not possible to perform this, plastic surgery of the defect with insular skin flaps was applied to the granulating wound. Subsequently, complete healing of the postoperative wound was noted in such patients. Thus, the proposed options for the reconstruction of radiation ulcers that developed after combined and radiation treatment of malignant neoplasms are highly effective methods that can get rid of disfiguring defects, improve the quality of life and restore social activity in almost 100% of patients.
Keywords: radiation therapy, complications, late radiation injuries of the skin, surgical treatment, rehabilitation.
For citation: Pasov V.V., Shitareva V.N., Korotkov V.A., Tivkova L.V., Kasymov M.R., Kaprin A.D., Ivanov S.A. Skin-plastic surgery in patients with late radiation injuries of soft tissues. Clinical review for general practice. 2024; 5 (7): 37-45. (In Russ.). DOI: 10.47407/kr2024.5.7.00446
Введение
В настоящее время частота развития поздних лучевых повреждений в мире составляет около 5% от всех пациентов, перенесших лучевую терапию, однако по сведениям некоторых исследователей формирование данной патологии в нашей стране превышает 10–15% [1].
Одним из осложнений лучевой терапии онкологических заболеваний являются местные лучевые повреждения мягких тканей в области полей облучения (фиброз, язва). В России развитие таких патологических изменений составляет около 2% [2]. Коррекция данной патологии представляет достаточно сложную задачу и требует радикального иссечения всех измененных тканей (включая костные фрагменты) с последующим адекватным замещением сформировавшегося дефекта, который, как правило, имеет большую площадь, объем и не может быть закрыт традиционными методами пластики. Широкое и успешное использование в хирургической практике ротационных кожно-фасциальных тканевых лоскутов, а также мышечных и кожно-мышечных с осевым кровоснабжением (перемещение, свободная пересадка) позволяет надеяться на хорошие результаты и при лечении местных лучевых повреждений мягких тканей [2–8]. Поздние лучевые повреждения мягких тканей, формирующиеся на постгоспитальном этапе лечения злокачественных новообразований, значительно снижают качество жизни пациента. Они могут стать причиной страданий, глубокой инвалидности, малигнизации и смерти больного. Поэтому благоприятный исход основного заболевания еще не означает полного выздоровления. Учитывая, что большинство пациентов находится в трудоспособном возрасте, проблема местных лучевых повреждений приобретает социальную значимость и требует поиска эффективных методов профилактики и реабилитации, которые позволят обеспечить приемлемые условия их жизни и деятельности [9].
В связи с вышесказанным, поиск путей повышения эффективности реабилитационных мероприятий у больных местными лучевыми повреждениями мягких тканей, разработка показаний к корригирующим кожно-пластическим операциям с использованием перемещенных васкуляризированных лоскутов и оценка эффективности их применения остаются актуальными.
Цель исследования: демонстрация возможностей и оценка эффективности кожно-пластических операций у пациентов с поздними лучевыми язвами мягких тканей.
Задачи исследования: 1) провести анализ ранних послеоперационных осложнений у пациентов после кожно-пластических операций по поводу поздних лучевых язв мягких тканей различных локализаций; 2) оценить количество отдаленных послеоперационных осложнений; 3) оценить количество и объем повторных хирургических вмешательств.
Материалы и методы
В течение 2019–2023 гг. в соответствии с планом научно-исследовательской работы в отделении лечения лучевых повреждений МРНЦ выполнено 60 оперативных вмешательств пациентам с поздними лучевыми язвами мягких тканей различной локализации. Медиана возраста больных составила 64 года, причем большинство из них были женщины (41 наблюдение).
Критериями включения в исследование являлись:
• возраст ≥ 18 лет;
• отсутствие, по данными лабораторных и инструментальных исследований, признаков прогрессирования основного заболевания;
• отсутствие декомпенсации сопутствующих заболеваний, требующих коррекции в условиях профильных стационаров.
Критериями исключения являлись:
• возраст менее 18 лет;
• наличие, по данным лабораторных и инструментальных исследований, признаков прогрессирования основного заболевания;
• наличие декомпенсации сопутствующих заболеваний, требующих коррекции в условиях профильных стационаров.
 По месту жительства в качестве лечебных мероприятий большинству пациентов применялись консервативные методы лечения с использованием различных антисептиков, мазей, протеолитических ферментов, сосудистых препаратов, антибактериальной и физиотерапии. Только в 2 наблюдениях была произведена пластика дефекта мягких тканей, которая в конечном итоге закончилась полным некрозом лоскута с последующим увеличением площади и объема язвы мягких тканей. Неудачный результат оперативного вмешательства, как правило, был обусловлен неправильным выбором метода пластики, неадекватным иссечением объема и площади пораженных тканей с сохранением патологически измененных костных фрагментов дна язвы и окружающих ее мягких тканей. Длительность течения патологического процесса была обусловлена частичной эффективностью консервативных мероприятий, которые позволяли добиться временной эпителизации язвенной поверхности. В связи с этим многие больные оттягивали момент госпитализации и поступили в нашу клинику только через несколько лет после начала заболевания (наибольший срок составил 29 лет). Наличие обширной язвы, болевой синдром и периодические аррозивные кровотечения значительно сужали временные рамки, в течение которых пациент обращался за специализированной помощью.
По месту жительства в качестве лечебных мероприятий большинству пациентов применялись консервативные методы лечения с использованием различных антисептиков, мазей, протеолитических ферментов, сосудистых препаратов, антибактериальной и физиотерапии. Только в 2 наблюдениях была произведена пластика дефекта мягких тканей, которая в конечном итоге закончилась полным некрозом лоскута с последующим увеличением площади и объема язвы мягких тканей. Неудачный результат оперативного вмешательства, как правило, был обусловлен неправильным выбором метода пластики, неадекватным иссечением объема и площади пораженных тканей с сохранением патологически измененных костных фрагментов дна язвы и окружающих ее мягких тканей. Длительность течения патологического процесса была обусловлена частичной эффективностью консервативных мероприятий, которые позволяли добиться временной эпителизации язвенной поверхности. В связи с этим многие больные оттягивали момент госпитализации и поступили в нашу клинику только через несколько лет после начала заболевания (наибольший срок составил 29 лет). Наличие обширной язвы, болевой синдром и периодические аррозивные кровотечения значительно сужали временные рамки, в течение которых пациент обращался за специализированной помощью.
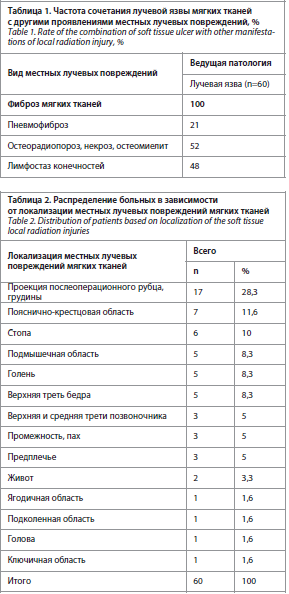
На момент госпитализации в отделение в 60 (100%) наблюдениях у пациентов констатирована лучевая язва. Среди клинических проявлений у наших пациентов преобладал болевой синдром. Интенсивность его непосредственно была связана с площадью, объемом лучевой язвы, повреждением подлежащих костных структур и наличием других местных лучевых повреждений. Фактически, боль и наличие язвы являются самыми частыми причинами, которые заставляют больного обратиться за помощью в специализированное отделение. В результате осмотра у всех больных с лучевыми язвами было выявлено сочетание местных лучевых повреждений, что является типичным в клинической картине у пациентов с данной патологией. Частота сочетания лучевой язвы мягких тканей с другими проявлениями местных лучевых повреждений представлена в табл. 1.
Согласно данным табл. 1, на фоне фиброза лучевая язва, как правило, сопровождалась лучевыми изменениями в костях (ребра, ключица, грудина, крестец и т.д.). Несколько реже у больных отмечался вторичный лимфостаз конечности и пневмофиброз. Локализация лучевых язв и площадь дефекта мягких тканей были различными (табл. 2).
Представленные в табл. 2 данные наглядно показывает, что абсолютное большинство больных страдали язвами передней поверхности грудной клетки в результате комбинированного лечения рака молочной железы.
Для исключения прогрессирования основного заболевания на первом этапе диагностических мероприятий всем пациентам выполнялось стандартное обследование, которое включало: осмотр больного, ультразвуковое исследование регионарных лимфоузлов, рентгенологическое исследование легких, маммографию контралатеральной молочной железы (при ее наличии), консультацию маммолога и гинеколога и других специалистов, а также обычный набор исследований крови и мочи (общий анализ крови и мочи, биохимия крови, коагулограмма). В случаях выявления увеличенных лимфоузлов широко применялась пункционная тонкоигольная биопсия под контролем ультразвука с последующим цитологическим исследованием полученного материала. При диагностических трудностях и подозрении на метастатический процесс дополнительно использовалась компьютерная томография, магнитно-резонансная томография и т.д. Радионуклидное и рентгенологическое обследование (включая рентгеновскую томографию – цифровая люминесцентная рентгенография) позволяли установить причину изменений в костях скелета (метастатическое поражение или лучевой остеорадионекроз, остеомиелит, патологический перелом). КТ-ангиография использовалась для выяснения состояния сосудистой ножки лоскута, который планируется переместить. Для исключения малигнизации, особенно в случаях длительно текущих и незаживающих язв, применялись цитологическое или гистологическое исследования с язвы. Кроме того, в обязательном порядке до операции выполнялись посев из язвы и определение чувствительности микрофлоры к антибиотикам для определения тактики антибиотикотерапии в раннем послеоперационном периоде.
Важным моментом предварительного обследования больных лучевой язвой являлось определение площади дефекта и окружающего его фиброза, которое выполнялось обычной линейкой или штангенциркулем.
Основная задача реконструктивных вмешательств у больных местными лучевыми повреждениями заключалась в радикальном иссечении пораженных тканей и адекватном замещении сформировавшегося дефекта. В некоторых случаях радикальное удаление поврежденных тканей выполнить не удается в связи с большой площадью поражения, вовлечением в патологический процесс крупных сосудисто-нервных пучков (над-, подключичной и подмышечной области, пахово-подвздошной и т.д.), а также костного каркаса грудной клетки или малого таза (ребра, грудина,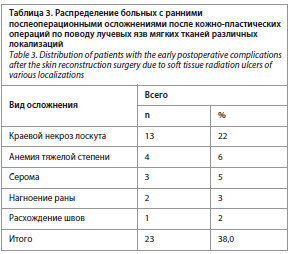 крестец), разрушение которых может вызвать нарушение стабильности. В таких случаях целесообразно было использовать кожно-мышечные и мышечные лоскуты. В условиях раневой инфекции и нерадикального иссечения измененных тканей они имеют значительное преимущество перед другими вариантами пластики, обладая высокой «биологической активностью» и васкуляризирующей способностью. Важным фактором успеха оперативного лечения местных лучевых повреждений мягких тканей являлось строгое соблюдение основных принципов пластической хирургии:
крестец), разрушение которых может вызвать нарушение стабильности. В таких случаях целесообразно было использовать кожно-мышечные и мышечные лоскуты. В условиях раневой инфекции и нерадикального иссечения измененных тканей они имеют значительное преимущество перед другими вариантами пластики, обладая высокой «биологической активностью» и васкуляризирующей способностью. Важным фактором успеха оперативного лечения местных лучевых повреждений мягких тканей являлось строгое соблюдение основных принципов пластической хирургии:
• применение хорошо васкуляризированных тканей;
• полное отсутствие натяжения лоскута и кожных краев раны;
• деликатное обращение с тканями;
• активная хирургическая тактика операции в ранние сроки развития гнойно-некротического процесса, а также превентивное иссечение фиброза;
• широкое агрессивное удаление тканей и всех инфицированных костных фрагментов.
В случаях небольших по площади и объему (поверхностных) лучевых повреждений кожи использовались ротационные кожно-фасциальные лоскуты, в том числе на перфорантных артериях магистральных сосудов. Важным моментом в оперативном вмешательстве являлись планирование и предоперационная разметка при формировании лоскута, ширина которого должна составлять не менее половины от его длины для сохранения адекватного кровоснабжения акромиальных отделов. Кроме того, крайне важно было избегать натяжения трансплантата при его фиксации к дефекту кожи. Учитывая вышесказанное, как правило, в случаях неизбежности натяжения использовался расщепленный кожный лоскут для закрытия донорской зоны.
Определение необходимости повторного хирургического вмешательства у пациентов с развившимся краевым некрозом лоскута проводилось с помощью расчета его площади. В случаях, когда площадь краевого некроза не превышала 10%, предпочтение отдавалось консервативному лечению.
У всех больных было получено письменное информированное согласие на проведение соответствующего метода хирургического лечения.
Одобрение работы локальным этическим комитетом не проводилось.
Обработка результатов исследования производилась с помощью статистического пакета Jamovi Version 2.3 (разработчики – J. Love, D. Dropmann, R. Selker, Сидней, Австралия). Описание непрерывных переменных представлено в виде средних значений и медиан.
Методы пластики и результаты
 За отчетный период нами выполнены 60 операций больным лучевыми язвами, которые сформировались после лечения опухолей различной локализации. В 21 случае использовались перемещенные кожно-мышечные лоскуты, еще в 21 случаях – ротационные кожно-фасциальные лоскуты; в 10 случаях – кожные лоскуты, и в 8 случаях удалось обойтись пластикой местными тканями. Последняя применялась в случаях небольших размеров язвенных дефектов.
За отчетный период нами выполнены 60 операций больным лучевыми язвами, которые сформировались после лечения опухолей различной локализации. В 21 случае использовались перемещенные кожно-мышечные лоскуты, еще в 21 случаях – ротационные кожно-фасциальные лоскуты; в 10 случаях – кожные лоскуты, и в 8 случаях удалось обойтись пластикой местными тканями. Последняя применялась в случаях небольших размеров язвенных дефектов.
Медиана продолжительности операции составила 120 мин, средняя кровопотеря – 37 мл. Ранние послеоперационные осложнения были зарегистрированы в 23 (38%) наблюдениях (табл. 3).
Наиболее частым осложнением являлся краевой некроз лоскута – у 13 (21%) пациентов, что у 11 (18%) потребовало проведения повторной операции в виде наложения вторичных швов или же применения кожной пластики островковыми лоскутами. В одном наблюдении также было отмечено расхождение швов в раннем послеоперационном периоде, что было обусловлено обширным послеоперационным дефектом. Пациенту также было выполнено наложение вторичных швов. Среднее время наблюдения пациентов в стационаре составило 13 дней.
Суммарно в раннем послеоперационном периоде выполнено 15 (25%) повторных хирургических вмешательств, в двух наблюдениях – в позднем (спустя несколько месяцев после операции у пациентов было отмечено расхождение швов).
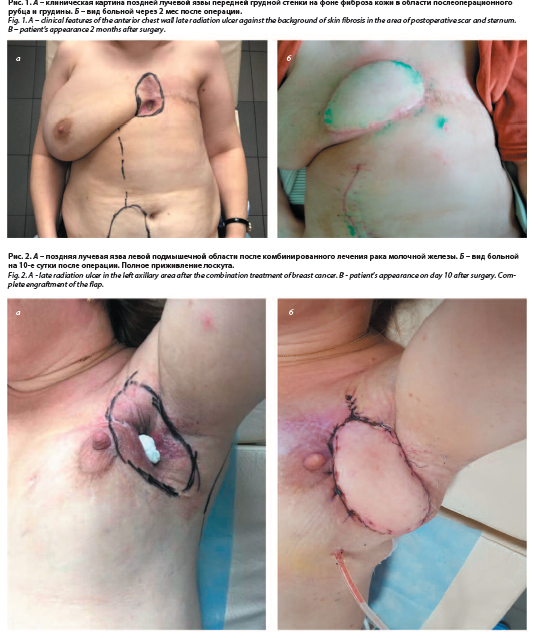
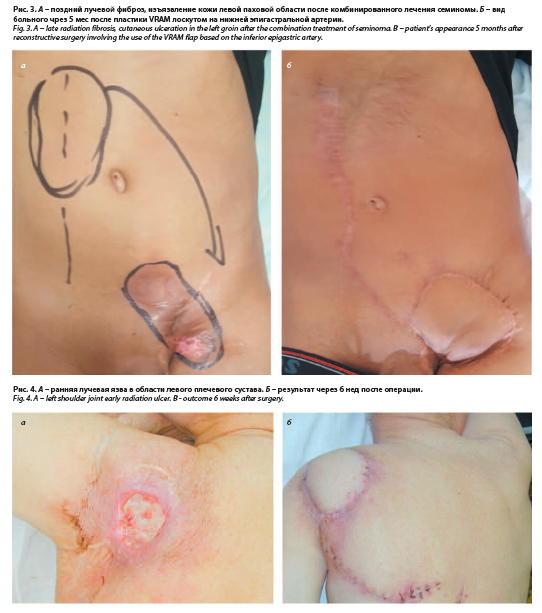
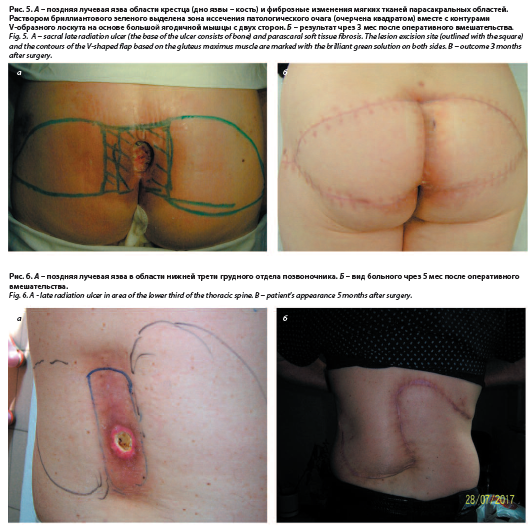
В остальных случаях послеоперационный период протекал гладко. В конечном итоге у 45 пациентов было зафиксировано заживление первичным натяжением. Осложнений не было (рис. 1–5).
У остальных пациентов (n=15) после повторных хирургических вмешательств зафиксировано полное заживление раневого дефекта, что позволило им вернуться к привычной социальной жизни без каких-либо ограничений.
 Обсуждение
Обсуждение
В литературе представлена довольно скудная информация о подобных исследованиях, вероятно, из-за редкой встречаемости подобной патологии с учетом совершенствования методик проведения лучевой терапии и совершенствования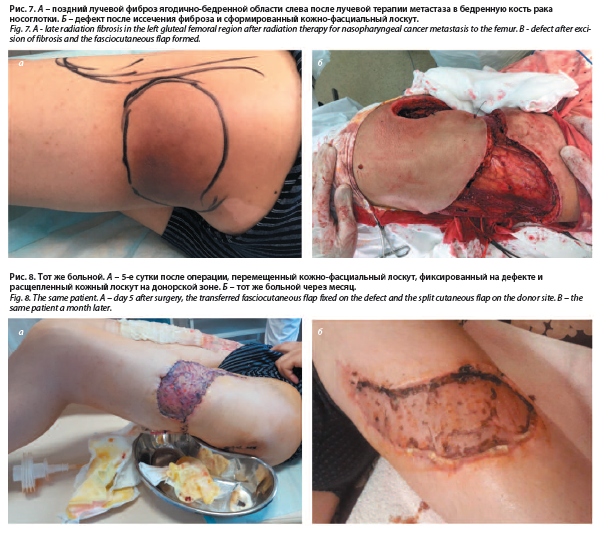 оборудования, а также узкой направленности. Данная когорта пациентов чаще всего попадает к общим хирургам, и чаще всего описывается в виде единичных клинических случаев.
оборудования, а также узкой направленности. Данная когорта пациентов чаще всего попадает к общим хирургам, и чаще всего описывается в виде единичных клинических случаев.
В 2019 г. группа исследователей из Китая представила результаты лечения 10 пациентов с поздними лучевыми язвами грудной стенки (пациентки набирались с 2012 по 2017 г.). В исследовании терапия проводилась в 2 этапа: на первом этапе проводилась хирургическая обработка язвы и применение терапии отрицательным давлением (более известна как установка ВАК-системы), а на втором – пластика лоскутом на основе широчайшей мышцы спины (ТДЛ). Средний возраст пациенток составил 60,3 года, средняя продолжительность наличия язв у пациентов – 21 мес. В исследовании все лоскуты хорошо прижились, послеоперационный период протекал без осложнений [10].
Также в 2019 г. было опубликовано еще одно исследование ученых из Вьетнама, которые представили результаты лечения поздних лучевых язв различных локализаций. В исследовании, которое длилось с 2013 по 2017 г., приняли участие 30 пациентов, были использованы, как и в нашем исследовании, различные хирургические техники. Средний возраст пациентов составил 50 лет. Наиболее частой причиной возникновения поздних лучевых язв являлось комбинированное и комплексное лечение рака молочной железы. У двоих пациентов был зафиксирован краевой некроз лоскута (7%), еще у двоих (7%) – тотальный некроз, потребовавший проведения повторного хирургического лечения. Среднее время наблюдения в стационаре составило
43 дня [11].
В 2019 г. Y. Zhou и Y. Zhang представили результаты ретроспективного исследования, посвященного хирургическому лечению 50 пациенток с поздними лучевыми язвами грудной стенки после лечения рака молочной железы с 2002 по 2016 г. Пациентки были поделены на две группы, в одной из которых выполнялась одномоментная пластика раневого дефекта, а в другой – на первом этапе выполнялась санация раны и перемещение на раневый дефект большого сальника с отсроченной реконструкцией через 2 нед. В первой группе был зарегистрирован один летальный исход от сепсиса, 6 (24%) случаев нагноения лоскута, 4 (16%) случая краевого некроза лоскута, тогда как во второй группе подобных осложнений зарегистрировано не было. В связи с этим исследователи пришли к выводу о безопасности применения двухэтапной техники [12].
Как видно из представленных исследований, хирургами по всему миру обсуждаются оптимальные тактики хирургического лечения данной редкой когорты пациентов. Чаще всего это пациенты с поздними лучевыми повреждениями мягких тканей области грудной стенки после лечения рака молочной железы. Суммируя непосредственные и отдаленные результаты оперативного лечения, можно констатировать, что с учетом локализации язвы, ее площади и объема необходимо избирательно подходить к методу пластического замещения дефекта. Безусловно, во многом это зависит от опыта хирурга, однако соблюдение основных принципов пластической хирургии остается залогом успешных результатов.
Заключение
Устранение лучевых дефектов мягких тканей различной локализации у больных после лучевого или комбинированного лечения злокачественных новообразований представляет собой достаточно трудную задачу, которую далеко не всегда удается решить в полном объеме консервативными методами лечения. С учетом многолетнего опыта и полученных в рамках данного исследования результатов можно говорить о высокой эффективности предложенных методов лечения местных лучевых повреждений мягких тканей различной локализации, которые в конечном счете позволяют добиться полной реабилитации пациентов. Таким образом, предложенные варианты реконструкции лучевых язв, развившихся после комбинированного и лучевого лечения злокачественных новообразований, являются высокоэффективными методами, которые позволяют избавиться от уродующих дефектов, улучшить качество жизни и вернуть социальную активность практически у 100% больных.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Пасов Виктор Владимирович – д-р мед. наук, вед. науч. сотр., проф. образовательного отдела, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: pasov@mrrc.obninsk.ru; ORCID: 0000-0003-0387-1648; Author ID: 767404;
SPIN: 8778-2401
Viktor V. Pasov – Dr. Sci. (Med.), Leading Res. Officer, Prof., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: pasov@mrrc.obninsk.ru; ORCID: 0000-0003-0387-1648; Author ID: 767404;
SPIN: 8778-2401
Шитарева Вероника Николаевна – врач-онколог, мл. науч. сотр., МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: veronikashitareva@gmail.com; ORCID: 0000-0002-0031-0354
Veronirka N. Shitareva – Oncologist, Res. Assist., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: veronikashitareva@gmail.com;
ORCID: 0000-0002-0031-0354
Коротков Валерий Александрович – канд. мед. наук, зав. отд-нием, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: korotkov910@mail.ru; ORCID: 0000-0001-7919-9750
Valeriy A. Korotkov – Cand. Sci. (Med.), Head of the Department, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: korotkov910@mail.ru; ORCID: 0000-0001-7919-9750
Тивкова Лилия Викторовна – врач-хирург, МРНЦ
им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии».
E-mail: ova.lika@yandex.ru
Lilia V. Tivkova – Surgeon, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: ova.lika@yandex.ru
Касымов Максим Ринадович – врач-онколог, МРНЦ
им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии».
E-mail: makskas89@yandex.ru; ORCID: 0000-0001-8202-8055
Maxim R. Kasymov – Researcher, Oncologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: makskas89@yandex.ru;
ORCID: 0000-0001-8202-8055
Каприн Андрей Дмитриевич – академик РАН, д-р мед. наук, проф., зав. каф. онкологии и рентгенорадиологии им. В.П. Харченко медицинского института РУДН, дир. МНИОИ им. П.А. Герцена (филиал ФГБУ «НМИЦ радиологии»), ген. дир. ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-8784-8415
Andrey D. Kaprin – Acad. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University), Director Hertsen Moscow Oncology Research Institute, General Director National Medical Research Radiological Centre.
ORCID: 0000-0001-8784-8415
Иванов Сергей Анатольевич – чл.-корр. РАН, д-р мед. наук, проф. каф. онкологии и рентгенорадиологии им. В.П. Харченко медицинского института РУДН, директор МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-7689-6032
Sergey A. Ivanov – Corr. Memb. RAS, Dr. Sci. (Med.), Director of Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
ORCID: 0000-0001-7689-6032
Поступила в редакцию: 04.07.2024
Поступила после рецензирования: 08.07.2024
Принята к публикации: 11.07.2024
Received: 04.07.2024
Revised: 08.07.2024
Accepted: 11.07.2024
Viktor V. Pasov1, Veronirka N. Shitareva1, Valeriy A. Korotkov1, Lilia V. Tivkova1,
Maxim R. Kasymov1, Andrey D. Kaprin2,3,4, Sergey A. Ivanov1,3
1Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Obninsk, Russia;
2National Medical Research Radiological Centre of the Ministry of Health of the Russian Federation, Moscow, Russia;
3Patrice Lumumba People’s Friendship University of Russia (RUDN University), Moscow, Russia;
4Hertsen Moscow Oncology Research Institute – branch of the National Medical Research Radiological Centre, Moscow, Russia
pasov@mrrc.obninsk.ru
Abstract
During the years of widespread use of radiotherapy in cancer patients, the incidence of local radiation damage to soft tissues (of varying severity) reached 30–40% or more. The experience of the radiation injury treatment department in the 70s and 80s indicates that every 2–3 beds were occupied by patients with this pathology. With the development of radiology, the introduction of new sources and techniques, the frequency of formation of such changes in the zone of irradiation fields has significantly decreased and currently stands at about 2%. The purpose of the proposed study is to demonstrate the possibilities of skin plastic surgery in this contingent of people who, as a rule, do not receive qualified care for a long time. As part of the work carried out, the time elapsed from the moment of formation of pathological changes to hospitalization in the department, on average, was 3–5 years, and was filled with ineffective conservative measures. Over the past 4 years, 60 reconstructive plastic surgeries have been performed in the radiation injury treatment department using musculoskeletal (21), skin fascial (21), skin (10) flaps, as well as plasty with local tissues (8). In the early postoperative period, the most common complication was marginal necrosis of the flap (13) which in 11 patients caused repeated operations in the form of secondary sutures or, in the case when it was not possible to perform this, plastic surgery of the defect with insular skin flaps was applied to the granulating wound. Subsequently, complete healing of the postoperative wound was noted in such patients. Thus, the proposed options for the reconstruction of radiation ulcers that developed after combined and radiation treatment of malignant neoplasms are highly effective methods that can get rid of disfiguring defects, improve the quality of life and restore social activity in almost 100% of patients.
Keywords: radiation therapy, complications, late radiation injuries of the skin, surgical treatment, rehabilitation.
For citation: Pasov V.V., Shitareva V.N., Korotkov V.A., Tivkova L.V., Kasymov M.R., Kaprin A.D., Ivanov S.A. Skin-plastic surgery in patients with late radiation injuries of soft tissues. Clinical review for general practice. 2024; 5 (7): 37-45. (In Russ.). DOI: 10.47407/kr2024.5.7.00446
Введение
В настоящее время частота развития поздних лучевых повреждений в мире составляет около 5% от всех пациентов, перенесших лучевую терапию, однако по сведениям некоторых исследователей формирование данной патологии в нашей стране превышает 10–15% [1].
Одним из осложнений лучевой терапии онкологических заболеваний являются местные лучевые повреждения мягких тканей в области полей облучения (фиброз, язва). В России развитие таких патологических изменений составляет около 2% [2]. Коррекция данной патологии представляет достаточно сложную задачу и требует радикального иссечения всех измененных тканей (включая костные фрагменты) с последующим адекватным замещением сформировавшегося дефекта, который, как правило, имеет большую площадь, объем и не может быть закрыт традиционными методами пластики. Широкое и успешное использование в хирургической практике ротационных кожно-фасциальных тканевых лоскутов, а также мышечных и кожно-мышечных с осевым кровоснабжением (перемещение, свободная пересадка) позволяет надеяться на хорошие результаты и при лечении местных лучевых повреждений мягких тканей [2–8]. Поздние лучевые повреждения мягких тканей, формирующиеся на постгоспитальном этапе лечения злокачественных новообразований, значительно снижают качество жизни пациента. Они могут стать причиной страданий, глубокой инвалидности, малигнизации и смерти больного. Поэтому благоприятный исход основного заболевания еще не означает полного выздоровления. Учитывая, что большинство пациентов находится в трудоспособном возрасте, проблема местных лучевых повреждений приобретает социальную значимость и требует поиска эффективных методов профилактики и реабилитации, которые позволят обеспечить приемлемые условия их жизни и деятельности [9].
В связи с вышесказанным, поиск путей повышения эффективности реабилитационных мероприятий у больных местными лучевыми повреждениями мягких тканей, разработка показаний к корригирующим кожно-пластическим операциям с использованием перемещенных васкуляризированных лоскутов и оценка эффективности их применения остаются актуальными.
Цель исследования: демонстрация возможностей и оценка эффективности кожно-пластических операций у пациентов с поздними лучевыми язвами мягких тканей.
Задачи исследования: 1) провести анализ ранних послеоперационных осложнений у пациентов после кожно-пластических операций по поводу поздних лучевых язв мягких тканей различных локализаций; 2) оценить количество отдаленных послеоперационных осложнений; 3) оценить количество и объем повторных хирургических вмешательств.
Материалы и методы
В течение 2019–2023 гг. в соответствии с планом научно-исследовательской работы в отделении лечения лучевых повреждений МРНЦ выполнено 60 оперативных вмешательств пациентам с поздними лучевыми язвами мягких тканей различной локализации. Медиана возраста больных составила 64 года, причем большинство из них были женщины (41 наблюдение).
Критериями включения в исследование являлись:
• возраст ≥ 18 лет;
• отсутствие, по данными лабораторных и инструментальных исследований, признаков прогрессирования основного заболевания;
• отсутствие декомпенсации сопутствующих заболеваний, требующих коррекции в условиях профильных стационаров.
Критериями исключения являлись:
• возраст менее 18 лет;
• наличие, по данным лабораторных и инструментальных исследований, признаков прогрессирования основного заболевания;
• наличие декомпенсации сопутствующих заболеваний, требующих коррекции в условиях профильных стационаров.
 По месту жительства в качестве лечебных мероприятий большинству пациентов применялись консервативные методы лечения с использованием различных антисептиков, мазей, протеолитических ферментов, сосудистых препаратов, антибактериальной и физиотерапии. Только в 2 наблюдениях была произведена пластика дефекта мягких тканей, которая в конечном итоге закончилась полным некрозом лоскута с последующим увеличением площади и объема язвы мягких тканей. Неудачный результат оперативного вмешательства, как правило, был обусловлен неправильным выбором метода пластики, неадекватным иссечением объема и площади пораженных тканей с сохранением патологически измененных костных фрагментов дна язвы и окружающих ее мягких тканей. Длительность течения патологического процесса была обусловлена частичной эффективностью консервативных мероприятий, которые позволяли добиться временной эпителизации язвенной поверхности. В связи с этим многие больные оттягивали момент госпитализации и поступили в нашу клинику только через несколько лет после начала заболевания (наибольший срок составил 29 лет). Наличие обширной язвы, болевой синдром и периодические аррозивные кровотечения значительно сужали временные рамки, в течение которых пациент обращался за специализированной помощью.
По месту жительства в качестве лечебных мероприятий большинству пациентов применялись консервативные методы лечения с использованием различных антисептиков, мазей, протеолитических ферментов, сосудистых препаратов, антибактериальной и физиотерапии. Только в 2 наблюдениях была произведена пластика дефекта мягких тканей, которая в конечном итоге закончилась полным некрозом лоскута с последующим увеличением площади и объема язвы мягких тканей. Неудачный результат оперативного вмешательства, как правило, был обусловлен неправильным выбором метода пластики, неадекватным иссечением объема и площади пораженных тканей с сохранением патологически измененных костных фрагментов дна язвы и окружающих ее мягких тканей. Длительность течения патологического процесса была обусловлена частичной эффективностью консервативных мероприятий, которые позволяли добиться временной эпителизации язвенной поверхности. В связи с этим многие больные оттягивали момент госпитализации и поступили в нашу клинику только через несколько лет после начала заболевания (наибольший срок составил 29 лет). Наличие обширной язвы, болевой синдром и периодические аррозивные кровотечения значительно сужали временные рамки, в течение которых пациент обращался за специализированной помощью.На момент госпитализации в отделение в 60 (100%) наблюдениях у пациентов констатирована лучевая язва. Среди клинических проявлений у наших пациентов преобладал болевой синдром. Интенсивность его непосредственно была связана с площадью, объемом лучевой язвы, повреждением подлежащих костных структур и наличием других местных лучевых повреждений. Фактически, боль и наличие язвы являются самыми частыми причинами, которые заставляют больного обратиться за помощью в специализированное отделение. В результате осмотра у всех больных с лучевыми язвами было выявлено сочетание местных лучевых повреждений, что является типичным в клинической картине у пациентов с данной патологией. Частота сочетания лучевой язвы мягких тканей с другими проявлениями местных лучевых повреждений представлена в табл. 1.
Согласно данным табл. 1, на фоне фиброза лучевая язва, как правило, сопровождалась лучевыми изменениями в костях (ребра, ключица, грудина, крестец и т.д.). Несколько реже у больных отмечался вторичный лимфостаз конечности и пневмофиброз. Локализация лучевых язв и площадь дефекта мягких тканей были различными (табл. 2).
Представленные в табл. 2 данные наглядно показывает, что абсолютное большинство больных страдали язвами передней поверхности грудной клетки в результате комбинированного лечения рака молочной железы.
Для исключения прогрессирования основного заболевания на первом этапе диагностических мероприятий всем пациентам выполнялось стандартное обследование, которое включало: осмотр больного, ультразвуковое исследование регионарных лимфоузлов, рентгенологическое исследование легких, маммографию контралатеральной молочной железы (при ее наличии), консультацию маммолога и гинеколога и других специалистов, а также обычный набор исследований крови и мочи (общий анализ крови и мочи, биохимия крови, коагулограмма). В случаях выявления увеличенных лимфоузлов широко применялась пункционная тонкоигольная биопсия под контролем ультразвука с последующим цитологическим исследованием полученного материала. При диагностических трудностях и подозрении на метастатический процесс дополнительно использовалась компьютерная томография, магнитно-резонансная томография и т.д. Радионуклидное и рентгенологическое обследование (включая рентгеновскую томографию – цифровая люминесцентная рентгенография) позволяли установить причину изменений в костях скелета (метастатическое поражение или лучевой остеорадионекроз, остеомиелит, патологический перелом). КТ-ангиография использовалась для выяснения состояния сосудистой ножки лоскута, который планируется переместить. Для исключения малигнизации, особенно в случаях длительно текущих и незаживающих язв, применялись цитологическое или гистологическое исследования с язвы. Кроме того, в обязательном порядке до операции выполнялись посев из язвы и определение чувствительности микрофлоры к антибиотикам для определения тактики антибиотикотерапии в раннем послеоперационном периоде.
Важным моментом предварительного обследования больных лучевой язвой являлось определение площади дефекта и окружающего его фиброза, которое выполнялось обычной линейкой или штангенциркулем.
Основная задача реконструктивных вмешательств у больных местными лучевыми повреждениями заключалась в радикальном иссечении пораженных тканей и адекватном замещении сформировавшегося дефекта. В некоторых случаях радикальное удаление поврежденных тканей выполнить не удается в связи с большой площадью поражения, вовлечением в патологический процесс крупных сосудисто-нервных пучков (над-, подключичной и подмышечной области, пахово-подвздошной и т.д.), а также костного каркаса грудной клетки или малого таза (ребра, грудина,
 крестец), разрушение которых может вызвать нарушение стабильности. В таких случаях целесообразно было использовать кожно-мышечные и мышечные лоскуты. В условиях раневой инфекции и нерадикального иссечения измененных тканей они имеют значительное преимущество перед другими вариантами пластики, обладая высокой «биологической активностью» и васкуляризирующей способностью. Важным фактором успеха оперативного лечения местных лучевых повреждений мягких тканей являлось строгое соблюдение основных принципов пластической хирургии:
крестец), разрушение которых может вызвать нарушение стабильности. В таких случаях целесообразно было использовать кожно-мышечные и мышечные лоскуты. В условиях раневой инфекции и нерадикального иссечения измененных тканей они имеют значительное преимущество перед другими вариантами пластики, обладая высокой «биологической активностью» и васкуляризирующей способностью. Важным фактором успеха оперативного лечения местных лучевых повреждений мягких тканей являлось строгое соблюдение основных принципов пластической хирургии:• применение хорошо васкуляризированных тканей;
• полное отсутствие натяжения лоскута и кожных краев раны;
• деликатное обращение с тканями;
• активная хирургическая тактика операции в ранние сроки развития гнойно-некротического процесса, а также превентивное иссечение фиброза;
• широкое агрессивное удаление тканей и всех инфицированных костных фрагментов.
В случаях небольших по площади и объему (поверхностных) лучевых повреждений кожи использовались ротационные кожно-фасциальные лоскуты, в том числе на перфорантных артериях магистральных сосудов. Важным моментом в оперативном вмешательстве являлись планирование и предоперационная разметка при формировании лоскута, ширина которого должна составлять не менее половины от его длины для сохранения адекватного кровоснабжения акромиальных отделов. Кроме того, крайне важно было избегать натяжения трансплантата при его фиксации к дефекту кожи. Учитывая вышесказанное, как правило, в случаях неизбежности натяжения использовался расщепленный кожный лоскут для закрытия донорской зоны.
Определение необходимости повторного хирургического вмешательства у пациентов с развившимся краевым некрозом лоскута проводилось с помощью расчета его площади. В случаях, когда площадь краевого некроза не превышала 10%, предпочтение отдавалось консервативному лечению.
У всех больных было получено письменное информированное согласие на проведение соответствующего метода хирургического лечения.
Одобрение работы локальным этическим комитетом не проводилось.
Обработка результатов исследования производилась с помощью статистического пакета Jamovi Version 2.3 (разработчики – J. Love, D. Dropmann, R. Selker, Сидней, Австралия). Описание непрерывных переменных представлено в виде средних значений и медиан.
Методы пластики и результаты

 За отчетный период нами выполнены 60 операций больным лучевыми язвами, которые сформировались после лечения опухолей различной локализации. В 21 случае использовались перемещенные кожно-мышечные лоскуты, еще в 21 случаях – ротационные кожно-фасциальные лоскуты; в 10 случаях – кожные лоскуты, и в 8 случаях удалось обойтись пластикой местными тканями. Последняя применялась в случаях небольших размеров язвенных дефектов.
За отчетный период нами выполнены 60 операций больным лучевыми язвами, которые сформировались после лечения опухолей различной локализации. В 21 случае использовались перемещенные кожно-мышечные лоскуты, еще в 21 случаях – ротационные кожно-фасциальные лоскуты; в 10 случаях – кожные лоскуты, и в 8 случаях удалось обойтись пластикой местными тканями. Последняя применялась в случаях небольших размеров язвенных дефектов.Медиана продолжительности операции составила 120 мин, средняя кровопотеря – 37 мл. Ранние послеоперационные осложнения были зарегистрированы в 23 (38%) наблюдениях (табл. 3).
Наиболее частым осложнением являлся краевой некроз лоскута – у 13 (21%) пациентов, что у 11 (18%) потребовало проведения повторной операции в виде наложения вторичных швов или же применения кожной пластики островковыми лоскутами. В одном наблюдении также было отмечено расхождение швов в раннем послеоперационном периоде, что было обусловлено обширным послеоперационным дефектом. Пациенту также было выполнено наложение вторичных швов. Среднее время наблюдения пациентов в стационаре составило 13 дней.
Суммарно в раннем послеоперационном периоде выполнено 15 (25%) повторных хирургических вмешательств, в двух наблюдениях – в позднем (спустя несколько месяцев после операции у пациентов было отмечено расхождение швов).
В остальных случаях послеоперационный период протекал гладко. В конечном итоге у 45 пациентов было зафиксировано заживление первичным натяжением. Осложнений не было (рис. 1–5).
У остальных пациентов (n=15) после повторных хирургических вмешательств зафиксировано полное заживление раневого дефекта, что позволило им вернуться к привычной социальной жизни без каких-либо ограничений.
 Обсуждение
ОбсуждениеВ литературе представлена довольно скудная информация о подобных исследованиях, вероятно, из-за редкой встречаемости подобной патологии с учетом совершенствования методик проведения лучевой терапии и совершенствования
 оборудования, а также узкой направленности. Данная когорта пациентов чаще всего попадает к общим хирургам, и чаще всего описывается в виде единичных клинических случаев.
оборудования, а также узкой направленности. Данная когорта пациентов чаще всего попадает к общим хирургам, и чаще всего описывается в виде единичных клинических случаев.В 2019 г. группа исследователей из Китая представила результаты лечения 10 пациентов с поздними лучевыми язвами грудной стенки (пациентки набирались с 2012 по 2017 г.). В исследовании терапия проводилась в 2 этапа: на первом этапе проводилась хирургическая обработка язвы и применение терапии отрицательным давлением (более известна как установка ВАК-системы), а на втором – пластика лоскутом на основе широчайшей мышцы спины (ТДЛ). Средний возраст пациенток составил 60,3 года, средняя продолжительность наличия язв у пациентов – 21 мес. В исследовании все лоскуты хорошо прижились, послеоперационный период протекал без осложнений [10].
Также в 2019 г. было опубликовано еще одно исследование ученых из Вьетнама, которые представили результаты лечения поздних лучевых язв различных локализаций. В исследовании, которое длилось с 2013 по 2017 г., приняли участие 30 пациентов, были использованы, как и в нашем исследовании, различные хирургические техники. Средний возраст пациентов составил 50 лет. Наиболее частой причиной возникновения поздних лучевых язв являлось комбинированное и комплексное лечение рака молочной железы. У двоих пациентов был зафиксирован краевой некроз лоскута (7%), еще у двоих (7%) – тотальный некроз, потребовавший проведения повторного хирургического лечения. Среднее время наблюдения в стационаре составило
43 дня [11].
В 2019 г. Y. Zhou и Y. Zhang представили результаты ретроспективного исследования, посвященного хирургическому лечению 50 пациенток с поздними лучевыми язвами грудной стенки после лечения рака молочной железы с 2002 по 2016 г. Пациентки были поделены на две группы, в одной из которых выполнялась одномоментная пластика раневого дефекта, а в другой – на первом этапе выполнялась санация раны и перемещение на раневый дефект большого сальника с отсроченной реконструкцией через 2 нед. В первой группе был зарегистрирован один летальный исход от сепсиса, 6 (24%) случаев нагноения лоскута, 4 (16%) случая краевого некроза лоскута, тогда как во второй группе подобных осложнений зарегистрировано не было. В связи с этим исследователи пришли к выводу о безопасности применения двухэтапной техники [12].
Как видно из представленных исследований, хирургами по всему миру обсуждаются оптимальные тактики хирургического лечения данной редкой когорты пациентов. Чаще всего это пациенты с поздними лучевыми повреждениями мягких тканей области грудной стенки после лечения рака молочной железы. Суммируя непосредственные и отдаленные результаты оперативного лечения, можно констатировать, что с учетом локализации язвы, ее площади и объема необходимо избирательно подходить к методу пластического замещения дефекта. Безусловно, во многом это зависит от опыта хирурга, однако соблюдение основных принципов пластической хирургии остается залогом успешных результатов.
Заключение
Устранение лучевых дефектов мягких тканей различной локализации у больных после лучевого или комбинированного лечения злокачественных новообразований представляет собой достаточно трудную задачу, которую далеко не всегда удается решить в полном объеме консервативными методами лечения. С учетом многолетнего опыта и полученных в рамках данного исследования результатов можно говорить о высокой эффективности предложенных методов лечения местных лучевых повреждений мягких тканей различной локализации, которые в конечном счете позволяют добиться полной реабилитации пациентов. Таким образом, предложенные варианты реконструкции лучевых язв, развившихся после комбинированного и лучевого лечения злокачественных новообразований, являются высокоэффективными методами, которые позволяют избавиться от уродующих дефектов, улучшить качество жизни и вернуть социальную активность практически у 100% больных.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Пасов Виктор Владимирович – д-р мед. наук, вед. науч. сотр., проф. образовательного отдела, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: pasov@mrrc.obninsk.ru; ORCID: 0000-0003-0387-1648; Author ID: 767404;
SPIN: 8778-2401
Viktor V. Pasov – Dr. Sci. (Med.), Leading Res. Officer, Prof., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: pasov@mrrc.obninsk.ru; ORCID: 0000-0003-0387-1648; Author ID: 767404;
SPIN: 8778-2401
Шитарева Вероника Николаевна – врач-онколог, мл. науч. сотр., МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: veronikashitareva@gmail.com; ORCID: 0000-0002-0031-0354
Veronirka N. Shitareva – Oncologist, Res. Assist., Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: veronikashitareva@gmail.com;
ORCID: 0000-0002-0031-0354
Коротков Валерий Александрович – канд. мед. наук, зав. отд-нием, МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». E-mail: korotkov910@mail.ru; ORCID: 0000-0001-7919-9750
Valeriy A. Korotkov – Cand. Sci. (Med.), Head of the Department, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: korotkov910@mail.ru; ORCID: 0000-0001-7919-9750
Тивкова Лилия Викторовна – врач-хирург, МРНЦ
им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии».
E-mail: ova.lika@yandex.ru
Lilia V. Tivkova – Surgeon, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: ova.lika@yandex.ru
Касымов Максим Ринадович – врач-онколог, МРНЦ
им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии».
E-mail: makskas89@yandex.ru; ORCID: 0000-0001-8202-8055
Maxim R. Kasymov – Researcher, Oncologist, Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre. E-mail: makskas89@yandex.ru;
ORCID: 0000-0001-8202-8055
Каприн Андрей Дмитриевич – академик РАН, д-р мед. наук, проф., зав. каф. онкологии и рентгенорадиологии им. В.П. Харченко медицинского института РУДН, дир. МНИОИ им. П.А. Герцена (филиал ФГБУ «НМИЦ радиологии»), ген. дир. ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-8784-8415
Andrey D. Kaprin – Acad. RAS, Dr. Sci. (Med.), Full Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University), Director Hertsen Moscow Oncology Research Institute, General Director National Medical Research Radiological Centre.
ORCID: 0000-0001-8784-8415
Иванов Сергей Анатольевич – чл.-корр. РАН, д-р мед. наук, проф. каф. онкологии и рентгенорадиологии им. В.П. Харченко медицинского института РУДН, директор МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии». ORCID: 0000-0001-7689-6032
Sergey A. Ivanov – Corr. Memb. RAS, Dr. Sci. (Med.), Director of Tsyb Medical Radiological Research Centre – branch of the National Medical Research Radiological Centre, Prof., Patrice Lumumba People’s Friendship University of Russia (RUDN University).
ORCID: 0000-0001-7689-6032
Поступила в редакцию: 04.07.2024
Поступила после рецензирования: 08.07.2024
Принята к публикации: 11.07.2024
Received: 04.07.2024
Revised: 08.07.2024
Accepted: 11.07.2024


