Клинический разбор в общей медицине №9 2024
Клинический разбор в общей медицине №9 2024
Самоконтроль гликемии у пожилых: новые возможности
Номера страниц в выпуске:85-90
Аннотация
За последние 50 лет частота сахарного диабета 2-го типа в старшей возрастной группе значительно увеличилась, а пожилые пациенты (старше 65 лет) составляют половину от всех случаев диагностированного заболевания. При этом наличие сопутствующих заболеваний, увеличение риска развития гипогликемии, снижение способности к самообслуживанию и повышение риска падений являются дополнительными факторами, усложняющими контроль заболевания у данной категории больных. Доступность современных технологий в управлении сахарным диабетом позволяет осуществлять дополнительный контроль гликемии у таких больных, в том числе со стороны родственников, что особенно важно в случае развития старческой астении и деменции. Как следствие, возможность принимать клинические решения на основе более полной информации позволяет существенно улучшить не только качество жизни пациентов, но и увеличить ожидаемую продолжительность жизни за счет снижения риска развития и прогрессирования макро- и микрососудистых осложнений сахарного диабета.
Ключевые слова: сахарный диабет, самоконтроль глюкозы крови, старческая астения.
Для цитирования: Барсуков И.А., Демина А.А. Самоконтроль гликемии у пожилых: новые возможности. Клинический разбор в общей медицине. 2024; 5 (9): 85–90. DOI: 10.47407/kr2024.5.9.00485
За последние 50 лет частота сахарного диабета 2-го типа в старшей возрастной группе значительно увеличилась, а пожилые пациенты (старше 65 лет) составляют половину от всех случаев диагностированного заболевания. При этом наличие сопутствующих заболеваний, увеличение риска развития гипогликемии, снижение способности к самообслуживанию и повышение риска падений являются дополнительными факторами, усложняющими контроль заболевания у данной категории больных. Доступность современных технологий в управлении сахарным диабетом позволяет осуществлять дополнительный контроль гликемии у таких больных, в том числе со стороны родственников, что особенно важно в случае развития старческой астении и деменции. Как следствие, возможность принимать клинические решения на основе более полной информации позволяет существенно улучшить не только качество жизни пациентов, но и увеличить ожидаемую продолжительность жизни за счет снижения риска развития и прогрессирования макро- и микрососудистых осложнений сахарного диабета.
Ключевые слова: сахарный диабет, самоконтроль глюкозы крови, старческая астения.
Для цитирования: Барсуков И.А., Демина А.А. Самоконтроль гликемии у пожилых: новые возможности. Клинический разбор в общей медицине. 2024; 5 (9): 85–90. DOI: 10.47407/kr2024.5.9.00485
Review
Vladimirsky Moscow Regional Research Clinical Institute (MONIKI), Moscow, Russia
palantirr@inbox.ru
Abstract
Over the last 50 years the prevalence of Type 2 diabetes mellitus (T2DM) in older adults (>65 years) rose dramatically. Comorbidity, high risk of hypoglycemia, lack of resilience an individual care needs are additional risk factors that complicate disease management in these patients. The availability of new technologies in diabetes management allow to provide additional control of blood glucose levels in these patients by there relatives, that is of a great importance in case of frailty and dementia. As the result, the possibility of making clinical decisions based on greater amount of information allow to ameliorate not only the patient’s quality of life, but also to extend life expectancy by reducing the risk of onset and progression of macro- and microvascular complications.
Keywords: diabetes mellitus, blood glucose self-monitoring, frailty.
For citation: Barsukov I.A., Demina A.A. Blood glucose self-monitoring in older adults: new approaches. Clinical review for general practice. 2024; 5 (9): 85–90 (In Russ.). DOI: 10.47407/kr2024.5.9.00485
Увеличение распространенности сахарного диабета 2-го типа (СД 2) среди населения является социально-значимой проблемой для систем здравоохранения во всем мире. По статистике около полумиллиарда человек в мире страдает СД, при этом 90% всех случаев приходится на СД 2 [1]. За последние 50 лет частота
СД 2 в старшей возрастной группе значительно увеличилась, и пожилые пациенты (старше 65 лет) составляют половину от всех случаев диагностированного заболевания [2, 3]. Важно, что у пациентов старшей возрастной группы отмечается более выраженная вариабельность физических и когнитивных возможностей, чем у молодых пациентов [3]. Более того, наличие сопутствующих заболеваний, увеличение риска развития гипогликемии, снижение способности к самообслуживанию и повышение риска падений являются дополнительными факторами, усложняющими контроль заболевания у данной категории больных [4]. Согласно прогнозам к 2045 г. распространенность СД 2 среди пациентов в возрасте старше 75 лет будет составлять порядка 24% [2].
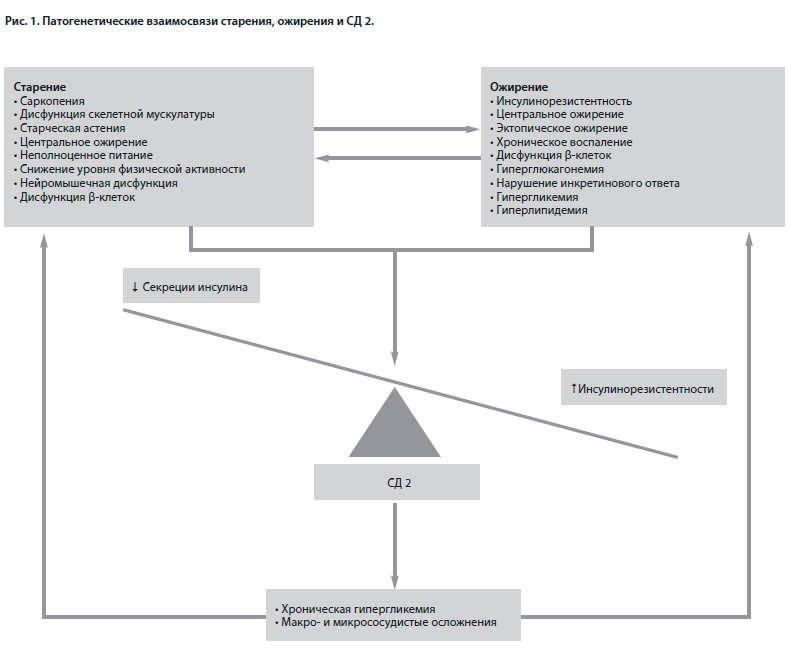
Основой патогенеза СД 2 является прогрессирующее снижение функции бета-клеток в сочетании с развитием инсулинорезистентности и иными нарушениями (в частности, гиперклюкагонемией и нарушением инкретинового ответа) [5]. Как правило, наличия одной лишь инсулинорезистентности недостаточно для развития СД 2, однако длительная гиперинсулинемия, развивающаяся на этом фоне, приводит к выпадению первой, а со временем и второй фазы инсулинового ответа на повышение глюкозы крови [5]. Старение также вносит свой вклад в патогенез СД 2 как напрямую за счет снижения функции бета-клеток и снижения секреции инсулина, так и косвенно за счет повышения инсулинорезистентности вследствие избыточной массы тела и других факторов риска [6, 7]. Так, с возрастом происходит накопление висцеральной жировой ткани (в печени, кардиальной и скелетно-мышечной ткани) с одновременным снижением мышечной массы и функциональных возможностей мышц (саркопения), которые могут в том числе усугубляться малоподвижным образом жизни [7–9]. Избыток висцеральной и эктопической жировой ткани, в свою очередь, снижает чувствительность клеток к инсулину путем увеличения синтеза адипокинов и цитокинов, влияющих на инсулиновые рецепторы (фактор некроза опухоли, С-реактивный белок и пр.), тем самым усугубляя инсулинорезистентность [10]. Схематически патогенетические взаимосвязи старения, ожирения и СД 2 у пожилых пациентов представлены на рис. 1.
• модель, разработанная L. Fried и соавт. (фенотипическая), включающая в себя снижение массы тела, силы сжатия, скорости ходьбы, уменьшения уровня физической активности и повышенную утомляемость. Наличие хотя бы трех из перечисленных симптомов соответствует критериям астении [12];
• модель, разработанная K. Rockwood и A. Mitnitski (накопления дефицитов), которая представляет собой индекс старческой астении и определяет уровень зависимости индивидуума от медицинской помощи. Индекс рассчитывается на основании перечня из 70 (впоследствии сокращенного до 40) заболеваний и симптомов: чем ближе значение к единице, тем более выражена степень астении [13].
Определить точную распространенность старческой астении среди пациентов пожилого возраста не представляется возможным из-за отсутствия единого универсального метода оценки данного состояния. По данным имеющихся систематических обзоров и метаанализов, она варьирует от 10% до 71,6% среди пациентов старшей возрастной группы в зависимости от уровня жизни в стране [14] и места проведения оценки (условия стационара или пациенты, живущие вне дома престарелых) [15, 16].
Физиологические изменения, происходящие в процессе старения организма, могут также снижать чувствительность к гипогликемиям и реакцию на нее. Так, было показано, что у пожилых пациентов частота распознавания гипогликемий была существенно ниже, а время восстановления дольше, чем у молодых пациентов. Примечательно, что симптомы гипогликемии у пожилых пациентов могут быть нетипичными и проявляться падением, транзиторной ишемической атакой, тошнотой и шаткостью походки, тем самым существенно затрудняя диагностику [22, 23].
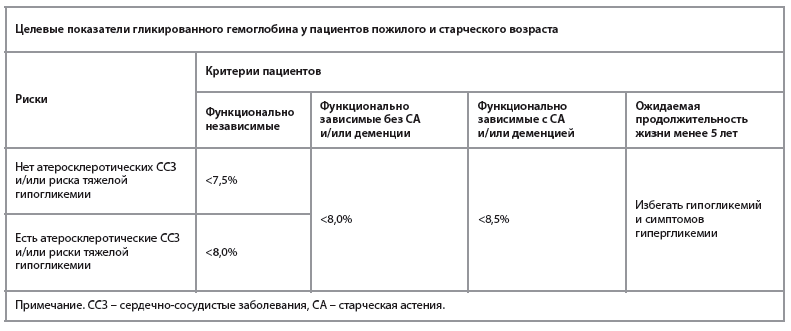
На сегодняшний день в Российской Федерации действует алгоритм индивидуализированного выбора терапевтической цели по уровню гликированного гемоглобина в зависимости от возраста пациента, наличия атеросклеротических сердечно-сосудистых заболеваний и/или риска тяжелой гипогликемии. Пациенты пожилого и старческого возраста условно могут быть поделены на несколько групп, в том числе на основании ряда критериев, характеризующих их функциональные возможности. Так, в случае относительно сохранного состояния пациента, отсутствия тяжелых сердечно-сосудистых заболеваний и старческой астении целевой показатель HbA1c должен составлять <7,5%. Напротив, пожилые пациенты, страдающие старческой астенией и/или деменцией, могут придерживаться менее строгих показателей гликемии, соответствующих целевому показателю HbA1c<8,5% (см. таблицу) [26].
Активное развитие современных технологий по контролю СД существенно расширило возможности современной медицины. Повышение доступности систем непрерывного мониторирования глюкозы и новых моделей глюкометров позволяет осуществлять дистанционный контроль за пожилым пациентом со стороны как родственников, так и врачей. Одной из таких моделей является глюкометр Контур Плюс Уан (Contour™ Plus One), который позволяет проводить дистанционный контроль состояния углеводного обмена при помощи приложения Контур Диабитис ( Contour Diabetes) и облачного хранилища Contour™ Cloud. Несомненно, важной особенностью глюкометра с позиции ведения пожилых пациентов является возможность настройки напоминаний о контроле глюкозы крови, а также функция «Умная подсветка» (Smartlight™), которая при помощи световых индикаторов мгновенно информирует об уровне нахождения глюкозы в пределах, выше или ниже целевого диапазона (рис. 2).
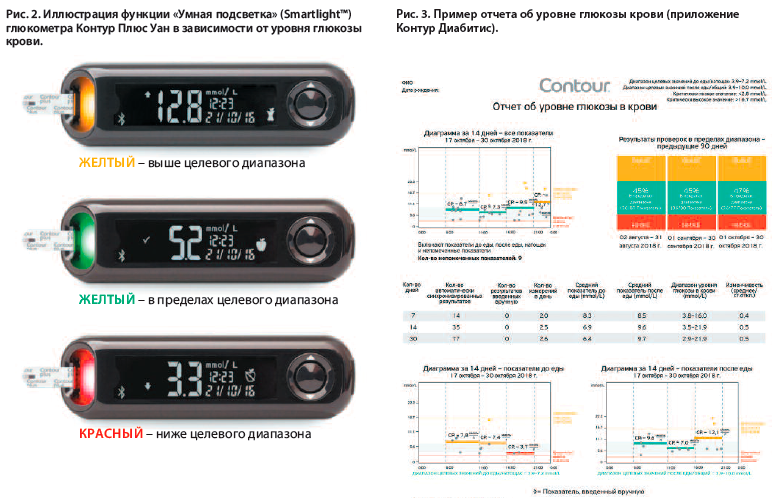
В дополнение к этому прибор обладает функцией «Второй шанс», которая позволяет в течение 60 с дополнительно нанести кровь на тест-полоску в том случае, когда первого образца оказалось недостаточно для анализа. Возможность дистанционного наблюдения и формирования отчетов в приложении Контур Диабитис родственниками для последующего их предоставления лечащему врачу особенно актуальна в случае снижения когнитивных способностей пожилого пациента с СД, так как позволяет облегчить процесс принятия клинических решений по коррекции терапии (рис. 3).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Барсуков Илья Алексеевич – канд. мед. наук, доц., ст. науч. сотр. отд-ния терапевтической эндокринологии, ГБУЗ МО «МОНИКИ
им. М.Ф. Владимирского». E-mail: palantirr@inbox.ru;
ORCID: 0000-0002-1889-8555; Scopus Author ID: 57225446501;
eLibrary SPIN: 7946-8566
Ilya A. Barsukov – Cand. Sci. (Med.), Vladimirsky Moscow Regional Research Clinical Institute (MONIKI).
E-mail: palantirr@inbox.ru; ORCID: 0000-0002-1889-8555; Scopus Author ID: 57225446501; eLibrary SPIN: 7946-8566
Демина Анна Александровна – науч. сотр. отд-ния терапевтической эндокринологии, ГБУЗ МО «МОНИКИ
им. М.Ф. Владимирского». E-mail: annagalitskova@gmail.com;
ORCID: 0000-0002-7742-5782; Scopus Author ID: 58318134200; eLibrary SPIN: 2345-6369
Anna A. Demina – Res. Officer, Vladimirsky Moscow Regional Research Clinical Institute (MONIKI). E-mail: annagalitskova@gmail.com; ORCID: 0000-0002-7742-5782; Scopus Author ID: 58318134200; eLibrary SPIN: 2345-6369
Поступила в редакцию: 04.09.2024
Поступила после рецензирования: 13.09.2024
Принята к публикации: 19.09.2024
Received: 04.09.2024
Revised: 13.09.2024
Accepted: 19.09.2024
Blood glucose self-monitoring in older adults: new approaches
Ilya A. Barsukov, Anna A. DeminaVladimirsky Moscow Regional Research Clinical Institute (MONIKI), Moscow, Russia
palantirr@inbox.ru
Abstract
Over the last 50 years the prevalence of Type 2 diabetes mellitus (T2DM) in older adults (>65 years) rose dramatically. Comorbidity, high risk of hypoglycemia, lack of resilience an individual care needs are additional risk factors that complicate disease management in these patients. The availability of new technologies in diabetes management allow to provide additional control of blood glucose levels in these patients by there relatives, that is of a great importance in case of frailty and dementia. As the result, the possibility of making clinical decisions based on greater amount of information allow to ameliorate not only the patient’s quality of life, but also to extend life expectancy by reducing the risk of onset and progression of macro- and microvascular complications.
Keywords: diabetes mellitus, blood glucose self-monitoring, frailty.
For citation: Barsukov I.A., Demina A.A. Blood glucose self-monitoring in older adults: new approaches. Clinical review for general practice. 2024; 5 (9): 85–90 (In Russ.). DOI: 10.47407/kr2024.5.9.00485
Увеличение распространенности сахарного диабета 2-го типа (СД 2) среди населения является социально-значимой проблемой для систем здравоохранения во всем мире. По статистике около полумиллиарда человек в мире страдает СД, при этом 90% всех случаев приходится на СД 2 [1]. За последние 50 лет частота
СД 2 в старшей возрастной группе значительно увеличилась, и пожилые пациенты (старше 65 лет) составляют половину от всех случаев диагностированного заболевания [2, 3]. Важно, что у пациентов старшей возрастной группы отмечается более выраженная вариабельность физических и когнитивных возможностей, чем у молодых пациентов [3]. Более того, наличие сопутствующих заболеваний, увеличение риска развития гипогликемии, снижение способности к самообслуживанию и повышение риска падений являются дополнительными факторами, усложняющими контроль заболевания у данной категории больных [4]. Согласно прогнозам к 2045 г. распространенность СД 2 среди пациентов в возрасте старше 75 лет будет составлять порядка 24% [2].
Особенности развития и течения сахарного диабета в пожилом возрасте
Патогенез развития сахарного диабета 2-го типа у пожилыхОсновой патогенеза СД 2 является прогрессирующее снижение функции бета-клеток в сочетании с развитием инсулинорезистентности и иными нарушениями (в частности, гиперклюкагонемией и нарушением инкретинового ответа) [5]. Как правило, наличия одной лишь инсулинорезистентности недостаточно для развития СД 2, однако длительная гиперинсулинемия, развивающаяся на этом фоне, приводит к выпадению первой, а со временем и второй фазы инсулинового ответа на повышение глюкозы крови [5]. Старение также вносит свой вклад в патогенез СД 2 как напрямую за счет снижения функции бета-клеток и снижения секреции инсулина, так и косвенно за счет повышения инсулинорезистентности вследствие избыточной массы тела и других факторов риска [6, 7]. Так, с возрастом происходит накопление висцеральной жировой ткани (в печени, кардиальной и скелетно-мышечной ткани) с одновременным снижением мышечной массы и функциональных возможностей мышц (саркопения), которые могут в том числе усугубляться малоподвижным образом жизни [7–9]. Избыток висцеральной и эктопической жировой ткани, в свою очередь, снижает чувствительность клеток к инсулину путем увеличения синтеза адипокинов и цитокинов, влияющих на инсулиновые рецепторы (фактор некроза опухоли, С-реактивный белок и пр.), тем самым усугубляя инсулинорезистентность [10]. Схематически патогенетические взаимосвязи старения, ожирения и СД 2 у пожилых пациентов представлены на рис. 1.

Старческая астения
Старческая астения представляет собой симптомокомплекс, проявляющийся снижением физиологических резервов организма и нарушением ответа на стрессовые воздействия [11]. На сегодняшний день существует несколько фенотипических моделей, определяющих наличие синдрома:• модель, разработанная L. Fried и соавт. (фенотипическая), включающая в себя снижение массы тела, силы сжатия, скорости ходьбы, уменьшения уровня физической активности и повышенную утомляемость. Наличие хотя бы трех из перечисленных симптомов соответствует критериям астении [12];
• модель, разработанная K. Rockwood и A. Mitnitski (накопления дефицитов), которая представляет собой индекс старческой астении и определяет уровень зависимости индивидуума от медицинской помощи. Индекс рассчитывается на основании перечня из 70 (впоследствии сокращенного до 40) заболеваний и симптомов: чем ближе значение к единице, тем более выражена степень астении [13].
Определить точную распространенность старческой астении среди пациентов пожилого возраста не представляется возможным из-за отсутствия единого универсального метода оценки данного состояния. По данным имеющихся систематических обзоров и метаанализов, она варьирует от 10% до 71,6% среди пациентов старшей возрастной группы в зависимости от уровня жизни в стране [14] и места проведения оценки (условия стационара или пациенты, живущие вне дома престарелых) [15, 16].
Саркопения у пациентов с сахарным диабетом 2-го типа
Саркопения представляет собой прогрессирующую потерю мышечной массы и снижение силы мышц с возрастом [17], которые вносят существенный вклад в определение фенотипа старческой астении. Развитие данного состояния ассоциировано с повышенным риском падений, развитием гипогликемии, снижением способности к самообслуживанию и увеличением частоты госпитализаций и смертности [18]. Известно, что после 50 лет происходит снижение мышечной массы в среднем на 1–2%. Скорость потери увеличивается с возрастом и после 60 лет может достигать от 3% и выше ежегодно [3]. Примечательно, что у пациентов с СД 2 отмечается более выраженная потеря мышечной массы, чем у здоровых лиц [3] за счет нарушения процесса передачи сигнала от инсулина клеткам мышечной ткани и, как следствие, снижения синтеза белка и увеличения его распада [19]. В совокупности с гипергликемией, оксидативным стрессом и развитием поздних осложнений СД это существенно повышает риск развития старческой астении [3].Гипогликемия
Одной из значимых проблем при ведении пожилых пациентов с СД 2 является высокий риск развития гипогликемии. В ряде исследований было показано, что гипогликемия значительно увеличивает риск развития фатальных сердечно-сосудистых событий у пациентов старшей возрастной группы [20, 21]. Точную распространенность данного состояния среди пациентов старшей возрастной группы назвать затруднительно в связи с различиями в критериях определения гипогликемии в когортных исследованиях и применяемой сахароснижающей терапии. Согласно имеющимся данным частота легких гипогликемических состояний варьируется от 5 до 16 эпизодов на пациента в год, в то время как тяжелые гипогликемии встречаются с частотой от 0,10 до 0,44 эпизодов и наиболее часто встречаются у пациентов, получающих препараты сульфонилмочевины или инсулин [3].Физиологические изменения, происходящие в процессе старения организма, могут также снижать чувствительность к гипогликемиям и реакцию на нее. Так, было показано, что у пожилых пациентов частота распознавания гипогликемий была существенно ниже, а время восстановления дольше, чем у молодых пациентов. Примечательно, что симптомы гипогликемии у пожилых пациентов могут быть нетипичными и проявляться падением, транзиторной ишемической атакой, тошнотой и шаткостью походки, тем самым существенно затрудняя диагностику [22, 23].
Снижение когнитивных способностей
Неудовлетворительный контроль СД 2 является дополнительным фактором риска снижения когнитивных способностей и развития деменции (в том числе болезни Альцгеймера) у пожилых пациентов за счет инсулинорезистентности и развития микро- и макрососудистых осложнений. Так, в ходе 20-летнего наблюдательного исследования было установлено, что у пациентов с СД 2, развившимся в среднем возрасте, снижение когнитивных способностей было более выраженным, чем у людей без диабета [24], а уровень гликированного гемоглобина коррелировал с риском развития деменции: чем выше (хуже компенсация углеводного обмена) или ниже (частые гипогликемии) уровень HbA1c, тем выше риск [25].Цели лечения сахарного диабета 2-го типа у пожилых пациентов
Основной задачей лечения пожилых пациентов с СД 2 является достижение баланса между длительностью пребывания в гипергликемии и снижением частоты гипогликемий. Принимая во внимание разнообразие фенотипов среди пациентов старшей возрастной группы (а именно когнитивные особенности, сопутствующие заболевания и т.д.), целевые показатели гликемического контроля должны быть подобраны индивидуально с учетом всех факторов [5, 26]. Достижение адекватных показателей гликемии способствует снижению частоты развития и прогрессирования макро- и микрососудистых осложнений СД независимо от возраста пациента. Тем не менее попытки более строгого контроля глюкозы крови и интенсификации терапии у пожилых пациентов могут не иметь существенных преимуществ за счет повышенного риска развития гипогликемии в данной возрастной группе [5, 26].На сегодняшний день в Российской Федерации действует алгоритм индивидуализированного выбора терапевтической цели по уровню гликированного гемоглобина в зависимости от возраста пациента, наличия атеросклеротических сердечно-сосудистых заболеваний и/или риска тяжелой гипогликемии. Пациенты пожилого и старческого возраста условно могут быть поделены на несколько групп, в том числе на основании ряда критериев, характеризующих их функциональные возможности. Так, в случае относительно сохранного состояния пациента, отсутствия тяжелых сердечно-сосудистых заболеваний и старческой астении целевой показатель HbA1c должен составлять <7,5%. Напротив, пожилые пациенты, страдающие старческой астенией и/или деменцией, могут придерживаться менее строгих показателей гликемии, соответствующих целевому показателю HbA1c<8,5% (см. таблицу) [26].
Активное развитие современных технологий по контролю СД существенно расширило возможности современной медицины. Повышение доступности систем непрерывного мониторирования глюкозы и новых моделей глюкометров позволяет осуществлять дистанционный контроль за пожилым пациентом со стороны как родственников, так и врачей. Одной из таких моделей является глюкометр Контур Плюс Уан (Contour™ Plus One), который позволяет проводить дистанционный контроль состояния углеводного обмена при помощи приложения Контур Диабитис ( Contour Diabetes) и облачного хранилища Contour™ Cloud. Несомненно, важной особенностью глюкометра с позиции ведения пожилых пациентов является возможность настройки напоминаний о контроле глюкозы крови, а также функция «Умная подсветка» (Smartlight™), которая при помощи световых индикаторов мгновенно информирует об уровне нахождения глюкозы в пределах, выше или ниже целевого диапазона (рис. 2).


В дополнение к этому прибор обладает функцией «Второй шанс», которая позволяет в течение 60 с дополнительно нанести кровь на тест-полоску в том случае, когда первого образца оказалось недостаточно для анализа. Возможность дистанционного наблюдения и формирования отчетов в приложении Контур Диабитис родственниками для последующего их предоставления лечащему врачу особенно актуальна в случае снижения когнитивных способностей пожилого пациента с СД, так как позволяет облегчить процесс принятия клинических решений по коррекции терапии (рис. 3).
Заключение
Высокая распространенность СД 2 среди лиц пожилого возраста и значительная вариабельность сопутствующих заболеваний в данной когорте больных ставит перед практикующим врачом непростую задачу по сохранению баланса между достижением целевых показателей гликемического контроля и одновременным снижением риска развития гипогликемий. Доступность современных технологий в управлении СД позволяет осуществлять дополнительный контроль гликемии у таких больных со стороны родственников, что особенно важно в случае развития старческой астении и деменции. Как следствие, возможность принимать клинические решения на основе более полной информации позволяет существенно улучшить не только качество жизни пациентов, но и увеличить ожидаемую продолжительность жизни за счет снижения риска развития и прогрессирования макро- и микрососудистых осложнений СД.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Барсуков Илья Алексеевич – канд. мед. наук, доц., ст. науч. сотр. отд-ния терапевтической эндокринологии, ГБУЗ МО «МОНИКИ
им. М.Ф. Владимирского». E-mail: palantirr@inbox.ru;
ORCID: 0000-0002-1889-8555; Scopus Author ID: 57225446501;
eLibrary SPIN: 7946-8566
Ilya A. Barsukov – Cand. Sci. (Med.), Vladimirsky Moscow Regional Research Clinical Institute (MONIKI).
E-mail: palantirr@inbox.ru; ORCID: 0000-0002-1889-8555; Scopus Author ID: 57225446501; eLibrary SPIN: 7946-8566
Демина Анна Александровна – науч. сотр. отд-ния терапевтической эндокринологии, ГБУЗ МО «МОНИКИ
им. М.Ф. Владимирского». E-mail: annagalitskova@gmail.com;
ORCID: 0000-0002-7742-5782; Scopus Author ID: 58318134200; eLibrary SPIN: 2345-6369
Anna A. Demina – Res. Officer, Vladimirsky Moscow Regional Research Clinical Institute (MONIKI). E-mail: annagalitskova@gmail.com; ORCID: 0000-0002-7742-5782; Scopus Author ID: 58318134200; eLibrary SPIN: 2345-6369
Поступила в редакцию: 04.09.2024
Поступила после рецензирования: 13.09.2024
Принята к публикации: 19.09.2024
Received: 04.09.2024
Revised: 13.09.2024
Accepted: 19.09.2024
Список исп. литературыСкрыть список1. Khan MAB et al. Epidemiology of Type 2 Diabetes – Global Burden of Disease and Forecasted Trends. J Epidemiol Glob Health 2019;10(1):107. DOI: 10.2991/jegh.k.191028.001
2. Sun H et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res Clin Pract 2022;183:109119. DOI: 10.1016/j.diabres.2021.109119
3. Bellary S et al. Type 2 diabetes mellitus in older adults: clinical considerations and management. Nature Reviews Endocrinology. Nature Research 2021;17(9):534-48. DOI: 10.1038/s41574-021-00512-2
4. Bezerra CB et al. Characteristics of the clinical treatment of Brazilian and French older adults with diabetes. Diabetes Res Clin Pract 2021;181:109088. DOI: 10.1016/j.diabres.2021.109088
5. ElSayed NA et al. Older Adults: Standards of Care in Diabetes – 2023. Diabetes Care 2023;46(Supplement 1):S216-S229. DOI: 10.2337/dc23-S013
6. Li N et al. Aging and stress induced β cell senescence and its implication in diabetes development. Aging 2019;11(21):9947-59. DOI: 10.18632/aging.102432
7. Chia CW, Egan JM, Ferrucci L. Age-Related Changes in Glucose Metabolism, Hyperglycemia, and Cardiovascular Risk. Circ Res 2018;123(7):886-904. DOI: 10.1161/CIRCRESAHA.118.312806
8. Shou J, Chen P-J, Xiao W-H. Mechanism of increased risk of insulin resistance in aging skeletal muscle. Diabetol Metab Syndr 2020;12(1):14. DOI: 10.1186/s13098-020-0523-x
9. Al-Sofiani ME, Ganji SS, Kalyani RR. Body composition changes in diabetes and aging. J Diabetes Complications 2019;33(6):451-9. DOI: 10.1016/j.jdiacomp.2019.03.007
10. Mancuso P, Bouchard B. The Impact of Aging on Adipose Function and Adipokine Synthesis. Front Endocrinol (Lausanne) 2019;10. DOI: 10.3389/fendo.2019.00137
11. Hoogendijk EO et al. Frailty: implications for clinical practice and public health. The Lancet 2019;394(10206):1365-75. DOI: 10.1016/S0140-6736(19)31786-6
12. Fried LP et al. Frailty in Older Adults: Evidence for a Phenotype. J Gerontol a Biol Sci Med Sci 2001;56(3):M146-M157. DOI: 10.1093/ gerona/56.3.M146
13. Rockwood K, Mitnitski A. Frailty in Relation to the Accumulation of Deficits. J Gerontol a Biol Sci Med Sci 2007;62(7):722-7. DOI: 10.1093/gerona/62.7.722
14. Siriwardhana DD et al. Prevalence of frailty and prefrailty among community-dwelling older adults in low-income and middle-income countries: a systematic review and meta-analysis. BMJ Open 2018;8(3):e018195. DOI: 10.1136/bmjopen-2017-018195
15. Doody P et al. The prevalence of frailty and pre-frailty among geriatric hospital inpatients and its association with economic prosperity and healthcare expenditure: A systematic review and meta-analysis of 467,779 geriatric hospital inpatients. Ageing Res Rev 2022;80:101666. DOI: 10.1016/j.arr.2022.101666
16. He B et al. Prevalence and Risk Factors for Frailty Among Community-Dwelling Older People in China: A Systematic Review and Meta-Analysis. J Nutr Health Aging 2019;23(5):442-450. DOI: 10.1007/s12603-019-1179-9
17. Cruz-Jentoft AJ et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing 2019;48(4):601-1. DOI: 10.1093/ageing/afz046
18. Zhang X et al. Falls among older adults with sarcopenia dwelling in nursing home or community: A meta-analysis. Clinical Nutrition 2020;39(1):33-9. DOI: 10.1016/j.clnu.2019.01.002
19. Cleasby ME, Jamieson PM, Atherton PJ. Insulin resistance and sarcopenia: mechanistic links between common co-morbidities. Journal of Endocrinology 2016;229(2):R67–R81. DOI: 10.1530/JOE-15-
0533
20. Davis SN et al. Effects of Severe Hypoglycemia on Cardiovascular Outcomes and Death in the Veterans Affairs Diabetes Trial. Diabetes Care 2019;42(1):157-63. DOI: 10.2337/dc18-1144
21. Miller ME et al. Effects of Randomization to Intensive Glucose Control on Adverse Events, Cardiovascular Disease, and Mortality in Older Versus Younger Adults in the ACCORD Trial. Diabetes Care 2014;37(3):634-43. DOI: 10.2337/dc13-1545
22. Hope SV et al. Are we missing hypoglycaemia? Elderly patients with insulin-treated diabetes present to primary care frequently with non-specific symptoms associated with hypoglycaemia. Prim Care Diabetes 2018;12(2):139-46. DOI: 10.1016/j.pcd.2017.08.004
23. Lee AK et al. Severe Hypoglycemia and Risk of Falls in Type 2 Diabetes: The Atherosclerosis Risk in Communities (ARIC) Study. Diabetes Care 2020;43(9):2060-5. DOI: 10.2337/dc20-0316
24. Rawlings AM et al. Diabetes in Midlife and Cognitive Change Over 20 Years. Ann Intern Med 2014;161(11):785. DOI: 10.7326/M14-0737
25. Janssen J et al. HbA1c, Insulin Resistance, and β-Cell Function in Relation to Cognitive Function in Type 2 Diabetes: The CAROLINA Cognition Substudy. Diabetes Care 2019;42(1):e1–e3. DOI: 10.2337/dc18-0914
26. Дедов И.И. и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Под ред. И.И. Дедова,
М.В. Шестаковой, А.Ю. Майорова. 11-й выпуск. Сахарный диабет. 2023;26(2S):1-157. DOI: 10.14341/DM13042
Dedov I. et al. Standards of Specialized Diabetes Care. Edited by I.I. Dedov, M.V. Shestakova, A.Yu. Mayorov. 11th Edition. Diabetes mellitus. 2023;26(2S):1-157 (in Russian).