Клинический разбор в общей медицине №10 2024
Клинический разбор в общей медицине №10 2024
Выбор режима дозирования современных β-адреноблокаторов в разных клинических ситуациях (на примере метопролола сукцината)
Номера страниц в выпуске:52-63
Аннотация
В настоящее время β-адреноблокаторы (β-АБ) являются одними из самых назначаемых лекарственных средств в терапии и кардиологии, поскольку имеют широкий спектр показаний к применению и большую доказательную базу. Одним из современных представителей липофильных β1-кардиоселективных адреноблокаторов, лишенных внутренней активности, является метопролола сукцинат (Беталок ЗОК), доступный в форме контролируемого замедленного высвобождения (CR/XL). С точки зрения доказательной медицины метопролола сукцинат CR/XL можно считать универсальным средством при ряде сердечно-сосудистых и прочих заболеваний (например, мигрень и тиреотоксикоз), к тому же из всех β-АБ он имеет самый полный спектр показаний. Однако зачастую на протяжении всего лечения данный препарат используется не совсем в оптимальных дозах. Цель этой статьи – привлечь внимание врачей к несправедливому и необоснованному занижению дозы β-АБ при ряде клинических состояний, которые одновременно являются их показаниями и клинико-фармакологическими нишами для использования.
Ключевые слова: бета-адреноблокаторы, режим дозирования, показания, коморбидность, метопролола сукцинат.
Для цитирования: Скотников А.С., Закиев В.Д., Гвоздева А.Д., Лазарева В.В. Выбор режима дозирования современных β-адреноблокаторов в разных клинических ситуациях (на примере метопролола сукцината). Клинический разбор в общей медицине. 2024; 5 (10): 52–63. DOI: 10.47407/kr2024.5.10.00496
В настоящее время β-адреноблокаторы (β-АБ) являются одними из самых назначаемых лекарственных средств в терапии и кардиологии, поскольку имеют широкий спектр показаний к применению и большую доказательную базу. Одним из современных представителей липофильных β1-кардиоселективных адреноблокаторов, лишенных внутренней активности, является метопролола сукцинат (Беталок ЗОК), доступный в форме контролируемого замедленного высвобождения (CR/XL). С точки зрения доказательной медицины метопролола сукцинат CR/XL можно считать универсальным средством при ряде сердечно-сосудистых и прочих заболеваний (например, мигрень и тиреотоксикоз), к тому же из всех β-АБ он имеет самый полный спектр показаний. Однако зачастую на протяжении всего лечения данный препарат используется не совсем в оптимальных дозах. Цель этой статьи – привлечь внимание врачей к несправедливому и необоснованному занижению дозы β-АБ при ряде клинических состояний, которые одновременно являются их показаниями и клинико-фармакологическими нишами для использования.
Ключевые слова: бета-адреноблокаторы, режим дозирования, показания, коморбидность, метопролола сукцинат.
Для цитирования: Скотников А.С., Закиев В.Д., Гвоздева А.Д., Лазарева В.В. Выбор режима дозирования современных β-адреноблокаторов в разных клинических ситуациях (на примере метопролола сукцината). Клинический разбор в общей медицине. 2024; 5 (10): 52–63. DOI: 10.47407/kr2024.5.10.00496
Review
1 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
2 Russian Gerontological Scientific and Clinical Center – branch of Pirogov Russian National Research Medical University, Moscow, Russia;
3 Davydovsky City Clinical Hospital, Moscow, Russia;
4 Russian State Social University, Moscow, Russia
skotnikov_a_s@staff.sechenov.ru
Abstract
Beta-blockers are currently one of the most prescribed drugs in various acute and chronic conditions due to wide range of indications and a large evidence base. Metoprolol succinate (Betaloc ZOK) is one of modern lipophilic β1-selective blocker without intrinsic sympathomimetic activity and available in controlled slow release (CR/XL) form. Metoprolol succinate CR/XL can be considered an essential treatment of a wide range of cardiovascular and other diseases (for example, migraine and thyrotoxicosis). However, this drug is often used in not optimal doses. The purpose of this article is to draw the attention of physicians to the unjustified underestimation of β-AB doses in a number of clinical conditions.
Keywords: beta-blockers, target doses, indications, comorbidity, metoprolol succinate.
For citation: Skotnikov A.S., Zakiev V.D., Gvozdeva A.D., Lazareva V.V. The choice of dosage regimen of modern beta-blockers in different clinical situations (using the example of metoprolol succinate). Clinical review for general practice. 2024; 5 (10): 52–63 (In Russ.). DOI: 10.47407/kr2024.5.10.00496
Так, блокада β1-рецепторов приводит к отрицательному инотропному (сила), отрицательному хронотропному (частота), отрицательному дромотропному (проводимость) и отрицательному батмотропному (возбудимость) действию в сердце и снижению секреции ренина и ангиотензина (АТ) II вследствие блокады β1-рецепторов в клетках юкстагломеруллярного аппарата (ЮГА) в почках. Медикаментозная блокада β2-рецепторов способствует повышению тонуса гладкой мускулатуры бронхов, усилению моторики желудочно-кишечного тракта (ЖКТ) (спастические боли в животе, рвота, поносы) и сократительной активности матки, а также активации синтеза гликогена и торможению гликогенолиза и гликонеогенеза (что может привести к гипогликемии, особенно на фоне приема гипогликемических средств у больных сахарным диабетом 2-го типа), а также повышению тонуса периферических сосудов, повышению общего периферического сосудистого сопротивления (ОПСС), ухудшению периферического кровообращения, повышенной утомляемости и мышечной слабости – здесь рождается ложное суждение, что все (!) β-АБ опасны для сосудов ног, если у пациента есть диагноз периферического атеросклероза (даже не облитерирующего). Однако при коморбидности не все так однозначно, и способность пропранолола приводить к сужению, в частности, сосудов пищевода нашла отражение в профилактике кровотечений из варикозно-расширенных вен пищевода у пациентов с портальной гипертензией. Наконец, блокада β3-рецепторов тормозит липолиз в жировой ткани и влияет на повышение содержания в крови атерогенных фракций холестерина – отсюда миф про усугубление инсулинорезистентности, увеличение риска развития СД 2-го типа и прогрессирование атерогенной дислипидемии на фоне приема любого (!) β-АБ.
Таким образом, очевидно, что наибольшую востребованность во врачебной среде приобрели современные кардиоселективные β1-АБ метопролол, небиволол, бисопролол и карведилол (не влияет на β2-рецепторы, хоть и не относится к селективным β-АБ). Критериями выбора и сравнения селективных β-АБ являются способность к достижению целевой ЧСС в терапевтических дозах, стабильный контроль ЧСС 24 ч при приеме один раз в сутки, положительное влияние на микроциркуляцию, метаболическая нейтральность и высокий профиль безопасности. При этом часто забывается, что большинство побочных эффектов и неудобств – прерогатива исключительно неселективных β-АБ, которая, однако, транслируется на весь класс β-АБ, что привело к страхам и осторожности врачей перед их назначением у сохранных молодых или, наоборот, у пожилых и ослабленных коморбидных больных, а особенно в дозах выше средних.
Кроме классификации β-АБ по селективности в фармакологии принято их разделять на препараты с внутренней активностью (симпатомиметической) (ВСА) (окспренолол, пиндолол, ацебуталол, целипролол, буциндалол, лабеталол) и без нее. Препараты без ВСА, в свою очередь, делят на гидрофильные (атенолол, надолол, соталол), липофильные (пропранолол, эсмолол, бетаксолол, метопролол, карведилол, небиволол) и амфифильные (гидролипофильные), способные к растворению как в воде, так и в жирах (бисопролол). Напомним, что ВСА проявляется в виде частичного обратного действия, т.е. стимуляции ряда β-адренорецепторов, что приводит к ослаблению основных эффектов β-АБ, а самое главное – к повышению потребления миокардом кислорода. Очевидно, что если препарат обладает ВСА, то его использование пациентом с ишемической болезнью сердца (ИБС), хронической сердечной недостаточностью (ХСН) или после инфаркта миокарда (ИМ) с высокой вероятностью принесет ему дополнительные проблемы [2].
Одним из современных представителей липофильных β1-кардиоселективных адреноблокаторов, лишенных внутренней активности, является метопролола сукцинат (Беталок ЗОК), доступный в форме контролируемого замедленного высвобождения (CR/XL). Каждая таблетка данного препарата содержит множество гранул метопролола сукцината, покрытых собственной оболочкой и представляющих собой собственную единицу доставки ЛС. А в исследованиях in vitro и in vivo на здоровых добровольцах показано, что данная передовая технология обеспечивает непрерывность высвобождения метопролола из плазменного депо в течение дня, что приводит к равномерной концентрации препарата в плазме крови без пиков и спадов. Высвобождение препарата не зависит от pH в ЖКТ и приема пищи, а плазменное депо не требует депонирования препарата в тканях, включая жировую [3].
С точки зрения доказательной медицины метопролола сукцинат CR/XL можно считать универсальным средством при ряде сердечно-сосудистых (СС) и прочих заболеваний (например, мигрень и тиреотоксикоз), к тому же из всех β-АБ он имеет самый полный спектр показаний. Однако зачастую на протяжении всего лечения данный препарат используется не совсем в оптимальных дозах (25 или 50 мг) [4–7]. Более того, мы видим, что при необходимости увеличивать дозу метопролола сукцината более 50 мг врачи вместо этого по необъяснимым, а не по объективным причинам переводят пациентов на другие β-АБ. Возможно, что недодозирование β-АБ в целом и метопролола сукцината в частности в реальной клинической практике связано с незнанием эквивалентных доз этих препаратов или с трудностями определения целевых значений ЧСС при том или ином заболевании.
Также складывается впечатление, что дозы метопролола сукцината от 75 до 200 мг элементарно отпугивают клиницистов и пациентов своей величиной, в то время как дозы Беталока ЗОК и других β-АБ от 6,25 до 50 мг субъективно воспринимаются врачами и их пациентами более комфортно и безопасно.
Цель написания этой статьи заключается в привлечении внимания врачей к несправедливому и необоснованному занижению дозы β-АБ при ряде клинических состояний, которые одновременно являются их показаниями и клинико-фармакологическими нишами для использования. В данном обзоре мы постарались рассмотреть выбор режима дозирования β-АБ на примере метопролола сукцината с позиций имеющихся доказательств и ответить на вопрос – оправданы ли ранее перечисленные опасения?
Показание 1. Гипертония (ESC, 2024). Режим дозирования 50–200 мг
Применение β-АБ у пациентов с артериальной гипертензией (АГ) приводит к снижению активности ренина, АТ II и альдостерона в плазме крови в результате блокады β₁-адренорецепторов ЮГА, а также к уменьшению ЧСС, силы сердечных сокращений и в конечном счете уровня артериального давления (АД) [8]. В актуальных российских и европейских клинических рекомендациях по лечению АГ от 2018 г. класс β-АБ входит в состав пяти основных групп антигипертензивных препаратов, рекомендуемых к применению наряду с ингибиторами ангиотензин-превращающего фермента (иАПФ), блокаторами рецепторов ангиотензина (БРА), блокаторами кальциевых каналов (БКК) и тиазидными/тиазидоподобными диуретиками (I, А), при этом β-АБ рассматриваются как препараты выбора у коморбидных пациентов, имеющих ИБС, ХСН или нарушения ритма сердца [9, 10]. В рекомендациях Европейского общества по гипертонии от 2023 г. допускается использование β-АБ как в монотерапии, так и в составе комбинированной антигипертензивной терапии при наличии других показаний к ним (стенокардии, ИМ в анамнезе, ХСН, нарушения ритма, АГ у беременных или планирующих беременность), обращается внимание и на другие состояния, когда β-АБ могут быть полезны (ЧСС>80 в минуту, тревожные состояния, мигрень, эссенциальный тремор и др.) [11]. В рекомендациях Европейского общества кардиологов от 2024 г. в целом позиция экспертов в отношении β-АБ не изменилась: они могут быть добавлены к терапии на любом шаге при наличии у пациента других показаний [12].
В некоторых клинических исследованиях отмечено преимущество метопролола над другими классами препаратов у пациентов с АГ. Например, в исследовании MAPHY изучали метопролол (средняя доза 176 мг/сут) по сравнению тиазидными диуретиками (гидрохлоротиазид в средней дозе 46 мг, бендрофлутиазид в средней дозе 4,4 мг) у мужчин в возрасте 40–64 лет с АГ в целях первичной профилактики. Несмотря на то что и в двух группах АД уменьшилось с 167/108 до 143/89 мм рт. ст. на последнем визите, в группе метопролола снижение диастолического АД было чуть более выраженное, но статистически значимое, при этом в группе метопролола отмечалось снижение СС смерти (р=0,012), фатального ИМ и внезапной сердечной смерти (р=0,048), фатального инсульта (р=0,043) [13].
В исследовании FISH, где метопролол сравнивали с исрадипином, отмечалось более значимое снижение среднего АД через 8 недель лечения: в группе метопролола АД снижалось на 15/12 мм рт. ст. (с 160/103 до 145/91 мм рт. ст.), в группе исрадипина 13/11 мм рт. ст. (с 161/104 до 148/93 мм рт. ст.). На монотерапии исрадипином в средней суточной дозе 4,26 мг диастолическое АД достигало целевого ≤90 мм рт. ст. у 52% пациентов, в то время как в группе монотерапии в средней суточной дозе 155 мг – у 58% пациентов [14]. Следует обратить внимание, что эффект метопролола обеспечивался на больших дозах, при этом есть мнение, что в исследованиях, где β-АБ уступили другим классам препаратов. Такой результат обусловлен использованием неоптимального режима дозирования β-АБ [15].
Таким образом, несмотря на то, что β-АБ не относятся к препаратам первой линии лечения АГ, метопролол сукцинат XR/CR может использоваться у пациентов с АГ и с другими показаниями к β-АБ как в моно-, так и в комбинированной терапии, однако стоит стремиться к максимально рекомендуемой дозе (200 мг) при условии хорошей переносимости.
Показание 2. Хронический коронарный синдром (ESC, 2019). Режим дозирования 100–200 мг
Существует два основных механизма антиангинальной терапии при стабильной ИБС: снижение потребности миокарда в кислороде (β-АБ уменьшают сократимость миокарда и ЧСС [16]) и увеличение доставки кислорода к миокарду путем усиления его артериального кровоснабжения.
Главная цель лечения стенокардии – максимально облегчить ее симптомы, уменьшить количество приступов и увеличить толерантность к физической нагрузке. При этом необходимо выбрать ЛС, которые не ухудшают течение сопутствующих заболеваний, не имеют значимых взаимодействий с другими используемыми ЛС и хорошо переносятся пациентом. В определенных ситуациях может быть более рационален выбор одного лекарственного агента вместо другого (например, β-АБ у пациента с сопутствующей дисфункцией ЛЖ) [16].
В различных клинических рекомендациях β-АБ рассматриваются как ЛС первой линии симптоматического лечения пациентов со стабильной ИБС [16–18].
В ранних исследованиях показано, что β-АБ и метопролол, в частности, увеличивали долю пациентов, свободных от стенокардии напряжения, уменьшали количество приступов стенокардии и потребление нитроглицерина [19–24]. По итога метаанализа 72 исследований, сравнивающих β-АБ с БКК, выявлены меньшее количество эпизодов стенокардии в неделю при приеме β-АБ и более низкие показатели отмены препарата [25]. Следует отметить, что в этих исследованиях использовали достаточно большие дозы метопролола (100–400 мг/сут) [19, 22–24], а его средняя стартовая доза составила 177 мг/сут. [25]. В недавно опубликованных клинических рекомендациях по ведению пациентов с хроническим коронарным синдромом Европейского общества кардиологов подчеркнуто, что крупных РКИ, напрямую сравнивающих β-АБ или БКК с более новыми противоишемическими препаратами (ивабрадином, никорандилом, ранолазином, триметазидином), не было. Последние оценивали в сравнении с β-АБ или БКК в небольших исследованиях типа non-inferiority («не хуже») или в более крупных исследованиях в качестве дополнительной терапии с β-АБ или БКК. В связи с этим на 2024 г. β-АБ остаются ангинальной терапией первой линии, несмотря на продолжительную историю использования и появление новых ЛС [26].
Несмотря на то что антиангинальный эффект β-АБ связан непосредственно с ЧСС, однозначного целевого значения ЧСС при стабильной ИБС нет. В актуальных российских и европейских клинических рекомендациях по лечению и диагностике пациентов со стабильной ИБС предлагается достигать у пациентов со стенокардией ЧСС 55–60 уд/мин [17, 18]. Однако в Американских клинических рекомендациях целевое значение ЧСС не оговаривается [16]. При этом некоторые специалисты полагают, что многие пациенты хорошо переносят ЧСС в покое ниже 50 уд/мин, поэтому возможно использование β-АБ и при более низких значениях ЧСС [27].
По данным регистра The Coronary Artery Surgery Study (CASS), в который включали пациентов, проходивших коронароангиографию при подозрении на наличие или при наличии подтвержденной ИБС, исходная ЧСС в покое ≥77 уд/мин была ассоциирована со значимым увеличением риска общей и СС смерти по сравнению с ЧСС ≤62 уд/мин. При этом ЧСС в диапазоне 63–70 и 71–76 уд/мин значимо на риск этих точек не влияла, в то же время пациенты с более частой ЧСС в покое чаще имели дислипидемию, АГ, СД, чаще курили [28]. Однако в недавнем исследовании с участием 19 102 пациентов со стабильной ИБС без ХСН, получавших стандартную антиангинальную терапию и имевших ЧСС ≥70 уд/мин, ивабрадин не снижал риск первичной конечной точки (ПКТ), состоящей из СС смерти или ИМ. При этом у пациентов со стенокардией, ограничивающей активность, в группе приема ивабрадина, несмотря на улучшение функционального класса (ФК), отмечалось увеличение частоты ПКТ. Вероятно, это связано с тем, что в группе ивабрадина в 10 раз чаще наблюдалась брадикардия, в том числе и симптомная [29]. Результаты данного исследования не позволяют однозначно судить, что наносит вред: более низкие целевые значения ЧСС или сам ивабрадин. Однако, например, в Американских рекомендациях добавление ивабрадина к стандартной антиангинальной терапии у пациентов с нормальной систолической функцией ЛЖ не рекомендуется [16].
Следует отметить, что ивабрадин добавляли к стандартной терапии, которая включала в том числе β-АБ, при этом не известно, какие были бы результаты, если бы пациенты достигали более низких значений ЧСС на фоне приема β-АБ.
Несмотря на выраженный антиангинальный эффект и широкое применение в клинической практике, убедительных данных, что β-АБ при стабильной ИБС без предшествующего ИМ и систолической дисфункции способствуют улучшению прогноза, нет. В регистре REACH с участием более 24 тыс. пациентов β-АБ не снижали риск ПКТ, состоящей из СС смерти, нефатального ИМ и нефатального инсульта, вторичных и третичных точек у пациентов как со стабильной ИБС без перенесенного ИМ в анамнезе, так и у пациентов с перенесенным ИМ и у пациентов с факторами риска, но без ИБС [30]. По данным ретроспективного регистра NCDR с участием 755 215 пациентов в возрасте ≥ 65 лет и стабильной ИБС без ИМ или ХСН с низкой фракцией выброса левого желудочка (ФВ ЛЖ), которым было выполнено чрескожное коронарное вмешательство (ЧКВ), использование β-АБ при выписке из стационара не было связано со снижением СС заболеваемости или смертности в течение 30 дней и в течение 3 лет наблюдения [31]. Подобные результаты также были получены в post-hoc анализе исследования CHARISMA (Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management and Avoidance), в котором также не отмечалось уменьшение частоты СС событий у пациентов без ИМ в анамнезе и ХСН, принимавших β-АБ [32]. Однако у пациентов после аортокоронарного шунтирования как с предшествующим ИМ, так и без него β-АБ были связаны с более низким риском долгосрочной смертности и неблагоприятных СС событий [33].
Таким образом, данных, однозначно поддерживающих мнение, что более низкое значение ЧСС приносит пользу пациенту, пока нет, требуются дополнительные специально спланированные исследования для определения целевого значения ЧСС у пациентов со стабильной ИБС. Однако, учитывая тот факт, что главная цель β-АБ – симптоматическое лечение стенокардии, следует достигать тех значений ЧСС, при которых у пациента не будет симптомов, т.е. будет достигнута клиническая цель лечения, и при этом терапия хорошо переносится. Чаще всего достичь клинической цели удается именно на больших дозировках β-АБ, например метопролол сукцинат эффективнее в дозировке 200 мг, нежели 100 или 50 мг при сопоставимой безопасности [34, 35], при этом метопролол сукцинат обладает более выраженным клиническим эффектом по сравнению с метопрололом тартратом [36, 37]. В то же время убедительных данных о влиянии β-АБ на прогноз у пациентов со стабильной ИБС нет, однако не вызывает сомнения польза β-АБ при наличии систолической дисфункции, при этом рекомендуется использовать β-АБ с доказанной эффективностью, в частности метопролол сукцинат в максимально переносимой или целевой дозе 200 мг в сутки [16].
Показание 3. Первый год после инфаркта миокарда. Режим дозирования 200 мг
β-АБ в течение длительного времени используют в клинической практике для лечения пациентов с ИМ,
в том числе и в острый период, однако данные по их эффективности противоречивы. В опубликованном в 1999 г. метаанализе ранних клинических исследований, выполненных по большей части в 70-е и 80-е годы XX в., показано, что короткое лечение β-АБ, в том числе и внутривенное их введение с последующим переходом на пероральную форму, в острый период ИМ улучшает прогноз таких пациентов, однако длительное применение β-АБ, в том числе и метопролола по отдельности, приводило к снижению смертности [38]. Однако почти все исследования, включенные в метаанализ, подвергаются критике [39], так как были выполнены до широкого применения реваскуляризации миокарда и без использования другой терапии, эффективной во вторичной профилактике ИМ (статины, иАПФ и даже дезагреганты). Отдельно следует отметить, что в этих исследованиях также не учитывали систолическую функцию у включенных пациентов, соответственно, β-АБ могли быть им полезны.
В более свежем метаанализе (2014), включившем в том числе и современные исследования, было показано, что β-АБ оказывают положительное влияние в отношении смертности в дореперфузионную эру, в то время как в реперфузионную эру (исследование относилось к реперфузинной эре, если более половины включенных пациентов получали тромболитическую терапию или были реваскуляризированы и/или получали аспирин и статин) β-АБ не снижали смертность, но уменьшали частоту повторного ИМ и стенокардии ценой увеличения частоты случаев СН и кардиогенного шока [40].
Краткосрочные эффекты β-АБ у пациентов с острым ИМ, подвергнутых ЧКВ, изучали в исследовании METOCARD-CNIC, в котором 270 пациентов были рандомизированы группу в/в метопролола и группу контроля в течение 6 ч с момента появления симптомов, при этом метопролол вводили до проведения ЧКВ.
В результате этого исследования внутривенное введение метопролола во время продолжающегося переднего ИМ с подъемом сегмента ST уменьшало размер инфаркта [41], микрососудистую обструкцию и реперфузионное повреждение [42], а также улучшало ФВ ЛЖ [43]. В исследовании EARLY-BAMI, в котором метопролол вводили в течение 12 ч с момента появления симптомов, не подтверждены кардиопротективные эффекты раннего назначения метопролола у пациентов с острым ИМ, перенесших первичную ангиопластику [44].
Расхождение между двумя исследованиями, по-видимому, обусловлено временем введения метопролола (гораздо раньше в METOCARD-CNIC), при этом чем раньше вводили метопролол в ходе инфаркта, тем меньше была зона инфаркта и выше ФВ ЛЖ [45]. В метаанализе 4 исследований с суммарным участием 1150 пациентов было показано некоторое увеличение ФВ ЛЖ через 6 мес. после острого ИМ в группе инфузии β-АБ (52,8% против 50,0% в контрольной группе; p=0,03), но не было отмечено влияния на размер инфаркта и на комбинированную точку из смерти или ИМ в течение 12 мес [46]. Эти данные позволили экспертам в Европейских клинических рекомендациях по ведению пациентов с острым коронарным синдромом (ОКС) от 2023 г. рекомендовать рассмотреть использование в/в β-АБ (предпочтительно метопролола) у пациентов, проходящих первичное ЧКВ без признаков острой СН, систолическим АД>120 мм рт. ст. и без других противопоказаний (IIa, A) [47].
Польза от длительного применения β-АБ у пациентов с ИМ и низкой ФВ не вызывает сомнения. Это основывается на исследовании CAPRICORN, в котором карведилол снижал смертность у пациентов с острым ИМ и ФВ ЛЖ<40% (средний период наблюдения 1,3 года) [48]. В дополнении к этому β-АБ снижали смертность в исследованиях с участием пациентов с ХСН с низкой ФВ, в том числе с перенесенным ранее ИМ как причиной ХСН, в частности в исследовании MERIT-HF с метопрололом сукцинатом CR/XL [49], о котором подробнее говорится далее.
Однако эффективность длительного применения β-АБ в современных условиях у пациентов с ИМ и сохраненной ФВ и выполненным ЧКВ остается дискутабельной. В японском исследовании CAPITAL-RCT с участием 801 пациента [50] оценивали долгосрочную эффективность β-АБ у пациентов после ИМ с подъемом сегмента ST с успешной ЧКВ и ФВ ЛЖ ≥ 40%. В результате этого исследования не было продемонстрировано положительное влияние карведилола на ПКТ, состоящую из смерти от всех причин, ИМ, госпитализаций из-за СН или ОКС, медиана наблюдения 3,9 года. Однако исследование не имело достаточной мощности для выявления значимой разницы ПКТ, что было связано с медленным набором пациентов.
В недавно опубликованном крупном открытом РКИ REDUCE-AMI, основанном на регистре, с участием 5020 пациентов с ИМ и ФВ ЛЖ>50%, где все пациенты были реваскуляризированы, β-АБ (метопролол в медианной дозе 100 мг/сут и бисопролол 5 мг/сут) не показали эффективность в отношении как ПКТ, состоящей из смерти от всех причин и ИМ, так и вторичных конечных точек (смерть от всех причин, СС смерть, ИМ, госпитализация по поводу фибрилляции предсердий, госпитализации по поводу СН), медиана наблюдения 3,5 года [51]. Однако это исследование подвергается критике [52]. Во-первых, частота развития ПКТ была существенно ниже, чем предполагали исследователи. Это отражает тот факт, что пациенты имели нормальную систолическую функцию, были реваскуляризированы и им была оказана качественная медицинская помощь, что не всегда бывает в реальной клинического практике. Поэтому результаты данного исследования не следует применять к пациентам с более высоким риском, например со сниженной систолической функцией ЛЖ (ФВ ЛЖ<50%) или пациентам, кому не выполнена реваскуляризация миокарда. Во-вторых, средние дозы β-АБ в исследовании были ниже, чем в первоначальных исследованиях с участием β-АБ после ИМ, что могло способствовать уменьшению различий между исследуемыми группами. Поскольку доверительный интервал влияния β-АБ на ПКТ включает снижение риска на 21% (близкий к тому, который наблюдался в более старых исследованиях, в которых изначально была показана терапия β-АБ после ИМ), нельзя исключить фактическую пользу β-АБ.
Помимо этого, в исследовании не предоставлена информация о профилактике желудочковых тахиаритмий и внезапной сердечной смерти (ВСС), что является важным потенциальным преимуществом β-АБ в этом контексте. В публикации этого исследования также нет подробной информации о соблюдении назначенного режима лечения после первого года лечения, при этом через 1 год среди пациентов, по которым имеются данные, около 18% пациентов, кому была назначена терапия β-АБ, прекратили их прием в то время, как около 14% пациентов в группе без β-АБ, начали лечение β-АБ. Это указывает на проблему перекрестного лечения в исследовании, что также могло повлиять на результаты.
На недавно прошедшем конгрессе Европейского общества кардиологов 2024 г. были представлены результаты исследования ABYSS, в котором отмена β-АБ у пациентов с перенесенным ИМ в анамнезе, ФВ ≥40% и не имевших в течение 6 мес СС событий не была «не хуже» (non-inferior) продолжения терапии в отношении ПКТ, состоящей из смерти, нефатального ИМ, нефатального инсульта и госпитализаций по СС причинам. Однако необходимо отметить, что исследование имело ряд ограничений [53]. Во-первых, почти четверть пациентов в группе отмены β-АБ имели сниженную ФВ ЛЖ (40–50%). О том, что β-АБ могут быть полезны в этой группе пациентов, свидетельствуют ряд публикаций [54, 55]. Кроме этого, увеличение частоты ПКТ в группе отмены β-АБ было в первую очередь за счет количества госпитализаций, которые в основном были обусловлены госпитализациями для проведения коронарографии и/или реваскуляризации. При этом в группе отмены β-АБ полная реваскуляризация была выполнена только 87,6% и у 1,1% пациентов была резидуальная стенокардия, что говорит о наличии субстрата для возобновления стенокардии при отмене
β-АБ и, соответственно, увеличения госпитализаций, при этом существенных различий в других компонента ПКТ не было.
Таким образом, пока нет убедительных доказательств в пользу назначения β-АБ у пациентов после ИМ и сохраненной ФВ ЛЖ, как и нет доказательств отмены β-АБ у пациентов, кому такая терапия была назначена ранее. В настоящее время проводится ряд исследований, призванных расставить все точки над «и» в вопросе длительного применения β-АБ (таблица).
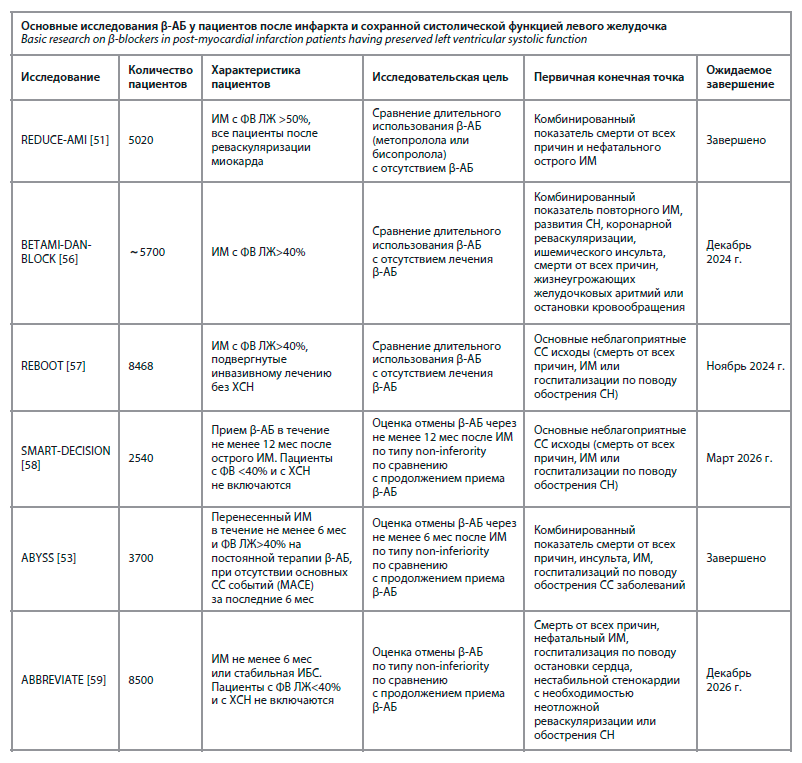
Некоторые из них оценивают эффективность длительного приема β-АБ по сравнению с отсутствием лечения [56, 57], когда другие оценивают отмену приема
β-АБ спустя 6–12 мес после перенесенного ИМ у пациентов, принимающих β-АБ как минимум в течение этого времени [58, 59].
В Европейских клинических рекомендациях по ведению пациентов с ОКС от 2023 г. β-АБ рекомендуют всем пациентам с ОКС и ФВ≤40% независимо от симптомов (I, A), при этом рекомендуется рассмотреть их использование у всех пациентов независимо от ФВ ЛЖ, в том числе и с сохранной ФВ ЛЖ (IIa, B) [47]. Согласно американским клиническим рекомендациям по лечению пациентов со стабильной ИБС, пациентам, которым была начата терапия β-АБ по поводу перенесенного ИМ без снижения ФВ ЛЖ≤50% в анамнезе или на данный момент, стенокардии, аритмии или неконтролируемой гипертонии, может быть целесообразно пересмотреть показания к длительному
(>1 года) использованию терапии β-АБ, которые были назначены с целью вторичной профилактики СС событий (IIa, B) [16].
Таким образом, имеющиеся данные скорее не поддерживают длительный прием β-АБ после перенесенного ИМ у пациентов, подвергнутых реваскуляризации миокарда и имеющих сохраненную систолическую функцию ЛЖ. Однако они могут быть полезны у пациентов, которым выполнить реваскуляризацию миокарда невозможно по тем или иным причинам, в том числе и тем, кому выполнена тромболитическая терапия. На наш взгляд, у пациентов с ИМ и сниженной систолической функцией ЛЖ подбор дозы метопролола сукцината должен осуществляться аналогично пациентам с ХСН и низкой ФВ ЛЖ. Внутривенное введение метопролола перед ЧКВ может положительно влиять на ФВ ЛЖ, однако следует учитывать риск побочных эффектов.
Показание 4. Хроническая сердечная недостаточность. Режим дозирования 12,5–200 мг (титрация)
Метопролол сукцинат CR/XL является одним из β-АБ, рекомендованных для лечения хронической сердечной недостаточности (ХСН) с низкой фракцией выброса (ФВ) левого желудочка (ЛЖ) различными актуальными клиническими рекомендациями по лечению и диагностике пациентов с СН [60–63]. Это базируется в первую очередь на данных исследования MERIT-HF с участием 3991 пациента с ХСН II–IV ФК по классификации NYHA и ФВ ЛЖ <40% и средней продолжительностью наблюдения 1 год. По результатам этого исследования метопролол сукцинат CR/XL по сравнению с плацебо снижал риск общей смерти (относительный риск (ОР) = 0,66, 95% ДИ 0,53–0,81; p=0,00009), СС смерти (ОР=0,62, 95% ДИ 0,50–0,78; p=0,00003), внезапной смерти (ОР=0,59, 95% ДИ 0,45–0,78; p=0,0002), а также риск смерти из-за ухудшения СН (ОР=0,51, 95% ДИ 0,33–0,79; p=0,0023).
Начальная доза метопролола сукцината в исследовании составляла 12,5 мг или 25 мг один раз в день (половина таблетки 25 мг была рекомендована пациентам с III–IV ФК по классификации NYHA). При хорошей переносимости доза удваивалась каждые 2 недели до достижения целевой дозы 200 мг один раз в день. Режим дозирования мог быть изменен в соответствии с решением исследователя. Средняя суточная доза метопролола в конце исследования составила 159 мг один раз в день, при этом 87% пациентов получали 100 мг или более, а 64% получали целевую дозу 200 мг один раз в день. В группе плацебо соответствующие значения составили 179 мг, 91% и 82% соответственно [49].
Таким образом, данные исследования MERIT-HF поддерживают постепенную титрацию дозы β-АБ до максимально переносимой. Следует отметить, что результаты исследования были получены в основном на больших дозах метопролола сукцината (100–200 мг), в связи с чем в реальной практике необходимо стремиться к достижению максимально переносимой дозы для достижения максимального влияния на прогноз.
Частота сердечных сокращений (ЧСС) независимо от других факторов предсказывает исходы пациентов с ХСН и низкой ФВ ЛЖ. В метаанализе 23 исследований с участием β-АБ показано, что снижение ЧСС при синусовом ритме напрямую связано с улучшением исходов ХСН [64]. В настоящее время клинические рекомендации поддерживают дополнительное назначение ивабрадина к максимально переносимой дозе β-АБ при ЧСС ≥70 уд/мин и ФВ ЛЖ ≤35% [60–63]. Эта рекомендация основана на значении ЧСС ≥70 уд/мин, использовавшимся в качестве критерия включения в исследовании SHIFT, по данным которого ивабрадин уменьшал риск комбинированной конечной точки из СС смерти или госпитализаций по причине СН у симптомных пациентов с ХСН и низкой ФВ ЛЖ (ФВ ЛЖ ≤35%) и ЧСС ≥70 уд/мин, которые были госпитализированы по поводу ХСН в течение 12 мес до включения в исследование и принимали иАПФ или БРА или ангиотензиновых рецепторов и неприлизина ингибитор (АРНИ), β-АБ и антагонист минералокортикоидного рецептора (АМКР) в максимально переносимых/целевых дозах [65]. Несмотря на такие результаты, Европейское агентство по ЛС одобрило ивабрадин для использования в Европе при ЧСС ≥75 уд/мин, потому что в этой подгруппе ивабрадин обеспечил преимущество в плане выживаемости на основе ретроспективного анализа подгрупп [66]. В любом случае, следует приложить все усилия для достижения рекомендуемых/максимально переносимых доз β-АБ, прежде чем рассматривать возможность применения ивабрадина. Однако экстраполирование результатов исследования SHIFT позволяет предположить, что достижение ЧСС≤70 уд/мин с помощью β-АБ также будет полезно, чем при большей ЧСС.
Согласно инструкции и клиническим рекомендациям, β-АБ нельзя инициировать при острой декомпенсации сердечной недостаточности (ОДСН), после стабилизации состояния также рекомендуется медленная титрация дозы [60–63]. Однако в исследовании STRONG-HF было показано, что среди госпитализированных с ОДСН высокоинтенсивное лечение, включающее быструю (в течение 6 недель после выписки из стационара) титрацию доз рекомендуемой лекарственной терапии, в том числе и β-АБ, до целевых доз, а также тщательное наблюдение, было безопасным, хорошо переносилось и ассоциировалось с пониженным риском смерти от любой причины или повторной госпитализации из-за СН, улучшением качества жизни в течение 180 дней по сравнению с медленной титрацией доз [67–68]. Таким образом, быстрая титрация дозы β-АБ может быть дополнительно полезна при наличии возможности мониторинга пациента.
Несмотря на то что β-АБ часто назначают пациентам с ХСН с сохранной ФВ ЛЖ, нет убедительных доказательств того, что β-АБ приносят пользу таким пациентам [54]. По итогам вторичного анализа исследования TOPCAT показано увеличение риска госпитализаций по поводу СН на 74% у пациентов с ФВ ЛЖ ≥50% по сравнению с больными, не получавшими β-АБ (отношение рисков = 1,74, 95% ДИ 1,28–2,37; p<0,001) при этом прием β-АБ не оказывал влияния на СС смертность.
В то же время среди пациентов с ФВ ЛЖ 45–49% увеличения риска госпитализаций по поводу СН у пациентов, принимавших β-АБ, не отмечено [55].
К тому же у части пациентов с ХСН и сохранной ФВ ЛЖ прием β-АБ может ухудшать симптомы СН. Вероятно, это связано с развитием у части пациентов хронотропной недостаточности, которая определяется как неадекватное увеличение ЧСС во время физической нагрузки. По данным К. Smarz, хронотропная недостаточность была выявлена у 81% пациентов, принимающих β-АБ, среди которых 64% имели ХСН, из них более половины – ХСН с сохранной ФВ ЛЖ. При этом у пациентов, принимавших β-АБ, наличие хронотропной недостаточности ассоциировалось с более низкой переносимостью физической нагрузки независимо от дозы препарата [69]. В исследовании PRESERVE-HR с участием 52 пациентов со стабильной ХСН с ФВ ЛЖ>50% и хронотропной недостаточностью через 30 дней после рандомизации отмена β-АБ сопровождалось большей частотой сердечных сокращений (ЧСС) при пиковой нагрузке (127 против 97 уд/мин; p<0,001) и значения пикового потребления кислорода (14,3 против 12,2 мл/кг/мин, p<0,001). Кроме этого, было отмечено улучшение суррогатных показателей качества жизни и уменьшение конечно-диастолического давления в ЛЖ по данным эхокардиографии [70].
Показание 5. Нарушения ритма сердца. Режим дозирования 100–200 мг
Нарушения сердечного ритма – одна из наиболее распространенных причин смертельных исходов у пациентов с ИМ, ИБС и ХСН. При применении β-АБ значимо уменьшается частота жизнеугрожающих желудочковых аритмий (ЖА) и фибрилляции желудочков (ФЖ), а также реже развивается синдром удлинения интервала QT, который предшествует ФЖ.
β-АБ – это одни из самых часто назначаемых ЛС для лечения и профилактики различных нарушений ритма сердца, при этом они не обладают проаритмогенным эффектом. Этот класс препаратов рекомендуется для лечения и профилактики наджелудочковых тахикардий (симптомной синусовой тахикардии, предсердной тахикардии, симптомной рецидивирующей атриовентрикулярной реципрокной тахикардии и др.) [71], фибрилляции и трепетания предсердий [72, 73], а также желудочковых нарушений ритма (желудочковой эктопической активности, при повышенном риске ВСС и нуждающихся в ее первичной или вторичной профилактике, для лечения желудочковой экстрасистолии, с целью профилактики желудочковых аритмий) [74].
В нескольких небольших исследованиях была показана эффективность метопролола сукцината CR/XL в плане удержания синусового ритма и профилактики развития пароксизмов фибрилляции предсердий (ФП) [75, 76], при этом β-АБ могут быть сопоставимы с соталолом [77]. В исследовании MERIT-HF метопролол уменьшал риск появления новых случаев ФП у пациентов с ХСН и низкой ФВ ЛЖ на 48% (95% ДИ 0,37–0,75; р=0,0004) [78]. В этих исследованиях большинство пациентов получали метопролол в дозе 100–200 мг, при этом метопролол был сопоставим по безопасности с контрольной группой. Однако в Европейских клинических рекомендациях по диагностике и лечению ФП
β-АБ рассматривают в первую очередь как главный компонент пульсурежающей терапии при выборе стратегии контроля частоты желудочкового ритма (I, А).
β-АБ часто рассматриваются как препараты первой линии для контроля ЧСС, что связано с лучшим контролем ЧСС этими ЛС. Зачастую β-АБ и дилтиазем/верапамил предпочтительнее дигоксина из-за быстрого начала действия и эффективности при высоком симпатическом тонусе. Комбинированная терапия, включающая различные препараты для контроля ЧСС, в первую очередь дигоксин, должна рассматриваться, если на одном препарате не удается достигнуть целевой ЧСС [72]. В клинических рекомендациях Европейского общества кардиологов 2024 г. позиция в отношении β-АБ осталась прежней [73].
Однако в реальной клинической практике мы зачастую наблюдаем, что пациенту для контроля ЧСС при ФП назначают небольшую дозу β-АБ, например метопролола сукцинат 50 мг и дигоксин 0,25 мг. Несмотря на то что такая схема может отвечать поставленной задаче достижения целевых значений ЧСС, использование дигоксина может быть сопряжено с риском серьезных нежелательных явлений, особенно у пациентов с хронической болезнью почек и пожилых пациентов, у которых высокий риск увеличения концентрации дигоксина и развития дигоксиновой интоксикации, при этом высокая плазменная концентрация дигоксина ассоциирована с повышением смертности [72]. В такой ситуации нам представляется более рациональным использовать максимально переносимую дозу метопролола, причем в Европейских клинических рекомендациях 2018 г. допускалось использование метопролола сукцината CR/XL до 400 мг/сут. [73], и только в случае недостижения целевых значений ЧСС на максимально переносимой дозе β-АБ добавление к терапии небольших доз дигоксина (до 0,125 мг).
За амбулаторной консультацией кардиолога обратилась пациентка М., 62 лет, с жалобами на перебои в работе сердца, учащенное сердцебиение, слабость и одышку при физической нагрузке. Данные жалобы появились около 4 мес. назад. При осмотре выявлено неритмичное сердцебиение со средней ЧСС 130–140 уд/мин, дефицит пульса на лучевой артерии, АД 140/80 мм рт. ст. Признаков задержки жидкости не было. На ЭКГ: фибрилляция предсердий со средней ЧСС 130 уд/мин. От предложенной экстренной госпитализации для решения вопроса о восстановлении синусового ритма, дообследования и подбора антиаритмической терапии пациентка отказалась в пользу планового стационарного лечения. Первично на амбулаторном этапе была назначена антикоагулянтная терапия апиксабаном, а также пульсурежающая терапия метопролола сукцинатом в дозе 200 мг 1 раз в сутки (утром) наряду с рекомендациями по коррекции образа жизни и необходимости дообследования (ЭхоКГ, анализы крови, мониторирование ЭКГ по Холтеру, УЗИ вен нижних конечностей и органов малого таза). Через 3 недели пациентка пришла на повторный прием. Отмечалось значительное улучшение состояния: сохранялся неправильный ритм сердца, но учащенное сердцебиение не беспокоило, а ритм фибрилляции предсердий по данным повторного мониторирования ЭКГ по Холтеру был со среднесуточной ЧСС 86 уд/мин, увеличилась переносимость физической нагрузки. Таким образом, назначение полноценной терапевтической дозы β-АБ позволило быстро достичь нужного клинического эффекта.
Показание 6. Функциональные нарушения сердечной деятельности, сопровождаемые тахикардией. Режим дозирования 100–200 мг
Функциональные нарушения сердечной деятельности относятся к одним из проявлений тревожных расстройств. У пациентов может быть чувство тревоги, беспокойства или раздражительность, часто сопровождающееся физическими симптомами, такими как учащенное сердцебиение, повышенное потоотделение, одышка, дрожь или головокружение, некоторые люди испытывают панические атаки [79]. Липофильные β-АБ, проникая через гематоэнцефалический барьер (78% плазменной концентрации метопролола сукцината обнаруживается в ликворе [80]), обладают гипотетической способностью вызывать сонливость, галлюцинации, депрессию или нарушения либидо. Данные побочные явления терапии β-АБ не являются достоверными или часто встречающимися, а также мало изучены. Способность β-АБ к противотревожному действию – основа для достаточно частого назначения этого класса ЛС больным тревожными расстройствами, однако убедительных доказательств их пользы в этой нише нет. Так, в недавно опубликованном метаанализе β-АБ были не лучше плацебо для лечения пациентов с тревожными расстройствами, правда, включенные в метаанализ исследования были небольшими, а многие исследования были вовсе исключены из него в связи с высоким риском систематической ошибки [81].
Таким образом, β-АБ влияют на физические симптомы тревоги, но не действуют напрямую на психологические проблемы, при этом уменьшение соматических проявлений может способствовать уменьшению тревожных мыслей, связанных с этими симптомами [82]. Рациональной можно считать ту дозировку β-АБ, на которой удается достичь приемлемого значения ЧСС (по самочувствию) для данного пациента.
Показание 7. Профилактика приступов мигрени. Режим дозирования 100–200 мг
Согласно консенсусу Американского общества головной боли, пациентам у которых мигренозная боль бывает 4 и более дня в месяц или 2 и более дня при значительном снижении трудоспособности, несмотря на обезболивающую терапию, рекомендуется назначение профилактической антимигренозной терапии (триптаны, когнитивно-поведенческая психотерапия и т.д.). Профилактическую терапию также следует рассмотреть у пациентов с нетипичной аурой (гемиплегическая мигрень, мигрень стволовой аурой) и мигренью с осложнениями, например при стойкой ауре, мигренозном инсульте, мигренозном статусе, даже если частота приступов низкая. При этом пропранолол и метопролола сукцинат рассматривают как препараты с доказанной эффективностью в отношении профилактики приступов мигрени [83].
β-АБ снижают частоту приступов мигрени, модулируя возбудимость коры головного мозга от большого количества зрительных, слуховых и прочих раздражителей, а также уменьшая аномальную обработку информации корой головного мозга. При этом прямого влияния системно вводимого метопролола и других β-АБ на центральные структуры, обрабатывающие боль, включая таламус, ни в здоровой системе, ни в патологической системе у страдающих мигренью не выявлено [84].
Согласно итогам метаанализа по сравнению с плацебо, метопролол в среднем уменьшал приступы мигрени на 0,94 случая в месяц (95% ДИ от -1,4 до -0,46), при этом во всех исследованиях использовали большие дозировки метопролола (100–200 мг) [85], в связи с чем рекомендуется использовать именно такие дозировки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Скотников Антон Сергеевич – канд. мед. наук, доц. каф. медико-социальной экспертизы, неотложной и поликлинической терапии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: skotnikov_a_s@staff.sechenov.ru; ORCID: 0000-0002-8856-3638
Anton S. Skotnikov – Cand. Sci. (Med.), Assoc. Prof., Sechenov First Moscow State Medical University (Sechenov University E-mail: skotnikov_a_s@staff.sechenov.ru; ORCID: 0000-0002-8856-3638
Закиев Вадим Дмитриевич – мл. науч. сотр. лаб. клинической фармакологии и фармакотерапии, ОСП «Российский геронтологический научно-клинический центр» – ФГАОУ ВО «РНИМУ им. Н.И. Пирогова». ORCID: 0000-0003-4027-3727
Vadim D. Zakiev – Res. Assist., Russian Gerontological Scientific and Clinical Center – Pirogov Russian National Research Medical University. ORCID: 0000-0003-4027-3727
Гвоздева Анна Дмитриевна – канд. мед. наук, врач функциональной диагностики, ГКБ им. И.В. Давыдовского. ORCID: 0000-0002-5684-9842
Anna D. Gvozdeva – Cand. Sci. (Med.), Doctor of functional diagnostics, Davydovsky City Clinical Hospital. ORCID: 0000-0002-5684-9842
Лазарева Вера Викторовна – канд. мед. наук, доц. каф. фармакологии и клинической фармакологии, ФГБОУ ВО «Российский государственный социальный университет». ORCID: 0009-0003-4024-3285
Vera V. Lazareva – Cand. Sci. (Med.), Assoc. Prof., Russian State Social University. ORCID: 0009-0003-4024-3285
Поступила в редакцию: 15.10.2024
Поступила после рецензирования: 17.10.2024
Принята к публикации: 17.10.2024
Received: 15.10.2024
Revised: 17.10.2024
Accepted: 17.10.2024
Selection of modern β-blocker dosing regimen in various clinical situations (exemplified by metoprolol succinate)
A.S. Skotnikov1, V.D. Zakiev2, A.D. Gvozdev3, V.V. Lazareva41 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
2 Russian Gerontological Scientific and Clinical Center – branch of Pirogov Russian National Research Medical University, Moscow, Russia;
3 Davydovsky City Clinical Hospital, Moscow, Russia;
4 Russian State Social University, Moscow, Russia
skotnikov_a_s@staff.sechenov.ru
Abstract
Beta-blockers are currently one of the most prescribed drugs in various acute and chronic conditions due to wide range of indications and a large evidence base. Metoprolol succinate (Betaloc ZOK) is one of modern lipophilic β1-selective blocker without intrinsic sympathomimetic activity and available in controlled slow release (CR/XL) form. Metoprolol succinate CR/XL can be considered an essential treatment of a wide range of cardiovascular and other diseases (for example, migraine and thyrotoxicosis). However, this drug is often used in not optimal doses. The purpose of this article is to draw the attention of physicians to the unjustified underestimation of β-AB doses in a number of clinical conditions.
Keywords: beta-blockers, target doses, indications, comorbidity, metoprolol succinate.
For citation: Skotnikov A.S., Zakiev V.D., Gvozdeva A.D., Lazareva V.V. The choice of dosage regimen of modern beta-blockers in different clinical situations (using the example of metoprolol succinate). Clinical review for general practice. 2024; 5 (10): 52–63 (In Russ.). DOI: 10.47407/kr2024.5.10.00496
Введение
β-адреноблокаторы (β-АБ) являются одними из самых назначаемых лекарственных средств (ЛС) в терапии и кардиологии, поскольку имеют широкий спектр показаний к применению и большую доказательную базу. Общеизвестно, что с фармакологических позиций все существующие β-АБ могут быть разделены на препараты первого (неселективные β1,2 адреноблокаторы – пропранолол и соталол), второго (β1-селективные адреноблокаторы – атенолол, метопролола тартрат и сукцинат, бисопролол) и третьего (β-АБ с дополнительным вазодилатирующим действием – карведилол, небиволол) поколения. Напомним, что β1-рецепторы в основном расположены в сердце и почках, β2 – в периферических кровеносных сосудах, почках, поджелудочной железе, скелетных мышцах, бронхах и легких, а также в матке, а β3 – в жировой ткани. Нейротропная и гуморальная стимуляция этих рецепторов приводит к увеличению силы и частоты сердечных сокращений (ЧСС), усилению сократимости сердца и внутрисердечной проводимости, увеличению выброса ренина и инулина, усилению гликогенолиза (расщепления глюкозы) и липолиза (расщепление жиров), бронходилатации и расслаблению мышечных волокон матки. В свою очередь, влияя через β-рецепторы на эффекторные органы, в которых они расположены, разные β-АБ вызывают различные фармакологические эффекты [1].Так, блокада β1-рецепторов приводит к отрицательному инотропному (сила), отрицательному хронотропному (частота), отрицательному дромотропному (проводимость) и отрицательному батмотропному (возбудимость) действию в сердце и снижению секреции ренина и ангиотензина (АТ) II вследствие блокады β1-рецепторов в клетках юкстагломеруллярного аппарата (ЮГА) в почках. Медикаментозная блокада β2-рецепторов способствует повышению тонуса гладкой мускулатуры бронхов, усилению моторики желудочно-кишечного тракта (ЖКТ) (спастические боли в животе, рвота, поносы) и сократительной активности матки, а также активации синтеза гликогена и торможению гликогенолиза и гликонеогенеза (что может привести к гипогликемии, особенно на фоне приема гипогликемических средств у больных сахарным диабетом 2-го типа), а также повышению тонуса периферических сосудов, повышению общего периферического сосудистого сопротивления (ОПСС), ухудшению периферического кровообращения, повышенной утомляемости и мышечной слабости – здесь рождается ложное суждение, что все (!) β-АБ опасны для сосудов ног, если у пациента есть диагноз периферического атеросклероза (даже не облитерирующего). Однако при коморбидности не все так однозначно, и способность пропранолола приводить к сужению, в частности, сосудов пищевода нашла отражение в профилактике кровотечений из варикозно-расширенных вен пищевода у пациентов с портальной гипертензией. Наконец, блокада β3-рецепторов тормозит липолиз в жировой ткани и влияет на повышение содержания в крови атерогенных фракций холестерина – отсюда миф про усугубление инсулинорезистентности, увеличение риска развития СД 2-го типа и прогрессирование атерогенной дислипидемии на фоне приема любого (!) β-АБ.
Таким образом, очевидно, что наибольшую востребованность во врачебной среде приобрели современные кардиоселективные β1-АБ метопролол, небиволол, бисопролол и карведилол (не влияет на β2-рецепторы, хоть и не относится к селективным β-АБ). Критериями выбора и сравнения селективных β-АБ являются способность к достижению целевой ЧСС в терапевтических дозах, стабильный контроль ЧСС 24 ч при приеме один раз в сутки, положительное влияние на микроциркуляцию, метаболическая нейтральность и высокий профиль безопасности. При этом часто забывается, что большинство побочных эффектов и неудобств – прерогатива исключительно неселективных β-АБ, которая, однако, транслируется на весь класс β-АБ, что привело к страхам и осторожности врачей перед их назначением у сохранных молодых или, наоборот, у пожилых и ослабленных коморбидных больных, а особенно в дозах выше средних.
Кроме классификации β-АБ по селективности в фармакологии принято их разделять на препараты с внутренней активностью (симпатомиметической) (ВСА) (окспренолол, пиндолол, ацебуталол, целипролол, буциндалол, лабеталол) и без нее. Препараты без ВСА, в свою очередь, делят на гидрофильные (атенолол, надолол, соталол), липофильные (пропранолол, эсмолол, бетаксолол, метопролол, карведилол, небиволол) и амфифильные (гидролипофильные), способные к растворению как в воде, так и в жирах (бисопролол). Напомним, что ВСА проявляется в виде частичного обратного действия, т.е. стимуляции ряда β-адренорецепторов, что приводит к ослаблению основных эффектов β-АБ, а самое главное – к повышению потребления миокардом кислорода. Очевидно, что если препарат обладает ВСА, то его использование пациентом с ишемической болезнью сердца (ИБС), хронической сердечной недостаточностью (ХСН) или после инфаркта миокарда (ИМ) с высокой вероятностью принесет ему дополнительные проблемы [2].
Одним из современных представителей липофильных β1-кардиоселективных адреноблокаторов, лишенных внутренней активности, является метопролола сукцинат (Беталок ЗОК), доступный в форме контролируемого замедленного высвобождения (CR/XL). Каждая таблетка данного препарата содержит множество гранул метопролола сукцината, покрытых собственной оболочкой и представляющих собой собственную единицу доставки ЛС. А в исследованиях in vitro и in vivo на здоровых добровольцах показано, что данная передовая технология обеспечивает непрерывность высвобождения метопролола из плазменного депо в течение дня, что приводит к равномерной концентрации препарата в плазме крови без пиков и спадов. Высвобождение препарата не зависит от pH в ЖКТ и приема пищи, а плазменное депо не требует депонирования препарата в тканях, включая жировую [3].
С точки зрения доказательной медицины метопролола сукцинат CR/XL можно считать универсальным средством при ряде сердечно-сосудистых (СС) и прочих заболеваний (например, мигрень и тиреотоксикоз), к тому же из всех β-АБ он имеет самый полный спектр показаний. Однако зачастую на протяжении всего лечения данный препарат используется не совсем в оптимальных дозах (25 или 50 мг) [4–7]. Более того, мы видим, что при необходимости увеличивать дозу метопролола сукцината более 50 мг врачи вместо этого по необъяснимым, а не по объективным причинам переводят пациентов на другие β-АБ. Возможно, что недодозирование β-АБ в целом и метопролола сукцината в частности в реальной клинической практике связано с незнанием эквивалентных доз этих препаратов или с трудностями определения целевых значений ЧСС при том или ином заболевании.
Также складывается впечатление, что дозы метопролола сукцината от 75 до 200 мг элементарно отпугивают клиницистов и пациентов своей величиной, в то время как дозы Беталока ЗОК и других β-АБ от 6,25 до 50 мг субъективно воспринимаются врачами и их пациентами более комфортно и безопасно.
Цель написания этой статьи заключается в привлечении внимания врачей к несправедливому и необоснованному занижению дозы β-АБ при ряде клинических состояний, которые одновременно являются их показаниями и клинико-фармакологическими нишами для использования. В данном обзоре мы постарались рассмотреть выбор режима дозирования β-АБ на примере метопролола сукцината с позиций имеющихся доказательств и ответить на вопрос – оправданы ли ранее перечисленные опасения?
Показание 1. Гипертония (ESC, 2024). Режим дозирования 50–200 мг
Применение β-АБ у пациентов с артериальной гипертензией (АГ) приводит к снижению активности ренина, АТ II и альдостерона в плазме крови в результате блокады β₁-адренорецепторов ЮГА, а также к уменьшению ЧСС, силы сердечных сокращений и в конечном счете уровня артериального давления (АД) [8]. В актуальных российских и европейских клинических рекомендациях по лечению АГ от 2018 г. класс β-АБ входит в состав пяти основных групп антигипертензивных препаратов, рекомендуемых к применению наряду с ингибиторами ангиотензин-превращающего фермента (иАПФ), блокаторами рецепторов ангиотензина (БРА), блокаторами кальциевых каналов (БКК) и тиазидными/тиазидоподобными диуретиками (I, А), при этом β-АБ рассматриваются как препараты выбора у коморбидных пациентов, имеющих ИБС, ХСН или нарушения ритма сердца [9, 10]. В рекомендациях Европейского общества по гипертонии от 2023 г. допускается использование β-АБ как в монотерапии, так и в составе комбинированной антигипертензивной терапии при наличии других показаний к ним (стенокардии, ИМ в анамнезе, ХСН, нарушения ритма, АГ у беременных или планирующих беременность), обращается внимание и на другие состояния, когда β-АБ могут быть полезны (ЧСС>80 в минуту, тревожные состояния, мигрень, эссенциальный тремор и др.) [11]. В рекомендациях Европейского общества кардиологов от 2024 г. в целом позиция экспертов в отношении β-АБ не изменилась: они могут быть добавлены к терапии на любом шаге при наличии у пациента других показаний [12].
В некоторых клинических исследованиях отмечено преимущество метопролола над другими классами препаратов у пациентов с АГ. Например, в исследовании MAPHY изучали метопролол (средняя доза 176 мг/сут) по сравнению тиазидными диуретиками (гидрохлоротиазид в средней дозе 46 мг, бендрофлутиазид в средней дозе 4,4 мг) у мужчин в возрасте 40–64 лет с АГ в целях первичной профилактики. Несмотря на то что и в двух группах АД уменьшилось с 167/108 до 143/89 мм рт. ст. на последнем визите, в группе метопролола снижение диастолического АД было чуть более выраженное, но статистически значимое, при этом в группе метопролола отмечалось снижение СС смерти (р=0,012), фатального ИМ и внезапной сердечной смерти (р=0,048), фатального инсульта (р=0,043) [13].
В исследовании FISH, где метопролол сравнивали с исрадипином, отмечалось более значимое снижение среднего АД через 8 недель лечения: в группе метопролола АД снижалось на 15/12 мм рт. ст. (с 160/103 до 145/91 мм рт. ст.), в группе исрадипина 13/11 мм рт. ст. (с 161/104 до 148/93 мм рт. ст.). На монотерапии исрадипином в средней суточной дозе 4,26 мг диастолическое АД достигало целевого ≤90 мм рт. ст. у 52% пациентов, в то время как в группе монотерапии в средней суточной дозе 155 мг – у 58% пациентов [14]. Следует обратить внимание, что эффект метопролола обеспечивался на больших дозах, при этом есть мнение, что в исследованиях, где β-АБ уступили другим классам препаратов. Такой результат обусловлен использованием неоптимального режима дозирования β-АБ [15].
Таким образом, несмотря на то, что β-АБ не относятся к препаратам первой линии лечения АГ, метопролол сукцинат XR/CR может использоваться у пациентов с АГ и с другими показаниями к β-АБ как в моно-, так и в комбинированной терапии, однако стоит стремиться к максимально рекомендуемой дозе (200 мг) при условии хорошей переносимости.
Показание 2. Хронический коронарный синдром (ESC, 2019). Режим дозирования 100–200 мг
Существует два основных механизма антиангинальной терапии при стабильной ИБС: снижение потребности миокарда в кислороде (β-АБ уменьшают сократимость миокарда и ЧСС [16]) и увеличение доставки кислорода к миокарду путем усиления его артериального кровоснабжения.
Главная цель лечения стенокардии – максимально облегчить ее симптомы, уменьшить количество приступов и увеличить толерантность к физической нагрузке. При этом необходимо выбрать ЛС, которые не ухудшают течение сопутствующих заболеваний, не имеют значимых взаимодействий с другими используемыми ЛС и хорошо переносятся пациентом. В определенных ситуациях может быть более рационален выбор одного лекарственного агента вместо другого (например, β-АБ у пациента с сопутствующей дисфункцией ЛЖ) [16].
В различных клинических рекомендациях β-АБ рассматриваются как ЛС первой линии симптоматического лечения пациентов со стабильной ИБС [16–18].
В ранних исследованиях показано, что β-АБ и метопролол, в частности, увеличивали долю пациентов, свободных от стенокардии напряжения, уменьшали количество приступов стенокардии и потребление нитроглицерина [19–24]. По итога метаанализа 72 исследований, сравнивающих β-АБ с БКК, выявлены меньшее количество эпизодов стенокардии в неделю при приеме β-АБ и более низкие показатели отмены препарата [25]. Следует отметить, что в этих исследованиях использовали достаточно большие дозы метопролола (100–400 мг/сут) [19, 22–24], а его средняя стартовая доза составила 177 мг/сут. [25]. В недавно опубликованных клинических рекомендациях по ведению пациентов с хроническим коронарным синдромом Европейского общества кардиологов подчеркнуто, что крупных РКИ, напрямую сравнивающих β-АБ или БКК с более новыми противоишемическими препаратами (ивабрадином, никорандилом, ранолазином, триметазидином), не было. Последние оценивали в сравнении с β-АБ или БКК в небольших исследованиях типа non-inferiority («не хуже») или в более крупных исследованиях в качестве дополнительной терапии с β-АБ или БКК. В связи с этим на 2024 г. β-АБ остаются ангинальной терапией первой линии, несмотря на продолжительную историю использования и появление новых ЛС [26].
Несмотря на то что антиангинальный эффект β-АБ связан непосредственно с ЧСС, однозначного целевого значения ЧСС при стабильной ИБС нет. В актуальных российских и европейских клинических рекомендациях по лечению и диагностике пациентов со стабильной ИБС предлагается достигать у пациентов со стенокардией ЧСС 55–60 уд/мин [17, 18]. Однако в Американских клинических рекомендациях целевое значение ЧСС не оговаривается [16]. При этом некоторые специалисты полагают, что многие пациенты хорошо переносят ЧСС в покое ниже 50 уд/мин, поэтому возможно использование β-АБ и при более низких значениях ЧСС [27].
По данным регистра The Coronary Artery Surgery Study (CASS), в который включали пациентов, проходивших коронароангиографию при подозрении на наличие или при наличии подтвержденной ИБС, исходная ЧСС в покое ≥77 уд/мин была ассоциирована со значимым увеличением риска общей и СС смерти по сравнению с ЧСС ≤62 уд/мин. При этом ЧСС в диапазоне 63–70 и 71–76 уд/мин значимо на риск этих точек не влияла, в то же время пациенты с более частой ЧСС в покое чаще имели дислипидемию, АГ, СД, чаще курили [28]. Однако в недавнем исследовании с участием 19 102 пациентов со стабильной ИБС без ХСН, получавших стандартную антиангинальную терапию и имевших ЧСС ≥70 уд/мин, ивабрадин не снижал риск первичной конечной точки (ПКТ), состоящей из СС смерти или ИМ. При этом у пациентов со стенокардией, ограничивающей активность, в группе приема ивабрадина, несмотря на улучшение функционального класса (ФК), отмечалось увеличение частоты ПКТ. Вероятно, это связано с тем, что в группе ивабрадина в 10 раз чаще наблюдалась брадикардия, в том числе и симптомная [29]. Результаты данного исследования не позволяют однозначно судить, что наносит вред: более низкие целевые значения ЧСС или сам ивабрадин. Однако, например, в Американских рекомендациях добавление ивабрадина к стандартной антиангинальной терапии у пациентов с нормальной систолической функцией ЛЖ не рекомендуется [16].
Следует отметить, что ивабрадин добавляли к стандартной терапии, которая включала в том числе β-АБ, при этом не известно, какие были бы результаты, если бы пациенты достигали более низких значений ЧСС на фоне приема β-АБ.
Несмотря на выраженный антиангинальный эффект и широкое применение в клинической практике, убедительных данных, что β-АБ при стабильной ИБС без предшествующего ИМ и систолической дисфункции способствуют улучшению прогноза, нет. В регистре REACH с участием более 24 тыс. пациентов β-АБ не снижали риск ПКТ, состоящей из СС смерти, нефатального ИМ и нефатального инсульта, вторичных и третичных точек у пациентов как со стабильной ИБС без перенесенного ИМ в анамнезе, так и у пациентов с перенесенным ИМ и у пациентов с факторами риска, но без ИБС [30]. По данным ретроспективного регистра NCDR с участием 755 215 пациентов в возрасте ≥ 65 лет и стабильной ИБС без ИМ или ХСН с низкой фракцией выброса левого желудочка (ФВ ЛЖ), которым было выполнено чрескожное коронарное вмешательство (ЧКВ), использование β-АБ при выписке из стационара не было связано со снижением СС заболеваемости или смертности в течение 30 дней и в течение 3 лет наблюдения [31]. Подобные результаты также были получены в post-hoc анализе исследования CHARISMA (Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management and Avoidance), в котором также не отмечалось уменьшение частоты СС событий у пациентов без ИМ в анамнезе и ХСН, принимавших β-АБ [32]. Однако у пациентов после аортокоронарного шунтирования как с предшествующим ИМ, так и без него β-АБ были связаны с более низким риском долгосрочной смертности и неблагоприятных СС событий [33].
Таким образом, данных, однозначно поддерживающих мнение, что более низкое значение ЧСС приносит пользу пациенту, пока нет, требуются дополнительные специально спланированные исследования для определения целевого значения ЧСС у пациентов со стабильной ИБС. Однако, учитывая тот факт, что главная цель β-АБ – симптоматическое лечение стенокардии, следует достигать тех значений ЧСС, при которых у пациента не будет симптомов, т.е. будет достигнута клиническая цель лечения, и при этом терапия хорошо переносится. Чаще всего достичь клинической цели удается именно на больших дозировках β-АБ, например метопролол сукцинат эффективнее в дозировке 200 мг, нежели 100 или 50 мг при сопоставимой безопасности [34, 35], при этом метопролол сукцинат обладает более выраженным клиническим эффектом по сравнению с метопрололом тартратом [36, 37]. В то же время убедительных данных о влиянии β-АБ на прогноз у пациентов со стабильной ИБС нет, однако не вызывает сомнения польза β-АБ при наличии систолической дисфункции, при этом рекомендуется использовать β-АБ с доказанной эффективностью, в частности метопролол сукцинат в максимально переносимой или целевой дозе 200 мг в сутки [16].
Показание 3. Первый год после инфаркта миокарда. Режим дозирования 200 мг
β-АБ в течение длительного времени используют в клинической практике для лечения пациентов с ИМ,
в том числе и в острый период, однако данные по их эффективности противоречивы. В опубликованном в 1999 г. метаанализе ранних клинических исследований, выполненных по большей части в 70-е и 80-е годы XX в., показано, что короткое лечение β-АБ, в том числе и внутривенное их введение с последующим переходом на пероральную форму, в острый период ИМ улучшает прогноз таких пациентов, однако длительное применение β-АБ, в том числе и метопролола по отдельности, приводило к снижению смертности [38]. Однако почти все исследования, включенные в метаанализ, подвергаются критике [39], так как были выполнены до широкого применения реваскуляризации миокарда и без использования другой терапии, эффективной во вторичной профилактике ИМ (статины, иАПФ и даже дезагреганты). Отдельно следует отметить, что в этих исследованиях также не учитывали систолическую функцию у включенных пациентов, соответственно, β-АБ могли быть им полезны.
В более свежем метаанализе (2014), включившем в том числе и современные исследования, было показано, что β-АБ оказывают положительное влияние в отношении смертности в дореперфузионную эру, в то время как в реперфузионную эру (исследование относилось к реперфузинной эре, если более половины включенных пациентов получали тромболитическую терапию или были реваскуляризированы и/или получали аспирин и статин) β-АБ не снижали смертность, но уменьшали частоту повторного ИМ и стенокардии ценой увеличения частоты случаев СН и кардиогенного шока [40].
Краткосрочные эффекты β-АБ у пациентов с острым ИМ, подвергнутых ЧКВ, изучали в исследовании METOCARD-CNIC, в котором 270 пациентов были рандомизированы группу в/в метопролола и группу контроля в течение 6 ч с момента появления симптомов, при этом метопролол вводили до проведения ЧКВ.
В результате этого исследования внутривенное введение метопролола во время продолжающегося переднего ИМ с подъемом сегмента ST уменьшало размер инфаркта [41], микрососудистую обструкцию и реперфузионное повреждение [42], а также улучшало ФВ ЛЖ [43]. В исследовании EARLY-BAMI, в котором метопролол вводили в течение 12 ч с момента появления симптомов, не подтверждены кардиопротективные эффекты раннего назначения метопролола у пациентов с острым ИМ, перенесших первичную ангиопластику [44].
Расхождение между двумя исследованиями, по-видимому, обусловлено временем введения метопролола (гораздо раньше в METOCARD-CNIC), при этом чем раньше вводили метопролол в ходе инфаркта, тем меньше была зона инфаркта и выше ФВ ЛЖ [45]. В метаанализе 4 исследований с суммарным участием 1150 пациентов было показано некоторое увеличение ФВ ЛЖ через 6 мес. после острого ИМ в группе инфузии β-АБ (52,8% против 50,0% в контрольной группе; p=0,03), но не было отмечено влияния на размер инфаркта и на комбинированную точку из смерти или ИМ в течение 12 мес [46]. Эти данные позволили экспертам в Европейских клинических рекомендациях по ведению пациентов с острым коронарным синдромом (ОКС) от 2023 г. рекомендовать рассмотреть использование в/в β-АБ (предпочтительно метопролола) у пациентов, проходящих первичное ЧКВ без признаков острой СН, систолическим АД>120 мм рт. ст. и без других противопоказаний (IIa, A) [47].
Польза от длительного применения β-АБ у пациентов с ИМ и низкой ФВ не вызывает сомнения. Это основывается на исследовании CAPRICORN, в котором карведилол снижал смертность у пациентов с острым ИМ и ФВ ЛЖ<40% (средний период наблюдения 1,3 года) [48]. В дополнении к этому β-АБ снижали смертность в исследованиях с участием пациентов с ХСН с низкой ФВ, в том числе с перенесенным ранее ИМ как причиной ХСН, в частности в исследовании MERIT-HF с метопрололом сукцинатом CR/XL [49], о котором подробнее говорится далее.
Однако эффективность длительного применения β-АБ в современных условиях у пациентов с ИМ и сохраненной ФВ и выполненным ЧКВ остается дискутабельной. В японском исследовании CAPITAL-RCT с участием 801 пациента [50] оценивали долгосрочную эффективность β-АБ у пациентов после ИМ с подъемом сегмента ST с успешной ЧКВ и ФВ ЛЖ ≥ 40%. В результате этого исследования не было продемонстрировано положительное влияние карведилола на ПКТ, состоящую из смерти от всех причин, ИМ, госпитализаций из-за СН или ОКС, медиана наблюдения 3,9 года. Однако исследование не имело достаточной мощности для выявления значимой разницы ПКТ, что было связано с медленным набором пациентов.
В недавно опубликованном крупном открытом РКИ REDUCE-AMI, основанном на регистре, с участием 5020 пациентов с ИМ и ФВ ЛЖ>50%, где все пациенты были реваскуляризированы, β-АБ (метопролол в медианной дозе 100 мг/сут и бисопролол 5 мг/сут) не показали эффективность в отношении как ПКТ, состоящей из смерти от всех причин и ИМ, так и вторичных конечных точек (смерть от всех причин, СС смерть, ИМ, госпитализация по поводу фибрилляции предсердий, госпитализации по поводу СН), медиана наблюдения 3,5 года [51]. Однако это исследование подвергается критике [52]. Во-первых, частота развития ПКТ была существенно ниже, чем предполагали исследователи. Это отражает тот факт, что пациенты имели нормальную систолическую функцию, были реваскуляризированы и им была оказана качественная медицинская помощь, что не всегда бывает в реальной клинического практике. Поэтому результаты данного исследования не следует применять к пациентам с более высоким риском, например со сниженной систолической функцией ЛЖ (ФВ ЛЖ<50%) или пациентам, кому не выполнена реваскуляризация миокарда. Во-вторых, средние дозы β-АБ в исследовании были ниже, чем в первоначальных исследованиях с участием β-АБ после ИМ, что могло способствовать уменьшению различий между исследуемыми группами. Поскольку доверительный интервал влияния β-АБ на ПКТ включает снижение риска на 21% (близкий к тому, который наблюдался в более старых исследованиях, в которых изначально была показана терапия β-АБ после ИМ), нельзя исключить фактическую пользу β-АБ.
Помимо этого, в исследовании не предоставлена информация о профилактике желудочковых тахиаритмий и внезапной сердечной смерти (ВСС), что является важным потенциальным преимуществом β-АБ в этом контексте. В публикации этого исследования также нет подробной информации о соблюдении назначенного режима лечения после первого года лечения, при этом через 1 год среди пациентов, по которым имеются данные, около 18% пациентов, кому была назначена терапия β-АБ, прекратили их прием в то время, как около 14% пациентов в группе без β-АБ, начали лечение β-АБ. Это указывает на проблему перекрестного лечения в исследовании, что также могло повлиять на результаты.
На недавно прошедшем конгрессе Европейского общества кардиологов 2024 г. были представлены результаты исследования ABYSS, в котором отмена β-АБ у пациентов с перенесенным ИМ в анамнезе, ФВ ≥40% и не имевших в течение 6 мес СС событий не была «не хуже» (non-inferior) продолжения терапии в отношении ПКТ, состоящей из смерти, нефатального ИМ, нефатального инсульта и госпитализаций по СС причинам. Однако необходимо отметить, что исследование имело ряд ограничений [53]. Во-первых, почти четверть пациентов в группе отмены β-АБ имели сниженную ФВ ЛЖ (40–50%). О том, что β-АБ могут быть полезны в этой группе пациентов, свидетельствуют ряд публикаций [54, 55]. Кроме этого, увеличение частоты ПКТ в группе отмены β-АБ было в первую очередь за счет количества госпитализаций, которые в основном были обусловлены госпитализациями для проведения коронарографии и/или реваскуляризации. При этом в группе отмены β-АБ полная реваскуляризация была выполнена только 87,6% и у 1,1% пациентов была резидуальная стенокардия, что говорит о наличии субстрата для возобновления стенокардии при отмене
β-АБ и, соответственно, увеличения госпитализаций, при этом существенных различий в других компонента ПКТ не было.
Таким образом, пока нет убедительных доказательств в пользу назначения β-АБ у пациентов после ИМ и сохраненной ФВ ЛЖ, как и нет доказательств отмены β-АБ у пациентов, кому такая терапия была назначена ранее. В настоящее время проводится ряд исследований, призванных расставить все точки над «и» в вопросе длительного применения β-АБ (таблица).

Некоторые из них оценивают эффективность длительного приема β-АБ по сравнению с отсутствием лечения [56, 57], когда другие оценивают отмену приема
β-АБ спустя 6–12 мес после перенесенного ИМ у пациентов, принимающих β-АБ как минимум в течение этого времени [58, 59].
В Европейских клинических рекомендациях по ведению пациентов с ОКС от 2023 г. β-АБ рекомендуют всем пациентам с ОКС и ФВ≤40% независимо от симптомов (I, A), при этом рекомендуется рассмотреть их использование у всех пациентов независимо от ФВ ЛЖ, в том числе и с сохранной ФВ ЛЖ (IIa, B) [47]. Согласно американским клиническим рекомендациям по лечению пациентов со стабильной ИБС, пациентам, которым была начата терапия β-АБ по поводу перенесенного ИМ без снижения ФВ ЛЖ≤50% в анамнезе или на данный момент, стенокардии, аритмии или неконтролируемой гипертонии, может быть целесообразно пересмотреть показания к длительному
(>1 года) использованию терапии β-АБ, которые были назначены с целью вторичной профилактики СС событий (IIa, B) [16].
Таким образом, имеющиеся данные скорее не поддерживают длительный прием β-АБ после перенесенного ИМ у пациентов, подвергнутых реваскуляризации миокарда и имеющих сохраненную систолическую функцию ЛЖ. Однако они могут быть полезны у пациентов, которым выполнить реваскуляризацию миокарда невозможно по тем или иным причинам, в том числе и тем, кому выполнена тромболитическая терапия. На наш взгляд, у пациентов с ИМ и сниженной систолической функцией ЛЖ подбор дозы метопролола сукцината должен осуществляться аналогично пациентам с ХСН и низкой ФВ ЛЖ. Внутривенное введение метопролола перед ЧКВ может положительно влиять на ФВ ЛЖ, однако следует учитывать риск побочных эффектов.
Показание 4. Хроническая сердечная недостаточность. Режим дозирования 12,5–200 мг (титрация)
Метопролол сукцинат CR/XL является одним из β-АБ, рекомендованных для лечения хронической сердечной недостаточности (ХСН) с низкой фракцией выброса (ФВ) левого желудочка (ЛЖ) различными актуальными клиническими рекомендациями по лечению и диагностике пациентов с СН [60–63]. Это базируется в первую очередь на данных исследования MERIT-HF с участием 3991 пациента с ХСН II–IV ФК по классификации NYHA и ФВ ЛЖ <40% и средней продолжительностью наблюдения 1 год. По результатам этого исследования метопролол сукцинат CR/XL по сравнению с плацебо снижал риск общей смерти (относительный риск (ОР) = 0,66, 95% ДИ 0,53–0,81; p=0,00009), СС смерти (ОР=0,62, 95% ДИ 0,50–0,78; p=0,00003), внезапной смерти (ОР=0,59, 95% ДИ 0,45–0,78; p=0,0002), а также риск смерти из-за ухудшения СН (ОР=0,51, 95% ДИ 0,33–0,79; p=0,0023).
Начальная доза метопролола сукцината в исследовании составляла 12,5 мг или 25 мг один раз в день (половина таблетки 25 мг была рекомендована пациентам с III–IV ФК по классификации NYHA). При хорошей переносимости доза удваивалась каждые 2 недели до достижения целевой дозы 200 мг один раз в день. Режим дозирования мог быть изменен в соответствии с решением исследователя. Средняя суточная доза метопролола в конце исследования составила 159 мг один раз в день, при этом 87% пациентов получали 100 мг или более, а 64% получали целевую дозу 200 мг один раз в день. В группе плацебо соответствующие значения составили 179 мг, 91% и 82% соответственно [49].
Таким образом, данные исследования MERIT-HF поддерживают постепенную титрацию дозы β-АБ до максимально переносимой. Следует отметить, что результаты исследования были получены в основном на больших дозах метопролола сукцината (100–200 мг), в связи с чем в реальной практике необходимо стремиться к достижению максимально переносимой дозы для достижения максимального влияния на прогноз.
Частота сердечных сокращений (ЧСС) независимо от других факторов предсказывает исходы пациентов с ХСН и низкой ФВ ЛЖ. В метаанализе 23 исследований с участием β-АБ показано, что снижение ЧСС при синусовом ритме напрямую связано с улучшением исходов ХСН [64]. В настоящее время клинические рекомендации поддерживают дополнительное назначение ивабрадина к максимально переносимой дозе β-АБ при ЧСС ≥70 уд/мин и ФВ ЛЖ ≤35% [60–63]. Эта рекомендация основана на значении ЧСС ≥70 уд/мин, использовавшимся в качестве критерия включения в исследовании SHIFT, по данным которого ивабрадин уменьшал риск комбинированной конечной точки из СС смерти или госпитализаций по причине СН у симптомных пациентов с ХСН и низкой ФВ ЛЖ (ФВ ЛЖ ≤35%) и ЧСС ≥70 уд/мин, которые были госпитализированы по поводу ХСН в течение 12 мес до включения в исследование и принимали иАПФ или БРА или ангиотензиновых рецепторов и неприлизина ингибитор (АРНИ), β-АБ и антагонист минералокортикоидного рецептора (АМКР) в максимально переносимых/целевых дозах [65]. Несмотря на такие результаты, Европейское агентство по ЛС одобрило ивабрадин для использования в Европе при ЧСС ≥75 уд/мин, потому что в этой подгруппе ивабрадин обеспечил преимущество в плане выживаемости на основе ретроспективного анализа подгрупп [66]. В любом случае, следует приложить все усилия для достижения рекомендуемых/максимально переносимых доз β-АБ, прежде чем рассматривать возможность применения ивабрадина. Однако экстраполирование результатов исследования SHIFT позволяет предположить, что достижение ЧСС≤70 уд/мин с помощью β-АБ также будет полезно, чем при большей ЧСС.
Согласно инструкции и клиническим рекомендациям, β-АБ нельзя инициировать при острой декомпенсации сердечной недостаточности (ОДСН), после стабилизации состояния также рекомендуется медленная титрация дозы [60–63]. Однако в исследовании STRONG-HF было показано, что среди госпитализированных с ОДСН высокоинтенсивное лечение, включающее быструю (в течение 6 недель после выписки из стационара) титрацию доз рекомендуемой лекарственной терапии, в том числе и β-АБ, до целевых доз, а также тщательное наблюдение, было безопасным, хорошо переносилось и ассоциировалось с пониженным риском смерти от любой причины или повторной госпитализации из-за СН, улучшением качества жизни в течение 180 дней по сравнению с медленной титрацией доз [67–68]. Таким образом, быстрая титрация дозы β-АБ может быть дополнительно полезна при наличии возможности мониторинга пациента.
Несмотря на то что β-АБ часто назначают пациентам с ХСН с сохранной ФВ ЛЖ, нет убедительных доказательств того, что β-АБ приносят пользу таким пациентам [54]. По итогам вторичного анализа исследования TOPCAT показано увеличение риска госпитализаций по поводу СН на 74% у пациентов с ФВ ЛЖ ≥50% по сравнению с больными, не получавшими β-АБ (отношение рисков = 1,74, 95% ДИ 1,28–2,37; p<0,001) при этом прием β-АБ не оказывал влияния на СС смертность.
В то же время среди пациентов с ФВ ЛЖ 45–49% увеличения риска госпитализаций по поводу СН у пациентов, принимавших β-АБ, не отмечено [55].
К тому же у части пациентов с ХСН и сохранной ФВ ЛЖ прием β-АБ может ухудшать симптомы СН. Вероятно, это связано с развитием у части пациентов хронотропной недостаточности, которая определяется как неадекватное увеличение ЧСС во время физической нагрузки. По данным К. Smarz, хронотропная недостаточность была выявлена у 81% пациентов, принимающих β-АБ, среди которых 64% имели ХСН, из них более половины – ХСН с сохранной ФВ ЛЖ. При этом у пациентов, принимавших β-АБ, наличие хронотропной недостаточности ассоциировалось с более низкой переносимостью физической нагрузки независимо от дозы препарата [69]. В исследовании PRESERVE-HR с участием 52 пациентов со стабильной ХСН с ФВ ЛЖ>50% и хронотропной недостаточностью через 30 дней после рандомизации отмена β-АБ сопровождалось большей частотой сердечных сокращений (ЧСС) при пиковой нагрузке (127 против 97 уд/мин; p<0,001) и значения пикового потребления кислорода (14,3 против 12,2 мл/кг/мин, p<0,001). Кроме этого, было отмечено улучшение суррогатных показателей качества жизни и уменьшение конечно-диастолического давления в ЛЖ по данным эхокардиографии [70].
Показание 5. Нарушения ритма сердца. Режим дозирования 100–200 мг
Нарушения сердечного ритма – одна из наиболее распространенных причин смертельных исходов у пациентов с ИМ, ИБС и ХСН. При применении β-АБ значимо уменьшается частота жизнеугрожающих желудочковых аритмий (ЖА) и фибрилляции желудочков (ФЖ), а также реже развивается синдром удлинения интервала QT, который предшествует ФЖ.
β-АБ – это одни из самых часто назначаемых ЛС для лечения и профилактики различных нарушений ритма сердца, при этом они не обладают проаритмогенным эффектом. Этот класс препаратов рекомендуется для лечения и профилактики наджелудочковых тахикардий (симптомной синусовой тахикардии, предсердной тахикардии, симптомной рецидивирующей атриовентрикулярной реципрокной тахикардии и др.) [71], фибрилляции и трепетания предсердий [72, 73], а также желудочковых нарушений ритма (желудочковой эктопической активности, при повышенном риске ВСС и нуждающихся в ее первичной или вторичной профилактике, для лечения желудочковой экстрасистолии, с целью профилактики желудочковых аритмий) [74].
В нескольких небольших исследованиях была показана эффективность метопролола сукцината CR/XL в плане удержания синусового ритма и профилактики развития пароксизмов фибрилляции предсердий (ФП) [75, 76], при этом β-АБ могут быть сопоставимы с соталолом [77]. В исследовании MERIT-HF метопролол уменьшал риск появления новых случаев ФП у пациентов с ХСН и низкой ФВ ЛЖ на 48% (95% ДИ 0,37–0,75; р=0,0004) [78]. В этих исследованиях большинство пациентов получали метопролол в дозе 100–200 мг, при этом метопролол был сопоставим по безопасности с контрольной группой. Однако в Европейских клинических рекомендациях по диагностике и лечению ФП
β-АБ рассматривают в первую очередь как главный компонент пульсурежающей терапии при выборе стратегии контроля частоты желудочкового ритма (I, А).
β-АБ часто рассматриваются как препараты первой линии для контроля ЧСС, что связано с лучшим контролем ЧСС этими ЛС. Зачастую β-АБ и дилтиазем/верапамил предпочтительнее дигоксина из-за быстрого начала действия и эффективности при высоком симпатическом тонусе. Комбинированная терапия, включающая различные препараты для контроля ЧСС, в первую очередь дигоксин, должна рассматриваться, если на одном препарате не удается достигнуть целевой ЧСС [72]. В клинических рекомендациях Европейского общества кардиологов 2024 г. позиция в отношении β-АБ осталась прежней [73].
Однако в реальной клинической практике мы зачастую наблюдаем, что пациенту для контроля ЧСС при ФП назначают небольшую дозу β-АБ, например метопролола сукцинат 50 мг и дигоксин 0,25 мг. Несмотря на то что такая схема может отвечать поставленной задаче достижения целевых значений ЧСС, использование дигоксина может быть сопряжено с риском серьезных нежелательных явлений, особенно у пациентов с хронической болезнью почек и пожилых пациентов, у которых высокий риск увеличения концентрации дигоксина и развития дигоксиновой интоксикации, при этом высокая плазменная концентрация дигоксина ассоциирована с повышением смертности [72]. В такой ситуации нам представляется более рациональным использовать максимально переносимую дозу метопролола, причем в Европейских клинических рекомендациях 2018 г. допускалось использование метопролола сукцината CR/XL до 400 мг/сут. [73], и только в случае недостижения целевых значений ЧСС на максимально переносимой дозе β-АБ добавление к терапии небольших доз дигоксина (до 0,125 мг).
За амбулаторной консультацией кардиолога обратилась пациентка М., 62 лет, с жалобами на перебои в работе сердца, учащенное сердцебиение, слабость и одышку при физической нагрузке. Данные жалобы появились около 4 мес. назад. При осмотре выявлено неритмичное сердцебиение со средней ЧСС 130–140 уд/мин, дефицит пульса на лучевой артерии, АД 140/80 мм рт. ст. Признаков задержки жидкости не было. На ЭКГ: фибрилляция предсердий со средней ЧСС 130 уд/мин. От предложенной экстренной госпитализации для решения вопроса о восстановлении синусового ритма, дообследования и подбора антиаритмической терапии пациентка отказалась в пользу планового стационарного лечения. Первично на амбулаторном этапе была назначена антикоагулянтная терапия апиксабаном, а также пульсурежающая терапия метопролола сукцинатом в дозе 200 мг 1 раз в сутки (утром) наряду с рекомендациями по коррекции образа жизни и необходимости дообследования (ЭхоКГ, анализы крови, мониторирование ЭКГ по Холтеру, УЗИ вен нижних конечностей и органов малого таза). Через 3 недели пациентка пришла на повторный прием. Отмечалось значительное улучшение состояния: сохранялся неправильный ритм сердца, но учащенное сердцебиение не беспокоило, а ритм фибрилляции предсердий по данным повторного мониторирования ЭКГ по Холтеру был со среднесуточной ЧСС 86 уд/мин, увеличилась переносимость физической нагрузки. Таким образом, назначение полноценной терапевтической дозы β-АБ позволило быстро достичь нужного клинического эффекта.
Показание 6. Функциональные нарушения сердечной деятельности, сопровождаемые тахикардией. Режим дозирования 100–200 мг
Функциональные нарушения сердечной деятельности относятся к одним из проявлений тревожных расстройств. У пациентов может быть чувство тревоги, беспокойства или раздражительность, часто сопровождающееся физическими симптомами, такими как учащенное сердцебиение, повышенное потоотделение, одышка, дрожь или головокружение, некоторые люди испытывают панические атаки [79]. Липофильные β-АБ, проникая через гематоэнцефалический барьер (78% плазменной концентрации метопролола сукцината обнаруживается в ликворе [80]), обладают гипотетической способностью вызывать сонливость, галлюцинации, депрессию или нарушения либидо. Данные побочные явления терапии β-АБ не являются достоверными или часто встречающимися, а также мало изучены. Способность β-АБ к противотревожному действию – основа для достаточно частого назначения этого класса ЛС больным тревожными расстройствами, однако убедительных доказательств их пользы в этой нише нет. Так, в недавно опубликованном метаанализе β-АБ были не лучше плацебо для лечения пациентов с тревожными расстройствами, правда, включенные в метаанализ исследования были небольшими, а многие исследования были вовсе исключены из него в связи с высоким риском систематической ошибки [81].
Таким образом, β-АБ влияют на физические симптомы тревоги, но не действуют напрямую на психологические проблемы, при этом уменьшение соматических проявлений может способствовать уменьшению тревожных мыслей, связанных с этими симптомами [82]. Рациональной можно считать ту дозировку β-АБ, на которой удается достичь приемлемого значения ЧСС (по самочувствию) для данного пациента.
Показание 7. Профилактика приступов мигрени. Режим дозирования 100–200 мг
Согласно консенсусу Американского общества головной боли, пациентам у которых мигренозная боль бывает 4 и более дня в месяц или 2 и более дня при значительном снижении трудоспособности, несмотря на обезболивающую терапию, рекомендуется назначение профилактической антимигренозной терапии (триптаны, когнитивно-поведенческая психотерапия и т.д.). Профилактическую терапию также следует рассмотреть у пациентов с нетипичной аурой (гемиплегическая мигрень, мигрень стволовой аурой) и мигренью с осложнениями, например при стойкой ауре, мигренозном инсульте, мигренозном статусе, даже если частота приступов низкая. При этом пропранолол и метопролола сукцинат рассматривают как препараты с доказанной эффективностью в отношении профилактики приступов мигрени [83].
β-АБ снижают частоту приступов мигрени, модулируя возбудимость коры головного мозга от большого количества зрительных, слуховых и прочих раздражителей, а также уменьшая аномальную обработку информации корой головного мозга. При этом прямого влияния системно вводимого метопролола и других β-АБ на центральные структуры, обрабатывающие боль, включая таламус, ни в здоровой системе, ни в патологической системе у страдающих мигренью не выявлено [84].
Согласно итогам метаанализа по сравнению с плацебо, метопролол в среднем уменьшал приступы мигрени на 0,94 случая в месяц (95% ДИ от -1,4 до -0,46), при этом во всех исследованиях использовали большие дозировки метопролола (100–200 мг) [85], в связи с чем рекомендуется использовать именно такие дозировки.
Заключение
Метопролол сукцинат CR/XL – это современное, универсальное и высокотехнологичное ЛС, показывающее клиническую эффективность при различных заболеваниях, что делает его использование особенно важным в условиях коморбидности. В клинических испытаниях метопролола сукцината в терапии различных заболеваний исследователи зачастую применяли полноценные дозы, которые способствовали увеличению эффективности лечения. Более того, в ряде работ использовали режим дозирования, близкий к максимальному, при этом Беталок ЗОК всегда был сопоставим в вопросах безопасности с контрольной группой.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Скотников Антон Сергеевич – канд. мед. наук, доц. каф. медико-социальной экспертизы, неотложной и поликлинической терапии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: skotnikov_a_s@staff.sechenov.ru; ORCID: 0000-0002-8856-3638
Anton S. Skotnikov – Cand. Sci. (Med.), Assoc. Prof., Sechenov First Moscow State Medical University (Sechenov University E-mail: skotnikov_a_s@staff.sechenov.ru; ORCID: 0000-0002-8856-3638
Закиев Вадим Дмитриевич – мл. науч. сотр. лаб. клинической фармакологии и фармакотерапии, ОСП «Российский геронтологический научно-клинический центр» – ФГАОУ ВО «РНИМУ им. Н.И. Пирогова». ORCID: 0000-0003-4027-3727
Vadim D. Zakiev – Res. Assist., Russian Gerontological Scientific and Clinical Center – Pirogov Russian National Research Medical University. ORCID: 0000-0003-4027-3727
Гвоздева Анна Дмитриевна – канд. мед. наук, врач функциональной диагностики, ГКБ им. И.В. Давыдовского. ORCID: 0000-0002-5684-9842
Anna D. Gvozdeva – Cand. Sci. (Med.), Doctor of functional diagnostics, Davydovsky City Clinical Hospital. ORCID: 0000-0002-5684-9842
Лазарева Вера Викторовна – канд. мед. наук, доц. каф. фармакологии и клинической фармакологии, ФГБОУ ВО «Российский государственный социальный университет». ORCID: 0009-0003-4024-3285
Vera V. Lazareva – Cand. Sci. (Med.), Assoc. Prof., Russian State Social University. ORCID: 0009-0003-4024-3285
Поступила в редакцию: 15.10.2024
Поступила после рецензирования: 17.10.2024
Принята к публикации: 17.10.2024
Received: 15.10.2024
Revised: 17.10.2024
Accepted: 17.10.2024
Список исп. литературыСкрыть список1. Goodman & Gilman’s The Pharmacological Basis of Therapeutics, 12th Edition.
2. Кукес В.Г., Сычев Д.А., Андреев Д.А. Клиническая фармакология β-адреноблокаторов. РМЖ. 2005;14:932.
Kukes V.G., Sychev D.A., Andreev D.A. Clinical pharmacology of b-adrenoblockers. Breast cancer. Russian Medical Journal. 2005;14:932 (in Russian).
3. Sandberg A, Ragnarsson G, Jonsson UE, Sjögren J. Design of a new multiple-unit controlled-release formulation of metoprolol—metoprolol CR. Eur J Clin Pharmacol 1988;33(Suppl):S3-7. DOI: 10.1007/ BF00578405
4. Sorbets E, Steg PG, Young R. et al. CLARIFY investigators. β-blockers, calcium antagonists, and mortality in stable coronary artery disease: an international cohort study. Eur Heart J 2019;40(18):1399-1407. DOI: 10.1093/eurheartj/ehy811
5. White CM. Prevention of suboptimal beta-blocker treatment in patients with myocardial infarction. Ann Pharmacother 1999;33(10):1063-72. DOI: 10.1345/aph.18395
6. Eriksen-Volnes T, Westheim A, Gullestad L. et al. β-Blocker Doses and Heart Rate in Patients with Heart Failure: Results from the National Norwegian Heart Failure Registry. Biomed Hub 2020;5(1):9-18. DOI: 10.1159/000505474
7. McGinlay M, Straw S, Byrom-Goulthorp R et al. Suboptimal Dosing of β-Blockers in Chronic Heart Failure: A Missed Opportunity? J Cardiovasc Nurs 2022;37(6):589-594. DOI: 10.1097/JCN.00000000 00000847
8. Бубнова М.Г. Место β-адреноблокаторов в лечении сердечно-сосудистых заболеваний с позиции современных рекомендаций: в фокусе метопролола сукцинат CR/XL. CardioСоматика. 2022;13 (1):51-62. DOI: 10.17816/22217185.2022.1.201712
Bubnova M.G. Current guidelines for β-adrenoblockers use in cardiovascular diseases: focus on metoprolol succinate CR/XL: A review. Cardiosomatics. 2022;13(1):51-62. DOI: 10.17816/22217185.2022. 1.201712 (in Russian).
9. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Рос. кардиол. журн. 2020;25(3):3786.
Arterial hypertension in adults. Clinical guidelines 2020. Russian Journal of Cardiology. 2020;25(3):3786. DOI: 10.15829/1560-4071-2020-3-3786 11 (in Russian).
10. Williams B, Mancia G, Spiering W et al. ESC Scientific Document Group. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018;39(33):3021-3104. DOI: 10.1093/eurheartj/ehy339. Erratum in: Eur Heart J. 2019;40(5):475. DOI: 10.1093/eurheartj/ehy686
11. Mancia G, Kreutz R, Brunström M. et al. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension: Endorsed by the International Society of Hypertension (ISH) and the European Renal Association (ERA). J Hypertens. 2023;41(12):1874-2071. DOI: 10.1097/HJH.0000000000003480. Erratum in: J Hypertens. 2024;42(1):194. DOI: 10.1097/HJH.0000000000003621
12. McEvoy JW, McCarthy CP, Bruno RM. et al. ESC Scientific Document Group. 2024 ESC Guidelines for the management of elevated blood pressure and hypertension. Eur Heart J 2024:ehae178. DOI: 10.1093/eurheartj/ehae178
13. Wikstrand J, Warnold I, Olsson G et al. Primary prevention with metoprolol in patients with hypertension. Mortality results from the MAPHY study. JAMA. 1988;259(13):1976-82.
14. Luomanmäki K, Inkovaara J, Hartikainen M et al. Efficacy and tolerability of isradipine and metoprolol in treatment of hypertension: the Finnish Isradipine Study in Hypertension (FISH). J Cardiovasc Pharmacol 1992;20(2):296-303. DOI: 10.1097/00005344-199208000-00016
15. Morales-Salinas A, Kones R. Concerning the degradation of β-blocker use in the 2018 ESC/ESH hypertension guidelines. Eur Heart J 2019;40(25):2091. DOI: 10.1093/eurheartj/ehz125
16. Virani SS, Newby LK, Arnold SV. et al. 2023 AHA/ACC/ACCP/ ASPC/NLA/PCNA Guideline for the Management of Patients With Chronic Coronary Disease: A Report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation 2023;148(9):e9-e119.
17. Knuuti J, Wijns W, Saraste A. et al. ESC Scientific Document Group. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J 2020;41(3):407-477. DOI: 10.1093/eurheartj/ehz425. Erratum in: Eur Heart J 2020;41 (44):4242. DOI: 10.1093/eurheartj/ehz825
18. Российское кардиологическое общество (РКО) Стабильная ишемическая болезнь сердца. Клинические рекомендации 2020. Рос. кардиол. журн. 2020;25(11):4076.
Russian Society of Cardiology (RSC) 2020 Clinical practice guidelines for Stable coronary artery disease. Russian Journal of Cardiology. 2020;25(11):4076 (in Russian).
19. Ekelund LG, Olsson AG, Orö L, Rössner S. Effects of the cardioselective beta-adrenergic receptor blocking agent metoprolol in angina pectoris. Subacute study with exercise tests. Br Heart J 1976;38(2):155-61. DOI: 10.1136/hrt.38.2.155
20. Narahara KA. Double-blind comparison of once daily betaxolol versus propranolol four times daily in stable angina pectoris. Betaxolol Investigators Group. Am J Cardiol. 1990;65(9):577-82. DOI: 10.1016/0002-9149(90)91033-3
21. Frishman WH, Heiman M, Soberman J et al. Comparison of celiprolol and propranolol in stable angina pectoris. Celiprolol International Angina Study Group. Am J Cardiol 1991;67(8):665-70. DOI: 10.1016/0002-9149(91)90518-p
22. Arnman K, Rydén L. Comparison of metoprolol and verapamil in the treatment of angina pectoris. Am J Cardiol 1982;49(4):821-7. DOI: 10.1016/0002-9149(82)91964-6
23. Ahuja RC, Sinha N, Kumar RR, Saran RK. Effect of metoprolol and diltiazem on the total ischaemic burden in patients with chronic stable angina: a randomized controlled trial. Int J Cardiol 1993;41(3):191-9. DOI: 10.1016/0167-5273(93)90115-w
24. Ardissino D, Savonitto S, Egstrup K et al. Transient myocardial ischemia during daily life in rest and exertional angina pectoris and comparison of effectiveness of metoprolol versus nifedipine. Am J Cardiol 1991;67(11):946-52. DOI: 10.1016/0002-9149(91)90165-h
25. Heidenreich PA, McDonald KM, Hastie T. et al. Meta-analysis of trials comparing beta-blockers, calcium antagonists, and nitrates for stable angina. JAMA 1999;281(20):1927-36. DOI: 10.1001/jama.281.20.1927
26. Vrints C, Andreotti F, Koskinas KC. et al. ESC Scientific Document Group. 2024 ESC Guidelines for the management of chronic coronary syndromes. Eur Heart J 2024:ehae177. DOI: 10.1093/eurheartj/ehae 177
27. Bassan M. Chronic Stable Angina. N Engl J Med. 2016;375(3):292-3. DOI: 10.1056/NEJMc1605394
28. Diaz A, Bourassa MG, Guertin MC, Tardif JC. Long-term prognostic value of resting heart rate in patients with suspected or proven coronary artery disease. Eur Heart J 26(10):967-74. DOI: 10.1093/eurheartj/ ehi190
29. Fox K, Ford I, Steg PG et al. SIGNIFY Investigators. Ivabradine in stable coronary artery disease without clinical heart failure. N Engl J Med 2014;371(12):1091-9. DOI: 10.1056/NEJMoa1406430
30. Bangalore S, Steg G, Deedwania P. et al. REACH Registry Investigators. β-Blocker use and clinical outcomes in stable outpatients with and without coronary artery disease. JAMA 2012;308(13):1340-9. DOI: 10.1001/jama.2012.12559
31. Motivala AA, Parikh V, Roe M et al. Predictors, Trends, and Outcomes (Among Older Patients ≥65 Years of Age) Associated With Beta-Blocker Use in Patients With Stable Angina Undergoing Elective Percutaneous Coronary Intervention: Insights From the NCDR Registry. JACC Cardiovasc Interv 2016;9(16):1639-48. DOI: 10.1016/j.jcin.2016.05.048
32. Bangalore S, Bhatt DL, Steg PG et al. β-blockers and cardiovascular events in patients with and without myocardial infarction: post hoc analysis from the CHARISMA trial. Circ Cardiovasc Qual Outcomes 2014;7(6):872-81. DOI: 10.1161/CIRCOUTCOMES.114.001073
33. Zhang H, Yuan X, Zhang H et al. Efficacy of Long-Term β-Blocker Therapy for Secondary Prevention of Long-Term Outcomes After Coronary Artery Bypass Grafting Surgery. Circulation 2015;131(25):2194-201. DOI: 10.1161/CIRCULATIONAHA.114.014209
34. Uusitalo A, Keyriläinen O, Johnsson G. A dose-response study on metoprolol in angina pectoris. Ann Clin Res 1981;13(30):54-7
35. Толпыгина С.Н., Марцевич С.Ю. Эффективность и безопасность высоких доз метопролола пролонгированного действия при лечении пациентов со стабильным течением ишемической болезни сердца. Рациональная фармакотерапия в кардиологии. 2008;5: 46-52
Tolpygina SN, Martsevich SY. Efficacy and safety of metoprolol succinate in high doses in patients with stable course of ischemic heart disease. Ratsional’naia farmakoterapiia v kardiologii. 2008;5:46-52. DOI: 10.20996/1819-6446 (in Russian).
36. Egstrup K, Gundersen T, Härkönen R et al. The antianginal efficacy and tolerability of controlled-release metoprolol once daily: a comparison with conventional metoprolol tablets twice daily. Eur J Clin Pharmacol 1988;33(l):S45-9. DOI: 10.1007/BF00578412
37. Sandberg A, Blomqvist I, Jonsson UE et al. Pharmacokinetic and pharmacodynamic properties of a new controlled-release formulation of metoprolol: a comparison with conventional tablets. Eur J Clin Pharmacol 1988;33(Suppl.):S9-14. DOI: 10.1007/BF00578406
38. Freemantle N, Cleland J, Young P et al. beta Blockade after myocardial infarction: systematic review and meta regression analysis. BMJ 1999;318(7200):1730-7. DOI: 10.1136/bmj.318.7200.1730
39. Evans T, Stewart R. Should beta-blockers be recommended after myocardial infarction when left ventricular ejection fraction is normal? Heart 2023;109(15):1128-1129. DOI: 10.1136/heartjnl-2023-322544
40. Bangalore S, Makani H, Radford M et al. Clinical outcomes with
β-blockers for myocardial infarction: a meta-analysis of randomized trials. Am J Med 2014;127(10):939-53. DOI: 10.1016/j.amjmed. 2014. 05.032.
41. Ibanez B, Macaya C, Sánchez-Brunete V et al. Effect of early metoprolol on infarct size in ST-segment-elevation myocardial infarction patients undergoing primary percutaneous coronary intervention: the Effect of Metoprolol in Cardioprotection During an Acute Myocardial Infarction (METOCARD-CNIC) trial. Circulation 2013;128(14):1495-503. DOI: 10.1161/CIRCULATIONAHA.113.003653
42. García-Prieto J, Villena-Gutiérrez R, Gómez M. et al. Neutrophil stunning by metoprolol reduces infarct size. Nat Commun. 2017;8:14780. DOI: 10.1038/ncomms14780
43. Pizarro G, Fernández-Friera L, Fuster V et al. Long-term benefit of early pre-reperfusion metoprolol administration in patients with acute myocardial infarction: results from the METOCARD-CNIC trial (Effect of Metoprolol in Cardioprotection During an Acute Myocardial Infarction). J Am Coll Cardiol 2014;63(22):2356-62. DOI: 10.1016/j.jacc. 2014.03.014
44. Roolvink V, Ibáñez B, Ottervanger JP et al. EARLY-BAMI Investigators. Early Intravenous Beta-Blockers in Patients With ST-Segment Elevation Myocardial Infarction Before Primary Percutaneous Coronary Intervention. J Am Coll Cardiol 2016;67(23):2705-2715. DOI: 10.1016/ j.jacc.2016.03.522
45. García-Ruiz JM, Fernández-Jiménez R, García-Alvarez A. et al. Impact of the Timing of Metoprolol Administration During STEMI on Infarct Size and Ventricular Function. J Am Coll Cardiol. 2016;67(18):2093-2104. DOI: 10.1016/j.jacc.2016.02.050
46. Hoedemaker NP, Roolvink V, de Winter RJ et al. Early intravenous beta-blockers in patients undergoing primary percutaneous coronary intervention for ST-segment elevation myocardial infarction: A patient-pooled meta-analysis of randomized clinical trials. Eur Heart J Acute Cardiovasc Care 2020;9(5):469-477. DOI: 10.1177/2048872619 830609.
47. Byrne RA, Rossello X, Coughlan JJ et al. ESC Scientific Document Group. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2023;44(38):3720-3826. DOI: 10.1093/eurheartj/ehad191. Erratum in: Eur Heart J 2024;45(13):1145. DOI: 10.1093/eurheartj/ehad870.
48. Dargie HJ. Effect of carvedilol on outcome after myocardial infarction in patients with left-ventricular dysfunction: the CAPRICORN randomised trial. Lancet 2001;357(9266):1385-90. DOI: 10.1016/s0140-6736(00)04560-8.
49. Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet. 1999;353(9169):2001-7
50. Watanabe H, Ozasa N, Morimoto T et al. CAPITAL-RCT investigators. Long-term use of carvedilol in patients with ST-segment elevation myocardial infarction treated with primary percutaneous coronary intervention. PLoS One. 2018;13(8):e0199347. DOI: 10.1371/journal.pone. 0199347
51. Yndigegn T, Lindahl B, Mars K et al. REDUCE-AMI Investigators. Beta-Blockers after Myocardial Infarction and Preserved Ejection Fraction. N Engl J Med 2024;390(15):1372-1381. DOI: 10.1056/NEJM oa2401479
52. Steg PG. Routine Beta-Blockers in Secondary Prevention – On Injured Reserve. N Engl J Med 2024;390(15):1434-1436. DOI: 10.1056/NEJMe2402731
53. Silvain J, Cayla G, Ferrari E et al. ABYSS Investigators of the ACTION Study Group. Beta-Blocker Interruption or Continuation after Myocardial Infarction. N Engl J Med. 2024. DOI: 10.1056/NEJMoa2404204
54. Закиев В.Д., Воробьёва Н.М., Малая И.П., и др. Бета-адреноблокаторы при хронической сердечной недостаточности с сохранной фракцией выброса левого желудочка: возможен ли депрескрайбинг? Рациональная Фармакотерапия в Кардиологии. 2023;19 (6):607-613. DOI: 10.20996/1819-6446-2023-2987
Zakiev VD, Vorobyeva NM, Malaya IP et al. Beta-blockers in chronic heart failure with preserved left ventricular ejection fraction: is deprescribing possible? Rational Pharmacotherapy in Cardiology. 2023;19(6):607-613 (in Russian).
55. Silverman DN, Plante TB, Infeld M et al. Association of β-Blocker Use With Heart Failure Hospitalizations and Cardiovascular Disease Mortality Among Patients With Heart Failure With a Preserved Ejection Fraction: A Secondary Analysis of the TOPCAT Trial. JAMA Netw Open 2019;2(12):e1916598. DOI: 10.1001/jamanetworkopen.2019. 16598.
56. Kristensen AMD, Munkhaugen J, Halvorsen S et al. The Danish-Norwegian randomized trial on beta-blocker therapy after myocardial infarction: Design, rationale, and baseline characteristics. Eur Heart J Cardiovasc Pharmacother. 2024;10(3):175-183. DOI: 10.1093/ehjcvp/ pvad093
57. Vetrano A, Vetrano D, Pariggiano I. P208 the treatment with beta-blockers after myocardial infarction without reduced ejection fraction (REBOOT) trial. Current status. Eur Heart J Suppl. 2022;24(Suppl. C):suac012.200. DOI: 10.1093/eurheartj/suac012.200
58. URL: https://clinicaltrials.gov/study/NCT04769362
59. URL: https://clinicaltrials.gov/study/NCT05081999
60. Heidenreich PA, Bozkurt B, Aguilar D et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology. American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation 2022;145(18):e895-e1032. DOI: 10.1161/CIR.0000000000001063
61. McDonagh TA, Metra M, Adamo M et al. ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021;42(36):3599-3726. DOI: 10.1093/eurheartj/ehab368
62. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Рос. кардиол. журн. 2020;25(11):4083. DOI: 10.15829/1560-4071-2020-4083.2020
Clinical practice guidelines for Chronic heart failure. Russian Journal of Cardiology. 2020;25(11):4083 (in Russian).
63. Maddox TM, Januzzi JL Jr, Allen LA et al. 2024 ACC Expert Consensus Decision Pathway for Treatment of Heart Failure With Reduced Ejection Fraction: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol 2024;83(15):1444-1488. DOI: 10.1016/j.jacc.2023.12.024
64. McAlister FA, Wiebe N, Ezekowitz JA et al. Meta-analysis: beta-blocker dose, heart rate reduction, and death in patients with heart failure. Ann Intern Med 2009;150(11):784-94. DOI: 10.7326/0003-4819-150-11-200906020-00006.
65. Swedberg K, Komajda M, Böhm M et al. SHIFT Investigators. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomised placebo-controlled study. Lancet. 2010;376(9744):875-85. DOI: 10.1016/S0140-6736(10)61198-1. Erratum in: Lancet 2010;376(9757):1988
66. Böhm M, Borer J, Ford I et al. Heart rate at baseline influences the effect of ivabradine on cardiovascular outcomes in chronic heart failure: analysis from the SHIFT study. Clin Res Cardiol 2013;102(1):11-22. DOI: 10.1007/s00392-012-0467-8
67. Mebazaa A, Davison B, Chioncel O et al. G. Safety, tolerability and efficacy of up-titration of guideline-directed medical therapies for acute heart failure (STRONG-HF): a multinational, open-label, randomised, trial. Lancet 2022;400(10367):1938-1952. DOI: 10.1016/S0140-6736(22)02076-1
68. Čelutkienė J, Čerlinskaitė-Bajorė K, Cotter G et al. Impact of Rapid Up-Titration of Guideline-Directed Medical Therapies on Quality of Life: Insights From the STRONG-HF Trial. Circ Heart Fail 2024;17(4): e011221. DOI: 10.1161/CIRCHEARTFAILURE.123.011221
69. Smarz K, Tysarowski M, Zaborska B et al. Chronotropic Incompetence Limits Aerobic Exercise Capacity in Patients Taking Beta-Blockers: Real-Life Observation of Consecutive Patients. Healthcare (Basel) 2021;9(2):212. DOI: 10.3390/healthcare9020212
70. Palau P, Seller J, Domínguez E et al. Effect of β-Blocker Withdrawal on Functional Capacity in Heart Failure and Preserved Ejection Fraction. J Am Coll Cardiol 2021;78(21):2042-2056. DOI: 10.1016/j.jacc.2021. 08.073
71. Бокерия Л.А., Голухова Е.З., Попов С.В. и др. Российское кардио-логическое общество. Наджелудочковые тахикардии у взрослых. Клинические рекомендации 2020. Рос. кардиол. журн. 2021; 26(5):4484. DOI: 10.15829/1560-4071-2021-4
Bokeria LA, Golukhova EZ, Popov SV et al. Russian Society of Cardiology. 2020 Clinical practice guidelines for Supraventricular tachycardia in adults. Russian Journal of Cardiology 2021;26(5):4484. DOI: 10.15829/1560-4071-2021-4 (in Russian).
72. Hindricks G, Potpara T, Dagres N et al. ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42(5):373-498. DOI: 10.1093/eurheartj/ehaa612. Erratum in: Eur Heart J. 2021;42(5):507. DOI: 10.1093/eurheartj/ehaa798. Erratum in: Eur Heart J. 2021;42(5):546-547. DOI: 10.1093/eurheartj/ ehaa945. Erratum in: Eur Heart J. 2021;42(40):4194. DOI: 10.1093/ eurheartj/ehab648
73. Van Gelder IC, Rienstra M, Bunting KV et al. ESC Scientific Document Group. 2024 ESC Guidelines for the management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2024 Aug 30:ehae176. DOI: 10.1093/eurheartj/ehae176
74. Лебедев Д.С., Михайлов Е.Н., Неминущий Н.М. и др. Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. Клинические рекомендации 2020. Рос. кардиол. журн. 2021;26(7):4600.
Lebedev DS, Mikhailov EN, Neminuschiy NM et al. 2020 Clinical guidelines. Russian Journal of Cardiology. 2021;26(7):4600. DOI: 10.15829/1560-4071-2021-4600 (in Russian).
75. Kühlkamp V, Schirdewan A, Stangl K et al. Use of metoprolol CR/XL to maintain sinus rhythm after conversion from persistent atrial fibrillation: a randomized, double-blind, placebo-controlled study. J Am Coll Cardiol 2000;36(1):139-46. DOI: 10.1016/s0735-1097(00)00693-8
76. Nergårdh AK, Rosenqvist M, Nordlander R, Frick M. Maintenance of sinus rhythm with metoprolol CR initiated before cardioversion and repeated cardioversion of atrial fibrillation: a randomized double-blind placebo-controlled study. Eur Heart J 2007;28(11):1351-7. DOI: 10.1093/eurheartj/ehl544
77. Capucci A, Botto G, Molon G et al. DAPHNE Study Investigators. The Drug And Pace Health cliNical Evaluation (DAPHNE) study: a randomized trial comparing sotalol versus beta-blockers to treat symptomatic atrial fibrillation in patients with brady-tachycardia syndrome implanted with an antitachycardia pacemaker. Am Heart J 2008; 156(2):373.e1-8. DOI: 10.1016/j.ahj.2008.01.032
78. van Veldhuisen DJ, Aass H, El Allaf D et al. MERIT-HF Study Group. Presence and development of atrial fibrillation in chronic heart failure. Experiences from the MERIT-HF Study. Eur J Heart Fail. 2006;8(5):539-46. DOI: 10.1016/j.ejheart.2006.01.015
79. Tuma AH, Maser JD (Eds.). (1985). Anxiety and the Anxiety Disorders (1st ed.). Routledge.
80. Инструкция по медицинскому применению препарата Беталок ЗОК.
Instructions for the medical use of the drug Betalok ZOK (in Russian).
81. Archer C, Wiles N, Kessler D et al. Beta-blockers for the treatment of anxiety disorders: A systematic review and meta-analysis. J Affect Disord 2024;368:90-99. DOI: 10.1016/j.jad.2024.09.068
82. MacCormack JK, Armstrong-Carter EL, Gaudier-Diaz MM et al. β-Adrenergic Contributions to Emotion and Physiology During an Acute Psychosocial Stressor. Psychosom Med 2021 Nov-Dec 01;83(9):959-968. DOI: 10.1097/PSY.0000000000001009
83. Ailani J, Burch RC, Robbins MS. Board of Directors of the American Headache Society. The American Headache Society Consensus Statement: Update on integrating new migraine treatments into clinical practice. Headache 2021;61(7):1021-1039. DOI: 10.1111/head.14153
84. Hebestreit JM, May A. The enigma of site of action of migraine preventives: no effect of metoprolol on trigeminal pain processing in patients and healthy controls. J Headache Pain 2017;18(1):116. DOI: 10.1186/s10194-017-0827-x
85. Jackson JL, Cogbill E, Santana-Davila R et al. A Comparative Effectiveness Meta-Analysis of Drugs for the Prophylaxis of Migraine Headache. PLoS One 2015;10(7):e0130733. DOI: 10.1371/journal. pone.0130733
29 ноября 2024
Количество просмотров: 443

