Клинический разбор в общей медицине №10 2024
1 NMRC of Oncology named after N.N. Petrov of MoH of Russia, St. Petersburg, Russia;
2 City Clinical Oncology Dispensary, St. Petersburg, Russia;
3 Saint Petersburg University, St. Petersburg, Russia;
4 Mechnikov North-Western State Medical University, St. Petersburg, Russia
kozjavin-nikita@mail.ru
Abstract
This clinical case about of left ventricular systolic dysfunction with chronic heart failure associated with targeted therapy with trastuzumab and pertuzumab in a patient suffering from HER-2 positive breast cancer. The exogenous phosphocreatine (“Neoton”) was added to the standard treatment of chronic heart failure with sacubitril/valsartan, bisoprolol, spironolactone or empagliflozin. It made possible to achieve an additional increase in the left ventricular ejection fraction and preventing interruption of targeted therapy and continue it as before.
Keywords: LV systolic dysfunction, cancer therapy-related cardiac dysfunction, exogenous phosphocreatine, trastuzumab, pertuzumab.
For citation: Kozyavin N.A., Mureiko E.A., Gluzman M.I., Nikiforov V.S. A clinical case of treatment of systolic dysfunction of the left ventricle during targeted antitumor therapy with HER-2 blockers. Clinical review for general practice. 2024; 5 (10): 84–88 (In Russ.). DOI: 10.47407/kr2024.5.10.00500
Систолическая дисфункция левого желудочка (СДЛЖ) и возникающая из-за нее хроническая сердечная недостаточность (ХСН) – одни из наиболее серьезных кардиоваскулярных осложнений лекарственной противоопухолевой терапии [1]. К основным противоопухолевым препаратам, вызывающим СДЛЖ и ХСН, относят антрациклины (доксорубицин, эпирубицин), блокаторы HER-2 (трастузумаб, пертузумаб), блокаторы VEGF (сорафениб, ленватиниб, акситиниб и др.) и ингибиторы BRAF и MEK (кобиметиниб, дабрафениб, траметиниб) [2].
Согласно современным клиническим рекомендациям, все пациенты перед проведением потенциально кардиотоксичного системного лекарственного противоопухолевого лечения подлежат стратификации риска возникновения кардиоваскулярных осложнений [3]. Базовая оценка риска кардиоваскулярных осложнений включает в себя сбор анамнеза (наличие ССЗ, предшествующее противоопухолевое лечение, факторы риска ССЗ), физикальное обследование, выполнение ряда лабораторных (общий анализ крови, уровень HbA1c, липидограмма) и инструментальных (ЭКГ, ЭхоКГ в 2D- и 3D-режимах с измерением глобальной продольной деформации левого желудочка – GLS) исследований [4]. При этом ценность представляет определение GLS, так как в исследованиях показано, что этот показатель является четким ранним предиктором дальнейшего снижения фракции выброса (ФВ) ЛЖ при использовании трастузумаба [5]. Выявленные факторы риска суммируют по определенной методике и формируют интегральный показатель риска возникновения кардиоваскулярных осложнений у определенного пациента до начала противоопухолевой лекарственной терапии. Больным с высоким и очень высоким риском развития кардиоваскулярных осложнений до начала таргетной терапии показана консультация кардиолога с целью выбора стратегии снижения этого риска. Однако такой подход не всегда позволяет прогнозировать возникновение кардиоваскулярных осложнений, которые случаются и у пациентов с исходно низким риском.
СДЛЖ и ХСН на фоне таргетной терапии HER-2 блокаторами в отличие от антрациклин-индуцированной не носит дозозависимого характера. Кроме того, ее возникновение, как правило, происходит непосредственно на фоне таргетной терапии HER-2 блокаторами, а не после окончания лечения. [6]. СДЛЖ, возникающая на фоне применения трастузумаба, часто обратима в течение нескольких месяцев после отмены препарата [7]. При этом возможно повторное назначение трастузумаба на фоне кардиопротективной терапии и тщательного мониторинга [8].
Основным инструментальным методом мониторирования систолической функции остается трансторакальная ЭхоКГ (с измерением ФВ ЛЖ по методу Симпсона в 2D-режиме, а при технической возможности в 3D-режиме с измерением глобальной продольной деформации левого желудочка – GLS). У пациентов, получающих неоадъювантную или адъювантную анти-HER-2 таргетную терапию, выполнение ЭхоКГ рекомендуется каждые 3 месяца и в течение 12 месяцев после лечения. При метастатическом раке предполагается длительное применение анти-HER2 препаратов и рекомендуется проводить ЭхоКГ также каждые 3 месяца в течение первого года лечения, а если изменений нет, интервал наблюдения может быть сокращен до 1 раза в 6 месяцев.
При этом клинические рекомендации допускают, что у пациентов с метастатическим раком и высоким/очень высоким риском кардиоваскулярных осложнений можно рассмотреть вопрос о более частом мониторинге. А у пациентов с ранним HER2+ раком молочной железы (МЖ) и низким риском без признаков кардиотоксичности после 3 месяцев наблюдения может быть рассмотрена возможность сокращения мониторинга до 1 раза в 4 месяца [2].
СДЛЖ может протекать как бессимптомно, так и сопровождаться клиническими проявлениями ХСН разной степени выраженности [2]. При бессимптомной СДЛЖ выделяют следующие варианты течения: тяжелое (новое снижение ФВ ЛЖ <40%), умеренное (новое снижение ФВ ЛЖ на ≥10% до ФВ ЛЖ 40–49%, или новое снижение ФВ ЛЖ <10% до ФВ ЛЖ 40–49% + новое относительное снижение GLS на 15% по сравнению с исходным уровнем, или новый рост сердечных биомаркеров), легкое течение (ФВ ЛЖ ≥50% + новое относительное снижение GLS на 15% по сравнению с исходным уровнем и/или новый рост сердечных биомаркеров) [1, 2].
К вариантам симптомной СДЛЖ (ХСН) относят: очень тяжелую, требующую инотропной поддержки, механической поддержки кровообращения или трансплантации; тяжелую, требующую госпитализации; умеренную, когда показана амбулаторная интенсификация терапии, диуретическая терапия; легкую, когда интенсификация терапии не требуется [2].
 В качестве мер по первичной профилактике развития СДЛЖ у пациентов с высоким/очень высоким риском развития кардиоваскулярных осложнений используется кардиопротективная терапия [9]. Имеются данные о наличии кардиопротективных свойств некоторых бета-адреноблокаторов (β-АБ), ингибиторов ангиотензин-превращающего фермента (иАПФ), блокаторов рецепторов ангиотензина II типа (БРА), антагонистов альдостерона (АА), ингибиторов натрий-глюкозного котранспортера 2-го типа (SGLT2) [18]. Это позволило рассматривать подобную терапию не только для лечения ХСН, но и как средство первичной медикаментозной профилактики систолической дисфункции ЛЖ при назначении кардиотоксичной противоопухолевой терапии [10, 11]. В исследовании M. Guglin и соавт., включавшем 468 больных HER2-позитивным раком МЖ, назначение как карведилола, так и лизиноприла снижало риск трастузумаб-индуцированной кардиотоксичности у пациентов, ранее пролеченных антрациклинами, а также частоту прерывания терапии трастузумабом [12]. При этом в исследовании MANTICOR 101-Breast, посвященном предупреждению трастузумаб-ассоциированного ремоделирования ЛЖ у больных HER2-позитивным раком МЖ, бисопролол и периндоприл не оказывали влияния на изменение конечного диастолического объема ЛЖ. Тем не менее профилактическое назначение обоих препаратов уменьшало связанное с трастузумабом снижение фракции выброса ЛЖ (в группе бисопролола достоверно) и позволяло сократить количество случаев прерывания противоопухолевой терапии, обусловленное дисфункцией сердца [13]. Согласно ретроспективному исследованию, длительное использование β-АБ у больных раком МЖ в процессе лечения антрациклинами и трастузумабом способствовало уменьшению риска развития сердечной недостаточности в течение 5-летнего периода наблюдения [14]. В небольшом проспективном плацебо-контролируемом исследовании спиронолактон оказывал защитное влияние не только на систолическую, но и на диастолическую функцию ЛЖ у больных раком МЖ с исходно нормальной фракцией выброса ЛЖ [15].
В качестве мер по первичной профилактике развития СДЛЖ у пациентов с высоким/очень высоким риском развития кардиоваскулярных осложнений используется кардиопротективная терапия [9]. Имеются данные о наличии кардиопротективных свойств некоторых бета-адреноблокаторов (β-АБ), ингибиторов ангиотензин-превращающего фермента (иАПФ), блокаторов рецепторов ангиотензина II типа (БРА), антагонистов альдостерона (АА), ингибиторов натрий-глюкозного котранспортера 2-го типа (SGLT2) [18]. Это позволило рассматривать подобную терапию не только для лечения ХСН, но и как средство первичной медикаментозной профилактики систолической дисфункции ЛЖ при назначении кардиотоксичной противоопухолевой терапии [10, 11]. В исследовании M. Guglin и соавт., включавшем 468 больных HER2-позитивным раком МЖ, назначение как карведилола, так и лизиноприла снижало риск трастузумаб-индуцированной кардиотоксичности у пациентов, ранее пролеченных антрациклинами, а также частоту прерывания терапии трастузумабом [12]. При этом в исследовании MANTICOR 101-Breast, посвященном предупреждению трастузумаб-ассоциированного ремоделирования ЛЖ у больных HER2-позитивным раком МЖ, бисопролол и периндоприл не оказывали влияния на изменение конечного диастолического объема ЛЖ. Тем не менее профилактическое назначение обоих препаратов уменьшало связанное с трастузумабом снижение фракции выброса ЛЖ (в группе бисопролола достоверно) и позволяло сократить количество случаев прерывания противоопухолевой терапии, обусловленное дисфункцией сердца [13]. Согласно ретроспективному исследованию, длительное использование β-АБ у больных раком МЖ в процессе лечения антрациклинами и трастузумабом способствовало уменьшению риска развития сердечной недостаточности в течение 5-летнего периода наблюдения [14]. В небольшом проспективном плацебо-контролируемом исследовании спиронолактон оказывал защитное влияние не только на систолическую, но и на диастолическую функцию ЛЖ у больных раком МЖ с исходно нормальной фракцией выброса ЛЖ [15].
Особый интерес представляет применение ингибиторов SGLT2 у пациентов, получающих системное лекарственное противоопухолевое лечение. Препараты канаглифлозин, дапаглифлозин, эмпаглифлозин обладают уникальным механизмом действия, имеют кардиопротекторные и противоопухолевые свойства. В недавних ретроспективных исследованиях было доказано, что у пациентов, получающих в ходе терапии онкологического заболевания ингибиторы SGLT2, регистрировалось меньшеее количество сердечных приступов, реже встречалась тяжелая форма сердечной недостаточности, требующая госпитализации, были выше показатели общей выживаемости [18].
Вместе с тем существенным и ограничивающим применение β-АБ, иАПФ, БРА, АА и SGLT2 фактором является артериальная гипотензия, особенно у больных с исходно нормальным или сниженным артериальным давлением.
Поэтому очевидно, что арсенал лекарственных средств, используемых как с целью первичной профилактики, так и лечения систолической дисфункции ЛЖ при таргетной анти-HER-2 терапии ограничен. Внедрение в клиническую практику препаратов, оказывающих кардиопротективное действие, с иными механизмами действия крайне актуально. Одним из таких препаратов является экзогенный фосфокреатин (Неотон), кардиопротективный эффект которого связан с поддержанием структурной целостности клеточных мембран, ресинтезом АТФ в митохондриях, обеспечением транспорта энергии к местам ее потребления [16, 20–22]. В недавних исследованиях, в том числе метаанализе, продемонстрирована эффективность Неотона как кардиопротектора при антракциклиновой химиотерапии [19].
Применение препарата Неотон для лечения СДЛЖ, возникшей у пациентки при проведении анти-HER-2 терапии, описано в клиническом случае.
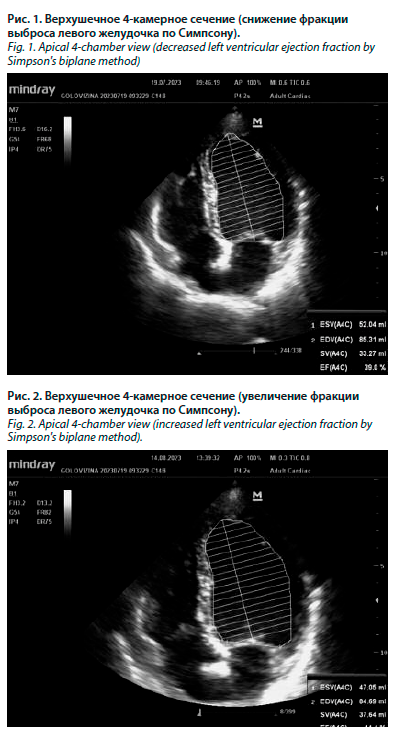
Больная, 55 лет, с установленным диагнозом рака левой МЖ, которой проводилась таргетная терапия трастузумабом и пертузумабом. Риск возникновения систолической дисфункции до начала таргетной терапии оценивался как низкий. В процессе таргетной терапии проводилось мониторирование систолической функции ЛЖ. В мае 2023 г., через 3 месяца после начала таргетной терапии, выявлена сердечная дисфункция, связанная с терапией HER-2 блокаторами (снижение ФВ ЛЖ по Симпсону с 60% до 34%). Из клинических симптомов больную беспокоили значительное снижение толерантности к физической нагрузке, слабость, повышенная утомляемость. Больной инициирована стандартная терапия ХСН (сакубитрил/валсартан, бисопролол, спиронолактон, эмпаглифлозин) с постепенным титрованием доз до максимально переносимых. Также по решению врачебного консилиума была временно приостановлена таргетная терапия. Через 1 месяц при ЭхоКГ отмечалась незначительная положительная динамика в виде роста ФВ ЛЖ по Симпсону до 39%. При обращении в июле 2023 г. в НМИЦ онкологии им. Н.Н. Петрова для консультации больной было выполнено повторное ЭхоКГ исследование, ФВ ЛЖ по Симпсону составляла 39% (рис. 1).
Учитывая отсутствие положительной динамики, к стандартной терапии был добавлен Неотон в дозе 2 г в 50 мл физраствора внутривенно капельно ежедневно. При этом безальтернативность таргетной анти-HER-2 терапии в длительной перспективе (у больной метастатический рак МЖ) диктовала необходимость ее возобновления в ближайшее время, так как прерывание сопряжено с возможностью прогрессирования онкологического процесса. Коллегиально было принято решение о возобновлении монотерапии трастузумабом на фоне стандартной таблетированной терапии ХСН и внутривенных инфузий Неотона.
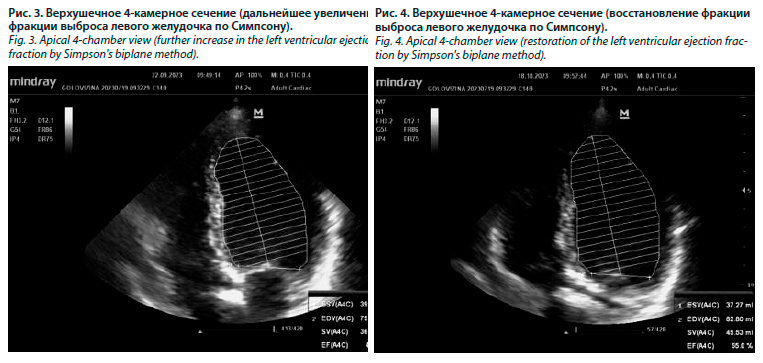
При первом контрольном обследовании через 1 месяц, в августе 2023 г., после цикла таргетной терапии трастузумабом на фоне комбинированной кардиотропной терапии отмечалась положительная динамика и рост ФВ ЛЖ по Симпсону до 44% (рис. 2). Также больная отмечала улучшение переносимости физических нагрузок, уменьшение слабости.
При обследовании в сентябре 2023 г. после очередного введения трастузумаба ФВ ЛЖ по Симпсону выросла до 47 % (рис. 3).
Очередное введение трастузумаба на фоне продолжающейся кардиотропной терапии проведено в октябре 2023 г. При этом эхокардиографический контроль показал восстановление систолической функции ЛЖ, при измерении ФВ ЛЖ по Симпсону составила 55% (рис. 4). Больная отмечала купирование клинических симптомов ХСН.
Стоит отметить, что в исследовании K. Khoury, проведенном в 2021 г., была продемонстрирована возможность безопасного проведения таргетной анти-HER2 терапии пациенткам с раком МЖ и умеренным снижением ФВ ЛЖ (от 40 до 50%) на фоне кардиотропной терапии [17].
В представленном клиническом случае показано, что добавление к стандартной терапии ХСН Неотона оказало дополнительное положительное влияние на течение ХСН, позволило ускорить восстановление систолической функции ЛЖ, купировать клинические проявления ХСН. В результате появилась возможность скорее возобновить таргетную терапию у больной с метастатическим HER2-позитивным РМЖ, что напрямую связано с прогнозом течения онкологического заболевания. Неотон за счет своего универсального механизма действия перспективен для лечения больных с систолической дисфункцией/сердечной недостаточностью на фоне кардиотоксичной таргетной терапии. При этом таргетная терапия у таких больных при комбинированной кардиотропной терапии возможна и безопасна.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Благодарности. Авторы могут выразить благодарности людям и организациям, способствовавшим публикации статьи в журнале, но не являющимся ее авторами.
Thanks. The authors can express their gratitude to the people and organizations who contributed to the publication of the article in the journal, but who are not its authors.
Информация об авторах
Information about the authors
Козявин Никита Александрович – зав. КДЦ ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова» Минздрава России. E-mail: kozjavin-nikita@mail.ru; ORCID: 0000-0003-2759-4817; SPIN: 2023-1598
Nikita A. Kozjavin – Head of the Consultative and Diagnostic Center, National Medical Research Center of Oncology. E-mail: kozjavin-nikita@mail.ru; ORCID: 0000-0003-2759-4817; SPIN: 2023-1598
Мурейко Екатерина Андреевна – врач-онколог ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова» Минздрава России. Е-mail: emureyko@mail.ru; ORCID: 0000-0003-1626-082X; eLibrary SPIN: 2023-1598
Ekaterina A. Mureyko – Resident Oncologist, Petrov National Medical Research Center of Oncology. Е-mail:emureyko@mail.ru; ORCID: https://orcid.org/0000-0003-1626-082X; eLibrary SPIN: 2023-1598
Глузман Марк Игоревич – канд. мед. наук, доц. каф. онкологии; зав. химиотерапевтическим отделением (противоопухолевой лекарственной терапии) №12. Санкт-Петербург. Е-mail: lok2008@list.ru; ORCID: 0000-0002-8965-8364; eLibrary SPIN: 4229-2201
Gluzman Mark Igorevich – Cand. Sci. (Med.), Assoc. Prof., St. Petersburg State University; head of the chemotherapy department (antitumor drug therapy) No. 12, City Clinical Oncology Dispensary.
Е-mail: lok2008@list.ru; ORCID 0000–0002–8965–8364;
SPIN 4229–2201; AuthorID 853558
Никифоров Виктор Сергеевич – д-р мед. наук, проф. каф. функциональной диагностики, декан мед.-биол. факультета ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России. E-mail: victor-nikiforov@yandex.ru; ORCID: 0000-0001-7862-0937; eLibrary SPIN: 4652-0981
Viktor S. Nikiforov – Dr. Sci. (Med.), Mechnikov North-Western State Medical University. E-mail: victor-nikiforov@yandex.ru.
ORCID: 0000-0001-7862-0937; eLibrary SPIN: 4652-0981
Поступила в редакцию: 25.09.2024
Поступила после рецензирования: 02.10.2024
Принята к публикации: 10.10.2024
Received: 25.09.2024
Revised: 02.10.2024
Accepted: 10.10.2024
Клинический разбор в общей медицине №10 2024
Клинический случай лечения систолической дисфункции левого желудочка при проведении таргетной противоопухолевой терапии HER-2 блокаторами
Номера страниц в выпуске:84-88
Аннотация
В статье описан клинический случай систолической дисфункции левого желудочка с хронической сердечной недостаточностью, связанной с проведением таргетной терапии трастузумабом и пертузумабом, у пациентки, страдающей HER-2-позитивным раком молочной железы. Добавление экзогенного фосфокреатина (препарата Неотон) к стандартной терапии хронической сердечной недостаточности сакубитрилом/валсартаном, бисопрололом, спиронолактоном и эмпаглифлозином позволило достичь дополнительного увеличения фракции выброса левого желудочка, предотвратить прерывание таргетной терапии и продолжить ее в прежнем режиме.
Ключевые слова: систолическая дисфункция левого желудочка, сердечная дисфункция, связанная с терапией рака, экзогенный фосфокреатин, трастузумаб, пертузумаб, фракция выброса, хроническая сердечная недостаточность.
Для цитирования: Козявин Н.А., Мурейко Е.А., Глузман М.И., Никифоров В.С. Клинический случай лечения систолической дисфункции левого желудочка при проведении таргетной противоопухолевой терапии HER-2 блокаторами. Клинический разбор в общей медицине. 2024; 5 (10): 84–88. DOI: 10.47407/kr2024.5.10.00500
В статье описан клинический случай систолической дисфункции левого желудочка с хронической сердечной недостаточностью, связанной с проведением таргетной терапии трастузумабом и пертузумабом, у пациентки, страдающей HER-2-позитивным раком молочной железы. Добавление экзогенного фосфокреатина (препарата Неотон) к стандартной терапии хронической сердечной недостаточности сакубитрилом/валсартаном, бисопрололом, спиронолактоном и эмпаглифлозином позволило достичь дополнительного увеличения фракции выброса левого желудочка, предотвратить прерывание таргетной терапии и продолжить ее в прежнем режиме.
Ключевые слова: систолическая дисфункция левого желудочка, сердечная дисфункция, связанная с терапией рака, экзогенный фосфокреатин, трастузумаб, пертузумаб, фракция выброса, хроническая сердечная недостаточность.
Для цитирования: Козявин Н.А., Мурейко Е.А., Глузман М.И., Никифоров В.С. Клинический случай лечения систолической дисфункции левого желудочка при проведении таргетной противоопухолевой терапии HER-2 блокаторами. Клинический разбор в общей медицине. 2024; 5 (10): 84–88. DOI: 10.47407/kr2024.5.10.00500
A clinical case of treatment HER-2 blockers cancer therapy-related cardiac dysfunction
N.A. Kozyavin1, E.A. Mureyko1, M.I. Gluzman2,3, V.S. Nikiforov41 NMRC of Oncology named after N.N. Petrov of MoH of Russia, St. Petersburg, Russia;
2 City Clinical Oncology Dispensary, St. Petersburg, Russia;
3 Saint Petersburg University, St. Petersburg, Russia;
4 Mechnikov North-Western State Medical University, St. Petersburg, Russia
kozjavin-nikita@mail.ru
Abstract
This clinical case about of left ventricular systolic dysfunction with chronic heart failure associated with targeted therapy with trastuzumab and pertuzumab in a patient suffering from HER-2 positive breast cancer. The exogenous phosphocreatine (“Neoton”) was added to the standard treatment of chronic heart failure with sacubitril/valsartan, bisoprolol, spironolactone or empagliflozin. It made possible to achieve an additional increase in the left ventricular ejection fraction and preventing interruption of targeted therapy and continue it as before.
Keywords: LV systolic dysfunction, cancer therapy-related cardiac dysfunction, exogenous phosphocreatine, trastuzumab, pertuzumab.
For citation: Kozyavin N.A., Mureiko E.A., Gluzman M.I., Nikiforov V.S. A clinical case of treatment of systolic dysfunction of the left ventricle during targeted antitumor therapy with HER-2 blockers. Clinical review for general practice. 2024; 5 (10): 84–88 (In Russ.). DOI: 10.47407/kr2024.5.10.00500
Систолическая дисфункция левого желудочка (СДЛЖ) и возникающая из-за нее хроническая сердечная недостаточность (ХСН) – одни из наиболее серьезных кардиоваскулярных осложнений лекарственной противоопухолевой терапии [1]. К основным противоопухолевым препаратам, вызывающим СДЛЖ и ХСН, относят антрациклины (доксорубицин, эпирубицин), блокаторы HER-2 (трастузумаб, пертузумаб), блокаторы VEGF (сорафениб, ленватиниб, акситиниб и др.) и ингибиторы BRAF и MEK (кобиметиниб, дабрафениб, траметиниб) [2].
Согласно современным клиническим рекомендациям, все пациенты перед проведением потенциально кардиотоксичного системного лекарственного противоопухолевого лечения подлежат стратификации риска возникновения кардиоваскулярных осложнений [3]. Базовая оценка риска кардиоваскулярных осложнений включает в себя сбор анамнеза (наличие ССЗ, предшествующее противоопухолевое лечение, факторы риска ССЗ), физикальное обследование, выполнение ряда лабораторных (общий анализ крови, уровень HbA1c, липидограмма) и инструментальных (ЭКГ, ЭхоКГ в 2D- и 3D-режимах с измерением глобальной продольной деформации левого желудочка – GLS) исследований [4]. При этом ценность представляет определение GLS, так как в исследованиях показано, что этот показатель является четким ранним предиктором дальнейшего снижения фракции выброса (ФВ) ЛЖ при использовании трастузумаба [5]. Выявленные факторы риска суммируют по определенной методике и формируют интегральный показатель риска возникновения кардиоваскулярных осложнений у определенного пациента до начала противоопухолевой лекарственной терапии. Больным с высоким и очень высоким риском развития кардиоваскулярных осложнений до начала таргетной терапии показана консультация кардиолога с целью выбора стратегии снижения этого риска. Однако такой подход не всегда позволяет прогнозировать возникновение кардиоваскулярных осложнений, которые случаются и у пациентов с исходно низким риском.
СДЛЖ и ХСН на фоне таргетной терапии HER-2 блокаторами в отличие от антрациклин-индуцированной не носит дозозависимого характера. Кроме того, ее возникновение, как правило, происходит непосредственно на фоне таргетной терапии HER-2 блокаторами, а не после окончания лечения. [6]. СДЛЖ, возникающая на фоне применения трастузумаба, часто обратима в течение нескольких месяцев после отмены препарата [7]. При этом возможно повторное назначение трастузумаба на фоне кардиопротективной терапии и тщательного мониторинга [8].
Основным инструментальным методом мониторирования систолической функции остается трансторакальная ЭхоКГ (с измерением ФВ ЛЖ по методу Симпсона в 2D-режиме, а при технической возможности в 3D-режиме с измерением глобальной продольной деформации левого желудочка – GLS). У пациентов, получающих неоадъювантную или адъювантную анти-HER-2 таргетную терапию, выполнение ЭхоКГ рекомендуется каждые 3 месяца и в течение 12 месяцев после лечения. При метастатическом раке предполагается длительное применение анти-HER2 препаратов и рекомендуется проводить ЭхоКГ также каждые 3 месяца в течение первого года лечения, а если изменений нет, интервал наблюдения может быть сокращен до 1 раза в 6 месяцев.
При этом клинические рекомендации допускают, что у пациентов с метастатическим раком и высоким/очень высоким риском кардиоваскулярных осложнений можно рассмотреть вопрос о более частом мониторинге. А у пациентов с ранним HER2+ раком молочной железы (МЖ) и низким риском без признаков кардиотоксичности после 3 месяцев наблюдения может быть рассмотрена возможность сокращения мониторинга до 1 раза в 4 месяца [2].
СДЛЖ может протекать как бессимптомно, так и сопровождаться клиническими проявлениями ХСН разной степени выраженности [2]. При бессимптомной СДЛЖ выделяют следующие варианты течения: тяжелое (новое снижение ФВ ЛЖ <40%), умеренное (новое снижение ФВ ЛЖ на ≥10% до ФВ ЛЖ 40–49%, или новое снижение ФВ ЛЖ <10% до ФВ ЛЖ 40–49% + новое относительное снижение GLS на 15% по сравнению с исходным уровнем, или новый рост сердечных биомаркеров), легкое течение (ФВ ЛЖ ≥50% + новое относительное снижение GLS на 15% по сравнению с исходным уровнем и/или новый рост сердечных биомаркеров) [1, 2].
К вариантам симптомной СДЛЖ (ХСН) относят: очень тяжелую, требующую инотропной поддержки, механической поддержки кровообращения или трансплантации; тяжелую, требующую госпитализации; умеренную, когда показана амбулаторная интенсификация терапии, диуретическая терапия; легкую, когда интенсификация терапии не требуется [2].
 В качестве мер по первичной профилактике развития СДЛЖ у пациентов с высоким/очень высоким риском развития кардиоваскулярных осложнений используется кардиопротективная терапия [9]. Имеются данные о наличии кардиопротективных свойств некоторых бета-адреноблокаторов (β-АБ), ингибиторов ангиотензин-превращающего фермента (иАПФ), блокаторов рецепторов ангиотензина II типа (БРА), антагонистов альдостерона (АА), ингибиторов натрий-глюкозного котранспортера 2-го типа (SGLT2) [18]. Это позволило рассматривать подобную терапию не только для лечения ХСН, но и как средство первичной медикаментозной профилактики систолической дисфункции ЛЖ при назначении кардиотоксичной противоопухолевой терапии [10, 11]. В исследовании M. Guglin и соавт., включавшем 468 больных HER2-позитивным раком МЖ, назначение как карведилола, так и лизиноприла снижало риск трастузумаб-индуцированной кардиотоксичности у пациентов, ранее пролеченных антрациклинами, а также частоту прерывания терапии трастузумабом [12]. При этом в исследовании MANTICOR 101-Breast, посвященном предупреждению трастузумаб-ассоциированного ремоделирования ЛЖ у больных HER2-позитивным раком МЖ, бисопролол и периндоприл не оказывали влияния на изменение конечного диастолического объема ЛЖ. Тем не менее профилактическое назначение обоих препаратов уменьшало связанное с трастузумабом снижение фракции выброса ЛЖ (в группе бисопролола достоверно) и позволяло сократить количество случаев прерывания противоопухолевой терапии, обусловленное дисфункцией сердца [13]. Согласно ретроспективному исследованию, длительное использование β-АБ у больных раком МЖ в процессе лечения антрациклинами и трастузумабом способствовало уменьшению риска развития сердечной недостаточности в течение 5-летнего периода наблюдения [14]. В небольшом проспективном плацебо-контролируемом исследовании спиронолактон оказывал защитное влияние не только на систолическую, но и на диастолическую функцию ЛЖ у больных раком МЖ с исходно нормальной фракцией выброса ЛЖ [15].
В качестве мер по первичной профилактике развития СДЛЖ у пациентов с высоким/очень высоким риском развития кардиоваскулярных осложнений используется кардиопротективная терапия [9]. Имеются данные о наличии кардиопротективных свойств некоторых бета-адреноблокаторов (β-АБ), ингибиторов ангиотензин-превращающего фермента (иАПФ), блокаторов рецепторов ангиотензина II типа (БРА), антагонистов альдостерона (АА), ингибиторов натрий-глюкозного котранспортера 2-го типа (SGLT2) [18]. Это позволило рассматривать подобную терапию не только для лечения ХСН, но и как средство первичной медикаментозной профилактики систолической дисфункции ЛЖ при назначении кардиотоксичной противоопухолевой терапии [10, 11]. В исследовании M. Guglin и соавт., включавшем 468 больных HER2-позитивным раком МЖ, назначение как карведилола, так и лизиноприла снижало риск трастузумаб-индуцированной кардиотоксичности у пациентов, ранее пролеченных антрациклинами, а также частоту прерывания терапии трастузумабом [12]. При этом в исследовании MANTICOR 101-Breast, посвященном предупреждению трастузумаб-ассоциированного ремоделирования ЛЖ у больных HER2-позитивным раком МЖ, бисопролол и периндоприл не оказывали влияния на изменение конечного диастолического объема ЛЖ. Тем не менее профилактическое назначение обоих препаратов уменьшало связанное с трастузумабом снижение фракции выброса ЛЖ (в группе бисопролола достоверно) и позволяло сократить количество случаев прерывания противоопухолевой терапии, обусловленное дисфункцией сердца [13]. Согласно ретроспективному исследованию, длительное использование β-АБ у больных раком МЖ в процессе лечения антрациклинами и трастузумабом способствовало уменьшению риска развития сердечной недостаточности в течение 5-летнего периода наблюдения [14]. В небольшом проспективном плацебо-контролируемом исследовании спиронолактон оказывал защитное влияние не только на систолическую, но и на диастолическую функцию ЛЖ у больных раком МЖ с исходно нормальной фракцией выброса ЛЖ [15].Особый интерес представляет применение ингибиторов SGLT2 у пациентов, получающих системное лекарственное противоопухолевое лечение. Препараты канаглифлозин, дапаглифлозин, эмпаглифлозин обладают уникальным механизмом действия, имеют кардиопротекторные и противоопухолевые свойства. В недавних ретроспективных исследованиях было доказано, что у пациентов, получающих в ходе терапии онкологического заболевания ингибиторы SGLT2, регистрировалось меньшеее количество сердечных приступов, реже встречалась тяжелая форма сердечной недостаточности, требующая госпитализации, были выше показатели общей выживаемости [18].
Вместе с тем существенным и ограничивающим применение β-АБ, иАПФ, БРА, АА и SGLT2 фактором является артериальная гипотензия, особенно у больных с исходно нормальным или сниженным артериальным давлением.
Поэтому очевидно, что арсенал лекарственных средств, используемых как с целью первичной профилактики, так и лечения систолической дисфункции ЛЖ при таргетной анти-HER-2 терапии ограничен. Внедрение в клиническую практику препаратов, оказывающих кардиопротективное действие, с иными механизмами действия крайне актуально. Одним из таких препаратов является экзогенный фосфокреатин (Неотон), кардиопротективный эффект которого связан с поддержанием структурной целостности клеточных мембран, ресинтезом АТФ в митохондриях, обеспечением транспорта энергии к местам ее потребления [16, 20–22]. В недавних исследованиях, в том числе метаанализе, продемонстрирована эффективность Неотона как кардиопротектора при антракциклиновой химиотерапии [19].
Применение препарата Неотон для лечения СДЛЖ, возникшей у пациентки при проведении анти-HER-2 терапии, описано в клиническом случае.
Больная, 55 лет, с установленным диагнозом рака левой МЖ, которой проводилась таргетная терапия трастузумабом и пертузумабом. Риск возникновения систолической дисфункции до начала таргетной терапии оценивался как низкий. В процессе таргетной терапии проводилось мониторирование систолической функции ЛЖ. В мае 2023 г., через 3 месяца после начала таргетной терапии, выявлена сердечная дисфункция, связанная с терапией HER-2 блокаторами (снижение ФВ ЛЖ по Симпсону с 60% до 34%). Из клинических симптомов больную беспокоили значительное снижение толерантности к физической нагрузке, слабость, повышенная утомляемость. Больной инициирована стандартная терапия ХСН (сакубитрил/валсартан, бисопролол, спиронолактон, эмпаглифлозин) с постепенным титрованием доз до максимально переносимых. Также по решению врачебного консилиума была временно приостановлена таргетная терапия. Через 1 месяц при ЭхоКГ отмечалась незначительная положительная динамика в виде роста ФВ ЛЖ по Симпсону до 39%. При обращении в июле 2023 г. в НМИЦ онкологии им. Н.Н. Петрова для консультации больной было выполнено повторное ЭхоКГ исследование, ФВ ЛЖ по Симпсону составляла 39% (рис. 1).
Учитывая отсутствие положительной динамики, к стандартной терапии был добавлен Неотон в дозе 2 г в 50 мл физраствора внутривенно капельно ежедневно. При этом безальтернативность таргетной анти-HER-2 терапии в длительной перспективе (у больной метастатический рак МЖ) диктовала необходимость ее возобновления в ближайшее время, так как прерывание сопряжено с возможностью прогрессирования онкологического процесса. Коллегиально было принято решение о возобновлении монотерапии трастузумабом на фоне стандартной таблетированной терапии ХСН и внутривенных инфузий Неотона.
При первом контрольном обследовании через 1 месяц, в августе 2023 г., после цикла таргетной терапии трастузумабом на фоне комбинированной кардиотропной терапии отмечалась положительная динамика и рост ФВ ЛЖ по Симпсону до 44% (рис. 2). Также больная отмечала улучшение переносимости физических нагрузок, уменьшение слабости.
При обследовании в сентябре 2023 г. после очередного введения трастузумаба ФВ ЛЖ по Симпсону выросла до 47 % (рис. 3).

Очередное введение трастузумаба на фоне продолжающейся кардиотропной терапии проведено в октябре 2023 г. При этом эхокардиографический контроль показал восстановление систолической функции ЛЖ, при измерении ФВ ЛЖ по Симпсону составила 55% (рис. 4). Больная отмечала купирование клинических симптомов ХСН.
Стоит отметить, что в исследовании K. Khoury, проведенном в 2021 г., была продемонстрирована возможность безопасного проведения таргетной анти-HER2 терапии пациенткам с раком МЖ и умеренным снижением ФВ ЛЖ (от 40 до 50%) на фоне кардиотропной терапии [17].
В представленном клиническом случае показано, что добавление к стандартной терапии ХСН Неотона оказало дополнительное положительное влияние на течение ХСН, позволило ускорить восстановление систолической функции ЛЖ, купировать клинические проявления ХСН. В результате появилась возможность скорее возобновить таргетную терапию у больной с метастатическим HER2-позитивным РМЖ, что напрямую связано с прогнозом течения онкологического заболевания. Неотон за счет своего универсального механизма действия перспективен для лечения больных с систолической дисфункцией/сердечной недостаточностью на фоне кардиотоксичной таргетной терапии. При этом таргетная терапия у таких больных при комбинированной кардиотропной терапии возможна и безопасна.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Благодарности. Авторы могут выразить благодарности людям и организациям, способствовавшим публикации статьи в журнале, но не являющимся ее авторами.
Thanks. The authors can express their gratitude to the people and organizations who contributed to the publication of the article in the journal, but who are not its authors.
Информация об авторах
Information about the authors
Козявин Никита Александрович – зав. КДЦ ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова» Минздрава России. E-mail: kozjavin-nikita@mail.ru; ORCID: 0000-0003-2759-4817; SPIN: 2023-1598
Nikita A. Kozjavin – Head of the Consultative and Diagnostic Center, National Medical Research Center of Oncology. E-mail: kozjavin-nikita@mail.ru; ORCID: 0000-0003-2759-4817; SPIN: 2023-1598
Мурейко Екатерина Андреевна – врач-онколог ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова» Минздрава России. Е-mail: emureyko@mail.ru; ORCID: 0000-0003-1626-082X; eLibrary SPIN: 2023-1598
Ekaterina A. Mureyko – Resident Oncologist, Petrov National Medical Research Center of Oncology. Е-mail:emureyko@mail.ru; ORCID: https://orcid.org/0000-0003-1626-082X; eLibrary SPIN: 2023-1598
Глузман Марк Игоревич – канд. мед. наук, доц. каф. онкологии; зав. химиотерапевтическим отделением (противоопухолевой лекарственной терапии) №12. Санкт-Петербург. Е-mail: lok2008@list.ru; ORCID: 0000-0002-8965-8364; eLibrary SPIN: 4229-2201
Gluzman Mark Igorevich – Cand. Sci. (Med.), Assoc. Prof., St. Petersburg State University; head of the chemotherapy department (antitumor drug therapy) No. 12, City Clinical Oncology Dispensary.
Е-mail: lok2008@list.ru; ORCID 0000–0002–8965–8364;
SPIN 4229–2201; AuthorID 853558
Никифоров Виктор Сергеевич – д-р мед. наук, проф. каф. функциональной диагностики, декан мед.-биол. факультета ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России. E-mail: victor-nikiforov@yandex.ru; ORCID: 0000-0001-7862-0937; eLibrary SPIN: 4652-0981
Viktor S. Nikiforov – Dr. Sci. (Med.), Mechnikov North-Western State Medical University. E-mail: victor-nikiforov@yandex.ru.
ORCID: 0000-0001-7862-0937; eLibrary SPIN: 4652-0981
Поступила в редакцию: 25.09.2024
Поступила после рецензирования: 02.10.2024
Принята к публикации: 10.10.2024
Received: 25.09.2024
Revised: 02.10.2024
Accepted: 10.10.2024
Список исп. литературыСкрыть список1. Couch LS, López-Fernández T, Lyon AR. The Ten Commandments‘ for the 2022 European Society of Cardiology guidelines on cardio-oncology. European heart journal. 2023;44(1):10-11. DOI: 10.1093/eurheartj/ehac666
2. Lyon AR, Lopez-Fernandez T et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). European heart journal. Cardiovascular Imaging. 2022;23:10: 333-465.
3. Akpek M, Ozdogru I, Sahin O et al. Protective effects of spironolactone against anthracycline-induced cardiomyopathy. European journal of heart failure. 2015;17(1):81-89. DOI: 10.1002/ejhf.196
4. Lyon AR, Dent S, Stanway S et al. Baseline cardiovascular risk assessment in cancer patients scheduled to receive cardiotoxic cancer therapies: a position statement and new risk assessment tools from the Cardio-Oncology Study Group of the Heart Failure Association of the European Society of Cardiology in collaboration with the International Cardio-Oncology Society. European journal of heart failure. 2020;22(11):1945-1960. DOI: 10.1002/ejhf.1920
5. Negishi K, Negishi T, Hare JL et al. Independent and incremental value of deformation indices for prediction of trastuzumab-induced cardiotoxicity. J Am Soc Echocardiogr. 2013;26(5):493-498. DOI: 10.1016/j.echo.2013.02.008
6. Procter M, Suter TM, de Azambuja E et al. Longer-term assessment of trastuzumab-related cardiac adverse events in the Herceptin Adjuvant (HERA) trial. Journal of clinical oncology: official journal of the American Society of Clinical Oncology. 2010;28(21):3422-3428. DOI: 10.1200/jco.2009.26.0463
7. Ewer MS, Vooletich MT, Durand JB et al. Reversibility of trastuzumab-related cardiotoxicity: new insights based on clinical course and response to medical treatment. Journal of clinical oncology: official journal of the American Society of Clinical Oncology. 2005;23(31): 7820-7826. DOI: 10.1200/jco.2005.13.300
8. Curigliano G, Lenihan D, Fradley M. et al. Management of cardiac disease in cancer patients throughout oncological treatment: ESMO consensus recommendations. Annals of oncology: official journal of the European Society for Medical Oncology. 2020;31(2):171-190. DOI: 10.1016/j.annonc.2019.10.023
9. Чазова И.Е., Агеев Ф.Т., Аксенова А.В. и др. Евразийские клинические рекомендации по диагностике, профилактике и лечению сердечно-сосудистых осложнений при противоопухолевой терапии. ЕКЖ. 2022;1(37). URL: https://cyberleninka.ru/article/n/evraziyskie-klinicheskie-rekomendatsii-po-diagnostike-profilaktike-i-lecheniyu-serdechno-sosudistyh-oslozhneniy-pri (дата обращения: 15.03.2024).
Chazova I.E., Ageev F.T., Aksenova A.V. et al. Eurasian clinical guidelines for the diagnosis, prevention and treatment of cardiovascular complications in antitumor therapy. ECJ. 2022;1(37). URL: https://cyberleninka.ru/article/n/evraziyskie-klinicheskie-rekomendatsii-po-diagnostike-profilaktike-i-lecheniyu-serdechno-sosudistyh-oslozhneniy-pri (date of application: 03/15/2024) (in Russian).
10. Zamorano JL, Lancellotti P, Rodriguez Muñoz D. et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC) [published correction appears in Eur Heart J. 2016 Dec 24;:]. Eur Heart J. 2016;37(36):2768-2801. https://doi.org/10.1093/eurheartj/ ehw211
11. Виценя М.В., Агеев Ф.Т., Гиляров М.Ю. и др. Злокачественные опухоли: Практические рекомендации RUSSCO. 2020;10:41.
Vitsenya M.V., Ageev F.T., Gilyarov M.Yu. et al. Malignant tumors: Practical recommendations RUSSCO. 2020;10:41. https://rosoncoweb.ru/standarts/RUSSCO/2020/2020-41.pdf (in Russian).
12. Guglin M, Krischer J, Tamura R et al. Randomized Trial of Lisinopril Versus Carvedilol to Prevent Trastuzumab Cardiotoxicity in Patients With Breast Cancer. Journal of the American College of Cardiology. 2019;73(22):2859-2868. DOI: 10.1016/j.jacc.2019.03.495
13. Pituskin E, Mackey JR, Koshman S et al. Multidisciplinary Approach to Novel Therapies in Cardio-Oncology Research (MANTICORE 101-Breast): A Randomized Trial for the Prevention of Trastuzumab-Associated Cardiotoxicity. Journal of clinical oncology: official journal of the American Society of Clinical Oncology. 2017;35(8):870-877. DOI: 10.1200/jco.2016.68.7830.
14. Seicean S, Seicean A, Alan N et al. Cardioprotective effect of β-adrenoceptor blockade in patients with breast cancer undergoing chemotherapy: follow-up study of heart failure. Circulation Heart failure 2013;6(3):420-426. DOI: 10.1161/circheartfailure.112.000055
15. Akpek M, Ozdogru I, Sahin O. et al. Protective effects of spironolactone against anthracycline-induced cardiomyopathy. Eur J Heart Fail. 2015;17(1):81-89. DOI: 10.1002/ejhf.196
16. Strumia E, Pelliccia F, D’Ambrosio G. Creatine phosphate: pharmacological and clinical perspectives. Advances in therapy. 2012;29(2):99-123. DOI: 10.1007/s12325-011-0091-4
17. Khoury K, Lynce F, Barac A et al. Long-term follow-up assessment of cardiac safety in SAFE-HEaRt, a clinical trial evaluating the use of HER2-targeted therapies in patients with breast cancer and compromised heart function. Breast Cancer Res Treat. 2021;185(3):863-868. DOI: 10.1007/s10549-020-06053-y
18. Dabour MS, George MY, Daniel MR, Blaes AH, Zordoky BN. The Cardioprotective and Anticancer Effects of SGLT2 Inhibitors: JACC: CardioOncology State-of-the-Art Review. JACC CardioOncol. 2024 Mar 12;6(2):159-182. DOI: 10.1016/j.jaccao.2024.01.007. PMID: 38774006; PMCID: PMC11103046.
19. CHEN Jian-kang, WANG Chun-guang Meta analysis of the protective effect of phosphocreatine on cardiotoxicity induced by anthracycline. DOI: 10.19347/j.cnki.2096-1413.201834003
20. Wang_nRCT_cardiotoxicity in ondo_300pts_2017_ch, Analysis of cardiotoxicity of Anthracyclines and relevant proposals for their clinical use. DOI: 10.3969/j.issn.1005-8982.2017.12.021
21. Li_RCT_cardiotoxicity in ondo_70pts_2-13_ch, Prevention of doxorubicin-associated cardiotoxicity by creatine phosphate sodium, 10.3969/j.issn.1672-4992.2013.03.50
22. Lin_RCT_cardiotoxicity in ondo_120pts_2010_ch, A Study of the Improvement of Quality of Life of 120 Patients With Malignant Tumors Treated with Doxorubicin-Containing Chemotherapy with Phosphonate Creatine for Injection. DOI: 10.3969/j.issn.1006-3765.2010.06.056.

