Клинический разбор в общей медицине №1 2025
Клинический разбор в общей медицине №1 2025
Гепато- и кардиотоксичность азитромицина: «мифологема» или реальная угроза (критический обзор)
Номера страниц в выпуске:6-13
Аннотация
Как показывает многолетний опыт клинического применения макролидов, эти препараты характеризуются наибольшей безопасностью. На фоне их применения нежелательные лекарственные реакции развиваются крайне редко. Одним из наиболее часто назначаемых антибиотиков, особенно в амбулаторной практике, остается азитромицин. В рамках настоящего обзора представлен критический анализ имеющихся данных о возможных нежелательных лекарственных реакциях на антибиотик со стороны печени и сердечно-сосудистой системы.
Ключевые слова: азитромицин, безопасность, гепатотоксичность, кардиотоксичность.
Для цитирования: Синопальников А.И. Гепато- и кардиотоксичность азитромицина: «мифологема» или реальная угроза (критический обзор). Клинический разбор в общей медицине. 2025; 6 (1): 6–13. DOI: 10.47407/kr2024.6.1.00543
Как показывает многолетний опыт клинического применения макролидов, эти препараты характеризуются наибольшей безопасностью. На фоне их применения нежелательные лекарственные реакции развиваются крайне редко. Одним из наиболее часто назначаемых антибиотиков, особенно в амбулаторной практике, остается азитромицин. В рамках настоящего обзора представлен критический анализ имеющихся данных о возможных нежелательных лекарственных реакциях на антибиотик со стороны печени и сердечно-сосудистой системы.
Ключевые слова: азитромицин, безопасность, гепатотоксичность, кардиотоксичность.
Для цитирования: Синопальников А.И. Гепато- и кардиотоксичность азитромицина: «мифологема» или реальная угроза (критический обзор). Клинический разбор в общей медицине. 2025; 6 (1): 6–13. DOI: 10.47407/kr2024.6.1.00543
Review
Alexander I. Sinopalnikov
Russian Medical Academy of Continuous Professional Education, Moscow, Russia
aisyn@list.ru
Abstract
As shown by long experience of the clinical use of macrolides, these drugs are characterized by the highest safety. Adverse drug reactions (ADRs) associated with the use of macrolides are extremely rare. Azithromycin remains one of the most prescribed antibiotics, especially in outpatient practice. The review presents critical analysis of the available data on possible ADRs to the antibiotic related to the liver and cardiovascular system.
Keywords: azithromycin, safety, hepatotoxicity, cardiotoxicity.
For citation: Sinopalnikov A.I. Hepatotoxicity and cardiotoxicity of azithromycin: a “mythologeme” or real threat (critical review). Clinical review for general practice. 2025; 6 (1): 6–13 (In Russ.). DOI: 10.47407/kr2024.6.1.00543
Многодесятилетний опыт клинического применения макролидов позволил утвердиться во мнении, что данный класс антибиотиков относится к числу наиболее безопасных, а возникающие при их назначении нежелательные лекарственные реакции (НЛР) предсказуемы и относительно редки [8].
С появлением «новых» макролидов (азитромицин, кларитромицин), характеризующихся среди прочего улучшенной фармакокинетикой, их популярность еще более возросла. Так, только в США азитромицин в 2017 г. назначался более 12 млн раз [10]. Неслучайно эксперты Всемирной организации здравоохранения оценивают азитромицин с учетом его доказанной эффективности и приемлемого профиля безопасности как один из самых привлекательных антибиотиков, подходящих для широкого применения любой национальной системой здравоохранения [11].
Впрочем, следует признать, что годы повсеместного и успешного применения азитромицина по широкому кругу показаний периодически «омрачаются» дискуссиями о его профиле безопасности, где в фокусе внимания чаще всего оказывались гепато- и кардиотоксичность препарата.
Тем не менее собственная гепатотоксичность, как и для подавляющего большинства лекарственных средств других групп, в той или иной степени свойственна всем макролидам, в связи с чем их применение в высоких дозах и/или длительное использование может быть сопряжено с риском развития нарушений функции печени. Здесь важно подчеркнуть, что потенциальная гепатотоксичность макролидов корреспондирует со способностью антибиотиков взаимодействовать с CYP3A4 (цитохромом P450 3A4) – одним из наиболее важных ферментов, участвующих в метаболизме ксенобиотиков в организме человека. При этом выделяют сильные ингибиторы CYP3A4 (олеандомицин, эритромицин, кларитромицин), макролиды, оказывающие умеренное воздействие на CYP3A4 (мидекамицин, джозамицин, рокситромицин) и, наконец, макролиды, не влияющие на активность CYP3A4 (азитромицин, спирамицин, диритромицин) [17]. Препараты первой группы метаболизируются в печени при участии фермента CYP3A4 с образованием реактивных нитрозоалкановых форм, которые связываются с цитохромом Р-450. Образование комплекса «матаболит – активный центр фермента» приводит к необратимому угнетению активности цитохрома Р-450. В противоположность этому, препараты третьей группы (азитромицин и др.) вообще не образуют комплексов с цитохромом Р-450. Эти различия весьма важны для понимания риска ЛПП, поскольку гепатотоксическое действие, связываемое с образованием реактивных метаболитов и лекарственных взаимодействий, наиболее демонстративно у эритромицина и, напротив, в минимальной степени выражено у азитромицина, спирамицина и диритромицина [18].
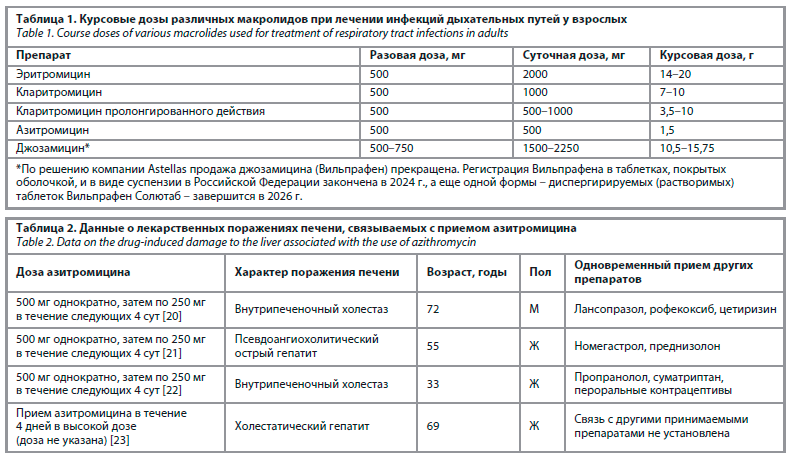
Помимо незначительного метаболизма и малого риска лекарственных взаимодействий азитромицин в сравнении с другими макролидами характеризуется значительно меньшей курсовой (кумулятивной) дозой (табл. 1), что также следует принимать во внимание, поскольку, как уже говорилось ранее, увеличение суммарной дозы препарата сопровождается повышением риска гепатотоксичности [19].
Низкий потенциал гепатотоксичности азитромицина находит свое подтверждение и в масштабных фармакоэпидемиологических исследованиях, в ходе которых описываются лишь единичные случаи ЛПП у взрослых, связываемые с приемом препарата (табл. 2), тогда как у детей в крайне редких случаях имеют место эпизоды бессимптомного повышения активности печеночных ферментов [24].
В 2003 г. в США была создана специальная структура (Drug-Induced Liver Injury Network, DILIN), призванная учитывать и анализировать все случаи ЛПП, выявляемые в лечебных учреждениях страны [25]. Изучение беспрецедентной по масштабам и строгости соблюдения диагностических критериев базы данных, полученных указанной сетевой структурой в период с сентября 2004 г. по май 2013 г. (в этот период азитромицин был наиболее востребованным антибиотиком на американском рынке, и за указанное 10-летие было выписана более 200 млн рецептов на этот препарат), позволило выявить 18 случаев ЛПП (72% женщины, средний возраст – 37 лет), вероятно или определенно связываемых с приемом азитромицина [26]. Общими симптомами у этих больных были желтуха, боль в животе, тошнота и/или кожный зуд. У 16 пациентов патологические изменения в сывороточной гепатограмме были впервые выявлены спустя 14 дней после прекращения приема азитромицина (в диапазоне от 9 до 20 дней). Средняя продолжительность лечения азитромицином составила 4 дня (от 2 до 7 дней). У 10 пациентов ЛПП трактовались как гепатоцеллюлярные, у 6 – как холестатические, а у двух – как смешанные. Средние пиковые значения аланинаминотрансферазы в крови составляли 2127 МЕ/л, щелочной фосфатазы – 481 МЕ/л, а общего билирубина – 9,2 мг/дл. Гистологические исследования печени обнаружили у нескольких пациентов дуктопению и веноокклюзионные изменения. Через 6 мес 8 пациентов выздоровели, у 4 пациентов были подтверждены хронические повреждения печени, 1 пациент умер и еще 1 пациенту была проведена трансплантация печени (здесь важно подчеркнуть, что 2 последних больных были старше 60 лет, один из которых страдал алкогольным гепатитом, а другой – неалкогольным стеатогепатитом). Таким образом, клинически/прогностически значимые ЛПП, вероятно или определенно связываемые с приемом азитромицина, развивались с частотой менее 1 случая на 10 млн назначений препарата.
Впрочем, несмотря на исключительную редкость азитромицин-ассоциированных ЛПП, контрольно-разрешительный орган США (Food and Drug Administration, FDA) на основе указанных выше данных о безопасности азитромицина принял решение о внесении соответствующих предостережений в инструкцию по его медицинскому применению (www.fda.gov).
Вскоре после этого последовало и соответствующее обращение Центра экспертизы безопасности лекарственных средств Минздрава России, в котором, в частности, указывалось, что «В послерегистрационном периоде (применения азитромицина) появились сообщения о развитии у больных гепатита, некроза печени, печеночной недостаточности, в некоторых случаях приводящих к летальному исходу». К сожалению, лишенное конкретики и соответствующей аргументации, данное обращение породило настороженное, если не негативное отношение к препарату среди немалого числа практикующих врачей, дополнявшееся спекулятивными публичными выступлениями и публикациями ряда представителей экспертного сообщества. Однако со временем дискуссии по поводу очевидно «гипертрофированной» гепатотоксичности азитромицина сошли на нет, а с момента регистрации препарата в Российской Федерации службой Фармаконадзора не было зарегистрировано ни одного случая азитромицин-ассоциированных ЛПП; в базе Росздравнадзора сведения о подобных НЛР на территории нашей страны также отсутствовали [27].
Интервал QT представляет собой временной промежуток от начала волны Q и до окончания волны T на электрокардиограмме, отражающий процессы деполяризации и реполяризации миокарда желудочков сердца. Основываясь на результатах многочисленных популяционных исследований, принято считать, что нормальная продолжительность интервала QT у мужчин и женщин составляет <430 мс и <450 мс соответственно1 [30]. В тех случаях, когда интервал QT превышает 500 мс (или удлиняется по сравнению с исходными значениями более чем на 60 мс), возрастает риск развития сердечно-сосудистых событий, включая нарушения сердечного ритма и внезапную смерть [31].
Удлинение интервала QT способно стать причиной так называемых ранних последеполяризаций (early after depolarizations), при достижении которыми порога потенциала действия может развиться полиморфная желудочковая тахикардия TdP и, как следствие, фибрилляция желудочков, остановка сердца и внезапная смерть [32]. Впрочем, предсказание развития тахикардии TdP, основывающееся исключительно на факте удлинения интервала QT, не является надежным.
Ятрогенное удлинение интервала QT связывают с ингибированием гена hERG, кодирующего быстрый компонент так называемых замедленных выпрямляющих калиевых каналов (IKR). По IKR осуществляется отток калия из миоцитов в процессе реполяризации желудочков. В случаях ингибирования гена hERG функционирование IKR нарушается, результатом чего становится внутриклеточная аккумуляция калия и задержка реполяризации желудочков, а значит, и удлинение интервала QT [33].
Согласно регуляторным документам FDA, удлинение интервала QT на 10 мс имеет клиническое значение, на 20 мс – потенциальный проаритмогенный эффект, а в случаях превышения 500 мс (или удлинения интервала QT на >60 мс по сравнению с исходным уровнем) настоятельно рекомендуется прекращение дальнейшего приема лекарственного препарата, «уличенного» в кардиотоксичности [34].
Вероятно, первое упоминание об удлинении интервала QT на фоне приема азитромицина принадлежит E.V. Granowitz и соавт. [35], описавших пациента, одновременно с антибиотиком принимавшего дизопирамид. Позднее появились сообщения об удлинении интервала QT и развитии тахикардии TdP при приеме азитромицина больными с врожденным синдромом удлиненного QT-интервала, хронической сердечной недостаточностью, гипокалиемией и др. [36, 37].
На фоне описания отдельных случаев кардиотоксичности азитромицина, в том числе применявшегося одновременно с лекарственными средствами с проаритмогенной активностью, как правило, у больных с хронической сердечной недостаточностью, гипокалиемией, врожденным синдромом удлиненного QT-интервала, синдромом слабости синусового узла и т.д. [38–44], как гром среди ясного неба («out of the blue») прозвучали выводы ретроспективного когортного исследования W.A. Ray и соавт. [45]. В исследование были включены пациенты в возрасте 30–74 лет, получавшие в период с 1992 по 2006 г. антибактериальную терапию – амоксициллин, ципро-флоксацин, левофлоксацин и азитромицин (последний в рамках стандартного 5-дневного режима дозирования); в качестве отдельной группы контроля наблюдались пациенты, не получавшие за указанный период какой-либо антибактериальной терапии.
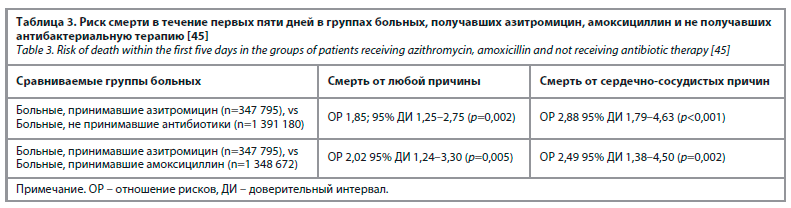
Авторами было показано, что в течение первых пяти дней среди пациентов, получавших азитромицин, смертность от любой причины (преимущественно сердечно-сосудистой) оказалась достоверно выше по сравнению с пациентами, не принимавшими антибиотики (табл. 3) [45]. Схожими оказались и различия в сравнении с больными, получавшими амоксициллин, ципрофлоксацин, но не левофлоксацин. Проведенные авторами цитируемого исследования расчеты позволили сделать вывод о том, что абсолютный риск смерти от любой причины в случаях 5-дневной терапии ази-тромицином составляет 85,2/1 млн курсов антибиотикотерапии, тогда как в случаях назначения амоксициллина – 31,5/1 млн (см. табл. 3).
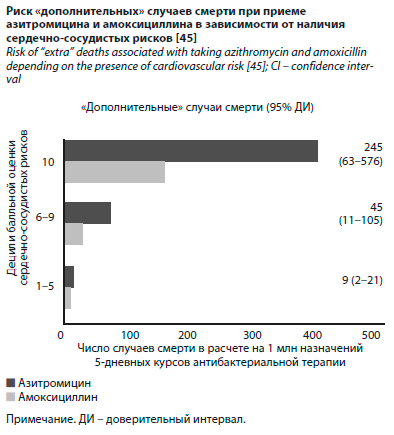 Не менее важным представлялось и заключение о «дополнительных» случаях смерти при приеме азитромицина по сравнению с амоксициллином в зависимости от наличия или отсутствия известных сердечно-сосудистых рисков (см. рисунок). Так, в группе низкого риска это было 9 случаев на 1 млн назначений (или 1 случай на 111 111 назначений), в группе умеренного риска – 45 случаев/1 млн (или 1 случай на 21 277 назначений), в группе высокого сердечно-сосудистого риска – 245 случаев/1 млн (или 1 случай на 4082 назначения).
Не менее важным представлялось и заключение о «дополнительных» случаях смерти при приеме азитромицина по сравнению с амоксициллином в зависимости от наличия или отсутствия известных сердечно-сосудистых рисков (см. рисунок). Так, в группе низкого риска это было 9 случаев на 1 млн назначений (или 1 случай на 111 111 назначений), в группе умеренного риска – 45 случаев/1 млн (или 1 случай на 21 277 назначений), в группе высокого сердечно-сосудистого риска – 245 случаев/1 млн (или 1 случай на 4082 назначения).
Впрочем, выводы данного исследования не свободны от контраргументов. Поскольку исследование имело ретроспективный когортный дизайн, это не позволяло надежно определить причинно-следственную связь смертельных исходов с применением того или иного антибиотика. Отсутствовали и адекватные сведения о показаниях к назначению антибактериальной терапии. Группа больных, получавших азитромицин по ряду показателей, не была эквивалентна группе больных, получавших амоксициллин. В цитируемом исследовании класс макролидов был представлен только азитромицином, между тем хорошо известно, что другие макролиды (например, эритромицин, кларитромицин) характеризуются более демонстративной кардиотоксичностью [46, 47].
В связи с обеспокоенностью по поводу удлинения интервала QT и сообщениями об увеличении риска сердечно-сосудистой смертности среди больных, принимающих азитромицин, FDA в период с 2011 по 2013 г. внесло ряд изменений в инструкцию по применению препарата2, рекомендуя не назначать азитромицин пациентам с известными факторами риска желудочковых аритмий [48].
Казалось бы, результаты исследования W.A. Ray и соавт. [45] следовало рассматривать в контексте с рядом других исследований, но, к сожалению, выводы последних оказались диаметрально противоположными. Так, если в некоторых из них также сообщалось, что при приеме азитромицина наблюдается увеличение числа летальных исходов вследствие сердечно-сосудистых причин, включая фатальные нарушения сердечного ритма или инфаркт миокарда [49–51], то в других подобная причинно-следственная связь не подтверждалась [52–54].
В стремлении преодолеть подобные разногласия FDA в 2014 г. обратилось к компании-производителю азитромицина с просьбой провести дополнительное эпидемиологическое исследование для установления реальной или мнимой связи применения азитромицина со смертностью, основной целью которого была бы оценка относительного и абсолютного риска сердечно-сосудистой смертности и внезапной сердечной смерти в течение первых 5 дней и последующих 6–10 дней после назначения азитромицина пациентам в возрасте от 30 до 74 лет.
В связи с указанным обращением было инициировано беспрецедентное по свои масштабам ретроспективное когортное исследование, в которое вошли
7 824 681 пациент в возрасте от 30 до 74 лет, принимавших азитромицин (1 736 976) или амоксициллин
(6 087 705), проживавших в Северной и Южной Калифорнии, США. Исследование предполагало полный учет обращений и лекарственных назначений за период с 1 января 1998 г. по 31 декабря 2014 г. Критериями невключения являлись отсутствие врачебного рецепта на антибиотик, назначение более одного вида исследуемых антибиотиков в течение 10 дней, госпитализация или проживание в доме престарелых, а также наличие серьезного заболевания. Риск сердечно-сосудистой смертности, связываемый с приемом азитромицина или амоксициллина, рассчитывался после учета сопутствующих факторов с использованием шкалы предрасположенности. Полученные фактические данные были проанализированы с 1 декабря 2016 г. по 30 марта 2020 г. [55].
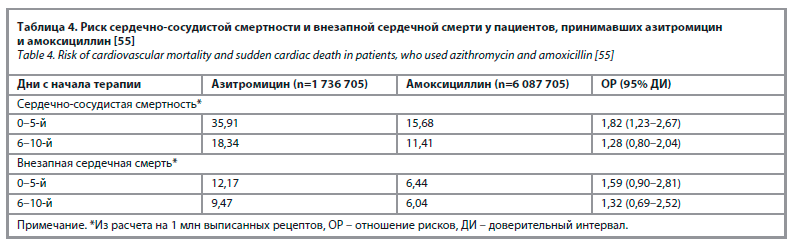
Полученные результаты свидетельствовали, что по сравнению с пациентами, принимавшими амоксициллин, пациенты, получавшие азитромицин, демонстрировали значительно более высокий риск сердечно-сосудистой смерти (ОР 1,82; 95% ДИ 1,23–2,67), но не внезапной сердечной смерти (ОР 1,59; 95% ДИ 0,90–2,81) в течение ближайших 5 дней с даты приема первой дозы антибиотика. Однако в последующие 6–10 дней различия между сравниваемыми группами больных были статистически незначимыми (табл. 4).
Продемонстрированная в исследовании связь приема азитромицина с сердечно-сосудистой смертностью оказалась аналогична той, что была ранее представлена в исследовании американской популяции W.A. Ray и соавт. [45], но отличается от результатов, полученных, например, при обследовании представительной выборки населения Дании H. Svanstrom и соавт. [52]. При изучении результатов этих исследований важно отметить ключевые различия между исследуемыми группами пациентов. Так, частота сердечно-сосудистых смертей в исследовании J.G. Zaroff и соавт. [55] составила 35,9 смертей на 1 млн назначений азитромицина, что оказалось ниже, чем у W.A. Ray и соавт. [45] (85,2 /1 млн), но выше, чем у H. Svanstrom и соавт. [52] (15,4 /млн). Эти различия отчасти могут быть объяснены исходным несоответствием популяционных характеристик участников того или иного исследования, но также и отличиями в выявлении и классификации случаев смерти от сердечно-сосудистых причин.
Публикация результатов исследования J.G. Zaroff и соавт. [55] (июнь 2020 г.), состоявшаяся на пике первой волны пандемии COVID-19, когда все внимание мирового врачебного сообщества было сосредоточено на поиске эффективных методов лечения и профилактики новой коронавирусной инфекции, прошла относительно незаметно. Примечательно, что практически в это же время была опубликована статья F. Gautret и соавт. [56], в которой авторы свидетельствовали, что применение гидроксихлорохина сопровождается значимым снижением вирусной нагрузки/эрадикацией SARS-CoV2 и этот противовирусный эффект существенно усиливается при одновременном назначении азитромицина. И несмотря на то, что данное нерандомизированное исследование было выполнено на ограниченном числе пациентов (14 больных принимали гидроксихлорохин, 6 – гидроксихлорохин и азитромицин), а также затем последовавшую негативную реакцию на саму статью3 президента Международного общества по антимикробной химиотерапии (International Society of Antimicrobial Chemotherapy, ISAC) Andreas Voss4, поддержанного главными редакторами журналов «International Journal of Antimicrobial Agents» (IJAA) и «Journal of Global Antimicrobial Resistance» (JGAR), азитромицин был возведен в ранг «кандидатных» противокоронавирусных препаратов, что открыло дорогу его широкому и бесконтрольному назначению5.
Впрочем, одновременно с экстраординарным ростом популярности азитромицина в лечении больных c COVID-19 [57, 58] росла и обеспокоенность его необоснованно «агрессивным» применением, среди возможных негативных последствий которого упоминалось и ожидаемое увеличение НЛР, в том числе и кардиотоксических эффектов [59]. Особое внимание при этом привлекалось к тому факту, что азитромицин поначалу нередко назначался в комбинации с гидроксихлорохином, также «уличенным» в кардиотоксичности [60].
И первые исследования, направленные на изучение риска развития кардиотоксичности азитромицина у больных c COVID-19, подтверждали обоснованность этого беспокойства. Поначалу речь шла об исследованиях с ограниченной мощностью выборки, в ходе которых удалось подтвердить уже хорошо известный факт о влиянии азитромицина на процесс реполяризации миокарда, при этом в наибольшей степени удлинение интервала QTc (до 23 мс), у отдельных больных превышавшее 500 мс, наблюдалось при комбинированном назначении гидроксихлорохина и азитромицина [61, 62]. В последующем стали доступны и исследования по оценке сердечно-сосудистой смертности в группах больных с COVID-19, получавших гидроксихлорохин, азитромицин или комбинацию препаратов. Так, в исследовании E.S. Rosenberg и соавт. [63] у госпитализированных больных, получавших комбинированную терапию гидроксихлорохином и азитромицином, вероятность остановки сердца была выше (ОР – 2,13) по сравнению с больными, принимавшими только гидроксихлорохин (ОР – 1,91) или азитромицин (ОР – 0,64). Эта же тенденция прослеживалась и при анализе кумулятивной госпитальной летальности, достигавшей в указанных подгруппах 25,7%, 19,9% и 10,0% соответственно (у больных, не получавших ни один их указанных препаратов, этот показатель составил 12,7%). Сходные выводы были сделаны позднее и авторами метаанализа преимущественно обсервационных (нерандомизированных исследований) [64].
Однако в ряде других исследований связь между увеличением риска сердечно-сосудистой смертности и комбинированным назначением гидроксихлорохина и азитромицина продемонстрировать не удалось. Так, в рандомизированном исследовании ATOMIC2, включавшим амбулаторных больных с COVID-19, назначение азитромицина в дозе 500 мг/сут на протяжении двух недель не сопровождалось ростом числа госпитализаций и летальных исходов [65]. В рандомизированных исследованиях COALITION I и COALITION II, в рамках которых госпитализированные больные с COVID-19 наряду со стандартной терапией получали гидроксихлорохин или его комбинацию с азитромицином, также не удалось подтвердить ни удлинения интервала QTc, ни увеличения числа сердечно-сосудистых событий, включая фатальные [66].
Вероятно, наиболее сбалансированную позицию в достижении минимального риска сердечно-сосудистых НЛР при назначении лекарственных средств, способных удлинять интервал QT, в начальном периоде пандемии COVID-19 сформулировали президенты American Heart Association (R.A. Harrington), American College of Cardiology (A. Poppas) и Heart Rhythm Society (A.M. Rosso), обозначив соответствующие «ограничительные» рамки, в равной степени относящиеся и к азитромицину [67]: а) отказаться от приема лекарственных средств пациентам с исходным удлинением интервала QT (≥500 мс); б) контролировать сердечный ритм и интервал QT и отменять препараты, если интервал QTc превышает 500 мс; в) коррекция гипокалиемии до уровня >4 мэкв/л и гипомагниемии до уровня >2 мг/дл; г) избегать применение ингибиторов протонной помпы (за исключением пациентов с язвенной болезнью в анамнезе или синдромом Золлингера–Эллисона), поскольку они снижают всасывание калия и магния. При отмене ингибиторов протонной помпы следует применять антацидные препараты (например, сукральфат); д) по возможности избегать приема других препаратов, удлиняющих интервал QT. Подобный подход представляется рациональным, поскольку способен удержать препарат в «обойме» потенциально эффективных, избежав при этом развития серьезных сердечно-сосудистых событий, в том числе и жизнеугрожающих.
1 Суточная вариабельность интервала QT может достигать 100 мс и зависит в том числе от частоты сердечного ритма. В этой связи предложено использовать различные формулы, корригирующие возможное влияние ритма сердца на QT-интервал. До настоящего времени наиболее популярной в определении корригированного QT-интервала (QTc) остается предложенная H.C. Bazett формула: QTc=QT/√RR [30].
2 В инструкции по применению азитромицина были обновлены разделы «Предупреждения» и «Меры предосторожности», в которые добавлена информация о риске удлинения интервала QT и «пируэтной» желудочковой тахикардии. (URL: https://www.fda.gov)
3 В 2024 г. по решению редакционного совета журнала IJAA данная статья было отозвана («retracted»).
4 В обращении президента ISAC, в частности, говорилось: «Хотя ISAC признает важность оказания помощи научному сообществу путем быстрой публикации новых данных, это не может быть сделано за счет снижения уровня научной проверки и внедрения передовых методов. Оба главных редактора наших журналов (IJAA и JGAR) полностью согласны с этим». (URL: https://www.isac. world/ news-and-publications/official-isac-statement)
5 В качестве кандидатного противокоронавирусного препарата азитромицин упоминался на страницах временных методических рекомендаций Минздрава России «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» вплоть до выхода
в свет 10-й версии этого документа 8 февраля 2021 г. (URL: https://www.minzdravri.ru)
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
Информация об авторе
Information about the author
Синопальников Александр Игоревич – д-р мед. наук, проф., зав. каф. пульмонологии, ФГБОУ ДПО РМАНПО, Заслуженный врач Российской Федерации. E-mail: aisyn@list.ru; ORCID: 0000-0002-1990-2042
Alexander I. Sinopalnikov – Dr. Sci. (Med.), Prof., Russian
Medical Academy of Continuous Professional Education, Honored Doctor of the Russian Federation. E-mail: aisyn@list.ru; ORCID: 0000-0002-1990-2042
Поступила в редакцию: 15.01.2025
Поступила после рецензирования: 22.01.2025
Принята к публикации: 23.01.2025
Received: 15.01.2025
Revised: 22.01.2025
Accepted: 23.01.2025
Hepatotoxicity and cardiotoxicity of azithromycin: a “mythologeme” or real threat (critical review)
Alexander I. Sinopalnikov
Russian Medical Academy of Continuous Professional Education, Moscow, Russia
aisyn@list.ru
Abstract
As shown by long experience of the clinical use of macrolides, these drugs are characterized by the highest safety. Adverse drug reactions (ADRs) associated with the use of macrolides are extremely rare. Azithromycin remains one of the most prescribed antibiotics, especially in outpatient practice. The review presents critical analysis of the available data on possible ADRs to the antibiotic related to the liver and cardiovascular system.
Keywords: azithromycin, safety, hepatotoxicity, cardiotoxicity.
For citation: Sinopalnikov A.I. Hepatotoxicity and cardiotoxicity of azithromycin: a “mythologeme” or real threat (critical review). Clinical review for general practice. 2025; 6 (1): 6–13 (In Russ.). DOI: 10.47407/kr2024.6.1.00543
Введение
Макролиды, появившиеся в клинической практике более 70 лет тому назад, в настоящее время относятся к широко и повсеместно используемым антибиотикам, прежде всего при внебольничных инфекциях верхних и нижних дыхательных путей [1, 2]. При этом, несмотря на рост устойчивости Streptococcus pneumoniae к макролидам в ряде стран и регионов (в том числе и в Российской Федерации), этот класс антибиотиков продолжает удерживать позиции как нередко назначаемый больным внебольничной пневмонией [3, 4], особенно на фоне отмеченного в последнее время «взрывного» роста заболеваемости микоплазменной пневмонией, совпавшего с окончанием пандемии COVID-19 [5]. Статус макролидов укрепляется и все возрастающим числом доказательств их многочисленных иммуномодулирующих свойств и, как следствие этого, расширением круга показаний к их назначению больным муковисцидозом, немуковисцидозными бронхоэктазами, хроническим риносинуситом, облитерирующим бронхиолитом и др. [6, 7].Многодесятилетний опыт клинического применения макролидов позволил утвердиться во мнении, что данный класс антибиотиков относится к числу наиболее безопасных, а возникающие при их назначении нежелательные лекарственные реакции (НЛР) предсказуемы и относительно редки [8].
С появлением «новых» макролидов (азитромицин, кларитромицин), характеризующихся среди прочего улучшенной фармакокинетикой, их популярность еще более возросла. Так, только в США азитромицин в 2017 г. назначался более 12 млн раз [10]. Неслучайно эксперты Всемирной организации здравоохранения оценивают азитромицин с учетом его доказанной эффективности и приемлемого профиля безопасности как один из самых привлекательных антибиотиков, подходящих для широкого применения любой национальной системой здравоохранения [11].
Впрочем, следует признать, что годы повсеместного и успешного применения азитромицина по широкому кругу показаний периодически «омрачаются» дискуссиями о его профиле безопасности, где в фокусе внимания чаще всего оказывались гепато- и кардиотоксичность препарата.
Гепатотоксичность
Лекарственные поражения печени (ЛПП) (drug-induced liver injury, DILI) нередко связываются с приемом антибиотиков. Так, согласно проведенным эпидемиологическим исследованиям в Швеции [12], Испании [13], Исландии [14], Индии [15] и США [16] частота антибиотик-ассоциированных повреждений печени в структуре всех зарегистрированных ЛПП составляла 26–65%, а среди «виновников» чаще присутствовали туберкулостатические антибиотики (изониазид, рифампицин и др.), амоксициллин/клавуланат, нитрофурантоин, триметоприм-сульфаметоксазол, доксициклин. В противоположность этому, макролиды (прежде всего, эритромицин) в этом перечне упоминались существенно реже, либо отсутствовали вовсе.Тем не менее собственная гепатотоксичность, как и для подавляющего большинства лекарственных средств других групп, в той или иной степени свойственна всем макролидам, в связи с чем их применение в высоких дозах и/или длительное использование может быть сопряжено с риском развития нарушений функции печени. Здесь важно подчеркнуть, что потенциальная гепатотоксичность макролидов корреспондирует со способностью антибиотиков взаимодействовать с CYP3A4 (цитохромом P450 3A4) – одним из наиболее важных ферментов, участвующих в метаболизме ксенобиотиков в организме человека. При этом выделяют сильные ингибиторы CYP3A4 (олеандомицин, эритромицин, кларитромицин), макролиды, оказывающие умеренное воздействие на CYP3A4 (мидекамицин, джозамицин, рокситромицин) и, наконец, макролиды, не влияющие на активность CYP3A4 (азитромицин, спирамицин, диритромицин) [17]. Препараты первой группы метаболизируются в печени при участии фермента CYP3A4 с образованием реактивных нитрозоалкановых форм, которые связываются с цитохромом Р-450. Образование комплекса «матаболит – активный центр фермента» приводит к необратимому угнетению активности цитохрома Р-450. В противоположность этому, препараты третьей группы (азитромицин и др.) вообще не образуют комплексов с цитохромом Р-450. Эти различия весьма важны для понимания риска ЛПП, поскольку гепатотоксическое действие, связываемое с образованием реактивных метаболитов и лекарственных взаимодействий, наиболее демонстративно у эритромицина и, напротив, в минимальной степени выражено у азитромицина, спирамицина и диритромицина [18].
Помимо незначительного метаболизма и малого риска лекарственных взаимодействий азитромицин в сравнении с другими макролидами характеризуется значительно меньшей курсовой (кумулятивной) дозой (табл. 1), что также следует принимать во внимание, поскольку, как уже говорилось ранее, увеличение суммарной дозы препарата сопровождается повышением риска гепатотоксичности [19].
Низкий потенциал гепатотоксичности азитромицина находит свое подтверждение и в масштабных фармакоэпидемиологических исследованиях, в ходе которых описываются лишь единичные случаи ЛПП у взрослых, связываемые с приемом препарата (табл. 2), тогда как у детей в крайне редких случаях имеют место эпизоды бессимптомного повышения активности печеночных ферментов [24].

В 2003 г. в США была создана специальная структура (Drug-Induced Liver Injury Network, DILIN), призванная учитывать и анализировать все случаи ЛПП, выявляемые в лечебных учреждениях страны [25]. Изучение беспрецедентной по масштабам и строгости соблюдения диагностических критериев базы данных, полученных указанной сетевой структурой в период с сентября 2004 г. по май 2013 г. (в этот период азитромицин был наиболее востребованным антибиотиком на американском рынке, и за указанное 10-летие было выписана более 200 млн рецептов на этот препарат), позволило выявить 18 случаев ЛПП (72% женщины, средний возраст – 37 лет), вероятно или определенно связываемых с приемом азитромицина [26]. Общими симптомами у этих больных были желтуха, боль в животе, тошнота и/или кожный зуд. У 16 пациентов патологические изменения в сывороточной гепатограмме были впервые выявлены спустя 14 дней после прекращения приема азитромицина (в диапазоне от 9 до 20 дней). Средняя продолжительность лечения азитромицином составила 4 дня (от 2 до 7 дней). У 10 пациентов ЛПП трактовались как гепатоцеллюлярные, у 6 – как холестатические, а у двух – как смешанные. Средние пиковые значения аланинаминотрансферазы в крови составляли 2127 МЕ/л, щелочной фосфатазы – 481 МЕ/л, а общего билирубина – 9,2 мг/дл. Гистологические исследования печени обнаружили у нескольких пациентов дуктопению и веноокклюзионные изменения. Через 6 мес 8 пациентов выздоровели, у 4 пациентов были подтверждены хронические повреждения печени, 1 пациент умер и еще 1 пациенту была проведена трансплантация печени (здесь важно подчеркнуть, что 2 последних больных были старше 60 лет, один из которых страдал алкогольным гепатитом, а другой – неалкогольным стеатогепатитом). Таким образом, клинически/прогностически значимые ЛПП, вероятно или определенно связываемые с приемом азитромицина, развивались с частотой менее 1 случая на 10 млн назначений препарата.
Впрочем, несмотря на исключительную редкость азитромицин-ассоциированных ЛПП, контрольно-разрешительный орган США (Food and Drug Administration, FDA) на основе указанных выше данных о безопасности азитромицина принял решение о внесении соответствующих предостережений в инструкцию по его медицинскому применению (www.fda.gov).
Вскоре после этого последовало и соответствующее обращение Центра экспертизы безопасности лекарственных средств Минздрава России, в котором, в частности, указывалось, что «В послерегистрационном периоде (применения азитромицина) появились сообщения о развитии у больных гепатита, некроза печени, печеночной недостаточности, в некоторых случаях приводящих к летальному исходу». К сожалению, лишенное конкретики и соответствующей аргументации, данное обращение породило настороженное, если не негативное отношение к препарату среди немалого числа практикующих врачей, дополнявшееся спекулятивными публичными выступлениями и публикациями ряда представителей экспертного сообщества. Однако со временем дискуссии по поводу очевидно «гипертрофированной» гепатотоксичности азитромицина сошли на нет, а с момента регистрации препарата в Российской Федерации службой Фармаконадзора не было зарегистрировано ни одного случая азитромицин-ассоциированных ЛПП; в базе Росздравнадзора сведения о подобных НЛР на территории нашей страны также отсутствовали [27].
Кардиотоксичность
Рассмотрение риска кардиотоксичности азитромицина следует, очевидно, предварить некоторыми общими положениями, касающимися проаритмогенного действия лекарственных препаратов, в том числе и антибиотиков. Вероятно, наиболее частым механизмом подобной ятрогении является удлинение интервала QT с последующим развитием «пируэтной» желудочковой тахикардии (torsades de pointes, TdP), приписываемым более чем 100 различным лекарственным средствам: общеанестезирующим, антидепрессантам, антиаритмикам, антиэметикам, антимикотикам, антипсихотикам, противомалярийным препаратами и антибиотикам [28]. В ряду последних прежде всего упоминаются макролиды (эритромицин, кларитромицин, азитромицин), а также линезолид, имипенем-циластатин, амикацин и фторхинолоны (левофлоксацин и моксифлоксацин) [29].Интервал QT представляет собой временной промежуток от начала волны Q и до окончания волны T на электрокардиограмме, отражающий процессы деполяризации и реполяризации миокарда желудочков сердца. Основываясь на результатах многочисленных популяционных исследований, принято считать, что нормальная продолжительность интервала QT у мужчин и женщин составляет <430 мс и <450 мс соответственно1 [30]. В тех случаях, когда интервал QT превышает 500 мс (или удлиняется по сравнению с исходными значениями более чем на 60 мс), возрастает риск развития сердечно-сосудистых событий, включая нарушения сердечного ритма и внезапную смерть [31].
Удлинение интервала QT способно стать причиной так называемых ранних последеполяризаций (early after depolarizations), при достижении которыми порога потенциала действия может развиться полиморфная желудочковая тахикардия TdP и, как следствие, фибрилляция желудочков, остановка сердца и внезапная смерть [32]. Впрочем, предсказание развития тахикардии TdP, основывающееся исключительно на факте удлинения интервала QT, не является надежным.
Ятрогенное удлинение интервала QT связывают с ингибированием гена hERG, кодирующего быстрый компонент так называемых замедленных выпрямляющих калиевых каналов (IKR). По IKR осуществляется отток калия из миоцитов в процессе реполяризации желудочков. В случаях ингибирования гена hERG функционирование IKR нарушается, результатом чего становится внутриклеточная аккумуляция калия и задержка реполяризации желудочков, а значит, и удлинение интервала QT [33].
Согласно регуляторным документам FDA, удлинение интервала QT на 10 мс имеет клиническое значение, на 20 мс – потенциальный проаритмогенный эффект, а в случаях превышения 500 мс (или удлинения интервала QT на >60 мс по сравнению с исходным уровнем) настоятельно рекомендуется прекращение дальнейшего приема лекарственного препарата, «уличенного» в кардиотоксичности [34].
Вероятно, первое упоминание об удлинении интервала QT на фоне приема азитромицина принадлежит E.V. Granowitz и соавт. [35], описавших пациента, одновременно с антибиотиком принимавшего дизопирамид. Позднее появились сообщения об удлинении интервала QT и развитии тахикардии TdP при приеме азитромицина больными с врожденным синдромом удлиненного QT-интервала, хронической сердечной недостаточностью, гипокалиемией и др. [36, 37].
На фоне описания отдельных случаев кардиотоксичности азитромицина, в том числе применявшегося одновременно с лекарственными средствами с проаритмогенной активностью, как правило, у больных с хронической сердечной недостаточностью, гипокалиемией, врожденным синдромом удлиненного QT-интервала, синдромом слабости синусового узла и т.д. [38–44], как гром среди ясного неба («out of the blue») прозвучали выводы ретроспективного когортного исследования W.A. Ray и соавт. [45]. В исследование были включены пациенты в возрасте 30–74 лет, получавшие в период с 1992 по 2006 г. антибактериальную терапию – амоксициллин, ципро-флоксацин, левофлоксацин и азитромицин (последний в рамках стандартного 5-дневного режима дозирования); в качестве отдельной группы контроля наблюдались пациенты, не получавшие за указанный период какой-либо антибактериальной терапии.
Авторами было показано, что в течение первых пяти дней среди пациентов, получавших азитромицин, смертность от любой причины (преимущественно сердечно-сосудистой) оказалась достоверно выше по сравнению с пациентами, не принимавшими антибиотики (табл. 3) [45]. Схожими оказались и различия в сравнении с больными, получавшими амоксициллин, ципрофлоксацин, но не левофлоксацин. Проведенные авторами цитируемого исследования расчеты позволили сделать вывод о том, что абсолютный риск смерти от любой причины в случаях 5-дневной терапии ази-тромицином составляет 85,2/1 млн курсов антибиотикотерапии, тогда как в случаях назначения амоксициллина – 31,5/1 млн (см. табл. 3).

 Не менее важным представлялось и заключение о «дополнительных» случаях смерти при приеме азитромицина по сравнению с амоксициллином в зависимости от наличия или отсутствия известных сердечно-сосудистых рисков (см. рисунок). Так, в группе низкого риска это было 9 случаев на 1 млн назначений (или 1 случай на 111 111 назначений), в группе умеренного риска – 45 случаев/1 млн (или 1 случай на 21 277 назначений), в группе высокого сердечно-сосудистого риска – 245 случаев/1 млн (или 1 случай на 4082 назначения).
Не менее важным представлялось и заключение о «дополнительных» случаях смерти при приеме азитромицина по сравнению с амоксициллином в зависимости от наличия или отсутствия известных сердечно-сосудистых рисков (см. рисунок). Так, в группе низкого риска это было 9 случаев на 1 млн назначений (или 1 случай на 111 111 назначений), в группе умеренного риска – 45 случаев/1 млн (или 1 случай на 21 277 назначений), в группе высокого сердечно-сосудистого риска – 245 случаев/1 млн (или 1 случай на 4082 назначения).Впрочем, выводы данного исследования не свободны от контраргументов. Поскольку исследование имело ретроспективный когортный дизайн, это не позволяло надежно определить причинно-следственную связь смертельных исходов с применением того или иного антибиотика. Отсутствовали и адекватные сведения о показаниях к назначению антибактериальной терапии. Группа больных, получавших азитромицин по ряду показателей, не была эквивалентна группе больных, получавших амоксициллин. В цитируемом исследовании класс макролидов был представлен только азитромицином, между тем хорошо известно, что другие макролиды (например, эритромицин, кларитромицин) характеризуются более демонстративной кардиотоксичностью [46, 47].
В связи с обеспокоенностью по поводу удлинения интервала QT и сообщениями об увеличении риска сердечно-сосудистой смертности среди больных, принимающих азитромицин, FDA в период с 2011 по 2013 г. внесло ряд изменений в инструкцию по применению препарата2, рекомендуя не назначать азитромицин пациентам с известными факторами риска желудочковых аритмий [48].
Казалось бы, результаты исследования W.A. Ray и соавт. [45] следовало рассматривать в контексте с рядом других исследований, но, к сожалению, выводы последних оказались диаметрально противоположными. Так, если в некоторых из них также сообщалось, что при приеме азитромицина наблюдается увеличение числа летальных исходов вследствие сердечно-сосудистых причин, включая фатальные нарушения сердечного ритма или инфаркт миокарда [49–51], то в других подобная причинно-следственная связь не подтверждалась [52–54].
В стремлении преодолеть подобные разногласия FDA в 2014 г. обратилось к компании-производителю азитромицина с просьбой провести дополнительное эпидемиологическое исследование для установления реальной или мнимой связи применения азитромицина со смертностью, основной целью которого была бы оценка относительного и абсолютного риска сердечно-сосудистой смертности и внезапной сердечной смерти в течение первых 5 дней и последующих 6–10 дней после назначения азитромицина пациентам в возрасте от 30 до 74 лет.
В связи с указанным обращением было инициировано беспрецедентное по свои масштабам ретроспективное когортное исследование, в которое вошли
7 824 681 пациент в возрасте от 30 до 74 лет, принимавших азитромицин (1 736 976) или амоксициллин
(6 087 705), проживавших в Северной и Южной Калифорнии, США. Исследование предполагало полный учет обращений и лекарственных назначений за период с 1 января 1998 г. по 31 декабря 2014 г. Критериями невключения являлись отсутствие врачебного рецепта на антибиотик, назначение более одного вида исследуемых антибиотиков в течение 10 дней, госпитализация или проживание в доме престарелых, а также наличие серьезного заболевания. Риск сердечно-сосудистой смертности, связываемый с приемом азитромицина или амоксициллина, рассчитывался после учета сопутствующих факторов с использованием шкалы предрасположенности. Полученные фактические данные были проанализированы с 1 декабря 2016 г. по 30 марта 2020 г. [55].
Полученные результаты свидетельствовали, что по сравнению с пациентами, принимавшими амоксициллин, пациенты, получавшие азитромицин, демонстрировали значительно более высокий риск сердечно-сосудистой смерти (ОР 1,82; 95% ДИ 1,23–2,67), но не внезапной сердечной смерти (ОР 1,59; 95% ДИ 0,90–2,81) в течение ближайших 5 дней с даты приема первой дозы антибиотика. Однако в последующие 6–10 дней различия между сравниваемыми группами больных были статистически незначимыми (табл. 4).

Продемонстрированная в исследовании связь приема азитромицина с сердечно-сосудистой смертностью оказалась аналогична той, что была ранее представлена в исследовании американской популяции W.A. Ray и соавт. [45], но отличается от результатов, полученных, например, при обследовании представительной выборки населения Дании H. Svanstrom и соавт. [52]. При изучении результатов этих исследований важно отметить ключевые различия между исследуемыми группами пациентов. Так, частота сердечно-сосудистых смертей в исследовании J.G. Zaroff и соавт. [55] составила 35,9 смертей на 1 млн назначений азитромицина, что оказалось ниже, чем у W.A. Ray и соавт. [45] (85,2 /1 млн), но выше, чем у H. Svanstrom и соавт. [52] (15,4 /млн). Эти различия отчасти могут быть объяснены исходным несоответствием популяционных характеристик участников того или иного исследования, но также и отличиями в выявлении и классификации случаев смерти от сердечно-сосудистых причин.
Публикация результатов исследования J.G. Zaroff и соавт. [55] (июнь 2020 г.), состоявшаяся на пике первой волны пандемии COVID-19, когда все внимание мирового врачебного сообщества было сосредоточено на поиске эффективных методов лечения и профилактики новой коронавирусной инфекции, прошла относительно незаметно. Примечательно, что практически в это же время была опубликована статья F. Gautret и соавт. [56], в которой авторы свидетельствовали, что применение гидроксихлорохина сопровождается значимым снижением вирусной нагрузки/эрадикацией SARS-CoV2 и этот противовирусный эффект существенно усиливается при одновременном назначении азитромицина. И несмотря на то, что данное нерандомизированное исследование было выполнено на ограниченном числе пациентов (14 больных принимали гидроксихлорохин, 6 – гидроксихлорохин и азитромицин), а также затем последовавшую негативную реакцию на саму статью3 президента Международного общества по антимикробной химиотерапии (International Society of Antimicrobial Chemotherapy, ISAC) Andreas Voss4, поддержанного главными редакторами журналов «International Journal of Antimicrobial Agents» (IJAA) и «Journal of Global Antimicrobial Resistance» (JGAR), азитромицин был возведен в ранг «кандидатных» противокоронавирусных препаратов, что открыло дорогу его широкому и бесконтрольному назначению5.
Впрочем, одновременно с экстраординарным ростом популярности азитромицина в лечении больных c COVID-19 [57, 58] росла и обеспокоенность его необоснованно «агрессивным» применением, среди возможных негативных последствий которого упоминалось и ожидаемое увеличение НЛР, в том числе и кардиотоксических эффектов [59]. Особое внимание при этом привлекалось к тому факту, что азитромицин поначалу нередко назначался в комбинации с гидроксихлорохином, также «уличенным» в кардиотоксичности [60].
И первые исследования, направленные на изучение риска развития кардиотоксичности азитромицина у больных c COVID-19, подтверждали обоснованность этого беспокойства. Поначалу речь шла об исследованиях с ограниченной мощностью выборки, в ходе которых удалось подтвердить уже хорошо известный факт о влиянии азитромицина на процесс реполяризации миокарда, при этом в наибольшей степени удлинение интервала QTc (до 23 мс), у отдельных больных превышавшее 500 мс, наблюдалось при комбинированном назначении гидроксихлорохина и азитромицина [61, 62]. В последующем стали доступны и исследования по оценке сердечно-сосудистой смертности в группах больных с COVID-19, получавших гидроксихлорохин, азитромицин или комбинацию препаратов. Так, в исследовании E.S. Rosenberg и соавт. [63] у госпитализированных больных, получавших комбинированную терапию гидроксихлорохином и азитромицином, вероятность остановки сердца была выше (ОР – 2,13) по сравнению с больными, принимавшими только гидроксихлорохин (ОР – 1,91) или азитромицин (ОР – 0,64). Эта же тенденция прослеживалась и при анализе кумулятивной госпитальной летальности, достигавшей в указанных подгруппах 25,7%, 19,9% и 10,0% соответственно (у больных, не получавших ни один их указанных препаратов, этот показатель составил 12,7%). Сходные выводы были сделаны позднее и авторами метаанализа преимущественно обсервационных (нерандомизированных исследований) [64].
Однако в ряде других исследований связь между увеличением риска сердечно-сосудистой смертности и комбинированным назначением гидроксихлорохина и азитромицина продемонстрировать не удалось. Так, в рандомизированном исследовании ATOMIC2, включавшим амбулаторных больных с COVID-19, назначение азитромицина в дозе 500 мг/сут на протяжении двух недель не сопровождалось ростом числа госпитализаций и летальных исходов [65]. В рандомизированных исследованиях COALITION I и COALITION II, в рамках которых госпитализированные больные с COVID-19 наряду со стандартной терапией получали гидроксихлорохин или его комбинацию с азитромицином, также не удалось подтвердить ни удлинения интервала QTc, ни увеличения числа сердечно-сосудистых событий, включая фатальные [66].
Вероятно, наиболее сбалансированную позицию в достижении минимального риска сердечно-сосудистых НЛР при назначении лекарственных средств, способных удлинять интервал QT, в начальном периоде пандемии COVID-19 сформулировали президенты American Heart Association (R.A. Harrington), American College of Cardiology (A. Poppas) и Heart Rhythm Society (A.M. Rosso), обозначив соответствующие «ограничительные» рамки, в равной степени относящиеся и к азитромицину [67]: а) отказаться от приема лекарственных средств пациентам с исходным удлинением интервала QT (≥500 мс); б) контролировать сердечный ритм и интервал QT и отменять препараты, если интервал QTc превышает 500 мс; в) коррекция гипокалиемии до уровня >4 мэкв/л и гипомагниемии до уровня >2 мг/дл; г) избегать применение ингибиторов протонной помпы (за исключением пациентов с язвенной болезнью в анамнезе или синдромом Золлингера–Эллисона), поскольку они снижают всасывание калия и магния. При отмене ингибиторов протонной помпы следует применять антацидные препараты (например, сукральфат); д) по возможности избегать приема других препаратов, удлиняющих интервал QT. Подобный подход представляется рациональным, поскольку способен удержать препарат в «обойме» потенциально эффективных, избежав при этом развития серьезных сердечно-сосудистых событий, в том числе и жизнеугрожающих.
Заключение
Знакомство с представленной в настоящей статье информацией, нередко противоречивой, невольно рождает вопрос: «Как должен поступать практикующий врач?» Ответ на этот вопрос есть и, полагаю, он хорошо знаком заинтересованному читателю. Следует быть бережливым с нашими антибиотиками и не назначать их в ситуациях, которые этого не требуют. Но, с другой стороны, мы не должны быть настолько парализованы страхом, чтобы не использовать хороший антибиотик, когда это обосновано и целесообразно. И, взвешивая риски и преимущества каждого из возможных для больного направлений терапии, следует остановить свой выбор на лучшем из них.1 Суточная вариабельность интервала QT может достигать 100 мс и зависит в том числе от частоты сердечного ритма. В этой связи предложено использовать различные формулы, корригирующие возможное влияние ритма сердца на QT-интервал. До настоящего времени наиболее популярной в определении корригированного QT-интервала (QTc) остается предложенная H.C. Bazett формула: QTc=QT/√RR [30].
2 В инструкции по применению азитромицина были обновлены разделы «Предупреждения» и «Меры предосторожности», в которые добавлена информация о риске удлинения интервала QT и «пируэтной» желудочковой тахикардии. (URL: https://www.fda.gov)
3 В 2024 г. по решению редакционного совета журнала IJAA данная статья было отозвана («retracted»).
4 В обращении президента ISAC, в частности, говорилось: «Хотя ISAC признает важность оказания помощи научному сообществу путем быстрой публикации новых данных, это не может быть сделано за счет снижения уровня научной проверки и внедрения передовых методов. Оба главных редактора наших журналов (IJAA и JGAR) полностью согласны с этим». (URL: https://www.isac. world/ news-and-publications/official-isac-statement)
5 В качестве кандидатного противокоронавирусного препарата азитромицин упоминался на страницах временных методических рекомендаций Минздрава России «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» вплоть до выхода
в свет 10-й версии этого документа 8 февраля 2021 г. (URL: https://www.minzdravri.ru)
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
Информация об авторе
Information about the author
Синопальников Александр Игоревич – д-р мед. наук, проф., зав. каф. пульмонологии, ФГБОУ ДПО РМАНПО, Заслуженный врач Российской Федерации. E-mail: aisyn@list.ru; ORCID: 0000-0002-1990-2042
Alexander I. Sinopalnikov – Dr. Sci. (Med.), Prof., Russian
Medical Academy of Continuous Professional Education, Honored Doctor of the Russian Federation. E-mail: aisyn@list.ru; ORCID: 0000-0002-1990-2042
Поступила в редакцию: 15.01.2025
Поступила после рецензирования: 22.01.2025
Принята к публикации: 23.01.2025
Received: 15.01.2025
Revised: 22.01.2025
Accepted: 23.01.2025
Список исп. литературыСкрыть список1. Zuckerman JM, Qamar F, Bono BR. Review of macrolides (azithromycin, clarithromycin), ketolids (telithromycin) and glycylcyclines (tigecycline). Med Clin North Am 2011;95:761-91.
2. Laopaiboon M, Panpanich R, Swa Mya K. Azithromycin for acute lower respiratory tract infections. Cochrane Database Syst Rev 2015;3:CD001954.
3. Pletz MW, Blasi F, Chalmers JD et al. International perspective on the new 2019 American Thoracic Society/Infectious Diseases SocПоначалу речь ty of America community-acquired pneumonia guideline: a critical appraisal by a global expert panel. Chest 2020;158:1912-18.
4. Seo C, Corrado M, Lim R, Thornton CS. Guideline-concordant therapy for community-acquired pneumonia in the hospitalized population: systematic review and meta-analysis. Open Forum Infectious Diseases 2024;11(7):ofae336. DOI: 10.1093/ofid/ofae336
5. Tahmasebi H, Babaeizad A, Mohammadlou M et al. Reemergence of Mycoplasma pneumoniae disease: pathogenesis and new approaches. Microb Pathog 2024;196:106944.
6. Синопальников А.И. Иммуномодулирующие эффекты макролидов: направления возможного клинического применения в пульмонологии. Терапевтический архив. 2011;83(8):10-20.
Sinopalnikov A.I. Immunomodulatory effects of macrolides: directions of possible clinical application in pulmonology. Therapeutic Archive. 2011;83(8):10-20 (in Russian).
7. Pollock J, Chalmers JD. The immunomodulatory effects of macrolide antibiotics in respiratory disease. Pulmonary Pharmacology & Therapeutics 2021;71:102095.
8. Williams JD. Evaluation of the safety of macrolides. Int J Antimicrob Agents 2001;18(Suppl. 1):S77-81.
9. Firth A, Prathapan P. Azithromycin: The first broad-spectrum therapeutic. Europ J Med Chemistry 2020;207:112739.
10. Web Page. Clincalc.com/DrugStats/Drugs/Azithromycin, July 2020.
11. World Health Organization Model List of Essential Medicines: 21st List, World Health Organization, Geneva, 2019 hdl:10665/325771.
12. Bjornsson E, Olsson R. Outcome and prognostic markers in severe drug-induced liver disease. Hepatology 2005;42:481-9.
13. Andrade RJ, Lucena MI, Fernandez MC et al. Drug-induced liver injury: an analysis of 461 incidences submitted to the Spanish registry over a 10-year period. Spanish Group for the Study of Drug-Induced Liver Disease. Gastroenterology 2005;129:512-21.
14. Bjornsson ES, Bergmann OM, Bjornsson HK et al. Incidence, presentation and outcomes in patients with drug-induced liver injury in the general population of Iceland. Gastroenterology 2013;144:1419-425.
15. Devarbhavi H, Dierkhising R, Kremers WK et al. Single center experience with drug-induced liver injury from India: causes, outcome, prognosis, and predictors of mortality. Am J Gastroenterol 2010;105:2396-404.
16. Chalasani N, Bonkovsky HL, Fontana R et al. Features and outcomes of 899 patients with drug-induced liver injury: the DILIN prospective study. Gastroenterology 2015;148:1340-52.
17. Zhou Q, Yan XF, Zhang ZM et al. Rational prescription of drugs within similar therapeutic or structural class for gastrointestinal disease treatment: drug metabolism and its related interactions. Wld J Gaastroenterol 2007;13:5618-28.
18. Periti P, Mazzei T, Mini E et al. Adverse effects of macrolide antibacterials. Drug Saf 1993;9:346-64.
19. Белоусов Ю.Б. Лекарственные поражения печени, ассоциируемые с макролидами. Очевидна ли связь? Русский медицинский журнал. 2011;19:3-7.
Belousov Yu.B. Medicinal liver lesions associated with macrolides. Is the connection obvious? Russian Medical Journal. 2011;19:3-7 (in Russian).
20. Longo G, Valenti C., Gandini G et al. Azithromycin-induced intrahepatic cholestasis. Amer J Med 1997;102:217-8.
21. Macaigne G, Mokbel M, Mart O et al Acute pseudo angiocholitic hepatitis probably induced by azithromycin. Gatroenterol Clin Biol 2000;4:969-70.
22. Suriawinata A, Min AD. A 33-year-old woman with jaundice after azithromycin use. Semin Liver Dis 2002;22:207-10.
23. Lockwood AM, Cole S, Rabinovich M. Azithromycin-induced liver injury. Amer J Hlth Syst Pharm 2010;67:810-4.
24. Principi N, Esposito S. Comparative tolerability of erythromycin and newer macrolide antibacterials in paediatric patients. Drug Saf 1999;20:25-41.
25. Hoofnagle JH. Drug-induced liver injury network (DILIN). Hepatology 2004;40:773.
26. Martinez MA, Vuppalanchi R, Fontana RJ et al. Clinical and histologic features of azithromycin-induced liver injury. Clin Gastroent Hepat 2015;13:369-76.
27. Синопальников А.И., Андреева И.В., Стецюк О.У. Безопасность макролидных антибиотиков: критический анализ. Клиническая медицина. 2012;3:23-30.
Sinopalnikov A.I., Andreeva I.V., Stetsiuk O.U. Safety of macrolide antibiotics: a critical analysis. Clinical medicine. 2012;3:23-30 (in Russian).
28. Tisdale JE. Drug-induced QT interval prolongation and torsades de pointes: Role of the pharmacist in risk assessment, prevention and management. Can Pharm J 2016;149(3):139-52.
29. Teng C, Walter EA, Gaspar DKS et al. Torsades de pointes and QT prolongation associations with antibiotics: a pharmacovigilance study of the FDA Adverse Event Reporting System. Int J Med Sci 2019;16:1018-22.
30. Bazett HC. An analysis of the time-relations of electrocardiograms. Heart 1920;7:353-70.
31. Priori SG, Schwartz PJ, Napolitano C et al. Risk stratification in the long-QT syndrome. N Engl J Med 2003;348:1866-74.
32. Viskin S. Long QT syndromes and torsade de pointes. Lancet 1999;354:1625-33.
33. Maisch NM, Kochupurackal JG, Sin J. Azithromycin and the risk of cardiovascular complications. J Pharm Pract 2014;27:496-500.
33. International Conference on Harmonization. E14 clinical evaluation of QT/QTc interval prolongation and proarrhythmic potential for non-antiarrhythmic drugs. URL: www.fda.dov/RegylatoryInformation/Guidances/ucm129335.htm
35. Granowitz EV, Tabor KJ, Kirchhoffer JB. Potentially fatal interaction between azithromycin and disopyramide. Pacing Clin Electrophysiol 2000;23:1433-5.
36. Arellano-Rodrigo E, García A, Mont L, Roqué M. Torsade de pointes and cardiorespiratory arrest induced by azithromycin in a patient with congenital long QT syndrome. Med Clin (Barc) 2001;117:118-9.
37. Matsunaga N, Oki Y, Prigollini A. A case of QT-interval prolongation precipitated by azithromycin. NZ Med J 2003;116(1185):U666.
38. Samarendra P, Kumari S, Evans SJ et al. QT prolongation associated with azithromycin/amiodarone combination. Pacing Clin Electrophysiol 2001;24:1572-4.
39. Kim MH, Berkowitz C, Trohman RG. Polymorphic ventricular tachycardia with a normal QT interval following azithromycin. Pacing Clin Electrophysiol 2005;28:1221-2.
40. Russo V, Puzio G, Siniscalchi N. Azithromycin-induced QT prolongation in elderly patient. Acta Biomed 2006;77:30-2.
41. Kezerashvili A, Khattak H, Barsky A et al. Azithromycin as a cause of QT-interval prolongation and torsade de pointes in the absence of other known precipitating factors. J Interv Card Electrophysiol 2007;18:243-6.
42. Huang BH, Wu CH, Hsia CP, Yin Chen C. Azithromycin-induced torsade de pointes. Pacing Clin Electrophysiol 2007;30:1579-82.
43. Del Rosario ME, Weachter R, Flaker GC. Drug-induced QT prolongation and sudden death. Mo Med 2010;107:53-8.
44. Santos N, Oliveira M, Galrinho A, et al. QT interval prolongation and extreme bradycardia after a single dose of azithromycin. Rev Port Cardiol 2010; 29: 139–142.
45. Ray WA, Murray KT, Hall K, et al. Azithromycin and the risk of cardiovascular death. N Engl J Med 2012; 366: 1881–1890.
46. Ohtani H, Taninaka C, E Hanada E et al. Comparative pharmacodynamic analysis of Q-T interval prolongation induced by the macrolides clarithromycin, roxithromycin, and azithromycin in rats. Antimicrob Agents Chemother 2000;44:2630-7.
47. Wong AYS, Root A, Douglas IJ, et al. Cardiovascular outcomes associated with use of clarithromycin: population-based study. BMJ 2016; 352: h6926.
48. Mosholder AD, Mathew J, Alexander JJ et al. Cardiovascular risks with azithromycin and other antibacterial drugs. N Engl J Med 2013;368:1665-8.
49. Rao GA, Mann JR, Shoaibi A et al. Azithromycin and levofloxacin use and increased risk of cardiac arrhythmia and death. Ann Fam Med 2014;12:121-27.
50. Chou HW, Wang JL, Chang CH et al. Risks of cardiac arrhythmia and mortality among patients using new-generation macrolides, fluoroquinolones, and β-lactam/β-lactamase inhibitors: a Taiwanese nationwide study. Clin Infect Dis 2015;60:566-77.
51. Mortensen EM, Halm EA, Pugh MJ, et al. Association of azithromycin with mortality and cardiovascular events among older patients hospitalized with pneumonia. JAMA 2014;311:2199-08.
52. Svanström H, Pasternak B, Hviid A. Use of azithromycin and death from cardiovascular causes. N Engl J Med 2013;368:1704-12.
53. Trifirò G, de Ridder M, Sultana J et al. Use of azithromycin and risk of ventricular arrhythmia. CMAJ 2017;189:E560-E568.
54. Polgreen LA, Riedle BN, Cavanaugh JE et al. Estimated cardiac risk associated with macrolides and fluoroquinolones decreases substantially when adjusting for patient characteristics and comorbidities. J Am Heart Assoc 2018;7(9):2-9.
55. Zaroff JG, Cheetham TC, Palmetto N et al. Association of azithromycin use with cardiovascular mortality. JAMA Netw Open 2020;3(6):e208199.
56. Gautret P, Lagier J-C, Parola P et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents 2020;56:105949.
57. Карноух К.И., Лазарева Н.Б. Анализ потребления антибактериальных средств на фоне пандемии COVID-19: уровень стационара. Медицинский совет. 2021;16:118-28.
Karnaukh K.I., Lazareva N.B. Analysis of consumption of antibacterial agents against the background of the COVID-19 pandemic: hospital level. Medical Council. 2021;16:118-28 (in Russian).
58. Захаренков И.А., Рачина С.А., Козлов Р.С., Белькова Ю.А. Потребление системных антибиотиков в России в 2017–2021 гг.: основные тенденции. Клиническая микробиология и антимикробная химиотерапия. 2022;24(3):220-5.
Zakharenkov I.A., Rachina S.A., Kozlov R.S., Belkova Yu.A. Consumption of systemic antibiotics in Russia in 2017-2021: main trends. Clinical Microbiology and Antimicrobial Chemotherapy. 2022;24(3):220-5 (in Russian).
59. Синопальников А.И. Пандемия COVID-19 – «пандемия» антибактериальной терапии. Клиническая микробиология и антимикробная химиотерапия. 2021;23(1):220-5.
Sinopalnikov A.I. The COVID-19 pandemic is a "pandemic" of antibacterial therapy. Clinical microbiology and antimicrobial chemotherapy. 2021;23(1):220-5 (in Russian).
60. Naksuk N, Lazar S, Peeraphatdit TB. Cardiac safety of off-label COVID-19 drug therapy: a review and proposed monitoring protocol. Eur Heart J Acute Cardiovasc Care 2020;9:215-21.
61. Mercuro NJ, Yen CF, Shim DJ et al. Risk of QT interval prolongation associated with use of hydroxychloroquine with or without concomitant azithromycin among hospitalized patients testing positive for coronavirus disease 2019 (COVID-19). JAMA Cardiol 2020;5(9):1036-41.
62. Özdemir IH, Özlek B, Özen MB et al. Hydroxychloroquine/ azithromycin treatment, QT interval and ventricular arrhythmias in hospitalised patients with COVID-19. Int J Clin Pract 2021;75:e13896.
63. Rosenberg ES, Dufort EM, Udo T et al. Association of treatment with hydroxychloroquine or azithromycin within-hospital mortality in patients with COVID-19 in New York State. JAMA 2020;323:2493-502.
64. Fiolet T, Guihur A, Rebeaud ME et al. Effect of hydroxychloroquine with or without azithromycin on the mortality of coronavirus disease 2019 (COVID-19) patients: a systematic review and meta-analysis. Clin Microb Infect 2020. DOI: 10.1016/j.cmi.2020.08.022
65. Hinks TSC, Cureton L, Knight R et al. Azithromycin versus standard care in patients with mild-to moderate COVID-19 (ATOMIC2): an open-label, randomised trial. Lancet Respir Med 2021;9:1130-40.
66. Furtado RHM, Barros e Silva PGM, Fonseca HAR et al. Cardiovascular safety of azithromycin in patients hospitalized with COVID-19: a prespecified pooled analysis of the COALITION I and COALITION II randomized clinical trials. Am J Cardiol 2024;214:18-24.
67. Roden DM, Harrington RA, Poppas A, Russo AM. Considerations for drug Interactions on QTc interval in exploratory COVID-19 treatment. J Amer Coll Cardiol 2020;75:2623-4.
24 февраля 2025
Количество просмотров: 10434